Перейти к:
Изучение влияния концентрации натрий-карбоксиметилцеллюлозы на кровоостанавливающую и противоспаечную активность при операциях на печени в эксперименте
https://doi.org/10.47093/2218-7332.2020.11.1.4-14
Аннотация
Операции на печени сопряжены с риском кровотечения и развитием спаечной болезни. Натрий-карбоксиметилцеллюлоза (Na-КМЦ) образует эластичный набухающий гель и «решетку», которая задерживает форменные элементы крови.
Цель. Определить концентрацию Na-КМЦ, обладающую максимальным гемостатическим и противоспаечным эффектом, при операциях на печени в эксперименте.
Материалы и методы. В опыте in vitro изучен коагулирующий эффект Na-КМЦ (от 0,5 до 9%). В эксперименте in vivo на 167 крысах-самцах линии Wistar массой 185–250 г оценивали время остановки кровотечения и величину кровопотери; противоспаечную активность в модели операции на печени путем отсечения края органа стандартным способом: глубина и ширина раны 1 см, высота — 3 мм.
Результаты. В эксперименте in vitro минимальный коагулирующий эффект получен у 3% Na-КМЦ. В эксперименте in vivo максимальным эффектом на уменьшение времени остановки кровотечения (–46% по сравнению с контролем, р < 0,01) и величину кровопотери (–27% по сравнению с контролем, р < 0,01) оказывал 6% Na-КМЦ. Далее по степени убывания эффекта времени остановки кровотечения следовали: 5% Na-КМЦ (–40%), 4% Na-КМЦ (–37%), 3% Na-КМЦ (–29%), 7% Na-КМЦ (–27%), 8% Na-КМЦ (–11%). Для величины кровопотери наблюдалась сходная закономерность убывания эффекта: 5% Na-КМЦ (–21%), 4% Na-КМЦ (–14%), 7% Na-КМЦ (–12%), 3% Na-КМЦ (–11%), 8% Na-КМЦ (–5%). При сравнении всех исследованных концентраций геля Na-КМЦ с группой контроля по времени кровотечения и величине кровопотери различия статистически значимы: р < 0,01. Максимальная противоспаечная активность отмечена для 6% Na-КМЦ на 7-е и 14-е сутки после операции: спаечный процесс оценен в 0,497 [0,0000,497] и 0,962 [0,000–1,301] балла vs. 2,457 [2,118–2,457] и 4,071 [3,758–4,602] балла в контрольной группе (р < 0,01).
Заключение. Максимальным гемостатическим и противоспаечным эффектом обладает 6% Na-КМЦ.
Ключевые слова
Практически все операции на печени сопряжены с риском диффузного, плохо контролируемого кровотечения [1][2][3][4][5] и его отдаленных последствий, одним из которых является спаечная болезнь на фоне гемобилиарного перитонита [6][7]. Повреждение даже одного листка брюшины может спровоцировать капиллярное кровотечение с образованием фибрина в качестве склеивающего фактора [8]. Ситуация усугубляется дальнейшим развитием васкуляризованной соединительной ткани в составе фибриновой стяжки и недостаточной активностью системы фибринолиза.
По этой причине одной из важнейших исследовательских задач является разработка методов и средств эффективного гемостаза, способных предупредить возникновение возможных осложнений, включая спаечный процесс.
В качестве противоспаечного средства рядом авторов предлагается 4% водный гель натрий-карбоксиметилцеллюлозы (Na-КМЦ), разрешенный к применению под торговой маркой «Мезогель» (ООО «Линтекс», г. Санкт-Петербург) [9]. Этот препарат успешно применяется для профилактики спаечной болезни в абдоминальной хирургии [10].
Основой «Мезогеля» служит Na-КМЦ, которая представляет собой полимерную структуру с общей формулой ([С6Н7О2(ОН)3-x(OCH2COONa)x]n, где x = 0,02-1,50). Достоинствами этого препарата являются отсутствие раздражающего и сенсибилизирующего действия, сравнительно низкая бактериоемкость и достаточно высокая осмотическая активность [11]. Na-КМЦ образует эластичные набухающие гели, объемы которых могут в десятки раз превосходить собственный объем полимера. Нити полимера располагаются параллельно друг другу, расстояние между ними пропорционально концентрации геля: чем она выше, тем последнее меньше, также расположенные более перпендикулярно гидроксильные группы способствуют образованию «решетки», которая задерживает форменные элементы крови, в том числе тромбоциты, образуя матрицу для формирования сгустка крови. С другой стороны, жидкая часть крови — плазма — абсорбируется, способствуя набуханию геля. Этот эффект зависит от степени замещения, полимеризации и степени нейтрализации карбоксильных групп [12][13][14]. Концентрация геля влияет на способность Na-КМЦ абсорбировать и удерживать воду. Эти данные натолкнули нас на мысль об усилении кровоостанавливающего эффекта препарата за счет увеличения концентрации геля.
Целью нашего исследования стало определение концентрации Na-КМЦ, обладающей максимальным гемостатическим эффектом, а также сохраняющей противоспаечную активность при операциях на печени в эксперименте.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование одобрено региональным этическим комитетом при Курском государственном медицинском университете (КГМУ), протокол № 2/2013.
В работе использовали растворы (0,5-2%) и гели (3%, от 5 до 9%) Na-КМЦ (ООО «Линтекс», г. Санкт- Петербург) с массовой долей 0,5-9%, которые готовили на бидистилляте воды, пропущенной предварительно через катионит КУ 1 для снижения степени ионного обмена. Помимо этого, использовали противоспаечный, рассасывающийся 4% гель Na-КМЦ («Мезогель», ООО «Линтекс», г. Санкт-Петербург). Нативную кровь получали с письменного согласия 10 доноров-добровольцев мужского пола в возрасте 20 лет без соматических заболеваний согласно ГОСТ Р 52623.0-2006 «Технология выполнения простых медицинских услуг». Осуществляли забор венозной крови по 5 мл.
Эксперимент in vitro
Для определения коагулирующего эффекта in vitro в лабораторные стаканы объемом 25 мл, диаметром 5 см, к 3 мл раствора или геля с концентрацией 0,5; 1,5; 2; 3; 4; 5; 6, 7, 8 и 9% добавляли по 0,5 мл нативной крови. Кровь помещали на поверхность геля и не перемешивали. Время экспозиции составляло 1 минуту. Для верификации образования кровяного сгустка к данной смеси добавляли 5 мл дистиллированной воды и использовали методику аппаратного механического перемешивания с тангенциальным движением. Затем для объективной оценки наличия коагулирующего эффекта делались цифровые фотографии смесей исследуемого геля и нативной крови на аппарате Olympus E-410 Kit, (Olympus Corporation, Южная Корея). Фотографии загружались в программу CorelDRAW Graphics Suite X6 16.1.0.843 (2012) (Corel Corporation, Канада). Проводили выделение границ кровяного сгустка до и после разведения водой, с последующим подсчетом их площадей в см2, дальнейшим сравнением и статистической обработкой полученных данных. Если площадь сгустка после разведения водой становилась равна площади дна градуированного стакана (19,634 см2, P = A %d), фиксировалось отсутствие коагулирующего эффекта. Если площадь сгустка после разведения водой увеличивалась, но не достигала всей предоставленной площади (19,634 см2), отмечали коагулирующий эффект. Если площадь кровяного сгустка статистически значимо не менялась после разведения геля водой, фиксировали значимый коагулирующий эффект.
Эксперимент in vivo
Оценка кровоостанавливающего эффекта in vivo выполнена на лабораторных животных — 167 кры- сах-самцах линии Wistar массой 185-250 г. Животные находились в виварии с соблюдением стандартных условий пребывания и режима кормления. Эксперименты проведены в соответствии с ГОСТ 33215-2014 «Правила оборудования помещений и организации процедур при работе с лабораторными животными; ГОСТ 33216-2014 «Правила работы с лабораторными грызунами и кроликами»; «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений» РД-АПК 3.10.07.02-09 и с рекомендациями Международного комитета по науке о лабораторных животных, поддержанными ВОЗ, директивой Европейского парламента № 2010/63/EU от 22.09.10 «О защите животных, используемых для научных целей»; Европейской конвенцией по защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18.03.1986).
В остром опыте под масочным изофлурановым наркозом крысам выполняли срединную лапарото- мию. Под левую долю печени подкладывали марлевую салфетку с заведомо известной массой и отграничивали пропитывание последней жидкостью, продуцируемой брюшиной, с помощью полиэтиленовой пленки. Затем моделировали рану печени путем отсечения края органа стандартным способом, прикладывая трафарет в виде угольника, длина ребер которого была равна 1 см; высота раны составляла 3 мм. Такой характер операционной раны выбран для повреждения не только поверхностных капилляров, но и крупных кровеносных сосудов и долевых желчных протоков, находящихся в толще паренхимы органа, с целью моделирования массивного кровотечения и желчеистечения.
После этого на кровоточащую область раны наносили исследуемые материалы: 1 мл геля Na-КМЦ концентраций, отобранных по результатам эксперимента in vitro (3, 4, 5, 6, 7 и 8%), в пропорции 1:2 (площадь раневой поверхности к объему апплицируемого геля). В каждой из 6 опытных групп для изученных концентраций Na-КМЦ было по 20 животных. В группе контроля (n = 20) моделировалась рана печени аналогично опытным группам, кровоостанавливающие средства не применялись.
После моделирования раны включали секундомер и останавливали его после полного прекращения кровотечения, которое определялось как отсутствие выделения крови или истечения ее из-под опытных образцов геля Na-КМЦ. Регистрировали время остановки кровотечения и величину кровопотери, которую определяли как разницу веса марлевой салфетки до эксперимента и после его окончания (пропитывания кровью).
В хроническом эксперименте определяли проти- воспаечную активность наиболее эффективного образца геля Na-КМЦ. Для этого у 27 крыс произведено моделирование раны печени без ее последующего ушивания, с аппликацией кровоостанавливающих средств, как описано выше. Из каждой группы: контрольной, без применения опытных образцов геля Na-КМЦ (n = 9) и двух опытных, с применением геля Na-КМЦ 4% («Мезогель») (n = 9) и Na-КМЦ 6% (n = 9) выводили из эксперимента по 3 животных путем подачи в кувез углекислого газа на 3, 7 и 14-е сутки.
Выраженность спаечного процесса оценивали с помощью метода семантического дифференциала, разработанного на кафедре оперативной хирургии и топографической анатомии КГМУ в 2004 г.
Липатовым В.А. [15], который по данным литературы выделил значимые виды спаек, типы их распространения, наличие деформации внутренних органов сращениями и разработал иерархическую структуру оценки образования спаек. Далее Липатовым В.А. было проведено анкетирование экспертов (врачей-хирургов), в котором предлагалось выстроить в логической последовательности три группы факторов согласно возрастанию значимости в формировании спаечного процесса. На основе результатов обработки анкет с помощью методов ранжирования и факторного анализа определены коэффициенты значимости (КЗ) для различных показателей внутрибрюшных спаек.
В нашем исследовании внутрибрюшинные спайки оценивали в баллах от 0 до 5 с последующим умножением на КЗ: распространенность спаечного процесса (КЗ = 0,455), деформация органов, вовлеченных в процесс образования спаек (КЗ = 0,338), выраженность различных видов спаек, таких как сальниковые (КЗ = 0,015), плоскостные (КЗ = 0,066), перепончатые (КЗ = 0,046), тракционные (КЗ = 0,45), шнуровидные (КЗ = 0,031). Комплексная оценка выраженности спаечного процесса получается из сложения оценок всех единичных качеств в каждом конкретном случае.
Статистический анализ
Полученные данные представлены в виде среднего значения и ошибки среднего, для хронического эксперимента данные представлены как медиана и меж- квартильный размах (Me, 25-й и 75-й процентили). Для проверки статистических гипотез использован критерий Манна — Уитни. Для изучения связи между признаками использовался коэффициент корреляции Пирсона. Различия считали значимыми прир < 0,05.
РЕЗУЛЬТАТЫ
Эксперимент in vitro
При добавлении к Na-КМЦ различных концентраций 0,5 мл крови наблюдалось образование сгустка, что свидетельствовало о коагуляции крови. Однако при дальнейшем добавлении к гелю воды в объеме, достаточном для превращения геля в раствор, происходил один из трех вариантов изменения сгустка: он растворялся, его площадь значимо не менялась или увеличивалась (табл.). Это свидетельствовало о наличии истинного коагулирующего эффекта не у всех концентраций Na-КМЦ
Таблица. Средние значения площади геля Na-КМЦ, окрашенной кровью, и кровяного сгустка в см2 в зависимости от его концентрации
Table. Average values of the area of the Na-CMC gel stained with blood and the blood clot in cm2, depending on its concentration
|
Концентрация геля Na-КМЦ |
Количество образцов (л) |
Площадь до разбавления водой (см2) |
Площадь после разбавления водой (см2) |
Значение p |
Интерпретация |
|---|---|---|---|---|---|
|
0,5% |
10 |
3,669 ± 0,170 |
19,634* |
<0,01 |
Псевдосгусток |
|
1,5% |
10 |
3,383 ± 0,120 |
19,634* |
<0,01 |
Псевдосгусток |
|
2% |
10 |
2,844 ± 0,104 |
19,634* |
<0,01 |
Псевдосгусток |
|
3% |
10 |
2,63 ± 0,092 |
8,725 ± 0,079 |
<0,01 |
Сгусток |
|
4% |
10 |
2,35 ± 0,062 |
4,395 ± 0,067 |
<0,01 |
Сгусток |
|
5% |
10 |
1,945 ± 0,073 |
2,031 ± 0,026 |
>0,05 |
Сгусток |
|
6% |
10 |
1,442 ± 0,063 |
1,526 ± 0,039 |
>0,05 |
Сгусток |
|
7% |
10 |
2,379 ± 0,079 |
6,482 ± 0,052 |
<0,01 |
Псевдосгусток |
|
8% |
10 |
2,838 ± 0,101 |
14,574 ± 0,058 |
<0,01 |
Псевдосгусток |
|
9% |
10 |
3,323 ± 0,070 |
19,634* |
<0,01 |
Псевдосгусток |
Примечание. * Площадь геля равна площади дна градуированного стакана диаметром 5 см (19,634 см2). При разбавлении псевдосгустка водой он растекается, и его площадь становится равной площади дна стакана.
Note. *The area of the gel is equal to the area of the bottom of a graduated glass with a diameter of 5 cm (19.634 cm2). When the pseudo-clot is diluted with water, it spreads and its area becomes equal to the area of the bottom of the glass.
Для 0,5, 1,5 и 2% растворов Na-КМЦ площадь, окрашенная кровью, значительно увеличивалась после добавления воды и занимала всю площадь дна стакана. Это свидетельствовало об образовании псевдосгустка (рис. 1А, Б).
При добавлении дистиллированной воды к 3 и 4% гелю Na-КМЦ площадь сгустка статистически значимо увеличилась, при этом полного растворения не наступило (рис. 1В, Г). Добавление воды к 5 и 6% гелю Na-КМЦ практически не изменяло площадь сгустка. (рис. 1Д, Е).

РИС. 1. Результаты добавления нативной крови к Na-КМЦ различной концентрации и последующего добавления дистиллированной воды. Первый этап: результат добавления нативной крови к Na-КМЦ в концентрации 1,5% (А), 3% (В) и 6% (Д). Второй этап: добавление воды к комплексу гель — нативная кровь: (Б) — псевдосгусток (кровь растворилась), (Г) и (Е) — истинный сгусток (образовался нерастворимый сгусток).
FIG. 1. Results of adding native blood to The Na-CMC of different concentrations and the subsequent addition of distilled water. First stage: the result of adding native blood to Na-CMC in concentrations of 1.5% (A), 3% (B) and 6% (Д). Second stage: adding water to the gel — native blood complex: (Б) — pseudo-clot (blood dissolved), (Г) and (E) — true clot (non-soluble clot formed).
После добавления дистиллированной воды к 7% гелю Na-КМЦ площадь сгустка увеличилась в 2,7 раза (р < 0,01). При добавлении крови к 8 и 9% образцам, представляющим собой густой желеобразный концентрат, не имеющий гелеобразной формы, который с трудом распределялся по дну градуированного стакана, кровь растекалась на поверхности. После добавления воды происходило то же самое. Различия площади сгустка были значимыми (р < 0,01), что свидетельствовало об отсутствии гемостатических свойств.
Острый эксперимент in vivo Анализ времени остановки кровотечения показал, что все изучаемые образцы статистически значимо снижали данную величину относительно контрольной группы (рис. 2). Наиболее выраженный эффект отмечен у Na-КМЦ 6%, который уменьшал время кровотечения на 46%; далее по степени убывания эффекта следовали: Na-КМЦ 5% — уменьшал время кровотечения на 40%, Na-КМЦ 4% — на 37%, Na-КМЦ 3% — на 29%, Na-КМЦ 7% — на 27% и Na- КМЦ 8% — на 11%.
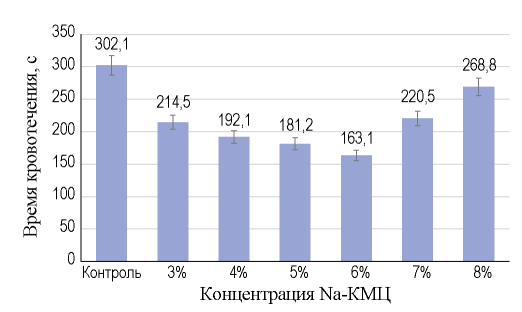
РИС. 2. Средние значения времени остановки кровотечения в группе контроля и для изученных концентраций Na-КМЦ.
FIG. 2. Average values of bleeding time in the control group and for the studied Na-CMC concentrations.
Величина кровопотери снижалась в изученных образцах сходным образом (рис. 3): наибольший эффект отмечен у Na-КМЦ 6%, для которого снижение кровопотери относительно группы контроля составило 27%; далее по степени убывания эффекта: Na-КМЦ 5% — уменьшение кровопотери на 21%, Na-КМЦ 4% — на 14%, Na-КМЦ 7% — на 12%, Na-КМЦ 3% — на 11% и Na-КМЦ 8% — на 5%. При сравнении всех исследованных концентраций геля Na-КМЦ с группой контроля по времени кровотечения и величине кровопотери различия статистически значимы: р < 0,01.
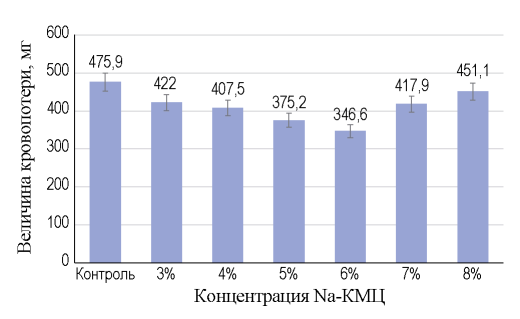
РИС. 3. Средние значения величины кровопотери в группе контроля и для изученных концентраций Na-КМЦ.
FIG. 3. Average values of blood loss in the control group and for the studied Na-CMC concentrations.
Отмечалась сильная обратная линейная связь между концентрациями от 3 до 6% Na-КМЦ и указанными величинами: коэффициент корреляции Пирсона для времени кровотечения составил -0,952 (р < 0,01), для объема кровопотери — 0,956 (р < 0,01).
Хронический эксперимент in vivo
Анализ данных хронического эксперимента показал, что при вскрытии животных, выведенных из эксперимента на 3-и сутки, спаечный процесс в контрольной группе оценен в 1,898 [1,433-2,237] балла; выявлены сальниковые и плоскостные спайки, подходящие к краю послеоперационной раны, ограниченные областью манипуляции, без видимой деформации внутренних органов. В двух группах исследования опытных образцов Na-КМЦ: 4% («Мезогель») и 6% концентраций спаечный процесс полностью отсутствовал — не выявлено спаек, край послеоперационной раны был покрыт нежным налетом фибрина, отсутствовали изменения соседних органов и выпот в брюшной полости.
У животных контрольной группы, выведенных из эксперимента на 7-е сутки, спаечный процесс оценен в 2,457 [2,118-2,457] балла. В группах применения Na-КМЦ 4% («Мезогель») и 6% на 7-е сутки спаечный процесс оценен в 0 [0,000-0,497] и 0,497 [0,000-0,497] балла соответственно (разница при попарном сравнении с контролем статистически значима, р < 0,01); выявлены единичные сальниковые спайки, подходящие к краю послеоперационной раны, не деформировавшие последний, без вовлечения в процесс синтопичных органов.
При вскрытии животных, выведенных из эксперимента на 14-е сутки, спаечный процесс в исследуемых группах оценен для Na-КМЦ 4% («Мезогель») в 0,960 [0,000-0,962] балла; Na-КМЦ 6% — 0,962 [0,0001,301] балла. Увеличение данного показателя связано с увеличением частоты выявления спаек, однако их характер — сальниковые — и отсутствие деформации внутренних органов остались прежними. Спаечный процесс в контрольной группе значимо прогрессировал, он составил 4,071 [3,758-4,602] балла. Изменился как характер выявленных спаек: преобладали тракционные, шнуровидные спайки, также присутствовали сальниковые и плоскостные, так и распространенность спаечного процесса, последний занимал всю брюшную полость. Была выражена деформация внутренних органов, вовлеченных в спаечный процесс: краев послеоперационной раны печени, желудка, отмечали сужение просвета кишечника. Выявлено статистически значимое различие между контролем и каждой из исследуемых групп (р < 0,01).
ОБСУЖДЕНИЕ
В эксперименте in vitro растворы Na-КМЦ концентраций 0,5; 1,5 и 2% не обладали коагулирующим эффектом; он появлялся у гелей начиная с 3% концентрации и достигал максимума к 6%. Это объясняется тем, что расстояние между фибриллами полимера становится меньше, также возрастает сила поляризации поперечных гидроксильных групп. С одной стороны, это способствует формированию решетки, на которой задерживаются форменные элементы, и наступлению условий для формирования кровяного сгустка, с другой стороны — усиливается процесс полимеризации, который усиливает набухание геля за счет абсорбции жидкой части крови — плазмы — полимером.
В ходе острого опыта мы наблюдали четкую U-образную связь между концентрацией Na-КМЦ и изучаемыми величинами: временем кровотечения и величиной кровопотери. Это подтвердило ранее заявленный механизм гемостатического эффекта в опыте in vitro и выявленную закономерность: увеличение эффекта от концентрации Na-КМЦ 3% до 6% и дальнейшее его уменьшение с 7-8%. Его спад можно также объяснить тем, что условия эксперимента, которые максимально приближены к условиям настоящей операции у человека, не способствуют увеличению гемостатических свойств образцов Na-КМЦ 7-8% по сравнению с опытом in vitro, так как время растворения (набухания) геля практически равно времени остановки кровотечения без применения гемостатиков. В условиях настоящей операции на печени у человека выдерживать такую экспозицию не предоставляется возможным и является даже опасным.
Температурный режим также не способствует более быстрому растворению образцов. Он был увеличен, по сравнению с опытом in vitro, для приближения к условиям реальной операции. Температура тела здорового животного (крысы) 38,5-39,5 °С; температура тела пациента, как здорового, так и с гипертермией, лежит в диапазоне 36,6-41 °С, а гель непосредственно контактирует с поверхностью резецированного края печени. Согласно данным Йулдошова Ш.А. [16], увеличение температуры не приводит к увеличению скорости растворения (набухания) гелей Na-КМЦ. Данные образцы являются непригодными для применения в рамках практической медицины.
Как видно из эксперимента, время кровотечения сокращалось более выраженно, чем величина крово- потери. Например, для геля 6% №-КМЦ эти показатели составили 46 и 27% соответственно. Это можно объяснить условиями эксперимента, когда, в отличие от искусственных моделей, из поврежденного сосудистого русла вытекает разный объем крови за единицу времени. Это обусловлено включением каскада системы гемостаза после нанесения операционной раны, причем как сосудисто-тромбоцитарного (местного), так и коагуляционного (системного), так как характер раны моделирует процесс как паренхиматозного, так и кровотечения из крупных долевых сосудов печени. Вначале (момент нанесения раны) будет истекать максимальный объем крови, затем при подключении факторов гемостаза (сокращения стенок сосудов, образования тромбоцитарной пробки, что способствует остановке кровотечения из мелких капилляров) объем крови уменьшится. Параллельно с этим начинает работать система коагуляционного гемостаза, отвечающая за остановку кровотечения в крупных сосудах: начало необратимой агрегации тромбоцитов и запуск образования фибрина на поверхности тромбоцитов, приводящие к образованию тромба, под действием тромбина плазмы на фибриноген, что еще больше сокращает величину кровопотери. Однако если повреждены крупные сосуды и не произведены меры по остановке кровотечения, тромб может оторваться, и объем излившейся крови вновь увеличится [17]. Это, в свою очередь, влияет в каждую конкретную секунду на объем кровопотери. Именно поэтому мы не наблюдали пропорциональной зависимости в уменьшении времени и величины кровопотери. Также гель Ка-КМЦ представляет собой местный гемостатик, и он не оказывает системного действия и не регулирует скорость гемостаза на каждом этапе.
Данные хронического эксперимента показали, что противоспаечная активность геля 6% Na-КМЦ не уступает барьерной функции «Мезогеля», в ходе опыта не выявлено значимых различий между группами. Однако относительно контрольной группы данные препараты являются высокоэффективными (р < 0,01).
При анализе результатов аналогичных исследований мы пришли к выводу, что по противоспаечной активности 6% гель Na-КМЦ значительно превосходит такие препараты, как губка гемостатическая «Белкозин» (г. Луга); гемостатические средства, содержащие окисленную регенерированную целлюлозу Surgicel и Surgicel Nu-knit (производство Johnson & Johnson, США). По данным Майстренко А.Н. [18], при их применении коэффициент выраженности спаечного процесса составил 3,168 ± 0,16, 2,171 ± 0,32 и 2,424 ± 0,17 балла соответственно. Вместе с этим, гемостатические свойства 6% геля Na-КМЦ были ниже, чем у гемостатической губки «Белкозин» (г. Луга), «Зеленая дубрава» (г. Москва), губки гемо- статической с транексамовой кислотой 9% и гемоблоком (производство «Зеленая дубрава», г. Москва): эти препараты снижали время остановки кровотечения и величину кровопотери по сравнению с контролем более чем на 51% [19].
В работе Давыденко В.В. [20] установлено укорочение времени остановки кровотечения при травме печени на 30% для нового гемостатического средства на основе хитозана «Гемофлекс Про» (ООО «Инмед», РФ), на 40% — для гемостатической пластины на основе прокоагулянтов животного и человеческого происхождения «TachoComb» (Nycomed Austria GmbH, Австрия), на 55% для препарата «Surgicel Nu-knit» (Johnson & Johnson, США), на 60% — для «CeloxТМ Gauze Hemostat» — гемостатического средства на основе хитозана (MedTrade Products Ltd, Великобритания). В нашем исследовании 6% гель Na-КМЦ уступал в эффективности последним двум образцам: время остановки кровотечения относительно контроля сокращалось на 46%.
В цитированном выше исследовании не выявлено прямой взаимосвязи между временем остановки кровотечения и величиной кровопотери, более вы- раженно сокращался второй показатель. Уменьшение величины кровопотери относительно контрольной группы при использовании «Surgicel Nu-knit» и «CeloxТМ Gauze Hemostat» происходило на 88%, «TachoComb» — на 82%, «Гемофлекс Про» — на 51%, что существенно выше, чем при использовании 6% геля Na-КМЦ в нашем исследовании. Такие различия можно объяснить разницей в степени пористости структуры применяемых образцов, что могло существенно повлиять на объем абсорбируемой крови самими гемостатическими средствами, изученными в работе Давыденко В.В. [20]
Что касается противоспаечной активности, при вскрытии животных на 7-е сутки с использованием всех образцов выявлены: «небольшое количество рыхлых спаек в зоне аппликации гемостатического средства; а на 30-е сутки — выраженные плотные спайки в зоне аппликации гемостатического средства, данный вид спаек выявлен и в контрольной группе» [20]. В данном случае 6%-ный гель Na-КМЦ значительно снижает развитие спаечного процесса в брюшной полости в отличие от оппонентов.
В исследовании Мельновой Н.И. [21] по изучению эффективности нового средства «Гамастат» на основе неорганических солей (полный состав не раскрывается) и «Вискостата» — гемостатического геля с 25%-ным содержанием хлорида алюминия (Ultradent, США) выявлено уменьшение показателя времени остановки кровотечения на 80 и 84% соответственно, однако в тексте статьи есть существенное примечание: «в единичных случаях «Гамастат» наносили повторно, при этом окончательный гемостаз наступал через 6-8 минут». Это время значительно превосходило время остановки кровотечения в контрольной группе (1712,5 ± 242,4 с). «В случаях когда остановка кровотечения была неполной и из-под краев пленки просачивалась кровь, “Вискостат” наносили повторно. При этом окончательный гемостаз наступал через 10-11 минут» [21]. В ходе всего эксперимента гемостаз в исследуемых группах Na-КМЦ был всегда окончательным и не превышал время в контрольной группе.
Величина кровопотери уменьшалась при применении «Вискостата» на 25% и «Гамастата» — на 47% процентов относительно контрольной группы. 6% Na-КМЦ не уступает своему гелевому аналогу и является более эффективным, уменьшение показателя происходило на 27%. Оценка спаечного процесса авторами не производилась.
В дальнейшем для совершенствования наиболее эффективного образца — геля Na-КМЦ 6% — возможно произвести увеличение гомеостатических свойств за счет дополнительных механизмов, например введения усиливающей компоненты, с целью конкурентоспособности данного материала и применения его в абдоминальной хирургии при операциях на печени в качестве комбинированного средства.
ЗАКЛЮЧЕНИЕ
Кровоостанавливающий эффект геля Na-КМЦ не имеет прямой зависимости от концентрации, увеличение показателя отмечается в диапазоне 3-6%, затем наступает регресс и полное отсутствие данного эффекта у препаратов с концентрацией от 7 до 9%. Максимальным гемостатическим и противоспаечным эффектом обладает гель Na-КМЦ 6%.
ВКЛАД АВТОРОВ
Д.С. Солдатова внесла основной вклад в разработку концепции статьи, подготовила текст статьи и иллюстрации, окончательно утвердила публикуемую версию статьи и согласна принять на себя ответственность за все аспекты работы. А.И. Бежин и Т.Н. Кудрявцева внесли существенный вклад в разработку концепции статьи и написали значительную часть текста.
AUTHOR CONTRIBUTIONS
Darya S. Soldatova, made the major contribution to the concept of the article, wrote the text of the article, designed the figure, approved the final version of the publication and agreed to take responsibility for all aspects of the work. Aleksandr I. Bezhin, Tatyana N. Kudryavtseva made the major contribution to the concept of the article and wrote the significant part of the text.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Курдяев И.Г., Умеров А.Х., Гришин А.В. и др. Способ местного гемостаза при поверхностном повреждении паренхиматозных органов живота: экспериментально-клиническое исследование. Медицина катастроф. 2017; 100(4): 51–4.
2. Пархисенко Ю.А., Воронцов А.К., Воронцов К.Е., Безалтынных А.А. Анализ результатов хирургического лечения пациентов с травматическими повреждениями печени. Перспективы науки и образования 2018; 1(31): 245–50.
3. Спиридонов А.А. Опыт применения отечественного гемостатического препарата при травме печени у детей. Практическая медицина. 2017; 4(105): 78–80.
4. Buci S., Torba M., Gjata A., et al. The rate of success of the conservative management of liver trauma in a developing country. World J Emerg Surg. 2017; 12: 24. https://doi.org/10.1186/s13017-017-0135-4 PMID: 28596799
5. Coccolini F., Catena F., Moore E.E., et al. WSES classification and guidelines for liver trauma. World J Emerg Surg. 2016; 10(11): 50. https://doi.org/10.1186/s13017-016-0105-2 PMID: 27766112
6. Аюшинова Н.И., Григорьев Е.Г., Чепурных Е.Е. и др. Спаечная болезнь — нерешенная проблема абдоминальной хирургии. Сибирский медицинский журнал. 2018; 15(2): 5–8.
7. Самарцев В.А., Кузнецова М. В., Гаврилов В. А. и др. Противоспаечные барьеры в абдоминальной хирургии: современное состояние проблемы. Пермский медицинский журнал. 2017; 34(2): 87–93.
8. Attard Jo-Anne P., MacLean A.R. Adhesive small bowel obstruction: epidemiology, biology and prevention. Can. J. Surg. 2007; 50(4): 291–300. PMID: 17897517
9. Вербицкий Д.А., Жуковский В.А., Немилов В.Е. и др. Способ получения геля на основе карбоксиметилцеллюлозы. Патент. Российская Федерация № 2 352 584. 2007. Заявл. 09.06.2007; опубл. 20.04.2009. Бюл. № 11. URL: https://www1.fips.ru/registers-doc-view/fips_servlet (дата обращения: 12.03.2020).
10. Лазаренко В.А., Суковатых Б.С., Бежин А.И. и др. Первый опыт применения противоспаечного рассасывающегося полимерного средства «Мезогель» при остром аппендиците. Курский научно-практический вестник «Человек и его здоровье». 2011; 1: 51–5.
11. Кленкова И.И. Структура и реакционная способность целлюлозы. Л.: Наука, 1976. 367 с.
12. Чернова В.В., Котяшов М.С., Лаздин Р.Ю. и др. Изучение реологических свойств растворов натриевой соли карбоксиметилцеллюлозы. Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2020. 20(2): 163–9. https://doi.org/10.18500/1816-9775-2020-20-2-163-169
13. Воробьева В.М., Макарова О.Г. Изучение физико-химических и технологических свойств различных марок кроскармелозы (NA-КМЦ). Научные ведомости Белгородского государственного университета. 2013; 4(147): 219–25.
14. Tkacheva N.I., Morozov S.V., Grigor’ev I.A., et al. Мodification of cellulose as a promising direction in the design of new materials. Polymer science. Ser. B. 2013; 55(7–8): 409–29. https://doi.org/10.1134/S1560090413070063 PMID: 95854641
15. Звягин И.Н., Фролова О.Г., Липатов В.А. и др. Влияние лекарственных препаратов, депонированных в средстве «мезогель», на его противоспаечную активность в эксперименте. Современные проблемы науки и образования. 2018;6. URL: https://www.science-education.ru/ru/article/view?id=28325 (дата обращения: 20.03.2020).
16. Йулдошов Ш.А., Шукуров А.И., Сарымсаков А.А., Рашидова С.Ш. Получение растворов карбоксиметилцеллюлозы методом замораживания-оттаивания. Universum: химия и биология, 2016; 5(23): 4.
17. Hoffman M., Monroe D.M. 3rd. A cell-based model of h stasis. Thromb Haemost. 2001; 85(6): 958–65. https://doi.org/10.1055/s-0037-1615947 PMID: 11434702
18. Майстренко А.Н., Бежин А.И., Липатов В.А. и др. Сравнительная оценка гемостатической активности новых аппликационных средств при травмах и операциях на печени и селезенке в эксперименте. Курский научно-практической вестник «Человек и его здоровье». 2009; 2: 19–26.
19. Бежин А.И., Солдатова Д.С., Литвиненко И.В., Горпинич А.Б. Экспериментальное обоснование кровоостанавливающего эффекта 3% геля карбоксиметилцеллюлозы. Курский научно-практический вестник «Человек и его здоровье». 2018; 4: 72–9. https://doi.org/10.21626/vestnik/2018-4/12
20. Давыденко В.В., Власов Т.Д., Доброскок И.Н. и др. Сравнительная эффективность аппликационных гемостатических средств местного действия при остановке экспериментального паренхиматозного и артериального кровотечения. Вестник экспериментальной и клинической хирургии 2015; 8(2): 186–94. https://doi.org/10.18499/2070-478X-2015-8-2-186-194
21. Мельнова Н.И., Жаворонок И.С., Жук И.Н. и др. Применение нового гемостатического средства «Гамастат» при паренхиматозном кровотечении в эксперименте. Военная медицина. 2013; (2): 62–6.
Об авторах
Д. С. СолдатоваРоссия
Солдатова Дарья Сергеевна, ассистент кафедры оперативной хирургии и топографической анатомии им. А. Д. Мясникова. SPIN-код 1865-5057
ул. Карла Маркса, д. 3, г. Курск, 305041
Тел.: +7 (920) 735-10-44
А. И. Бежин
Россия
Бежин Александр Иванович, д-р мед. наук, профессор, заведующий кафедрой оперативной хирургии и топографической анатомии им. А. Д. Мясникова. SPIN-код: 1250-5549.
ул. Карла Маркса, д. 3, г. Курск, 305041
Т. Н. Кудрявцева
Россия
Кудрявцева Татьяна Николаевна, канд. хим. наук, доцент, старший научный сотрудник научно-исследовательской лаборатории органического синтеза
ул. Радищева, д. 33, г. Курск, 305000
Рецензия
JATS XML







































