Перейти к:
Морфофункциональные изменения у мышей после однократного введения высоких и низких доз Hsp70
https://doi.org/10.47093/2218-7332.2023.918.13
Аннотация
Цель. Оценить влияние экзогенного Hsp70 (heat shock protein, белок теплового шока массой 70 кДа) на морфофункциональное состояние взрослых мышей при его однократном подкожном введении в высоких и низких дозах.
Материалы и методы. Изучались самцы мышей линии CD1 (n = 30) возрастом 90 ± 3 суток, рандомизированные на три группы по 10 животных в каждой. Вводили однократно подкожно: 1-й группе (контроль) – физиологический раствор, 2-й группе – низкую дозу Hsp70 (500 мкг/кг) и 3-й группе – высокую дозу Hsp70 (5000 мкг/кг) рекомбинантного человеческого HspA1A. На 3-й день регистрировали поведенческую активность: скорость перемещения, пройденный путь и количество дефекаций. На 5-й день мышей выводили из эксперимента с последующим гистологическим исследованием и морфометрией срезов коры головного мозга, тимуса, селезенки и печени. Статистическая обработка данных осуществлялась при помощи однофакторного дисперсионного анализа и апостериорного теста Тьюки.
Результаты. В изученных группах не обнаружено статистически значимой разницы поведенческих показателей. Синусоидные капилляры печени в группе контроля и группе Hsp70 500 мкг/кг оказались немного шире и полнокровнее по сравнению с Hsp70 5000 мкг/кг. При морфометрии клеток получены следующие результаты: число нейронов в ганглионарном слое коры больших полушарий головного мозга, разница лимфоцитарной клеточности между корковым и мозговым веществами тимуса, число лимфоцитов в белой пульпе селезенки, количество ядер гепатоцитов в печени в группах не различались. В красной пульпе селезенки количество макрофагов составило 1774,5 ± 24,8, 1623,0 ± 26,7, 1553,6 ± 47,0 в группах контроля, низкой и высокой доз Hsp70 соответственно (р < 0,0001). В тесте Тьюки статистически значимые различия получены между группой контроля и группами Hsp70 500 мкг/кг (р = 0,012) и 5000 мкг/кг (р < 0,0001).
Заключение. Исследование не выявило негативного влияния подкожного введения низких и высоких доз Hsp70 на морфофункциональные показатели у мышей.
Ключевые слова
Список сокращений:
- Hsp70– 70 kilodalton heat shock proteins, белки теплового шока массой 70 килодальтон
Молекулярной основой разнообразных патологических процессов служат нарушения работы всей совокупности клеточных белков (протеома). Для коррекции таких нарушений разрабатывают терапевтические подходы с применением регуляторов, позволяющих защищать и/или восстанавливать свойства белковых макромолекул. Данные регуляторы, составляющие разнородную группу соединений под названием «молекулярные шапероны», помогают поддерживать протеостаз, обеспечивая динамическую работу сбалансированного, функционального протеома. Шапероны представляют собой белки, участвующие в восстановлении правильной нативной третичной или четвертичной структуры белков организма, в том числе за счет образования с ними промежуточных белковых комплексов и их диссоциации. Среди них ключевое значение отводят семейству белков теплового шока массой 70 килодальтон (70 kilodalton heat shock proteins, Hsp70) [1].
Представители Hsp70 участвуют в обеспечении структурно-функционального постоянства практически во всех клетках организма посредством контроля качества протеома, предотвращая накопление агрегатов из неправильно свернутых белков или продуктов их деградации. Механизмами этого управления служат как ограждение от возможных ошибок посттрансляционных модификаций (фолдинга и рефолдинга), так и активация протеасом и процесса протеолиза, а также транспорт дефектных белков для аутофагии. Hsp70 регулирует апоптотическую активность, предотвращая клеточную гибель и образование апоптосом [2].
Хотя каскады биохимических реакций, задействующие Hsp70, происходят во всех клетках организма, роль этого семейства шаперонов особенно велика для долгоживущих клеточных популяций, например нервной ткани. Hsp70 способствуют устойчивости нейронов к преждевременной деградации [3][4], снижению реакции нейроглии на провоспалительные цитокины [5][6]. Всплеск интереса к разработке фармакологических веществ, служащих индукторами или аллостерическими модификаторами для данного белка в нервной ткани [7], привел к росту числа исследований, посвященных изучению роли Hsp70 в механизме защиты нейронов от повреждения при различных нейродегенеративных заболеваниях, например болезни Альцгеймера или ишемии головного мозга [8]. Тем не менее большинство научных коллективов нацелены на исключительно прикладной результат для быстро реализуемых терапевтических опций, что ограничивает понимание фундаментальных последствий повышенной экспрессии или активности Hsp70 в нейронах и глии in vivo [9]. Так, участие Hsp70 в различных внутриклеточных каскадах позволяет предположить, что усиление экспрессии или активности данных белков может вызвать череду нежелательных клинических реакций, что особенно вероятно при стрессовых реакциях, увеличивающих выработку молекулярных шаперонов. Возможно, таргетированная доставка Hsp70 непосредственно к клетке-мишени стала бы более безопасной альтернативой, хоть и более затратной. Целесообразность последней зависит от сравнения поступления в нервную ткань Hsp70 извне и стимуляции выработки собственных белков.
Цель исследования: изучить морфофункциональные изменения в органах нервной и иммунной систем, а также печени при поступлении избытка экзогенного Hsp70.
МАТЕРИАЛЫ И МЕТОДЫ
Манипуляции с животными
Исследования на экспериментальных животных проводились в соответствии с ГОСТ 33215-2014 от 01.07.2016, ГОСТ 33216-20143 от 01.07.20164 и Руководством по содержанию и использованию лабораторных животных (Guide for the Care and Use of Laboratory Animals, 8th edition)5. Исследование выполнено на 30 самцах мышей аутбредной линии CD1. Количество животных рассчитано согласно стандартным правилам для дизайна экспериментов на грызунах [10]. Животные поступали из филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий» ФМБА России, пребывали в виварии с поддержанием постоянной комнатной температуры 20–22 °C и влажности 50–60 % с доступом к чистой воде и гранулированному корму ad libitum.
Возраст животных на начало эксперимента составлял 90 ± 3 суток, средняя масса тела 33,2 ± 2,3 г. Выбор возраста мышей был обусловлен необходимостью в полной мере оценить изменения в органах нервной и иммунной систем в связи с процессами реорганизации коры головного мозга в более ранние периоды жизни, а также началом инволюции тимуса в более поздние периоды жизни животных. Поскольку инволюция вилочковой железы у самцов и самок происходит в разное время, для исследования были выбраны животные одного пола [11][12].
Для исследования был выбран белок 1A семейства Hsp70 – HspA1A – как наиболее активный представитель семейства шаперонов при стрессе [13]. Для определения того, как влияет аллогенный Hsp70 на работу нервной системы, изучались поведенческие характеристики, а также клеточные популяции в центральной нервной системе. Оценка системных нежелательных эффектов при введении Hsp70 проводилась путем изучения клеточных популяций в печени как органе, осуществляющем метаболизм экзогенного Hsp70, и в органах иммунной системы (тимусе и селезенке). Дизайн эксперимента представлен на рисунке 1.
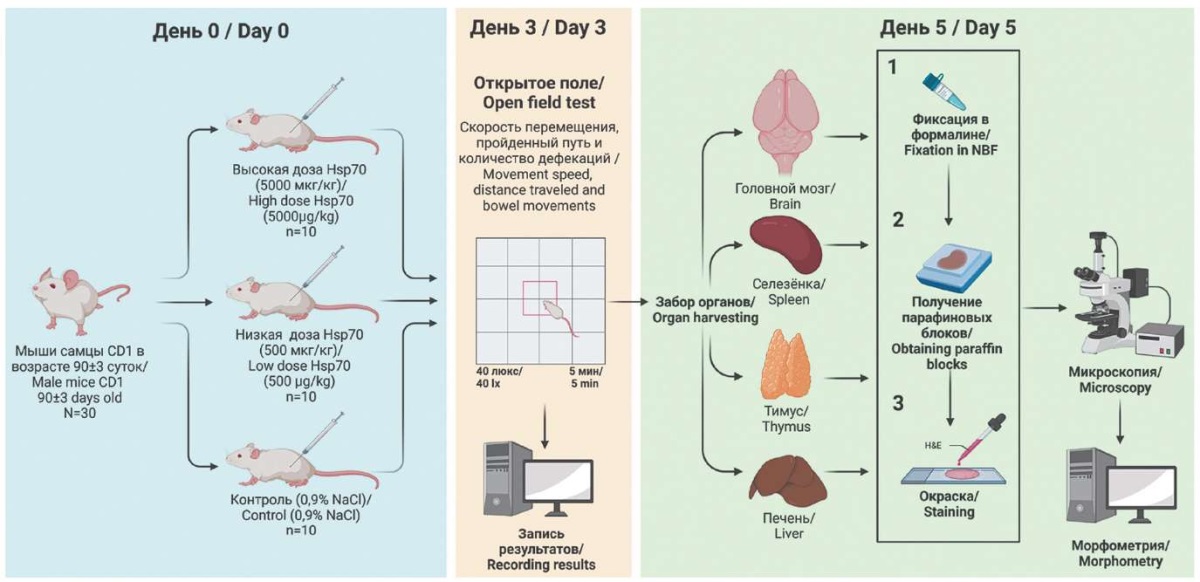
РИС. 1. Схема эксперимента.
FIG. 1. Experimental design.
Примечание: Hsp70 (heat shock 70 kDA, белок теплового шока
массой 70 кДа) / рекомбинантный человеческий HspA1A.
Note: Hsp70 (heat shock 70 kDA) / HspA1A (heat shock 70 kDa protein 1A),
recombinant; NBF – Neutral Buffered Formalin.
После двухнедельного карантина осуществляли рандомизацию мышей методом случайных чисел на 3 группы по 10 особей в каждую. Животных каждой группы содержали отдельно по 5 особей в клетке в отдельном помещении вивария для недопущения скученности. Все особи получили в день 0 однократные подкожные введения: 1-я группа – физиологического раствора (контроль), 2-я группа – низкой дозы
Hsp70 (рекомбинантный человеческий HspA1A, ИМБ РАН, Россия, доза – 500 мкг/кг), 3-я группа – высокой дозы Hsp70 (тот же препарат и производитель, 5000 мкг/кг).
На 3-й день после инъекции все мыши проходили физиологический тест «открытое поле» в течение двух минут в интервале времени 8:00–8:30 и при освещенности 40 люкс при помощи установки «Открытое поле для мышей» (ООО «НПК Открытая Наука», Россия). За час до теста мышам давали отдохнуть в покое – исключали передвижение клетки, взятие грызунов в руки или беспокойство их какимлибо иным способом. Регистрировали показатели поведенческой активности: скорость перемещения, пройденный путь и количество дефекаций.
На 5-й день после инъекции животных выводили из эксперимента, повышая концентрацию углекислого газа во вдыхаемом ими воздухе [14].
Морфологическое исследование
Осуществляли забор головного мозга, тимуса, селезенки и печени. После фиксации в 10 % забуференном формалине (ООО «ЭргоПродакшн», Россия) и стандартной проводки через изопропиловый спирт возрастающей концентрации изготавливали гистологические препараты толщиной 5 мкм по рутинной методике с окраской гематоксилином и эозином [15]. На каждом стекле анализировали по шесть полей зрения при помощи микроскопа Axio Imager.A1 с камерой Axiocam 305 color и программным обеспечением Zen 3.3 (все – производство Zeiss, Германия).
Морфометрия
Для определения клеток и ядер использовали программное обеспечение с открытым кодом QuPath 0.3.2, (Queen’s University Belfast, Великобритания), обученное в рамках проводимых исследований на определение тех или иных структур в представляющих интерес органах и тканях [16].
На препаратах больших полушарий головного мозга в затылочной области идентифицировали количество нейронов в ганглионарном слое коры.
На срезах тимуса анализировали сохранность селекции Т-клеток, для чего в полях зрения подсчитывали отдельно количество лимфоцитов в участках коркового и мозгового веществ равной площади и вычисляли разницу между этими значениями. При этом по форме и контрастности ядер исключали эндотелиальную и ретикулоэпителиальную популяции.
На препаратах селезенки в 6 полях зрения от каждого препарата учитывали количество объектов с морфологией лимфоцита в периартериолярных лимфатических влагалищах белой пульпы и количество объектов с морфологией макрофага в красной пульпе.
На срезах печени в полях зрения регистрировали количество ядер гепатоцитов в паренхиме печеночных долек без центральных вен и триад. При морфометрии печени учитывали округлые ядра средней контрастности. Поскольку отдельные гепатоциты полиплоидны, определять непосредственно клеточность было нецелесообразно.
Статистический анализ
Оценивали нормальность распределения по критерию Колмогорова – Смирнова. Все полученные данные представлены в виде медианы и интеквартильного размаха (25-й; 75-й процентили), а также среднего арифметического со стандартной ошибкой среднего. Для сравнения групп использовался однофакторный дисперсионный анализ (ANOVA). При наличии значимых различий в ANOVA попарное сравнение между группами проводили с помощью апостериорного (post hoc) теста Тьюки. Принятый уровень значимости p < 0,05. Для проведения статистического анализа использовались пакеты программного обеспечения Microsoft Excel (Microsoft, США) и OriginPro (OriginLab, США).
РЕЗУЛЬТАТЫ
Тест «открытое поле»
Анализ двигательной активности показал, что в группе контроля грызуны двигались со средней скоростью 8,9 ± 1,0 см/с, в группе Hsp70 500 мкг/кг – 8,4 ± 0,6 см/с, а в группе Hsp70 5000 мкг/кг – 8,4 ± 0,7 см/с (рис. 2А). Результаты для пройденного пути: мыши группы контроля в среднем перемещались на 2671,7 ± 292,1 см, группы Hsp70 500 мкг/кг – 2507,8 ± 167,0 см, группы Hsp70 5000 мкг/кг – 2524,7 ± 222,7 см (рис. 2В). У мышей группы контроля отмечено в среднем 1,7 ± 0,5 дефекации, в группе Hsp70 500 мкг/кг – 2,5 ± 0,5 и в группе Hsp70 5000 мкг/кг – 2,2 ± 0,7 дефекации (рис. 2С). Количество болюсов при одном испражнении варьировало во всех группах в пределах 1–3 штук. По всем изученным параметрам статистически значимых различий между группами в тесте «открытое поле» не выявлено.
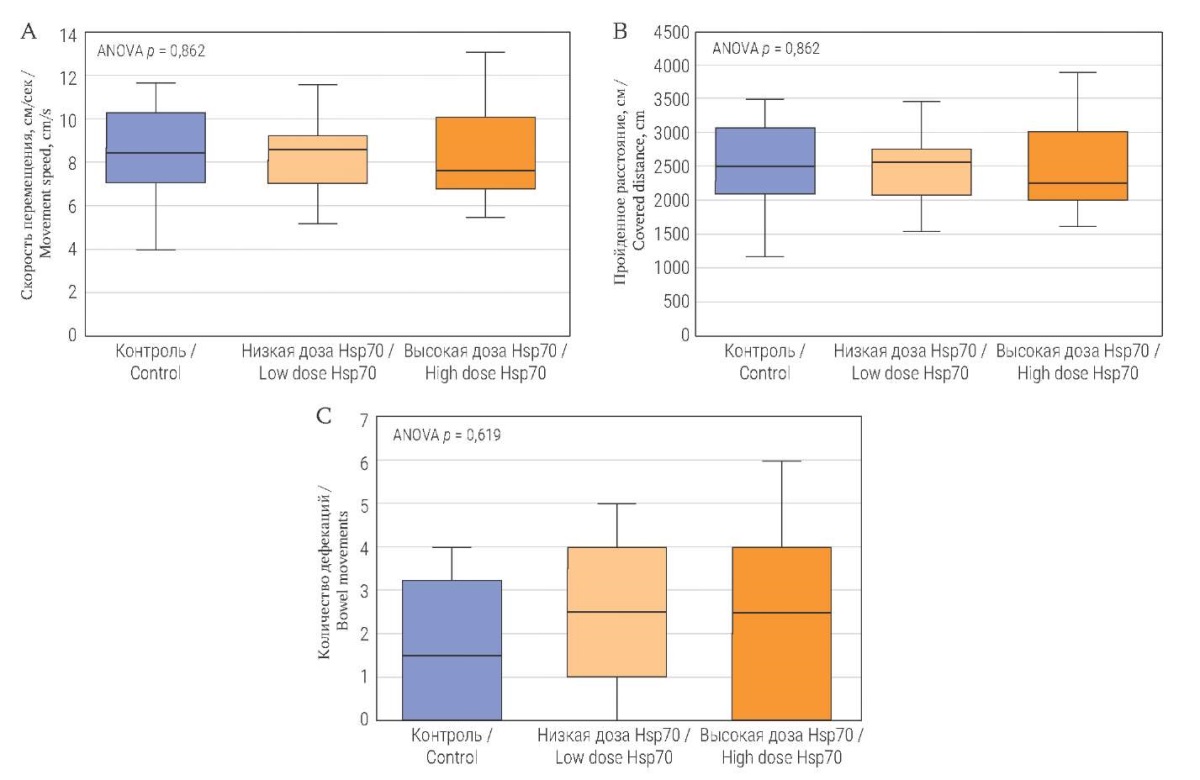
РИС. 2. Поведенческие показатели взрослых мышей в тесте «открытое поле»
на третьи сутки после однократного введения низкой или высокой дозы Hsp70.
FIG. 2. Behavior of adult mice in “open field” test
on Day 3 after single injections of Hsp70 at low or high dose.
При гистологическом исследовании головного мозга у мышей всех групп были выявлены сохранная цито- и миелоархитектоника, нейроны и глия были распределены равномерно (рис. 3). Гистологическая картина всех трех групп соответствовала норме.
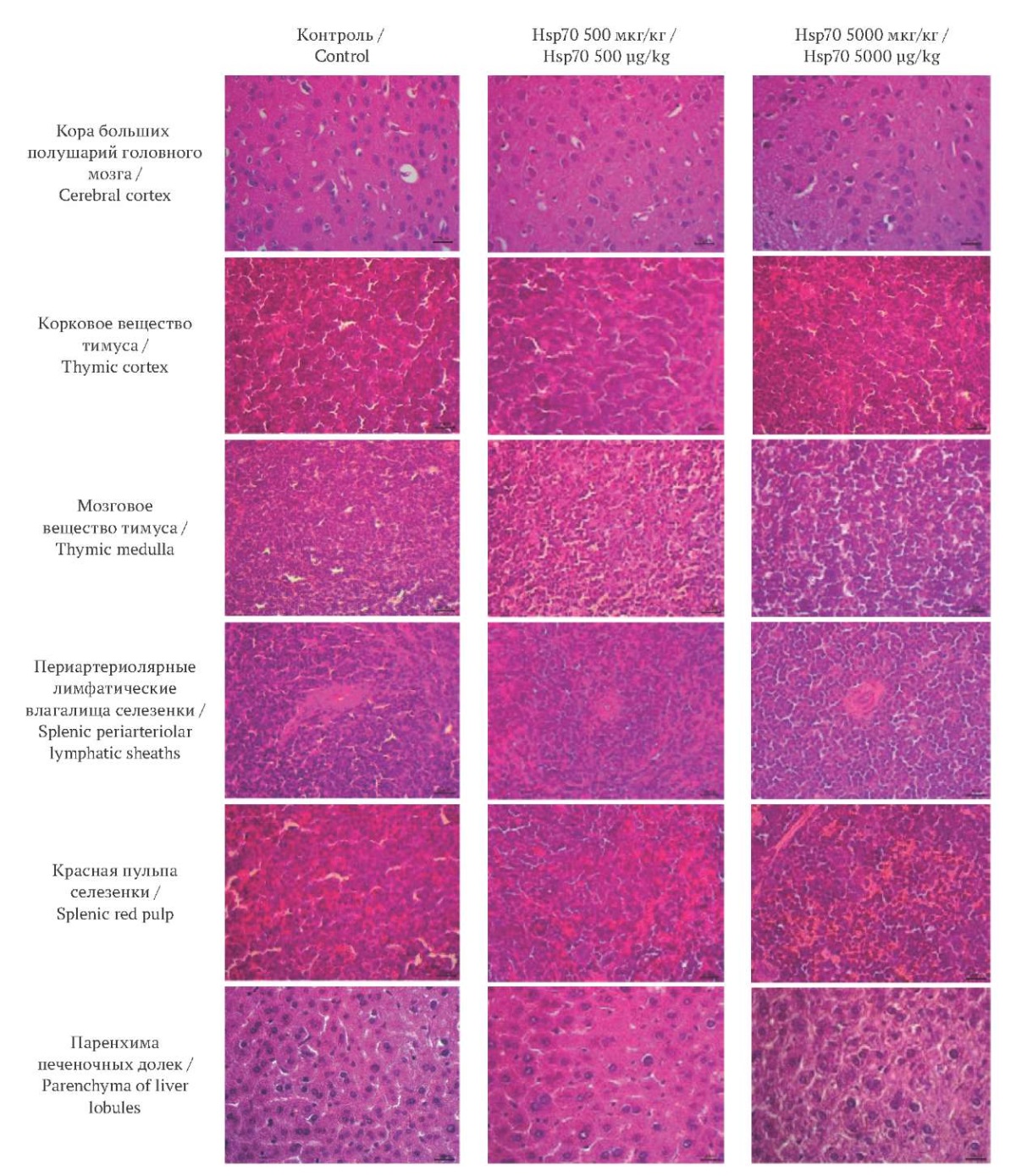
РИС. 3. Гистологические препараты органов мышей
на пятые сутки после однократного введения низкой или высокой дозы Hsp70.
Окраска гематоксилином и эозином, об.×40, ок.×20.
FIG. 3. Histological slides of murine organs
on Day 5 after single injections of Hsp70 at low or high dose.
Hematoxylin and eosin staining, ob.×40, oc.×20.
При оценке иммуноморфологических эффектов Hsp70 на срезах тимуса у животных всех трех групп структура как коркового, так и мозгового вещества хорошо визуализируется, признаки структурных изменений отсутствуют, визуальных различий между группами не выявлено (рис. 3).
На срезах белой пульпы селезенки для всех трех групп отличных от нормальных структурных признаков не обнаружено. В красной пульпе не отмечено накопления специфических пигментов, а отдельные макрофаги хорошо различимы, при этом их количество выглядит меньшим в группе Hsp70 5000 мкг/кг (рис. 3).
В ткани печени для всех трех групп структура органа была не нарушена. Синусоидные капилляры в группе контроля и группе Hsp70 500 мкг/кг оказались немного шире и полнокровнее по сравнению с Hsp70 5000 мкг/кг (рис. 3).
При проведении морфометрического анализа (рис. 4A) у мышей группы контроля в ганглионарном слое коры больших полушарий головного мозга в среднем определено 34,6 ± 1,6 нейрона в поле зрения, группы Hsp70 500 мкг/кг – 25,2 ± 1,4 клетки, группы Hsp70 5000 мкг/кг – 27,2 ± 1,7 нейрона. На срезах вилочковой железы (рис. 4B) разница лимфоцитарной клеточности между корковым и мозговым веществом для группы контроля – 398,7 ± 30,4 клетки, группы Hsp70 500 мкг/кг – 274,9 ± 36,1 клетки, группы Hsp70 5000 мкг/кг – 407,6 ± 42,8 клетки. В периартериолярных лимфатических влагалищах (рис. 4C) в селезенке у животных группы контроля выявлено 2091,6 ± 33,4 лимфоцита, группы Hsp70 500 мкг/кг – 2040,0 ± 15,7 клетки, группы Hsp70 5000 мкг/кг – 1987,4 ± 20,9. Хотя наблюдались отдельные пики в группах, распределение соответствовало нормальному и все три выборки из генеральных совокупностей перекрывали друг друга. Статистически значимых различий между группами по числу нейронов, разнице лимфоцитарной клеточности между корковым и мозговым веществом и числу лимфоцитов в периартериолярных лимфатических влагалищах не выявлено.
В красной пульпе (рис. 4D) результаты морфометрии выявили различия в группах исследования. Так, у мышей группы контроля определено 1774,5 ± 24,8 макрофага, в группах Hsp70 число макрофагов уменьшалось в зависимости от введенной дозы: 500 мкг/кг – 1623,0 ± 26,7 клетки, 5000 мкг/кг – 1553,6 ± 47,0. Различия между группами статистически значимы (р < 0,0001). В апостериорном тесте Тьюки статистически значимые различия получены при сравнении группы контроля с группами Hsp70 500 мкг/кг (р < 0,05) и 5000 мкг/кг (р < 0,0001).
При морфометрическом анализе срезов печени (рис. 4E) у мышей группы контроля определено 122,5 ± 4,2 гепатоцита, группы Hsp70 500 мкг/кг – 129,5 ± 3,6 клетки, группы Hsp70 5000 мкг/кг – 115,7 ± 3,6. Полученное значение р находилось на границе принятого уровня статистической значимости (p = 0,053), в тесте Тьюки разница между группами Hsp70 500 мкг/кг и 5000 мкг/кг статистически значима.
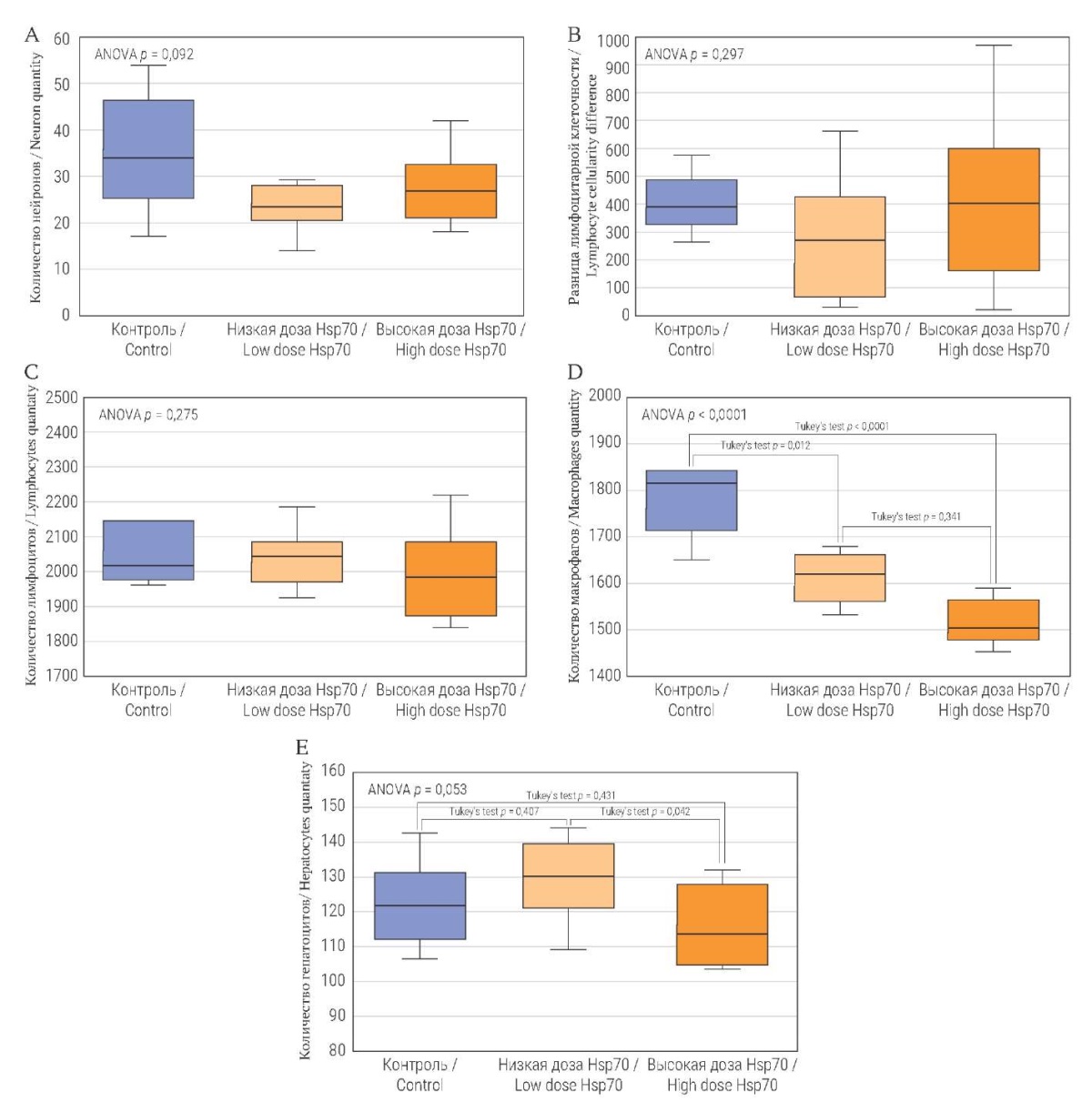
РИС. 4. Морфометрические показатели у мышей
на пятые сутки после однократного введения низкой или высокой дозы Hsp70
при подсчете в 6 полях зрения. Об.×40, ок.×20.
FIG. 4. Morphometrics in mice on Day 5 after single injections of Hsp70
at low or high dose, 6 fields of view. Ob.×40, oc.×20.
ОБСУЖДЕНИЕ
Полученные нами результаты показали, что на фоне подкожного введения Hsp70 (рекомбинантного человеческого HspA1A) функциональные реакции у мышей не пострадали и остались в пределах значений, определенных для группы контроля, при низкой (500 мкг/кг) и высокой дозировках (5000 мкг/кг) препарата. Также продемонстрирована толерантность нейронов ганглионарного слоя коры головного мозга к однократным высоким дозам подкожно вводимого Hsp70.
Обнаружена устойчивость тимуса к возможному повреждающему воздействию экзогенного Hsp70, несмотря на близкий к началу инволюции возраст грызунов. На фоне введения Hsp70 оказались индифферентны и медиаторные клеточные элементы иммунной системы в периартериолярных лимфатических влагалищах. На примере ткани печени также продемонстрировано, что при введении рекомбинантного человеческого Hsp70 не произошло негативных изменений в метаболически активных органах. Интересно, что введение высоких доз Hsp70 статистически значимо приводило к некоторому уменьшению числа гепатоцитов, при этом обе выборки не имеют различий с таковой для контрольной группы. Вероятно, высокие дозы Hsp70 имеют незначительное воздействие на печеночную паренхиму, но оно, тем не менее, не выходит за пределы нормальной вариативности.
При этом отмечена тенденция к меньшему кровенаполнению синусоидных капилляров при повышении дозы Hsp70. Возможно, такой эффект дает взаимодействие Hsp70 с фагоцитирующими клетками в красной пульпе селезенки. Наблюдаемое нами уменьшение количества макрофагов могло способствовать изменениям в метаболизме компонентов гема, что теоретически могло сказаться на утилизации продуктов распада гема. Настоящее явление требует тщательного подробного изучения в дальнейшем.
Мы предполагаем, что наблюдаемые нами изменения в красной пульпе селезенки в виде тенденции к сокращению количества макрофагов при повышении дозы Hsp70 (при том, что при post hoc анализе не получено данных о дозозависимом характере таких изменений) могут служить приспособительной реакцией антиген-представляющих клеток к воздействию маркера вводимого экзогенного Hsp70 как белка стресса. При этом сами различия в моноцитарно-макрофагальном звене между группами исследования не уникальны [17]. Отметим, что в литературе есть данные и о противоположных эффектах, особенно при длительном воздействии Hsp70 и на фоне онкопатологии [18][19].
Применение Hsp70 для настоящего исследования требовало тщательного подбора релевантного режима дозирования. Дизайн рандомизации на введение однократно подкожно 500 или 5000 мкг/кг рекомбинантного человеческого HspA1A в качестве низко- и высокодозовых режимов соответственно разработан после изучения описанных в литературе альтернатив. Так, не приводил к повреждению тканей вводимый внутрибрюшинно Hsp70 по 200 мкг/кг в течение 21 дня [17] или подкожно по 50 мкг/кг в течение 14 суток [20]. Неинъекционное применение без патологических реакций описано для интраназального введения, например по 2 мкг/кг в течение 9 месяцев [21]. Существуют разработки по таргетированной доставке рекомбинантного человеческого Hsp70 при помощи инкапсуляции, продемонстрировавшие системные провоспалительные свойства белка в виде эффективного снижения выработки активных форм кислорода и фактора некроза опухоли [22].
Мы обратили внимание на подкожный путь введения как на наименее изученный, в том числе в вопросе проникновения экзогенного Hsp70 через гематоэнцефалический барьер. Учитывая диапазон доз Hsp70 по данным источников, мы выбрали максимально высокие дозы в 5000 мкг/кг рекомбинантного человеческого HspA1A, не приводившие к фатальным последствиям. Этим же принципом обусловлен выбор однократного воздействия, при котором возможна компенсация избытка вводимого Hsp70.
Ограничения исследования
Разброс значений для полученных данных неизбежно велик, поскольку выборка была малой. Это необходимое ограничение пилотного эксперимента в силу этических соображений.
Направления для дальнейших исследований
На основании полученных результатов не до конца ясно, позволяет ли гематоэнцефалический барьер экзогенному Hsp70 проникнуть в нервную ткань при подкожном введении. Это побуждает сравнивать разные способы введения для оценки состояния нервной ткани при введении данного белка.
ВЫВОДЫ
Подкожное введение высоких и низких доз экзогенного Hsp70 трехмесячным мышам не показало статистически значимого воздействия на органы нервной (кора головного мозга) и иммунной систем (тимус, селезенка), а также печень. Полученные функциональные и гистологические результаты демонстрируют отсутствие негативного воздействия при однократном введении даже высоких (5000 мкг/кг) дозировок рекомбинантного человеческого HspA1A. Это дает возможность дальнейших разработок в области применения Hsp70 при нейродегенеративных заболеваниях с учетом минимальных нежелательных морфофункциональных проявлений. Кроме того, результаты исследования облегчают титрование предельных доз рекомбинантного человеческого Hsp70 при подкожном введении.
ВКЛАД АВТОРОВ
Г.А. Пьявченко и А.А. Венедиктов в равной степени внесли вклад в работу и должны считаться первыми соавторами. Г.А. Пьявченко, А.А. Венедиктов и С.Л. Кузнецов разработали дизайн исследования. Г.А. Пьявченко, А.А. Венедиктов и Е.А. Кузьмин осуществляли подготовку животных и проводили физиологические тесты. Е.А. Кузьмин изготавливал гистологические препараты. Г.А. Пьявченко, А.А. Венедиктов выполняли морфометрию, статистическую обработку результатов и написали текст работы. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Gennadii A. Piavchenko, and Artem A. Venediktov contributed equally to this work and should be considered as co-first authors.
Gennadii A. Piavchenko, Artem A. Venediktov, and Sergey L. Kuznetsov designed the study. Gennadii A. Piavchenko, Artem A. Venediktov, and Egor A. Kuzmin provided manipulations with animals and physiological testing. Egor A. Kuzmin made histological slides. Gennadii A. Piavchenko, and Artem A. Venediktov carried out morphometrics and statistical calculations for the results, and wrote the text of the article. All the authors read and approved the final version of this manuscript.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Кудрявцевой В.А., Моисеевой А.В., Бойковой П.В., Гореловой М.А. – студентам ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России (Сеченовский Университет) и Сердюк Е.А – врачу КФ ФГАУ НМИЦ «МНТК “Микрохирургия глаза” имени С.Н. Федорова» в г. Белгороде за помощь в проведении исследования и обсуждение полученных результатов.
ACKNOWLEDGMENTS
The authors express their gratitude to Kudryavtseva V.A., Moiseeva A.V., Boykova P.V., Gorelova M.A. (students of Sechenov University), and Serdyuk E.A. (doctor of the Fyodorov Eye Microsurgery, Belgorod) for assistance in conducting the study and discussing the results obtained.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (№ 04-23-02.03.2023).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проведено за счет гранта Российского научного фонда № 23-25-004481 от 12.01.2023.
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Sechenov First Moscow State Medical University (Sechenov University), No. 04-23 of 02.03.2023.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare no confict of interests.
Financing. The work was financed by funding obtained from a grant of Russian Scientific Fund # 23-25-004482 from 12.01.2023.
1. https://rscf.ru/project/23-25-00448/ (дата обращения: 12.06.2023).
2. https://rscf.ru/project/23-25-00448/ (дата обращения: 12.06.2023).
3. https://www.internet-law.ru/gosts/gost/61242/ (дата обращения: 12.06.2023).
4. https://www.internet-law.ru/gosts/gost/62388/ (дата обращения: 12.06.2023).
5. Руководство по содержанию и использованию лабораторных животных. Восьмое издание / пер. с англ. под ред. И.В. Белозерцевой, Д.В. Блинова, М.С. Красильщиковой. М.: ИРБИС, 2017. 336 с.
Список литературы
1. Hagymasi A.T., Dempsey J.P., Srivastava P.K. Heat-Shock proteins. Curr Protoc. 2022; 2(11): e592. https://doi.org/10.1002/cpz1.592. PMID: 36367390
2. Albakova Z., Armeev G.A., Kanevskiy L.M., et al. HSP70 multifunctionality in cancer. Cells. 2020 Mar 2; 9(3): 587. https://doi.org/10.3390/cells9030587. PMID: 32121660
3. Roodveldt C., Outeiro T.F., Braun J.E.A. Editorial: Molecular Chaperones and neurodegeneration. Front Neurosci. 2017; 11: 565. https://doi.org/10.3389/fnins.2017.00565. PMID: 29085276
4. Магнаева А.С., Баранич Т.И., Воронков Д.Н. и др. Иммуногистохимическая оценка шаперон-индуцируемой аутофагии в различных отделах головного мозга человека при старении. Морфологические ведомости. 2023; 31(1): 724. https://doi.org/10.20340/mv-mn.2023.31(1).724
5. Юринская М.М., Фуников С.Ю., Евгеньев М.Б., Винокуров М.Г. Экзогенный белок теплового шока HSP70 снижает реакцию клеток нейробластомы человека на липополисахарид. Докл Биохим Биофизика. Июль 2016; 469(1): 239–243. https://doi.org/10.1134/S1607672916040025. Epub 2016 Sep 7. PMID: 27599502
6. Лазарев В.Ф., Дутышева Е.А., Утепова И.А. и др. Применение активаторов синтеза белков теплового шока в качестве нейропротекторов. III объединенный научный форум физиологов, биохимиков и молекулярных биологов. Материалы: VII съезд биохимиков России. X российский симпозиум «Белки и пептиды». VII съезд физиологов СНГ, Сочи, Дагомыс, 3–8 октября 2021 года. Том 2. М.: Издательство «Перо», 2021; 55–56. ISBN: 978-5-00189-678-4
7. Venediktov A., Bushueva O., Kudryavtseva V., et al. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front. Mol. Neurosci. Sec. Molecular Signalling and Pathways. 2023;16. https://doi.org/10.3389/fnmol.2023.1230436
8. Zatsepina O.G., Evgen’ev M.B., Garbuz D.G. Role of a Heat Shock transcription factor and the major Heat Shock protein Hsp70 in memory formation and neuroprotection. Cells. 2021; 10: 1638. https://doi.org/10.3390/cells10071638. PMID: 34210082
9. Kalmar B., Greensmith L. Cellular chaperones as therapeutic targets in ALS to restore protein homeostasis and improve cellular function. Front Mol Neurosci. 2017; 10(9): 251. https://doi.org/10.3389/fnmol.2017.00251
10. Festing M.F.W., Altman D.G. Guidelines for the design and statistical analysis of experiments using laboratory animals. ILAR J. 2002; 43(4): 244–258. https://doi.org/10.1093/ilar.43.4.244. Erratum in: ILAR J. 2005; 46(3): 320. PMID: 12391400
11. Baran-Gale J., Morgan M.D., Maio S., et al. Ageing compromises mouse thymus function and remodels epithelial cell differentiation. Elife. 2020; 9: e56221. https://doi.org/10.7554/eLife.56221. PMID: 32840480
12. Yousefzadeh M.J., Zhao J., Bukata C., et al. Tissue specificity of senescent cell accumulation during physiologic and accelerated aging of mice. Aging Cell. 2020 Mar; 19 (3): e13094. https://doi.org/10.1111/acel.13094. Epub 2020 Jan 25. PMID: 31981461
13. Rai R., Kennedy A.L., Isingizwe Z.R., et al. Similarities and differences of Hsp70, Hsc70, Grp78, and mortalin as cancer biomarkers and drug targets. Cells. 2021; 10(11): 2996. https://doi.org/10.3390/cells10112996. PMID: 34831218
14. Moody C.M., Makowska I.J., Weary D.M. Testing three measures of mouse insensibility following induction with isoflurane or carbon dioxide gas for a more humane euthanasia. Applied Animal Behaviour Science. 2015; 163: 183–187. https://doi.org/10.1016/J.APPLANIM.2014.11.010
15. Feldman A.T., Wolfe D. Tissue processing and hematoxylin and eosin staining. Methods Mol Biol. 2014; 1180: 31–43. https://doi.org/10.1007/978-1-4939-1050-2_3. PMID: 25015141
16. Bankhead P., Loughrey M.B., Fernández J.A., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 2017; 7(1): 16878. https://doi.org/10.1038/s41598-017-17204-5. PMID: 29203879
17. Lee C.H., Su T.C., Lee M.S., et al. Heat shock protein 70 protects the lungs from hyperoxic injury in a neonatal rat model of bronchopulmonary dysplasia. PLoS One. 2023; 18(5): e0285944. https://doi.org/10.1371/journal.pone.0285944. PMID: 37200358
18. Son H., Choi H.S., Baek S.E., et al. Shear stress induces monocyte/ macrophage-mediated inflammation by upregulating cell-surface expression of heat shock proteins. Biomed Pharmacother. 2023; 161: 114566. https://doi.org/10.1016/j.biopha.2023.114566. Epub 2023 Mar 22. PMID: 36963359
19. Yamaguchi-Tanaka M., Takagi K., Miki Y., et al. The pro-tumorigenic role of chemotherapy-induced extracellular HSP70 from breast cancer cells via intratumoral macrophages. Cancers (Basel). 2023; 15(6): 1903. https://doi.org/10.3390/cancers15061903. PMID: 36980788
20. Kao J.K., Hsu T.F., Lee M.S., et al. Subcutaneous injection of recombinant heat shock protein 70 ameliorates atopic dermatitis skin lesions in a mouse model. Kaohsiung J Med Sci. 2020; 36(3): 186-195. https://doi.org/10.1002/kjm2.12163. Epub 2020 Jan 6. PMID: 31904187
21. Bobkova N.V., Evgen’ev M., Garbuz D.G., et al. Exogenous Hsp70 delays senescence and improves cognitive function in aging mice. Proc Natl Acad Sci USA. 2015; 112(52): 16006–16011. https://doi.org/10.1073/pnas.1516131112. Epub 2015 Dec 14. PMID: 26668376
22. Yurinskaya M.M., Kochetkova O.Y., Shabarchina L.I., et al. Encapsulated Hsp70 decreases endotoxin-induced production of ROS and TNFα in human phagocytes. Cell Stress Chaperones. 2017; 22(1): 163–171. https://doi.org/10.1007/s12192-016-0743-z. Epub 2016 Oct 26. Erratum in: Cell Stress Chaperones. 2017 Mar; 22(2): 317. PMID: 27783274
Об авторах
Г. А. ПьявченкоРоссия
Пьявченко Геннадий Александрович - канд. мед. наук, доцент кафедры анатомии и гистологии человека.
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
А. А. Венедиктов
Россия
Венедиктов Артем Андреевич - аспирант, ассистент кафедры анатомии и гистологии человека.
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
Тел.: +7 (980) 019-08-63
Е. А. Кузьмин
Россия
Кузьмин Егор Александрович - студент, лаборант кафедры анатомии и гистологии человека.
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
С. Л. Кузнецов
Россия
Кузнецов Сергей Львович - чл.-корр. РАН, д-р мед. наук, профессор кафедры анатомии и гистологии человека.
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
Дополнительные файлы

|
1. Чек-лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(163KB)
|
Метаданные ▾ | |
Рецензия
JATS XML







































