Перейти к:
Факторы риска рецидива эндометриоидных кист яичников после хирургического лечения: ретроспективное когортное исследование
https://doi.org/10.47093/2218-7332.2020.11.4.60-71
Аннотация
Цель. Определить факторы риска рецидива эндометриоидных кист яичников (ЭКЯ) после хирургического лечения.
Материалы и методы. В ретроспективное когортное исследование включены 82 пациентки, прооперированные впервые по поводу ЭКЯ, период наблюдения составил 30 мес. Рецидив развился у 19 пациенток (группа 1), у 63 — рецидив не диагностирован (группа 2). В качестве факторов риска рецидива оценены данные до операции (клинические особенности, уровень СА-125), во время операции (концентрация цитокинов в перитонеальной жидкости, иммуногистохимический анализ капсулы ЭКЯ), послеоперационная терапия. Для сравнения групп использовался U-критерий Манна — Уитни, точный критерий Фишера. Рассчитаны специфичность, чувствительность, точность, AUC ROC и пороговые значения.
Результаты. Частота рецидивов ЭКЯ составила 23%. Не выявлено отличий между группами по возрасту, доле курящих, индексу массы тела, гинекологическому анамнезу, акушерскому статусу и послеоперационной гормональной терапии. Предоперационная концентрация СА-125 в группе 1 была выше, чем в группе 2: 62,5 Ед/мл [40,7; 112,3] vs 40,3 Ед/мл [20,3; 68,8], р < 0,05. Концентрация IL-6, IL-8, TNFα, IL-1β, IL-17, VEGF, MCP 1 в перитонеальной жидкости, взятой во время операции, была статистически значимо выше в группе 1. Наибольшая AUC ROC получена для VEGF — 0,875 (0,778–0,973) и IL-8 — 0,953 (0,896–1,009). Для VEGF пороговое значение составило 125,6 пг/мл, чувствительность 100%, специфичность 71%, точность 79,8%. Для IL-8 пороговое значение составило 128,78 пг/мл, чувствительность 93%, специфичность 87,1%, точность 88,9%. В группе 1 регистрировались более высокие значения экспрессии маркеров ангиогенеза VEGF и CD34 в ЭКЯ. Наибольшая AUC ROC отмечена для CD34 — 0,844 (0,683–1,000), пороговое значение составило 2,5%, чувствительность 90%, специфичность 75%, точность 80,8%.
Заключение. К факторам риска рецидива ЭКЯ после оперативного лечения относятся уровень VEGF и IL-8 в перитонеальной жидкости и экспрессия CD 34 в капсуле.
Ключевые слова
Список сокращений:
AUC ROC — area under receiver operating characteristic curve, площадь под ROC-кривой
IL — interleukin, интерлейкин
MCP-1 — monocyte chemotactic protein 1, моноцитарный хемоаттрактантный протеин 1
TNFα — tumor necrosis factor α, фактор некроза опухоли альфа
VEGF — vascular endothelial growth factor, сосудистый эндотелиальный фактор роста
аГнРГ — агонисты гонадотропин-рилизинг гормона
ИГХ — иммуногистохимия
ИМТ — индекс массы тела
ИППП — инфекции, передающиеся половым путем
СА-125 — Carbohydrate antigen — 125, углеводный антиген — 125
ЭКЯ — эндометриоидная киста яичника
Эндометриоз — хроническое дисгормональное иммунозависимое заболевание, при котором за пределами полости матки происходит разрастание ткани, по морфологическим и структурным особенностям подобной эндометрию [1][2].
Наиболее распространенной формой эндометриоидной болезни являются эндометриоидные кисты яичников, на их долю приходится до 59% случаев [3][4].
Рецидивирование ЭКЯ — одна из наиболее сложных проблем в современной гинекологии [5]. Частота этого осложнения, по данным различных исследований, колеблется от 6 до 67% [6].
К настоящему времени установлено, что рецидив — это многофакторный процесс, развивающийся на фоне вялой ответной реакции системного иммунитета, избыточного воспаления и ангиогенеза. Проведены исследования по поиску возможных факторов риска рецидива ЭКЯ [7][8][9], включающие оценку уровня лептина и интерлейкина-6 (IL-6, interleukin 6) в сыворотке крови спустя 3 месяца после органосохраняющего оперативного вмешательства [7] путем определения факторов пролиферации и апоптоза (Ki 67, Bcl 2), воспалительных предикторов (NF-κβ p 65, COX 2), факторов адгезии (β-катенин), эстрогеновых и прогестероновых рецепторов в капсуле ЭКЯ [8], индекса пролиферативной активности железистой ткани Ki 67 и экспрессии рецепторов эстрадиола в капсуле патологического образования [9]. Однако результаты этих исследований противоречивы.
Другие исследователи оценивали уровень различных биохимических показателей непосредственно в перитонеальной жидкости пациенток с наружным генитальным эндометриозом [10][11]. Следует отметить, что в этих работах не исследовалась взаимосвязь между уровнем цитокинов и риском рецидива заболевания.
Таким образом, проведение настоящего исследования было продиктовано необходимостью поиска факторов риска возможного рецидива ЭКЯ, оценка которых позволила бы повысить точность прогноза этого осложнения и оптимизировать подходы к послеоперационной медикаментозной терапии.
Цель исследования: определить факторы риска рецидива ЭКЯ после хирургического лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на кафедре акушерства и гинекологии ФГБОУ ВО «ПИМУ» Минздрава России г. Нижнего Новгорода на базе I и II гинекологических отделений НОКБ им. Н.А. Семашко и ГБУЗ НО «ГКБ № 29» в период с 14.11.2016 по 13.04.2020 г.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО «ПИМУ» Минздрава России, протокол № 14 от 07.11.2016 г.
Для достижения поставленной цели проведено ретроспективное когортное исследование, в которое были включены пациентки, поступившие в медицинские учреждения на плановое оперативное лечение по поводу ЭКЯ (рис.).
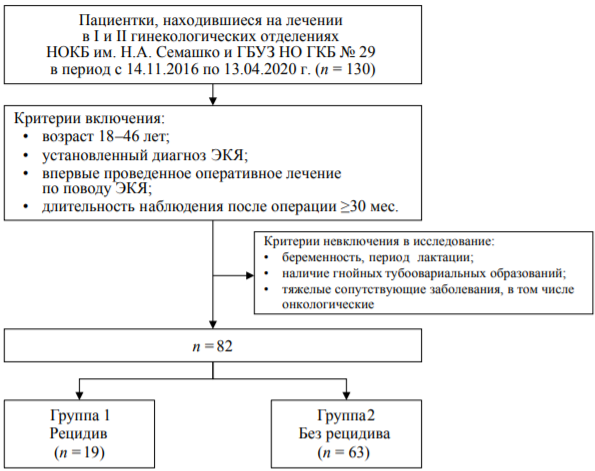
РИС. Потоковая диаграмма включения пациентов в исследование.
FIG. Patient enrollment flowchart.
Диагноз ЭКЯ устанавливался на основании лапароскопических (образование округлой или овальной формы с капсулой темно-синего цвета, густое «шоколадного» цвета содержимое кисты) и морфологических (цитогенная строма, функционально активный или дистрофически измененный эпителий, отложения гемосидерина и свежие кровоизлияния) признаков эндометриоидных кист.
В качестве возможных факторов риска рецидива оценены:
1) данные до операции:
- клинические особенности;
- результаты лабораторных и инструментальных методов исследования;
2) данные во время операции:
- описание протокола оперативного вмешательства;
- концентрация цитокинов в перитонеальной жидкости;
- иммуногистохимический (ИГХ) анализ капсулы ЭКЯ;
3) послеоперационная терапия.
Изучались следующие характеристики пациенток: возраст, жалобы, ИМТ, менструальная и детородная функции, информация о перенесенных гинекологических заболеваниях и операциях, оценка уровня СА-125 (Carbohydrate antigen — 125, углеводный антиген — 125) в сыворотке крови, данные ультразвукового исследования (УЗИ) органов малого таза.
Хирургическое лечение осуществлялось лапароскопическим доступом с использованием расширенного лапароскопического набора для гинекологии Olympus.
У всех пациенток изучены данные протоколов операционного лечения согласно классификации Американского общества по репродуктивной медицине (ASRM American Society for Reproductive Medicine), дополнительно оценивалось наличие ретроцервикального эндометриоза.
Интраоперационно у 15 женщин первой группы и у 31 — второй исследовалась перитонеальная жидкость, в которой определялись: IL-6, IL-8, IL-17, IL-1β, фактор некроза опухоли альфа (TNF α, tumor nercrosis factor α), сосудистый эндотелиальный фактор роста (VEGF, vascular endothelial growth factor), моноцитарный хемотаксический белок 1 (MCP 1, monocyte chemotactic protein 1). Для определения концентрации исследуемых цитокинов применялся метод твердофазного иммуноферментного анализа на анализаторе Sunrise (“Tecan Austria GmbH”, Австрия) и набор реагентов производства ООО «Цитокин» (Санкт-Петербург, Россия) и АО «Вектор-Бест» (Новосибирская область, р.п. Кольцово, Россия).
На базе прозектория НОКБ им. Н.А. Семашко 10 пациенткам группы 1 и 16 пациенткам группы 2 выполнен ИГХ-анализ с целью выявления экспрессии в структурных компонентах ЭКЯ-маркеров ангиогенеза — CD34, VEGF, апоптоза — Р53 и пролиферации Ki67. Исследование проведено на срезах с парафиновых блоков операционного материала с использованием мышиных моноклональных антител к Ki 67, P53, VEGF и СD34.
После выписки всем пациенткам назначали гормональную терапию: агонисты гонадотропин-рилизинг гормона (аГнРГ) — бусерелина ацетат или трипторелина ацетат 3,75 мг № 3–6, аГнРГ с последующим приемом диеногеста 2 мг в течение 6 месяцев либо только диеногест 2 мг в течение 6–9 месяцев.
Контроль эффективности лечения оценивался через 2,5 года после оперативного вмешательства. Рецидив ЭКЯ определяли при выявлении объемного образования яичника более 1 см с эхоскопическими признаками ЭКЯ, не уменьшающегося в размерах или не проходящего в течение нескольких последовательных менструальных циклов.
Статистический анализ результатов
Нормальность распределения анализируемых признаков оценивалась критериями Шапиро — Уилка и Колмогорова — Смирнова. Признаки описывались с помощью медианы и межквартильного размаха (25%-го; 75%-го процентилей). Качественные данные обобщались путем вычисления доли наблюдений конкретной категории в исследуемой выборке. Сравнение двух выборок при анализе переменных осуществлялось с применением непараметрического U-критерия Манна — Уитни, точного критерия Фишера. Рассчитаны операционные характеристики (специфичность, чувствительность, точность) исследуемых иммунологических показателей перитонеальной жидкости и капсулы кисты, проведен расчет площади по ROC-кривой (AUC ROC), пороговые значения. Значимыми считали различия при уровне статистической значимости р < 0,05.
Статистический анализ результатов проводился с применением программ IBM SPSS v.23.0 (SPSS: An IBM Company, США).
РЕЗУЛЬТАТЫ
Характеристики до операции
Клиническая характеристика пациенток, прооперированных в ходе настоящего исследования, представлена в таблице 1.
Таблица 1. Клинические и инструментальные характеристики пациенток на момент операции
Table 1. Clinical and instrumental characteristics of the patients at the time of surgery
|
Показатель |
Группа 1 (n = 19) |
Группа 2 (n = 63) |
Значение р |
|
Возраст, лет |
36 [ 31,5; 40,75 ] |
33 [ 29; 39 ] |
n.s. |
|
Курение табака |
2 (11) |
3 (5) |
n.s. |
|
ИМТ |
23,1 [ 19,5; 27,2 ] |
24,5 [ 21,4; 28,7 ] |
n.s. |
|
Жалобы: |
|||
|
боль перед менструацией |
17 (89) |
61 (97) |
n.s. |
|
бесплодие |
3 (16) |
16 (25) |
n.s. |
|
нарушение менструальной функции |
1 (5) |
7 (11) |
n.s. |
|
дисменорея |
11 (58) |
43 (68) |
n.s. |
|
Акушерский статус: |
|||
|
≥2 родов |
3 (16) |
14 (22) |
n.s. |
|
аборт |
2 (11) |
14 (22) |
n.s. |
|
выкидыш |
2 (11) |
4 (6) |
n.s. |
|
неразвивающаяся беременность |
1 (5,3) |
- |
n.s. |
|
Гинекологический анамнез: |
|||
|
миома матки |
5 (26) |
18 (28) |
n.s. |
|
аденомиоз |
9 (47) |
27 (43) |
n.s. |
|
гиперпластические процессы эндометрия |
6 (32) |
12 (19) |
n.s. |
|
хронический сальпингоофорит |
9 (47) |
16 (25) |
0,089 |
|
хронический эндометрит |
4 (21) |
8 (13) |
n.s. |
|
ИППП |
1 (5) |
2 (3) |
n.s. |
|
ВПЧ |
2 (11) |
3 (5) |
n.s. |
|
СПКЯ |
1 (5) |
1 (2) |
n.s. |
|
операции на придатках матки по поводу патологии, не связанной |
2 (11) |
- |
0,052 |
|
СА-125, Ед/мл |
62,5 [ 40,7; 112,3 ] |
40,3 [ 20,3; 68,8 ] |
<0,05 |
|
УЗИ: 2-сторонние образования |
8 (42) |
13 (21) |
0,076 |
Примечание. Данные представлены как абсолютное число и доля (%) или как медиана и 25–75-й процентили.
ИППП — инфекции, передающиеся половым путем, ВПЧ — вирус папилломы человека, СПКЯ — синдром поликистозных яичников.
n.s. — not significant, незначимо.
Note. Data presented as absolute number and proportion (%) or as median and 25–75 percentiles.
STIs — sexually transmitted infections, HPV — human papillomavirus, PCOS — polycystic ovary syndrome.
n.s. — not significant.
Медианы возраста пациенток в группах 1 и 2 значимо не различались и составили 36 и 33 года соответственно. Доля курящих среди исследованных групп была невысокой (5–11%). Индекс массы тела (ИМТ) был несколько ниже в группе 1, статистически значимых различий между группами не выявлено.
Большинство пациенток в обеих группах (89–97%) отмечали жалобы на боль в нижних отделах живота и в поясничной области, усиливающуюся перед менструацией (разница между группами незначима). По частоте отсутствия наступления беременности, нарушений менструальной функции в виде мажущих кровянистых выделений до, после менструации и в середине цикла значимых отличий между группами не установлено.
В обеих группах была достаточно высока доля пациенток с дисменореей — 58–68% (разница между группами незначима).
При оценке акушерского статуса значимых различий по доле пациенток с двумя и более родами в анамнезе, абортами, выкидышами между группами выявлено не было.
По данным гинекологического анамнеза наиболее частым был аденомиоз: у 43–47% пациенток. Частота миомы матки, хронического эндометрита, гиперпластических процессов в эндометрии не отличалась между группами. У 3–5% пациенток в анамнезе диагностированы инфекции, передающиеся половым путем, у 5–11% — вирус папилломы человека, у 1% — синдром поликистозных яичников. Хронический сальпингоофорит диагностировался почти в два раза чаще в группе 1: у 9 (47%) пациенток vs 16 (25%) в группе 2 (p = 0,089). У двух пациенток в группе 1 в анамнезе имелись указания на наличие операций на придатках матки по поводу патологии, не связанной с эндометриозом, в группе 2 таких пациенток не отмечено, разница между группами близка к статистически значимой (p = 0,052).
Медиана концентрации СА-125 перед операцией была выше референсных значений в обеих группах, при этом в группе 1 она была в 1,5 раза выше, чем в группе 2, различия статистически значимы.
По данным УЗИ двухсторонние ЭКЯ в два раза чаще регистрировались в группе 1, разница с группой 2 близка к статистически значимой (p = 0,076).
Характеристики во время операции
При оценке протоколов первичного оперативного вмешательства оказалось, что малые формы на контрлатеральном яичнике при односторонних ЭКЯ, поражение брюшины малого таза и спаечный процесс 3-й и 4-й степени статистически значимо чаще встречались у пациенток в группе 1. Ретроцервикальный эндометриоз также чаще наблюдался в группе 1, однако статистически значимой разницы с группой 2 не установлено (табл. 2).
При анализе концентрации IL-6, IL-8, TNF-α, IL-1β, IL-17, VEGF, MCP 1 выявлено, что в группе 1 все изучаемые показатели статистически значимо превышали аналогичные показатели в группе 2 (табл. 3).
Результаты ИГХ-анализа капсулы образования представлены в таблице 4. Согласно полученным данным, по пролиферативной активности эпителиальных клеток в капсуле ЭКЯ, экспрессии маркера Р 53 и сосудам фиброзного компонента стенки ЭКЯ статистически значимых отличий между группами не выявлено.
Таблица 2. Интраоперационные характеристики пациенток групп исследования
Table 2. Intraoperative characteristics of the patients of study groups
|
Показатель |
Группа 1 (n = 19) |
Группа 2 (n = 63) |
Значение р |
|
Малые формы на контрлатеральном яичнике при односторонних ЭКЯ |
11 (58) |
19 (30) |
<0,05 |
|
Поражение брюшины малого таза |
16 (84) |
34 (54) |
<0,05 |
|
Ретроцервикальный эндометриоз |
7 (37) |
11 (17) |
n.s. |
|
Спаечный процесс 3-й степени |
10 (53) |
12 (19) |
0,007 |
|
Спаечный процесс 4-й степени |
9 (47) |
2 (3) |
<0,001 |
Примечание. Данные представлены как абсолютное число и доли (%).
Note. Data presented as absolute number and proportions (%).
Таблица 3. Средние значения иммунологических показателей перитонеальной жидкости в сравниваемых группах
Table 3. The average values of the immunological parameters of peritoneal fluid in the compared groups
|
Наименование цитокина |
Группа 1 (n = 15) |
Группа 2 (n = 31) |
Значение р |
|
IL-6 |
126,5 [ 87,7; 560,7] |
36,1 [ 15,7; 74,1 ] |
<0,01 |
|
IL-8 |
1255,9 [ 537,5; 1739,3] |
35,5 [ 9,0; 97,4 ] |
<0,01 |
|
TNFα |
2,4 [ 1,1; 4,5] |
0,92 [ 0,81; 1,16 ] |
<0,01 |
|
IL-1β |
4,65 [ 1,08;55,36] |
0,70 [ 0,38; 1,15 ] |
<0,01 |
|
IL-17 |
18,93 [ 8,25; 42,96] |
10,2 [ 0; 18,0 ] |
<0,05 |
|
VEGF |
288,9 [ 176,8; 562,2] |
112,4 [ 78,8; 160,2 ] |
<0,01 |
|
MCP 1 |
729,2 [ 416,7; 1398,3] |
235,2 [ 137,2; 437,5 ] |
<0,01 |
Примечание. Представлены концентрации цитокинов в пг/мл.
Note. Cytokine concentrations presented in pg/ml.
Таблица 4. Результаты иммуногистохимического исследования
Table 4. Results of the immunohistochemical study
|
Показатель |
Группа 1 (n = 10) |
Группа 2 (n = 16) |
Значение р |
|
Р 53 |
0,75 [ 0,06; 1,58 ] |
1 [ 0,25; 2 ] |
n.s. |
|
Ki 67 |
0,1 [ 0; 0,375 ] |
0 [ 0; 0 ] |
n.s. |
|
CD34 |
4,14 [ 3,2; 4,86 ] |
2 [ 2; 2,75 ] |
<0,01 |
|
VEGF |
2,71 [ 1,88; 3,58 ] |
1 [ 0,225; 2 ] |
<0,01 |
|
Сосуды фиброзного компонента стенки ЭКЯ |
0,36 [ 0,238; 0,488 ] |
0,4 [ 0,225; 0,5 ] |
n.s. |
|
Сосуды стромального компонента ЭКЯ |
0,3 [ 0,208; 0,379 ] |
0,1 [ 0,1; 0,2 ] |
<0,05 |
Примечание. Результаты представлены в %.
Note. Results presented in %.
В группе 1 по сравнению с группой 2 регистрировались более высокие значения экспрессии маркеров ангиогенеза VEGF и CD34 и более активный кровоток в стромальном компоненте ЭКЯ.
В ROC-анализ включены иммунологические показатели перитонеальной жидкости и результаты ИГХ капсулы, для которых получены статистически значимые различия между группами. Сосуды стромального компонента не включены в ROC-анализ, так как рассчитывались на основании оценки экспресcии маркера ангиогенеза CD34, включенного в анализ. По результатам ROC-анализа получено, что наибольшей AUC ROC обладает концентрация VEGF и IL-8 в перитонеальной жидкости и CD34 в капсуле ЭКЯ (табл. 5).
Таблица 5. ROC-анализ исследуемых иммунологических показателей перитонеальной жидкости и капсулы кисты
Table 5. ROC-analysis of the studied immunological parameters of the peritoneal fluid and cyst capsule
|
Название цитокина |
AUC ROC |
Se, % |
Sp, % |
Ac, % |
Пороговое значение |
|
Концентрация в перитонеальной жидкости |
|||||
|
IL-6 |
0,849 (0,740–0,959) |
100 |
67,7 |
78 |
58,124 |
|
VEGF |
0,875 (0,778–0,973) |
100 |
71 |
79,8 |
125,6 |
|
IL-1 |
0,809 (0,657–0,960) |
66,7 |
90,3 |
82,4 |
1,81 |
|
TNF-α |
0,832 (0,704–0,961) |
60 |
93,5 |
82,4 |
1,725 |
|
IL-8 |
0,953 (0,896–1,009) |
93,3 |
87,1 |
88,9 |
128,78 |
|
IL-17 |
0,723 (0,566–0,880) |
40 |
96,8 |
78,3 |
30,22 |
|
MCP 1 |
0,828 (0,707–0,949) |
80 |
74,2 |
76,1 |
411,1 |
|
Содержание в капсуле ЭКЯ |
|
||||
|
CD34 |
0,844 (0,683–1,000) |
90 |
75 |
80,8 |
2,5% |
|
VEGF |
0,787 (0,626–0,947) |
63,6 |
87 |
77,9 |
2,5% |
Примечание. Пороговое значение цитокина, пг/мл, если не указано иначе.
AUC ROC — площадь под ROC-кривой, cut-off — порог отсечения, Se — чувствительность, Sp — специфичность, Ac — точность.
Note. Cytokine threshold values pg/ml, unless otherwise indicated.
AUC ROC — area under receiver operating characteristic curve, cut-off — cut-off threshold, Se — sensitivity, Sp — specificity, Ac — accuracy.
Послеоперационная терапия
В послеоперационном периоде пациентки групп исследования получали гормональную терапию. Статистически значимых отличий по используемым схемам и частоте отказов от медикаментозной терапии между группами не установлено (табл. 6).
Таблица 6. Послеоперационная гормональная терапия
Table 6. Postoperative hormone therapy
|
Группы препаратов |
Группа 1 (n = 19) |
Группа 2 (n = 63) |
Значение р |
|
аГнРГ |
2 (11) |
12 (19) |
n.s. |
|
аГнРГ + диеногест |
3 (16) |
5 (8) |
n.s. |
|
Диеногест |
13 (68) |
42 (67) |
n.s. |
|
Отказ от гормональной терапии |
1 (5) |
4 (6) |
n.s. |
Примечание. n.s. — not significant, не значимо.
Note. n.s. — not significant.
Наиболее часто пациентки принимали диеногест — 67–68%, частота рецидивов на этой терапии составила 24%. Частота рецидива ЭКЯ у женщин, получавших аГнРГ, составила 14%, комбинированную терапию аГнРГ + диеногест — 38%. На фоне терапии самый ранний рецидив регистрировался у пациенток, принимавших диеногест, — через 3 месяца от начала лечения. По завершении курса наиболее ранний рецидив ЭКЯ диагностирован через 3 месяца у женщин, получавших комбинированную терапию и диеногест, у пациенток, использующих только аГнРГ, — через 18 месяцев. Среди пациенток, отказавшихся от терапии, частота рецидива составила 20%. Статистически значимых различий по частоте рецидивов в зависимости от проводимой терапии или ее отсутствия установлено не было.
ОБСУЖДЕНИЕ
Рецидив ЭКЯ — одна из нерешенных проблем в лечении эндометриоза. Выявление факторов риска развития этого осложнения может стать основанием для оптимизации подходов к послеоперационной медикаментозной терапии, что позволит снизить необходимость повторного хирургического лечения, сохранить овариальный резерв и улучшить показатели качества жизни.
Ранее исследователи выявили в качестве факторов риска рецидива ЭКЯ распространенность патологического процесса по классификации ASRM [12], уровень в крови СА-125 и хирургические вмешательства на органах малого таза в анамнезе [13], что было продемонстрировано и в нашей работе.
Согласно данным X.Y. Li и соавт., дисменорея и аденомиоз статистически значимо коррелируют с рецидивом ЭКЯ после хирургического лечения [14], однако в проведенном нами исследовании частота встречаемости дисменореи и аденомиоза не имела различий в группах сравнения, что не позволяет нам рассматривать указанные характеристики как факторы риска рецидива ЭКЯ. По данным Л.В. Адамян и соавт. [15], В. McKinnon и соавт. [16], выраженность болевых ощущений носит субъективный характер ввиду индивидуальных особенностей болевой чувствительности и имеет более «яркую окраску» при связи эндометриоидных имплантов с нервными волокнами, что при ЭКЯ случается редко. Это также свидетельствует о том, что дисменорея не может рассматриваться как возможный фактор риска рецидива ЭКЯ.
Согласно исследованию М.М. Zolbin и соавт., развитие эндометриоза ассоциировано с изменениями в экспрессии генов и уменьшением количества стволовых клеток адипоцитов, что способствует метаболическим изменениям и более низкому ИМТ у женщин с эндометриозом [17][18]. В собственном исследовании у пациенток, имеющих впоследствии рецидив ЭКЯ, также фиксировался более низкий ИМТ по сравнению с пациентками без рецидива заболевания, но статистически значимых различий установлено не было.
В нашей работе выявлено, что дополнительным фактором риска рецидива ЭКЯ может быть указание в анамнезе на хронические воспалительные процессы придатков, что, согласно исследованиям отечественных и зарубежных авторов, обусловлено общностью патогенетических механизмов развития этих двух процессов [19][20][21][22]. В нашей работе частота хронического сальпингоофорита была почти в два раза больше у пациенток в группе 1, различия с группой 2 были близки к статистически значимым.
Одним из возможных механизмов прогрессирования эндометриоидной болезни рассматривается иммунная дисфункция, проявляющаяся в нарушении соотношения про- и противовоспалительных цитокинов, увеличении концентрации факторов роста, зарегистрированных как в периферической крови [23], так и в перитонеальной жидкости [24][25][26][27][28]. Однако в доступной литературе не удалось найти исследований, отражающих взаимосвязь цитокинового профиля перитонеальной жидкости и риска развития рецидива ЭКЯ. Настоящее исследование продемонстрировало, что у пациенток, имеющих рецидив ЭКЯ, средние концентрации исследованных цитокинов значительно превышают аналогичные показатели в группе без рецидива заболевания, но наиболее высокими диагностическими характеристиками обладают фактор роста VEGF и хемокин IL-8, оказывающий проангиогенное действие. Так, значение первого 125,6 пг/мл и более и второго — 128,78 пг/мл и более прогнозирует рецидив ЭКЯ с точностью 79,8 и 88,9% соответственно.
По результатам ИГХ-исследования продемонстрировано, что наибольшую точность в прогнозе рецидива ЭКЯ имеет маркер ангиогенеза CD34. При его экспрессии 2,5% и более она составляет 80,8%.
Полученные данные совпадают с уже опубликованными исследованиями, согласно которым перитонеальная жидкость пациенток с эндометриозом обладает повышенной ангиогенной активностью, что играет ключевую роль в росте эндометриоидных клеток [26][28].
Учитывая повышение маркеров ангиогенеза в перитонеальной жидкости и в капсуле ЭКЯ, неоангиогенез может рассматриваться в качестве «мишени» при лечении эндометриоза, однако, учитывая, что ангиогенез — важное звено также и физиологических процессов, такой подход требует дальнейшего исследования.
В нашем исследовании общая частота рецидивов ЭКЯ за 30 мес. наблюдения составила 23%. Полученные данные совпадают с данными другого исследования, согласно которому частота рецидива ЭКЯ в течение 24 мес. наблюдения составляла 21,5% [14].
Существенных различий между частотой рецидивов в зависимости от проведения/непроведения гормональной терапии не установлено, что совпадает с исследованием X.Y. Li и соавт., в котором также не обнаружено значимой корреляции между частотой рецидива и проведением послеоперационной гормональной терапии [14].
Тем не менее сегодня большинство экспертов сходятся во мнении, что эндометриоз — это хроническое заболевание, требующее долговременной гормональной терапии, способной оказывать антипролиферативное и противовоспалительное действие в эндометриоидных очагах. Современные концепции лечения эндометриоза предполагают разработку индивидуального плана терапии с учетом определяющих факторов прогнозирования рецидива ЭКЯ, что позволит использовать все преимущества медикаментозной терапии и снизить необходимость повторного оперативного лечения.
К ограничениям настоящего исследования следует отнести ретроспективный дизайн, небольшое число пациенток с рецидивом, относительно небольшой период послеоперационного наблюдения. Необходимо проведение дальнейших проспективных исследований для установления факторов риска рецидива ЭКЯ.
ЗАКЛЮЧЕНИЕ
К возможным факторам риска рецидива ЭКЯ после оперативного лечения относятся более высокий уровень СА-125 до операции, малые формы на контрлатеральном яичнике при односторонних ЭКЯ, поражение брюшины малого таза, 3–4-я степень спаечного процесса, повышение VEGF в перитонеальной жидкости ≥125,6 пг/мл, IL-8 ≥128,78 пг/мл и экспрессия CD34 в капсуле ЭКЯ ≥2,5%, установленные во время операции.
ВКЛАД АВТОРОВ
Т.С. Качалина разработала основную концепцию исследования. М.Е. Богатова внесла вклад в разработку концепции исследования, провела анализ данных, подготовила текст статьи и согласилась взять на себя ответственность за все аспекты работы. С.С. Кузнецов участвовал в сборе и анализе данных. В.Ф. Лазукин провел статистическую обработку данных. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Tatyana S. Kachalina made the significant contribution to the concept of the study Marina E. Bogatova made the contribution to the concept of the article, analyzed the data, wrote the text and agreed to take responsibility for all aspects of the work. Sergey S. Kuznetsov participated in the collection and analysis of the data. Valeriy F. Lazukin made the statistical processing of the data. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is not conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Протасова А.Э, Вандеева Е.Н., Кузьмина Н.С. Эндометриоз — доброкачественное заболевание? Современные дискуссионные аспекты эндометриоз-ассоциированных опухолей яичника. Проблемы репродукции. 2016; 22(5): 98–109. https://doi.org/10.17116/repro201622598-109
2. Попова О. С. Клетки иммунной системы как биомаркеры в диагностике эндометриоза. Проблемы репродукции. 2019; 25(2): 8–15. https://doi.org/10.17116/repro2019250218
3. Fassbender A., Overbergh L., Verdrengh E., et al. How can macroscopically normal peritoneum contribute to the pathogenesis of endometriosis? Fertility and sterility. 2011; 96 (3): 697–9. https://doi.org/10.1016/j.fertnstert.2011.06.034 PMID: 21762896
4. Mita S., Aznaurova Y.B., Zhumataev M.B., et al. Molecular aspects of development and regulation of endometriosis. Reproductive Biology and Endocrinology. 2014; 12: 50–68. https://doi.org/10.1186/1477-7827-12-50 PMID: 24927773
5. Адамян Л. В., Андреева Е.Н. Роль современной гормонмодулирующей терапии в комплексном лечении генитального эндометриоза. Проблемы репродукции. 2011; 17(6): 66–77.
6. Ouchi N., Akira S., Mine K., et al. Recurrence of ovarian endometrioma after laparoscopic excision: risk factors and prevention. Journal of obstetrics and gynaecology research (Tokyo, Japan). 2014; 40(1): 230–6. https://doi.org/10.1111/jog.12164 PMID: 24102958
7. Давыдов А.И., Стрижакова М.А., Орлов О. Н. Клиническая оценка экспрессии лептина и интерлейкина-6 при эндометриозе яичников. Вопросы гинекологии, акушерства и перинатологии. 2005; 2(4): 44–9.
8. Дубровина С.О., Берлим Ю.Д., Красильникова Л.В. и др. Прогнозирование рецидива эндометриоидных кист яичника во время первичного оперативного вмешательства. Таврический медико-биологический вестник. 2018; 21(2): 26–30.
9. Пшеничнюк Е.Ю., Асатурова А.В., Адамян Л.В., Зайцев Н.В. Прогнозирование раннего рецидивирования эндометриоидных кист яичников после оперативного лечения: факторы риска и профилактики. Проблемы репродукции. 2018; 24(2): 97–107. https://doi.org/10.17116/repro201824297-107
10. Wickiewicz D., Chrobak A., Gmyrek G.B., et al. Diagnostic accuracy of interleukin-6 levels in peritoneal fluid for detection of endometriosis. Archives of Gynecology and Obstetrics. 2013; 288 (4): 805–14. https://doi.org/10.1007/s00404-013-2828-6 PMID: 23553197
11. Funamizu А., Fukui А., Kamoi М., et al. Expression of natural cytotoxicity receptors on peritoneal fluid natural killer cell and cytokine production by peritoneal fluid natural killer cell in women with endometriosis. American journal of reproductive immunology. 2014; 71(4): 359–67. https://doi.org/10.1111/aji.12206 PMID: 24495049
12. Tobiume Т., Kotani Y., Takaya H., et. al. Determinant factors of postoperative recurrence of endometriosis: difference between endometrioma and pain. European journal of obstetrics, gynecology and reproductive biology. 2016; 205: 54–9. https://doi.org/10.1016/j.ejogrb.2016.07.516
13. Guzel A.I., Topcu H.O., Ekilinc S., et al. Recurrence factors in women underwent laparoscopic surgery for endometrioma. Minerva Chir. 2014; 69(5): 277–82. PMID: 25267018
14. Li X.Y., Chao X.P., Leng J.N., et al. Risk factors for postoperative recurrence of ovarian endometriosis: long-term follow-up of 358 women. Journal of Ovarian Research. 2019; 12(1): 79. https://doi.org/10.1186/s13048-019-0552-y PMID: 31470880
15. Адамян Л.В., Сонова М.М., Арсланян К.Н. и др. Особенности хронической тазовой боли у пациенток с наружным генитальным эндометриозом. Лечащий врач. 2019; 9: 3–87. https://www.lvrach.ru/2019/09/15437391
16. McKinnon B., Bersinger N.A., Wotzkow C., Mueller M.D. Endometriosis-associated nerve fibers, peritoneal fluid cytokine concentrations, and pain in endometriotic lesions from different locations. Fertility and sterility. 2012; 97 (2): 373–380. https://doi.org/10.1016/j.fertnstert.2011.11.011 PMID: 22154765
17. Zolbin М.М., Mamillapalli R., Nematian S.E., et al. Adipocyte alterations in endometriosis: reduced numbers of stem cells and microRNA induced alterations in adipocyte metabolic gene expression. Reproductive biology and endocrinology: RB&E. 2019; 17(6): 36. https://doi.org/10.1186/s12958-019-0480-0
18. Holdsworth-Carson S.J., Rogers P.A.W. The complex relationship between body mass index and endometriosis. Journal of endometriosis and pelvic pain disorders. 2018; 10(4): 187–9. https://doi.org/10.1177/2284026518810586
19. Бебнева Т. Н., Дамирова К.Ф. Воспалительные заболевания органов малого таза. Гинекология. 2019; 5: 39–44.
20. Lin J., Gu Y. Effect of monocyte chemoattractant protein-1 and estradiol on the secretion of vascular endothelial growth factor in endometrial stromal cells in vitro. Fertility and sterility. 2005; 84(6): 1793–6. https://doi.org/10.1016/j.fertnstert.2005.03.090
21. Smith S. K. Regulation of angiogenesis in the endometrium. Trends Endocrinology and Metabolism. 2001; 12(4): 147–51. https://doi.org/10.1016/s1043-2760(01)00379-4 PMID: 11295569
22. Pittatore G., Moggio A., Benedetto C., et al. Endometrial adult/ progenitor stem cells: pathogenetic theory and new antiangiogenic approach for endometriosis therapy. Reprod Sci. 2014; 21(3): 296–304. https://doi.org/10.1177/1933719113503405 PMID: 24037753
23. Павлов Р. В., Кундохова М.С. Иммунологические критерии раннего прогнозирования рецидивов наружного генитального эндометриоза. Медицинский вестник Северного Кавказа. 2011; 1: 39–43.
24. Маркарьян И.В., Ермолова Н.В., Линде В.А. и др. Маркеры пролиферации и апоптоза при наружном генитальном эндометриозе. Таврический медико-биологический вестник. 2015; 18(1): 145–9.
25. Пыдра А.Р., Павлов Р.В., Аксененко В.А. Кундохова М.С. Особенности иммунной дисфункции при рецидивировании наружного генитального эндометриоза. Медицинский вестник Северного Кавказа. 2011; 4: 55–8.
26. Кондратьева П.Г., Соколов Д.И., Колобов А.В. Участие факторов ангиогенеза в развитии наружного генитального эндометриоза. Журнал акушерства и женских болезней. 2007; 56(3): 70–4.
27. Чантурия Т. З. Роль иммунологических факторов при развитии различных форм эндометриоза. Актуальные проблемы медицины и биологии. 2018; 3: 25–30.
28. Сазонова Н. Г., Салмина А.Б., Макаренко Т.А. Неоангиогенез в развитии эндометриоза (обзор литературы). Проблемы репродукции. 2017; 23 (3): 12–8. https://doi.org/10.17116/repro201723312-18
Об авторах
Т. С. КачалинаРоссия
Качалина Татьяна Симоновна, д-р мед. наук, профессор кафедры акушерства и гинекологии
пл. Минина и Пожарского, д. 10/1, Нижний Новгород, 603005
М. Е. Богатова
Россия
Богатова Марина Евгеньевна, врач — акушер-гинеколог
ул. Тропинина, д. 13-б, г. Нижний Новгород, 603137
+7 (905) 010-03-79
С. С. Кузнецов
Россия
Кузнецов Сергей Станиславович, д-р мед. наук, доцент, заведующий патолого-анатомическим отделением
ул. Родионова, д. 190, Нижний Новгород, 603126
В. Ф. Лазукин
Россия
Лазукин Валерий Федорович, канд. биол. наук, доцент кафедры медицинской физики и информатики
пл. Минина и Пожарского, д. 10/1, Нижний Новгород, 603005







































