Перейти к:
Лигирование геморроидальных артерий с и без применения ультразвуковой Допплернавигации в лечении геморроидальной болезни: одноцентровое рандомизированное исследование
https://doi.org/10.47093/2218-7332.2021.274.01
Аннотация
Цель исследования. Сравнительная оценка эффективности применения новой методики хирургического лечения геморроидальной болезни (ГБ) - лигирования геморроидальных артерий (ГА) с предварительным пальпаторным определением их локализации и дополненной мукопексией геморроидальных узлов (ГУ) - по сравнению с HAL-RAR-технологией.
Материалы и методы. В рандомизированное контролируемое клиническое исследование включены пациенты >18 лет с симптоматической ГБ II и III степени по Golligher. Группу исследования (п = 75) оперировали при помощи пальпаторного определения локализации ГА и дополняли мукопексией. В контрольной группе (п = 75) использовали HAL-RAR. Первичная конечная точка (25-30-й дни после операции): частота рецидива симптомов ГБ. Вторичные конечные точки: частота осложнений в послеоперационном периоде, интенсивность боли по визуально-аналоговой шкале от 1 до 10 баллов, удовлетворенность пациентов результатами лечения по 10-балльной шкале.
Результаты. По исходным характеристикам (возраст, пол, индекс массы тела, стадия ГБ, частота клинических симптомов) группы не различались. Рецидив анальных кровотечений в группе исследования развился у 11%, в группе контроля - у 14% пациентов, рецидив пролапса ГУ - у 3 и 5% пациентов соответственно (р > 0,05). Послеоперационные осложнения отмечены у 6 (8%) в группе исследования и 4 (5%) в группе контроля (р > 0,05). Интенсивность боли на 2-е и 25-30-е сутки после операции составила соответственно 6,3 [4,8; 7,4] и 1,2 [0,6; 2,5] балла в группе исследования и 6,5 [4,9; 7,3] и 2,1 [1,9; 4,1] - в группе контроля (р > 0,05). Удовлетворенность пациентов результатами лечения через 12 мес. оценена в 8,7 [7,9; 9,2] и 9,4 [8,2; 9,6] в группах исследования и контроля соответственно (р > 0,05).
Заключение. Лигирование ГА с предварительным пальпаторным определением их локализации и дополненной мукопексией ГУ имеет сходные с HAL-RAR показатели эффективности лечения в отношении устранения геморроидальных кровотечений и пролапса узлов.
Ключевые слова
Список сокращений:
- ГА – геморроидальные артерии
- ГБ – геморроидальная болезнь
- ГУ – геморроидальные узлы
- УЗДН – ультразвуковая Допплер-навигация
- HAL – haemorrhoidal artery ligation (лигирование геморроидальных артерий)
- RAR – recto anal repair (трансанальная мукопексия пролабирующей ткани внутренних геморроидальных узлов)
До 10% пациентов с геморроидальной болезнью (ГБ) подвергаются хирургическому лечению. Одной из наиболее популярных методик лечения ГБ II–III стадий является лигирование геморроидальных артерий (ГА) и трансанальная мукопексия пролабирующей ткани внутренних геморроидальных узлов (ГУ) – комбинированная HAL-RAR-технология (HAL – haemorrhoidal artery ligation, RAR – recto anal repair) [1][2]. Первоначально для ликвидации ГУ развивали мукопексию. С целью поиска и лигирования ГА – дезартеризации ГУ в ходе HAL – K. Morinaga и соавт. [3] предложили использовать ультразвуковую Допплер-навигацию (УЗДН). После неоднократного подтверждения эффективности и безопасности изолированной процедуры HAL [4, 5], P.P. Dal Monte и соавт. [6], а затем J.L. Faucheron и соавт. [7] комбинировали дезартеризацию ГУ с их мукопексией (HAL-RAR).
Изучение опыта применения HAL-RAR подтвердило ее высокую эффективность при лечении пациентов с любой стадией ГБ. В настоящее время проводятся исследования по оценке эффективности и безопасности HAL-RAR в сравнении с другими методами лечения [8–11]. Высокая популярность этой методики объясняется минимальной интенсивностью болевого синдрома и возможностью вернуться к привычной жизни на следующий день после операции.
Лигирование ГА считают ключевым патогенетическим аспектом лечения ГБ, эта методика распространяется повсеместно, в том числе в медицинских организациях без специального оборудования. Потому актуальной задачей является оценка эффективности проведения вмешательства без УЗДН. В настоящий момент большинство исследований направлено на сравнение эффективности различных подходов в лечении ГБ, при этом существует небольшое количество работ, оценивающих эффективность лигирования ГА без применения УЗДН, например с мукопексией, которая, в отличие от HAL, не требует применения высокотехнологичного оборудования и позволяет добиться результатов, сопоставимых с радикальной геморроидэктомией [12].
Цель исследования: сравнительная оценка эффективности применения новой методики хирургического лечения ГБ – лигирования ГА с предварительным пальпаторным определением их локализации и дополненной мукопексией ГУ – по сравнению с HAL-RAR-технологией.
МАТЕРИАЛЫ И МЕТОДЫ
В работе представлены результаты моноцентрового рандомизированного контролируемого клинического исследования, проведенного в Клинике колопроктологии и малоинвазивной хирургии Института клинической медицины им. Н.В. Склифосовского (Университетской клинической больницы № 2) Клинического центра ФГАОУ ВО «Первый Московский государственный медицинский университет им И.М. Сеченова» Минздрава России (Сеченовский университет) с 01.11.2017 по 31.01.2020.
Исследование одобрено локальным Комитетом по этике (протокол № 10–19 от 17.10.2017), зарегистрировано на ClinicalTrials.gov (NCT04119401), опубликован протокол исследования [13].
В исследование включали пациентов 18 лет и старше мужского и женского пола. Критерии включения: симптоматический геморрой II и III степени по Golligher; отсутствие другого источника анального кровотечения, кроме геморроя (по данным тотальной колоноскопии); подписание добровольного информированного согласия на участие в исследовании. Критерии исключения: беременность; хроническая анальная трещина с выраженным спазмом сфинктера; наличие аноректальных свищей; любая предыдущая операция по удалению геморроя (включая мини-инвазивные процедуры); любая стадия колоректального рака; прием пероральных антикоагулянтов при врожденных нарушениях свертывающей системы.
Исходно для участия оценен 171 пациент. Включение пациентов в исследование происходило в поликлиническом отделении после подписания добровольного информированного согласия на участие в исследовании при соответствии критериям включения (рис.).
Итоговая величина выборки – 150 пациентов – рассчитана с учетом экспертных оценок. С целью проведения исследования предварительно был создан рандомизационный лист всех испытуемых с использованием онлайн-сервиса Research Randomizer (Version 4.0) [Computer software] (Urbaniak G.C., Plous S., 2013)1. Рандомизация – случайное назначение (присвоение) – происходила в поликлинике в день операции. О ее результатах оперирующий хирург узнавал только после начала анестезии, уже в операционной.
Группу исследования (n = 75) оперировали без применения УЗДН с предварительным пальпаторным определением локализации ГА и дополняли мукопексией. В контрольной группе (n = 75) использовали HAL-RAR.
Подготовку прямой кишки перед операцией не проводили. Операции в обеих группах выполняли под эпидуральной анестезией. Контроль послеоперационной боли обеспечивали назначением нестероидных противовоспалительных препаратов на срок не менее 5 дней.
В группе исследования пульсацию ГА определяли пальпаторно в области аноректального соединения, затем их лигировали и проводили мукопексию ГУ. В контрольной группе операцию HAL-RAR выполняли комплектными ректоскопами «Ангиодин-Прокто» (АО НПФ «БИОСС», Россия) и THD (THD S.P.A, Италия). Швы накладывали в соответствии со следующими принципами: первый z-образный шов на артерию («якорный») накладывали над аноректальным переходом в точке максимально отчетливой пульсации сосуда с захватом мышечного слоя кишки, далее – для осуществления мукопексии – в дистальном направлении формировали непрерывный обвивной шов с шагом 5 мм, завершающийся на расстоянии 8–12 мм проксимальнее зубчатой линии. Узел затягивали по направлению «снаружи-внутрь» от последнего шва, фиксирующего слизистую, к первому «якорному». Мукопексию в группе исследования выполняли по Farag [12], а в контрольной – по стандартной технике в соответствии с конструктивными особенностями ректоскопа [2].
В обеих группах при наличии соответствующих показаний проводились дополнительные вмешательства: удаление перианальной бахромки, единичного наружного ГУ, полипа анального канала, иссечение хронической анальной трещины, протекающей без спазма сфинктера.
В качестве первичной конечной точки исследования в сроки 25–30 дней после операции оценивали частоту рецидива любого из начальных симптомов или появления любого нового симптома ГБ: анальное кровотечение во время дефекации и/или выпадение ГУ. Клинический осмотр и регистрацию результатов лечения проводил хирург, не принимавший участия в операции. Кроме этого, учитывали продолжительность операции, количество лигированных ГА и мукопексий, дополнительных манипуляций, продолжительность стационарного лечения.
Вторичными показателями исходов служили: общая частота осложнений в послеоперационном периоде; субъективная оценка пациентом интенсивности боли (временные рамки: 2-е сутки и 25–30-й дни), которую измеряли в баллах, с использованием визуально-аналоговой шкалы в диапазоне от 1 до 10, где 1 – «нет боли», а 10 – «самая сильная боль, которую можно себе представить»; удовлетворенность пациента результатами лечения по 10-балльной шкале (при этом 10 баллов отражает самую высокую, а 1 балл – самую низкую удовлетворенность) через 12 и 18 мес. Дополнительно через 18 мес. оценивались симптомы рецидива. В сроки в среднем более 18 месяцев утрачена связь с 26 пациентами в группе исследования и 23 – в группе контроля (рис.).
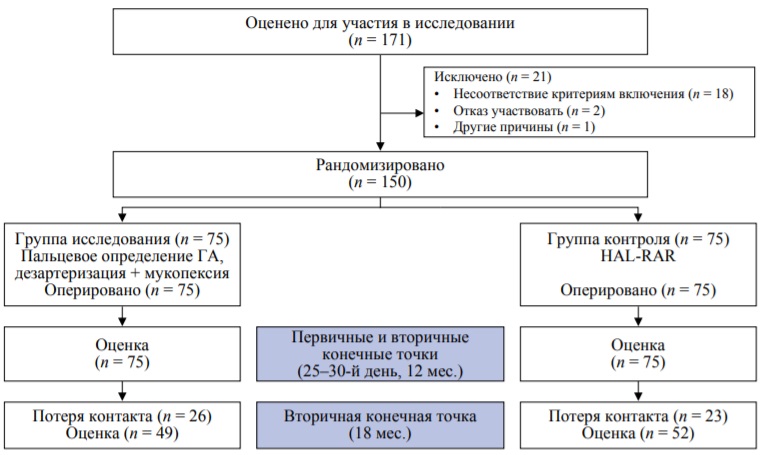
РИС. Потоковая диаграмма включения пациентов в исследование
FIG. Flowchart of patient inclusion in the study
Статистический анализ
Для проверки нормальности распределения данных использовали критерии Шапиро – Уилка и Колмогорова – Смирнова. Количественные показатели, соответствующие нормальному распределению, представлены в виде среднего значения и стандартного отклонения, не соответствующие – в виде медианы и интерквартильного размаха (25–75-й процентили). Сравнение количественных данных проводилось с помощью непарного критерия Стьюдента, критерия Манна – Уитни. Категориальные переменные представлены как абсолютные значения и доли, выраженные в процентах; для их сравнения применялся точный тест Фишера, критерий хи-квадрат Пирсона. Статистически значимыми считали различия при p < 0,05.
Статистический анализ выполнен с использованием программы IBM SPSS v.23.0 (SPSS: An IBM Company, США).
РЕЗУЛЬТАТЫ
Демографические и клинические характеристики оперированных пациентов представлены в таблице 1. Различий в возрасте больных, гендерном составе, ИМТ пациентов не было.
Распределение по стадиям (II или III) ГБ статистически значимо не отличалось между группами, 60–63% имели III стадию заболевания. В обеих группах при первичном обращении жалобы на выпадение ГУ и выделение крови при дефекации предъявляли 60–88% пациентов, у большинства пациентов было сочетание нескольких симптомов ГБ.
Рецидив анальных кровотечений и выпадения ГУ в группе исследования составил 11%, в группе контроля – 14%, рецидив пролапса – 3 и 5% соответственно, разница между группами статистически не значима.
Средняя продолжительность выполнения хирургических вмешательств в группах исследования и контроля статистически значимо не отличалась. У половины пациентов в обеих группах во время оперативного вмешательства лигировали 3 ГА, у 15–21% – 2 и у 11–12% – 4 ГА. Различий по количеству лигированных ГА между группами не установлено (табл. 2).
Количество выполненных мукопексий статистически не различалось между группами. Количество и частота выполнения дополнительных процедур резекционного характера значимо не отличались (табл. 2).
Таблица 1. Демографические и клинические характеристики пациентов в группах исследования и контроля
Table 1. Demographic and clinical characteristics of study and control groups
|
Характеристика / Feature |
Группа исследования / Study group (n = 75) |
Группа контроля / Control group (n = 75) |
Значение p / p value |
|
Возраст, лет / Age, years |
40,1 ± 9,8 |
43,1 ± 12,4 |
n.s. |
|
Mужчины / men, n (%) |
40 (53%) |
43 (57%) |
n.s. |
|
ИМТ, кг/м2 / BMI, kg/m2 |
24,3 ± 4,1 |
25,5 ± 4,8 |
n.s. |
|
ГБ III стадии / HD III stage, n (%) |
47 (63%) |
45 (60%) |
n.s. |
|
Жалобы / symptoms, n (%) |
|||
|
анальные кровотечения / anal bleeding |
45 (60%) |
55 (73%) |
n.s. |
|
выпадение ГУ / prolapse of haemorrhoids |
66 (88%) |
56 (75%) |
n.s. |
|
боль / pain |
21 (28%) |
23 (31%) |
n.s. |
Note: BMI – body mass index; HD – haemorrhoidal disease.
Таблица 2. Оценка эффективности лечения: первичные и вторичные точки
Table 2. Evaluation of the effectiveness of treatment: primary and secondary outcomes
|
Критерии оценки / Evaluation criteria |
Группа исследования / Study group (n = 75) |
Группа контроля / Control group (n = 75) |
Значение p / p value |
|
Первичная точка (25–30-й дни) / Primary outcome (25–30 days) |
|||
|
рецидив анальных кровотечений / anal bleeding recurrence, n (%) |
5 (11%) (n = 45) |
8 (14%) (n = 55) |
n.s. |
|
рецидив выпадения ГУ / haemorrhoid prolapse recurrence, n (%) |
2 (3%) (n = 66) |
3 (5%) (n = 56) |
n.s. |
|
Дополнительная оценка (0–14 дней) / Additional evaluation (0–14 days) |
|||
|
Продолжительность операции, мин. / Duration of operation, min |
28,7 ± 7,7 |
31,3 ± 8,9 |
0,056 |
|
Количество лигированных ГА / Number of bandaged HA |
|||
|
1 |
2 (3%) |
2 (3%) |
n.s. |
|
2 |
16 (21%) |
11 (14%) |
n.s. |
|
3 |
40 (54%) |
45 (60%) |
n.s. |
|
4 |
13 (17%) |
8 (11%) |
n.s. |
|
5 |
3 (4%) |
5 (7%) |
n.s. |
|
6 |
1 (1%) |
4 (5%) |
n.s. |
|
Количество мукопексий / Number of mucopexia |
|||
|
1 |
1 (1%) |
– |
n.s. |
|
2 |
2 (3%) |
3 (4%) |
n.s. |
|
3 |
17 (23%) |
18 (24%) |
n.s. |
|
4 |
39 (52%) |
41 (55%) |
n.s. |
|
5 |
11 (14%) |
8 (10%) |
n.s. |
|
6 |
5 (7%) |
5 (7%) |
n.s. |
|
Дополнительные манипуляции / Additional manipulations |
40 (53%) |
35 (47%) |
n.s. |
|
Продолжительность стационарного лечения, дни / Duration of hospital stay, days |
3,4 [ 2,6; 4,4] |
2,5 [ 2,1; 3,2] |
n.s. |
|
Вторичные точки / Secondary outcome |
|||
|
Послеоперационные осложнения / Postoperative complications, n (%) |
6 (8%) |
4 (5%) |
n.s. |
|
Интенсивность боли по адаптированной шкале 10-балльной шкале Ликерта, баллы / Pain intensity according to the adapted 10-point Likert scale, points |
|||
|
2-е сутки после операции / 2 days after the operation |
6,3 [ 4,8; 7,4] |
6,5 [ 4,9; 7,3 ] |
n.s. |
|
25–30-е сутки после операции / 25–30 days after the operation |
1,2 [ 0,6; 2,5] |
2,1 [ 1,9; 4,1 ] |
n.s. |
|
Удовлетворенность пациентом результатами лечения по 10-балльной шкале, баллы / Patient satisfaction with treatment results on a 10-point scale, points |
|||
|
через 12 мес. / after 12 months |
8,7 [ 7,9; 9,2] |
9,4 [ 8,2; 9,6] |
n.s. |
|
через 18 мес. / after 18 months |
8,8 [ 7,2; 9,1] (n = 49) |
8,9 [ 7,0; 9,2] (n = 52) |
n.s. |
|
Дополнительная оценка (18 мес.) / Additional assessment (18 months) |
|||
|
Эпизодические ректальные кровотечения после дефекации / |
5 (10%) (n = 49) |
8 (15%) (n = 52) |
n.s. |
|
Эпизодическое выпадение ГУ / Episodic prolapse of haemorrhoids, n (%) |
8 (16%) (n = 49) |
7 (13%) (n = 52) |
n.s. |
Note: HA – haemorrhoidal arteries; n.s. – not significant.
Послеоперационные осложнения развивались у небольшой части пациентов. В группе исследования послеоперационное кровотечение зарегистрировано у 1 и в группе контроля – у 2 пациентов. Все эпизоды были связаны с прорезыванием швов на лигированных ГУ и были купированы повторным выполнением лигирования ГА под эпидуральной анестезией в условиях операционной. Прочие наблюдения (3 и 5 пациентов в группе исследования и в группе контроля соответственно) незначительных эпизодических выделений крови были связаны с нарушением диеты и купировались самостоятельно в течение раннего послеоперационного периода при соблюдении рекомендаций по диете и медикаментозному лечению. В группе исследования отмечены 4 эпизода тромбоза лигированных ГУ, в контрольной – 2. В одном наблюдении в контрольной группе потребовалось выполнение тромбэктомии, ревизии анального канала со снятием швов с лигированного ГУ. В других наблюдениях симптомы были купированы назначением симптоматического медикаментозного лечения. В одном случае в группе исследования развился острый парапроктит с последующим формированием интерсфинктерного свища в раннем послеоперационном периоде. Продолжительность стационарного лечения в группах исследования и контроля не различалась и не превышала 3–4 суток.
Первая дефекация у большинства пациентов обеих групп наблюдалась на 2-е сутки после операции и сопровождалась максимальным уровнем боли по визуально-аналоговой шкале за весь период наблюдения. В последующие дни интенсивность боли значительно уменьшалась, и к 25–30-м суткам более 93% пациентов в обеих группах не испытывали этот симптом. В сроки позже 6 мес. боль, непосредственно связанную с выполненным хирургическим лечением, не отмечал ни один из респондентов.
Субъективная удовлетворенность пациентов результатами лечения через 12 и 18 мес. в группах не отличалась.
Дополнительная оценка, проведенная через
18 мес., показала сохранение периодически возникающего выделения крови у 10–15% и эпизодическое выпадение узлов у 13–16% пациентов, разница между группами не значима.
Выполненное хирургическое лечение не стало окончательным в связи с рецидивом симптомов ГБ у 6 пациентов. Открытая геморроидэктомия выполнена в группе исследования 2 (3%) пациентам, в контрольной – 4 (5%), разница не значима.
ОБСУЖДЕНИЕ
Сравнение эффективности двух вариантов дезартеризации ГУ в отношении устранения геморроидальных кровотечений и пролапса узлов свидетельствует об отсутствии преимуществ инструментальной методики над пальцевой, несмотря на точное определение локализации ГА именно с помощью УЗДН.
Структура и частота послеоперационных осложнений в сроки до 30 дней после операции в обеих группах больных свидетельствуют о безопасности методики мануальной дезартеризации ГА, сопоставимой с таковой при использовании классического варианта HAL-RAR с УЗДН.
Роль изолированного лигирования ГА с их предварительной идентификацией УЗДН недостаточно известна, за исключением работ J.P. Schuurman и соавт. [14][15], в которых были проанализированы результаты рандомизированного клинического исследования по сравнению эффективности HAL-RAR и мукопексии. Предпочтение автор отдал мукопексии, основываясь на том, что в области аноректального соединения могут отсутствовать крупные дистальные ветви верхней прямокишечной артерии, которые способен обнаружить ультразвуковой датчик, из-за наличия разветвленной сети обильно анастомозирующих между собой мелких терминальных ветвей этой артерии.
Кроме того, ход терминальных ветвей ГА почти никогда не имеет строго вертикальной ориентации, а располагается под углом к оси анального канала [15]. В такой ситуации фиксация лигатуры непосредственно под или над ультразвуковым датчиком (в зависимости от конструкции аноскопа с УЗДН) может не обеспечить перевязку сосуда.
Для того чтобы добиться существенного снижения кровотока, необходимо накладывать больше лигатур и перевязывать все обнаруживаемые датчиком сосуды. Некоторые авторы [16] убеждены, что необходимо лигировать от 6 до 8 ГА (минимум 6), причем некоторые исследователи [17] подчеркивают необходимость лигирования до 16 найденных артерий (от 4 до 16, в среднем – 9). Однако даже в этом случае рецидив в течение 5 лет после операции возможен в 35,6% [18].
Следует ли лигировать все, даже самые мелкие терминальные ветви ГА (с трудом выявляемые с использованием УЗДН), если часть пациентов все равно вернется к врачу с клинической картиной рецидива ГБ? По нашему мнению, в большинстве наблюдений пульсация ГА отчетливо определяется пальцем хирурга в тех же точках, в которых они выявляются ультразвуковым датчиком. Хотя исследования, посвященные выполнению изолированной мукопексии, косвенно свидетельствуют об отсутствии необходимости прецизионного лигирования ГА [14][19][20], в случае выявления пульсации ГА при пальцевом исследовании, по нашему мнению, их все-таки следует перевязывать перед выполнением мукопексии.
Лигирование ГА объясняется необходимостью воздействовать не только на дистрофический фактор развития ГБ (пролапс ГУ), но и на сосудистый (избыточное наполнение кровью геморроидальных сплетений). Кроме того, уменьшая к ним приток крови, можно минимизировать риск развития тромбоза лигированных ГУ, что является вероятным осложнением и мукопексии, и HAL-RAR.
Отсутствие необходимости лигирования как минимум 6 ГА, даже если они не обнаружены ультразвуковым датчиком в типичных точках, как того требует современный протокол HAL-RAR [16], подтверждается результатами лечения в сравниваемых группах нашего исследования. Так, жалобы на продолжающееся выделение крови после дефекации в контрольной группе через 18 мес. после операции встречались несколько чаще и были отмечены у 15% респондентов, а в группе исследования – у 10%, но разница статистически не значима. Кроме того, если хирург не смог обнаружить достаточного числа пульсирующих ГА и лигировать их, риск рецидива геморроидальных кровотечений не повышается при условии адекватного выполнения мукопексии.
Отсутствие разницы между средним количеством выполненных мукопексий и лигированных ГА в группах исследования и контроля объясняется тем фактом, что в большинстве наблюдений как ультразвуковой датчик, так и палец хирурга могут обнаружить от 1 до 6 ГА (чаще всего – 3), в то время как количество пролабирующих ГУ, как правило, остается стандартным (3 ГУ в типичных точках). Кроме того, хирург вынужден выполнять мукопексию незначительно пролабирующих ГУ в случае, если они расположены на одной оси с лигированной ГА.
Вероятно, эффективность устранения симптомов ГБ может зависеть от того, насколько хирург был сосредоточен на качественном и полном выполнении мукопексии, а не на идентифицированных и лигированных ГА. Отсутствие при этом стандартных для выполнения HAL-RAR ректоскопов может облегчить объективную оценку локализации, состояния, а также степени пролапса ГУ, поскольку сам ректоскоп, введенный в анальный канал, способствует снижению кровенаполнения ГУ, смещает их в краниальном направлении, что искажает в глазах хирурга истинную стадию ГБ. Оставаясь сосредоточенным на сигналах, получаемых при УЗДН, хирург старается лигировать все выявленные датчиком артерии, пренебрегая зачастую качественным и полным выполнением мукопексии там, где это действительно необходимо.
Приобретение достаточного опыта при освоении методики HAL-RAR, обеспеченной УЗДН, позволяющей стандартизировать оперативный подход, позволяет хирургу со временем расширить свои возможности на этапе дезартеризации ГУ за счет опоры лишь на свое зрение и тактильные ощущения, а не на сложный дорогостоящий одноразовый инструмент. Однако S.R.Q. Naqvi и соавт. не дополняли такой вариант лигирования ГА мукопексией [21]. Об эффективности операции свидетельствовали низкая частота рецидива кровотечений (2,06%) и стойкого пролапса (4,12%). В группе, состоящей из 70 пациентов, S.M. Hussain и соавт. лигирование ГА под визуальным контролем дополняли мукопексией, рецидив пролапса был зарегистрирован лишь в 1,42% [22]. Однако сроки наблюдения за больными в обоих сообщениях были ограничены лишь 6 мес. Эти факты свидетельствуют в пользу необходимости увеличения количества специальных исследований в больших группах больных с длительными сроками их наблюдения.
Полученные результаты косвенно свидетельствуют о достаточной эффективности и безопасности перевязки ГА только в проекции клинически значимых геморроидальных сплетений, без необходимости рутинного лигирования всех выявляемых при УЗДН артериальных стволов.
К ограничениям исследования следует отнести максимальный срок наблюдения – 18 мес. после операции и утрату контактов с 49 (23%) пациентами на этом сроке.
ЗАКЛЮЧЕНИЕ
Новая методика хирургического лечения ГБ – лигирование ГА с предварительным пальпаторным определением их локализации и дополненной мукопексией ГУ – имеет сходные с HAL-RAR показатели эффективности лечения в отношении устранения геморроидальных кровотечений и пролапса узлов при оценке через 30 дней и 18 мес. Спектр и частота послеоперационных осложнений, интенсивность боли и удовлетворенность пациентов результатами лечения в группах новой методики и HAL-RAR не отличаются.
ВКЛАД АВТОРОВ
П.В. Царьков является автором и первым исполнителем оригинального метода дезартеризации геморроидальных артерий, главным разработчиком концепции статьи. М.А. Поповцев провел сбор и статистический анализ данных, изучил литературные источники. Ю.С. Медкова провела сбор и статистический анализ данных. А.В. Алекберзаде участвовал в разработке концепции статьи, провел интерпретацию полученных данных. Н.Н. Крылов провел анализ полученных данных и данных литературы, подготовил окончательный вариант текста статьи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Petr V. Tsarkov is the author and the first performer of the original method of desarterization of haemorrhoidal arteries, the main developer of the concept of the article. Maxim A. Popovtsev conducted the collection and statistical analysis of the data, studied the literature sources. Yulia. S. Medkova conducted data collection and statistical analysis. Aftandil V. Alekberzade participated in the development of the concept of the publication and interpreted the data obtained. Nikolay N. Krylov analyzed the data obtained and literature data and prepared the final version of the published text. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interest.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Forrest N.P., Mullerat J., E-vans C., Middleton S.B. Doppler-guided haemorrhoidal artery ligation with recto anal repair: a new technique for the treatment of symptomatic haemorrhoids. Int J Colorectal Dis. 2010; 25(10): 1251-1256. https://doi.org/10.1007/s00384-010-0951-4. PMID: 20411266
2. Ratto C. THD Doppler procedure for hemorrhoids: the surgical technique. Tech Coloproctol. 2014; 18(3): 291-298. https://doi.org/10.1007/s10151-013-1062-3. PMID: 24026315
3. MorinagaK., HasudaK., Ikeda T. A novel therapy for internal hemorrhoids: ligation of the hemorrhoidal artery with a newly devised instrument (moricorn) in conjunction with a Doppler flowmeter. Am J Gastroenterol. 1995; 90(4): 610-613. PMID: 7717320
4. Ramwez J.M., Aguilella V., EUa M., et al. Doppler-guided hemorrhoidal artery ligation in the management of symptomatic hemorrhoids. Rev Esp Enferm Dig. 2005; 97(2): 97-103. https://doi.org/10.4321/s1130-01082005000200004. PMID: 15801885
5. Faucheron J.L., Gangner Y. Doppler-guided hemorrhoidal artery ligation for the treatment of symptomatic hemorrhoids: early and three-year follow-up results in 100 consecutive patients. Dis Colon Rectum. 2008; 51(6): 945-949. https://doi.org/10.1007/s10350-008-9201-z. PMID: 18219528
6. Dal Monte P.P., Tagariello C., Sarago M., et al. Transanal haemorrhoidal dearterialisation: nonexcisional surgery for the treatment of haemorrhoidal disease. Tech Coloproctol. 2007; 11(4): 333-338; discussion 338-339. https://doi.org/10.1007/s10151-007-0376-4. PMID: 18060529
7. Faucheron J.L., Poncet G., Voirin D., et al. Doppler-guided hemorrhoidal artery ligation and rectoanal repair (HAL-RAR) for the treatment of grade IV hemorrhoids: long-term results in 100 consecutive patients. Dis Colon Rectum. 2011; 54(2): 226-231. https://doi.org/10.1007/DCR.0b013e318201d31c. PMID: 21228673
8. Xu L., Chen H., Lin G., et al. Transanal hemorrhoidal dear-terialization with mucopexy versus open hemorrhoidectomy in the treatment of hemorrhoids: a meta-analysis of randomized control trials. Tech Coloproctol. 2016; 20(12): 825-833. https://doi.org/10.1007/s10151-016-1551-2. PMID: 27888438
9. Trenti L., Biondo S., Galvez A., et al. Distal Doppler-guided transanal hemorrhoidal dearterialization with mucopexy versus conventional hemorrhoidectomy for grade III and IV hemorrhoids: postoperative morbidity and long-term outcomes. Tech Coloproctol. 2017; 21(5): 337-344. https://doi.org/10.1007/s10151-017-1620-1. PMID: 28451767
10. Popov V., Yonkov A., Arabadzhieva E., et al. Doppler-guided transanal hemorrhoidal dearterilization versus conventional hemorrhoidectomy for treatment of hemorrhoids - early and long-term postoperative results. BMC Surg. 2019; 19(1): 4. https://doi.org/10.1186/s12893-019-0469-9. PMID: 30630463
11. Consalvo V, D’Auria F., Salsano V. Transanal hemorrhoidal dearterialization with Doppler arterial identification versus classic hemorrhoidectomy: a retrospective analysis of 270 patients. Ann Coloproctol. 2019; 35(3): 118-122. https://doi.org/10.3393/ ac.2017.09.04. PMID: 31142105
12. Farag A.E. Pile suture: a new technique for the treatment of haemorrhoids. Br J Surg. 1978; 65(4): 293-295. https://doi.org/10.m02/bjs.1800650422. PMID: 346141
13. Markaryan D., Tulina I., Garmanova T., et al. Hemorrhoidal artery ligation with Doppler guidance vs digital guidance for grade II-III hemorrhoidal disease treatment: study protocol clinical trial (SPIRIT compliant). Medicine (Baltimore). 2020; 99(15): e19424. https://doi.org/10.1097/MD.0000000000019424. PMID: 32282696
14. Schuurman J.P., Borel Rinkes I.H., Go P.M. Hemorrhoidal artery ligation procedure with or without Doppler transducer in grade II and III hemorrhoidal disease: a blinded randomized clinical trial. Ann Surg. 2012; 255(5): 840-845. https://doi.org/10.1097/SLA.0b013e31824e2bb5. PMID: 22504188
15. Schuurman J.P., Go PM. Anal duplex fails to show changes in vascular anatomy after the haemorrhoidal artery ligation procedure. Colorectal Dis. 2012; 14(6): e330-e334. https://doi.org/10.1111/j.1463-1318.2012.02931.x.
16. Infantino A., Bellomo R., Dal Monte P.P., et al. Transanal haem-orrhoidal artery echodoppler ligation and anopexy (THD) is effective for II and III degree haemorrhoids: a prospective multicentric study. Colorectal Dis. 2010; 12(8): 804-809. https://doi.org/10.1111/j.1463-1318.2009.01915.x. PMID: 19508513
17. Theodoropoulos G.E., Sevrisarianos N., Papaconstantinou J., et al. Doppler-guided haemorrhoidal artery ligation, rectoanal repair, sutured haemorrhoidopexy and minimal mucocutaneous excision for grades III-IV haemorrhoids: a multicenter prospective study of safety and efficacy. Colorectal Dis. 2010; 12(2): 125-134. https://doi.org/10.1111/j.1463-1318.2008.01739.x. PMID: 19055522
18. Ferrandis C., De Faucal D., Fabreguette J.M., Borie F. Efficacy of Doppler-guided hemorrhoidal artery ligation with mucopexy, in the short and long terms for patients with hemorrhoidal disease. Tech Coloproctol. 2020; 24(2): 165-171. https://doi.org/10.1007/s10151-019-02136-1. PMID: 31919601
19. Voiculescu S., Voiculescu E.G., Scauna^u R., Balalau C. Supradentate transmucosal hemorrhoidopexy (original technical variant). Chirurgia (Bucur). 2016; 111(5): 445-449. https://doi.org/10.21614/chirurgia.111.5.445. PMID: 27819645
20. Omar A.A., Rageh T.M., Elmanakhly M.A. Ligation anopexy in the treatment of hemorrhoids. Menoufia Med J. 2018; 31(1): 193-198.
21. Qamar Naqvi S.R., Qamar Naqvi S.S., Rashid M.M., et al. Haemorrhoidal artery ligation operation without Doppler guidance. J Ayub Med Coll Abbottabad. 2018; 30(Suppl 1) (4): S664-S667. PMID: 30838827
22. Hussain S.M., Azim M.T., Saleem M.M., et al. Experience with haemorrhoidal artery ligation under direct vision at a tertiary care hospital: a case series. J Pak Med Assoc. 2020; 70(6): 1089-1093. https://doi.org/10.5455/JPMA.300504. PMID: 32810115
Об авторах
П. В. ЦарьковRussian Federation
Царьков Петр Владимирович - доктор медицинских наук, профессор, директор Клиники колопроктологии и малоинвазивной хирургии Университетской клинической больницы N° 2; заведующий кафедрой хирургии Первый МГМУ им. И.М. Сеченова.
Ул. Трубецкая, д. 8, стр. 2, Москва, 119991
М. А. Поповцев
Russian Federation
Поповцев Максим Александрович - соискатель кафедры хирургии.
Ул. Трубецкая, д. 8, стр. 2, Москва, 119991, Тел.: +7 (926) 197-36-43
Ю. С. Медкова
Russian Federation
Медкова Юлия Сергеевна - кандидат медицинских наук, ассистент кафедры хирургии.
Ул. Трубецкая, д. 8, стр. 2, Москва, 119991
А. В. Алекберзаде
Russian Federation
Алекберзаде Афтандил Вагиф оглы - доктор медицинских наук, профессор кафедры хирургии.
Ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Н. Н. Крылов
Russian Federation
Крылов Николай Николаевич - доктор медицинских наук, профессор кафедры гуманитарных наук.
Ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Рецензия
JATS XML







































