Перейти к:
Концентрация химических элементов в сыворотке и кариозное поражение зубов у детей после проведенной противоопухолевой терапии
https://doi.org/10.47093/2218-7332.2022.13.4.45-55
Аннотация
Цель. Изучить концентрацию микро- и макроэлементов в сыворотке крови и корреляционные связи между ними у детей и подростков после противоопухолевой терапии (ПОТ) в зависимости от наличия или отсутствия кариеса.
Материалы и методы. В исследование вошли 98 пациентов в возрасте от 4 до 17 лет, находившихся в ремиссии после ПОТ, проведенной по поводу острого лейкоза или лимфом. Пациенты, имевшие кариозное поражение зубов, вошли в группу 1 (n = 34), пациенты без кариеса составили группу 2 (n = 64). Расчет содержания эссенциальных, условно эссенциальных и токсических элементов сыворотки крови проводился с помощью масс-спектрометрии с индуктивно-связанной плазмой. Произведен расчет медианы и интерквартильного размаха, для сравнения групп применен U-критерий Манна – Уитни, для тандемов элементов вычислен коэффициент ранговой корреляции Кендалла (τ).
Результаты. В обеих группах концентрации изученных элементов находились в пределах референсных значений. В группе 1 по сравнению с группой 2 отмечены более высокие концентрации калия, мышьяка, йода и бора и более низкие лития и вольфрама (p < 0,05). Между группами не выявлено различий по концентрации фосфора, кальция, магния, марганца, золота, серебра, платины, алюминия, бериллия, висмута, кадмия, кобальта, хрома, меди, железа, ртути, лития, молибдена, никеля, рубидия, сурьмы, олова, ванадия, цинка, циркония и таллия. Значимые коэффициенты корреляции в обеих группах получены для тандема железо/марганец (τ = 0,24, p < 0,05). Разные значения τ установлены для тандемов никель/марганец, кобальт/железо, марганец/фосфор, бериллий/литий: τ = 0,342 и τ = 0,14; τ = 0,363 и τ = 0,033; τ = –0,111 и τ = –0,326; τ = –0,365 и τ = 0,42 соответственно для групп 1 и 2.
Заключение. У пациентов в ремиссии после противоопухолевой терапии выявлена ассоциация кариеса с повышением (в пределах референсных значений) концентрации эссенциальных (калий, йод) и условно эссенциальных элементов (мышьяк, бор), снижением концентрации лития и вольфрама; изменением соотношения никель/марганец, кобальт/железо, марганец/фосфор и направления корреляционной связи в тандеме бериллий/литий.
Ключевые слова
Список сокращений:
Ag – серебро
Al – алюминий
As – мышьяк
Au – золото
B – бор
Ba – барий
Be – бериллий
Bi – висмут
Ca – кальций
Cd – кадмий
Co – кобальт
Cr – хром
Cu – медь
F – фтор
Fe – железо
Hg – ртуть
I – йод
K – калий
Li – литий
Mg – магний
Mn – марганец
Mo – молибден
Ni – никель
P – фосфор
Pb – свинец
Pt – платина
Rb – рубидий
Sb – сурьма
Se – селен
Sn – олово
Sr – стронций
Tl – таллий
V – ванадий
W – вольфрам
Zn – цинк
Zr – цирконий
ЗНО – злокачественное новообразование
ИСП-МС – масс-спектрометрия с индуктивно связанной плазмой
ПОТ – противоопухолевая терапия
На сегодня базисная терапия по поводу большинства злокачественных новообразований (ЗНО) предусматривает применение химиопрепаратов в комбинации с лучевой терапией. При этом именно чувствительность опухоли к противоопухолевой терапии (ПОТ) определяет перечень используемых цитостатиков в протоколах полихимиотерапии, а также назначение или отсутствие радиологических методов лечения. К сожалению, цитотоксический механизм характеризуется ограниченной селективностью, в связи с чем токсическое воздействие химиопрепаратов и облучения приводит к формированию сходных поздних эффектов ПОТ, в том числе и на твердых тканях зубов [1].
Одним из проявлений нарушений метаболического гомеостаза является нарушение содержания химических элементов – дисэлементоз. Многие макро-, микро- и ультрамикроэлементы в организме человека выполняют биорегуляторные функции, такие как защита клеток от окислительного стресса, участие в синтезе и структурной стабилизации белков, короткоцепочечных пептидов и всех видов нуклеиновых кислот [2].
Ранее было установлено, что поражение органов ротовой полости у пациентов с ЗНО после завершения ПОТ формируется вследствие токсического воздействия химиопрепаратов и терапевтического ионизирующего излучения на ткани зуба и слизистую оболочку. Особенности патогенеза поражения твердых тканей зуба во многом обусловлены его композитным составом [3]. Так, твердые ткани зуба (дентин, эмаль и цемент) имеют в составе как неорганическую (гидроксиапатит), так и органическую матрицу [4]. Химический состав эмали зуба, помимо органических веществ (3%) и воды (2%), состоит в основном из неорганических соединений (95%): кальция (Ca) и фосфора (P) в виде кристаллов гидроксиапатита и гидроксифторапатита (75%), карбонатапатита (19%), хлорапатита (4,4%), фторапатита (0,66%) [5]. Однако их содержание может колебаться в зависимости от проявления типовых патологических процессов в зубной полости [6]. При этом химические элементы содержатся не только в неорганическом каркасе эмали, они также входят в состав металлопротеинов, регулируя на ферментном уровне процессы минерализации и деминерализации тканей зуба [7].
Известно, что цемент зуба представлен плотной минерализованной тканью, где определяющей структурой являются минерализированные коллагеновые волокна, синтезируемые цементобластами и фибробластами. Их топографический вариант определяет фиксационную и репаративную функциональность зубов, участвует в формировании гомфоза зубов [8]. Выделяют наиболее минерализованный перитубулярный дентин, содержащий незначительное количество органических веществ, и межтрубчатый дентин, минерализация которого выражена в меньшей степени. Соотношение неорганических компонентов в нем вариабельно как по морфологическим особенностям, так и по возрастным и половым признакам, что демонстрируют исследования от 2016–2017 гг. [9][10].
Многие элементы присутствуют в небольших количествах в эмали и дентине зубов человека. Хотя они необходимы в незначительных количествах, их отсутствие может нарушить здоровое развитие эмали и дентина и привести к дефектам развития зубов, а также формированию кариозного процесса. Кроме того, к поражению зубных тканей может привести и экзогенное потребление некоторых микроэлементов, их неправильный метаболизм, например при ЗНО [11]. Такая вариабельность даже на уровне физиологической нормы подразумевает, что в случае патологии разброс содержания элементного компонента может увеличиваться, что было продемонстрировано в нашей ранее опубликованной работе [12].
Существует ряд микроэлементов, способствующих развитию кариеса зубов: цинк (Zn), селен (Se), свинец (Pb), кадмий (Cd), медь (Cu), магний (Mg). Изменение содержания этих токсических и эссенциальных химических элементов, а также концентрации кариес-статических элементов (литий (Li), фтор (F), ванадий (V), стронций (Sr), молибден (Mo)), отмечено в слюне, тканях зуба, сыворотке пациентов [13]. Развитие кариозного процесса сопровождается повышением содержания в слюне марганца (Mn) и железа (Fe). В литературе имеются данные, свидетельствующие о возможном участии этих элементов в метаболизме микроорганизмов, вовлеченных в кариозный процесс [14].
Гомеостаз химических элементов является активной динамической системой и активно изучается у пациентов с различными гистологическими вариантами ЗНО. Постоянное совершенствование методов диагностики обуславливает появление новых сведений о нарушениях элементного гомеостаза у больных ЗНО. Так, дисэлементоз диагностируется у пациенток с разными стадиями рака молочной железы [15 – препринт][16]. Результаты проспективного исследования N. Ahmadi и соавт. [17] демонстрируют значительное снижение уровня Zn и Fe у пациенток с раком молочной железы после трех курсов химиотерапии адриамицином и цитоксаном. На основании полученных данных предполагается, что профилактическое назначение добавок цинка может быть полезно пациентам для снижения побочных эффектов ПОТ [17], однако следует принимать во внимание отмеченную выше способность Zn способствовать кариозному поражению.
Для острого лимфобластного лейкоза, миелолейкоза характерно не только различие по прогнозу и лечению, но и существенная разница в уровнях содержания Se [18]. У пациентов с лейкозом до начала терапии в сыворотке отмечается избыточное содержание Cu, Zn, Se [19]. После окончания ПОТ в эмали удаленных зубов у пациентов с лейкозом выявлено повышение массового содержания Mg, Zn, Cl, измененное соотношение Ca и P. В участках с аномальной эмалью у пациентов после химиотерапии концентрация Ca и P была ниже нормы [20]. Однако некоторые исследования отмечают, что, к примеру, в придатках кожи корреляционная связь между содержанием химических элементов и наличием ЗНО у пациентов не прослеживается [21], что оставляет тему дискуссионной.
Рассматривая химические элементы как мишени для диагностики, лечения и профилактики поздних токсических эффектов ПОТ, применяя методы биоэлементологии, мы можем разработать подходы к сопроводительной терапии у пациентов с ЗНО [22][23].
Целью нашей работы явилось изучение концентрации микро- и макроэлементов в сыворотке крови и корреляционных связей между ними у детей и подростков после завершения ПОТ в зависимости от наличия или отсутствия кариеса.
МАТЕРИАЛЫ И МЕТОДЫ
Для участия в представленном одномоментно мретроспективном исследовании сформирована когорта из числа пациентов, госпитализированных в реабилитационный научный центр «Русское поле» в 2017–2019 гг. Возраст детей и подростков, включенных в исследование, варьировал от 4,2 до 17,6 года, медиана 11,4 года. Продолжительность ремиссии ЗНО составляла от 2,6 до 8,0 года, в среднем 3,9 ± 1,1 года. Критерии включения: наличие ремиссии острого лейкоза и лимфомы (коды заболеваний по МКБ-10: С81–84; С91, С92, С96); заключение детского стоматолога с оценкой состояния здоровья полости рта.
Исследование спланировано и согласовано в соответствии с рекомендациями экспертного совета и Комитета по этике НМИЦ ДГОИ им. Дмитрия Рогачева. Информированное согласие пациентов младше 14 лет подписано родителями или сопровождающими лицами, а подростки старше 14 лет сами оформляли согласие на участие в исследовании.
Критериями исключения являлось тяжелое соматическое или психологическое состояние пациента, препятствующее проведению исследования, и отсутствие подписанного пациентами либо их представителями информированного согласия.
Лечение гемобластозов осуществлялось по протоколам BFM-ALL, BFM-NHL, MВ-2008, MB-2015, DAL-HD-90. Перечень используемых цитостатиков в этих протоколах практически совпадает. В исследование включены 98 пациентов: 47 девочек и 51 мальчик. У 34 пациентов был диагностирован кариес различной степени тяжести (группа 1); группа сравнения (группа 2) сформирована из 64 пациентов без поражения твердых тканей зубов. Группы не различались по продолжительности ремиссии, она составила 3,7 ± 0,9 и 4,1 ± 0,3 года соответственно.
Для оценки концентрации химических элементов эссенциальной и токсической групп посредством масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) на приборе Nexion 300D («Perkin Elmer Inc.», США) была использована сыворотка пациентов. Работа проведена в соответствии с методическими указаниями от 2003 г. для определения химических элементов в биологических средах посредством ИСПМС1 . Тестировалось содержание в сыворотке макроэлементов: P, калия (K), Mg, Ca и микроэлементов: золота (Au), алюминия (Al), мышьяка (As), бора (B), бериллия (Be), висмута (Bi), Cd, кобальта (Co), хрома (Cr), Cu, Fe, ртути (Hg), йода (I), Li, Mn, Mo, никеля (Ni), Pb, платины (Pt), рубидия (Rb), сурьмы (Sb), Se, олова (Sn), Sr, серебра (Ag), V, вольфрама (W), бария (Ba), Zn, циркония (Zr), таллия (Tl).
Забор крови из локтевой вены производили утром натощак с использованием пробирок «Vacutest» («Vacutest KIMA», Италия) с активатором свертывания. Сыворотку отделяли и хранили в аликвотах, замороженных при температуре –40 °С. В качестве референсных величин для сыворотки использовались данные, полученные у здоровых пациентов АНО «Центр биотической медицины» методом ИСП-МС [24].
Статистическая обработка данных
Расчеты элементного статуса пациентов обеих групп и сравнение групп осуществляли с использованием среды программной разработки Jupyter Notebook на языке Python 3.9. Базисом для реализации алгоритма стали библиотеки с открытым исходным кодом: Pandas, Pingouin, NumPy. Ссылка на репозиторий: https://github.com/coldrex2/elements_carious_tumor.git
Нормальность распределения оценивали с использованием критерия Шапиро – Уилка. Статистическую значимость межгрупповых различий оценивали с использованием непараметрического U-критерия Манна – Уитни для данных, характеризующихся отличным от нормального распределения. Также производился расчет медианы, интерквартильного размаха (ИКР, 25-й; 75-й процентили) и коэффициента ранговой корреляции Кендалла. Результаты проведенных статистических тестов считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В сыворотке крови (табл. 1) элементный дисбаланс выражался в изменении концентрации эссенциальных (K и I) и условно эссенциальных металлов (As, B и Li). Для пациентов с кариесом по отношению к пациентам с отсутствием кариозного поражения статистически значимо повышалась концентрация K, As, I, B (p < 0,05). В то же время Li, наоборот, был повышен в группе пациентов без кариеса. Также в группе токсических элементов зафиксировано статистически значимое снижение концентрации W в группе пациентов с кариесом. При этом концентрации всех макро- и микроэлементов в обеих группах пациентов не выходили из референсных значений.
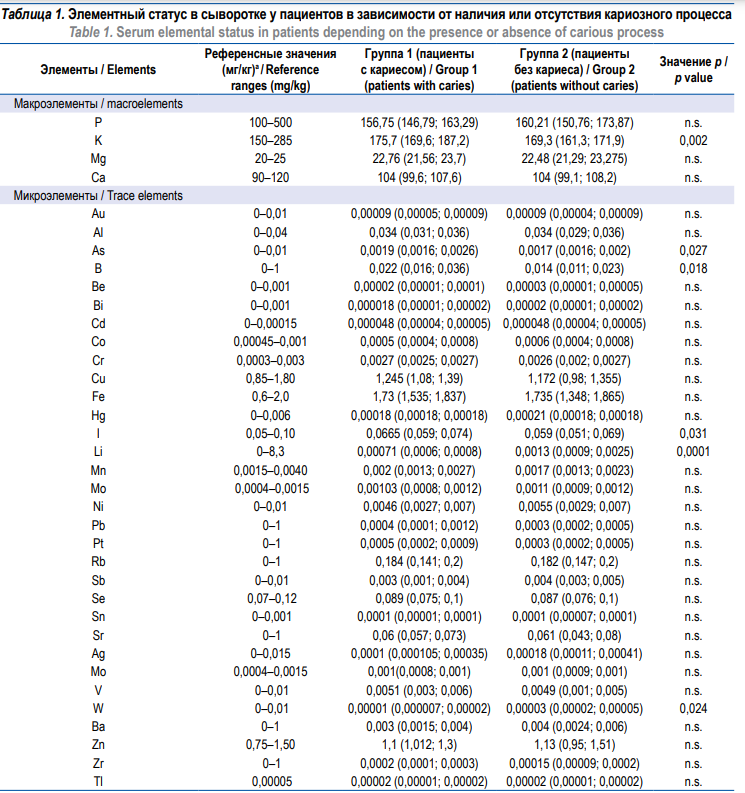
Примечание: данные представлены как медиана и интерквартильный размах; n.s. – not significant, не значимо; а в качестве референсных
значений использованы данные из [24].
Note: data are presented as median and interquartile range; n.s. – not significant; а data from [24] were used as reference values.
Помимо детекции уровней отдельных элементов мы измерили и рассчитали соотношение разных микро- и макроэлементов, которые показали наивысший коэффициент корреляции. Тандемы элементов, демонстрирующие наибольший коэффициент корреляции, представлены в таблице 2. Результаты показывают, что изменение корреляции некоторых тандемов нарушается в зависимости от наличия кариеса: коэффициенты корреляции статистически значимо изменяются в паре элементов Ni/Mn, Co/Fe, Mn/P, также меняется направление корреляционной связи в тандеме Be/Li.
ОБСУЖДЕНИЕ
Нормальное протекание физиологических процессов в полости рта зависит не только от местных, но и от общих факторов: функционирование эндокринной системы, иммунитета, регуляция сосудистого тонуса и микроциркуляции, состояние ферментативных и транспортных систем.
Для поддержания гомеостаза минерального состава зубов биохимические процессы в полости рта должны находиться в химическом равновесии, что при проведении ПОТ может нарушаться. Дисбаланс химических элементов в организме неблагоприятно воздействует на структурно-функциональное состояние тканей полости рта, повышает риск развития поражений твердых тканей зубов и зубочелюстных аномалий. Изменение ионного состава ротовой жидкости, омывающей зуб, приводит к изменению проницаемости эмали, а также к диспропорции процессов де- и реминерализации, следовательно, снижает кариесрезистентность.
В нашей ранее опубликованной работе у детей и подростков после ПОТ не было обнаружено в сыворотке изменений уровня K, I, As, уровни B были снижены, W не был исследован, а концентрация Li была снижена и не отличалась от результатов настоящего исследования [23].
В представленном исследовании W снижался, а As, B, K, I повышались в пределах референсных значений в группе пациентов с подтвержденным кариозным поражением зубной ткани, в связи с этим можно сделать вывод, что эти элементы так или иначе ассоциированы с развитием кариеса и их повышение в сыворотке не следует объяснять действием цитостатиков в рамках долгосрочных последствий ПОТ.
Полученные нами низкие уровни Li вполне согласуются с литературными данными, что этот элемент обладает кариес-статическими свойствами [25], поскольку он был статистически значимо снижен (хотя и оставался в пределах референсных значений) в группе пациентов с кариесом, что, по всей видимости, может быть связано с поздними эффектами ПОТ. Что касается W, в литературе его концентрации в сыворотке и возможные ассоциации с кариозным поражением не описаны.
Помимо этого, основополагающим фактором развития кариеса считается соотношение Ca/P [26], которое и опосредует процессы деминерализации и резорбции матрикса зубной ткани [27]. В нашем исследовании статистически значимых изменений концентрации Ca и P не зафиксировано, впрочем, как и других химических элементов, важных для гистологической композиции эмали и дентина, предположительно принимающих участие в процессах образования кариеса: Mg, Cd, Cl, Zn, Se.
Однако нами было выявлено изменение других пар элементов, соотношение которых изменяется после ПОТ у пациентов с кариесом: Ni/Mn, Co/Fe, Be/Li, Mn/P, в этих тандемах присутствуют элементы, влияние которых на патогенез кариеса является неоспоримым: с доказанными кариес-статическими свойствами, как Li и P, либо же сомнительным, но требующим большего внимания: Mn, Fe, Ni, Co [28]. Кроме того, соотношение элементов может являться более точным коррелятом того или иного заболевания, чем их отдельные концентрации.
Это может стать направлением для дальнейших исследований, рассматривающих элементный статус в фокусе ПОТ и ее побочных эффектов, поскольку функциональный синергизм или антагонизм разных элементов может быть изменен в зависимости от их концентрации. Также интересным представляется дальнейшее изучение элементного статуса в других биосубстратах, например в волосах или ногтях, потому что это может помочь оценить более отсроченные изменения минерального обмена. Стоит в дальнейшем рассмотреть особенности профилактики дисэлементозов в рамках сопроводительной терапии при лечении детей с гемобластозами, чтобы предотвратить прогрессию кариозного процесса полости рта.
Наше исследование имеет ограничения ввиду небольшой численности изученной когорты, мы не учитывали половые различия в общей выборке пациентов, сегрегирование по возрасту и продолжительности ремиссии. Помимо этого, пациенты имели разные сроки завершения ПОТ, что также затрудняет интерпретацию полученных данных. В рамках исследования не был проанализирован элементный состав сыворотки у пациентов непосредственно до проведения ПОТ, что должно быть учтено в последующих исследованиях.
ЗАКЛЮЧЕНИЕ
Оценка содержания химических элементов в сыворотке крови у детей, получавших терапию по поводу ЗНО и находившихся в ремиссии, выявила ассоциацию между кариозным поражением зубной ткани с повышением концентрации некоторых эссенциальных (K, I), условно эссенциальных элементов (As, B), снижением концентрации Li и W, а также изменением соотношения прочих, влияющих на процесс развития кариеса элементов (Ni/Mn, Co/Fe, Mn/P), и направления корреляционной связи в тандеме Be/Li. Таким образом, токсическое воздействие ПОТ, возможно, оказывает потенциальное негативное воздействие на ткани полости рта вследствие индуцированного дисэлементоза. Необходимы дальнейшие исследования для определения связи между ПОТ и развитием дисэлементоза с целью определения целесообразности лечебных и профилактических мер.
ВКЛАД АВТОРОВ
Е.В. Жуковская, А.В. Скальный внесли основной вклад в разработку концепции и дизайна исследования, руководили процессом написания, редактирования и статистической обработки статьи. Ю.А. Обухов выполнил сбор клинических данных. С.А. Савко, Ю.А. Обухов, А.Ф. Карелин, А.П. Гончаров, Ю.В. Жернов внесли равнозначный вклад в поиск литературных источников, написание и редактирование текста, статистическую обработку. Все авторы одобрили окончательный вариант статьи и готовы взять на себя ответственность за все аспекты представленной публикации.
AUTHOR CONTRIBUTIONS
Elena V. Zhukovskaya, Anatoly V. Skalny made the main contribution to the development of the concept and design of the study, led the process of writing, editing and statistical processing of the article. Yury A. Obukhov was responsible for the clinical part of the research. Sergey A. Savko, Yury A. Obukhov, Aleksandr F. Karelin, Anton P. Goncharov, Yury V. Zhernov made an equal contribution to the search for literary sources, writing and editing the text, statistical processing. All authors approved the final version of the article and are ready to take responsibility for all aspects of the submitted publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрией с индуктивно связанной плазмой: Методические указания. М.: Федеральный центр госсанэпиднадзора Минздрава России, 2003. 56 с. ISBN 5-7508-0462-3.
Список литературы
1. Florea A.M., Büsselberg D. Cisplatin as an anti-tumor drug: cellular mechanisms of activity, drug resistance and induced side effects. Cancers (Basel). 2011; 3(1): 1351–1371. https://doi.org/10.3390/CANCERS3011351. PMID: 24212665.
2. Feng J.F., Lu L., Zeng P., et al. Serum total oxidant/antioxidant status and trace element levels in breast cancer patients. Int J Clin Oncol. 2012; 17(6): 575–583. https://doi.org/10.1007/S10147-011-0327-Y. PMID: 21968912.
3. Wilmers J., Bargmann S. Nature’s design solutions in dental enamel: Uniting high strength and extreme damage resistance. Acta Biomater. 2020; 107: 1–24. https://doi.org/10.1016/J.ACTBIO.2020.02.019. PMID: 32087326.
4. Habelitz S., Marshall S.J., Marshall G.W., Balooch M. Mechanical properties of human dental enamel on the nanometre scale. Arch Oral Biol. 2001; 46(2): 173–183. https://doi.org/10.1016/S0003-9969(00)00089-3. PMID: 11163325.
5. Ахмедбейли Р.М. Современные данные о минеральном составе, структуре и свойствах твердых зубных тканей. Биомедицина (Баку). 2016; 2: 22–27. https://doi.org/10.24412/ FE4PDDYLZZW
6. Михейкина Н.И. Особенности строения интактной зубной эмали у лиц с различным уровнем устойчивости к кариесу. Здравоохранение Югры: опыт и инновации. 2016; 3(8): 13–17. EDN: WMWMJR
7. Бурак Ж.М., Сукало А.В., Терехова Т.Н. Воздействие свинцовой интоксикации на человека и животных, влияние на развитие и функции зубочелюстной системы. Медицинский журнал. 2005; 4: 10–13.
8. Yamamoto T., Hasegawa T., Yamamoto T., et al. Histology of human cementum: Its structure, function, and development. Jpn Dent Sci Rev. 2016; 52(3): 63–74. https://doi.org/10.1016/J.JDSR.2016.04.002. PMID: 28408958.
9. Fischer A., Wiechuła D. Age-dependent changes in Pb concentration in human teeth. Biol Trace Elem Res. 2016; 173(1): 47–54. https://doi.org/10.1007/S12011-016-0643-1. PMID: 26888348.
10. Asaduzzaman K., Khandaker M.U., Binti Baharudin N.A., et al. Heavy metals in human teeth dentine: A bio-indicator of metals exposure and environmental pollution. Chemosphere. 2017; 176: 221–230. https://doi.org/10.1016/J.CHEMOSPHERE.2017.02.114. PMID: 28273529.
11. Shaik I., Dasari B., Shaik A., et al. Functional role of inorganic trace elements on enamel and dentin formation: A review. J Pharm Bioallied Sci. 2021; 13 (Suppl 2): S952–S956. https://doi.org/10.4103%2Fjpbs.jpbs_392_21. PMID: 35017905.
12. Zhukovskaya E.V., Obuchov Y., Gor A., Karelin A. Changes in the composition of electrolytes in the saliva of children and adolescents after the end of anticancer therapy. Trace Elements and Electrolytes. Abstract of Meeting of the Russian Society for Trace Elements in Medicine (RUSTEM). 2021; 38(3): 160. E-pub: May 7, 2021. https://doi.org/10.5414/TEX01685
13. Pathak M.U., Shetty V., Kalra D. Trace elements and oral health: A systematic review. J Adv Oral Res. 2016; 7: 12–20. https://doi.org/10.1177/2229411220160203
14. Poletto A.C., Singi P., Barri R.M., et al. Relationship of levels of trace elements in saliva and dental caries in preschool children using total reflection X-ray fluorescence technique (TXRF)⋆. J Trace Elem Med Biol. 2021; 63: 126663. https://doi.org/10.1016/j.jtemb.2020.126663. PMID: 33069944.
15. Cabré N., Luciano-Mateo F., Arenas M., et al. Trace element concentrations in breast cancer patients. Breast. 2018; 42: 142–149. https://doi.org/10.1016/J.BREAST.2018.09.005. PMID: 30296647.
16. Ding X., Jiang M., Jing H., et al. Analysis of serum levels of 15 trace elements in breast cancer patients in Shandong, China. Environ Sci Pollut Res Int. 2015; 22: 7930–7935. https://doi.org/10.1007/S11356-014-3970-9. PMID: 25520207.
17. Ahmadi N., Mahjoub S., Hosseini R.H., et al. Alterations in serum levels of trace element in patients with breast cancer before and after chemotherapy. Caspian J Intern Med. 2018; 9(2): 134–139. https://doi.org/10.22088/CJIM.9.2.134. PMID: 29732030.
18. Modaressi A., Hadjibabaie M., Shamshiri A.R., et al. Trace elements (Se, Zn, and Cu) levels in patients with newly diagnosed acute leukemia. Int J Hematol Oncol Stem Cell Res. 2015; 6(4): 5–10.
19. Kurdoglu Z., Kurdoglu M., Demir H., Sahin H.G. Serum trace elements and heavy metals in polycystic ovary syndrome. Hum Exp Toxicol. 2012; 31(5): 452–456. https://doi.org/10.1177/0960327111424299. PMID: 22027497.
20. Krasuska-Sławińska E., Dembowska-Bagińska B., Brożyna A., et al. Changes in the chemical composition of mineralised teeth in children after antineoplastic treatment. Contemp Oncol. 2018; 22(1): 37–41. https://doi.org/10.5114/WO.2018.74392. PMID: 29692662.
21. Huynh P.T., Dinh B.T., Nguyen L.T.T., et al. Investigation of the effects of chemotherapy on trace element contents in the nails in patients with colorectal cancer. J Radioanal Nucl Chem. 2021; 328: 1173–1180. https://doi.org/10.1007/s10967-021-07734-8
22. Sousa C., Moutinho C., Vinha A.F., Matos C. Trace minerals in human health: Iron, zinc, copper, manganese and fluorine. IJSRM. Human. 2019; 13(3): 57–80.
23. Жуковская Е.В., Нор А.А., Карелин А.Ф. Параметры гомеостаза химических элементов в биологических образцах пациентов, завершивших терапию по поводу злокачественных новообразований. Микроэлементы в медицине. 2021; 22(2): 43–49. https://doi.org/10.19112/2413-6174-2021-22-5-43-49. EDN: WCZEEP
24. Иванов С.И., Подунова Л.Г., Скачков В.Б. и др. Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрии с индуктивно связанной плазмой: Методические указания. Минздрав России, 2003. 56 с. ISBN 5-7508-0462-3.
25. Doğan M.S. Relation of trace elements on dental health. Trace Elements-Human Health and Environment. 2018; 71. https://dx.doi.org/10.5772/intechopen.75899
26. Кисельникова Л.П., Алексеева И.А., Данилова И.Г. и др. Изучение особенностей фосфорнокальциевого обмена в патогенезе кариеса у детей подросткового возраста. Российский Медицинский Журнал. 2014; 20(2): 27–30. EDN: SCFEBT
27. Обухов Ю.А. Локальные и системные процессы, влияющие на развитие кариеса у детей (обзор литературы). Педиатрический вестник Южного Урала. 2015; 2: 63–66. EDN: VDOYXJ
28. Shaik P.S., Pachava S. The role of vitamins and trace elements on oral health: a systematic review. Int J Med Rev. 2017; 4(1): 22–31. https://doi.org/10.29252/ijmr-040105
Об авторах
Е. В. ЖуковскаяРоссия
Жуковская Елена Вячеславовна, д-р мед. наук, профессор, заведующая отделом изучения поздних эффектов противоопухолевой терапии лечебно-реабилитационного научного центра «Русское поле»
ул. Саморы Машела, д. 1, г. Москва, 117198
Тел.: +7 (915) 414-51-45
С. А. Савко
Россия
Савко Сергей Алексеевич, студент
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ю. А. Обухов
Россия
Обухов Юрий Алексеевич, врач-стоматолог лечебно-реабилитационного научного центра «Русское поле»
ул. Саморы Машела, д. 1, г. Москва, 117198
А. Ф. Карелин
Россия
Карелин Александр Федорович, канд. мед. наук, главный врач лечебно-реабилитационного научного центра «Русское поле»
ул. Саморы Машела, д. 1, г. Москва, 117198
А. П. Гончаров
Россия
Гончаров Антон Павлович, студент
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ю. В. Жернов
Россия
Жернов Юрий Владимирович, д-р мед. наук, профессор Института общественного здоровья им. Ф.Ф. Эрисмана; химического факультета; Центра медицинской антропологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ленинские горы, д. 1, г. Москва, 119991
Ленинский проспект, д. 32а, г. Москва, 119334
А. В. Скальный
Россия
Скальный Анатолий Викторович, д-р мед. наук, профессор, директор Центра биоэлементологии и экологии человека; зав. кафедрой медицинской элементологии Медицинского института
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
ул. Миклухо-Маклая, д. 6, г. Москва, 117198
Дополнительные файлы

|
1. STROBE чек-лист | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(156KB)
|
Метаданные ▾ | |







































