Перейти к:
Сравнительный анализ цитолитического потенциала вируса везикулярного стоматита серотипов Indiana и New Jersey в отношении опухолевых клеточных линий
https://doi.org/10.47093/2218-7332.2023.946.14
Аннотация
Цель. Провести сравнительный анализ эффективности лизиса раковых клеток и кинетику накопления двумя серотипами вируса везикулярного стоматита Indiana (VSV-IND) и New Jersey (VSV-NJ) на клеточных линиях меланомы мыши B16F10, гепатоцеллюлярной карциномы человека HepG2 и аденокарциномы молочной железы человека MCF7.
Материалы и методы. Была оценена жизнеспособность клеточных линий меланомы мыши B16F10, гепатоцеллюлярной карциномы человека HepG2 и аденокарциномы молочной железы человека MCF7, инфицированных вирусами VSV-IND и VSV-NJ при разной множественности заражения (Multiplicity of infection, MOI) (10 MOI; 1 MOI; 0,1 MOI), через 24, 48 и 72 часа, а также вычислены значения половины максимальной ингибирующей концентрации (IC50) с помощью метил-тетразолиевого теста. Взаимосвязь с накоплением вируса в клеточной культуре определяли с помощью полимеразной цепной реакции c обратной транскрипцией в режиме реального времени, 50%-ные инфицирующие дозы (TCID50) VSV-IND и VSV-NJ для B16F10, HepG2, MCF7 рассчитывали с помощью метода Рида – Менча.
Результаты. Наиболее восприимчивой клеточной линией для обоих вирусов оказалась B16F10: жизнеспособность клеток через 72 часа после заражения 10 MOI составила лишь 10,4 и 5,7% для VSV-IND и VSV-NJ соответственно. Жизнеспособность клеток HepG2 составила 10,8 и 9,8% для VSV-IND и VSV-NJ, а для аденокарциномы MCF7 – 46,6 и 36,2% соответственно через 72 часа после заражения 10 MOI. При этом лишь в культуре B16F10 установлена положительная статистически значимая корреляция средней силы между ингибированием жизнеспособности клеток и накоплением вирусной РНК: для VSV-IND r = 0,601 (р < 0,05); для VSV-NJ r = 0,668 (р < 0,05). HepG2 и MCF7 не продемонстрировали значимой корреляции.
Заключение. Результаты исследований свидетельствуют о возможности использования серотипов VSV-IND и VSV-NJ в качестве платформы для разработки новых рекомбинантных вирусов для виротерапии солидных опухолей в комбинации с другими видами лечения.
Ключевые слова
Несмотря на прогресс в изучении молекулярных процессов онкогенеза, смертность от рака в мире (9,3 млн случаев в год) остается на втором месте после сердечно-сосудистых заболеваний (17,2 млн случаев в год) в структуре смертности от неинфекционных болезней1. Согласно мировым статистическим данным за 2020 год, тройку наиболее частых и агрессивных видов рака составляют: рак молочной железы (РМЖ), рак легких и рак толстого кишечника / прямой кишки, число новых случаев в год составляет 2,26, 2,21 и 1,93 млн соответственно2.
В борьбе с онкологическими заболеваниями остается ряд нерешенных задач, связанных с эффективностью и безопасностью лечения – так, химиотерапия и лучевая терапия, несмотря на положительный результат воздействия на раковые клетки, вызывают клинически значимые побочные эффекты, ухудшающие общее состояние пациентов. Актуален поиск лекарственных средств с высокой эффективностью, вызывающих избирательную гибель опухолевых клеток, но с минимальными побочными эффектами для здоровых клеток и тканей [1–4].
Онколитические вирусы уже долгое время рассматриваются как возможные противоопухолевые средства [5]. Среди них большое внимание уделяется вирусам семейства Rhabdoviridae, к которым относится вирус везикулярного стоматита (Vesicular stomatitis virus, VSV) [6]. VSV – РНК-содержащий вирус, который может эффективно проникать в разные типы клеток животных, оставаясь непатогенным для человека [7][8]. Репликация VSV усиливается в опухолевых клетках с дефектным сигнальным путем интерферона, в котором не срабатывает врожденный иммунный ответ [9]. Кроме того, VSV имеет быстрый жизненный цикл, не интегрируется в геном хозяина [8] и является мощным индуктором апоптоза в инфицированных раковых клетках [10][11].
VSV продемонстрировал противоопухолевую активность в широком спектре раковых клеток, включая остеосаркому [12], рак шейки матки [13], РМЖ [14], меланому [15], гепатоцеллюлярную карциному (ГЦК) [16], рак поджелудочной железы [17] и глиобластому [4][18].
Известно два основных серотипа VSV: New Jersey (VSV-NJ) и Indiana (VSV-IND), которые отличаются генетическими и антигенными свойствами. Гомология главного капсидного гликопротеина G вирусов обоих серотипов составляет менее 50% [19]. Вирусы серотипов VSV-NJ и VSV-IND также обладают разной патогенностью для сельскохозяйственных животных [20][21]. Дополнительно фосфопротеин Р, важный компонент комплекса РНК-зависимой РНК-полимеразы, является наиболее вариабельным для обоих вирусов – гомология нуклеотидных последовательностей составляет 30% [22]. Обладая общностью происхождения и разными антигенными свойствами, VSV-NJ и VSV-IND могут обладать индивидуальными особенностями в эффективности уничтожения опухолевых клеток.
Потенциал виротерапии привлекает интерес как возможность воздействия вирусов на широкий спектр злокачественных клеток. В данной работе мы сравнили онколитический потенциал VSV-NJ и VSV-IND в отношении наиболее широко распространенных линий: меланомы мыши – B16F10, ГЦК человека – HepG2, РМЖ человека – MCF7. Помимо отличий в происхождении, строении и характере метастазирования меланомы, ГЦК, РМЖ, данные клеточные линии обладают различной пермиссивностью в отношении онколитических вирусов. Например, B16F10 не пермиссивна к человеческому аденовирусу 5-го типа [23][24], однако пермиссивна к вирусу миксомы [25]. Такое отличие обусловлено отсутствием рецептора CAR (chimeric antigen receptor, химерный рецептор антигена) на поверхности клетки, необходимого для проникновения аденовируса, в то время как инфекционный цикл вируса миксомы не зависит от мембранных рецепторов [26].
Большинство современных исследований посвящены рекомбинантным штаммам на основе VSV-IND, однако ни один из них до настоящего времени не одобрен в клинике. Для оценки перспективы использования других серотипов VSV в виротерапии опухолей необходим их сравнительный анализ, как и дальнейшее изучение различных генетически отличающихся вариантов природных серотипов VSV c целью выбора наиболее перспективной платформы для разработки новых армированных онколитических вирусов.
Цель исследования: изучить цитолитическое действие и кинетику накопления VSV-IND и VSV-NJ на клеточных линиях меланомы мыши, ГЦК и РМЖ человека.
МАТЕРИАЛЫ И МЕТОДЫ
Вирусы
В работе были использованы вирусы везикулярного стоматита VSV (серотип New Jersey (VSV-NJ) и Indiana (VSV-IND) из рабочей коллекции Института медицинской паразитологии, тропических и трансмиссивных инфекций им. Е.И. Марциновского ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет). Вирусы VSV получали в культуре клеток фибробластов хомяка BHK-21 (American Type Culture Collection (ATCC), CCL-10)3.
Клеточные линии
Для работы были выбраны клеточные линии: меланомы мыши – B16F10 (ATCC CRL-6475)4, ГЦК человека – HepG2 (ATCC HB-8065)5, РМЖ человека – MCF7 (ATCC HTB-22)6. Раковые клеточные линии предоставлены ФГБУН «Институт биологии гена РАН» (Москва, Россия) (рис. 1).
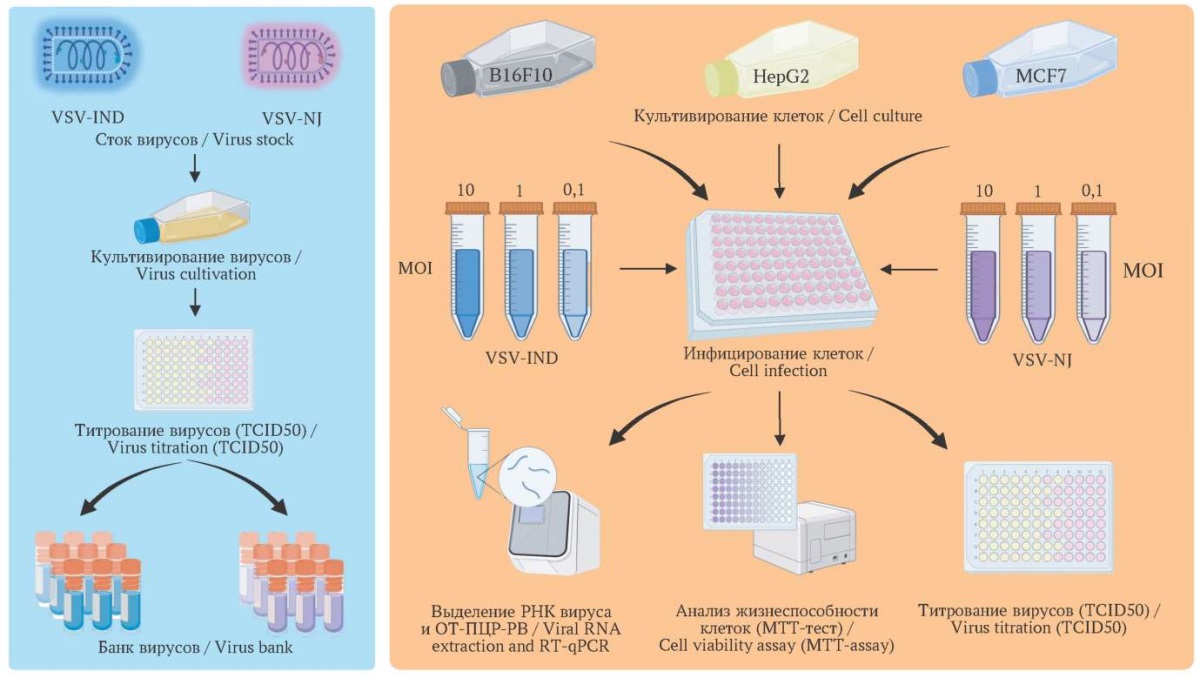
РИС. 1. Схема эксперимента: изучение онколитического потенциала
вируса везикулярного стоматита серотипов Indiana и New Jersey.
FIG. 1. Experimental design: study of oncolytic potential
of vesicular stomatitis virus serotypes Indiana and New Jersey.
Примечание: VSV-IND – Vesicular stomatitis virus Indiana,
вирус везикулярного стоматита серотип Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey,
вирус везикулярного стоматита серотип New Jersey;
TCID50 – 50% Tissue Culture Infectious Dose,
50%-ная инфицирующая доза вируса;
B16F10 – клеточная линия меланомы мыши;
HepG2 – клеточная линия гепатоцеллюлярной карциномы человека;
MCF7 – клеточная линия рака молочной железы человека;
MOI – Multiplicity of infection, множественность заражения;
РНК – pибонуклеиновая кислота;
ОТ-ПЦР-РВ –полимеразная цепная реакция c обратной транскрипцией
в режиме реального времени;
МТТ – метил-тетразолиевый тест.
Note: VSV-IND – Vesicular stomatitis virus Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey;
TCID50 – 50% Tissue Culture Infectious Dose;
B16F10 – Mouse melanoma cell line;
HepG2 – Human hepatocellular carcinoma cell line;
MCF7 – Human breast cancer cell line;
MOI – Multiplicity of infection;
RNA – Ribonucleic acid;
RT-qPCR – real-time reverse transcription –
quantitative polymerase chain reaction;
MTT – methyl tetrazolium test.
Культивирование клеток и анализ жизнеспособности
Экспериментальная часть данной работы проводилась с августа 2022 по февраль 2023 года. Клетки культивировали в стандартных условиях (5% СО2, 37 °С), согласно протоколам ATCC для каждой клеточной линии, до достижения 70–80% конфлюэнтности на флаконах Т25 и Т75 (Wuxi NEST Biotechnology Co., Ltd., Китай), в среде Игла, модифицированной по Дульбекко (Dulbecco’s Modified Eagle Medium, DMEM) (ООО «ПанЭко», Россия) с высоким содержанием глюкозы, с L-глютамином (ООО «ПанЭко», Россия), с добавлением 10% телячьей эмбриональной сыворотки (ООО «Диаэм», Россия) и пенициллина-стрептомицина, 100-х лиофил. (ООО «ПанЭко», Россия).
Жизнеспособность клеток определяли на счетчике клеток C-100 (RWD Life Science, Китай) с использованием трипанового синего (ООО «ПанЭко», Россия). Цитотоксичность серотипов онколитических вирусов оценивали по снижению жизнеспособности клеток исследуемых линий в метил-тетразолиевом тесте (МТТ)7. Для каждого эксперимента клетки рассаживали в три 96-луночных культуральных планшета (SARSTEDT AG & Co., Германия) в концентрации 10 000 клеток на лунку, культивировали 24 часа, после чего из одной лунки снимали клетки и подсчитывали количество живых клеток для расчета множественности заражения (Multiplicity of infection, MOI).
Клетки в лунках планшета инфицировали серотипами VSV-IND и VSV-NJ в дозах 10 MOI, 1 MOI и 0,1 MOI. В качестве неинфицированного контроля оставляли лунки с клетками без добавления вируса. Для каждой дозы вируса (MOI) использовали от 4 до 8 лунок. Все работы проводили в стерильных условиях.
Результаты эксперимента учитывали через 24, 48 и 72 часа с помощью МТТ-теста (конечная концентрация МТТ-реагента в лунке – 0,5 мг/мл). Оптическую плотность цветной реакции измеряли при длинах волн 550 и 620 нм на планшетном спектрофотометре Varioskan LUX (ThermoFisher Scientific TM., США). Жизнеспособность клеток в лунках с неинфицированными клетками принималась за 100% (контрольное значение). Жизнеспособность инфицированных клеток рассчитывалась как процент от значений оптической плотности неинфицированных. На основе данных МТТ-теста также были вычислены значения половины максимальной ингибирующей концентрации (Half maximal inhibitory concentration, IC50) для каждой клеточной линии при различных MOI (10; 1; 0,1) и длительности инкубации (24, 48 и 72 часа).
Выделение РНК вируса
Для проведения полимеразной цепной реакции c обратной транскрипцией в режиме реального времени (real-time reverse transcription – quantitative polymerase chain reaction, RT-qPCR) из лунок планшета спустя 24, 48 и 72 часа после инфицирования клеточных культур отбирали 100 мкл суспензии и выделяли РНК вирусов комплектом реагентов для выделения
РНК/ДНК из клинического материала «РИБО-преп» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия) согласно протоколу производителя.
RT-qPCR. Для обнаружения РНК VSV была разработана система праймеров комплементарной последовательности участка гена N VSV-IND и VSV-NJ. Прямой (5’-GCTGCAGTGGACATGTTCTTC-3’) и обратный праймеры (5’-CATGTATGAATCSGCCTTRTCAATTTC-3’) использовали для амплификации RT-qPCR продукта размером 240 п.о. в присутствии интеркалирующего красителя SybrGreen с набором для полимеразной цепной реакции c обратной транскрипцией в одной пробирке (ООО «Альфа Фермент», Россия) и добавлением 3% диметилсульфоксида при следующих параметрах реакции: 50 °C – 10 мин (1 цикл), 95 °C – 5 мин (1 цикл), 95 °C – 15 cек., 55 °C – 30 cек, 72 °C – 30 cек. (40 циклов) на приборе QuantStudio 5 (ThermoFischer Scientific, США).
Определение 50% тканевой инфицирующей дозы вируса
Определение 50% тканевой инфицирующей дозы вируса (Tissue Culture Infectious Dose, TCID50) на 1 мл образца проводили методом титрования в культуре клеток BHK-21 (ATСC CCL-10) в формате 96-луночного планшета (рис. 1). В лунки планшета вносили 10 000 клеток в полной ростовой среде Игла, модифицированной по Дульбекко, культивировали 24 часа в атмосфере 5% СО2 при 37 °С, затем проводили заражение VSV-IND и VSV-NJ в дозах 10 MOI, 1 MOI и 0,1 MOI (по 8 лунок на разведение) в объеме
50 мкл на лунку и инкубировали 60 минут (5% СО2, 37 °С) для сорбции вируса на клетках. Далее, добавляли 150 мкл полной ростовой среды и инкубировали 72 часа в тех же условиях. Результаты учитывали под инвертированным микроскопом («Микромед И», Россия), отмечая лунки с характерными изменениями морфологии клеток (округлившиеся и сжатые клетки, частичное отслоение клеток). Титр вируса рассчитывали с помощью метода Рида – Менча1.
Статистический анализ
Оценка на нормальность данных проводилась с помощью критерия Шапиро – Уилка. Данные MTT-теста и RT-qPCR представлены в виде средних значений со стандартным отклонением выборки. Статистическая значимость различий жизнеспособности клеток определялась с применением t-критерия Стьюдента с поправкой Бонферрони для множественных сравнений.
Для выявления взаимосвязей между жизнеспособностью клеток и накоплением вируса в клеточной культуре применяли корреляционный анализ с расчетом коэффициента корреляции Пирсона (r). Интерпретацию силы корреляции проводили, оценивая диапазон величин (r): от 0 до 0,299 – как слабую взаимосвязь; от 0,3 до 0,699 – как среднюю; от 0,7 до 1,0 – как сильную. Для опровержения нулевой гипотезы принят уровень статистической значимости p < 0,05. Статистический анализ данных и построение графиков осуществляли при помощи RStudio v.2023.03.1+4469 c использованием библиотек rstatix, ggplot2.
РЕЗУЛЬТАТЫ
Клеточная линия мышиной меланомы B16F10
При трансдукции клеточной линии B16F10 в экспериментах с МТТ наблюдалось значительное снижение жизнеспособности клеток при заражении обоими серотипами вируса – как VSV-IND (рис. 2А), так и VSV-NJ (рис. 2В).
При анализе взаимосвязи между цитотоксичностью и количеством вирусной РНК установлена положительная статистически значимая корреляция средней силы для обоих серотипов: r = 0,601 для VSVIND, р < 0,05 и r = 0,668 для VSV-NJ, р < 0,05.
TCID50 вирусов, накопленных на этой культуре за 24 часа, при дозе заражения 10 MOI составил 1,0×104 и 1,47×105 TCID50 для VSV-IND и VSV-NJ соответственно (рис. 2С, 2D). Мы также определили дозу IC50 (MOI) для вирусов обоих серотипов (Табл.).
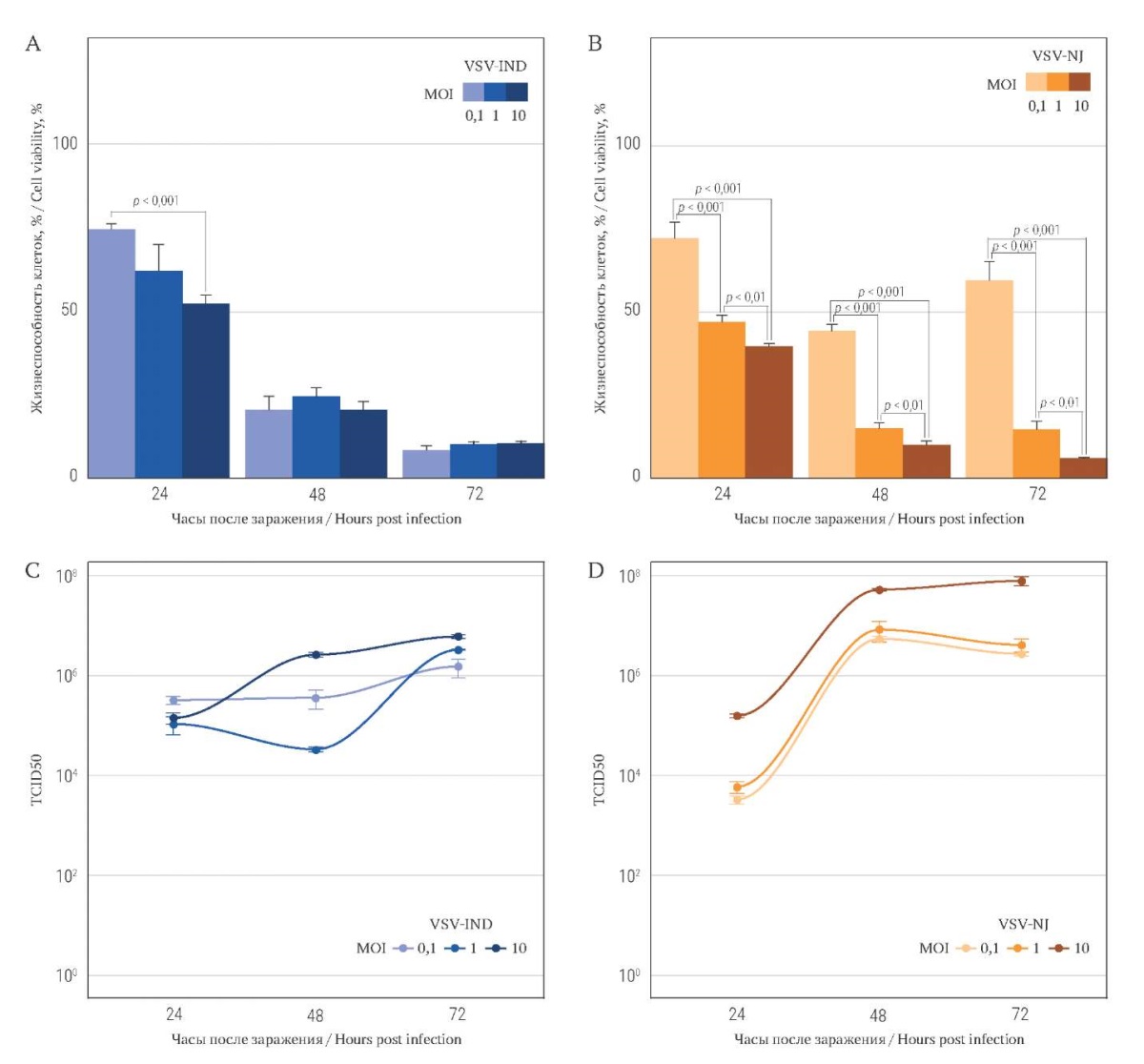
РИС. 2. Оценка жизнеспособности клеток B16F10,
инфицированных вирусами VSV-IND и VSV-NJ.
FIG. 2. В16F10 cells viability after VSV-IND and VSV-NJ infection.
Примечание: онколитический эффект представлен в % живых клеток
после инфицирования VSV-IND (A) и VSV-NJ (B).
Количественный анализ РНК выражается в титре (TCID50) VSV-IND (C) и VSV-NJ (D).
В качестве референс-стандарта для количественного определения TCID50
использовали VSV c известным титром:
3,0×107 TCID50 и 6,23×106 TCID50 для VSV-IND и VSV-NJ соответственно.
VSV-IND – Vesicular stomatitis virus Indiana,
вирус везикулярного стоматита серотип Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey,
вирус везикулярного стоматита серотип New Jersey;
MOI – Multiplicity of infection, множественность заражения;
TCID50 – 50% Tissue Culture Infectious Dose,
50%-ная инфицирующая доза вируса.
Note: the oncolytic effect is expressed as a proportion of living cells (%)
after infection with VSV-IND (A) and VSV-NJ (B).
Quantitative analysis of RNA is expressed as titer (TCID50) VSV-IND (C) and VSV-NJ (D).
As a reference standard for the quantitative determination of TCID50,
VSV with a predetermined titer was used:
3.0×107 TCID50 and 6.23×106 TCID50 for VSV-IND and VSV-NJ, respectively.
VSV-IND – Vesicular stomatitis virus Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey;
MOI – Multiplicity of infection;
TCID50 – 50% Tissue Culture Infectious Dose.
В культуре B16F10 через 24 часа воздействия для ингибирования жизнеспособности 50% клеток определили 5,31 MOI VSV-IND и 1,08 MOI VSV-NJ, то есть IC50 VSV-IND почти пятикратно превышала IC50 VSV-NJ. Напротив, при увеличении времени экспозиции до 48 и 72 часов определить IC50 для VSV-IND уже не удалось из-за гибели подавляющего большинства клеток (более 80%) во всем диапазоне применяемых концентраций вируса.
При этом для VSV-NJ через 48 и 72 часа IC50 определялась в пределах 0,02–0,1 MOI (табл.), а показатель TCID50 для VSV-IND оказался более чем в 3 раза выше, чем для VSV-NJ (9,28×103и 2,94×103 TCID50 для 10 MOI соответственно).
Таблица. Определение IC50 для серотипов вируса VSV-NJ и VSV-IND
на раковых клеточных культурах
Table. IC50 values for VSV-NJ and VSV-IND in cancer cell lines
|
Клеточная линия / Cell line |
Время, ч / Time, h |
IC50 |
|
|
VSV-IND (MOI) |
VSV-NJ (MOI) |
||
|
B16F10 |
24 |
5,31 |
1,08 |
|
48 |
n/a |
0,02 |
|
|
72 |
n/a |
0,1 |
|
|
HepG2 |
24 |
12,07 |
4,80 |
|
48 |
0,25 |
0,01 |
|
|
72 |
n/a |
n/a |
|
|
MCF7 |
24 |
17,25 |
33,12 |
|
48 |
n/a |
0,01 |
|
|
72 |
0,66 |
6,02 |
|
Примечание: IC50 – Half maximal inhibitory concentration,
половина максимальной ингибирующей концентрации;
VSV-IND – Vesicular stomatitis virus Indiana,
вирус везикулярного стоматита серотип Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey,
вирус везикулярного стоматита серотип New Jersey;
MOI – Multiplicity of infection, множественность заражения;
n/a – not analyzed, не определяется.
Note: IC50 – Half maximal inhibitory concentration;
VSV-IND – Vesicular stomatitis virus Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey;
MOI – Multiplicity of infection;
n/a – not analyzed.
Клеточная линия гепатоцеллюлярной карциномы человека HepG2
Жизнеспособность клеток линии HepG2 через 24 часа инкубации с вирусом обоих серотипов сопоставима с таковой B16F10 (рис. 3A, 3B). Через 48 часов на всем диапазоне концентраций вируса остается больше жизнеспособных клеток HepG2, чем в культуре B16F10 в этих же условиях, за исключением VSV-NJ 0,1 MOI, для которых значения у обеих клеточных линий совпадают (рис. 2B, 3B). Динамика снижения жизнеспособности клеток позволяет определить IC50 через 48 часов экспозиции вируса обоих серотипов (табл.). Однако через 72 часа пермиссивность HepG2 к VSV-NJ превосходит таковую для линии B16F10. Даже при минимальной инфицирующей дозе вируса в 0,1 MOI более 80% клеток погибает через 72 часа: IC50 не определяется в данном диапазоне инфицирующих доз для обоих серотипов (рис. 3B).
В результате титрования VSV-NJ и VSV-IND методом TCID50, после инфицирования клеток HepG2 значения составляли от 2,15×104 до 4,64×106 TCID50 для VSV-IND и от 1,0×106 до 3,16×109 TCID50 для VSV-NJ (рис. 3С, 3D), что на несколько порядков превышает эти показатели для B16F10. Значимых корреляций между снижением жизнеспособности и изменением количества вирусной РНК (RT-qPCR) для HepG2 не обнаружено.
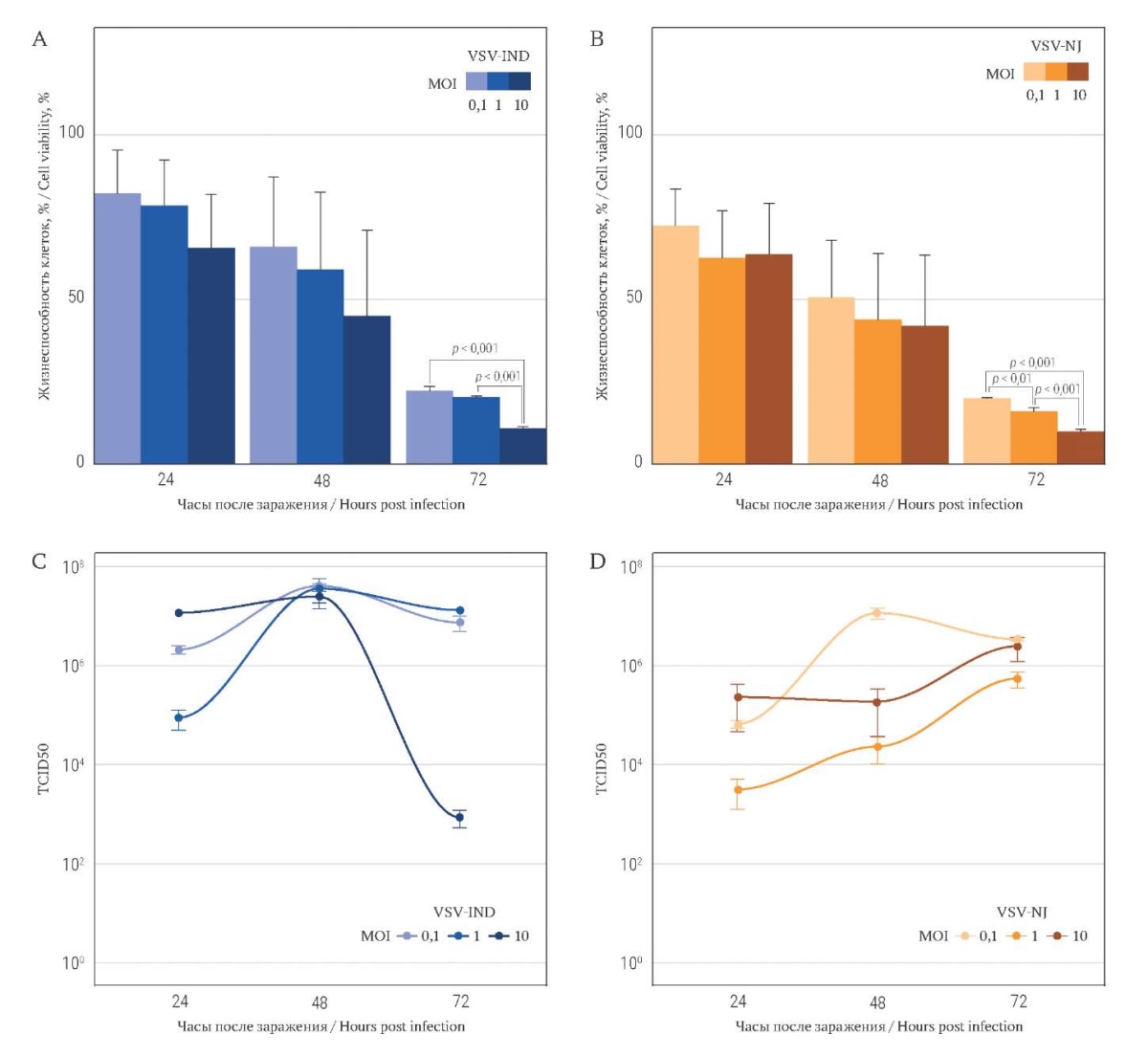
РИС. 3. Оценка жизнеспособности клеток HepG2,
инфицированных вирусами VSV-IND и VSV-NJ.
FIG. 3. HepG2 cells viability after VSV-IND and VSV-NJ infection.
Примечание: онколитический эффект представлен в % живых клеток
после инфицирования VSV-IND (A) и VSV-NJ (B).
Количественный анализ РНК выражается в титре (TCID50) VSV-IND (C) и VSV-NJ (D).
В качестве референс-стандарта для количественного определения TCID50
использовали VSV c известным титром:
3,0×107 TCID50 и 6,23×106 TCID50 для VSV-IND и VSV-NJ соответственно.
VSV-IND – Vesicular stomatitis virus Indiana,
вирус везикулярного стоматита серотип Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey,
вирус везикулярного стоматита серотип New Jersey;
MOI – Multiplicity of infection, множественность заражения;
TCID50 – 50% Tissue Culture Infectious Dose,
50%-ная инфицирующая доза вируса.
Note: the oncolytic effect is expressed as a proportion of living cells (%)
after infection with VSV-IND (A) and VSV-NJ (B).
Quantitative analysis of RNA is expressed as titer (TCID50) VSV-IND (C) and VSV-NJ (D).
As a reference standard for the quantitative determination of TCID50,
VSV with a predetermined titer was used:
3.0×107 TCID50 and 6.23×106 TCID50 for VSV-IND and VSV-NJ, respectively.
VSV-IND – Vesicular stomatitis virus Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey;
MOI – Multiplicity of infection;
TCID50 – 50% Tissue Culture Infectious Dose.
Клеточная линия аденокарциномы молочной железы человека – MCF7
В серии наших экспериментов клеточная линия MCF7 являлась наименее пермиссивной к VSV (рис. 4A, 4B), демонстрируя устойчивость к VSV-NJ более 50% во всем диапазоне концентраций вируса и времени инкубации, кроме максимальных концентраций (10 MOI, 72 часа). При воздействии VSV-IND в течение 72 часов содержание жизнеспособных клеток оставалось не ниже 40%. Соответственно, наблюдались и высокие значения IC50 (Табл.).
Содержание в культуре MCF7 вирусной РНК в динамике либо оставалось практически без изменений, как у VSV-IND (1 MOI), либо снижалось, причем снижение достигало трех порядков, как у VSV-NJ (10 MOI) (рис. 4C, D). Подтвержденная взаимосвязь между показателями снижения жизнеспособности клеток и изменением количества вирусной РНК отсутствовала при заражении обоими серотипами.
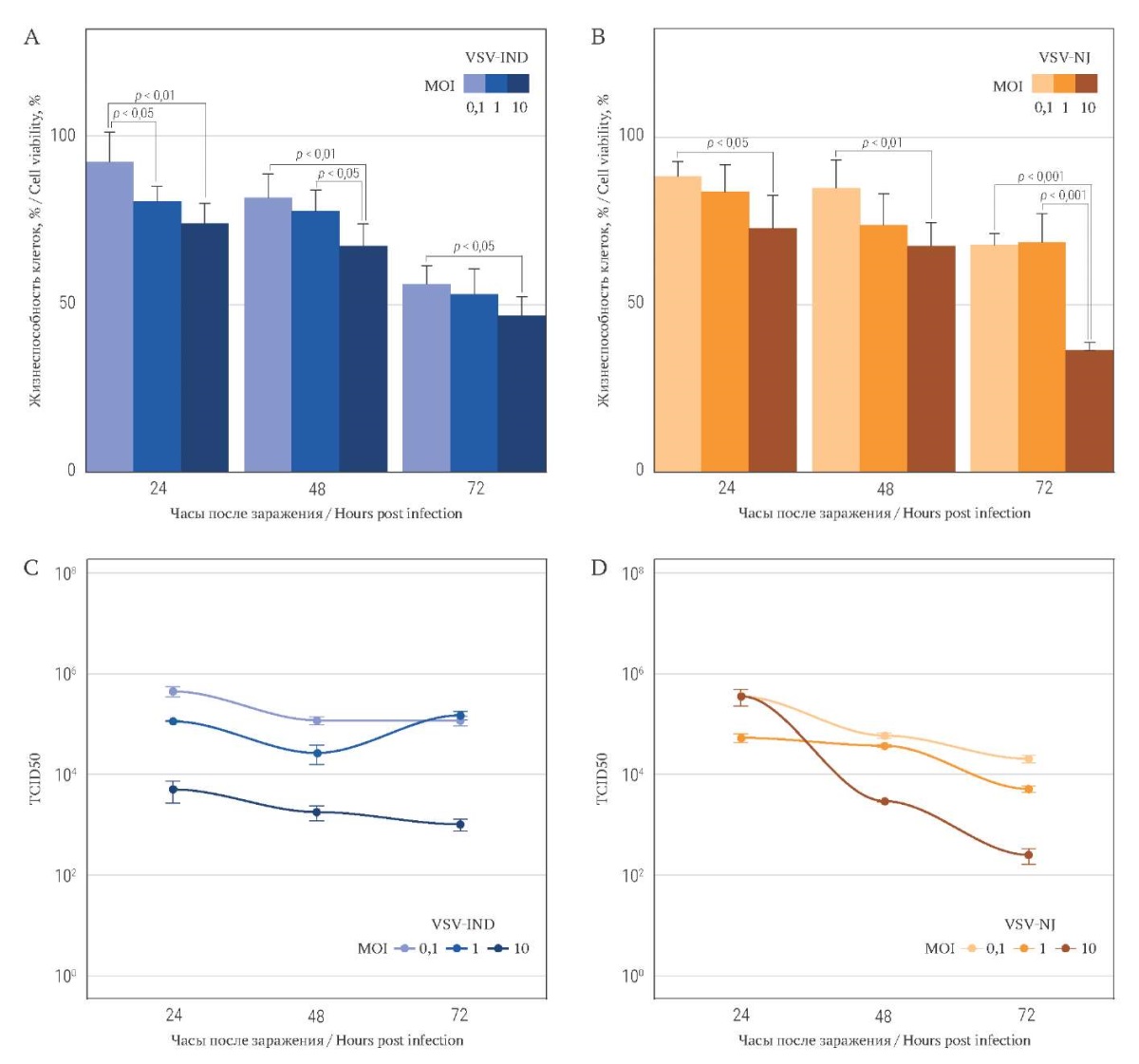
РИС. 4. Оценка жизнеспособности клеток MCF7,
инфицированных вирусами VSV-IND и VSV-NJ.
FIG. 4. MCF7 cells viability after VSV-IND and VSV-NJ infection.
Примечание: онколитический эффект выражается в % живых клеток
после инфицирования VSV-IND (A) и VSV-NJ (B).
Количественный анализ РНК выражается в титре (TCID50) VSV-IND (C) и VSV-NJ (D).
В качестве референс-стандарта для количественного определения TCID50
использовали VSV c известным титром:
3,0×107 TCID50 и 6,23×106 TCID50 для VSV-IND и VSV-NJ соответственно.
VSV-IND – Vesicular stomatitis virus Indiana,
вирус везикулярного стоматита серотип Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey,
вирус везикулярного стоматита серотип New Jersey;
MOI – Multiplicity of infection, множественность заражения;
TCID50 – 50% Tissue Culture Infectious Dose, 5
0%-ная инфицирующая доза вируса.
Note: the oncolytic effect is expressed as a proportion of living cells (%)
after infection with VSV-IND (A) and VSV-NJ (B).
Quantitative analysis of RNA is expressed as titer (TCID50) VSV-IND (C) and VSV-NJ (D).
As a reference standard for the quantitative determination of TCID50,
VSV with a predetermined titer was used:
3.0×107 TCID50 and 6.23×106 TCID50 for VSV-IND and VSV-NJ, respectively.
VSV-IND – Vesicular stomatitis virus Indiana;
VSV-NJ – Vesicular stomatitis virus New Jersey;
MOI – Multiplicity of infection;
TCID50 – 50% Tissue Culture Infectious Dose.
ОБСУЖДЕНИЕ
VSV является модельным объектом исследований, способствующих комплексному пониманию взаимодействия вирусов и раковых клеток [10]. Благодаря непатогенности VSV для человека и способности репродуцироваться в разных клетках природные серотипы VSV-IND и VSV-NJ могут служить источником новых эффективных средств иммунотерапии. VSV селективно индуцирует цитолиз многочисленных трансформированных клеточных линий человека in vitro со всеми морфологическими характеристиками апоптотической клеточной гибели [27]. Кроме того, геном VSV может вместить вставку одного или нескольких функциональных генов [28–30], а значит, онколитический потенциал может быть значительно усилен. В данной работе мы сфокусировались на сравнении VSV-IND и VSV-NJ в эффективности разрушения опухолевых клеток.
Исходя из результатов МТТ-теста мы предполагаем, что клеточные линии меланомы мыши B16F10 и ГЦК человека HepG2 пермиссивны к обоим серотипам вируса VSV. Причем на клетках линии B16F10 цитотоксичность VSV-IND (72 часа после инфекции) достигала более 80% независимо от первоначальной дозы, а в культуре клеток HepG2 такая же картина наблюдалась и для VSV-NJ. Однако ни в одной клеточной линии не удалось зафиксировать 100% гибель клеток. По данным литературы, клеточная линия меланомы мыши B16F10 может быть частично устойчива к инфекции VSV [15][28]. О высокой цитотоксичности VSV в культуре HepG2 сообщается в работе B.M. Nagalo и соавт., 2020 [16], где гликопротеин G VSV был модифицирован гемагглютинином вируса кори.
В нашей гипотезе мы исходили из того, что: (1) наличие прямой статистически достоверной сильной или средней корреляции между ингибированием жизнеспособности клеток (цитотоксичностью VSV) и накоплением вирусной РНК может отражать гибель в результате репликации вируса, тогда как (2) высокие показатели гибели клеток в отсутствие накопления РНК (а значит и репликации вируса) могут свидетельствовать о цитотоксическом действии вирусных белков. Первая ситуация наблюдалась в культуре клеток B16F10 для обоих серотипов. Напротив, в культуре клеток HepG2 каких-либо достоверных взаимосвязей между снижением жизнеспособности клеток и накоплением вирусной РНК выявлено не было. Можно предположить, что восприимчивость клеток HeрG2 к VSV-IND и VSV-NJ в большей степени обусловлена цитотоксическим действием их белков, чем репликацией, что согласуется с данными литературы [20].
Отдельно следует отметить линию РМЖ человека MCF7, которая демонстрировала выживаемость более 50% практически во всем диапазоне концентраций VSV-IND и VSV-NJ и времени экспозиции, кроме максимальных (10 MOI и 72 часа). Ранее в работе C. Rogers и соавт., 2017 [11], при исследовании влияния матриксного белка М VSV на высокоонкогенную линию MCF7 были получены аналогичные результаты. Авторам не удалось добиться полной регрессии опухоли in vivo, и они сделали вывод, что цитолитический эффект VSV при РМЖ необходимо сочетать с более агрессивным лечением [11]. В 2021 году попытка применить VSV совместно с иммунотерапией натуральными киллерами (Natural killer T-cells, NKT) оказалась более успешной [31]. При этом монотерапия VSV не приводила к полной регрессии опухоли (как и в наших экспериментах), хотя и демонстрировала индукцию гибели клеток. Исследование проводилось на линии аденокарциномы человека 4T1, что не позволяет сравнивать результаты с нашим экспериментом, тем не менее оно дает надежду на успех в случае комбинированной терапии для аденокарциномы молочной железы.
Содержание вирусной РНК через 72 часа в культуре клеток MCF7 в нашем исследовании снизилось как для VSV-IND, так и для VSV-NJ. Статистически значимой связи между снижением жизнеспособности клеток и накоплением вирусной РНК не выявлено при заражении обоими серотипами.
Ограничения исследования
Настоящее исследование не включает генетически модифицированные VSV, ограничиваясь природными (дикими) серотипами вируса. Большее разнообразие раковых клеточных линий может быть использовано для проверки онколитического потенциала вирусов.
Направления для дальнейших исследований
Дальнейшие исследования могут включать оценку воздействия VSV-IND и VSV-NJ на более широкий спектр раковых, а также нераковых клеточных линий, например MCF10, фибробластов и др. Планируется также определить тип клеточной гибели в результате воздействия VSV (некроз, апоптоз, аутофагия). По итогам более масштабного исследования можно определить наиболее универсальный и перспективный серотип как платформу для дальнейших генетических модификаций VSV с целью усиления противоопухолевого действия.
ЗАКЛЮЧЕНИЕ
В работе мы показали, что восприимчивой клеточной линией для вирусов VSV-IND и VSV-NJ оказались B16F10 и HepG2, в то время как ингибирование жизнеспособности клеток MCF7 составило лишь 63,8 и 53,4% для VSV-IND и VSV-NJ соответственно. Линия MCF7 по выживаемости клеток и по накоплению вирусной РНК умеренно устойчива к заражению VSV обоих серотипов. Линии B16F10 и HepG2 оказались пермиссивными при заражении VSV-IND и VSV-NJ в дозах 10, 1 и 0,1 MOI, несмотря на отсутствие тотальной гибели клеток. При этом в них обнаруживается разная динамика гибели и накопления РНК вируса, что может быть использовано для выбора средств при комбинированной терапии меланомы и рака печени.
ВКЛАД АВТОРОВ
А.С. Исаева и Н.О. Порозова внесли равный значительный вклад в проведение исследований и обработку данных, статистическую обработку результатов исследования и подготовку рукописи. Э. Идота внесла основной вклад в подготовку и поддержание раковых клеточных линий. С.И. Володина участвовала в разработке протоколов титрования серотипов VSV и депонирования вирусов в рабочую коллекцию. А.Н. Лукашев внес основной вклад в дизайн исследований, обсуждение и редактирование статьи. А.С. Малоголовкин внес основной вклад в разработку концепции идеи и методологии проведения эксперимента, а также написание текста статьи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Anastasia S. Isaeva and Natalya O. Porozova made equal significant contributions to research and data processing, statistical analysis, and preparation of the manuscript. Esther Idota: preparation and maintenance of cancer cell lines. Sofya I. Volodina: development of protocols for VSV serotypes titration and depositing viruses in the working collection. Alexander N. Lukashev study design, discussion and manuscript editing. Alexander S. Malogolovkin: study concept and methodology of the experiment, as well as writing the text of the article. All the authors approved the final version of the article.
БЛАГОДАРНОСТИ
Авторы выражают благодарность заместителю директора Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) кандидату медицинских наук Ахмадишиной Людмиле Васильевне за помощь в организации и проведении исследований; заведующему лабораторией биофизики ФГБНУ «ФНЦ ВИЭВ РАН» кандидату ветеринарных наук Надточею Григорию Андреевичу за комментарии и дискуссию по результатам работы; а также заведующему лабораторией молекулярной онкобиологии Института биологии гена РАН кандидату биологических наук Татарскому Виктору Вячеславовичу за предоставленные клеточные линии.
ACKNOWLEDGEMENTS
The authors express their gratitud Deputy Director, Martsinovsky Institute of Medical Parasitology, Tropical and Vector-borne Diseases, Sechenov First Moscow State Medical University, Cand. of Sci. (Medicine), Ludmila V. Akhmadishina for her help in organizing and conducting the research; Head of Biophysics Laboratory, FSC VIEV, Cand. of Sci. (Veterinary medicine), Grigory A. Nadtochey for comments and discussion of the results; as well as the Head of the Laboratory of Molecular Oncobiology of the Institute of Gene Biology of the Russian Academy of Sciences, Cand. of Sci. (Biology), Victor V. Tatarsky for providing the cell lines.
Соответствие принципам этики. Данное исследование с использованием биологического материала проводилось исключительно в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации об этических принципах проведения биомедицинских исследований.
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование выполнено при поддержке Программы академического лидерства «Приоритет-2030» ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский университет).
Ethics statements. This research involving biological material was conducted solely in accordance with the World Medical Association's Declaration of Helsinki on ethical principles for medical research.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The research was supported by the Priority 2030 academic leadership program, Sechenov First Moscow State Medical University (Sechenov University).
1. World Health Organization: Newsroom/Fact sheets/Detail/Noncommunicable diseases. https://www.who.int/news-room/fact-sheets/detail/noncommunicable-diseases (дата обращения: 22.09.2023).
2. World Health Organization: Newsroom/Fact sheets/Detail/Cancer. https://www.who.int/news-room/fact-sheets/detail/cancer (дата обращения: 22.09.2023).
3. American Type Culture Collection (ATCC): Cell Products/Animal Cells/CCL-10. https://www.atcc.org/products/ccl-10 (дата обращения: 29.09.2023).
4. American Type Culture Collection (ATCC): Cell Products/Animal Cells/CRL-6475. https://www.atcc.org/products/crl-6475 (дата обращения: 29.09.2023).
5. American Type Culture Collection (ATCC): Cell Products/Human Cells/HB-8065. https://www.atcc.org/products/hb-8065 (дата обращения: 29.09.2023).
6. American Type Culture Collection (ATCC): Cell Products/Human Cells/HTB-22. https://www.atcc.org/products/htb-22 (дата обращения: 29.09.2023).
7. Методы исследования цитотоксичности при скрининге лекарственных препаратов. Учебно-методическое пособие / А.Г. Иксанова, О.В. Бондарь, К.В. Балакин. Казань: Казанский университет, 2016. 40 с. https://kpfu.ru/staff_files/F1213114794/Metody_skrininga_LS.pdf (дата обращения: 29.09.2023).
8. https://web.archive.org/web/20131119121647/http://aje.oxfordjournals.org/content/27/3/493.extract
9. https://dailies.rstudio.com/rstudio/cherry-blossom/electron/windows-xcopy/2023-03-1-446/
Список литературы
1. Zainutdinov S.S., Kochneva G.V., Netesov S.V., et al. Directed evolution as a tool for the selection of oncolytic RNA viruses with desired phenotypes. Oncolytic Virother. 2019 Jul 12; 8: 9–26. https://doi.org/10.2147/OV.S176523. PMID: 31372363
2. Бабаева Ф.Э., Липатова А.В., Кочетков Д.В. и др. Исследование репродукции онколитических вирусов в органных культурах лимфоидных опухолей человека. Онкогематология 2019; 14(4): 84–89. https://doi.org/10.17650/1818-8346-2019-14-4-84-89
3. Shalhout S.Z., Miller D.M., Emerick K.S., Kaufman H.L. Therapy with oncolytic viruses: progress and challenges. Nat Rev Clin Oncol. 2023 Mar; 20(3): 160–177. https://doi.org/10.1038/s41571-022-00719-w. Epub 2023 Jan 11. PMID: 36631681
4. Jiang B., Huang D., He W., et al. Inhibition of glioma using a novel non-neurotoxic vesicular stomatitis virus. Neurosurg Focus. 2021 Feb; 50(2): E9. https://doi.org/10.3171/2020.11.FOCUS20839. PMID: 33524950
5. Kelly E., Russell S.J. History of oncolytic viruses: genesis to genetic engineering. Mol Ther. 2007 Apr; 15(4): 651–659. https://doi.org/10.1038/sj.mt.6300108. Epub 2007 Feb 13. PMID: 17299401
6. Hastie E., Grdzelishvili V.Z. Vesicular stomatitis virus as a flexible platform for oncolytic virotherapy against cancer. J Gen Virol. 2012 Dec; 93(Pt 12): 2529–2545. https://doi.org/10.1099/vir.0.046672-0. Epub 2012 Oct 10. PMID: 23052398
7. Pelzel-McCluskey A.M. Vesicular Stomatitis Virus. Vet Clin North Am Equine Pract. 2023 Apr; 39(1): 147–155. https://doi.org/10.1016/j.cveq.2022.11.004. Epub 2023 Feb 1. PMID: 36737291
8. Bishnoi S., Tiwari R., Gupta S., et al. Oncotargeting by Vesicular Stomatitis Virus (VSV): advances in cancer therapy. Viruses. 2018 Feb 23; 10(2): 90. https://doi.org/10.3390/v10020090. PMID: 29473868
9. Bressy C., Droby G.N., Maldonado B.D., et al. Cell Cycle Arrest in G2/M phase enhances replication of interferon-sensitive cytoplasmic RNA viruses via inhibition of antiviral gene expression. J Virol. 2019 Feb 5; 93(4): e01885-18. https://doi.org/10.1128/JVI.01885-18. PMID: 30487274
10. Koyama A.H. Induction of apoptotic DNA fragmentation by the infection of vesicular stomatitis virus. Virus Res. 1995 Aug; 37(3): 285–290. https://doi.org/10.1016/0168-1702(95)00026-m. PMID: 8533463
11. Rogers C., Fernandes-Alnemri T., Mayes L., et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death. Nat Commun. 2017 Jan 3; 8: 14128. https://doi.org/10.1038/ncomms14128. PMID: 28045099
12. Makielski K.M., Sarver A.L., Henson M.S, et al. Neoadjuvant systemic oncolytic vesicular stomatitis virus is safe and may enhance long-term survivorship in dogs with naturally occurring osteosarcoma. Molecular Therapy: Oncolytics 2023 December; 31: 1–12. https://doi.org/10.1016/j.omto.2023.100736. Epub 2023 October 13.
13. Riepler L., Frommelt L.S., Wilmschen-Tober S., et al. Therapeutic efficacy of a VSV-GP-based human papilloma virus vaccine in a murine cancer model. J Mol Biol. 2023 Jul 1; 435(13): 168096. https://doi.org/10.1016/j.jmb.2023.168096. Epub 2023 Apr 20. PMID: 37086948
14. Askari F.S., Mohebbi A., Moradi A., Javid N. The role of vesicular stomatitis virus matrix protein in autophagy in the breast cancer. Asian Pac J Cancer Prev. 2021 Jan 1; 22(1): 249–255. https://doi.org/10.31557/APJCP.2021.22.1.249. PMID: 33507706
15. Kimpel J., Urbiola C., Koske I., et al. The oncolytic virus VSV-GP is effective against malignant melanoma. Viruses. 2018 Mar 2; 10(3): 108. https://doi.org/10.3390/v10030108. PMID: 29498639
16. Nagalo B.M., Breton C.A., Zhou Y., et al. Oncolytic virus with attributes of vesicular stomatitis virus and Measles virus in hepatobiliary and pancreatic cancers. Mol Ther Oncolytics. 2020 Sep 25; 18: 546–555. https://doi.org/10.1016/j.omto.2020.08.007. Epub 2020 Aug 19. PMID: 32839735
17. Tang S., Shi L., Luker B.T., et al. Modulation of the tumor microenvironment by armed vesicular stomatitis virus in a syngeneic pancreatic cancer model. Virol J. 2022 Feb 23; 19(1): 32. https://doi.org/10.1186/s12985-022-01757-7. PMID: 35197076
18. Kim T.E., Puckett S., Zhang K., et al. Diversity in responses to oncolytic Lassa-vesicular stomatitis virus in patient-derived glioblastoma cells. Mol Ther Oncolytics. 2021 Jun 12; 22: 232–244. https://doi.org/10.1016/j.omto.2021.06.003. PMID: 34514102
19. Martinez I., Wertz G.W. Biological differences between vesicular stomatitis virus Indiana and New Jersey serotype glycoproteins: identification of amino acid residues modulating pH-dependent infectivity. J Virol. 2005 Mar; 79(6): 3578–3585. https://doi.org/10.1128/JVI.79.6.3578-3585.2005. PMID: 15731252
20. Velazquez-Salinas L., Medina G.N., Valdez F., et al. Exploring the molecular basis of vesicular stomatitis virus pathogenesis in swine: insights from expression profiling of primary macrophages infected with M51R mutant virus. Pathogens. 2023; 12(7): 896. https://doi.org/10.3390/pathogens12070896. PMID: 37513744
21. Velazquez-Salinas L., Canter J.A., Zhu J.J., Rodriguez L.L. Molecular pathogenesis and immune evasion of vesicular stomatitis New Jersey virus inferred from genes expression changes in infected porcine macrophages. Pathogens. 2021 Sep 3; 10(9): 1134. https://doi.org/10.3390/pathogens10091134. PMID: 34578166
22. Das S.C., Pattnaik A.K. Phosphorylation of vesicular stomatitis virus phosphoprotein P is indispensable for virus growth. J Virol. 2004 Jun; 78(12): 6420–6430. https://doi.org/10.1128/JVI.78.12.6420-6430.2004. PMID: 15163735
23. Blair G.E., Dixon S.C., Griffiths S.A., Zajdel M.E. Restricted replication of human adenovirus type 5 in mouse cell lines. Virus Res. 1989 Dec; 14(4): 339-346. https://doi.org/10.1016/0168-1702(89)90026-9. PMID: 2560294
24. Zhang L., Hedjran F., Larson C., et al. A novel immunocompetent murine model for replicating oncolytic adenoviral therapy. Cancer Gene Ther. 2015 Jan; 22(1): 17–22. https://doi.org/10.1038/cgt.2014.64. Epub 2014 Dec 19. PMID: 25525035
25. Stanford M.M., Shaban M., Barrett J.W., et al. Myxoma virus oncolysis of primary and metastatic B16F10 mouse tumors in vivo. Mol Ther. 2008 Jan; 16(1): 52–59. https://doi.org/10.1038/sj.mt.6300348. Epub 2007 Nov 13. PMID: 17998900
26. Rahman M.M., McFadden G. Oncolytic virotherapy with Myxoma virus. J Clin Med. 2020 Jan 8; 9(1): 171. https://doi.org/10.3390/jcm9010171. PMID: 31936317
27. Balachandran S., Barber G.N. Vesicular stomatitis virus (VSV) therapy of tumors. IUBMB Life. 2000 Aug; 50(2): 135–138. https://doi.org/10.1080/713803696. PMID: 11185959
28. Munis A.M., Bentley E.M., Takeuchi Y. A tool with many applications: vesicular stomatitis virus in research and medicine. Expert Opin Biol Ther. 2020 Oct; 20(10): 1187–1201. https://doi.org/10.1080/14712598.2020.1787981. Epub 2020 Jul 9. PMID: 32602788
29. Zhang Y., Nagalo B.M. Immunovirotherapy based on recombinant vesicular stomatitis virus: Where are we? Front Immunol. 2022 Jun 28; 13: 898631. https://doi.org/10.3389/fimmu.2022.898631. PMID: 35837384
30. Leveille S., Goulet M.L., Lichty B.D., Hiscott J. Vesicular stomatitis virus oncolytic treatment interferes with tumor-associated dendritic cell functions and abrogates tumor antigen presentation. J Virol. 2011 Dec; 85(23): 12160–12169. https://doi.org/10.1128/JVI.05703-11. PMID: 21917977
31. Gebremeskel S., Nelson A., Walker B., et al. Natural killer T cell immunotherapy combined with oncolytic vesicular stomatitis virus or reovirus treatments differentially increases survival in mouse models of ovarian and breast cancer metastasis. J Immunother Cancer. 2021 Mar; 9(3): e002096. https://doi.org/10.1136/jitc-2020-002096. PMID: 33722907
Об авторах
А. С. ИсаеваРоссия
Исаева Анастасия Сергеевна - младший научный сотрудник, аспирантка Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Н. О. Порозова
Россия
Порозова Наталья Олеговна - канд. биол. наук, старший научный сотрудник Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Э. Идота
Россия
Идота Эстер - аспирантка Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
С. И. Володина
Россия
Володина Софья Игоревна - младший научный сотрудник, аспирантка Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. Н. Лукашев
Россия
Лукашев Александр Николаевич - д-р мед. наук, профессор, член-корреспондент РАН, директор Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. С. Малоголовкин
Россия
Малоголовкин Александр Сергеевич - канд. биол. наук, зав. лабораторией молекулярной вирусологии Института медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского.
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Тел.: +7 (919) 000-89-02
Рецензия
JATS XML







































