Перейти к:
Биомаркеры нейровоспаления в диагностике черепномозговой травмы и нейродегенеративных заболеваний: обзор литературы
https://doi.org/10.47093/2218-7332.2024.15.1.20-35
Аннотация
Воспалительные процессы, сопровождающиеся поражением тел нейронов, объединяют в группу нейровоспаления. На молекулярном, клеточном и тканевом уровнях нейровоспаление служит саногенетической реакцией на разнообразные повреждения, включая посттравматические состояния и нейродегенерацию. Тем не менее воспалительные изменения в таких долгоживущих клетках, как нейроны, неизбежно запускают целый ряд неблагоприятных эффектов. В результате прогноз зачастую зависит от тяжести нейровоспаления. В настоящей работе мы рассматриваем широкий спектр биомаркеров, участвующих в двух ключевых механизмах нейровоспаления: иммуноопосредованного и при механическом повреждении, и имеющих потенциал клинического применения: цитокины, нейроспецифические белки и продукты их протеолиза, маркеры окислительного стресса, матриксные металлопротеиназы и эндокринные показатели. За последние десятилетия накоплен значительный пул данных о биомаркерах нейровоспаления, и он продолжает расти, но единого консенсуса по фактической градации их клинической значимости не достигнуто. Прикладные отрасли медицины требуют дальнейшей систематизации сведений о биомаркерах нейровоспаления для эффективных прогностических решений в клинике.
Ключевые слова
Список сокращений
- Apo E – Apolipoprotein E, Аполипопротеин E
- APP – Amyloid precursor protein, белок-предшественник амилоида
- β-APP – β-amyloid precursor protein, предшественник бета-амилоида
- BDNF – Brain-derived neurotrophic factor, нейротрофический фактор мозга
- BNP – Brain Natriuretic Peptide, натрийуретический пептид B-типа, илимозговой натрийуретический пептид
- CCL – C-C Motif Chemokine Ligand, хемокиновый лиганд с мотивом C-C
- CXCL – C-X-C Motif Chemokine Ligand, хемокиновый лиганд к рецептору с повтором цистеин-вставка (X)-цистеин
- GFAP – Glial Fibrillary Acidic Protein, глиальный фибриллярный кислый белок
- HMGB1 – High-Mobility Group Protein B1, амфотерин
- IGF-1 – Insulin-like Growth Factor-1, инсулиноподобный фактор роста 1
- IL – Interleukin, интерлейкин
- MBP – Myelin basic protein, основной миелиновый белок
- MMP – Matrix Metalloproteinase, матриксные металлопротеиназы
- NFs – Neurofilaments, нейрофиламенты
- NF-L – Neurofilaments light, нейрофиламенты легкие
- NF-M – Neurofilaments medium, нейрофиламенты средние
- NF-H – Neurofilaments heavy, нейрофиламенты тяжелые
- NMDA – N-methyl-D-aspartate, N-метил-D-аспартат
- NSE – Neuron-specific enolase, γ-енолаза
- NT – Neurotrophin, нейротрофин
- pNF-H – Phosphorylated neurofilament heavy, фосфорилированная форма тяжелой цепи нейрофиламентов
- PS-1 – Presenilin-1, пресенилин-1
- S100β– S100 calcium-binding protein B, кальций-связывающий белок S100β
- SBDPs – Spectrin breakdown products, продукты распада спектрина
- SNTF – N-terminal proteolytic fragment of spectrin, N-концевой протеолитический фрагмент спектрина
- TNF-α– Tumor necrosis factor-alpha, фактор некроза опухоли-альфа
- TREM-2 – Triggering receptor expressed on myeloid cells 2, триггерный рецептор, экспрессированныйна миелоидных клетках 2
- UCH-L1 – Ubiquitin Carboxyl-terminal Hydrolase L1, убиквитин карбокси-концевая гидролаза L1
- АФК – активные формы кислорода
- ГЭБ – гематоэнцефалический барьер
- ДНК – дезоксирибонуклеиновая кислота
- КТ – компьютерная томография
- ЦНС – центральная нервная система
- ЧМТ – черепно-мозговая травма
Своевременное установление диагноза при острых или хронических заболеваниях центральной нервной системы (ЦНС) во многом определяет раннюю диагностику и дальнейшую тактику лечения. В настоящее время для установления диагноза «черепно-мозговая травма» (ЧМТ) основным клиническим инструментом является компьютерная томография (КТ). Данный метод позволяет оценить наличие внутримозговых кровотечений, некротически-ишемических поражений и других повреждений. Однако КТ недостаточно чувствительна для выявления диффузного аксонального повреждения, в то время как метод магнитно-резонансной томографии более специфичен для такого типа травмы [1]. При этом недостатком обоих методов является невозможность регулярно оценивать текущее состояние пациента в острой фазе. Необходим поиск более чувствительных и доступных диагностических инструментов для обнаружения повреждений ЦНС, в связи с чем актуализация современных данных по потенциальным маркерам нейровоспаления имеет большую диагностическую ценность.
Биомаркеры не всегда являются объективным показателем состояния пациента, но их сочетание может раскрыть картину патологического процесса. Измерение концентрации биомаркеров в спинномозговой жидкости и плазме крови может помочь как при диагностике, так и при мониторинге заболевания и прогнозировании исходов ЧМТ и других патологий ЦНС. Как известно, исход заболевания определяется взаимодействием между процессами первичного, вторичного повреждения ткани (включающего нейровоспаление, нарушение гематоэнцефалического барьера (ГЭБ) и метаболизма) и репаративного восстановления. Нарушение регуляции этих механизмов может способствовать неблагоприятному неврологическому исходу [2]. Применение биомаркеров воспаления и повреждения нервной ткани может быть полезно в качестве перспективных методов терапии ЧМТ и других патологий ЦНС в виде: терапии на основе стволовых клеток [3][4], шаперонов как нейропротекторов [5], противовоспалительных препаратов, воздействующих на сигнальные пути нейроиммунной системы [6][7], гипербарической оксигенации [8], стабилотренинга [9], а также для мониторинга соотношения процессов нейродегенерации и нейрорегенерации, контроля нейровоспаления и оценки эффективности лечения [10].
Некоторые из биомаркеров нейровоспаления были одобрены для клинического использования. Так, кальций-связывающий белок S100β (S100 calcium-binding protein B, S100β) рекомендуется к применению в скандинавских клинических рекомендациях по лечению пациентов с нейротравмой [11], а комбинированная панель убиквитин карбокси-концевой гидролазы L1(Ubiquitin Carboxyl-terminal Hydrolase L1, UCH-L1) и глиального фибриллярного кислого белка (Glial Fibrillary Acidic Protein, GFAP) была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) для использования при диагностике низкого риска внутричерепного повреждения, что снижает необходимость в экстренном проведении КТ [12].
Цель данного обзора – рассмотреть и сравнить современные сообщения об исследованиях биомаркеров нейровоспаления и повреждения нервной ткани при различных патологиях ЦНС, описать происхождение, прогностическую и диагностическую значимость наиболее изученных биомаркеров. Для обзора были преимущественно использованы материалы статей, опубликованных в период с 2018 по 2023 год в базах данных Google Scholar, PubMed, eLibrary, RusMed, включающие данные о связи тех или иных маркеров нейровоспаления с развитием острых и хронических патологий ЦНС.
МЕХАНИЗМ РАЗВИТИЯ НЕЙРОВОСПАЛЕНИЯ
Воспалительный процесс в ЦНС значительно отличается от такового в периферических тканях, так как ГЭБ затрудняет проникновение макрофагов из крови в нервную ткань головного и спинного мозга, в которой основными клетками, контролирующими иммунный ответ, являются микроглиоциты. Кроме ключевой роли в развитии нейровоспаления микроглия, в частности ее амебоидный тип, на этапе формирования мозга вплоть до раннего постнатального периода регулирует развитие и перестройку нервной ткани за счет фагоцитарной активности. Покоящийся зрелый тип микроглии участвует в процессах запоминания и обучения, модулируя силу синаптических структур, а также разрушает избыточные синапсы [13]. При повреждении нервной ткани, в присутствии патогенов, нейротоксинов, при стрессовой стимуляции, инфекциях или травмах, покоящаяся микроглия активируется и переходит в реактивную. Этот процесс характеризуется усилением экспрессии молекул межклеточной адгезии, реорганизацией цитоскелета, увеличением клетки в размерах, и в результате микроглиоцит приобретает свойства макрофага. В результате здоровые нейроны могут подвергаться фагоцитозу или действию секретируемых факторов апоптоза. Одновременно с этим происходят пролиферация микроглии, удлинение отростков, формирование узелков в мелких очагах поражения, скопление микроглиоцитов вокруг тел погибающих нейронов и их фагоцитоз [14]. Реактивная микроглия реализуется по аналогии с макрофагами в дихотомических субпопуляциях, из которых дифференцируют М1-фенотип, продуцирующий провоспалительные цитокины: фактор некроза опухоли-альфа (Tumor necrosis factor-alpha, TNF-α) и интерлейкины 6 и 1β (Interleukin-6, IL-6; Interleukin-1β, IL-1β), и М2-тип – противовоспалительные. M1-опосредованная продукция цитокинов способствует увеличению проницаемости ГЭБ [15].
При нейровоспалении одна и та же клетка плавно переходит от «провоспалительного» к «противовоспалительному» фенотипу (рис., блок В). Клетки микроглии продуцируют инсулиноподобный фактор роста 1 (Insulin-like Growth Factor-1, IGF-1), участвующий в нейрогенезе, и обладающий нейропротекторным действием хемокиновый лиганд 10 к рецептору с повтором цистеин-вставка (X)-цистеин (C-X-C Motif Chemokine Ligand 10, CXCL10), индуцированный белок дифференцировки клеток миелоидного лейкоза-1 (Induced myeloid leukemia cell differentiation protein-1, MCL1) и белки сывороточного амилоида А (Serum amyloid A, SAA) (рис., блок В) [16]. Клетки микроглии при хроническом нейровоспалении могут оставаться активированными в течение длительного времени, выделяя цитокины и нейротоксические молекулы, которые способствуют долгосрочной нейродегенерации [17].
На повреждение реагирует не только микроглия, но и другие глиальные клетки: после травматического повреждения нервной ткани астроциты претерпевают фенотипический сдвиг, известный как реактивный астроглиоз, который характеризуется гипертрофией и гиперплазией клеток [18]. Астроциты реагируют по A1 типу (нейротоксичные) и A2 типу (прорегенеративные), секретируя различные цитокины (TNF-α, IL-6, IL-1β), хемокиновые лиганды CXCL1, CXCL10, лиганды 2, 3, 5 к рецепторам с повторами сдвоенного цистеина (C-C motif ligand 2, CCL2; C-C motif ligand 3, CCL3; C-C motif ligand 5, CCL5), а также активные формы кислорода (АФК) и аденозинтрифосфат (АТФ), которые усиливают активацию микроглии (рис., блок В) [18][19]. Роль нейровоспаления двояка: с одной стороны, оно выполняет нейропротекторную функцию, изолируя участок повреждения глиальным рубцом, способствуя репарации и функциональному восстановлению мозга [20]; с другой стороны, нейродеструктивную, вызывая гибель нейронов не только в центре повреждения, но и за его пределами. Протеогликаны хондроитина и кератинсульфата, продуцируемые реактивными астроцитами в глиальных рубцах, ингибируют аксональный рост и нарушают функциональное восстановление ткани [21]. Нейровоспаление состоит из огромного количества последовательных биохимических реакций, и при нарушении какого-либо звена в этой цепи возможно ухудшение состояния пациента, развитие неблагоприятного неврологического исхода [22].
Механизм развития нейровоспаления патогенетически схож при травмах и заболеваниях различной этиологии, что позволяет выделить ряд специфических и неспецифических биомаркеров. В связи с повышенной проницаемостью ГЭБ и гематоликворного барьера при нейровоспалении маркеры в большом количестве попадают в системный кровоток, что облегчает диагностику. На основе данных об их уровне и соотношении в крови можно корректировать терапию и прогнозировать неврологический исход [23]. Несмотря на универсальность биохимических процессов нейровоспаления, при диагностике отдельных неврологических заболеваний ценность имеют свойственные для конкретной патологии маркеры.
В данной статье рассмотрены биомаркеры, характерные для ЧМТ. Их можно разделить на несколько групп: цитокины, нейроспецифические белки и продукты их протеолиза, маркеры окислительного стресса, матриксные металлопротеиназы, некоторые эндокринные показатели.
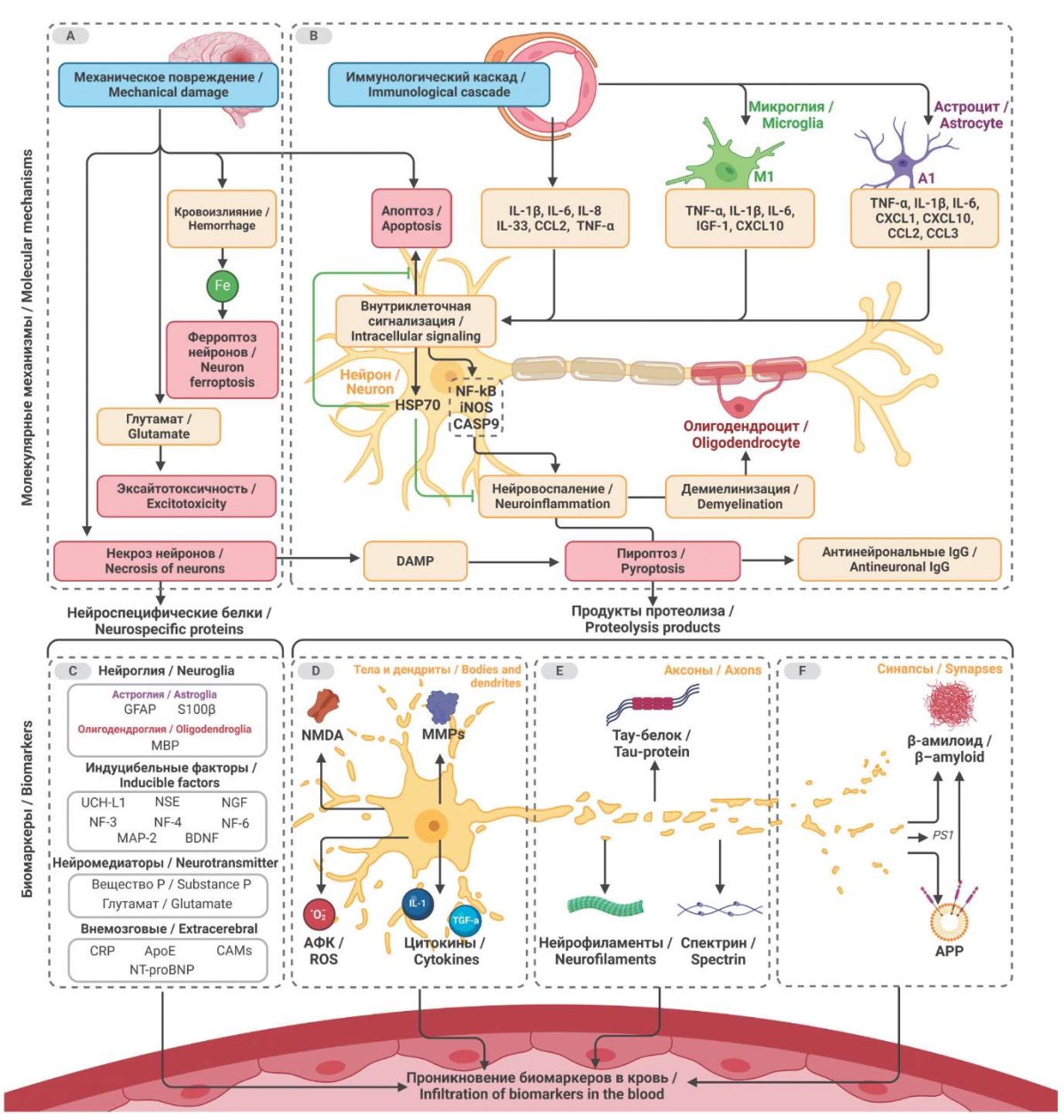
РИС. На схеме показаны молекулярные механизмы патологии нервных клеток и вовлеченных в канонические каскады компонентов их микроокружения, микроглии и астроцитов, при двух стратегиях развития повреждения (обозначены синим): механическом, например вследствие травмы или геморрагического инсульта, и иммуноспецифическом, например при инфекции. Взаимосвязь этих процессов приводит к различным видам гибели нейрона с последующей инфильтрацией патогномоничных биологических маркеров в кровь (промежуточные этапы обозначены желтым, исходы – красным). Разрушение нейронов при травмах приводит к активации как индукторов, так и ингибиторов процессов клеточной дегенерации. В качестве индукторов на схеме представлены набор провоспалительных цитокинов, которые могут выступать как молекулы, ассоциированные с повреждением (damage-associated molecular patterns, DAMP), рецепторно-опосредованно активирующие сборку инфламмасом криопирина (NLRP3) или пути пироптоза и апоптоза. Эритроцитарный выпад при диапедезе сосудов приводит к высвобождению железа и запуску ферроптоза. Высвобождение дополнительного пула глутамата при клеточном шоке усложняет процесс и приводит к эксайтотоксичности. Эти молекулы, их клеточные агенты, продукты распада и антитела к внутриклеточным и внеклеточным компонентам клетки могут служить биомаркерами патологического процесса и указывать на этиологию, степень, характер и прогноз заболевания. С другой стороны, есть молекулы, выполняющие роль молекулярного рычага, решающего, вступать ли клетке на путь программируемой смерти или нет. Такими факторами являются белки теплового шока 70 (heat shock proteins 70, HSP70). Если для клеток повреждение незначительное, то белки теплового шока блокируют экспрессию и активацию проапоптотических и провоспалительных факторов.
FIG. Molecular mechanisms of pathology of nerve cells and their microenvironment (microglia and astrocytes) involved into canonical cascades of two strategies (indicated in blue): mechanical, e.g., as a consequence of trauma or hemorrhagic stroke, and immune-specific, e.g., in case of infection. The relationship between these processes leads to different types of neuronal death with the subsequent infiltration of pathognomonic biological markers into the blood (intermediate stages are marked in yellow, outcomes in red). The destruction of neurons during injuries leads to the activation of inducers and inhibitors of cell degeneration processes. A set of proinflammatory cytokines that can act as damage-associated molecules (DAMP), receptor-mediated, activating NLRP3 inflammasome assembly or the pyroptosis and apoptosis pathways are represented in the scheme. Erythrocyte prolapse during vascular diapedesis leads to iron release and triggers ferroptosis. The release of an additional pool of glutamate during cellular shock complicates the process and leads to excitotoxicity. These molecules, their cellular agents, degradation products and antibodies to intracellular and extracellular components of the cell can serve as biomarkers of the pathologic process and can indicate the etiology, extent, nature and prognosis of the disease. On the other hand, there are molecules that act as a molecular switch that decides whether a cell should enter the path of programmed death or not. Such factors are heat shock proteins 70 (HSP70). If damage to cells is insignificant, heat shock proteins block the expression and activation of proapoptotic and proinflammatory factors.
Примечание: Fe – Ferrum, железо; IL – interleukin, интерлейкин; CCL– C-C Motif Chemokine Ligand, хемокиновый лиганд к рецептору с повтором сдвоенного цистеина; TNF-α – tumor necrosis factor-alpha, фактор некроза опухоли-альфа; IGF-1 – insulin-like Growth Factor-1, инсулиноподобный фактор роста 1; CXCL – C-X-C Motif Chemokine Ligand, хемокиновый лиганд к рецептору с повтором цистеин-вставка (X)-цистеин; HSP70 – heat shock proteins 70 kDA, белки теплового шока массой 70 кДа; NF-kB – nuclear factor kappa-B, ядерный фактор каппа-би; iNOS – inducible nitric oxide synthase, индуцибельная синтаза оксида азота; CASP9 – caspase-9, каспаза 9; IgG –immunoglobulin G, иммуноглобулин G; GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок; S100β – S100 calcium-binding protein B, кальций-связывающий белок S100β; MBP – myelin basic protein, основной миелиновый белок; UCH-L1 – ubiquitin carboxyl-terminal hydrolase L1, убиквитин карбокси-концевая гидролаза L1; NSE – neuron-specific enolase, γ-енолаза; NGF – nerve growth factor, фактор роста нейронов; NFs – neurofilaments, нейрофиламенты; MAP-2 – Microtubule-associated protein 2, микротубуло-ассоциированный протеин-2; BDNF – Brain-derived neurotrophic factor, нейротрофический фактор мозга; CRP – C-reactive protein, С-реактивный белок; ApoE – Apolipoprotein E, Аполипопротеин E; CaMs – Cellular adhesion molecules, молекулы клеточной адгезии; NT-proBNP – N-Terminal Pro-Brain Natriuretic Peptide, мозговой натрийуретический пептид; NMDA – N-methyl-D-aspartate, N-метил-D-аспартат; MMPs – matrix metalloproteinase, матриксные металлопротеиназы; O2 – кислород; АФК – активные формы кислорода; TGF-α -transforming growth factor alpha, трансформирующий фактор роста альфа; PS1 – presenilin-1, пресенилин-1; APP – amyloid precursor protein, белок-предшественник амилоида.
Note: Fe – Ferrum; IL – interleukin; CCL– C-C Motif Chemokine Ligand; TNF-α – tumor necrosis factor-alpha; IGF-1 – insulin-like Growth Factor-1; CXCL – C-X-C Motif Chemokine Ligand; HSP70 – heat shock proteins 70 kDA; NF-kB – nuclear factor kappa-B; iNOS – inducible nitric oxide synthase; CASP9 – caspase-9; IgG –Immunoglobulin G; GFAP – glial fibrillary acidic protein; S100β – S100 calcium-binding protein B; MBP – myelin basic protein; UCH-L1 – ubiquitin carboxyl-terminal hydrolase L1; NSE – neuron-specific enolase; NGF – nerve growth factor; NFs – neurofilaments; MAP-2 – Microtubule-associated protein 2; BDNF – Brain-derived neurotrophic factor; CRP – C-reactive protein; ApoE – apolipoprotein E; CaMs – Cellular adhesion molecules; NT-proBNP – N-Terminal Pro-Brain Natriuretic Peptide; NMDA – N-methyl-D-aspartate; MMPs – matrix metalloproteinase; O2 – oxygen; ROS – reactive oxygen species; TGF-α -transforming growth factor alpha; PS1 – presenilin-1; APP – amyloid precursor protein.
ОБЩИЕ МАРКЕРЫ НЕЙРОВОСПАЛЕНИЯ
Цитокины
Цитокины – обширная группа белковых молекул, секретируемых при нейровоспалении активированной микроглией, астроцитами и макрофагами. Цитокины являются основными регуляторами воспаления, поэтому на основании изменения их концентрации в ликворе и периферической крови можно осуществлять уточняющую оценку состояния пациента. В качестве биомаркеров используются провоспалительные цитокины: амфотерин (High-Mobility Group Protein B1, HMGB1), IL-1β, IL-6, IL-8, IL-33, CCL-2, TNF-α, фактор торможения миграции макрофагов (Macrophage migration inhibitory factor, MIF), и противовоспалительный IL-10 (рис., блок В). При нейровоспалении также может повышаться уровень трансформирующего фактора роста-β (Transforming growth factor beta, TGF-β), увеличение концентрации которого связано с поступлением фибриногена в нервную ткань из-за нарушения целостности ГЭБ [24].
HMGB1 является одним из самых ранних факторов, характеризующих травму, и выступает инициатором нейровоспаления [25][26]. В физиологических условиях негистоновый ДНК-связывающий белок HMGB1 участвует в координации транскрипции генов. При ЧМТ он функционирует как молекулярный фрагмент, ассоциированный с повреждениями (Damage Associated Molecular Patterns, DAMP). Высвобождаясь из поврежденных нейронов и других клеток, он связывается с соответствующими рецепторами-мишенями, способствуя выработке других провоспалительных цитокинов [25]. Известно, что высокие показатели HMGB1 в спинномозговой жидкости связаны с неблагоприятным исходом после ЧМТ у детей, а его пиковые уровни обратно коррелируют с показателями по шкале исходов Глазго через 6 месяцев после ЧМТ [26]. HMGB1 также активируется экзогенными молекулами, в частности липополисахаридом, который является неотъемлемым компонентом клеточной стенки грамотрицательных бактерий и мощным индуктором воспалительных каскадов. HMGB1-зависимый путь ответственен за активацию каспазы-1 и сборку неканонических инфламмасом, исходом чего становится развитие пироптоза (рис., блок В).
IL-33, секретируемый нейроглией, представляет собой потенциальный маркер нейровоспаления и служит эндогенным сигналом о повреждении ткани [27]. Его роль заключается в активации микроглии и макрофагов и стимуляции высвобождении хемокинов. F. Olde Heuvel и соавт. показали, что при ЧМТ происходит повышение уровня IL-33 наряду с другими цитокинами: IL-1β, IL-38, TNF-α, интерферона альфа (IFN-α) и IL-19 через 3 часа после травмы [28].
Доказана зависимость между повышением уровня IL-1β, IL-6 в сыворотке крови и ликворе и выраженностью отека мозга, ухудшением состояния пациентов в остром периоде ЧМТ и неблагоприятным неврологическим исходом через 6 месяцев после травмы [29][30]. Концентрация провоспалительных цитокинов TNF-α, IL-8, интерферона гамма (IFN-γ) в сыворотке крови значимо увеличивается при тяжелой ЧМТ [31][32], как и уровень противовоспалительных цитокинов (IL-10), однако соотношение этих веществ может меняться в зависимости от прошедшего после ЧМТ времени [33].
Использование цитокинов в качестве биомаркеров целесообразно, поскольку они являются динамичным показателем: период полувыведения цитокинов из системного кровотока составляет несколько минут. Однако данные о корреляции цитокинов с другими типами биомаркеров, а также со степенью тяжести ЧМТ противоречивы, а использование этих веществ в качестве маркеров нейровоспаления неоднозначно. Цитокины обладают плейотропностью, существует большое количество их дублирующих и антагонизирующих цепей. Концентрация цитокинов может повышаться при периферическом воспалении, не затрагивающем нервную ткань, поскольку источником этих веществ являются не только клетки глии, но и клетки иммунной системы. Поэтому при диагностике следует анализировать уровень в биологических жидкостях не одного конкретного цитокина, а сразу нескольких – провоспалительных и противовоспалительных.
Нейроспецифические белки
Наличие в периферической крови или ликворе нейроспецифических протеинов, таких как S100β, нейронспецифической енолазы (Neuron-specific enolase, NSE), основного миелинового белка (myelin basic protein, MBP), GFAP, нейротрофического фактора мозга (Brain-derived neurotrophic factor, BDNF) будет указывать на проникновение чужеродных факторов через ГЭБ и повреждение нервной ткани, по их концентрации можно судить об обширности повреждения.
Белок S100β
Белок S100β относится к группе Ca2+-связывающих нейроглиальных белков, продуцируется преимущественно астроцитами и при повреждении нервной ткани поступает в кровоток. Белок S100β выполняет нейропротекторную функцию, участвует в репаративных процессах, препятствует гибели нейронов и действует как фактор роста. Но при гиперэкспрессии он обладает нейротоксичностью [34]. S100β имеет короткий период полувыведения, поэтому на чувствительность биомаркера может влиять время отбора проб [35]. Маркер S100β обладает высокой точностью в качестве предиктора смертности при ЧМТ [36]. Тем не менее применение S100β ограничено, поскольку он может высвобождаться не только при травматическом повреждении ЦНС, но и при скелетной травме и значительных физических нагрузках [35].
Нейронспецифическая енолаза
NSE локализуется в клетках нейроэктодермального происхождения и является маркером нейронального повреждения. Существуют данные о корреляции уровня NSE в периферической крови с тяжестью ЧМТ [37]. В отличие от S100β, NSE имеет длительный период полувыведения (более 20 часов) [38]. NSE также экспрессируется в эритроцитах и выделяется из них при гемолизе, что является недостатком данного маркера при диагностике повреждений ЦНС [39].
Глиальный фибриллярный кислый белок
GFAP – белок цитоскелета астроцитов. При нейровоспалении наблюдается повышенный синтез протеинов различных клеточных структур астроцитов, включая цитоскелет. Появление GFAP в сыворотке крови может являться маркером повреждения ЦНС и активации астроцитов. GFAP позволяет довольно точно определить степень поражения головного мозга и является важным прогностическим фактором: согласно исследованиям, повышенные уровни GFAP и S100β в ранний период ЧМТ средней и тяжелой степени коррелируют с развитием неблагоприятного исхода спустя 6 месяцев [40][41].
Основной миелиновый белок
MBP специфичен для олигодендроцитов и входит в состав миелина. Наличие MBP в крови может свидетельствовать о травматическом аксональном и нейрональном повреждении [42]. В сыворотке крови MBP можно обнаружить через 42–78 часов после ЧМТ [37], в связи с чем его можно использовать для верификации ЧМТ спустя время, когда другие маркеры (цитокины, белок S100β, NSE) элиминируются из системного кровотока.
Убиквитин карбокси-концевая гидролаза L1
UCH-L1 ранее использовалась в качестве гистологического маркера для нейронов. Уровень UCH-L1 повышается в течение 12 часов после травмы, после чего резко снижается. Тест с совместным определением GFAP и UCH-L1 в плазме крови в течение 12 часов после ЧМТ с высокой вероятностью позволяет исключить наличие внутричерепных поражений и не назначать пациенту КТ-исследование [43], его можно также использовать и для прогнозирования неблагоприятного исхода [44].
Белки, ассоциированные с микротрубочками
Микротубуло-ассоциированный протеин-2 (Microtubule-associated protein 2, MAP-2), преимущественно встречающийся в дендритах, способствует сборке и стабилизации микротрубочек, предотвращая их деполимеризацию, а также участвует в регуляции роста нейронов и формировании нейрональной пластичности [45]. MAP-2 обладает диагностическим и прогностическим потенциалом: его уровень в спинномозговой жидкости может отражать тяжесть травмы и прогнозировать риск 2-недельной смертности у пациентов с ЧМТ и оставаться повышенным в течение 6 месяцев после травмы [46][47]. MAP-2 является надежным маркером регенерации нервной ткани, его повышенная концентрация отмечается при благоприятных исходах тяжелых ЧМТ [48].
Нейротрофины
Нейротрофинами (Neurotrophin, NT) называют группу белков, способствующих росту, развитию и выживаемости нейронов. К нейротрофинам относят BDNF, фактор роста нейронов (Nerve growth factor, NGF), нейротрофины NT-3, NT-4, NT-6. Одним из наиболее изученных нейротрофинов является BDNF. У людей, страдающих некоторыми психическими или нейродегенеративными заболеваниями, часто снижен уровень BDNF в крови. Он также снижается при нейровоспалении для поддержания интенсивности апоптоза поврежденных клеток [49]. Поскольку данное вещество участвует в восстановлении функций нервной ткани после повреждения, наблюдается прямая зависимость между концентрацией BDNF и улучшением состояния пациента при ЧМТ легкой и средней тяжести. Установлено, что у пациентов с закрытой ЧМТ повышение содержания BDNF в сыворотке крови коррелировало с уменьшением выраженности тревоги и улучшением когнитивных функций [50].
Продукты протеолиза нейроспецифических белков
Известно, что при нейровоспалении повышается активность каспазы-3 и кальпаина. Эти протеиназы являются основными факторами, вызывающими некроз и апоптоз в нервной ткани при повреждении. Некоторые нейроспецифические белки, например расщепленный тау-белок, спектрин и продукты его деградации, можно обнаружить в спинномозговой жидкости и сыворотке крови как продукты расщепления протеиназ [37][51–53].
Расщепленный тау-белок
Тау-белок преимущественно локализуется в аксонах нейронов и участвует в образовании и связывании сетей микротрубочек посредством связывания субъединиц тубулина (рис., блок E). За счет своей эластичности тау-белок позволяет микротрубочкам скользить относительно друг друга и избегать повреждения отростков при деформации. Однако слишком сильная или резкая деформация приводит к разрушению элементов цитоскелета. При повреждении клеток и активации протеаз тау-белок расщепляется на фрагменты. При многих нейродегенеративных заболеваниях происходят фосфорилирование и агрегация этих фрагментов с образованием так называемых тау-клубков, наличие которых в крови говорит о повреждении аксонов [37]. Увеличение концентрации тау-белка может являться маркером повышенного внутричерепного давления. Согласно исследованию S. Stukas и соавт., расщепленный тау-белок является надежным маркером ЧМТ, так как его уровень повышается при травме по сравнению со здоровыми людьми [51].
Спектрин и продукты его деградации
Альфа-II спектрин – компонент цитоскелета нейронов коры головного мозга. Он обнаруживается в пресинаптических окончаниях и аксонах. Данный белок является субстратом для кальций-активируемых протеиназ (кальпаин, каспаза-3). При повреждении нервной ткани содержание продуктов распада спектрина (Spectrin breakdown products, SBDPs) в цереброспинальной жидкости значительно повышается. Уровень SBDPs можно качественно и количественно определять при диагностике. Каспаза-3 и кальпаин осуществляют расщепление альфа-II-спектрина с разных концов молекулы, поэтому продукты расщепления будут различаться. Так, SBDPs145 (маркер некроза) является продуктом расщепления альфа-II-спектрина кальпаином, SBDPs120 (маркер апоптоза) – продуктом расщепления альфа-II-спектрина каспазой-3. Уровни SBDPs в спинномозговой жидкости повышаются через 24 часа после травмы, после чего показатели SBDPs120 постепенно снижаются, а уровни SBDPs145 и SBDPs150 остаются высокими до 72 часов с момента травмы [52]. N-концевой протеолитический фрагмент спектрина (N-terminal proteolytic fragment of spectrin, SNTF) – продукт распада спектрина в результате расщепления кальпаином – считают маркером диффузного аксонального повреждения [53]. SNTF обладает высокой специфичностью как диагностический маркер ЧМТ, eго концентрация повышается через час после травмы и остается устойчивой в течение 6–12 суток [53].
Белки нейрофиламентного триплета
Нейрофиламенты (Neurofilaments, NFs), структурные компоненты цитоскелета, локализующиеся в аксонах, делятся на легкие (Neurofilaments light, NF-L), средние (Neurofilaments medium, NF-M) и тяжелые (Neurofilaments heavy, NF-H). Они, соответственно, различаются по массе. Наибольшую диагностическую значимость имеют NF-H, его фрагменты можно обнаружить в ликворе и в крови. Он также может являться субстратом для протеолитических ферментов, в таком случае образуется фосфорилированная форма тяжелой цепи нейрофиламентов (Phosphorylated neurofilament heavy, pNF-H). У пациентов с закрытой ЧМТ легкой степени наблюдается устойчивое повышение уровня pNF-H в крови. Однако pNF-H является гораздо менее динамичным показателем, чем тау-белок [54] (рис., блок Е).
Амилоид-β и его предшественники
Одним из маркеров повреждения нервной ткани являются предшественники бета-амилоида (β–amyloid precursor protein, β-APP). Это трансмембранные белки, в больших количествах локализующиеся в синаптических мембранах. При нейровоспалении происходит активация белка пресенилина-1 (presenilin-1, PS-1) и образование β-амилоида (рис., блок F). Наличие β-амилоида, β-APP и PS-1 в ликворе и крови может говорить об аксональном и синаптическом повреждении [55]. Болезнь Альцгеймера связывают с появлением β-амилоидных бляшек и накоплением β-амилоида в нервной ткани [56].
Фрагменты NMDA-рецептора и антитела к нему
NMDA-рецептор – ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат (N-methyl-D-aspartate, NMDA) и состоящий из четырех субъединиц: две субъединицы NR1-подтипа, две – NR2-подтипа. Продукты протеолитического расщепления NMDA-рецептора высвобождаются в периферическую кровь при повреждении нервной ткани [57] (рис., блок D). Уровень антител к данному маркеру значительно повышается при ЧМТ. Низкий уровень антител к NR2 (NMDA) в первые 2 дня после травмы связан с низкой выживаемостью и высоким риском развития неблагоприятного исхода [58].
Вещество P
Вещество P – нейропептид из группы тахикининов, состоящий из 11 аминокислот. Высвобождаясь из нейронов при их повреждении (изменении рН, связывании лигандов, воздействии экстремальных температур и других раздражителей), вещество P может связываться с тахикининовыми рецепторами NK-клеток (natural killer cells, естественных киллеров) или других тканей либо оказывать прямое действие в качестве нейромедиатора. Повышение его уровня в крови приводит к увеличению проницаемости ГЭБ и формированию отека. Концентрация вещества P в крови возрастает через 5 часов после ЧМТ и сохраняется как минимум 24 часа после травмы, повышенные значения в течение месяца связывают с высокой летальностью [59].
Глутамат
Нейромедиатор глутамат играет роль в развитии эксайтотоксичности и последующей гибели нейронов посредством гиперактивации собственных рецепторов, что важно в патогенезе нейродегенеративных заболеваний. Его высокая концентрация при высвобождении поврежденными нейронами может вызвать их гибель путем некроза и апоптоза (рис., блок А). Повышенное содержание глутамата в крови и ликворе после ЧМТ ассоциировано с неблагоприятным прогнозом [24].
Матриксные металлопротеиназы
Матриксные металлопротеиназы (Matrix Metalloproteinase, MMP) – семейство секретируемых нейтральных протеаз, задействованных во многих физиологических и патологических процессах. Они регулируют структуру внеклеточного матрикса, доступность ростовых факторов и функционирование сигнальных систем клеточных мембран, участвуют в активации и деактивации цитокинов и хемокинов [24]. При нейровоспалении MMP участвуют в восстановлении нервной ткани, однако они обладают нейротоксичностью и способны повышать проницаемость ГЭБ, что может привести к отеку мозга. Их подразделяют на несколько типов: коллагеназы, эластазы, желатиназы, стромелизины, MMP мембранного типа. MMP-7 в сыворотке крови может рассматриваться в качестве маркера, количественно определяющего дисфункцию ГЭБ у пациентов с ЧМТ [60]. В настоящее время изучается эффективность других металлопротеиназ: MMP-10, MMP-9, MMP-2, MMP-3 в качестве маркеров нейровоспаления [61][62] (рис., блок D).
Маркеры окислительного стресса
Окислительный стресс обуславливает вторичные повреждения после ЧМТ. Основной причиной окислительного стресса является действие АФК и оксида азота. Действие АФК можно измерить после образования продуктов окисления липидов и нуклеиновых кислот, таких как 4-гидрокси-2-ноненаля (4-Hydroxynonenal, 4-HNE), изопростанов (isoprostanes, IsoPs) и малондиальдегида (malondialdehyde, MDA). Окислительный стресс повреждает нуклеиновые кислоты либо путем фрагментации ДНК, либо путем модификации и потери азотистых оснований. В качестве показателя окислительного повреждения ДНК используется 8-Гидрокси-2’-дезоксигуанозин (8-hydroxy-2’-deoxyguanosine, 8-OHdG). Оксид азота оказывает провоспалительное действие, его метаболиты (нитраты, нитриты, нитротирозин) можно обнаружить в ликворе пациентов после ЧМТ [63].
Эндокринные показатели
Основными гормонами – маркерами нейровоспаления выступают глюкокортикоиды. Они снижают выработку провоспалительных цитокинов IL-1β и TNF-α, вследствие чего завершаются процессы нейровоспаления и восстанавливается нормальная проницаемость ГЭБ. Низкий уровень глюкокортикоидов ухудшает течение и исход патологий ЦНС. Помимо прогноза при ЧМТ, современные исследования рассматривают возможность использования глюкокортикоидов для лечения хронического нейровоспаления [64].
Прочие маркеры
При прогрессировании патологического процесса в ЦНС происходит компенсаторный ответ ряда других органов и систем в виде повышения продукции не специфических для нервной ткани молекул (рис., блок С). Данные вещества необходимо рассматривать не только для уточнения степени и характера повреждения ЦНС, но и для предупреждения развития возможных осложнений на другие органы и организм в целом.
Натрийуретические пептиды
Семейство натрийуретических пептидов представлено несколькими веществами, имеющими различное происхождение. Это натрийуретический пептид A-типа, или предсердный натрийуретический пептид (Atrial Natriuretic Peptide, ANP), натрийуретический пептид B-типа, или мозговой натрийуретический пептид (Brain Natriuretic Peptide, BNP), натрий-уретический пептид C-типа (C-type Natriuretic Peptide, CNP), дендроасписный натрийуретический пептид (Dendroaspis Natriuretic Peptide, DNP) и уродилатин. Они представляют большую ценность в качестве маркеров в кардиологии, поскольку синтезируются секреторными кардиомиоцитами желудочков и предсердий, а также почечными канальцами. Однако было замечено, что все пептиды этого семейства могут секретироваться в различных отделах ЦНС. В настоящее время из всех натрийуретических пептидов наиболее информативным маркером считается BNP и его предшественник (N-Terminal Pro-Brain Natriuretic Peptide, NTpro-BNP). При повреждении нервной ткани в результате ЧМТ уровни этих маркеров в плазме крови значительно повышаются, достигая максимума на третий день после травмы [65] (рис., блок С).
C-реактивный белок
С-реактивный белок относится к пентраксинам, участвует во врожденном иммунном ответе и является стабильным биомаркером плазмы крови для выявления системного воспаления низкой интенсивности. Данный белок служит потенциальным маркером при ЧМТ: его высокий уровень в сыворотке в первые две недели после травмы связан с развитием неблагоприятного исхода через 6 месяцев [66]. Тем не менее С-реактивный белок неспецифичен для нейровоспаления, любая другая патология, не связанная с нервной тканью, может оказывать влияние на концентрацию этого вещества в плазме [24]. Современные исследования рассматривают возможность использовать в диагностических целях комбинацию С-реактивного белка с белком S100β [67].
Аполипопротеин Е
Аполипопротеин E (Apolipoprotein E, ApoE) – полиморфный белок, выполняющий функцию транспортировки липидов в крови. Современные исследования показывают, что наличие в гене ApoE аллели эпсилон-4 может способствовать риску развития долгосрочных осложнений после ЧМТ, а также болезни Альцгеймера [68]. Однако существуют исследования, результаты которых демонстрируют отсутствие зависимости исхода ЧМТ от наличия аллели эпсилон-4 в гене ApoE [69]. Для подтверждения возможности использования ApoE в качестве маркера нейровоспаления необходимо дальнейшее изучение.
Молекулы клеточной адгезии
Молекулами клеточной адгезии (Cellular adhesion molecules, CAMs) называют белки на поверхности клеток, способствующие взаимодействию клеток разных тканей. Такие белки, как E-селектин, белок сосудистой адгезии-1 (Vascular Adhesive Protein-1, VAP-1), молекула адгезии сосудистого эндотелия 1-го типа (Vascular cell adhesion molecule 1, VCAM-1), молекула межклеточной адгезии 1-го типа (Inter-Cellular Adhesion Molecule 1, ICAM-1), антиген макрофага-1 (Macrophage-1 antigen, Mac-1 ) и ассоциированный с функцией лимфоцитов антиген-1 (Lymphocyte function-associated antigen 1, LFA-1), способствуют прохождению лейкоцитов через ГЭБ [70]. Увеличение экспрессии этих белков говорит о процессах нейровоспаления.
Белки теплового шока
Белки теплового шока, являясь шаперонами, выполняют в первую очередь защитную функцию, и активация их экспрессии служит компенсаторным механизмом ответа при воспалении, отравлении, инфекциях, гипоксии, голоде, воздействии других стрессовых факторов [71] (рис., блок В). Выявлено участие этих белков в реакциях презентации антигенов [72]. Повышение экспрессии белка теплового шока 70 (Heat shock protein 70, HSP70) происходит в течение 48 часов после ЧМТ [73]. Экспрессия этих белков также может усиливаться при других повреждениях ЦНС, например при рассеянном склерозе [74], поэтому в качестве специфичных биомаркеров нейровоспаления при ЧМТ использование белков теплового шока затруднено.
МАРКЕРЫ НЕЙРОВОСПАЛЕНИЯ ПРИ ОТДЕЛЬНЫХ ПАТОЛОГИЯХ ЦНС
Процесс нейровоспаления универсален, так как его основным механизмом является активация глиальных клеток. Описанные маркеры могут быть использованы для диагностики и прогнозирования течения не только ЧМТ, но и других патологий ЦНС: эпилепсии, психических и нейродегенеративных заболеваний, последствий гипоксии [75–78].
Болезнь Альцгеймера
Предполагается, что нейровоспаление играет значительную роль в патогенезе болезни Альцгеймера: сверхактивированные клетки микроглии и астроглии вырабатывают цитотоксины, способствующие нейродегенерации и отложению β-амилоида в головном мозге в результате расщепления белка – предшественника амилоида (amyloid precursor protein, APP) [79], а также нейрофибриллярных клубков, образующихся вследствие гиперфосфорилирования тау-протеина [80]. Для болезни Альцгеймера характерно повышение TNF, NF-L, тау-протеина и его фосфорилированной формы, снижение концентрации BDNF в плазме крови [81], повышенный уровень в крови известного как кластерин аполипопротеина J (apolipoprotein J, ApoJ). Это вещество ассоциировано с нейродегенеративными процессами, его уровни коррелируют со степенью атрофии гиппокампа. Кластерин действует как шаперон для внеклеточных белков, включая амилоид [81]. Об активном амилоидогенезе также говорит повышение уровня изоформы амилоида A42 в спинномозговой жидкости и плазме крови [56][81][82]. Соотношение амилоидов Aβ42/Aβ40 обратно пропорционально количеству церебральных амилоидных β-бляшек, а концентрации общего и фосфорилированного тау-белка коррелируют с интенсивностью нейродегенерации [82].
Рассеянный склероз
При рассеянном склерозе происходит высвобождение большого количества провоспалительных хемокинов и цитокинов, патологическая активация микроглии и астроцитов, что приводит к прогрессирующей нейродегенерации [83]. В качестве прогностических маркеров при рассеянном склерозе были предложены GFAP и растворимая форма триггерного рецептора, экспрессированного на миелоидных клетках 2 (Triggering receptor expressed on myeloid cells 2, TREM-2) [83][84]. TREM-2 является поверхностным рецептором микроглиоцитов, его концентрация в цереброспинальной жидкости свидетельствует об активности микроглии. Концентрация TREM-2 и GFAP в спинномозговой жидкости повышена у пациентов с рассеянным склерозом [83].
При рассеянном склерозе также наблюдаются повышенные уровни легких цепей нейрофиламента в спинномозговой жидкости и сыворотке крови, а также высокие показатели β-тубулина, NSE, миелин-олигодендроцитарного гликопротеина (Myelin oligodendrocyte glycoprotein, MOG), APP, MBP, G-индекса иммуноглобулина (соотношение IgG к альбумину в спинномозговой жидкости по сравнению с таковым в сыворотке) [74–76]. С более быстрым прогрессированием рассеянного склероза связаны высокие уровни GFAP, тау-белка и белка 14-3-3 в спинномозговой жидкости [83][84].
ЗАКЛЮЧЕНИЕ
Молекулярные факторы нейровоспаления прогностически важны при ведении травматических и органических повреждений нервной ткани. В последнее время отмечен бурный рост научно-практического применения подобных факторов. В данной статье рассмотрены наиболее изученные биомаркеры при ЧМТ, рассеянном склерозе и болезни Альцгеймера: нейротрофины, вещество P, глутамат, белки теплового шока, основной миелиновый белок и др. Следует отметить, что многие из них, например нейронспецифическая енолаза, белок S100β, С-реактивный белок, натрийуретические пептиды и белки, ассоциированные с микротрубочками, уже достаточно активно используются в качестве вспомогательных средств при принятии клинических решений. Однако количество работ по изучению сочетания различных биомаркеров при прогнозах заболеваний ЦНС недостаточно. Необходимы клинические исследования на большой популяции, в ходе которых пациенты с ЧМТ и нейродегенеративными заболеваниями будут длительно наблюдаться у специалистов мультидисциплинарной команды, включающей неврологов, нейрохирургов, нейропсихологов, психиатров и физиотерапевтов, чтобы оценить, для каких клинических последствий биомаркеры нейровоспаления оказываются наиболее прогностически ценными.
ВКЛАД АВТОРОВ
Е.А. Кузьмин и З.В. Шамитько провели анализ литературных источников, составили текст статьи. Г.А. Пьявченко, А.А. Венедиктов, М.Ю. Иванова участвовали в доработке и редактировании рукописи. С.Л. Кузнецов осуществлял общее руководство написанием статьи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTION
Egor A. Kuzmin and Zoia V. Shamitko analyzed literature sources and compiled the text of the article. Gennadii A. Piavchenko, Artem A. Venediktov and Marina Yu. Ivanova contributed to the revision and editing of the manuscript. Sergey L. Kuznetsov provided project general guidance. All authors approved the final version of the article.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование выполнено за счет гранта Российского научного фонда № 23-25-004481
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was supported by the Russian Science Foundation, project no. 23-25-004482
1. https://rscf.ru/project/23-25-00448/ (дата обращения: 28.12.2023).
2. https://rscf.ru/project/23-25-00448/(date of application: 28.12.2023).
Список литературы
1. Benjamini D., Iacono D., Komlosh M.E., et al. Diffuse axonal injury has a characteristic multidimensional MRI signature in the human brain. Brain. 2021 Apr 12; 144(3): 800–816. https://doi.org/10.1093/brain/awaa447. PMID: 33739417; PMCID: PMC8041044
2. Song S., Hasan M.N., Yu L., et al. Microglial-oligodendrocyte interactions in myelination and neurological function recovery after traumatic brain injury. J Neuroinfl ammation. 2022 Oct 5; 19(1): 246. https://doi.org/10.1186/s12974-022-02608-6. PMID: 36199097; PMCID: PMC9533529
3. Borlongan M.C., Rosi S. Stem cell therapy for sequestration of traumatic brain injury-induced infl ammation. International Journal of Molecular Sciences. 2022 Sep 7; 23(18): 10286. https://doi.org/10.3390/ijms231810286. PMID: 36142198; PMCID: PMC9499317
4. Воронков Д.Н., Ставровская А.В., Гущина А.С. и др. Морфологическая характеристика астроцитов в ксенотрансплантанте нейрональных предшественников, полученных из индуцированных плюрипотентных стволовых клеток человека. Acta Naturae. 2022; 14(3): 100–108. https://doi.org/10.32607/actanaturae.11710. PMID: 36348713; PMCID: PMC9611864
5. Kim J.Y., Barua S., Huang M.Y., et al. Heat Shock Protein 70 (HSP70) induction: chaperonotherapy for neuroprotection after brain injury. Cells. 2020 Sep 2; 9(9): 2020. https://doi.org/10.3390/cells9092020. PMID: 32887360; PMCID: PMC7563654
6. Kalra S., Malik R., Singh G., et al. Pathogenesis and management of traumatic brain injury (TBI): role of neuroinfl ammation and anti-infl ammatory drugs. Infl ammopharmacology. 2022 Aug; 30(4): 1153–1166. https://doi.org/10.1007/s10787-022-01017-8. Epub 2022 Jul 8. PMID: 35802283; PMCID: PMC9293826
7. Hu J., Wang X., Chen X., et al. Hydroxychloroquine attenuates neuroinfl ammation following traumatic brain injury by regulating the TLR4/NF-κB signaling pathway. J Neuroinfl ammation. 2022 Mar 28; 19(1): 71. https://doi.org/10.1186/s12974-022-02430-0. PMID: 35346242; PMCID: PMC8961949
8. Lu Y., Zhou X., Cheng J., Ma Q. Early intensifi ed rehabilitation training with hyperbaric oxygen therapy improves functional disorders and prognosis of patients with traumatic brain injury. Advanced Wound Care (New Rochelle). 2021 Dec; 10(12): 663– 670. https://doi.org/10.1089/wound.2018.0876. Epub 2019 Mar 15. PMID: 34546088; PMCID: PMC8568788
9. Бофанова Н.С., Артюшина Н.В., Долгова Ю.Е., Алехина Е.В. Стабилотренинг в реабилитации пациентов с последствиями черепно-мозговой травмы. Вестник новых медицинских технологий. 2021; 28(2): 21–24. https://doi.org/10.24412/16092163-2021-2-21-24
10. Wareham L.K., Liddelow S.A., Temple S., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 2022 Mar 21; 17(1): 23. https://doi.org/10.1186/s13024-022-00524-0. PMID: 35313950; PMCID: PMC8935795
11. Janigro D., Mondello S., Posti J.P., Unden J. GFAP and S100B: what you always wanted to know and never dared to ask. Front Neurol. 2022 Mar 21; 13: 835597. https://doi.org/10.3389/fneur.2022.835597. PMID: 35386417; PMCID: PMC8977512
12. Papa L., Ladde J.G., O’Brien J.F., et al. Evaluation of glial and neuronal blood biomarkers compared with clinical decision rules in assessing the need for computed tomography in patients with mild traumatic brain injury. JAMA Network Open. 2022 Mar 1; 5(3): e221302. https://doi.org/10.1001/jamanetworkopen.2022.1302. PMID: 35285924; PMCID: PMC9907341
13. Гоголева В.С., Друцкая М.С., Атретханы К.С.-Н. Микроглия в гомеостазе центральной нервной системы и нейровоспалении. Молекулярная биология. 2019; 53(5): 790–798. https://doi.org/10.1134/S0026898419050057. PMID: 31661478
14. Zheng R.Z., Lee K.Y., Qi Z.X., et al. Neuroinfl ammation following traumatic brain injury: take it seriously or not. Front Immunol. 2022 Mar 22; 13: 855701. https://doi.org/10.3389/fimmu.2022.855701. PMID: 35392083; PMCID: PMC8981520
15. Saxena S., Kruys V., Vamecq J., Maze M. The role of microglia in perioperative neuroinfl ammation and neurocognitive disorders. Front Aging Neurosci. 2021 May 28; 13: 671499. https://doi.org/10.3389/fnagi.2021.671499. PMID: 34122048; PMCID: PMC8193130 16. Chen Z., Trapp B.D. Microglia and neuroprotection. J Neurochem. 2016 Jan;136 Suppl 1:10–17. https://doi.org/10.1111/jnc.13062. Epub 2015 Mar 10. PMID: 25693054
16. Shabab T., Khanabdali R., Moghadamtousi S.Z., et al. Neuroinfl ammation pathways: a general review. Int J Neurosci. 2017 Jul; 127(7): 624–633. https://doi.org/10.1080/00207454.2016.1212854. Epub 2016 Aug 9. PMID: 27412492
17. Hart C.G., Karimi-Abdolrezaee S. Recent insights on astrocyte mechanisms in CNS homeostasis, pathology, and repair.
18. J Neurosci Res. 2021 Oct; 99(10): 2427–2462. https://doi.org/10.1002/jnr.24922. Epub 2021 Jul 14. PMID: 34259342
19. Yu G., Zhang Y., Ning B. Reactive astrocytes in central nervous system injury: subgroup and potential therapy. Front Cell Neurosci. 2021 Dec 23; 15: 792764. https://doi.org/10.3389/fncel.2021.792764. PMID: 35002629; PMCID: PMC8733560
20. Карчевская А.Е., Паюшина О.В., Шарова Е.В. и др. Нейровоспаление как процесс вторичного повреждения при черепно-мозговой травме. Анналы клинической и экспериментальной неврологии. 2023; 17(1): 55–68. https://doi.org/10.54101/ACEN.2023.1.7
21. Okada S., Hara M., Kobayakawa K., et al. Astrocyte reactivity and astrogliosis after spinal cord injury. Neurosci Res. 2018 Jan; 126: 39–43. https://doi.org/10.1016/j.neures.2017.10.004. Epub 2017 Oct 17. PMID: 29054466
22. Lyman M., Lloyd D.G., Ji X., et al. Neuroinfl ammation: the role and consequences. Neurosci Res. 2014 Feb; 79: 1–12. https://doi.org/10.1016/j.neures.2013.10.004. Epub 2013 Oct 19. PMID: 24144733
23. DiSabato D.J., Quan N., Godbout J.P. Neuroinfl ammation: the devil is in the details. J Neurochem. 2016 Oct; 139 Suppl 2(Suppl 2): 136–153. https://doi.org/10.1111/jnc.13607. Epub 2016 May 4. PMID: 26990767; PMCID: PMC5025335
24. Зудова А.И., Сухоросова А.Г., Соломатина Л.В. Черепномозговая травма и нейровоспаление: обзор основных биомаркеров. Acta Biomedica Scientifi ca. 2020; 5(5): 60–67. https://doi.org/10.29413/ABS.2020-5.5.8
25. Manivannan S., Marei O., Elalfy O., Zaben M. Neurogenesis after traumatic brain injury – the complex role of HMGB1 and neuroinfl ammation. Neuropharmacology. 2021 Feb 1; 183: 108400. https://doi.org/10.1016/j.neuropharm.2020.108400. Epub 2020 Nov 13. PMID: 33189765
26. Paudel Y.N., Angelopoulou E., Piperi C., et al. HMGB1-mediated neuroinfl ammatory responses in brain injuries: potential mechanisms and therapeutic opportunities. Int J Mol Sci. 2020 Jun 29; 21(13): 4609. https://doi.org/10.3390/ijms21134609. PMID: 32610502; PMCID: PMC7370155
27. Erenler A.K., Baydin A. Interleukin-33 (IL-33) as a diagnostic and prognostic factor in traumatic brain injury. Emerg Med Int. 2020 Jan 10; 2020: 1832345. https://doi.org/10.1155/2020/1832345. PMID: 32399302; PMCID: PMC7199602
28. Olde Heuvel F., Holl S., Chandrasekar A., et al. STAT6 mediates the effect of ethanol on neuroinfl ammatory response in TBI. Brain Behav Immun. 2019 Oct; 81: 228–246. https://doi.org/10.1016/j.bbi.2019.06.019. Epub 2019 Jun 15. PMID: 31207335
29. Nwachuku E.L., Puccio A.M., Adeboye A., et al. Time course of cerebrospinal fl uid infl ammatory biomarkers and relationship to 6-month neurologic outcome in adult severe traumatic brain injury. Clin Neurol Neurosurg. 2016 Oct; 149: 1–5. https://doi.org/10.1016/j.clineuro.2016.06.009. Epub 2016 Jun 27. PMID: 27450760
30. Sun Y., Bai L., Niu X., et al. Elevated serum levels of infl ammation-related cytokines in mild traumatic brain injury are associated with cognitive performance. Front Neurol. 2019 Oct 23; 10: 1120. https://doi.org/10.3389/fneur.2019.01120. PMID: 31708858; PMCID: PMC6819507
31. Yu Z., Jiang N., Su W., Zhuo Y. Necroptosis: a novel pathway in neuroinfl ammation. Front Pharmacol. 2021 Jul 12; 12: 701564. https://doi.org/10.3389/fphar.2021.701564. PMID: 34322024; PMCID: PMC8311004
32. Daoud H., Alharfi I., Alhelali I., et al. Brain injury biomarkers as outcome predictors in pediatric severe traumatic brain injury. Neurocrit Care. 2014 Jun; 20(3): 427–435. https://doi.org/10.1007/s12028-013-9879-1. PMID: 23943317
33. Дюкарев В.В., Юдина С.М., Кравчук А.Д. Состояние факторов врожденного иммунитета у больных с тяжелой черепно-мозговой травмой. Курский научно-практический вестник «Человек и его здоровье». 2019; (1): 70–76. https://doi.org/10.21626/vestnik/2019-1/08
34. Balança B., Desmurs L., Grelier J., et al. DAMPs and RAGE pathophysiology at the acute phase of brain injury: an overview. Int J Mol Sci. 2021 Feb 28; 22(5): 2439. https://doi.org/10.3390/ijms22052439. PMID: 33670976; PMCID: PMC7957733
35. Oris C., Kahouadji S., Durif J., et al. S100B, actor and biomarker of mild traumatic brain injury. Int J Mol Sci. 2023 Apr 1; 24(7): 6602. https://doi.org/10.3390/ijms24076602. PMID: 37047574; PMCID: PMC10095287
36. Golden N., Mahadewa T.G.B., Aryanti C., Widyadharma I.P.E. S100B serum level as a mortality predictor for traumatic brain injury: a meta-analysis. Open Access Maced J Med Sci. 2018 Nov 15; 6(11): 2239–2244. https://doi.org/10.3889/oamjms.2018.432. PMID: 30559895; PMCID: PMC6290435
37. Ganeshalingham A., Beca J. Serum biomarkers in severe paediatric traumatic brain injury-a narrative review. Transl Pediatr. 2021 Oct; 10(10): 2720–2737. https://doi.org/10.21037/tp-20-386. PMID: 34765496; PMCID: PMC8578762
38. Park D.W., Park S.H., Hwang S.K. Serial measurement of S100B and NSE in pediatric traumatic brain injury. Childs Nerv Syst. 2019 Feb; 35(2): 343–348. https://doi.org/10.1007/s00381-018-3955-y. Epub 2018 Aug 31. PMID: 30171330
39. Wang K.K., Yang Z., Zhu T., et al. An update on diagnostic and prognostic biomarkers for traumatic brain injury. Expert Rev Mol Diagn. 2018 Feb; 18(2): 165–180. https://doi.org/10.1080/14737159.2018.1428089. Epub 2018 Jan 23. PMID: 29338452; PMCID: PMC6359936
40. Abdelhak A., Foschi M., Abu-Rumeileh S., et al. Blood GFAP as an emerging biomarker in brain and spinal cord disorders. Nat Rev Neurol. 2022 Mar; 18(3): 158–172. https://doi.org/10.1038/s41582-021-00616-3. Epub 2022 Feb 3. PMID: 35115728
41. Frankel M., Fan L., Yeatts S.D., et al. Association of very early serum levels of S100B, glial fi brillary acidic protein, ubiquitin C-terminal hydrolase-L1, and spectrin breakdown product with outcome in ProTECT III. J Neurotrauma. 2019 Oct 15; 36(20): 2863–2871. https://doi.org/10.1089/neu.2018.5809. Epub 2019 Jul 9. PMID: 30794101; PMCID: PMC6761588
42. Kim H.J., Tsao J.W., Stanfi ll A.G. The current state of biomarkers of mild traumatic brain injury. JCI Insight. 2018 Jan 11; 3(1): e97105. https://doi.org/10.1172/jci.insight.97105. PMID: 29321373; PMCID: PMC5821170
43. Bazarian J.J., Biberthaler P., Welch R.D., et al. Serum GFAP and UCH-L1 for prediction of absence of intracranial injuries on head CT (ALERT-TBI): a multicentre observational study. Lancet Neurol. 2018 Sep; 17(9): 782–789. https://doi.org/10.1016/S1474-4422(18)30231-X. Epub 2018 Jul 24. PMID: 30054151
44. Korley F.K., Jain S., Sun X., et al. Prognostic value of day-of-injury plasma GFAP and UCH-L1 concentrations for predicting functional recovery after traumatic brain injury in patients from the US TRACK-TBI cohort: an observational cohort study. Lancet Neurol. 2022 Sep; 21(9): 803–813. https://doi.org/10.1016/S1474-4422(22)00256-3. PMID: 35963263; PMCID: PMC9462598
45. DeGiosio R.A., Grubisha M.J., MacDonald M.L., et al. More than a marker: potential pathogenic functions of MAP2. Front Mol Neurosci. 2022 Sep 16; 15: 974890. https://doi.org/10.3389/fnmol.2022.974890. PMID: 36187353; PMCID: PMC9525131
46. Papa L., Robicsek S.A., Brophy G.M. et al. Temporal profi le of Microtubule-Associated Protein 2: a novel indicator of diffuse brain injury severity and early mortality after brain trauma. J Neurotrauma. 2018 Jan 1; 35(1): 32–40. https://doi.org/10.1089/neu.2017.4994. Epub 2017 Nov 3. PMID: 28895474; PMCID: PMC5757083
47. Mondello S., Hayes R.L. Biomarkers. Handb Clin Neurol. Elsevier, 2015; 127: 245–265. https://doi.org/10.1016/B978-0444-52892-6.00016-7. PMID: 25702221
48. Anderson T. N., Hwang J., Munar M., et al. Blood-based biomarkers for prediction of intracranial hemorrhage and outcome in patients with moderate or severe traumatic brain injury. J Trauma Acute Care Surg. 2020 Jul; 89(1): 80–86. https://doi.org/10.1097/TA.0000000000002706. PMID: 32251265; PMCID: PMC7311234
49. Lima Giacobbo B., Doorduin J., Klein H.C., et al. Brain-Derived Neurotrophic Factor in brain disorders: focus on neuroinfl ammation. Mol Neurobiol. 2019 May; 56(5): 3295–3312. https://doi.org/10.1007/s12035-018-1283-6. Epub 2018 Aug 17. PMID: 30117106; PMCID: PMC6476855
50. Острова И.В., Голубева Н.В., Кузовлев А.Н., Голубев А.М. Прогностическая значимость и терапевтический потенциал мозгового нейротрофического фактора BDNF при повреждении головного мозга (обзор). Общая реаниматология. 2019; 15(1): 70–86. https://doi.org/10.15360/1813-9779-2019-1-70-86
51. Stukas S., Higgins V., Frndova H., et al. Characterisation of serum total tau following paediatric traumatic brain injury: a casecontrol study. Lancet Child Adolesc Health. 2019 Aug; 3(8): 558– 567. https://doi.org/10.1016/S2352-4642(19)30194-4. Epub 2019 Jun 21. PMID: 31231066
52. Chen S., Shi Q., Zheng S., et al. Role of α-II-spectrin breakdown products in the prediction of the severity and clinical outcome of acute traumatic brain injury. Exp Ther Med. 2016 May; 11(5): 2049–2053. https://doi.org/10.3892/etm.2016.3153. Epub 2016 Mar 11. PMID: 27168849; PMCID: PMC4840563
53. Siman R., Cui H., Wewerka S.S., et al. Serum SNTF, a surrogate marker of axonal injury, is prognostic for lasting brain dysfunction in mild TBI treated in the emergency department. Front Neurol. 2020 Apr 8; 11: 249. https://doi.org/10.3389/fneur.2020.00249. PMID: 32322237; PMCID: PMC7156622
54. Ковтун Н.А., Савельева М.И., Трофименко А.В. и др. Оценка потенциальных биомаркеров клеточного повреждения мозга при легких черепно-мозговых травмах. Кремлевская медицина. Клинический вестник. 2020; (4): 34–46. https://doi.org/10.26269/00k8-t921
55. Brett B.L., Gardner R.C., Godbout J., et al. Traumatic brain injury and risk of neurodegenerative disorder. Biol Psychiatry. 2022 Mar 1; 91(5): 498–507. https://doi.org/10.1016/j.biopsych.2021.05.025. Epub 2021 Jun 2. PMID: 34364650; PMCID: PMC8636548
56. Ramos-Cejudo J., Wisniewski T., Marmar C., et al. Traumatic brain injury and Alzheimer’s disease: the cerebrovascular link. EBioMedicine. 2018 Feb; 28: 21–30. https://doi.org/10.1016/j.ebiom.2018.01.021. Epub 2018 Jan 31. PMID: 29396300; PMCID: PMC5835563
57. Белозор О.С., Шуваев А.Н., Фрицлер Я.В., Шуваев А.Н. Антагонисты NMDA рецепторов как потенциальные средства для лечения нейродегенеративных заболеваний мозжечка. Анналы клинической и экспериментальной неврологии. 2022; 16(2): 58–69. https://doi.org/10.54101/ACEN.2022.2.7
58. Sorokina E.G., Semenova Z.B., Reutov V.P., et al. Brain biomarkers in children after mild and severe traumatic brain injury. Acta Neurochir Suppl. 2021; 131: 103–107. https://doi.org/10.1007/978-3-030-59436-7_22. PMID: 33839828
59. Nichols P., Urriola J., Miller S., et al. Blood-brain barrier dysfunction signifi cantly correlates with serum matrix metalloproteinase-7 (MMP-7) following traumatic brain injury. Neuroimage Clin. 2021; 31: 102741. https://doi.org/10.1016/j.nicl.2021.102741. Epub 2021 Jun 24. PMID: 34225019; PMCID: PMC8264212
60. Lima R., Simon D., Deivson W., et al. Prognostic utility of early plasma matrix metalloproteinases -2 and -9 concentrations after severe traumatic brain injury. Rev Bras Ter Intensiva. 2020 Jul-Sep; 32(3): 418–425. https://doi.org/10.5935/0103-507X.20200071. PMID: 33053032; PMCID: PMC7595721
61. Minta K., Brinkmalm G., Al Nimer F., et al. Dynamics of cerebrospinal fl uid levels of matrix metalloproteinases in human traumatic brain injury. Sci Rep. 2020 Oct 22; 10(1): 18075. https://doi.org/10.1038/s41598-020-75233-z. PMID: 33093584; PMCID: PMC7582923
62. Abdul-Muneer P.M., Chandra N., Haorah J. Interactions of oxidative stress and neurovascular infl ammation in the pathogenesis of traumatic brain injury. Mol Neurobiol. 2015; 51(3): 966–979. https://doi.org/10.1007/s12035-014-8752-3. Epub 2014 May 28. PMID: 24865512; PMCID: PMC9420084
63. Gu M., Mei X.-L., Zhao Y.-N. Sepsis and cerebral dysfunction: BBB damage, neuroinfl ammation, oxidative stress, apoptosis and autophagy as key mediators and the potential therapeutic approaches. Neurotox Res. 2021 Apr; 39(2): 489–503. https://doi.org/10.1007/s12640-020-00270-5. Epub 2020 Sep 2. PMID: 32876918
64. Hosseini Shirazi S.M., Parsian Z., Ebrahimi Bakhtavar H., Rahmani F. NT pro BNP: a factor to predict the outcome of head trauma patients. Trauma Monthly. 2022; 27(3): 479–484. https://doi.org/10.30491/tm.2022.215817.1059
65. Vink R., Gabrielian L., Thornton E. The role of substance P in se condary pathophysiology after traumatic brain injury. Front Neurol. 2017 Jun 28; 8: 304. https://doi.org/10.3389/fneur.2017.00304. PMID: 28701994; PMCID: PMC5487380
66. Xu L.B., Yue J.K., Korley F., et al. High-sensitivity C-Reactive Protein is a prognostic biomarker of six-month disability after traumatic brain injury: results from the TRACK-TBI study. J Neurotrauma. 2021 Apr 1; 38(7): 918–927. https://doi.org/10.1089/neu.2020.7177. Epub 2020 Dec 28. PMID: 33161875; PMCID: PMC7987360
67. Carabias C.S., Gomez P.A., Panero I., et al. Chitinase-3Like Protein 1, Serum Amyloid A1, C-Reactive Protein, and Procalcitonin are promising biomarkers for intracranial severity assessment of traumatic brain injury: relationship with Glasgow Coma Scale and computed tomography volumetry. World Neurosurg. 2020 Feb; 134: e120–e143. https://doi.org/10.1016/j.wneu.2019.09.143. Epub 2019 Oct 10. PMID: 31606503
68. Kim H.J., Tsao J.W., Stanfi ll A.G. The current state of biomarkers of mild traumatic brain injury. JCI Insight. 2018 Jan 11; 3(1): e97105. https://doi.org/10.1172/jci.insight.97105. PMID: 29321373; PMCID: PMC5821170
69. Maiti T.K., Konar S., Bir S., et al. Role of apolipoprotein E polymorphism as a prognostic marker in traumatic brain injury and neurodegenerative disease: a critical review. Neurosurg Focus. 2015 Nov; 39(5): E3. https://doi.org/10.3171/2015.8.FOCUS15329. PMID: 26646927
70. Geraghty J.R., Davis J.L., Testai F.D. Neuroinfl ammation and microvascular dysfunction after experimental subarachnoid hemorr hage: emerging components of early brain injury related to outcome. Neurocrit Care. 2019 Oct; 31(2): 373–389. https://doi.org/10.1007/s12028-019-00710-x. PMID: 31012056; PMCID: PMC6759381
71. Venediktov A.A., Bushueva O.Y., Kudryavtseva V.A., et al. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front Mol Neurosci. 2023 Sep 19; 16: 1230436. https://doi.org/10.3389/fnmol.2023.1230436. PMID: 37795273; PMCID: PMC10546621
72. Hagymasi A.T., Dempsey J.P., Srivastava P.K. Heat-Shock proteins. Curr Protoc. 2022 Nov; 2(11): 592. https://doi.org/10.1002/cpz1.592. PMID: 36367390
73. Li X., Pierre K., Yang Z., et al. Blood-based brain and global biomarker changes after combined hypoxemia and hemorrhagic shock in a rat model of penetrating ballistic-like brain injury. Neurotrauma Rep. 2021 Aug 12; 2(1): 370–380. https://doi.org/10.1089/neur.2021.0006. PMID: 34901937; PMCID: PMC8655796
74. Lechner P., Buck D., Sick L., et al. Serum heat shock protein 70 levels as a biomarker for infl ammatory processes in multiple sclerosis. Mult Scler J Exp Transl Clin. 2018 May 2; 4(2): 2055217318767192. https://doi.org/10.1177/2055217318767192. PMID: 29780609; PMCID: PMC5954314
75. Tomasik J., Rahmoune H., Guest P.C., Bahn S. Neuroimmune biomarkers in schizophrenia. Schizophr Res. 2016 Sep; 176(1): 3–13. https://doi.org/10.1016/j.schres.2014.07.025. Epub 2014 Aug 12. PMID: 25124519
76. Hartwig F.P., Borges M.C., Horta B.L., et al. Infl ammatory biomarkers and risk of s chizophrenia: a 2-sample Mendelian randomization study. JAMA Psychiatry. 2017 Dec 1; 74(12): 1226– 1233. https://doi.org/10.1001/jamapsychiatry.2017.3191. PMID: 29094161; PMCID: PMC6583386
77. Herron J.W., Nerurkar L., Cavanagh J. Neuroimmune biomarkers in mental illness. Curr Top Behav Neurosci. 2018; 40: 45–78. https://doi.org/10.1007/7854_2018_45. PMID: 29626340
78. Кудрявцева В.А., Кузьмин Е.А., Моисеева А.В. и др. Мо лекулярные и морфологические маркеры гибели нейронов при острых нарушениях мозгового кровообращения. Сеченовский вестник. 2022; 13(4): 18–32. https://doi.org/10.47093/2218-7332.2022.13.4.18-32
79. Uddin M.S., Kabir M.T., Mamun A.A., et al. Pharmacological approaches to mitigate neuroinfl ammation in Alzheimer’s disease. Int Immunopharmacol. 2020 Jul; 84: 106479. https://doi.org/10.1016/j.intimp.2020.106479. Epub 2020 Apr 27. PMID: 32353686
80. Dhapola R., Hota S.S., Sarma P., et al. Recent advances in molecular pathways and therapeutic implications targeting neuroinfl ammation for Alzheimer’s disease. Infl ammopharmacology. 2021 Dec; 29(6): 1669–1681. https://doi.org/10.1007/s10787021-00889-6. Epub 2021 Nov 23. PMID: 34813026; PMCID: PMC8608577
81. Altuna-Azkargorta M., Mendioroz-Iriarte M. Blood biomarkers in Alzheimer’s disease. Neurologia (Engl Ed). 2021 Nov-Dec; 36(9): 704–710. https://doi.org/10.1016/j.nrleng.2018.03.006. Epub 2020 Feb 19. PMID: 34752348
82. Graff-Radford J., Yong K.X.X., Apostolova L.G., et al. New insights into atypical Alzheimer’s disease in the era of biomarkers. Lancet Neurol. 2021 Mar; 20(3): 222–234. https://doi.org/10.1016/S1474-4422(20)30440-3. PMID: 33609479; PMCID: PMC8056394
83. Azzolini F., Gilio L., Pavone L., et al. Neuroinfl ammation is associated with GFAP and sTREM2 levels in multiple sclerosis. Biomolecules. 2022 Jan 27; 12(2): 222. https://doi.org/10.3390/biom12020222. PMID: 35204724; PMCID: PMC8961656
84. Yang J., Hamade M., Wu Q., et al. Current and future biomarkers in multiple sclerosis. Int J Mol Sci. 2022 May 24; 23(11): 5877. https://doi.org/10.3390/ijms23115877. PMID: 35682558; PMCID: PMC9180348
Об авторах
Е. А. КузьминРоссия
Кузьмин Егор Александрович, стажер-исследователь кафедры анатомии и гистологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
З. В. Шамитько
Россия
Шамитько Зоя Вадимовна, студентка
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Г. А. Пьявченко
Россия
Пьявченко Геннадий Александрович*, канд. мед. наук, доцент кафедры анатомии и гистологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. А. Венедиктов
Россия
Венедиктов Артем Андреевич, ассистент кафедры анатомии и гистологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
М. Ю. Иванова
Россия
Иванова Марина Юрьевна, канд. мед. наук, доцент кафедры анатомии и гистологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
С. Л. Кузнецов
Россия
Кузнецов Сергей Львович, член-корр. РАН, д-р мед. наук, профессор кафедры анатомии и гистологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048







































