Перейти к:
Морфологические характеристики коры головного мозга мини-свиньи в условиях генной терапии после экспериментального инсульта
https://doi.org/10.47093/2218-7332.2024.15.2.13-27
Аннотация
Цель. Изучить эффективность превентивной генной терапии (за 2 суток) и генной терапии в острую фазу (через 4 часа) ишемического инсульта у мини-свиньи с помощью аутологичного лейкоконцентрата (АутоЛК), обогащенного рекомбинантными генами сосудистого эндотелиального фактора роста (VEGF165), глиального нейротрофического фактора (GDNF) и нейрональной молекулы клеточной адгезии 1 (NCAM1), а также миграцию лейкоцитов, трансдуцированных химерным аденовирусным вектором 5 серотипа с фибером 35 серотипа (Ad5/F35) и геном зеленого флуоресцентного белка (GFP) в органы иммунной защиты.
Материалы и методы. Эксперимент проведен на 8-месячных вьетнамских вислобрюхих мини-свиньях (n = 16). Ишемический инсульт создавали путем окклюзии дистальных ветвей левой средней мозговой артерии и правой общей сонной артерии. Генетически модифицированный АутоЛК вводили превентивно внутривенно за 2 суток до или в острую фазу через 4 часа после моделирования инсульта, контрольной группе вводили 30 мл физиологического раствора. Морфологию коры мозга оценивали с помощью гистологических методов в пограничной с инфарктом и периинфарктной зонах через 21 сутки. Миграцию генетически модифицированных Ad5/F35-GFP лейкоцитов в головной мозг, селезенку, поднижнечелюстные лимфоузлы изучали через неделю после моделирования инсульта.
Результаты. В периинфарктной зоне содержание пикнотических нейронов у контрольных животных было выше, при этом количество капилляров было меньше, чем в группах генной терапии. У последних нейроны имели типичную морфологию с сохранными отростками, в контрольной группе отростки были извилисты и фрагментированы. Флуоресцентная микроскопия после введения АутоЛК с Ad5/F35-GFP выявила GFPпозитивные клетки в селезенке и поднижнечелюстных лимфатических узлах.
Заключение. Через 21 сутки после моделирования инсульта у мини-свиней на фоне превентивной генной терапии или генной терапии в острую фазу с помощью VEGF165/GDNF/NCAM1-АутоЛК установлена большая сохранность нейронов и выше плотность капилляров в периинфарктной зоне ишемического повреждения мозга. Лейкоциты с Ad5/F35-GFP обнаружены в селезенке и поднижнечелюстных лимфатических узлах.
Ключевые слова
Ишемический инсульт, в переводе с латинского «удар», известный с античных времен как апоплексия, характеризуется фокальным инфарктом головного мозга (ГМ), возникающим в результате окклюзии мозговой артерии [1]. Степень тяжести неврологической дисфункции, развивающейся в результате инсульта, зависит от калибра артерии и области мозга, вовлеченной в патологический процесс [2]. Основные подходы к лечению инсульта заключаются в восстановлении проходимости окклюзированного сосуда, сопутствующей симптоматической терапии и реабилитационных мероприятий [3]. Клетки реактивной нервной ткани вокруг первичного очага необратимых нарушений, так называемая ишемическая полутень, или пенумбра, сохраняют жизнеспособность в течение терапевтического окна длительностью 3–6 часов [4]. Лечения, направленного на стимуляцию нейропластичности мозга и минимизацию объема развивающихся необратимых повреждений после инсульта в ишемической полутени, до сих пор не существует [5]. Поэтому в настоящее время активно разрабатываются методы генной и клеточной терапии, в первую очередь нацеленные на сдерживание негативных последствий инсульта в области пенумбры.
Известно, что общие принципы нейроонтогенеза могут быть применимы и к механизмам нейрорегенерации [6]. Так, нейротрофические факторы, продуцируемые нервными и глиальными клетками в формирующемся мозге, обеспечивают миграцию, выживаемость и терминальную дифференцировку нейрональных клеток-предшественниц, а также направленный рост аксонов, синаптогенез и формирование нейронных сетей [7]. Это указывает на потенциальную возможность использования нейротрофических факторов для стимулирования нейрорегенерации у пациентов с разнообразными заболеваниями центральной нервной системы (ЦНС) [8]. Для ослабления последствий патологических процессов в ЦНС уже используют в эксперименте: нейротрофины – фактор роста нервов (Nerve growth factor, NGF), нейротропный фактор мозга (Brain-derived neurotrophic factor, BDNF), нейротрофин-3 и нейротрофин-4/5; глиальный нейротрофический фактор (Glial cell line-derived neurotrophic factor, GDNF), ньютурин, артемин и персефин; нейропоэтические цитокины – цилиарный нейротрофический фактор (Ciliary neurotrophic factor, CNTF), фактор, ингибирующий лейкемию (Leukemia inhibitory factor, LIF), интерлейкин 6 (Interleukin-6, IL-6); сосудистые эндотелиальные факторы роста (Vascular endothelial growth factor, VEGF) – VEGF-А, VEGF-B, VEGF-C, VEGF-D, фактор роста плаценты (Placental growth factor, PGF); инсулиноподобные факторы роста (Insulin-like growth factor, IGF) – IGF-1, IGF-2 и нейрональные молекулы клеточной адгезии (Neural cell adhesion molecule, NCAM), в том числе белок L1 [8–10]. В многочисленных доклинических исследованиях на лабораторных животных доказана целесообразность использования генной терапии при ишемическом инсульте ГМ [11]. Доставка в область ишемического повреждения рекомбинантной комплементарной ДНК, кодирующей нейротрофические факторы BDNF, VEGF-А, NGF, GDNF, CNTF и основной фактор роста фибробластов (Basic fibroblast growth factor, bFGF), продемонстрировала положительное влияние указанных факторов на постишемическое восстановление мозга [9][11][12].
В настоящее время генотерапевтические препараты, экспрессирующие нейротрофические факторы, преимущественно исследуют в экспериментах с инсультом, применяя их непосредственно, после его возникновения. Однако пока нет однозначного ответа на вопрос о возможности использования превентивной генной терапии ишемического инсульта, в том числе и в клинике, с целью стимулирования физиологических адаптивных механизмов нервной ткани еще до наступления инсульта, например у пациентов, подверженных высокому риску нарушения мозгового кровообращения. Преобладающее число экспериментов, когда терапевтические гены нейропротекторных молекул доставляли в ЦНС в различные временные интервалы до моделирования инсульта, выполнено на грызунах [13].
В наших продолжающихся исследованиях для сдерживания негативных последствий ишемического инсульта головного мозга у мини-свиней была разработана терапия, основанная на доставке в очаг инсульта с помощью аутологичных лейкоцитов из периферической крови генов, кодирующих нейропротекторные факторы [14]. Лейкоконцентрат, обогащенный генами VEGF165, GDNF и NCAM1, вводили внутривенно в острую фазу инсульта (через 4 часа после окклюзии дистальной ветви средней мозговой артерии) или превентивно (за 2 суток до моделирования инсульта) [14]. На эффективность такого аутологичного лейкоконцентрата (АутоЛК) с тремя терапевтическими генами указывало: сдерживание увеличения объема инфаркта, положительное ремоделирование клеток нейроглии и восстановление уровня экспрессии синаптических белков в нейронах периинфарктной области как в условиях превентивной генной терапии, так и генной терапии в острую фазу ишемического инсульта [14].
Цель исследования: изучить влияние АутоЛК с генами VEGF165, GDNF и NCAM1 на морфологическую сохранность нервной ткани в области ишемического повреждения коры ГМ у мини-свиньи, а также миграцию генетически модифицированных лейкоцитов, трансдуцированных химерными аденовирусными векторами 5 серотипа с фибером 35 серотипа (Chimeric Adenovirus serotype 5 with Fiber serotype 35, Ad5/F35), несущих ген зеленого флуоресцентного белка (Green fluorescent protein, GFP).
МАТЕРИАЛЫ И МЕТОДЫ
Настоящий эксперимент проведен на 8-месячных вьетнамских вислобрюхих мини-свиньях (25–30 кг; n = 16) [15]. Для моделирования инсульта были отобраны самки по причине того, что негативные последствия острого ишемического инсульта у женщин более тяжелые, чем у мужчин [16]. Животных содержали по одному в индивидуальном загоне в условиях 12-часового режима ночь/день при температуре 24–25 °C с кондиционированием воздуха и контролируемым доступом к корму и воде.
Способы получения и введения АутоЛК, обогащенного генами нейротрофических факторов, и моделирование инсульта представлены ниже в сокращенном виде, их подробное описание приведено в нашей публикации, упомянутой выше [14].
Морфологические изменения в коре ГМ на фоне генной терапии изучали через 21 сутки после моделирования инсульта с помощью гистологических методов окраски фронтальных парафиновых срезов головного мозга подопытных животных. Конечная точка эксперимента была выбрана на основании продолжительности острого периода инсульта в течение 3 недель, а также 3-недельного периода активности аденовирусного вектора [17]. Для обзорного исследования очага ишемического повреждения использовали окраску гематоксилином и эозином; морфологические изменения в нейронах выявляли путем импрегнации серебром по методу Бильшовского – Грос – Лаврентьева; сохранность (жизнеспособность) нейронов оценивали окраской толуидиновым синим по Нисслю; для изучения плотности васкуляризации и выраженности фиброза применяли трехцветную окраску по Массону с анилиновым синим.
Получение аутологичного лейкоконцентрата, обогащенного генами VEGF165, GDNF и NCAM1
У всех подопытных мини-свиней под анестезией с помощью Zoletil®100 (Virbac Sante Animale, Франция), 3 мг/кг внутримышечно, в асептических условиях из подключичной вены забирали 50 мл крови в контейнеры (гемакон), содержащие 35 мл раствора гемоконсерванта ЦФДА-1 (Green Cross Corporation, Республика Корея). Лейкоконцентрат готовили в гемаконе по нашему оригинальному протоколу, который последовательно включает седиментацию эритроцитов с помощью 6% гидроксиэтилкрахмала с последующим центрифугированием (ускорение 34g) в течение 10 мин при 10 ºC (центрифуга DP-2065 R PLUS, Presvac S.R.L., Аргентина) и промывки физиологическим раствором. После чего надосадочную жидкость с помощью фракционатора компонентов крови ФК-01 (ООО «Лидкор», Россия) экстрагировали, а оставшуюся в контейнере жидкость, содержащую лейкоциты, считали лейкоконцентратом.
Далее полученный лейкоконцентрат трансдуцировали с помощью Ad5/F35, несущих последовательности генов человека: VEGF165 (Ad5/F35-VEGF165), GDNF (Ad5/F35-GDNF) и NCAM1 (Ad5/F35-NCAM1) в равном соотношении каждого вектора. С помощью стерильного шприца смесь трех генетических конструкций вводили в гемакон с лейкоконцентратом.
Соотношение клеток лейкоконцентрата и аденовирусных векторов составляло 1:10 – таким образом, множественность заражения (multiplicity of infection, MOI) равнялась 10. Трансдукцию лейкоконцентрата проводили при температуре 21–22 °С и постоянном покачивании на шейкере. Через 12 ч в контейнер добавляли 200 мл стерильного физиологического раствора и центрифугировали при 1000 оборотах в минуту и температуре 10 °С в течение 10 мин. Далее с помощью фракционатора экстрагировали надосадочную жидкость, включающую в себя физиологический раствор, фрагменты клеток крови и свободные вирусные частицы, таким образом, чтобы в контейнере осталось приблизительно 30 мл физиологического раствора с лейкоконцентратом. До введения экспериментальным животным генетически модифицированный лейкоконцентрат хранили при температуре 21–22 °С при постоянном покачивании на шейкере, время от забора крови и до введения концентрата животным не превышало установленного срока для выделения лейкоконцентрата из пуповинной крови человека с целью криоконсервации.
Для исследования миграции генетически модифицированных лейкоцитов после внутривенной инфузии готовили лейкоконцентрат, трансдуцированный с помощью Ad5/F35-GFP.
Моделирование ишемического инсульта головного мозга у мини-свиней
В эксперименте использован разработанный нами протокол, включающий окклюзию правой общей сонной артерии и левой средней мозговой артерии. Животных наркотизировали с помощью Zoletil®100 и подключали к ингаляционному наркозному аппарату MinorVet Optima (Zoomed, Россия), по которому подавали 2,0–2,5% смесь изофлурана (Laboratorios Karizoo. S.A., Испания) с кислородом. После трепанации левой височной кости под операционным микроскопом YZ-20T9 (Nanjing Redsun Optical Co., Ltd. Китай) рассекали твердую мозговую оболочку, подводили биполярный пинцет под предварительно выделенные и приподнятые над уровнем поверхности мозга сосуды и путем электрокоагуляции прижигали дистальные ветви левой средней мозговой артерии. Для уменьшения кровотока в виллизиевом круге дополнительно перевязывали правую общую сонную артерию. Послеоперационный уход включал в себя терапию: анальгезирующую – кеторолак 30 мг/мл 2 р/д в/м 10 дней (Dr. Reddy`s Laboratories, Ltd., Индия); антибактериальную – цефотаксим 1 г/5 мл 1 р/д в/м 7 дней («ПромоМед Рус» ООО, Россия) и инфузионную – физиологический раствор 400,0 мл подкожно капельно 1 р/д 3 дня [18].
Экспериментальные группы животных
Для изучения влияния генетически модифицированного АутоЛК на морфологическую сохранность нервной ткани в области ишемического повреждения коры ГМ животные были разделены на 4 группы. Мини-свиньям из группы генной терапии инсульта в острой фазе (n = 3) за 14–16 ч до моделирования инсульта готовили АутоЛК, трансдуцированный Ad5/F35-VEGF165, Ad5/F35-GDNF и Ad5/F35-NCAM1 (что соответствовало времени его получения) и вводили через ушную вену через 4 ч после операции. Животным из группы превентивной генной терапии (n = 3) такой же АутоЛК готовили и вводили за 2 суток до моделирования инсульта. Животным контрольной группы (n = 3) вводили 30 мл физиологического раствора. Интактные мини-свиньи (n = 3) служили для сбора базовых показателей исследования.
Для изучения миграции генетически модифицированных лейкоцитов АутоЛК, трансдуцированный Ad5/F35-GFP, вводили за 2 суток (n = 2) или через 4 часа (n = 2) после моделирования инсульта (рис. 1).
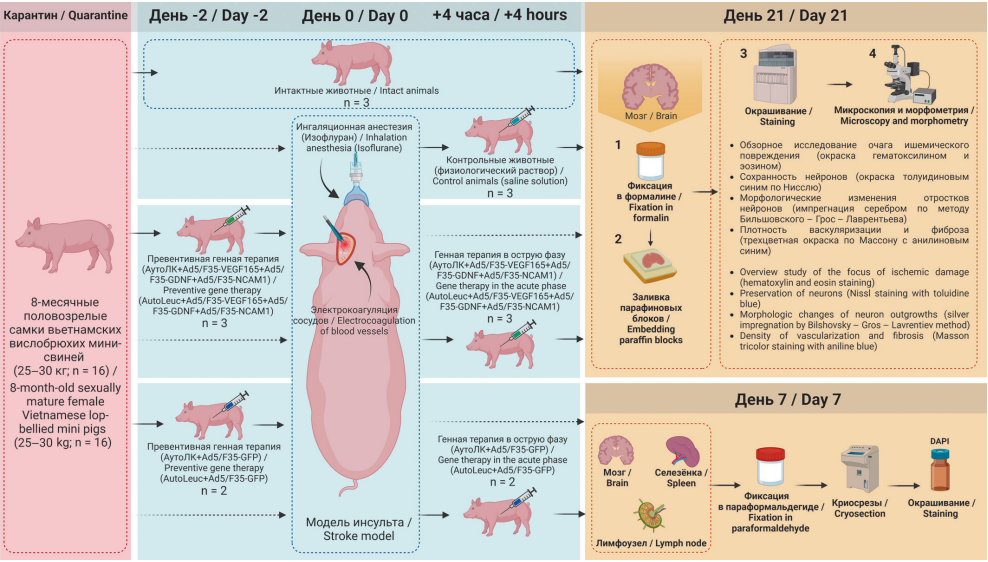
РИС. 1. Изучение влияния генетически модифицированного АутоЛК, введенного в разные периоды, на сохранность нервной ткани в области ишемического повреждения коры головного мозга. Эксперимент проведен на 4 группах мини-свиней (каждая по n = 3): интактная служила для сбора базовых показателей; контрольной вводили 30 мл физиологического раствора; группе превентивной генной терапии готовили и вводили АутоЛК, трансдуцированный Ad5/F35-VEGF165, Ad5/F35-GDNF и Ad5/F35-NCAM1 за 2 суток до моделирования инсульта; группе генной терапии в острой фазе готовили такой же АутоЛК за 14–16 ч до моделирования инсульта и вводили через 4 ч после операции через ушную вену. Через 21 сутки после моделирования инсульта с помощью гистологических методов окраски фронтальных парафиновых срезов изучали морфологические изменения в коре головного мозга.
Миграцию генетически модифицированных лейкоцитов, трансдуцированных Ad5/F35-GFP, изучали в двух группах (каждая по n = 2): первой вводили препарат за 2 суток, второй через 4 часа после моделирования инсульта. Через неделю забирали головной мозг, селезенку и поднижнечелюстные лимфатические узлы для люминесцентной микроскопии.
Примечание: АутоЛК – аутологичный лейкоконцентрат; Ad5/F35 – chimeric adenoviral vector of 5 serotypes with fiber of serotype 35, химерный аденовирусный вектор 5 серотипа с фибером 35 серотипа; GDNF – glial cell line-derived neurotrophic factor, глиальный нейтротрофический фактор; NCAM – neural cell adhesion molecule, нейрональная молекула клеточной адгезии; GFP – green fluorescent protein, зеленый флуоресцирующий белок; VEGF – vascular endothelial growth factor, сосудистый эндотелиальный фактор роста.
FIG. 1. Study of modified genetic AutoLeuc, introduced at different periods, for the preservation of nervous tissue in the area of ischemic damage to the cerebral cortex. The experiment was carried out on 4 groups of mini-pigs (each n = 3): the intact one served to collect basic indicators; the control group was injected with 30 ml of saline solution; the preventive gene therapy group was prepared and administered AutoLeuc with Ad5/F35-VEGF165, Ad5/F35-GDNF and Ad5/F35-NCAM1 2 days before stroke modeling; the acute phase gene therapy group was prepared with the same AutoLeuc 14–16 hours before stroke modeling and administered 4 hours after surgery through the ear vein. 21 days after stroke modeling morphological changes in the cerebral cortex were studied using histological methods of staining frontal paraffin sections.
The migration of genetically modified leukocytes transduced with Ad5/F35-GFP was studied in two groups (each n = 2): the first was administered within 2 days, the second 4 hours after stroke modeling. A week later, the brain, spleen, and mandibular lymph nodes were sampled for fluorescence microscopy.
Note: AutoLeuc – autologous leucoconcentrate; Ad5/F35 – chimeric adenoviral vector of 5 serotypes with fiber of serotype 35; GDNF – glial cell line-derived neurotrophic factor; NCAM – neural cell adhesion molecule; GFP – green fluorescent protein; VEGF – vascular endothelial growth factor.
Гистологические методы исследования
Через 21 сутки после моделирования инсульта всех животных наркотизировали с помощью Zoletil®100 и выводили из эксперимента путем введения хлористого калия (150 мг/кг) через ушную вену. Головной мозг извлекали из черепной коробки и фиксировали в 4% растворе параформальдегида в течение недели, далее готовили фронтальные срезы толщиной 3 мм через область инфаркта. Для гистологического исследования выбирали срез с максимальным кратерообразным повреждением по типу «минус ткань», вырезали фрагменты по краю кратера размером 2×2 см (рис. 2). Полученные образцы помещали в кассеты, обрабатывали с помощью гистопроцессора АГОТ-1 (АО «Орион Медик», Россия) согласно инструкции завода-изготовителя по стандартному протоколу проводки через спирт-ксилол и готовили парафиновые блоки с использованием заливочной станции HistoDream EW (Milestone Medical, Италия). Образцы головного мозга интактных животных для гистологического исследования получали из области, соответствующей инфаркту у подопытных животных, в тот же день. Фронтальные парафиновые срезы мозга толщиной 5 мкм готовили с помощью ротационного микротома HM 325 (Thermo Fisher Scientific, США), окрашивали гематоксилином и эозином, толуидиновым синим по Нисслю, анилиновым синим по Массону, импрегнировали серебром по методу Бильшовского – Грос – Лаврентьева. Оцифрованные изображения гистологических препаратов получали с помощью микроскопа Zeiss Axio Scope.A1 (Zeiss, Германия). Морфометрический анализ проводили с использованием программы ImageJ (NIH, США).
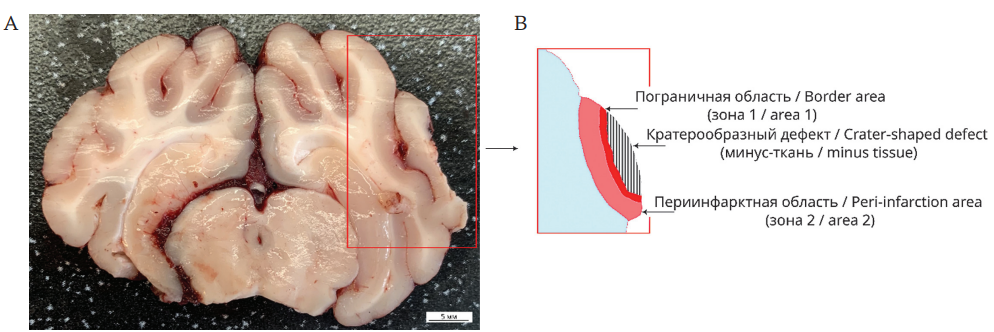
РИС. 2. Гистологическое исследование коры головного мозга у мини-свиньи через 21 сут после моделирования инсульта.
А. Фронтальный срез толщиной 3 мм через кратерообразное повреждение.
B. Схема гистологического среза с указанием зон исследования.
FIG. 2. Histological examination of the cerebral cortex in a mini-pig 21 days after a simulated stroke.
А. 3 mm thick coronal section through a crater-shaped lesion.
B. Scheme of a histological section indicating the areas of study.
Морфологический анализ проводили в пограничной с инфарктом области коры ГМ на расстоянии 1 мм и в периинфарктной реактивной области, прилегающей к пограничной на расстоянии 4 мм.
Окраска гематоксилином-эозином
Окрашивание срезов проводили по стандартному протоколу с помощью гематоксилина Эрлиха и спиртового раствора эозина, далее дегидратировали в спиртах возрастающей концентрации, просветляли и заключали в среду Витрогель (все препараты для окраски – ООО «БиоВитрум», Россия). Микроскопический анализ включал в себя оценку патологических изменений в пограничной и периинфарктной зонах ишемического повреждения коры ГМ: наличие и выраженность периваскулярного отека, некроза, кровоизлияний, лейкоцитарной инфильтрации.
Окраска толуидиновым синим по Нисслю
В 50 мл раствора толуидинового синего добавляли 2 мл модификатора окраски по Нисслю согласно инструкции изготовителя (ООО «БиоВитрум», Россия). В этот раствор погружали депарафинизированные препараты на 4 мин и дифференцировали в 96% уксуснокислом растворе этанола. Окрашенные препараты просветляли и заключали в среду Витрогель. Жизнеспособность нейронов оценивали по следующим признакам: размер клеток, сохранность плазматической мембраны, сохранность клеточного ядра и ядрышка, состояние тигроидного вещества, наличие патологических включений. Пикнотически измененные нейроны определяли по уменьшению размера клетки (сморщивание), гиперхромии и отсутствию клеточных структур. Подсчет пикнотических нейронов проводили относительно общего количества нервных клеток в пограничной и периинфарктной зонах по 0,3 мм2 площади каждой. Данные представлены в виде медианы количества пикнотических нейронов [1 квартиль; 3 квартиль] на 100 нейронов.
Импрегнация серебром по методу Бильшовского – Грос – Лаврентьева3,4
Депарафинизированные срезы инкубировали в 20% растворе нитрата серебра в течение 60 мин, после чего препараты быстро проводили через 5 ванночек, наполненных 20% формалином на водопроводной воде, и помещали для импрегнации в заранее подготовленный рабочий раствор аммиачного серебра (1 мл 20% раствора нитрата серебра титровали 10% раствором аммиака до исчезновения осадка оксида серебра). Срезы импрегнировали под визуальным контролем с помощью микроскопа в течение 5–10 мин, помещали на 15 мин в аммиачную воду, а затем на несколько часов в дистиллированную воду для промывки. Окрашенные препараты дегидратировали в спиртах возрастающей концентрации, просветляли и заключали в среду Витрогель. Морфологическое исследование включало в себя оценку архитектуры коры, а также состояние нейронов и их отростков.
Трехцветная окраска по Массону с анилиновым синим.
Окрашивание препаратов проводили по следующему протоколу: на депарафинизированные срезы наносили 8 капель рабочего раствора железного гематоксилина Вейгерта на 10 мин. После просушивания на срезы наносили по 6 капель спиртового раствора пикриновой кислоты на 4 мин, раствора кислого пунцового фуксина на 4 мин, затем раствора фосфорно-молибденовой кислоты на 10 мин – между реагентами срезы промывали в дистиллированной воде. Далее срезы подсушивали и на 5 мин наносили 6 капель раствора анилинового синего с последующей промывкой в дистиллированной воде, затем дегидратировали в спиртах возрастающей концентрации, просветляли и заключали в среду Витрогель. Микроскопический анализ препаратов включал выявление волокнистых структур для оценки выраженности соединительной ткани. Морфометрический анализ плотности васкуляризации проводили в пограничной и периинфарктной зонах ишемического повреждения коры ГМ на площади 1,5 мм2 в каждой зоне методом подсчета количества капилляров (сосудов диаметром 5–10 мкм).
Люминесцентная микроскопия
Через неделю после внутривенной инфузии лейкоцитов, экспрессирующих ген GFP, у животных забирали головной мозг, селезенку и поднижнечелюстные лимфатические узлы. Образцы из левого (в области инфаркта) и соответствующей области правого полушарий, селезенки и лимфатических узлов фиксировали в 4% растворе параформальдегида, в целях криопротекции насыщали 30% раствором сахарозы, заливали в среду для замораживания тканей Neg 50 (Thermo Scientific, США) и готовили срезы толщиной 20 мкм на криостате Microm HM 560 (Thermo Scientific, США). Полученные срезы для визуализации клеточных ядер инкубировали в 10 мкг/мл раствора 4’,6-диамидино-2-фенилиндола (4’,6-diamidino-2-phenylindole, DAPI) в фосфатно-солевом буфере (Sigma, США) и заключали в среду для защиты от выгорания флуоресценции Fluoroshield™ (Sigma Aldrich, США). Оцифрованные изображения получали с помощью люминесцентного микроскопа Zeiss Axioscope A1 (Zeiss, Германия).
Статистический анализ
Описательные статистики представлены в виде медиан и интерквартильного размаха (25-й; 75-й процентили). Для сравнения значений количественных переменных между группами применяли тест Краскела – Уоллиса. Для попарных межгрупповых сравнений использовали тест Данна, различия считали статистически значимыми при p < 0,05. Статистический анализ полученных данных проводили в среде для статистических вычислений R 4.1.2 (R Foundation for Statistical Computing, Австрия)5.
Результаты
Обзорное исследование очага ишемического повреждения
На препаратах мозга у животных контрольной группы очаг ишемического повреждения имеет кратерообразную форму по типу «минус-ткань» (рис. 2).
На срезах ГМ, окрашенных гематоксилином и эозином, в прилегающей к области инфаркта мягкой мозговой оболочке видны реактивные изменения в виде лейкоцитарной инфильтрации, преимущественно мононуклеарной, фиброза и гемосидероза (рис. 3А). В пограничной зоне ишемического повреждения мозга отсутствуют нейроны, встречаются пенистые клетки и участки разрежения с микрокистозными изменениями (рис. 3А). В сосудистом русле выявлены постнекротические явления с оголением сосудистого каркаса, микроциркуляторными расстройствами в виде сладжей, тромбов в капиллярах и экстравазаты. В поверхностных слоях коры обнаруживаются очаги деструкции с небольшой мононуклеарной инфильтрацией, в периинфарктной зоне визуализируются выраженные изменения нейронов в виде: пикноза, гиперхромии, плохо различимых клеточных структур, а также отсутствия отростков (рис. 3А).
На микропрепаратах ГМ мини-свиней из группы генной терапии в острую фазу в пограничной зоне ишемического повреждения отмечаются менее выраженные очаги деструкции, нет существенных изменений микроциркуляторного русла и отсутствует лейкоцитарная инфильтрация. Обнаруживаются нейроны, во многих из которых визуализируются ядра, ядрышки, а также нейриты (рис. 3B). Патологические изменения в периинфарктной зоне не выражены.
В мозге животных из группы с превентивной генной терапией в пограничной с инфарктом зоне определяются единичные пикнотические нейроны и минимальные микрокистозные изменения; нервная ткань периинфарктной зоны демонстрирует большую сохранность при сравнении с мозгом контрольной группы и группы на фоне генной терапии в острую фазу (рис. 3C).
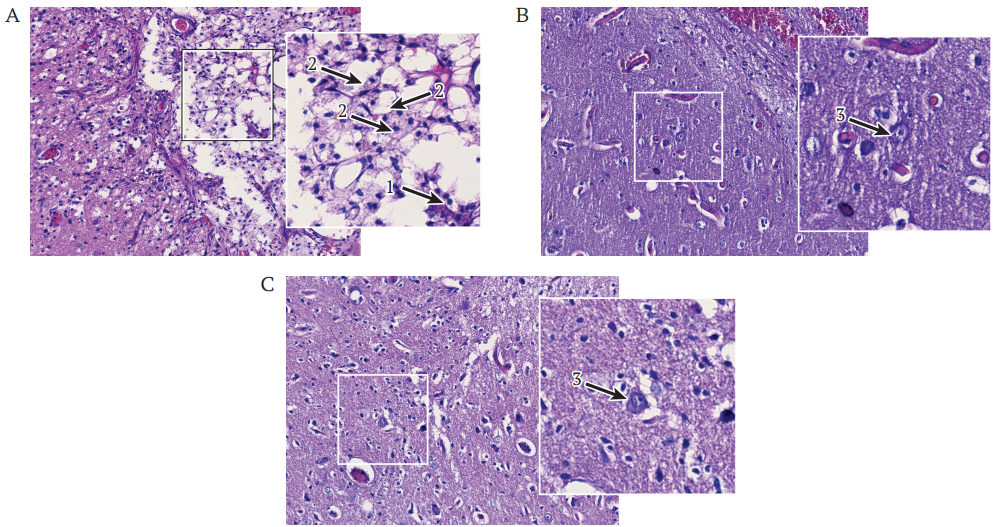
РИС. 3. Морфологические изменения в пограничной зоне ишемического повреждения коры головного мозга мини-свиней на 21 сут после моделирования инсульта. Окраска гематоксилином и эозином; ув. 200, на вставках ув. 400.
- Контрольная группа.
- Группа генной терапии в острую фазу.
- Группа превентивной генной терапии.
Примечание: стрелки: 1 – оголение сосудистого каркаса; 2 – пенистые клетки; 3 – сохранные нейроны.
FIG. 3. Morphological changes in the border zone of ischemic brain injury of mini-pigs at 21 days after stroke modeling. Hematoxylin and eosin staining; magnification 200, in inserts magnification 400.
- Control group.
- Group of gene therapy in the acute phase.
- Preventive gene therapy group.
Note: arrows: 1 – vascular framework denudation; 2 – foam cells; 3 – intact neurons.
Сохранность нейронов
В пограничной и периинфарктной зонах ишемического повреждения коры больших полушарий у мини-свиней из контрольной группы при окраске по Нисслю визуализируются нейроны с различными признаками дегенерации: вакуолизированной цитоплазмой, сморщенными пикнотическими ядрами, кариолизисом, субстанцией Ниссля либо мелкозернистой, либо не выраженной (рис. 4А), тогда как в обеих группах генной терапии тигроидное вещество сохранено в нейронах и пограничной, и периинфарктной зон (рис. 4B, C). Во всех экспериментальных группах в мозге встречаются нейроны с глиальным сателлитозом, свидетельствующим о повреждении нейронов.
Морфометрический анализ нейронов, подвергшихся пикнозу в периинфарктной зоне ишемического повреждения ГМ экспериментальных мини-свиней, выявил их большее количество в контрольной группе – 49,5 (47,7; 52,9), при сравнении с группами генной терапии: в острую фазу – 31,1 (20,6; 36,36); p = 0,0369, и превентивной – 31,6 (29,5; 36,4); p = 0,0526. В пограничной зоне количество пикнотически измененных нейронов во всех экспериментальных группах не различалось и составило: в контрольной группе 81,0 (69,0; 87,2), в группе с генной терапией в острую фазу 47,0 (44,3; 52,7); р = 0,1011 при сравнении с контрольной группой, и в группе с превентивной генной терапией 64,3 (61,3; 76,1); р = 0,8815 при сравнении с контрольной группой.
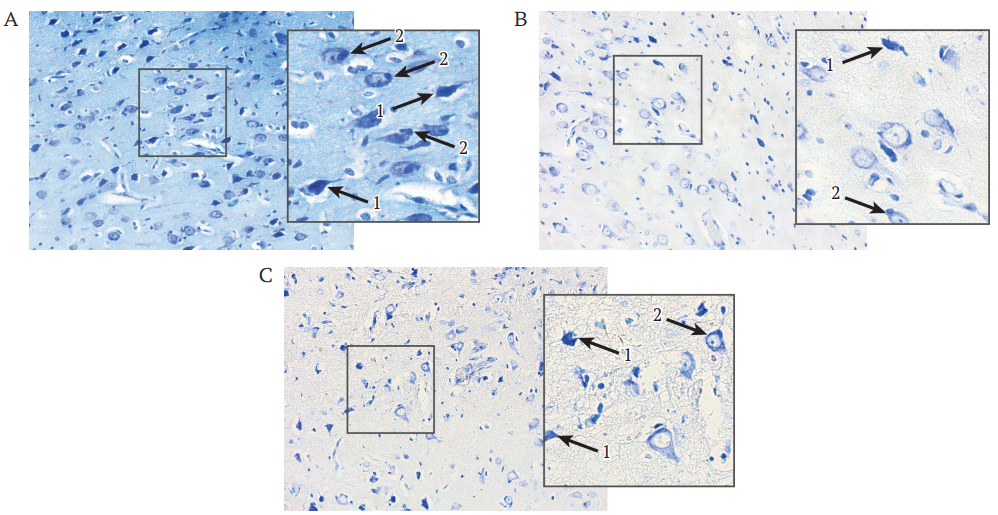
РИС. 4. Сохранность нейронов в периинфарктной зоне ишемического повреждения коры головного мозга мини-свиней через 21 сут после моделирования инсульта. Окрашивание толуидиновым синим по Нисслю; ув. 200, на вставках ув. 400.
- Контрольная группа.
- Группа генной терапии в острую фазу.
- Группа превентивной генной терапии.
Примечание: стрелки: 1 – пикнотически измененные нейроны; 2 – глиальный сателлитоз.
FIG. 4. Preservation of neurons in the peri-infarct zone of ischemic brain injury of mini-pigs 21 days after stroke modeling. Nissl staining with toluidine blue; magnification 200, in inserts magnification 400.
- Control group.
- Group of gene therapy in the acute phase.
- Preventive gene therapy group.
Note: arrows: 1 – pycnotic neurons; 2 – glial satelliteosis.
Архитектура коры и морфология нейронов
На гистологических препаратах коры теменной области интактных животных, импрегнированных нитратом серебра, визуализируется характерная слоистая архитектура, включающая в себя молекулярный (плексиформный), наружный зернистый, наружный пирамидный, внутренний зернистый, внутренний пирамидный слои и слой полиморфных клеток. Хорошо выражена сетчатая «войлокообразная» структура нервной ткани, обусловленная переплетениями тонких нейритов (рис. 5A).
У всех экспериментальных животных в пограничной зоне ишемического повреждения кора истончена, архитектура нарушена, отсутствует молекулярный слой. В периинфарктной зоне у контрольных животных, в отличие от терапевтических групп, слой наружных зернистых нейронов был истончен. Кроме того, в мозге контрольных животных во втором и третьем слоях наблюдались частичная фрагментация или отсутствие отростков нейронов, фрагментированные нервные отростки имели извитый ход (рис. 5B). В мозге мини-свиней терапевтических групп от нейронов отходили сохранные прямые отростки (рис. 5C, D). Выраженная гиперхромия преимущественно затрагивала нейроны в наружных зернистом и пирамидном слоях во всех трех группах животных с инсультом. Однако нервная ткань у мини-свиней из терапевтических групп имела «войлокообразную» текстуру, соответствующую таковой у интактных животных (рис. 5A, B, C).
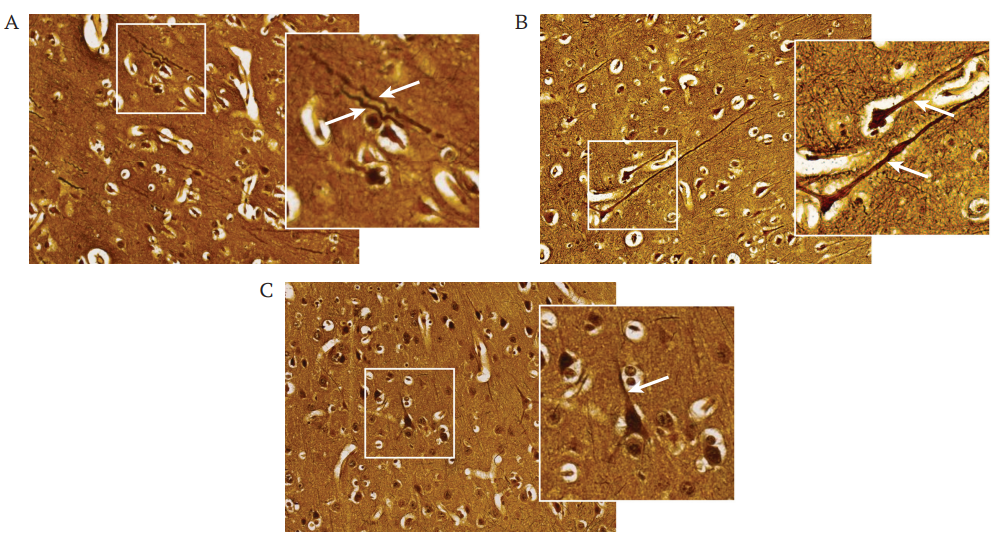
РИС. 5. Морфология отростков нейронов в периинфарктной зоне ишемического повреждения головного мозга мини-свиней через 21 сут после моделирования инсульта. Импрегнация серебром по Бильшовскому – Грос – Лаврентьеву; ув. 200, на вставках ув. 400.
- Контрольная группа.
- Группа генной терапии в острую фазу.
- Группа превентивной генной терапии.
Примечание: стрелками отмечены отростки нейронов.
FIG. 5. Morphology of neuronal outgrowths in the peri-infarct zone of ischemic brain injury of mini-pigs 21 days after stroke modeling. Silver impregnation according to Bilshovsky – Gros – Lavrentiev; magnification 200, in inserts magnification 400.
- Control group.
- Group of gene therapy in the acute phase.
- Preventive gene therapy group.
Note: arrows indicate neuronal outgrowths.
Васкуляризация коры в области ишемического повреждения мозга
На гистологических препаратах, окрашенных по Массону (рис. 6А–C), в пограничной и периинфарктной зонах вокруг очага инфаркта у всех экспериментальных животных стенки мелких сосудов утолщены и слоисты. Вокруг сосудов визуализируются периваскулярные соединительнотканные волокна. Морфометрический анализ количества сосудов диаметром 5–10 мкм в периинфарктной зоне выявил значимое увеличение содержания капилляров у мини-свиней в группе с превентивной генной терапией – 14,5 (14,3; 15,1), при сравнении с интактной группой – 10,3 (9,8; 11,1); р = 0,0415, и контрольной группой – 9,0 (8,3; 10,5); р = 0,0127. У животных группы генной терапии в острую фазу количество капилляров в этой зоне составило 12,8 (10,2; 13,4) и не отличалось от аналогичных данных у группы с превентивной генной терапией, р = 0,1129.
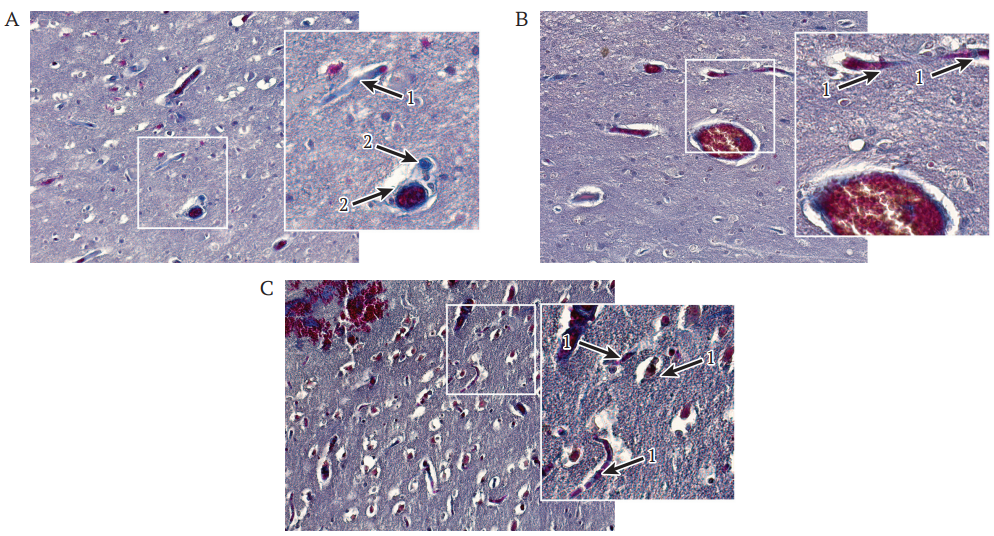
РИС. 6. Плотность капилляров в периинфарктной зоне ишемического повреждения головного мозга мини-свиней через 21 сут после моделирования инсульта. Окрашивание по Массону; ув. 200, на вставках ув. 400.
- Контрольная группа.
- Группа генной терапии в острую фазу.
- Группа превентивной генной терапии.
Примечание: стрелки: 1 – капилляры; 2 – фиброз сосудистой стенки.
FIG. 6. Capillary density in the peri-infarct zone of ischemic brain injury of mini-pigs 21 days after stroke modeling. Masson staining; magnification 200, in inserts magnification 400.
- Control group.
- Group of gene therapy in the acute phase.
- Preventive gene therapy group.
Note: arrows: 1 – capillaries; 2 – vascular fibrosis.
Миграция генетически модифицированных лейкоцитов после внутривенной инфузии
Флуоресцентная микроскопия препаратов селезенки и поднижнечелюстных лимфатических узлов экспериментальных животных после внутривенной инфузии АутоЛК, несущего репортерный ген GFP, до и после моделирования инсульта обнаружила лейкоциты со специфическим зеленым свечением. Ранее нами было показано присутствие генетически модифицированных клеток в периинфарктной области в левом полушарии мозга подопытных животных [14], в правом полушарии GFP-позитивные клетки не обнаружены. Результаты микроскопии демонстрируют, что после внутривенной инфузии лейкоциты с Ad5/35-GFP выселяются из кровотока в область ишемического повреждения коры ГМ и органы иммунной защиты и синтезируют рекомбинантный белок GFP.
ОБСУЖДЕНИЕ
Ранее при изучении мозга мини-свиней было показано положительное влияние генной терапии на ремоделирование нейроглии и экспрессию синаптических белков в нейронах периинфарктной области мозга путем введения АутоЛК, обогащенного генами VEGF165, GDNF, NCAM1, как в острую фазу инсульта, так и превентивно [14].
В данном исследовании также был смоделирован ишемический инсульт у мини-свиней – на 21-й день при иммунофлуоресцентном исследовании периинфарктной области выявлен апоптоз клеток; увеличение доли микроглии и астроцитов, ответственных за формирование глиального рубца; уменьшение доли миелинообразующих олигодендроглиальных клеток; снижение экспрессии синаптических белков в нервных клетках. При этом в условиях генной терапии АутоЛК, обогащенным генами VEGF165, GDNF, NCAM1, в острую фазу через 4 часа после инсульта и превентивно за 2 суток до инсульта в коре ГМ животных в обеих терапевтических группах были продемонстрированы: (1) уменьшение объема инфаркта и уменьшение доли апоптотических клеток; (2) сдерживание формирования глиального рубца; (3) увеличение количества миелинообразующих клеток. Ранее нами было косвенно подтверждено восстановление функциональной активности нейронов на основании уровня экспрессии белка синаптических пузырьков синаптофизина и белка постсинаптической плотности (PSD95) [14].
В представленном исследовании получены дополнительные доказательства положительного влияния рекомбинантных молекул VEGF165, GDNF и NCAM1 на восстановление нервной ткани в области ишемического повреждения мозга. В мозге животных обеих терапевтических групп в периинфарктной зоне, соответствующей ишемической полутени, выявлено меньше деструктивных изменений и большее количество жизнеспособных нейронов с сохранными нейритами, а также более высокая плотность капилляров, чем в группе инсульта без лечения.
Данные о способности генетически модифицированных лейкоцитов, обогащенных генами VEGF165, GDNF, NCAM1, мигрировать из кровотока через нарушенный гематоэнцефалический барьер в область ишемического повреждения мозга и положительно влиять на ремоделирование нервной ткани дают основание полагать, что они локально продуцируют молекулы VEGF165, GDNF и NCAM1, которые по паракринному механизму сдерживают развитие последствий инсульта в области ишемической полутени. Положительное влияние VEGF165, GDNF и NCAM1 основано на их нейропротекторном действии [19–21], ангиогенных эффектах [19] и свойстве обеспечить миграцию генетически модифицированных лейкоцитов в область инфаркта мозга и выживание в ней [22].
Внутривенная инфузия АутоЛК, обогащенного рекомбинантными генами VEGF165, GDNF и NCAM1, оказывает положительное действие на постишемическую регенерацию мозга мини-свиней в области пенумбры. При этом продукция рекомбинантных молекул VEGF165, GDNF и NCAM1 генетически модифицированными лейкоцитами после их внутривенного введения продолжается не менее 3 недель [17], что соответствует острому периоду инсульта.
Ограничения исследования
При разработке принципов генной терапии для сдерживания дегенеративных процессов и стимулирования регенерации в ЦНС при травмах, ишемических инсультах и нейродегенеративных заболеваниях используются гены, кодирующие различные цитокины и их комбинации, с доказанной в эксперименте эффективностью [23]. При этом в практическую медицину пока не введен ни один одобренный для лечения заболеваний ЦНС генотерапевтический препарат [24]. Ограничения связаны как с подбором терапевтических генов, так и с вектором доставки для конкретной нозологии – согласно характеру заболевания, воздействию на этиологические, патогенетические или симптоматические аспекты, ожидаемому результату.
Результаты настоящего исследования следует считать пилотными из-за ограниченного количества животных и данных, полученных только на самках мини-свиней. Кроме того, представленные выводы основаны на однократном введении генетически модифицированного АутоЛК с комбинацией генов VEGF165, GDNF и NCAM1 в составе химерного аденовирусного вектора Ad5/35 в единственной дозе. Функциональное восстановление животных после экспериментального инсульта на фоне генной терапии позволит комплексно оценить данные поведенческих тестов наряду с морфологическими изменениями в головном мозге.
Тот факт, что генетически модифицированные лейкоциты мини-свиней способны мигрировать в область ишемического повреждения мозга, заселять органы иммунной системы и продуцировать рекомбинантные VEGF, GDNF и NCAM in vitro [25], предполагает необходимость исследовать секрецию и распространение этих терапевтических молекул in situ для установления механизма их действия.
Направления для дальнейших исследований
Вопросы оптимизации трансдукции лейкоконцентрата с помощью комбинации химерных аденовирусных векторов Ad5/35-VEGF165, Аd5/35-GDNF и Ad5/35-NCAM1, объема и кратности введения животным, фармакокинетики, возможных побочных эффектов требуют дополнительных исследований для инициирования комплексных доклинических испытаний. Кроме того, в практической медицине для превентивной генной терапии ишемического инсульта сроки приготовления АутоЛК, обогащенного терапевтическими генами, не так критичны, как для его использования в острую фазу. В этой связи необходимы дальнейшие исследования по решению задачи получения персонифицированного генно-клеточного препарата в пределах времени терапевтического окна.
ЗАКЛЮЧЕНИЕ
Результаты настоящего исследования согласуются с полученными ранее данными о положительном влиянии АутоЛК, обогащенного рекомбинантными генами VEGF165, GDNF и NCAM1, на регенерацию нервной ткани в области ишемической полутени мозга у мини-свиней. Через 21 сутки после моделирования инсульта у животных на фоне превентивной генной терапии или генной терапии в острую фазу инсульта установлена лучшая сохранность нейронов и большая плотность кровеносных капилляров в периинфарктной зоне ишемического повреждения мозга. Сведения о миграции генетически модифицированных лейкоцитов и их способности продуцировать рекомбинантный белок дают основание полагать, что терапевтические молекулы VEGF165, GDNF и NCAM1 по паракринному механизму оказывают положительное влияние на жизнеспособность и морфологию нервных клеток, а также на рост кровеносных сосудов.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России (№ 5-26.05.2020).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование выполнено при финансовой поддержке гранта РНФ № 19-75-100301.
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Kazan State Medical University, No. 5 of 26.05.2020.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interest. The authors declare that there is no conflict of interests.
Financial support. The research was supported by the grant of the Russian Science Foundation No. 19-75-100302.
1 Российский научный фонд. Карточка проекта 19-75-10030. https://rscf.ru/project/19-75-10030/ (дата обращения: 12.03.2024).
2 Russian Science Foundation. Card of project 19-75-10030. https://rscf.ru/project/19-75-10030/ (access date: 12.03.2024).
3 Лаврентьев Б.И. Методика окраски нервных элементов по Бильшовскому в модификации Грос. Морфология автономной нервной системы. М.: Медгиз, 1946, издание 2-е, 244 с.
4 Роскин Г.И., Левинсон Л.Б. Микроскопическая техника. М.: Советская наука, 1957, 3-е изд., 476 с.
5 Team R.C. A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna. Published online 2022 г. https://www.r-project.org/ (дата обращения: 12.10.2023).
Список литературы
1. Saini V., Guada L., Yavagal D.R. Global epidemiology of stroke and access to acute ischemic stroke interventions. Neurology. 2021 Nov 16; 97(20 Suppl 2): S6–S16. https://doi.org/10.1212/WNL.0000000000012781. PMID: 34785599
2. Campbell B.C., De Silva D.A., Macleod M.R., et al. Ischaemic stroke. Nat Rev Dis Prim. 2019 Oct 10; 5(1): 70. https://doi.org/10.1038/s41572-019-0118-8. PMID: 31601801
3. Чикризова Е.А., Коломиец Т.В., Зерчанинова Е.И. Современные методы лечения ишемических инсультов и их осложнения. Тенденции развития науки и образования. 2022; 86(3): 121–125. https://doi.org/10.18411/trnio-06-2022-122
4. Кудрявцева В.А., Кузьмин Е.А., Моисеева А.В. и др. Молекулярные и морфологические маркеры гибели нейронов при острых нарушениях мозгового кровообращения. Сеченовский вестник. 2022; 13(4): 18–32. https://doi.org/10.47093/2218-7332.2022.13.4.18-32
5. Hasan T.F., Hasan H., Kelley R.E. Overview of acute ischemic stroke evaluation and management. Biomedicines. 2021 Oct 16; 9(10): 1486. https://doi.org/10.3390/biomedicines9101486. PMID: 34680603; PMCID: PMC8533104
6. Lavrov I., Islamov R. Implementing principles of neuroontogenesis and neuroplasticity for spinal cord injury therapy. Front Biosci (Landmark Ed). 2022 May 19; 27(5): 163. https://doi.org/10.31083/j.fbl2705163. PMID: 35638430
7. Kuriakose D., Xiao Z. Pathophysiology and treatment of stroke: present status and future perspectives. Int J Mol Sci. 2020 Oct 15; 21(20): 7609. https://doi.org/10.3390/ijms21207609. PMID: 33076218; PMCID: PMC7589849
8. Puhl D.L., D’Amato A.R., Gilbert R.J. Challenges of gene delivery to the central nervous system and the growing use of biomaterial vectors. Brain Res Bull. 2019 Aug; 150: 216–230. https://doi.org/10.1016/j.brainresbull.2019.05.024. Epub 2019 Jun 5. PMID: 31173859; PMCID: PMC8284997
9. Craig A.J., Housley G.D. Evaluation of gene therapy as an intervention strategy to treat brain injury from stroke. Front Mol Neurosci. 2016; 9: 34. https://doi.org/10.3389/fnmol.2016.00034. PMID: 27252622; PMCID: PMC4877374
10. Alfonsetti M., d’Angelo M., Castelli V. Neurotrophic factorbased pharmacological approaches in neurological disorders. Neural Regen Res. 2023 Jun; 18(6): 1220–1228. https://doi.org/10.4103/1673-5374.358619. PMID: 36453397; PMCID: PMC9838155
11. Rhim T., Lee M. Targeted delivery of growth factors in ischemic stroke animal models. Expert Opin Drug Deliv. 2016; 13(5): 709– 723. https://doi.org/10.1517/17425247.2016.1144588. Epub 2016 Feb 6. PMID: 26788902
12. Parambi D.G.T., Alharbi K.S., Kumar R., et al. Gene therapy approach with an emphasis on growth factors: theoretical and clinical outcomes in neurodegenerative diseases. Mol Neurobiol. 2022 Jan; 59(1): 191–233. https://doi.org/10.1007/s12035021-02555-y. Epub 2021 Oct 15. PMID: 34655056; PMCID: PMC8518903
13. Gan Y., Jing Z., Stetler R.A., Cao G. Gene delivery with viral vectors for cerebrovascular diseases. Front Biosci (Elite Ed). 2013 Jan 1; 5(1): 188–203. https://doi.org/10.2741/e607. PMID: 23276981; PMCID: PMC5516729
14. Safiullov Z., Izmailov A., Sokolov M., et al. Autologous genetically enriched leucoconcentrate in the preventive and acute phases of stroke treatment in a mini-pig model. Pharmaceutics. 2022 Oct 17; 14(10): 2209. https://doi.org/10.3390/pharmaceutics14102209. PMID: 36297644; PMCID: PMC9611398
15. Melià-Sorolla M., Castaño C., Degregorio-Rocasolano N., et al. Relevance of porcine stroke models to bridge the gap from pre-clinical fi ndings to clinical implementation. Int J Mol Sci. 2020 Sep 8; 21(18): 6568. https://doi.org/10.3390/ijms21186568. PMID: 32911769; PMCID: PMC7555414
16. Bonkhoff A.K., Schirmer M.D., Bretzner M., et al. Outcome after acute ischemic stroke is linked to sex-specifi c lesion patterns. Nat Commun. 2021 Jun 2; 12(1): 3289. https://doi.org/10.1038/s41467-021-23492-3. PMID: 34078897; PMCID: PMC8172535
17. Seregin S.S., Amalfi tano A. Overcoming pre-existing adenovirus immunity by genetic engineering of adenovirus-based vectors. Expert Opin Biol Ther. 2009 Dec; 9(12): 1521–1531. https://doi.org/10.1517/14712590903307388. PMID: 19780714
18. Маркосян В.А., Измайлов А.А., Соколов М.Е. и др. Модель мелкоочагового ишемического инфаркта головного мозга как основа для разработки новых методов терапии инсульта. Казанский Медицинский Журнал. 2023; 104(2): 242– 248. https://doi.org/10.17816/KMJ112404
19. Simoes Braga Boisserand L., Bouchart J., Geraldo L.H., et al. VEGF-C promotes brain-derived fl uid drainage, confers neuroprotection, and improves stroke outcomes. bioRxiv Prepr Serv Biol. [Preprint]. 2023 May 30 https://doi.org/10.1101/2023.05.30.542708. PMID: 37398128; PMCID: PMC10312491.
20. Cintrón-Colón A.F., Almeida-Alves G., Boynton A.M., et al. GDNF synthesis, signaling, and retrograde transport in motor neurons. Cell Tissue Res. 2020 Oct; 382(1): 47–56. https:// doi.org/10.1007/s00441-020-03287-6. Epub 2020 Sep 8. PMID: 32897420; PMCID: PMC7529617
21. Miguel-Hidalgo J.J. Neuroprotective astroglial response to neural damage and its relevance to affective disorders. Explor neuroprotective Ther. 2023; 3(5): 328–345. https://doi.org/10.37349/ent.2023.00054. Epub 2023 Oct 31. PMID: 37920189; PMCID: PMC10622120
22. Сафиуллов З.З., Гаранина Е.Е., Измайлов А.А. и др. Адресная миграция и выживание генетически модифицированных мононуклеарных клеток крови пуповины человека после трансплантации G93A мышам с моделью бокового амиотрофического склероза. Гены и клетки. 2015; 10(4): 86–89. https:// doi.org/10.23868/gc120519
23. Zhao Y., Zhang X., Chen X., Wei Y. Neuronal injuries in cerebral infarction and ischemic stroke: from mechanisms to treatment (Review). Int J Mol Med. 2022 Feb; 49(2): 15. https://doi.org/10.3892/ijmm.2021.5070. Epub 2021 Dec 8. PMID: 34878154; PMCID: PMC8711586
24. Ekkert A., Šliachtenko A., Grigaitė J., et al. Ischemic stroke genetics: what is new and how to apply it in clinical practice? Genes (Basel). 2021 Dec 24; 13(1): 48. https://doi.org/10.3390/genes13010048. PMID: 35052389; PMCID: PMC8775228
25. Islamov R., Bashirov F., Izmailov A., et al. New therapy for spinal cord injury: autologous genetically-enriched leucoconcentrate integrated with epidural electrical stimulation. Cells. 2022 Jan 2; 11(1): 144. https://doi.org/10.3390/cells11010144. PMID: 35011706; PMCID: PMC8750549
Об авторах
З. З. СафиулловРоссия
Сафиуллов Зуфар Зуфарович, канд. мед. наук, доцент кафедры нормальной анатомии
ул. Бутлерова, д. 49, г. Казань, 420012
А. А. Измайлов
Россия
Измайлов Андрей Александрович, канд. мед. наук, ассистент кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
В. А. Маркосян
Россия
Маркосян Ваге Аршалуйсович, канд. мед. наук, старший преподаватель кафедры оперативной хирургии и топографической анатомии
ул. Бутлерова, д. 49, г. Казань, 420012
А. Е. Хомяков
Россия
Хомяков Александр Евгеньевич, врач-патологоанатом, научный сотрудник лаборатории молекулярной и клеточной медицины
ул. Бутлерова, д. 49, г. Казань, 420012
Н. В. Бойчук
Россия
Бойчук Наталья Валентиновна, канд. биол. наук, доцент кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
М. В. Нигметзянова
Россия
Нигметзянова Мария Владимировна, канд. биол. наук, доцент кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
А. Р. Сираева
Россия
Сираева Алина Рафаиловна, студентка
ул. Бутлерова, д. 49, г. Казань, 420012
С. С. Таргачев
Россия
Таргачев Султан Субханвердиевич, ассистент кафедры оперативной хирургии и топографической анатомии
ул. Бутлерова, д. 49, г. Казань, 420012
В. В. Валиуллин
Россия
Валиуллин Виктор Владимирович, д-р биол. наук, профессор кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
Р. Р. Исламов
Россия
Исламов Рустем Робертович, д-р мед. наук, профессор, заведующий кафедрой гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
В. И. Поспелов
Россия
Поспелов Вадим Игоревич, профессор, научный руководитель
ул. Маршала Бирюзова, д. 32, Москва, 123060
Дополнительные файлы

|
1. Чек-лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(94KB)
|
Метаданные ▾ | |







































