Перейти к:
Модель смерти мозга с постепенной индукцией как основа для экспериментальных исследований донорских органов
https://doi.org/10.47093/2218-7332.2024.15.2.28-35
Аннотация
Цель. Апробировать в эксперименте патогенетически адекватную модель смерти мозга вследствие повышения внутричерепного давления с постепенной индукцией, позволяющую оценивать изменения, развивающиеся в органах потенциального донора.
Материалы и методы. 6–8-месячных беспородных крыс-самцов экспериментальной группы (n = 18) и контрольной группы (n = 8) наркотизировали, катетеризировали левую общую сонную артерию для регистрации систолического, диастолического артериального давления (АД) и частоты сердечных сокращений (ЧСС), рассчитывали среднее АД (АДср.). После перевода на искусственную вентиляцию легких в экспериментальной группе моделировали смерть мозга по разработанной методике.
Результаты. У всех животных в экспериментальной группе через 30 мин от начала эксперимента констатирована смерть мозга, в течение 3 ч вследствие прогрессирования недостаточности кровообращения погибло 10 крыс (56%). Исходно у наркотизированных животных АДср. составило 101 (90; 105) мм рт. ст., ЧСС 310 (297; 315) уд./мин. Через 5 мин от начала индукции смерти мозга АДср. повысилось до 147 (140; 150) мм рт. ст. (p = 0,01), ЧСС до 396 (384; 406) уд./мин (р = 0,03), затем в течение 20 мин АДср. постепенно снижалось до 94 (90; 100) мм рт. ст., ЧСС до 290 уд./мин. С 26 до 90 мин АДср. стабилизировалось на уровне 87–92 мм рт. ст., ЧСС от 263 до 274 уд/мин (p = 0,01), далее через 120–150 мин АДср. продолжало снижаться до 75–80 мм рт. ст. (p = 0,03), ЧСС до 256–264 уд./мин (p = 0,01). К завершению эксперимента, несмотря на волемическую поддержку, у животных продолжалось снижение АДср. до 64 (61; 67) мм рт. ст. (р = 0,02), усугублялась брадикардия до 250 (248; 260) уд./мин (р = 0,01), что свидетельствует о развитии декомпенсации гемодинамических расстройств.
Заключение. Апробация модели смерти мозга потенциального донора с постепенной индукцией на беспородных крысах показала себя патогенетически адекватной и позволяющей оценивать состояние потенциальных донорских органов в течение 3 ч после индукции смерти мозга.
Ключевые слова
Трансплантация органов остается «золотым стандартом» лечения пациентов с терминальной стадией недостаточности сердца, легких, печени и почек [1]. В подавляющем большинстве случаев источником для эксплантации органов являются доноры со смертью мозга вследствие необратимого ишемического, геморрагического или травматического повреждения центральной нервной системы (ЦНС). Смерть мозга вызывает в организме потенциального донора каскад различных гемодинамических, эндокринных и воспалительных реакций, которые оказывают повреждающее действие различной степени выраженности на морфофункциональное состояние трансплантатов [2].
Известен ряд экспериментальных моделей для исследования влияния смерти мозга на состояние донорских органов [3, 4]. В большинстве этих моделей смерть мозга развивается вследствие повышения внутричерепного давления (ВЧД) при раздувании баллона, помещенного в полость черепа. Принципиально данную модель смерти мозга вследствие повышения ВЧД можно разделить на две категории: с быстрой (sudden onset model) или постепенной (gradual onset model) индукцией. В случае быстрой индукции ВЧД повышают в течение 30–60 сек, что сопровождается высокой летальностью экспериментальных животных из-за выраженной сердечно-сосудистой и дыхательной недостаточности. При постепенной индукции ВЧД повышают медленно в течение 5–20 мин, в результате достигается относительная стабилизация системной гемодинамики без потребности во введении инотропных препаратов в течение нескольких часов.
Наиболее известен способ моделирования смерти мозга у мелких лабораторных животных путем трепанации черепа, введения в субдуральное пространство и последующего раздувания баллонного катетера Фогарти 14G, что вызывает необратимое механическое повреждение головного мозга [5]. К недостаткам этого способа моделирования смерти мозга можно отнести необходимость проведения оперативного вмешательства в виде трепанации черепа с помощью специальных хирургических инструментов (микрохирургическая дрель, сверло, баллонный катетер), а также возможные технические сложности, связанные с проведением баллонного катетера в полость черепа через отверстие в кости размером 1×1 мм, что значительно снижает воспроизводимость модели и удорожает ее исполнение.
Цель исследования: апробировать в эксперименте патогенетически адекватную модель смерти мозга вследствие повышения ВЧД с постепенной индукцией, позволяющую оценивать изменения, развивающиеся в органах потенциального донора.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве биомодели были выбраны 6–8-месячные половозрелые беспородные крысы-самцы массой 250–300 г (n = 32). Эксперименты были проведены на кафедрах топографической анатомии и оперативной хирургии и патофизиологии ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России с соблюдением требований Европейской конвенции по содержанию, кормлению и уходу за подопытными животными, а также выводу их из эксперимента и последующей утилизации (Страсбург, 1986) и соответствовало требованиям международных рекомендаций ARRIVE [6]. Минимальное достаточное количество экспериментальных животных в группе, необходимое для получения достоверных результатов, было рассчитано по формуле F. Lopez-Jimenez и соавт. [7] и составило 8 особей.
Эксперимент проводили по разработанному нами способу [8]. С учетом апробации модели острого эксперимента и прогнозируемой высокой летальности в экспериментальную группу вошли 24 животных. Всех крыс экспериментальной и контрольной (n = 8) групп наркотизировали 10% диэтиловым эфиром (ООО ПХФК «Медхимпром», Россия), катетеризировали левую общую сонную артерию для регистрации систолического и диастолического артериального давления, частоты сердечных сокращений (ЧСС), рассчитывали среднее артериальное давление (АДср.) по формуле АДср. = АД диастолическое + 1/3 (АД систолическое – АД диастолическое). Далее осуществляли им интубацию трахеи и переводили животных на искусственную вентиляцию легких (ИВЛ). Схема эксперимента представлена на рис. 1.
Для моделирования смерти мозга (точка 0) в положении животного лежа на животе пальпировали наружный затылочный выступ (protuberantia occipitalis externa) и остистый отросток II шейного позвонка, производили вкол иглы 22G с мандреном в мягкие ткани и далее вдоль чешуи затылочной кости, пунктировали большую цистерну (cisterna magna), что определялось по появлению капли спинномозговой жидкости в канюле после удаления мандрена (рис. 1). Иглу направляли горизонтально, продвигали на всю длину в полость черепа, соединяли с механическим тонометром. В полость черепа нагнетали атмосферный воздух до достижения давления, равного АДср., со скоростью 20 мм рт. ст./мин, время экспозиции повышенного давления составляло 5 мин, после чего ВЧД снижали в 2 раза и прекращали подачу диэтилового эфира в дыхательный контур [8].
Через 30 мин (точка 1) проводили констатацию смерти мозга у экспериментального животного на основании следующих общепринятых критериев [9]: отсутствие самостоятельного дыхания (апноэ), подтвержденное положительным тестом апноэтической оксигенации; полное и устойчивое отсутствие сознания (кома); отсутствие фотореакции зрачков и роговичных рефлексов (рис. 1). В соответствии с протоколом констатации смерти мозга при наличии положительного теста апноэтической оксигенации и признаков смерти мозга при физикальном исследовании дополнительные инструментальные методы (церебральная ангиография, электроэнцефалография, транскраниальная допплерография) не проводятся [9].
Для кондиционирования донора в течение 3 ч животным экспериментальной группы проводили ИВЛ, мониторинг показателей гемодинамики и сердечного ритма, поддерживали температуру тела на уровне 37 °С. При снижении АДср. ниже 75 мм рт. ст. проводили инфузию раствора «Гелофузина» (B.Braun Medical AG, Швейцария) для обеспечения адекватной перфузии потенциальных донорских органов. В этой группе вывод животных из эксперимента заканчивали через 3 ч после моделирования смерти мозга (точка 2) прекращением волемической поддержки и ИВЛ (рис. 1).
На этапе разработки модели смерти мозга 6 животных экспериментальной группы были исключены из исследования по причине развития биологической смерти: 3 крысы из-за проблем с интубацией и проведением ИВЛ и 3 – из-за остановки сердечной деятельности. Погибшим животным выполняли краниотомию с целью валидации экспериментальной модели, при макроскопической оценке степени повреждения головного мозга выявляли множественные кровоизлияния и каудальное смещение мозговых структур с компрессией и вклинением ствола мозга.
Вывод контрольных животных из эксперимента заканчивали через 3 ч (точка 2) удалением катетера из сонной артерии, прекращением подачи анестетика, остановкой ИВЛ и помещением в газовую камеру.
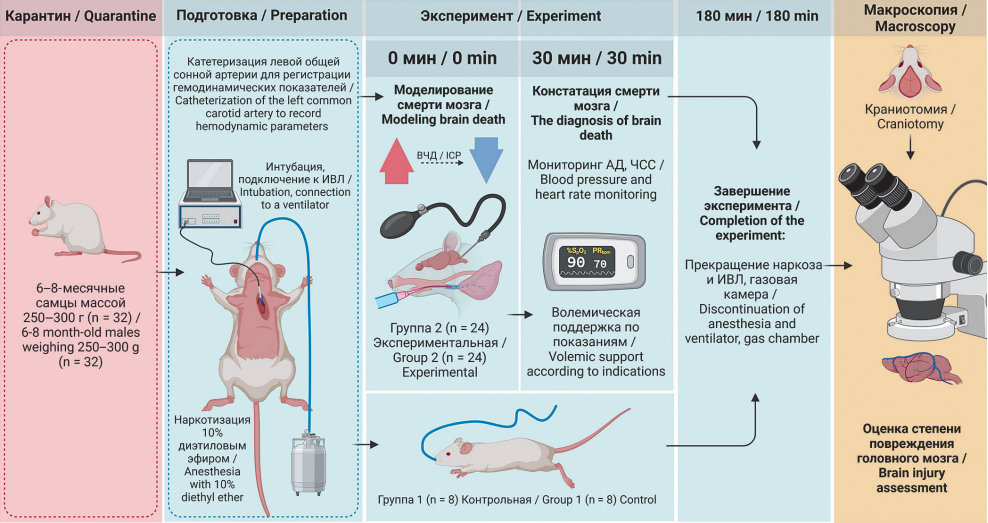
РИС. 1. Схема эксперимента.
Примечание: ИВЛ - искусственная вентиляция легких; ВЧД - внутричерепное давление; АД - артериальное давление; ЧСС - частота сердечных сокращений.
FIG. 1. Experimental design.
Note: ICP - intracranial pressure.
Статистический анализ
Для проверки нормальности распределения полученных данных использовали критерий Шапиро – Уилка. В связи с тем что гипотеза о нормальном распределении данных была отклонена, далее использовали непараметрические критерии. Для оценки различий между показателями гемодинамики контрольной и экспериментальной групп использовали критерий Манна – Уитни. Для оценки различий между показателями гемодинамики до и после моделирования смерти мозга использовали критерий Вилкоксона. Данные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили). Критический уровень значимости при тестировании статистических гипотез принимали равным 0,05. Данные обрабатывались с помощью программы Statistica 13.0 (TIBCO, США).
РЕЗУЛЬТАТЫ
Смерть мозга была констатирована у всех 18 экспериментальных животных. При оценке их неврологического статуса, по мере повышения ВЧД наблюдался тремор нижних конечностей с преобладанием тонуса мышц-разгибателей, то есть развивалась децеребрационная ригидность. Спустя 30 мин от начала индукции смерти мозга при временном прекращении ИВЛ в течение 1 мин отсутствовали самостоятельные дыхательные движения грудной клетки, а также сознание и мышечный тонус, не вызывались роговичные рефлексы, отсутствовала фотореакция зрачков.
В течение 2 ч эксперимента вследствие прогрессирования недостаточности кровообращения биологическая смерть развилась у 3 крыс (летальность 17%), в течение 3 ч. еще у 7 (летальность 39%). Общая летальность за 3 часа составила 56%.
Динамика показателей АДср. и ЧСС в ходе эксперимента представлена на рисунках 2 и 3.
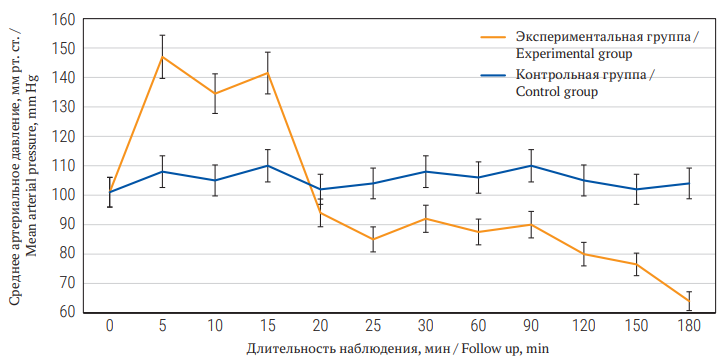
РИС. 2. Динамика среднего артериального давления у беспородных крыс-самцов после моделирования смерти мозга и в контрольной группе в течение 180 мин.
FIG. 2. Dynamics of mean blood pressure in outbred male rats after simulating brain death and in the control group for 180 min.
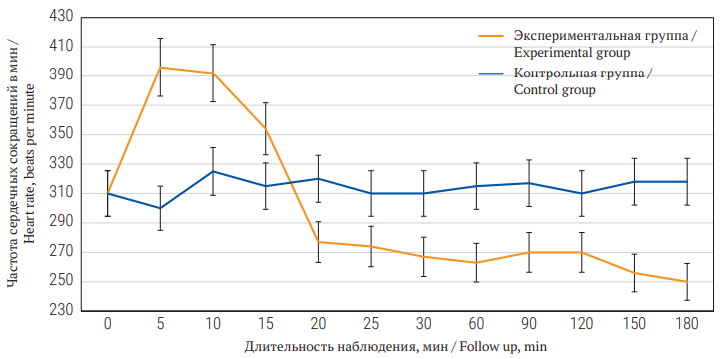
РИС. 3. Динамика частоты сердечных сокращения у беспородных крыс-самцов после моделировании смерти мозга и в контрольной группе в течение 180 мин.
FIG. 3. Dynamics of heart rate in outbred male rats after simulating brain death and in the control group for 180 minutes.
Показатели АДср. и ЧСС между контрольной и экспериментальной группами до индукции смерти мозга статистически значимо не отличались и составляли АДср. 101 (90; 105) мм рт. ст., ЧСС 310 (297; 315) уд./мин. Через 5 мин от начала индукции смерти мозга в экспериментальной группе было выявлено значительное повышение АДср. до 147 (140; 150) мм рт. ст. (p = 0,01) и ЧСС до 396 (384; 406) уд./мин (р = 0,03). Далее в течение 20 мин отмечалось постепенное снижение АДср. до 94 (90; 100) мм рт. ст. и ЧСС до 290 уд./мин.
В период наблюдения от 26 до 90 мин в экспериментальной группе регистрировалась относительная стабилизация АДср. на уровне 87–92 мм рт. ст., отмечалась тенденция к брадикардии с ЧСС от 263 до 274 уд/мин (p = 0,01) по сравнению с исходными значениями. Через 120 и 150 мин от начала индукции смерти мозга наблюдалось некоторое снижение АДср. до 75–80 мм рт. ст. (p = 0,03), снижение ЧСС до 256–264 уд./мин (p = 0,01) по сравнению с исходными значениями. К концу третьего часа эксперимента, несмотря на волемическую поддержку, у экспериментальных животных продолжалось снижение АДср. до 64 (61; 67) мм рт. ст. (р = 0,02), наряду с этим усугублялась брадикардия до 250 (248; 260) уд/мин (р = 0,01) по сравнению с исходными величинами, что свидетельствует о развитии декомпенсации гемодинамических расстройств.
ОБСУЖДЕНИЕ
В проведенном нами исследовании представлены результаты экспериментальной апробации модели донора со смертью мозга с постепенной индукцией ВЧД. При осуществлении предлагаемого способа индукции смерть мозга является неизбежным следствием постепенного снижения церебральной перфузии, что последовательно приводит сначала к дисциркуляции, а затем и дислокации мозговых структур и, тем самым, к прекращению всех функций головного мозга.
Показано, что в ходе моделирования смерти мозга предлагаемым способом развиваются фазные нарушения центральной гемодинамики, которые характеризуются начальной кратковременной гипердинамической реакцией, сопровождающейся артериальной гипертензией и тахикардией, и последующей продолжительной гиподинамической стадией с развитием артериальной гипотензии и брадикардии, что согласуется с данными литературы [10][11].
Необратимое тотальное повреждение ЦНС с последующим развитием смерти мозга представляет собой мощное стрессорное воздействие на организм в целом. В результате в организме потенциального донора органов запускается выраженная нейроэндокринная реакция, связанная с первоначальной активацией, а затем угнетением гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем [12–14]. У пострадавших и у экспериментальных животных со смертью мозга наблюдается значительное повышение концентрации катехоламинов в крови [14][15]. Гиперкатехоламинемия, как известно, ассоциирована со смещением метаболических реакций в сторону преобладания катаболизма, вазоконстрикцией и активацией свободнорадикального окисления, что в конечном итоге приводит к разобщению окислительного фосфорилирования и тканевой гипоксии [15][16].
Смерть мозга как терминальное состояние организма донора является начальным, но далеко не единственным звеном в цепи ишемического повреждения донорских органов в ходе трансплантации. Кроме собственно ишемии, важнейшим звеном в генезе ухудшения морфофунционального состояния трансплантатов выступает системная воспалительная реакция, которая реализуется путем значительного повышения концентрации провоспалительных цитокинов, таких как интерлейкин 1 альфа, интерлейкин 6, фактор некроза опухоли-альфа в крови и активации опосредованных ими проапоптотических сигнальных каскадов в периферических тканях [17][18].
Становится очевидным, что донорские органы, эксплантированные после смерти мозга даже у молодого условно здорового субъекта, не являются в полной мере интактными, а находятся в состоянии исходной, зачастую латентной дисфункции различной степени. Это положение подтверждается данными о худшей выживаемости трупных трансплантатов, в частности почки, в сравнении с органами, полученными от живых родственных доноров [10]. С другой стороны, возможности для коррекции функционального состояния донорских органов после смерти мозга представляют значительный интерес и требуют дальнейших исследований.
Необходимо отметить, что общепринятой экспериментальной модели смерти мозга, в полной мере пригодной для всесторонней оценки развивающихся патологических изменений в донорских органах, в настоящее время не разработано. Так, к существенным недостаткам, присущим моделям смерти мозга с быстрой индукцией, следует отнести необходимость дополнительного введения препаратов инотропного действия для поддержания уровня АДср., что усугубляет вазоконстрикцию и способствует дальнейшему ухудшению кровотока в периферических органах и тканях вплоть до развития ишемического повреждения.
Формирование наблюдаемого паттерна гемодинамических реакций в ответ на значительное повышение ВЧД, по всей видимости, может быть объяснено с позиций утраты поврежденным головным мозгом интегративной функции, а также нарушением вегетативной регуляции сосудистого тонуса и ритма сердца вследствие повреждения сосудодвигательного центра продолговатого мозга. Согласно классическому описанию о компенсаторных реакциях в ответ на увеличение ВЧД, у экспериментальных животных наблюдается артериальная гипертензия, брадикардия и нерегулярное дыхание, что впоследствии было названо рефлексом (триадой) Кушинга [19].
Гипердинамические реакции системы кровообращения при повышении ВЧД, как считается, направлены на обеспечение церебральной перфузии на адекватном уровне. При распространении ишемии на продолговатый мозг происходит резкая активация симпатоадреналовой системы с увеличением сердечного выброса, тахикардией и ростом периферического сосудистого сопротивления. Смерть мозга наступает в случае прогрессирования внутричерепной гипертензии за счет декомпенсации адаптивных реакций стволовых структур и других систем организма. Далее ишемическое повреждение, достигнув шейных сегментов спинного мозга, вызывает симпатическую денервацию сердца и сосудистого русла. Закономерно наступает гиподинамическая стадия расстройств гемодинамики с развитием системной гипотензии за счет брадикардии и утраты вазомоторного тонуса. Критическое состояние гемодинамики усугубляется гиповолемией, которая возникает как последствие повреждения и последующего отека мозга, а также является результатом метаболических, эндокринных и электролитных нарушений [20]. Изменения гемодинамических нарушений, наблюдаемых в эксперименте, являются схожими с таковыми при массивных внутричерепных кровоизлияниях и у доноров со смертью мозга в клинической практике, что может свидетельствовать о патогенетической адекватности предлагаемой биомодели [20].
Проведенное нами экспериментальное исследование носило пилотный характер и было выполнено на выборке ограниченного объема. Следующим этапом исследования будет углубленное изуче- ние выраженности функционально-метаболических и структурных нарушений в органах в ходе кондиционирования донора со смертью мозга и возможности коррекции этих нарушений на предтрансплантационном этапе.
ЗАКЛЮЧЕНИЕ
Результаты экспериментальной апробации модели потенциального донора с постепенной индукцией смерти мозга, разработанной на беспородных крысах, показали, что она является воспроизводимой, патогенетически адекватной и позволяет оценивать состояние потенциальных донорских органов в течение 3 ч после индукции смерти мозга.
ВКЛАД АВТОРОВ
П.А. Ермолаев, А.С. Вяльцин и Л.О. Барская провели эксперимент, сбор данных и их статистическую обработку, анализ литературных источников, составили текст статьи. Т.П. Храмых осуществляла общее руководство написанием статьи, участвовала в критической доработке и редактировании рукописи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTION
Pavel A. Ermolaev, Alexey S. Vyaltsin and Lyubov O. Barskaya carried out the experiment, data collection and statistical analysis, analyzed literature sources and compiled the text of the article. Tatyana P. Khramykh provided project general guidance, contributed to the critical revision and editing of the manuscript. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России (№ 4-24.11.2023).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Omsk State Medical University, No. 4 of 24.11.2023.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare no conflict of interest.
Financing. The study was not sponsored (own resources).
Список литературы
1. Guo Z., Luo T., Mo R., et al. Ischemia-free organ transplantation – a review. Curr Opin Organ Transplant. 2022 Aug 1; 27(4): 300– 304. https://doi.org/10.1097/MOT.0000000000000998. Epub 2022 Jul 5. PMID: 36354255
2. Yoshikawa M.H., Rabelo N.N., Welling L.C., et al. Brain death and management of the potential donor. Neurol Sci. 2021 Sep; 42(9): 3541–3552. https://doi.org/10.1007/s10072-021-05360-6. Epub 2021 Jun 17. PMID: 34138388; PMCID: PMC8210518
3. Zens T.J., Danobeitia J.S., Chlebeck P.J., et al. Guidelines for the management of a brain death donor in the rhesus macaque: A translational transplant model. PLoS ONE 2017 Sep 19; 12(9): e0182552. https://doi.org/10.1371/journal.pone.0182552. PMID: 28926566; PMCID: PMC5604963
4. Esmaeilzadeh M., Sadeghi M., Heissler H.E., et al. Experimental rat model for brain death induction and kidney transplantation. J Invest Surg. 2020 Feb; 33(2): 141–146. https://doi.org/10.1080/08941939.2018.1480677. Epub 2018 Oct 18. PMID: 30335532
5. Petersen A., Soderstrom M., Saha B., Sharma P. Animal models of traumatic brain injury: a review of pathophysiology to biomarkers and treatments. Exp Brain Res. 2021 Oct; 239(10): 2939–2950. https://doi.org/10.1007/s00221-021-06178-6. Epub 2021 Jul 29. PMID: 34324019
6. Percie du Sert N., Ahluwalia A., Alam S., et al. Reporting animal research: explanation and elaboration for the ARRIVE guidelines 2.0. PLoS Biol. 2020 Jul 14; 18(7): e3000411. https://doi.org/10.1371/journal.pbio.3000411. PMID: 32663221; PMCID: PMC7360025
7. Lopez-Jimenez F., Pniagua D., Lamas G.A. La interpretación de los ensayos clínicos negativos [Interpretation of negative clinical trials]. Rev. Invest. Clin. 1998 Sep-Oct; 50(5): 435–440. Spanish. PMID: 9949676
8. Ермолаев П.А., Храмых Т.П. Патент РФ RU 2798902 С1, Способ моделирования смерти головного мозга в эксперименте. Опубликовано: 28.06.2023 Бюл. № 19
9. Clarke C., Management of the brain-dead organ donor. Indian J Thorac Cardiovasc Surg. 2021 Sep; 37(Suppl 3): 395–400. https://doi.org/10.1007/s12055-021-01224-y. Epub 2021 Sep 17. PMID: 34548770; PMCID: PMC8445737
10. Jurcau A., Simion A. Neuroinfl ammation in cerebral ischemia and ischemia/reperfusion injuries: from pathophysiology to therapeutic strategies. Int J Mol Sci. 2021 Dec 21; 23(1): 14. https://doi.org/10.3390/ijms23010014. PMID: 35008440; PMCID: PMC8744548
11. Pomper G., Trescher K., Santer D., et al. Introducing a mouse model of brain death. J Neurosci Methods. 2010 Sep 30; 192(1): 70–74. https://doi.org/10.1016/j.jneumeth.2010.07.019. Epub 2010 Jul 23. PMID: 20655951
12. Kalra S., Malik R., Singh G., et al. Pathogenesis and management of traumatic brain injury (TBI): role of neuroinfl ammation and anti-infl ammatory drugs. Infl ammopharmacology. 2022 Aug; 30(4): 1153–1166. https://doi.org/10.1007/s10787-022-01017-8. Epub 2022 Jul 8. PMID: 35802283; PMCID: PMC9293826
13. Visser K., Koggel M., Blaauw J., et al. Blood-based biomarkers of infl ammation in mild traumatic brain injury: A systematic review. Neurosci Biobehav Rev. 2022 Jan; 132: 154–168. https://doi.org/10.1016/j.neubiorev.2021.11.036. Epub 2021 Nov 23. PMID: 34826510
14. Виноградов В.Л. Актуальные вопросы органного донорства. Введение. Лекция. Трансплантология. 2013; 4: 15–23
15. Feng D., Lewis A. Brain death: ethical and legal challenges. Neurol Clin. 2023 Aug; 41(3): 469–483. https://doi.org/10.1016/j.ncl.2023.03.004. Epub 2023 Apr 20. PMID: 37407100
16. Walweel K., Boon A.C., See Hoe L.E., et al. Brain stem death induces pro-infl ammatory cytokine production and cardiac dysfunction in sheep model. Biomed J. 2022 Oct; 45(5): 776–787. https://doi.org/10.1016/j.bj.2021.10.007. Epub 2021 Oct 16. PMID: 34666219; PMCID: PMC9661508
17. Alsbrook D.L., Di Napoli M., Bhatia K., et al. Neuroinfl ammation in acute ischemic and hemorrhagic Stroke. Curr Neurol Neurosci Rep. 2023 Aug; 23(8): 407–431. https://doi.org/10.1007/s11910023-01282-2. Epub 2023 Jul 3. PMID: 37395873; PMCID: PMC10544736
18. Marasco S., Kras A., Schulberg E., et al. Donor brain death time and impact on outcomes in heart transplantation. Transplant Proc. 2013 Jan-Feb; 45(1): 33–37. https://doi.org/10.1016/j.transproceed.2012.08.008. PMID: 23375272
19. Tsai Y.H., Lin J.Y., Huang Y.Y., Wong J.M. Cushing response-based warning system for intensive care of brain-injured patients. Clin Neurophysiol. 2018 Dec; 129(12): 2602–2612. https://doi:10.1016/j.clinph.2018.09.010. Epub 2018 Sep 21. PMID: 30453271
20. Ng S.Y., Lee A.Y.W. Traumatic brain injuries: pathophysiology and potential therapeutic targets. Front Cell Neurosci. 2019 Nov 27; 13: 528. https://doi.org/10.3389/fncel.2019.00528. PMID: 31827423; PMCID: PMC6890857
Об авторах
П. А. ЕрмолаевРоссия
Ермолаев Павел Александрович, канд. мед. наук, ассистент кафедры топографической анатомии и оперативной хирургии
ул. Ленина, д. 12, г. Омск, 644099
Т. П. Храмых
Россия
Храмых Татьяна Петровна, д-р мед. наук, доцент, заведующая кафедрой топографической анатомии и оперативной хирургии
ул. Ленина, д. 12, г. Омск, 644099
А. С. Вяльцин
Россия
Вяльцин Алексей Сергеевич, канд. мед. наук, доцент кафедры топографической анатомии и оперативной хирургии
ул. Ленина, д. 12, г. Омск, 644099
Л. О. Барская
Россия
Барская Любовь Олеговна, канд. мед. наук, доцент кафедры топографической анатомии и оперативной хирургии
ул. Ленина, д. 12, г. Омск, 644099
Дополнительные файлы

|
1. Чек лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(100KB)
|
Метаданные ▾ | |







































