Перейти к:
Специфическая противоопухолевая активность анти-СА125 CAR-T-лимфоцитов в отношении СА125-позитивных и СА125-негативных клеток
https://doi.org/10.47093/2218-7332.2024.15.2.36-47
Аннотация
Цель. Оценить противоопухолевую эффективность разработанного нами препарата на основе цитотоксических Т-лимфоцитов, генетически модифицированных химерным антигенным рецептором (CAR), специфичным к антигену СА125 в отношении как СА125-позитивных, так и СА125-негативных клеточных культур.
Материалы и методы. Исследование было проведено в условиях in vitro на СА125-позитивных клетках рака яичника человека (OVCAR-3, OVKATE) и СА125-негативных клетках (рака молочной железы MCF-7, эмбриональной почки НЕК293). Цитотоксические эффекты в отношении опухолевых клеток оценивали через 0, 4, 8 и 24 часа с помощью бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиевого (МТТ) и лактатдегидрогеназного (ЛДГ) тестов. Также было проведено исследование изменения количества клеток в реальном времени при воздействии трансфецированных лимфоцитов при помощи прибора RTCA iCELLIgence (ACEA Biosciences, США). Контролем специфичности являлись лимфокин-активированные киллеры (ЛАК).
Результаты. На культурах клеток OVCAR-3 и OVKATE был получен выраженный цитотоксический эффект при использовании анти-СА125 CAR-T-лимфоцитов, превышающий воздействие ЛАК в 1,3 раза. Популяция клеток в исследуемых опытных образцах снижалась на 70 ± 4%, что превосходило эффект ЛАК на 9 ± 8,2%. В отношении MCF-7 цитотоксическое воздействие анти-СА125 CAR-T лимфоцитов имеет минимальное значение, что проявилось в снижении относительного количества живых клеток на 25,8%, по сравнению с цитотоксичностью ЛАК в 68%. Исследование изменения количества клеток в реальном времени доказало высокий специфический цитотоксический эффект анти-СА125 CAR-T-лимфоцитов в отношении опухолевых культур, экспрессирующих СА-125, при этом уступающий по эффективности ЛАК для культур, не экспрессирующих СА125 (MCF-7, HEK293).
Заключение. Применение анти-СА125 CAR-T-лимфоцитов в отношении СА125-позитивных опухолевых клеточных линий OVCAR-3 и OVKATE продемонстрировало выраженный специфический цитотоксический эффект, превышающий цитотоксическое воздействие ЛАК, чего не удалось достигнуть в отношении СА125негативных клеток MCF-7 и НЕК293.
Ключевые слова
Рак яичников занимает восьмое место в структуре онкологических заболеваний у женщин и третье место в структуре заболеваний женской репродуктивной системы [1, 2] и является второй по частоте причиной смертности, связанной с гинекологическими заболеваниями [3][4].
Примерно 90% опухолей яичника составляет эпителиальная карцинома яичника [5]. Из-за отсутствия специфических ранних симптомов и адекватных методов скрининга первичной эпителиальной карциномы яичников [6] более 51% ее случаев диагностируют на стадии II и 29% – на стадии IV [7][8]. Основным методом лечения для таких пациентов является обширное хирургическое вмешательство в сочетании с химиотерапией, однако прогноз для таких пациентов на сегодня остается неблагоприятным [9][10]. Отсутствие серьезных изменений за последние десятилетия по показателю общей выживаемости у женщин с диагнозом «рак яичников» [11], высокая частота рецидивов и резистентных к химиопрепаратам форм свидетельствуют о необходимости создания новых методов лечения этой высоколетальной нозологии.
Адоптивная Т-клеточная иммунотерапия с использованием химерных антигенных рецепторов (Chimeric antigen receptor T-cell therapy, CAR-T) является одним из наиболее интенсивно развивающихся и перспективных методов лечения онкологических заболеваний, позволяющим минимально воздействовать на нормальные ткани организма благодаря своей высокой специфичности [12]. Однако если лечение гемобластозов с помощью кластеров дифференцировки 19, 20 (Clusters of differentiation 19, 20, CD19/20) в составе CAR-T [13][14] получило широкое распространение в клинической практике, то использование CAR-T для лечения солидных опухолей столкнулось с рядом принципиальных проблем: наличием побочных эффектов, связанных с экспрессией целевого антигена нормальными клетками организма вследствие относительной специфичности опухолевых антигенов, а также токсичностью вне опухоли (в маточной трубе, эндометрии, перикарде, брюшине), локальной иммуносупрессией CAR-Т-лимфоцитов клетками микроокружения опухоли и недостаточным цитотоксическим эффектом в отношении крупных новообразований [15][16]. Для решения этих проблем ведутся активные исследования, направленные как на модификацию конструкции CAR с целью усиления эффективности генно-модифицированных Т-лимфоцитов [17][18], так и на увеличение доставки CAR-T-лимфоцитов в ткани опухоли с помощью хоминг-рецепторов (homing receptors) [19][20].
CAR-Т для лечения рака яичников является многообещающим подходом [21], в частности, с использованием CAR-T-продуктов, нацеленных на различные антигены, одним из которых является углеводный антиген 125 (Carbohydrate antigen 125, CA125), экстрацеллюлярный домен гликопротеина муцина 16 (Mucin 16, MUC16) [21][22].
MUC16 гиперэкспрессируется в различных опухолях и участвует в активации пролиферации и метастазировании раковых клеток [23]. Показано, что в 80% случаев эпителиальная карцинома яичников экспрессирует MUC16 [21][23], а его внеклеточный сегмент (Mucin 16 extracellular segment, sМUС16) благодаря десквамации и протеолитическому расщеплению N-концевого домена MUC16 попадает в кровоток с поверхности клеток опухоли [24][25]. sМUС16, антигенный эпитоп CA125, обнаруживают в сыворотке крови методом иммуноферментного анализа, его принято считать лучшим биомаркером эпителиального рака яичников [26]. МUС16 и его растворимый фрагмент CA125 занимают особую позицию среди белков, являясь не только диагностическим биомаркером, но и привлекательной терапевтической мишенью для антиген-позитивных опухолей, включая рак яичника [27].
В настоящее время нами разрабатывается соматоклеточный лекарственный препарат на основе анти-СА125 CAR-T-лимфоцитов, предназначенный для лечения СА125-позитивного рака яичников. Препарат представляет собой Т-лимфоциты, генетически модифицированные ex vivo ДНК-плазмидой, обеспечивающей экспрессию на поверхности клеток CAR с высокой аффинностью к опухоль-специфичному антигену СА125. Отсутствие встраивания в ДНК клетки-хозяина Т-лимфоцита резко снижает риск побочных эффектов, в частности, возможные мутагенные реакции. Разработанная нами технология получения СА125 CAR-T-лимфоцитов не требует дополнительного наращивания клеток, что существенно снижает стоимость процедуры.
Цель исследования: оценить противоопухолевую эффективность in vitro нового соматоклеточного лекарственного препарата на основе анти-СА125 CAR-T лимфоцитов. Оценить цитотоксичность на основе воздействия исследуемого препарата в отношении СА125-позитивных и СА125-негативных клеточных линий, а также сравнить с эффектом лимфокин-активированных киллеров (ЛАК).
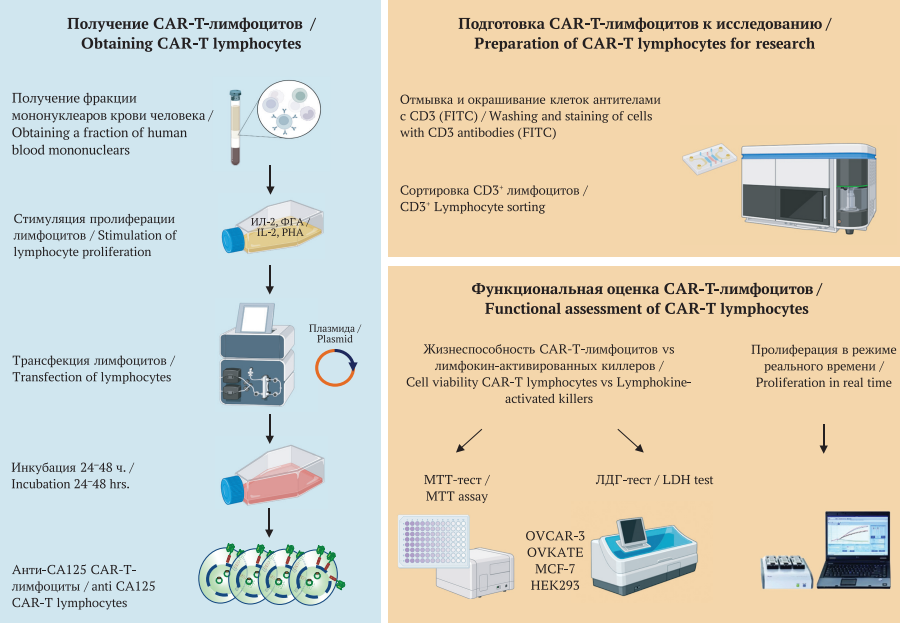
РИС. 1. Изучение специфической противоопухолевой активности анти-СА125 CAR-T-лимфоцитов. Первый этап: выделение фракции мононуклеаров крови и трансфекция клеток плазмидным вектором, несущим ген CAR к СА125; последующая 24-часовая инкубация для экспрессии CAR на мембране лимфоцитов; параллельно с получением CAR-Т продукта активация лимфокин-активированных киллеров (ЛАК). Второй этап (после анализа полученной фракции CAR-Т-лимфоцитов): оценка цитотоксичности с помощью МТТ и ЛДГ-тестов; оценка воздействия CAR-Т-лимфоцитов на пролиферацию исследуемых культур клеток в режиме реального времени.
Примечание: CAR – Chimeric Antigen Receptor, химерный антигенный рецептор; CAR-T – Chimeric antigen receptor T-cell therapy, адоптивная Т-клеточная иммунотерапия; ИЛ-2 – интерлейкин 2; ФГА – фитогемагглютинин; СА125 – Carbohydrate antigen 125, углеводный антиген 125; CD3 (FITC) – Cluster of differentiation, кластер дифференцировки; МТТ – бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия; ЛДГ – лактатдегидрогеназа.
FIG. 1. Study of the specific antitumor activity of anti-CA125 CAR-T lymphocytes. First stage: isolation of the blood mononuclear cell fraction and transfection of cells with a plasmid vector carrying the CAR gene for CA125; subsequent 24-hour incubation for CAR expression on the lymphocyte membrane; in parallel with the production of the CAR-T product, activation of lymphokine-activated killer cells (LAK). Second stage (after analysis of the obtained fraction of CAR-T lymphocytes): assessment of cytotoxicity using MTT and LDH tests; assessment of the impact of CAR-T lymphocytes on the proliferation of cell cultures under study in real time.
Note: CAR – Chimeric Antigen Receptor; CAR-T – Chimeric antigen receptor T-cell therapy; IL-2 – Interleukin 2; PHA – Phytohemagglutinin; СА125 – Carbohydrate antigen 125; CD3 (FITC) – Cluster of differentiation; MTT – 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide; LDH – lactate dehydrogenase.
МАТЕРИАЛЫ И МЕТОДЫ
Получение фракции мононуклеаров периферической крови человека
Мононуклеары периферической крови выделяли из гепаринизированной периферической крови человека (12–30 МЕ гепарина/1 мл крови) центрифугированием на ступенчатом градиенте фиколла-урографина плотностью 1,077 г/мл (ООО НПП «ПанЭко», Россия) при ускорении в 700 g в течение 25 мин. Далее их трижды отмывали фосфатно-солевым буфером, pH 7,4 при 300, 160 и 300 g по 10 мин и культивировали в среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки (ЭТС) (Gibco™, Thermo Fisher Scientific, США), 0,3 мг/мл L-глутамина (ООО НПП «ПанЭко», Россия) и 10 мкг/мл гентамицина (ООО НПП «ПанЭко», Россия) при 37 °С и 5% СO2. Количество и состав выделенных мононуклеаров периферической крови контролировали на гематологическом анализаторе Advia-60 (Bayer HealthCare LLC, США). Лимфоциты стимулировали к пролиферации добавлением 50 Ед/мл интерлейкина-2 (ООО «НПК «Биотех», Россия) и 2 мкг/мл фитогемагглютинина (ООО НПП «ПанЭко», Россия). Клетки культивировали в чашках Петри с адгезивным покрытием в стерильных условиях при температуре 37 °С во влажной атмосфере с 5% CO2 в течение 24 ч. За это время происходила адгезия моноцитов, содержащихся в мононуклеарной фракции крови, к дну чашек Петри. Неприкрепившиеся клетки, представляющие собой в основном активированные лимфоциты, смывали пипетированием и использовали для электропорации.
Процедура трансфекции, получение CAR-T-лимфоцитов
Исследуемый препарат содержал Т-лимфоциты, генетически модифицированные ДНК-плазмидой pCI/3CА2-CAR3g. Данная плазмида, несущая ген CAR, специфичный к антигену MUC16, представляла собой конструкцию третьего поколения, включающую шарнирную область CD8, трансмембранную область CD28 и активационные домены CD137 (4-1 ВВ), CD 247 (ζ-цепь). Распознающая часть была сконструирована на основании моноклонального антитела X181 [28]. Трансфекция лимфоцитов плазмидной конструкцией производилась на электропораторе Lonza Amaxa Nucleofector II с использованием набора Human T-Cell Nucleofector Kit (Lonza, Швейцария), программы Т-020 или Т-023. Для трансфекции одного образца объемом 100 мкл использовали 5×106 клеток и 5 мкг стерильного раствора плазмиды с концентрацией 1 мг/мл. После проведения трансфекции клетки переносили в чашки Петри и культивировали в течение 24–48 часов в стандартных стерильных условиях 5% СО2, 37 °С, с использованием среды RPMI-1640 с содержанием 10% ЭТС и 10 мкг/мл гентамицина. Через сутки фракцию мононуклеаров дважды отмывали в 10 мл RPMI-1640 при 300 g в течение 5 минут, окрашивали антителами к CD3-FITC (Sony, Япония) и проводили выборку CD3-положительных Т-лимфоцитов на клеточном сортере SH8000 (Sony, Япония). Количество жизнеспособных лимфоцитов, несущих CAR, оценивали на проточном цитофлуориметре Cytomics FC 500 (Beckman Coulter, США) с помощью окраски пропидием йодидом и антителами к CD3 (Beckman Coulter, США).
Клеточные линии
Противоопухолевую эффективность оценивали in vitro на моделях СА125-позитивных культур клеток аденокарцином яичника человека OVCAR-31 и OVKATE2 и СА125-негативных: рака молочной железы MCF-73 и эмбриональной почки человека НЕК2934. Клетки опухолевых культур культивировали в питательной среде DMEM (содержание глюкозы 4,5 г/л; ООО НПП «ПанЭко», Россия) с 10% ЭТС (Gibco, Thermo Fisher Scientific, США) и 10 мкг/мл гентамицина (ООО «ПанЭко», Россия).
Бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиевый тест
Для оценки цитотоксических эффектов, оказываемых лимфоцитами на клетки исследуемых опухолевых линий, были использованы три метода: бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиевый (МТТ) тест, лактатдегидрогеназный (ЛДГ) тест и оценка количества жизнеспособных клеток в условиях реального времени.
Для постановки МТТ-теста клетки рассеивали в лунки 96-луночного планшета и инкубировали до получения 50% конфлюэнтности, затем к клеткам-мишеням вносили эффекторные CAR-T-лимфоциты или ЛАК в количестве 10:1 по отношению к опухолевым клеткам. Ко-культивирование проводили в течение 8 часов в стандартных условиях (5% СО2, 37 °С), затем отбирали ростовую среду, проводили однократную промывку раствором Хенкса (ООО НПП «ПанЭко», Россия), далее в каждую лунку планшета вносили МТТ (Sigma-Aldrich, Германия) в концентрации 5 мг/мл в растворе Хенкса. После 2-часовой инкубации удаляли жидкость и в лунки планшета вносили по 100 мл раствора диметилсульфоксида (ООО НПП «ПанЭко», Россия), измеряли оптическую плотность на планшетном ридере SpectraMax i3 (Molecular Devices, США) при двух длинах волн, 540 и 690 нм. Контролем специфичности являлись ЛАК, полученные путем аналогичного выделения лимфоцитов периферической крови и последующей их инкубации с интерлейкином-2. В качестве негативных образцов использовали культуры OVCAR-3, OVKATE и MCF-7 без добавления эффекторных клеток.
Лактатдегидрогеназный тест
ЛДГ-тест, в отличие от МТТ-теста, отражает количество погибших клеток за все время инкубации (активность ЛДГ во внеклеточной инкубационной среде пропорциональна количеству погибших клеток). Объектом исследования явились линии OVCAR-3, OVKATE, MCF-7 и HEK293. ЛДГ-тест оценивался через 24 и 48 часов инкубации клеток-мишеней с CAR-T и ЛАК. При оценке цитотоксического эффекта с помощью ЛДГ-теста были использованы два значения количества вносимых лимфоцитов: 250 тыс. и 500 тыс. (соотношение эффекторов и клеток-мишеней – 10:1 и 20:1). Контролем специфичности являлись ЛАК, негативным контролем – образцы клеточных культур без воздействия цитотоксических клеток. Оценку уровня ЛДГ проводили на биохимическом анализаторе AU400 (Olympus, Япония).
Оценка пролиферации в реальном времени
Технология RTCA iCELLIgence (ACEA Biosciences, США) позволяет проводить оценку количества жизнеспособных адгезивных клеток по изменению показателя «клеточного индекса», отражающего зависимость количества жизнеспособных клеток от времени инкубации. Среда инкубации в исследовании цитотоксичности имела следующий состав: DMEM, 10 мкг/мл гентамицина (все – ООО НПП «ПанЭко», Россия) и 10% ЭТС (Gibco, Thermo Fisher Scientific, США). Клетки инкубировали в специализированных планшетах E-plate 16 (Agilent, США) в течение 24 часов. На момент начала опыта достигалась конфлюэнтность 50%, что составляло около 50 тыс. клеток на ячейку. Исследуемые клеточные продукты – CAR-T-лимфоциты и ЛАК вносили в лунки планшета в количестве 250 тыс. и 500 тыс. в 50 мкл среды RPMI1640, что соответствовало 5:1 и 10:1 эффекторов и клеток-мишеней. В качестве контроля использовались клетки опухолевых культур, к которым добавляли 50 мкл среды RPMI1640.
Статистический анализ
Все эксперименты были повторены три раза независимо друг от друга, показатели непрерывных переменных соответствовали нормальному распределению (тест Колмогорова – Смирнова и Крамера фон Мизеса) и представлены в виде среднего значения и стандартного отклонения. Группы сравнивались с помощью однофакторного дисперсионного анализа (ANOVA) и апостериорного теста Тьюки. Нормированное количество клеток представлено в виде доли (%), для сравнения групп по этому параметру использовался критерий хи-квадрат с апостериорным тестом. Статистическая значимость была установлена на уровне р < 0,05. Для обработки данных использовалась программа IBM SPSS v.23.0 (SPSS: An IBM Company, США).
РЕЗУЛЬТАТЫ
Оценка цитотоксического эффекта с помощью МТТ-теста
В ходе эксперимента проводили измерение количества метаболически активных клеток в культурах после воздействия исследуемого продукта на основе анти-СА125 CAR-T-лимфоцитов и ЛAK. Цитотоксический эффект оценивали через 4, 8 и 24 часа. Сравнение эффектов было проведено в отношении культур клеток опухолей женской репродуктивной системы MCF-7, OVCAR-3 и OVKATE.
Анти-СА125 CAR-T-лимфоциты оказывали стойкий цитотоксический эффект на клеточные культуры линий OVCAR-3 и OVКАТЕ. Популяция клеток в исследуемых опытных образцах снижалась на 70 ± 4%, что превосходило эффект, оказываемый ЛАК, на 9 ± 8,2%. Разница для цитотоксических эффектов, оказываемых анти-СА125 CAR-T-лимфоцитами и ЛАК, составила 1,3 раза.
В отношении СА125-негативной клеточной линии MCF-7 эффект исследуемого CAR-T продукта проявлялся в снижении относительного количества живых клеток на 25,8%. При инкубации клеток MCF-7 с ЛАК наблюдался более выраженный цитотоксический эффект – количество жизнеспособных клеток снижалось на 67,9% (35 ± 4% клеток сохраняли функциональную активность после 24-часовой инкубации).
Средние значения оптической плотности для трех независимых экспериментов представлены в таблице 1. Количество метаболически активных живых клеток вычисляли на основании принятия среднего значения количества клеток в контрольных образцах после 24-часовой инкубации за 100%, что выражено параметром «нормированное количество клеток». При сравнении значений контрольных и опытных образцов установлены статистически значимые отличия при воздействии ЛАК на все исследуемые клеточные культуры после 8 и 24 часов ко-культивирования. Анти-СА125 CAR-T-лимфоциты оказывали статистически значимые эффекты при воздействии на СА-125-позитивные линии через 8 и 24 часа инкубации и на клетки линии MCF-7 через 24 часа. Также при сравнении групп с применением ЛАК и CAR-T-лимфоцитов были обнаружены достоверные отличия в эффективности воздействия на все клеточные популяции после 24 часов инкубации.
При сравнении результатов не было выявлено статистически значимых различий цитотоксического эффекта ЛАК в зависимости от экспрессии СА125, в то же время разница в эффектах, оказываемых на клетки с разным уровнем экспрессии СА125 специфичными CAR-T-лимфоцитами через 24 часа инкубации, составила 44,5% (табл. 1).
Таблица 1. Результаты МТТ-теста CAR-T-лимфоцитов и ЛАК по сравнению с контролем на культурах клеток OVCAR-3, OVКАТЕ и MCF-7
Table 1. Results of the MTT test CAR-T lymphocytes and LAK compared with control on OVCAR-3, OVKATE and MCF-7 cell cultures
|
Клеточная культура / Cell culture |
Оптическая плотность / Optical density |
ANOVA, величина р / ANOVA, p value |
Нормированное количество клеток, % / Normalized cell count, % |
Хи-квадрат, величина р / Chi square, р value |
||||
|
Контроль / Control |
CAR-T / CAR-T |
ЛАК / LAK |
Контроль / Control |
CAR-T / CAR-T |
ЛАК / LAC |
|||
|
OVCAR-3 |
||||||||
|
0 ч / 0 h |
0,41 ± 0,024 |
0,414 ± 0,027 |
0,412 ± 0,035 |
n.s. |
84,5 |
85,3 |
84,9 |
n.s. |
|
4 ч / 4 h |
0,41 ± 0,03 |
0,319 ± 0,091 |
0,333 ± 0,128 |
n.s. |
84,6 |
65,7а |
68,6а |
<0,05 |
|
8 ч / 8 h |
0,419 ± 0,026 |
0,264 ± 0,084а |
0,22 ± 0,043а |
<0,05 |
86,4 |
54,5а |
45,4а |
<0,001 |
|
24 ч / 24 h |
0,485 ± 0,019 |
0,129 ± 0,019а, b |
0,168 ± 0,009а |
<0,05 |
100 |
26,7а |
34,7а |
<0,001 |
|
OVKАТЕ |
||||||||
|
0 ч / 0 h |
0,289 ± 0,06 |
0,291 ± 0,025 |
0,288 ± 0,02 |
n.s. |
76,8 |
77,3 |
76,5 |
n.s. |
|
4 ч / 4 h |
0,29 ± 0,031 |
0,253 ± 0,087 |
0,243 ± 0,043 |
n.s. |
77,1 |
67,4 |
64,5 |
n.s. |
|
8 ч / 8 h |
0,337 ± 0,027 |
0,216 ± 0,009а |
0,206 ± 0,025а |
<0,05 |
89,6 |
57,5а |
54,7а |
<0,01 |
|
24 ч / 24 h |
0,376 ± 0,018 |
0,123 ± 0,0а, b |
0,16 ± 0,008а |
<0,05 |
100 |
32,7 |
42,6 |
<0,001 |
|
MCF-7 |
||||||||
|
0 ч / 0 h |
0,337 ± 0,071 |
0,342 ± 0,051 |
0,337 ± 0,037 |
n.s. |
82,3 |
83,5 |
82,1 |
n.s. |
|
4 ч / 4 h |
0,314 ± 0,036 |
0,333 ± 0,08 |
0,28 ± 0,041 |
n.s. |
76,5 |
81,2 |
68,4 |
n.s. |
|
8 ч / 8 h |
0,342 ± 0,04 |
0,318 ± 0,128 |
0,214 ± 0,036а |
<0,05 |
83,4 |
77,6 |
52,1а |
<0,05 |
|
24 ч / 24 h |
0,41 ± 0,023 |
0,276 ± 0,087b |
0,132 ± 0,02а |
<0,05 |
100 |
74,2а |
32,1а,b |
<0,05 |
Примечание: МТТ – бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия; CAR-T – Chimeric antigen receptor T-cell therapy, адоптивная Т-клеточная иммунотерапия; ЛАК – лимфокин-активированные киллеры.
n.s. – not significant, не значимо.
а р < 0,05 при сравнении с контролем в апостериорном тесте Тьюки / хи-квадрат.
b р < 0,05 при сравнении с ЛАК в апостериорном тесте Тьюки / хи-квадрат.
Note: MTT – 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide; CAR-T – Chimeric antigen receptor T-cell therapy; LAK – Lymphokine-activated killer cells.
n.s. – not significant.
a p < 0.05 when compared with control in Tukey’s / Chi-square post hoc test.
b р < 0.05 when compared with LAK in in Tukey’s / Chi-square post hoc test.
Оценка цитотоксического эффекта с помощью ЛДГ-теста
Как представлено в таблице 2, для клеток линии OVCAR-3 результаты ЛДГ-теста схожи с результатами МТТ-теста, внесение CAR-T-лимфоцитов вызывает гибель клеток исследуемой культуры. Цитотоксический эффект CAR-T сопоставим с ЛАК, пропорционален времени инкубации и возрастает примерно в 2 раза при увеличении времени воздействия до 48 часов. Также показано, что уменьшение количества добавляемого продукта в 2 раза приводит к снижению цитотоксического эффекта в 1,3 раза при инкубации в течение 24 часов и незначительному снижению (в 1,1 раза) при увеличении времени инкубации до 48 часов.
Таблица 2. Результаты лактатдегидрогеназного теста после 24 и 48 часов инкубации с CAR-T-лимфоцитами и ЛАК по сравнению с контролем на культуры клеток OVCAR-3, OVKATE, MCF-7 и HEK293
Table 2. Results of lactate dehydrogenase test after 24 and 48 hours of incubation with CAR-T lymphocytes and LAK compared with control on OVCAR-3, OVKATE, MCF-7 and HEK293 cell cultures
|
Клеточная культура / Cell culture |
Часы / Hours |
Контроль / Control |
CAR-T 500 тыс. / CAR-T 500К |
CAR-T 250 тыс. / CAR-T 250К |
ЛАК 500 тыс. / LAK 500К |
ЛАК 250 тыс. / LAK 250К |
ANOVA, величина р / ANOVA, p value |
|
OVCAR-3 |
24 ч / 24 h |
1 |
3,4 ± 0,8a |
2,6 ± 0,8a |
3,2 ± 0,7a |
2,8 ± 0,6a |
<0,05 |
|
48 ч / 48 h |
1,3 ± 0,6 |
5,7 ± 1,4a |
4,8 ± 0,4a |
6,5 ± 0,9a |
5 ± 1,2a |
<0,05 |
|
|
OVKATE |
24 ч / 24 h |
1 |
4,8 ± 0,6a |
3,8 ± 0,8a |
4,9 ± 0,8a |
3,7 ± 0,6a |
<0,01 |
|
48 ч / 48 h |
1,5 ± 0,5 |
6,1 ± 1,2a |
5,6 ± 1,0a |
5,9 ± 0,8a |
5,5 ± 1,1a |
<0,05 |
|
|
MCF-7 |
24 ч / 24 h |
1 |
1,7 ± 0,6b |
1,3 ± 0,4b |
3,5 ± 0,9a |
2,9 ± 0,5a |
<0,05 |
|
48 ч / 48 h |
1,4 ± 0,7 |
3,1 ± 0,5a, b |
2,8 ± 0,5b |
5,8 ± 0,8a |
5,2 ± 1,1a |
<0,01 |
|
|
HEK293 |
24 ч / 24 h |
1 |
1,5 ± 0,8b |
1,3 ± 0,6b |
4,5 ± 0,9a |
3,7 ± 0,9a |
<0,05 |
|
48 ч / 48 h |
1,3 ± 0,6 |
1,9 ± 0,8b |
1,7 ± 0,6b |
5,9 ± 1,1a |
4,9 ± 0,8a |
<0,05 |
Примечание: CAR-T – Chimeric antigen receptor T-cell therapy, адоптивная Т-клеточная иммунотерапия; ЛАК – лимфокин-активированные киллеры.
а р < 0,05 при сравнении с контролем в апостериорном тесте Тьюки.
b р < 0,05 при сравнении с аналогичной группой ЛАК (250 тыс. или 500 тыс.) в апостериорном тесте Тьюки.
Note: CAR-T – Chimeric antigen receptor T-cell therapy; LAK – Lymphokine-activated killer cells.
a p < 0.05 when compared with control in Tukey’s post hoc test.
b р < 0.05 when compared with a similar LAK group (250К or 500К) in Tukey’s post hoc test.
Результаты ЛДГ-теста для культуры OVKATE показали, что наибольший эффект оказывают CAR-T-лимфоциты, экспрессирующие Т-клеточный рецептор к СА125. Эффект пропорционален времени инкубации, но при уменьшении количества вносимого продукта снижается в 1,3 раза при инкубации 24 часа и в 1,1 раза при инкубации 48 часов. Цитотоксические эффекты CAR-T лимфоцитов и ЛАК по данным ЛДГ-теста для клеток, экспрессирующих СА125, статистически значимо не отличаются.
При исследовании и сравнении цитотоксических эффектов, оказываемых CAR-T-лимфоцитами и ЛАК, на клетки, не экспрессирующие СА125 (MCF-7, HEK293), было показано, что ЛАК для обеих культур превосходит CAR-T по эффективности. Также отмечалось усиление эффекта при увеличении времени инкубации до 48 часов и увеличении количества вносимых лимфоцитов.
Таким образом, в ходе исследования было показано, что CAR-T-лимфоциты оказывают выраженный цитотоксический эффект на СА125-позитивные культуры. Данный эффект имеет зависимость от времени инкубации и количества внесенных лимфоцитов, а также превосходит цитотоксический эффект ЛАК. В отношении культур клеток, не экспрессирующих СА125, цитотоксический эффект ЛАК превышает эффект, оказываемый CAR-T.
Исследование влияния CAR-T на жизнеспособность клеток
Для исследования влияния CAR-T-лимфоцитов, экспрессирующих рецептор к СА125, на рост клеточных линий, различающихся по экспрессии СА125, проводили мониторинг в режиме реального времени (рис. 2).
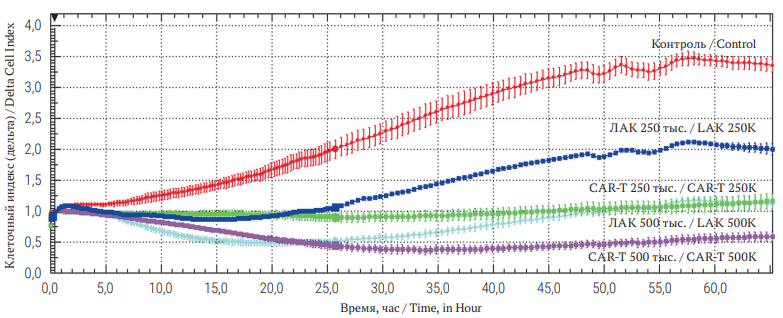
РИС. 2. Динамика количества клеток культуры OVKATE в процессе инкубации с/без CAR-T-лимфоцитами и ЛАК (получена с RTCA iCELLIgence).
Примечание: CAR-T – Chimeric antigen receptor T-cell therapy, адоптивная Т-клеточная иммунотерапия; ЛАК – лимфокин-активированные киллеры.
FIG. 2. Dynamics of OVKATE culture cell number during incubation with/without CAR-T lymphocytes and LAK (obtained from RTCA iCELLIgence).
Note: CAR-T – Chimeric antigen receptor T-cell therapy; LAK – Lymphokine-activated killer cells.
Как представлено на рисунке 2, в контрольных образцах наблюдается рост количества жизнеспособных клеток (увеличение показателя клеточного индекса в 3,5 раза). Внесение ЛАК и CAR-T к культуре клеток OVKATE в соотношении 10:1 (500 тыс.) приводит к снижению показателя клеточного индекса, что свидетельствует о снижении количества жизнеспособных клеток в лунках и наличии выраженного цитотоксического эффекта для ЛАК и CAR-T. Через 64 часа после внесения лимфоцитов индекс пролиферации в контрольных образцах более чем в пять раз превышает индекс в образцах с CAR-T-лимфоцитами.
Внесение CAR-T-лимфоцитов и ЛАК в количестве 5:1 (250 тыс.) оказывает менее выраженный цитотоксический эффект, однако показатель клеточного индекса в исследуемых лунках также достоверно ниже, чем в контрольных.
При исследовании динамики показателя клеточного индекса на клетках линии OVCAR-3 при воздействии CAR-T и ЛАК получены результаты, аналогичные с данными для OVKATE.
При исследовании культур, не экспрессирующих СА125 (MCF-7 и НЕК293), было показано, что при добавлении CAR-T регистрировалось снижение показателя клеточного индекса в 3,5 раза, что демонстрирует выраженный цитотоксический эффект CAR-T. Однако снижение пролиферативной активности по уровню было близким с воздействием ЛАК и менее выраженным, чем при воздействии CAR-T на культуры OVCAR-3 и OVKATE.
ОБСУЖДЕНИЕ
В нашем исследовании было показано, что цитотоксическое воздействие CAR-T и ЛАК сопоставимо для культур, не экспрессирующих СА125, при этом CAR-T оказывает специфический эффект в отношении клеток, экспрессирующих CA125.
Технология CAR-Т показала высокую эффективность в клинических исследованиях при лечении гемобластозов и включена в протоколы лечения. Однако для солидных опухолей на данный момент еще нет зарегистрированных CAR-T продуктов, разрешенных к медицинскому применению [29].
Тем не менее литературные данные, а также опыт проведенных нами экспериментальных исследований свидетельствуют о высокой перспективности CAR-T по сравнению с ЛАК-терапией, что связано, в первую очередь, с более высокой специфичностью воздействия CAR-T-лимфоцитов [30].
ЛАК способны эффективно воздействовать на клетки опухоли различного гистогенеза, независимо от экспрессии специфических рецепторов на поверхности опухолевой клетки [31]. CAR-T-лимфоцитам требуется наличие специфических рецепторов на поверхности опухолевой клетки для ее активации, благодаря которым они не оказывают цитотоксического воздействия на другие клетки, не экспрессирующие данный рецептор [17, 18]. Эти преимущества CAR-T позволяют применять данный метод при создании таргетных противоопухолевых препаратов не только для СА125-позитивных опухолей, но и против других опухолей, экспрессирующих специфические рецепторы.
В данной работе нами была проведена оценка эффективности CAR-Т-лимфоцитов, полученных путем трансфекции плазмидной конструкции третьего поколения, несущей ген CAR, специфичный к антигену MUC16 (СAR-СА125) [32]. Исследование цитотоксического действия CAR-T-лимфоцитов на культурах клеток OVCAR-3 и OVKATE показало выраженный специфический цитотоксический эффект. Воздействие CAR-T-лимфоцитов на СА125-негативные клетки, видимо, неспецифично и является проявлением собственной цитотоксичности аллогенных лимфоцитов. В то же время увеличение количества погибших СА125-позитивных клеток от CAR-T по сравнению с воздействием ЛАК может свидетельствовать о наличии специфической токсичности разработанного нами препарата в отношении СА125. Проведенное исследование показало неспецифичность воздействия ЛАК на СА125-негативные и СА125-позитивные линии, что согласуется с литературными данными и, как следствие, увеличивает риск возникновения побочных эффектов при терапии ЛАК [30][31]. В то же время в представленном исследовании противоопухолевый эффект, оказываемый CAR-T-лимфоцитами, был пропорционален времени инкубации, что дает основания для возможного снижения количества препарата при получении адекватного цитотоксического эффекта.
Полученные нами результаты показывают важность и необходимость дальнейших исследований разработанного продукта, являющегося потенциальным соматоклеточным лекарственным препаратом на основе CAR-T-лимфоцитов, экспрессирующих рецептор к СА125.
Ограничения исследования
Настоящее исследование было нацелено на оценку конкретного CAR-T продукта, направленного на опухолевый антиген СА125. Потенциальных мишеней для разработки конструкций CAR, а также способов создания CAR-T продукта, существует большое количество, выбор мишени, конструкции CAR, вектора и способа доставки генетического материала во многом определяют свойства полученного продукта.
ЗАКЛЮЧЕНИЕ
В проведенном исследовании был достигнут выраженный специфический цитотоксический эффект in vitro вследствие применения анти-СА125 CAR-T-лимфоцитов в отношении СА125-позитивных опухолевых клеточных линий OVCAR-3 и OVKATE, превышающий цитотоксическое воздействие ЛАК. Применение методов МТТ, ЛДГ-тестов и RTCA iCELLIgence позволило получить детальное представление о величине противоопухолевого действия разработанного нами препарата CAR-T, направленного на опухолевые клетки, экспрессирующие СА125. На культуры СА125-негативных клеток MCF-7 и НЕК293 его цитотоксическое воздействие имеет минимальное значение, а воздействие ЛАК на эти клетки сравнимо с воздействием на OVCAR-3 и OVKATE.
ВКЛАД АВТОРОВ
Т.М. Кулинич, Я.Ю. Киселева, А.М. Шишкин и Е.А. Кудинова в равной мере участвовали в проведении экспериментальных исследований, провели анализ научной литературы, участвовали в составлении текста статьи. О.Б. Князева и Р. Ранджит провели интерпретацию полученных данных, редактирование рукописи, подготовку иллюстративного материала. В.К. Боженко был ответственным за разработку концепции и дизайна исследования, руководил написанием статьи. В.А. Солодкий проводил научное консультирование. Все авторы утвердили окончательную версию статьи
AUTHOR CONTRIBUTION
Tatyana M. Kulinich, Yana Yu. Kiseleva, Alexander M. Shishkin and Elena A. Kudinova equally participated in experimental studies, analyzed the scientific literature, participated in drafting the text of the article. Oksana B. Knyazeva and Rajesh Ranjit analyzed the data obtained, edited the text of the article, prepared illustrations. Vladimir K. Bozhenko developed the concept and design of the study, conducted the guidance of writing the article. Vladimir A. Solodky conducted scientific consulting. All authors approved the final version of the article.
Соответствие принципам этики. Данное исследование с использованием биологического материала проводилось исключительно в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации об этических принципах проведения биомедицинских исследований. Исследование проведено в соответствии с разрешением Независимого этического комитета и этической комиссии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России (протоколы № 10 от 29.10.2021 и № 2/14-Э от 17.02.2014).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование было проведено при поддержке Государственного контракта № 14.N 08.11.0081 от 14 июля 2016 г. в рамках федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу».
Ethics statements. This research using biological material was conducted solely in accordance with the World Medical Association Declaration of Helsinki on Ethical Principles for Biomedical Research. The study was conducted in accordance with the permission of the Independent Ethics Committee and the Ethics Commission of the “Russian Scientific Center of Roentgenoradiology” (protocols No. 10 of 29.10.2021 and No. 2/14-E of 17.02.2014).
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Confl ct of interests. The authors declare no conflict of interest.
Financing. The study was conducted with the support of State Contract No. 14.N 08.11.0081 dated 14.07.2016 within the framework of the federal target program “Development of the pharmaceutical and medical industry of the Russian Federation for the period until 2020 and beyond”.
1 American Type Culture Collection (ATCC): Cell Products/Human Cells/HTB-161. https://www.atcc.org/products/htb-161 (дата обращения: 02.02.2024).
2 Cellosaurus OVKATE (CVCL_3110). https://cellosaurus.org/CVCL_3110 (дата обращения: 02.02.2024).
3 American Type Culture Collection (ATCC): Cell Products/Human Cells/ CRL-3435. https://www.atcc.org/products/crl-3435 (дата обращения: 02.02.2024).
4 American Type Culture Collection (ATCC): Cell Products/Human Cells/ CRL-1573. https://www.atcc.org/products/crl-1573 (дата обращения: 02.02.2024).
Список литературы
1. Zhang J., Li M., Feng L., et al. Laparoscopic versus laparotomic surgical treatment in apparent stage I ovarian cancer: a multi-center retrospective cohort study. World J Surg Oncol. 2024 Feb 22; 22(1): 62. https://doi.org/10.1186/s12957-024-03345-1. PMID: 38389046; PMCID: PMC10882876
2. Jokhadze N., Das A., Dizon D.S. Global cancer statistics: A healthy population relies on population health. CA Cancer J Clin. 2024 May-Jun; 74(3): 224–226. https://doi.org/10.3322/caac.21838. Epub 2024 Apr 4. PMID: 38572764
3. Котова Е.Г., Папанова Е.К., Адамян Л.В. Своевременное выявление и лечение злокачественных новообразований репродуктивных органов у женщин как резерв роста ожидаемой продолжительности жизни в Российской Федерации. Проблемы репродукции. 2023; 29(6): 6–11. https://doi.org/10.17116/repro2023290616 /
4. Osann K., Wenzel L., McKinney C., et al. Fear of recurrence, emotional well-being and quality of life among long-term advanced ovarian cancer survivors. Gynecol Oncol. 2023 Apr; 171: 151– 158. https://doi.org/10.1016/j.ygyno.2023.02.015. Epub 2023 Mar 9. PMID: 36905875; PMCID: PMC10681156.
5. Yu Y., Li X.B., Lin Y.L., et al. Effi cacy of 1 384 cases of peritoneal carcinomatosis underwent cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy. Zhonghua Wei Chang Wai Ke Za Zhi. 2021 Mar 25; 24(3): 230–239. Chinese. https://doi.org/10.3760/cma.j.cn.441530-20201110-00603. PMID: 34645167
6. Shan D., Cheng S., Ma Y., Peng H. Serum levels of tumor markers and their clinical signifi cance in epithelial ovarian cancer. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2023 Jul 28; 48(7): 1039– 1049. https://doi.org/10.11817/j.issn.1672-7347.2023.230090. PMID: 37724407; PMCID: PMC10930038
7. Suzuki T., Conant A., Jung Y., et al. A stem-like patient-derived ovarian cancer model of platinum resistance reveals dissociation of stemness and resistance. Int J Mol Sci. 2024 Mar 29; 25(7): 3843. https://doi.org/10.3390/ijms25073843. PMID: 38612653; PMCID: PMC11011340
8. Torre L.A., Trabert B., DeSantis C.E., et al. Ovarian cancer statistics, 2018. CA Cancer J Clin. 2018 July; 68(4): 284–296. https://doi.org/10.3322/caac.21456. Epub 2018 May 29. PMID: 29809280; PMCID: PMC6621554
9. Mikuła-Pietrasik J., Witucka A., Pakuła M., et al. Comprehensive review on how platinum- and taxane-based chemotherapy of ovarian cancer affects biology of normal cells. Cell Mol Life Sci. 2019 Feb; 76(4): 681–697. https://doi.org/10.1007/s00018-018-2954-1. Epub 2018 Oct 31. PMID: 30382284; PMCID: PMC6514066
10. Vergote I., Gonzalez-Martin A., Lorusso D., et al. Clinical research in ovarian cancer: consensus recommendations from the Gynecologic Cancer InterGroup. Lancet Oncol. 2022 Aug; 23(8): e374–e384. https://doi.org/10.1016/S1470-2045(22)001395. Erratum in: Lancet Oncol. 2022 Sep; 23(9): e404. https://doi.org/10.1016/S1470-2045(22)00502-2. PMID: 35901833; PMCID: PMC9465953
11. Lawton F.G., Pavlik E.J. Perspectives on ovarian cancer 1809 to 2022 and beyond. Diagnostics (Basel). 2022 Mar 24; 12(4): 791. https://doi.org/10.3390/diagnostics12040791. PMID: 35453839; PMCID: PMC9024743
12. Sun D., Shi X., Li S., et al. CAR-T cell therapy: a breakthrough in traditional cancer treatment strategies (Review). Mol Med Rep. 2024 Mar; 29(3): 47. https://doi.org/10.3892/mmr.2024.13171. Epub 2024 Jan 26. PMID: 38275119; PMCID: PMC10835665
13. Wang L., Zhang L., Dunmall L.C., et al. The dilemmas and possible solutions for CAR-T cell therapy application in solid tumors. Cancer Lett. 2024 Jun 1; 591: 216871. https://doi.org/10.1016/j. canlet.2024.216871. Epub 2024 Apr 10. PMID: 38604310
14. Tong C., Zhang Y., Liu Y., et al. Optimized tandem CD19/ CD20 CAR-engineered T cells in refractory/relapsed B-cell lymphoma. Blood. 2020 October 1; 136(14): 1632–1644. https://doi.org/10.1182/blood.2020005278. PMID: 32556247; PMCID: PMC7596761
15. Li Y., Zheng Y., Liu T., et al. The potential and promise for clinical application of adoptive T cell therapy in cancer. J Transl Med. 2024 May 1; 22(1): 413. https://doi.org/10.1186/s12967-02405206-7. PMID: 38693513; PMCID: PMC11064426
16. Jogalekar M.P., Rajendran R.L., Khan F., et al. CAR T-CellBased gene therapy for cancers: new perspectives, challenges, and clinical developments. Front Immunol. 2022 Jul 22; 13: 925985. https://doi.org/10.3389/fimmu.2022.925985. PMID: 35936003; PMCID: PMC9355792
17. Flugel C.L., Majzner R.G., Krenciute G., et al. Overcoming ontarget, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 2023 Jan; 20(1): 49–62. https://doi.org/10.1038/s41571-022-00704-3. Epub 2022 Nov 23. PMID: 36418477; PMCID: PMC10278599
18. Daei Sorkhabi A., Mohamed Khosroshahi L., Sarkesh A., et al. The current landscape of CAR T-cell therapy for solid tumors: mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 2023 Mar 20; 14: 1113882. https://doi.org/10.3389/fimmu.2023.1113882. PMID: 37020537; PMCID: PMC10067596
19. Biondi M., Tettamanti S., Galimberti S., et al. Selective homing of CAR-CIK cells to the bone marrow niche enhances control of the acute myeloid leukemia burden. Blood. 2023 May 25; 141(21): 2587–2598. https://doi.org/10.1182/blood.2022018330. PMID: 36787509; PMCID: PMC10646802
20. Hong Y., Walling B.L., Kim H.R., et al. ST3GAL1 and βII-spectrin pathways control CAR T cell migration to target tumors. Nat Immunol. 2023 Jun;24(6): 1007–1019. https://doi.org/10.1038/s41590-023-01498-x. Epub 2023 Apr 17. PMID: 37069398; PMCID: PMC10515092.
21. Zhang X.W., Wu Y.S., Xu T.M., et al. CAR-T Cells in the treatment of ovarian cancer: a promising cell therapy. Biomolecules. 2023 Mar 2; 13(3): 465. https://doi.org/10.3390/biom13030465. PMID: 36979400; PMCID: PMC10046142
22. Cutri-French C., Nasioudis D., George E., et al. CAR-T Cell Therapy in ovarian cancer: where are we now? Diagnostics (Basel). 2024 Apr 16; 14(8): 819. https://doi.org/10.3390/diagnostics14080819. PMID: 38667465; PMCID: PMC11049291
23. Giamougiannis P., Martin-Hirsch P.L., Martin F.L. The evolving role of MUC16 (CA125) in the transformation of ovarian cells and the progression of neoplasia. Carcinogenesis. 2021 Apr 17; 42(3): 327–343. https://doi.org/10.1093/carcin/bgab010. PMID: 33608706
24. Wang C.W., Weaver S.D., Boonpattrawong N., et al. A revised molecular model of ovarian cancer biomarker CA125 (MUC16) enabled by long-read sequencing. Cancer Res Commun. 2024 Jan 31; 4(1): 253–263. https://doi.org/10.1158/2767-9764.CRC-230327. PMID: 38197671; PMCID: PMC10829539
25. Lee K., Perry K., Xu M., et al. Structural basis for antibody recognition of the proximal MUC16 ectodomain. J Ovarian Res. 2024 Feb 19; 17(1): 41. https://doi.org/10.1186/s13048-024-01373-9. PMID: 38374055; PMCID: PMC10875768
26. Song Y., Yuan M., Wang G. Update value and clinical application of MUC16 (cancer antigen 125). Expert Opin Ther Targets. 2023 Jul-Dec; 27(8): 745–756. https://doi.org/10.1080/14728222.2023. 2248376. Epub 2023 Aug 24. PMID: 37584221
27. Casey N.P., Kleinmanns K., Forcados C., et al. Effi cient CAR T cell targeting of the CA125 extracellular repeat domain of MUC16. J Immunother Cancer. 2024 Apr 11; 12(4): e008179. https://doi.org/10.1136/jitc-2023-008179. PMID: 38604812; PMCID: PMC11015285
28. Боженко В., Кудинова Е., Кулинич Т. и др. Патент РФ RU 2 747 095 C2. Мономолекулярный химерный Т-клеточный рецептор к раковому антигену СА125. Опубликовано: 26.04.2021 Бюл. № 12 /
29. Albelda S.M. CAR T cell therapy for patients with solid tumours: key lessons to learn and unlearn. Nat Rev Clin Oncol. 2024 Jan; 21(1): 47–66. https://doi.org/10.1038/s41571-023-00832-4. Epub 2023 Oct 30. PMID: 37904019
30. Wang Y., Suarez E.R., Kastrunes G., et al. Evolution of cell therapy for renal cell carcinoma. Mol Cancer. 2024 Jan 9; 23(1): 8. https://doi.org/10.1186/s12943-023-01911-x. PMID: 38195534; PMCID: PMC10775455
31. Wendel P., Reindl L.M., Bexte T., et al. Arming immune cells for battle: a brief journey through the advancements of T and NK cell immunotherapy. Cancers (Basel). 2021 Mar 23; 13(6): 1481. https://doi.org/10.3390/cancers13061481. PMID: 33807011; PMCID: PMC8004685
32. Киселева Я.Ю., Большакова О.Б., Кулинич Т.М. и др. Сравнение эффективности плазмид 1 и 3 поколения, кодирующих химерный Т- клеточный рецептор к опухолевому маркеру рака яичников. Вестник Российского Научного Центра Рентгенорадиологии. 2021; 21(2): 25–40
Об авторах
Т. М. КулиничРоссия
Кулинич Татьяна Михайловна, канд. мед. наук, заведующая лабораторией иммунологии и онкоцитологии научно-исследовательского отдела молекулярной биологии и экспериментальной терапии опухолей
ул. Профсоюзная, д. 86, Москва, 117997
Я. Ю. Киселева
Россия
Киселева Яна Юрьевна, канд. мед. наук, научный сотрудник лаборатории иммунологии и онкоцитологии научноисследовательского отдела молекулярной биологии и экспериментальной терапии опухолей
ул. Профсоюзная, д. 86, Москва, 117997
А. М. Шишкин
Россия
Шишкин Александр Михайлович, канд. мед. наук, старший научный сотрудник лаборатории иммунологии и онкоцитологии научно-исследовательского отдела молекулярной биологии и экспериментальной терапии опухолей
ул. Профсоюзная, д. 86, Москва, 117997
Е. А. Кудинова
Россия
Кудинова Елена Александровна, д-р мед. наук, заведующая клинико-диагностической лабораторией
ул. Профсоюзная, д. 86, Москва, 117997
О. Б. Князева
Россия
Князева Оксана Борисовна, младший научный сотрудник лаборатории клеточной и генной терапии
ул. Профсоюзная, д. 86, Москва, 117997
Р. Ранджит
Россия
Ранджит Раджеш, аспирант, ассистент кафедры онкологии и рентгенорадиологии Медицинского института; врач-онколог
ул. Миклухо-Маклая, д. 6, Москва, 117198
Загородное шоссе, д. 18А, Москва, 117151
В. К. Боженко
Россия
Боженко Владимир Константинович, д-р мед. наук, профессор, заведующий научно-исследовательским отделом молекулярной биологии и экспериментальной терапии опухолей
ул. Профсоюзная, д. 86, Москва, 117997
В. А. Солодкий
Россия
Солодкий Владимир Алексеевич, академик РАН, д-р мед. наук, профессор, директор
ул. Профсоюзная, д. 86, Москва, 117997







































