Перейти к:
Гистоморфометрические изменения гонадотропных эндокриноцитов гипофиза при воздействии темновой депривацией
https://doi.org/10.47093/2218-7332.2024.15.3.36-47
Аннотация
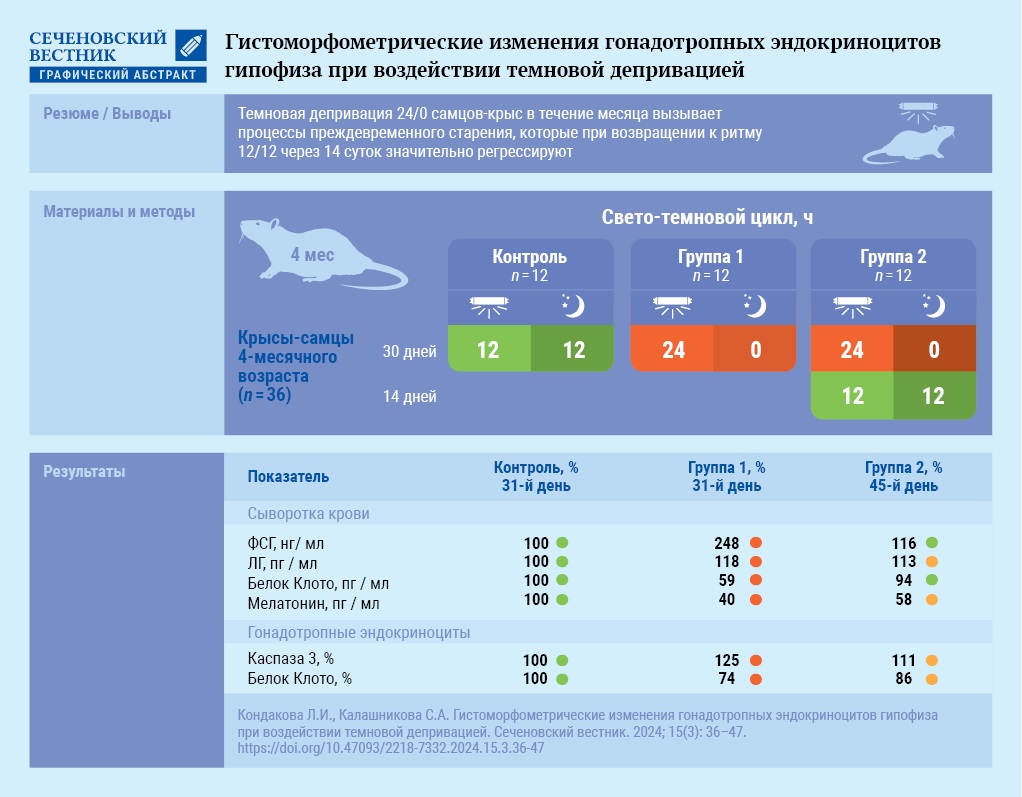
Цель. Оценить влияние 30-суточной темновой депривации на функциональные и гистоморфометрические изменения гонадотропных эндокриноцитов аденогипофиза и их обратимость у половозрелых крыс-самцов.
Материалы и методы. Беспородные белые крысы самцы (n = 36) массой тела 365–375 г 4-месячного возраста были рандомно разделены на три группы (каждая по n = 12). В течение 30 суток контрольная группа находилась при автоматическом свето-темновом режиме 12/12, а крысы экспериментальных групп 1 и 2 – при круглосуточном искусственном освещении (24/0, 300 люкс), затем крыс группы 2 возвращали в режим 12/12 на последующие 14 дней. У животных контрольной и группы 1 прижизненно на 31-е сутки, у группы 2 на 45-е сутки производили забор крови из брюшной аорты и определяли уровни фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов, мелатонина, белка Клото методом твердофазного иммуноферментного анализа, после чего выводили из эксперимента путем декапитации. Посмертно гистологически и иммуногистохимически исследовали гипофиз с помощью поликлональных кроличьих антител к каспазе-3, белку Клото, проводили морфометрию. Статистическая обработка данных осуществлялась при помощи теста Краскела – Уоллиса с апостериорным критерием Данна.
Результаты. Световой десинхроноз в виде 30-суточной темновой депривации вызвал увеличение уровня ФСГ и ЛГ и уменьшение уровня мелатонина и белка Клото в крови самцов крыс; увеличение площади, объема и периметра гонадотропных эндокриноцитов на 23,1% (p < 0,001), 48,7% (p < 0,001), 10,9% (p < 0,001) соответственно; увеличение площади, объема и периметра ядра на 16, 11,7, 2,5% соответственно. Иммуногистохимическое исследование показало увеличение удельной площади иммунореактивных на каспазу-3 гонадотропных эндокриноцитов на 25,2% без явных морфологических признаков апоптоза, при этом уменьшение экспрессии белка Клото на 25,7%. Все показатели носили обратимый характер, уровни ФСГ и белка Клото в крови животных практически достигли исходных значений через 14 суток восстановления свето-темного цикла 12/12.
Заключение. Темновая депривация в течение 30 суток у крыс-самцов индуцировала обратимые процессы ускоренного старения и апоптоза в клетках, о чем свидетельствуют изменения экспрессии маркеров старения в гонадотропных эндокриноцитах и уровней гонадотропных гормонов в крови. При восстановлении свето-темного режима уже через 14 дней уровни ФСГ и белка Клото нормализуются.
Ключевые слова
Список сокращений
- ИГХ – иммуногистохимическое (окрашивание)
- ЛГ – лютеинизирующий гормон
- ФСГ – фолликулостимулирующий гормон
- 12/12 – свето-темновой цикл: 12 ч свет / 12 ч темнота
- 24/0 – свето-темновой цикл: 24 часа свет / 0 ч темнота
По данным Всемирной организации здравоохранения, бесплодием страдает около 17,5% взрослого населения, что требует повышенного внимания со стороны государств1. Рост мужского бесплодия в Российской Федерации обусловлен, с одной стороны, увеличением продолжительности жизни и, соответственно, более частой регистрацией заболевания среди лиц старше трудоспособного возраста – за период 2021–2023 гг. прирост данной возрастной группы составил 1,8%2. С другой стороны, отмечено увеличение частоты воспалительных заболеваний мочеполовой системы, в том числе инфекций, передающихся половым путем, например прирост числа вновь установленных случаев сифилиса составил 81,7%3 за период 2020–2022 гг., также увеличилась заболеваемость врожденными аномалиями (пороками развития), деформациями и хромосомными нарушениями у детей 0–14 лет – прирост составил 3% за тот же период.
На мужскую фертильность также влияют и различные стрессовые факторы внешней среды, например нарушение свето-темнового режима [1]. Темновая депривация в целом оказывает негативное влияние на физиологические и морфологические реакции в организме [2–7] и приводит к нарушению циркадных ритмов, находящихся под контролем супрахиазматического ядра гипоталамуса и гонадотропных эндокриноцитов аденогипофиза [8], что способствует повышению выработки фолликулостимулирующего (ФСГ), лютеинизирующего гормонов (ЛГ) гонадотропными эндокриноцитами гипофиза и снижению выработки тестостерона клетками Лейдига семенников [9]. Длительная темновая депривация может приводить к преждевременному старению клеток организма [10] за счет ускоренной апоптотической гибели клеток и уменьшения выработки белка Клото, который обладает антиоксидантной и антиапоптотической активностью [11–13]. Другим маркером старения является изменение экспрессии каспаз [11][14], запускающих каскад ферментативных реакций при апоптозе [15].
Малоизученной остается взаимосвязь между темновой депривацией и морфометрическими изменениями гонадотропных эндокриноцитов аденогипофиза, которая представляет научный и практический интерес.
Цель исследования: выявить гистоморфометрические изменения гонадотропных эндокриноцитов аденогипофиза крысы при воздействии полной темновой депривации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 36 половозрелых 4-месячных беспородных белых крысах-самцах массой тела 365–375 г. В качестве модели для изучения влияния старения на организм, особенно на гипоталамо-гипофизарно-гонадную систему, нами были выбраны крысы, учитывая чувствительность этих животных к стрессу [16]. Количество животных рассчитано согласно стандартным правилам для дизайна экспериментов на грызунах и составило 12 крыс в каждой группе [17]. Выбор возраста в 4 месяца на начало эксперимента обусловлен необходимостью в полной мере оценить изменения в гипоталамо-гипофизарно-гонадной системе.
Животные были получены из филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства» России, содержались в виварии по 3–5 особей в клетках для лабораторных крыс РР-4, 466×314×200 мм (Suzhou Fengshi Laboratory Animal Equipment Co., Ltd, Китай) при относительной влажности воздуха 40–50% и температуре 22–24 °С со свободным доступом к воде и гранулированному корму (ЗАО «Тосненский комбикормовый завод», Россия). Содержание животных соответствовало ГОСТ 33216-2014 от 01.07.2016 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами»4; ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики»; руководству по содержанию и использованию лабораторных животных» (Guide for the Care and Use of Laboratory Animals, 8th edition5).
После двухнедельного карантина всех животных при помощи простой рандомизации разделили на три группы: контрольную (n = 12) и две экспериментальные (каждая по n = 12). Животные контрольной группы во время эксперимента находились при искусственном световом режиме 12 ч свет / 12 ч темнота (12/12). В обеих экспериментальных группах (группа 1, группа 2) моделировали ускоренное старение: в течение 30 суток крысы находились при искусственном освещении 300 люкс в течение всех суток (свето-темновой цикл 24/0) [18]. При проведении эксперимента световой режим в контрольной и экспериментальных группах регулировался автоматически. Через 30 суток животных контрольной и группы 1 выводили из эксперимента путем декапитации с использованием гильотины (ООО «Открытая наука», Россия), а крыс группы 2 возвращали в искусственный свето-темновой режим 12/12 на последующие 14 дней [19], затем тем же способом выводили из эксперимента (рис. 1).
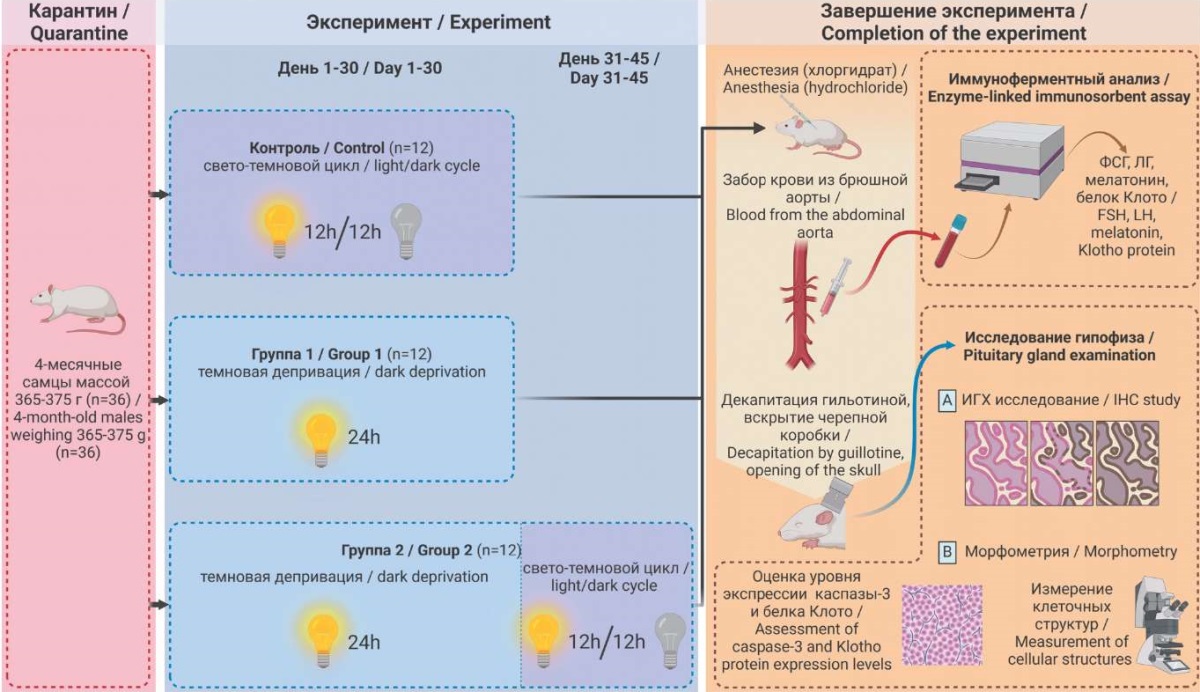
РИС. 1. Схема эксперимента.
Примечание: ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; ИГХ – иммуногистохимическое (исследование).
FIG. 1. Experimental design.
Note: FSH – follicle-stimulating hormone; LH – luteinizing hormone; IHC – immunohistochemical (study).
Перед выводом из эксперимента после внутрибрюшинной анестезии хлоралгидратом 400 мг/кг у животных всех групп производили забор крови в объеме 5 мл из брюшной аорты в пробирки с 3,8% водным раствором цитрата натрия (НЦИЛС ВолгГМУ, Россия). Далее методом твердофазного иммуноферментного анализа на автоматическом микропланшетном фотометре Sunrise TS4TECAN (Tecan Austria GmbH, Австрия) с помощью наборов ELISA Kit (Cloud-Clone Corp., США) определяли уровни ФСГ и ЛГ, мелатонина, белка Клото в сыворотке крови по методикам, рекомендованным производителем.
Морфологическое исследование
После вскрытия черепной коробки и выделения головного мозга из полости турецкого седла извлекали гипофиз [20], фиксировали его в 10%-ном растворе забуференного формалина с последующей автоматизированной гистологической проводкой на гистопроцессоре Leica TP1020 (Leica Biosystems Nussloch GmbH, Германия). Гистологический материал для определения ацидофильных, базофильных и хромофобных эндокриноцитов обрабатывали по стандартной методике с окраской гематоксилином Майера и эозином [21]. Идентификацию гонадотропных эндокриноцитов осуществляли по эксцентричному расположению ядра и центрально расположенной макуле. Определение экспрессии биологических маркеров программируемой гибели и старения проводили с помощью маркера апоптоза каспазы-3 и биомаркера старения белка Клото.
Парафиновые блоки резали на ротационном микротоме Microm HM340E (Thermo Fisher Scientific, Германия), получали срезы толщиной 4 мкм, которые монтировали на предметные стекла, обработанные поли-L-лизином (Menzel, Германия). Срезы подвергали иммуногистохимическому (ИГХ) окрашиванию в соответствии с рекомендуемыми протоколами фирм производителей по стандартной методике с использованием поликлональных антител к каспазе-3 PAA626Ra01 в разведении 1:100 и поликлональных антител к белку Клото DF10309 в разведении 1:100 (Cloud-Clone Corp., США). Для визуализации применяли набор вспомогательных реагентов для ИГХ IS086 согласно инструкции производителя (Cloud-Clone Corp., США). На заключительном этапе реакции срезы докрашивали гематоксилином Майера. В соответствии с протоколами фирм производителей при определении экспрессии первичных антител использовали позитивные контроли: для каспазы-3 – ткань почки (крыса), для белка Клото – ткань поджелудочной железы (человек) (НЦИЛС ВолгГМУ, Россия). Негативным контролем служили срезы без инкубации с первичными антителами при полном соблюдении остальных этапов протокола.
Морфометрия
Серийные микрофотографии выполнены с помощью цифровой камеры Leica ICC50 HD, окуляра HC PLAN 10× и объектива HC PLAN 40× на базе бинокулярного микроскопа Leica DM1000 (все перечисленное – Leica Microsystems GmbH, Германия). В каждом гистологическом срезе анализировали 10 полей зрения. Проводили измерение максимального и минимального диаметра гонадотропных эндокриноцитов, их периметра (мкм), ядер, ядрышек (по 100 измерений для каждого животного), рассчитывали объемные показатели: площадь (мкм²), объем (мкм³) клеток, ядер и ядрышек. Анализ и расчет осуществлялся автоматически с помощью программного обеспечения LAS 4.7.1 (Leica Microsystems GmbH, Германия).
Оценку уровня экспрессии каспазы-3 и белка Клото определяли путем подсчета в поле зрения доли иммунопозитивных к данным маркерам клеток к общему числу гонадотропных эндокриноцитов аденогипофиза. Положительно окрашенные клетки подсчитывали при увеличении 400×, затем на 10 рандомизированных микрофотографиях образцов гипофиза рассчитывали их удельную площадь в процентах относительно общей оцениваемой площади среза с помощью программного обеспечения LAS 4.7.1 (Leica Microsystems GmbH, Германия).
Статистический анализ
Нормальность распределения проверяли по критерию Шапиро – Уилка. При получении распределения значений непрерывного признака, отличного от нормального, данные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили), результаты обрабатывали тестом Краскела – Уоллиса с апостериорным критерием Данна. Для признаков, значения которых подчинялись нормальному распределению, данные представлены как среднее и стандартное отклонение. Для сравнения этих признаков использован тест ANOVA с апостериорным тестом Тьюки. Принятый уровень значимости p < 0,05. Для проведения статистического анализа использовали программное обеспечение GraphPad Prism 8.0.1 (GraphPad Software, США).
РЕЗУЛЬТАТЫ
Интенсивное освещение животных группы 1 в течение 24 часов на протяжении 30 суток привело к статистически значимому росту уровня ФСГ в крови на 144,8% по сравнению с контрольной группой. На момент окончания эксперимента у крыс группы 2 уровень ФСГ значимо снизился по сравнению с группой 1 и не отличался от контроля (рис. 2А).
После 30-суточной темновой депривации уровень ЛГ в крови животных группы 1 повысился статистически значимо на 15,2% по сравнению с контрольной группой. У крыс группы 2 на момент окончания эксперимента уровень ЛГ значимо снизился на 3,8% (p < 0,05) по сравнению с группой 1, однако остался выше контрольных значений на 11,7% (p < 0,01) (рис. 2B).
Искусственное круглосуточное освещение животных группы 1 в течение 30 суток привело к снижению уровня мелатонина в крови на 60,3% по сравнению с контрольной группой. На момент окончания эксперимента у крыс группы 2 уровень мелатонина превысил значения группы 1 на 31,3% (p < 0,05), однако остался ниже контрольных значений на 42,2% (p < 0,05) (рис. 2C).
Также снизился уровень белка Клото в крови животных группы 1 на 41,4% (p < 0,001) по сравнению с контрольной группой. У крыс группы 2 на момент окончания эксперимента уровень белка Клото практически восстановился и статистически не отличался от контрольной группы (рис. 2D).
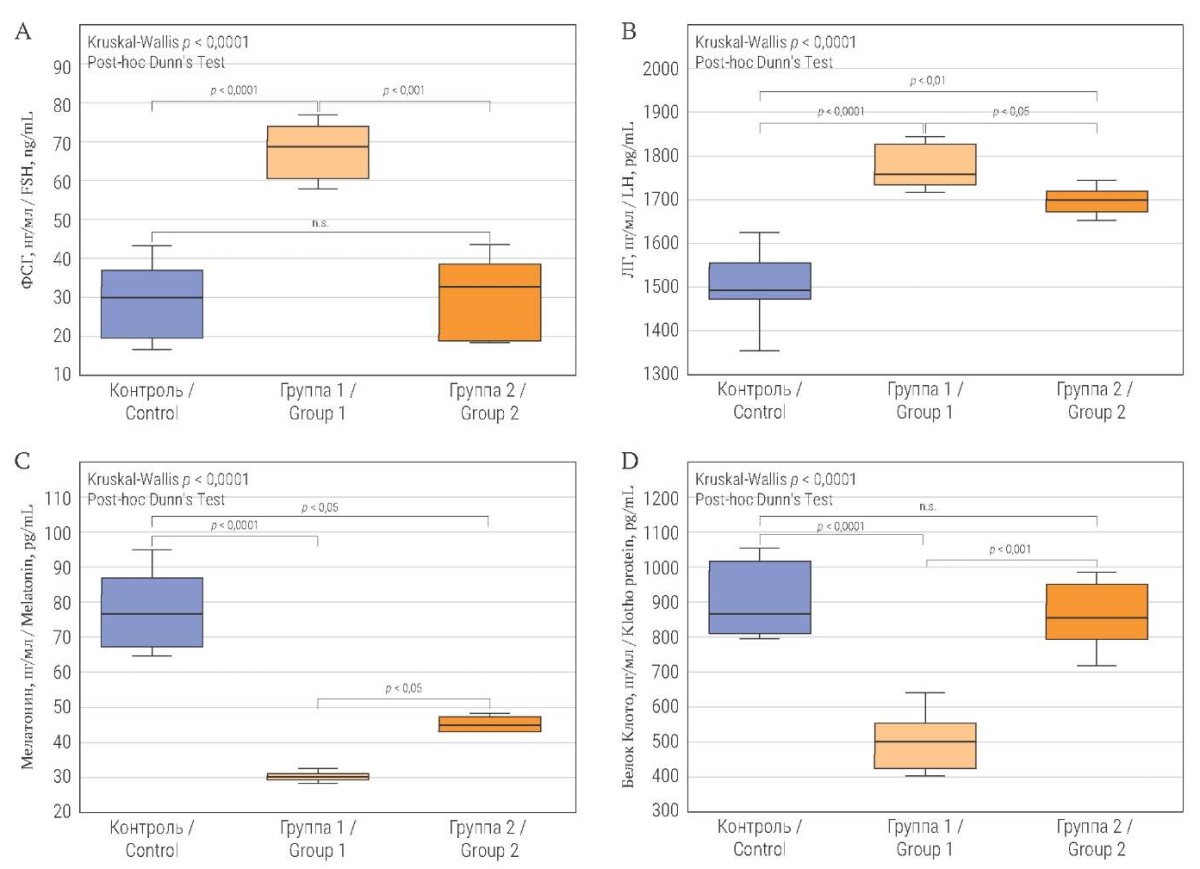
РИС. 2. Концентрация гормонов и белка Клото в сыворотке крови крыс в экспериментальных группах при темновой депривации и в контроле.
Примечание: ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон.
Контроль: 12/12 – 30 дней; группа 1: темновая депривация 24/0 – 30 дней; группа 2: темновая депривация 24/0 – 30 дней, 12/12 – 14 дней; n.s. – not significant, не значимо.
FIG. 2. Concentration of hormones and Klotho protein in the blood serum of rats in experimental groups under dark deprivation and in control.
Note: FSH – follicle – stimulating hormone; LH – luteinizing hormone.
Control: 12/12 – 30 days; Group 1: dark deprivation 24/0 – 30 days; Group 2: dark deprivation 24/0 – 30 days, 12/12 – 14 days; n.s. – not significant.
При морфологическом исследовании аденогипофиза животных контрольной группы была обнаружена паренхима, представленная тяжами эндокриноцитов, которые плотно прилегали друг к другу, и соединительнотканная строма. Между клетками располагались синусоидальные капилляры. В тяжах гипофиза присутствовали хромофобные (27,2 ± 1,1%), ацидофильные (64,7 ± 2,9%) и базофильные (8,1 ± 0,9%) эндокриноциты, различные по форме и размеру. Гонадотропные базофильные эндокриноциты (4,5 ± 0,3%) располагались группами вблизи кровеносных капилляров (рис. 3А).
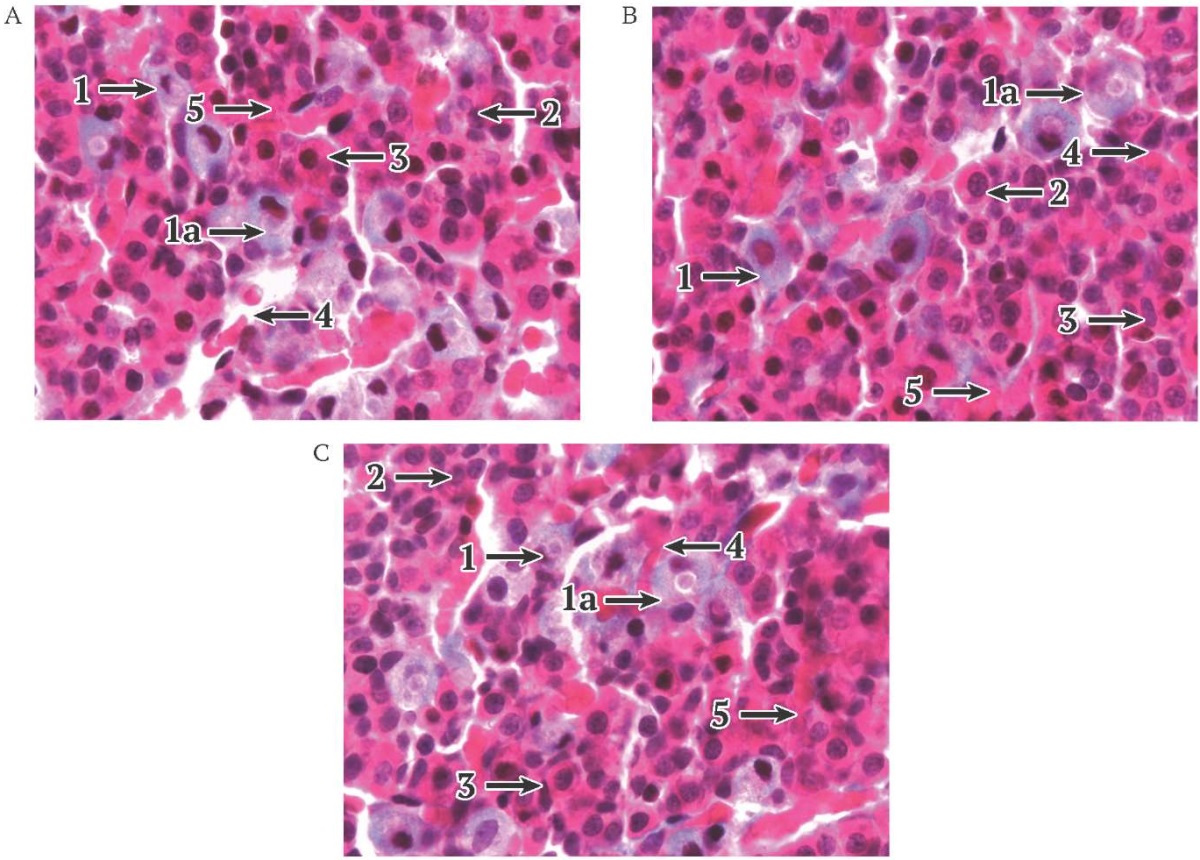
РИС. 3. Морфологическая картина аденогипофиза крысы-самца в экспериментальных группах при темновой депривации и в контроле (окраска: гематоксилин и эозин, ув. 400×).
А. Контроль: 12/12 – 30 дней.
В. Группа 1: темновая депривация 24/0 – 30 дней.
С. Группа 2: темновая депривация 24/0 – 30 дней, 12/12 – 14 дней.
Примечание: стрелки: 1 – базофильные эндокриноциты; 1а – базофильные гонадотропные эндокриноциты; 2 – хромофобные эндокриноциты; 3 – ацидофильные эндокриноциты; 4 – синусоидальные капилляры; 5 – соединительнотканная строма.
FIG. 3. Morphological picture of male rat adenohypophysis in experimental groups under dark deprivation and in control (hematoxylin and eosin stain, 400×).
А. Control: 12/12 – 30 days.
В. Group 1: dark deprivation 24/0 – 30 days.
С. Group 2: dark deprivation 24/0 – 30 days, 12/12 – 14 days.
Note: Arrows: 1 – basophilic endocrinocytes; 1a – basophilic gonadotropic endocrinocytes; 2 – chromophobic endocrinocytes; 3 – acidophilic endocrinocytes; 4 – sinusoidal capillaries; 5 – connective tissue stroma.
Гонадотропные эндокриноциты имели многоугольную форму с эксцентрично расположенным ядром и образовывали группы по 5–7 клеток. Характеристики гонадотропных эндокриноцитов представлены в таблице.
Таблица. Морфометрические показатели гонадотропных эндокриноцитов и их ядер у самцов-крыс в аденогипофизе в экспериментальных группах при темновой депривации и в контроле
Table. Morphometric parameters of gonadotropic endocrinocytes and their nuclei in the adenohypophysis of male rats in experimental groups under dark deprivation and in control
|
Параметр / Parameter |
Контроль / Control |
Группа 1 / Group 1 |
Группа 2 / Group 2 |
|
Площадь, мкм²/ Area, µm² |
106,10 ± 0,70 |
130,60 ± 0,56a |
128,00 ± 0,79 a, b |
|
Объем, мкм³ / Volume, µm³ |
744,20 ± 10,58 |
1099,00 ± 10,55 a |
1086,00 ± 12,31 a,b |
|
Периметр, мкм / Perimeter, µm |
37,12 ± 0,17 |
41,48 ± 0,13 a |
41,35 ± 0,13 a |
|
Площадь ядра, мкм² / Nucleus area, µm² |
27,32 ± 0,20 |
31,69 ± 0,28 a |
30,39 ± 0,20 a |
|
Объем ядра, мкм³ / Nucleus volume, µm³ |
119,90 ± 1,45 |
133,60 ± 1,61 a |
125,60 ± 0,95 a |
|
Периметр ядра, мкм / Nucleus perimeter, µm |
19,50 ± 0,07 |
19,98 ± 0,09 a |
19,88 ± 0,07 a |
Примечание: контроль: 12/12 – 30 дней; группа 1: темновая депривация 24/0 – 30 дней; группа 2: темновая депривация 24/0 – 30 дней, 12/12 – 14 дней; n.s. – not significant, не значимо.
ар = 0,001 при сравнении с контролем.
bр = 0,01 при сравнении группы 2 с группой 1.
Note: Control: 12/12 – 30 days; Group 1: dark deprivation 24/0 – 30 days; Group 2: dark deprivation 24/0 – 30 days, 12/12 – 14 days; n.s. – not significant.
ар = 0.001 when comparing with control.
bр = 0.001 when comparing group 2 with group 1.
После 30-суточной темновой депривации наблюдалась гипертрофия гонадотропных эндокриноцитов: увеличение их размеров и морфометрических показателей (рис. 3B). Клетки имели полигональную форму с эксцентрично расположенными ядрами и группировались по 2–5 клеток. Площадь клетки в группе 1 была статистически значимо больше (p < 0,001) на 23,1%, объем на 48,7% и периметр на 10,9% по сравнению с контрольной группой. Цитокариометрические исследования не показали значительных изменений (p < 0,001), при этом площадь ядра в условиях эксперимента увеличилась на 16%, объем на 11,7% и периметр на 2,5% по сравнению с контрольной группой.
ИГХ исследование показало экспрессию каспазы-3 в ядрах гонадотропных эндокриноцитов, что сопровождалось интенсивным окрашиванием хроматина. Удельная площадь иммунореактивных гонадотропных эндокриноцитов при окрашивании каспазой-3 в контрольной группе равнялась 3,89 ± 0,89, а удельная площадь иммунореактивных клеток с белком Клото составляла 0,35 ± 0,01.
После 30-суточной темновой депривации обнаружено увеличение экспрессии каспазы-3 – удельная площадь иммунореактивных гонадотропных эндокриноцитов увеличилась на 25,2% (p < 0,05) (4,87 ± 0,75) по сравнению с контрольной группой. При этом отмечено уменьшение активности белка Клото, проявляющееся уменьшением удельной площади соответствующих эндокриноцитов на 25,7% (p < 0,05) (0,26 ± 0,01) по сравнению с контрольной группой.
Через 14 суток после отмены темновой депривации размеры гонадотропных эндокриноцитов снова уменьшились (рис. 3C). Клетки полигональной формы с эксцентрично расположенными ядрами группировались в центре аденогипофиза. Отмечалось уменьшение площади, периметра и объема гонадотропных эндокриноцитов на 2, 0,3 и 1,6% соответственно по сравнению с группой 1 (p < 0,001). Цитокариометрические исследования также показали уменьшение площади, периметра и объема ядра на 4,1, 0,5 и 6% соответственно по сравнению с группой 1.
Через 14 суток после отмены темновой депривации наблюдалось уменьшение удельной площади иммунореактивных гонадотропных эндокриноцитов, содержащих каспазу-3, на 11,3% (p < 0,05) (4,32 ± 0,77) по сравнению с группой 1, но она оставалась превышенной на 11,1% (p < 0,05) по сравнению с контрольной группой. Кроме того, в гонадотропных эндокриноцитах аденогипофиза отмечалось увеличение удельной площади иммунореактивных клеток с белком Клото на 15,4% (p < 0,05) (0,30 ± 0,01) по сравнению с группой 1, но она оставалась ниже на 14,2% (p < 0,05) по сравнению с контрольной группой.
ОБСУЖДЕНИЕ
Результаты нашего исследования продемонстрировали, что световой десинхроноз в виде 30-суточной 24-часовой темновой депривации приводит к увеличению морфометрических показателей гонадотропных эндокриноцитов и секреции ФСГ и ЛГ и их обратному снижению при отмене темновой депривации, что обусловлено регуляцией скорости клеточного роста и деления [22–26]. Увеличение секреции ФСГ является одним из показателей старения [10][27], а повышение уровня ЛГ обусловлено уменьшением отрицательной обратной связи на фоне снижения уровня тестостерона [28].
В ходе эксперимента нами установлено, что 30-суточная темновая депривация у самцов крыс приводит к статистически значимому снижению выработки эндогенного мелатонина, что является ключевым звеном в развитии преждевременного старения [29]. Круглосуточное воздействие света в течение месяца на 4-месячных животных привело к уменьшению уровня белка Клото, что может указывать на патологические изменения в клетках гипофиза, приводящие к преждевременному старению [10].
Увеличение уровня экспрессии каспазы-3 и белка Клото, обнаруженное нами при подсчете иммунопозитивных гонадотропных эндокриноцитов после 30-суточной темновой депривации, может указывать на возможное развитие апоптоза в аденогипофизе [28]. Динамика гистоморфометрических изменений гонадотропных эндокриноцитов, вызванная 30-суточной темновой депривацией, аналогична усилению функциональной активности, ассоциированной с возрастом, что проявляется преимущественно клеточной гиперплазией [22]. Отмена темновой депривации через 14 дней приводила к увеличению уровня белка Клото в крови, что, вероятно, указывает на восстановление процессов его выработки [29]. Идентификация экспрессии каспазы-3 в гонадотропоцитах без явных морфологических признаков апоптоза указывает на важность проведения дополнительных исследований для выявления механизмов, регулирующих более ранние стадии развития апоптоза в гонадотропных эндокриноцитах, и их влияние на функциональную активность и гистоморфометрию [30].
Важно также отметить, что рост гистоморфометрических параметров гонадотропных эндокриноцитов, вызванный темновой депривацией, может быть связан с компенсаторной реакцией аденогипофиза на изменения чувствительности клеток Лейдига и состояние отрицательной обратной связи между периферией и гонадотропинами ФСГ и ЛГ [31–33]. Эти выводы предполагают наличие сложных механизмов взаимодействия между различными компонентами эндокринной системы и важность подробного изучения их влияния на гонадотропную функцию. Дефицит мелатонина, вызванный темновой депривацией, может привести к недостатку его тормозящего воздействия на выработку гонадотропинов. Это подтверждается нарушениями функции и дистрофическими изменениями в семенниках, которые не устраняются повышенной выработкой ФСГ [28][34]. Взаимодействие половых стероидов и мелатонина свидетельствует об обратной связи между репродуктивной системой и эпифизом [35].
Ограничения исследования и перспективы дальнейших исследований
Данная работа выполнена на крысах-самцах, в дальнейшем необходимо оценить возможные гендерные различия при влиянии темновой депривации. В перспективе также необходимо изучить электронно-микроскопические особенности гонадотропных эндокриноцитов гипофиза и их связь с экспрессией тропных гормонов. Дальнейшее изучение и понимание процессов, происходящих в аденогипофизе при темновой депривации, важно для расширения знаний в области эндокринологии и их клинического применения.
ЗАКЛЮЧЕНИЕ
30-суточная темновая депривация привела к увеличению уровня ФСГ и ЛГ и уменьшению уровня мелатонина и белка Клото в крови самцов крыс, а также к гипертрофии гонадотропных эндокриноцитов, увеличению в них экспрессии каспазы-3 и уменьшению экспрессии белка Клото, что может демонстрировать процессы преждевременного старения. Они носят обратимый характер, и при отмене провоцирующего фактора уже через 14 суток уровни данных маркеров восстанавливаются практически до исходных значений.
ВКЛАД АВТОРОВ
Л.И. Кондакова участвовала в сборе и анализе литературных источников, написании текста статьи, оформлении списка литературы, подготовке материала для публикации. С.А. Калашникова провела научное редактирование статьи, доработала текст, отвечала за отбор ключевой информации по тематике, финальную подготовку текста. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTION
Larisa I. Kondakova contributed to the collection and analysis of literary sources, drafting the article, compiling the reference list, and preparing the manuscript for publication. Svetlana A. Kalashnikova conducted scientific editing of the manuscript, refining its content, curated essential information pertaining to the subject matter and coordinated the finalization of the manuscript. All the authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации (№ 20 22/164 от 25.11.2022 г).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. All manipulations with animals were approved by the Local Bioethics Committee of the Volgograd State Medical University, No. 2022/164 of 25.11.2022.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interest. The authors declare that there is no conflict of interest.
Financing. The study had no sponsorship (own resources).
1. Всемирная организация здравоохранения. ВОЗ: бесплодием страдает каждый шестой человек в мире. https://www.who.int/ru/news/item/04-04-2023-1-in-6-people-globally-affected-by-infertility/ (дата обращения: 12.06.2023).
2. Росстат. Заболеваемость населения социально значимыми болезнями. https://rosstat.gov.ru/ (дата обращения: 12.06.2023).
3. Росстат. Заболеваемость детей в возрасте 0–14 лет по основным классам болезней. https://rosstat.gov.ru/ (дата обращения: 12.06.2023).
4. Межгосударственный стандарт ГОСТ 33216 –2014. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами. https://rosgosts.ru/file/gost/13/020/gost_33216-2014.pdf (дата обращения: 12.06.2023).
5. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th ed. National Academies Press (US); 2011. https://doi.org/10.17226/12910. PMID: 21595115 (дата обращения: 12.06.2023).
Список литературы
1. Wang X.R., Tao F.B. Progress in researches on the effect of artificial light at night on infertility. Zhonghua Yu Fang Yi Xue Za Zhi. 2022 Jun 6; 56(6): 847–851 (In Chinese). https://doi.org/10.3760/cma.j.cn112150-20211214-01155. PMID: 35785868
2. Ricketts E.J., Joyce D.S., Rissman A.J., et al. Electric lighting, adolescent sleep and circadian outcomes, and recommendations for improving light health. Sleep Med Rev. 2022 Aug; 64: 101667. https://doi.org/10.1016/j.smrv.2022.101667. PMID: 36064209; PMCID: PMC10693907
3. Touitou Y., Reinberg A., Touitou D. Association between light at night, melatonin secretion, sleep deprivation, and the internal clock: health impacts and mechanisms of circadian disruption. Life Sci. 2017 Mar 15; 173: 94–106. https://doi.org/10.1016/j.lfs.2017.02.008. PMID: 28214594
4. Koopman A.D.M., Rauh S.P., van ‘t Riet E., et al. The association between social jetlag, the metabolic syndrome, and type 2 diabetes mellitus in the general population: the new hoorn study. J Biol Rhythms. 2017 Jun 20; 32(4): 359–368. https://doi.org/10.1177/0748730417713572. PMID: 28631524
5. Garcia-Saenz A., Sánchez de Miguel A., Espinosa A., et al. Evaluating the association between artificial light-at-night exposure and breast and prostate cancer risk in Spain (MCC-Spain study). Environ Health Perspect. 2018 Apr 5; 126(4): 047011. https://doi.org/10.1289/ehp1837. PMID: 29687979
6. Fleury G., Masis-Vargas A., Kalsbeek A. Metabolic implications of exposure to light at night: lessons from animal and human studies. Obesity (Silver Spring). 2020 Jul; 28 Suppl 1(Suppl 1): S18–S28. https://doi.org/10.1002/oby.22807. PMID: 32700826
7. Munzel T., Hahad O., Daiber A. The dark side of nocturnal light pollution. Outdoor light at night increases risk of coronary heart disease. Eur Heart J. 2020 Nov 21; 42(8): 831–834. https://doi.org/10.1093/eurheartj/ehaa866. PMID: 33221876; PMCID: PMC7897459
8. von Gall C. The effects of light and the circadian system on rhythmic brain function. Int J Mol Sci. 2022 Mar 3; 23(5): 2778. https://doi.org/10.3390/ijms23052778. PMID: 35269920
9. Lizneva D., Gavrilova-Jordan L., Walker W., et al. Androgen excess: investigations and management. Best Pract Res Clin Obstet Gynaecol. 2016 May 19; 37: 98–118. https://doi.org/10.1016/j.bpobgyn.2016.05.003. PMID: 27387253
10. Кондакова Л.И., Калашникова С.А., Полякова Л.В. и др. Морфофункциональные изменения семенников крыс при преждевременном старении, вызванном темновой депривацией. Вестник ВолгГМУ. 2022; 19(4): 123–127. https://doi.org/10.19163/1994-9480-2022-19-4-123-127. EDN: OGWTYM
11. Кузьмин Е.А., Шамитько З.В., Пьявченко Г.А. и др. Биомаркеры нейровоспаления в диагностике черепномозговой травмы и нейродегенеративных заболеваний: обзор литературы. Сеченовский вестник. 2024; 15(1): 20–35. https://doi.org/10.47093/2218-7332.2024.15.1.20-35. EDN: PWFHHW
12. Патракеева В.П., Контиевская Е.В. Современные представления об апоптозе. Якутский медицинский журнал. 2023; 3(83): 97–101. https://doi.org/10.25789/YMJ.2023.83.24. EDN: ZAQONG
13. Сорокина Ю.А., Мосина А.А., Постникова А.Д. и др. Влияние лекарственных средств на уровень белка Клото. Международный научно-исследовательский журнал. 2020; 12(102): 142–145. https://doi.org/10.23670/IRJ.2020.102.12.061. EDN: FMQPML
14. Lessard-Beaudoin M., Laroche M., Loudghi A., et al. Organ-specific alteration in caspase expression and STK3 proteolysis during the aging process. Neurobiol Aging. 2016; 47: 50–62. https://doi.org/10.1016/j.neurobiolaging.2016.07.003. PMID: 27552481
15. Beroske L., Van den Wyngaert T., Stroobants S., et al. Molecular imaging of apoptosis: the case of caspase-3 radiotracers. Int J Mol Sci. 2021 Apr 11; 22(8): 3948. https://doi.org/10.3390/ijms22083948. PMID: 33920463; PMCID: PMC8069194
16. Lo Y., Yi P.L., Hsiao Y.T., et al. A prolonged stress rat model recapitulates some PTSD-like changes in sleep and neuronal connectivity. Commun Biol. 2023 Jul 12; 6(1): 716. https://doi.org/10.1038/s42003-023-05090-9. PMID: 37438582; PMCID: PMC10338557
17. Макарова М.Н., Шекунова Е.В., Рыбакова А.В. и др. Объем выборки лабораторных животных для экспериментальных исследований. Фармация. 2018; 67(2): 3–8. https://doi.org/10.29296/25419218-2018-02-01. EDN: YTJSHU
18. Осиков М.В., Бойко М.С., Огнева О.И. и др. Этолого-иммуннологические взаимосвязи при экспериментальном десинхронозе в условиях люминисцентного освещения. Патологическая физиология и экспериментальная терапия. 2023; 67(3): 58–67. https://doi.org/10.25557/0031-2991.2023.03.58-67. EDN: BVPCAA
19. Пахомий С.С., Злобина О.В., Бугаева И.О. и др. Влияние длительности нарушения циркадных ритмов световым воздействием на морфологию печени лабораторных крыс. Оптика и спектроскопия. 2022; 130(6): 856–860. https://doi.org/10.21883/OS.2022.06.52627.34-22. EDN: LQBIGI
20. Коптяева К.Е., Мужикян А.А., Гущин Я.А. и др. Методика вскрытия и извлечения органов лабораторных животных (крысы). Лабораторные животные для научных исследований. 2018; 2: 71–93. https://doi.org/10.29296/2618723X-2018-02-08. EDN: XSMTCH
21. Feldman A.T., Wolfe D. Tissue processing and hematoxylin and eosin staining. Methods Mol Biol. 2014; 1180: 31–43. https://doi.org/10.1007/978-1-4939-1050-2_3. PMID: 25015141
22. Guligowska A., Krystek Z., Pawlikowski M., et al. Gonadotropins at advanced age – perhaps they are not so bad? Correlations between gonadotropins and sarcopenia indicators in older adults. Front Endocrinol (Lausanne). 2021 Dec 24; 12: 797243. https://doi.org/10.3389/fendo.2021.797243. PMID: 35002975; PMCID: PMC8739969
23. Okafor I.A., Okpara U.D., Ibeabuchi K.C. The reproductive functions of the human brain regions: a systematic review. J Hum Reprod Sci. 2022 Jun 30; 15(2): 102. https://doi.org/10.4103/jhrs.jhrs_18_22. PMID: 35928473; PMCID: PMC9345277
24. Берштейн Л.М., Цырлина Е.В. Гипоталамо-гипофизарная система: возраст и основные неинфекционные заболевания (злокачественные новообразования гормонозависимых тканей, кардиоваскулярная патология и сахарный диабет 2 типа). Российский физиологический журнал им. И.М. Сеченова. 2020; 106(6): 667–682. https://doi.org/10.31857/s0869813920060023. EDN: NHSGMQ
25. Davies D.M., van den Handel K., Bharadwaj S., et al. Cellular enlargement – A new hallmark of aging? Front Cell Dev Biol. 2022 Nov 10; 10: 1036602. https://doi.org/10.3389/fcell.2022.1036602. PMID: 36438561; PMCID: PMC9688412
26. Cadart C., Venkova L., Piel M., et al. Volume growth in animal cells is cell cycle dependent and shows additive fluctuations. Elife. 2022 Jan 28; 11: e70816. https://doi.org/10.7554/elife.70816. PMID: 35088713; PMCID: PMC8798040
27. Осадчук Л.В., Клещев М.А., Типисова Е.В. и др. Показатели сперматогенеза, гормонального и метаболического статуса у мужчин разных возрастных групп на Европейском Севере России. Физиология человека. 2019; 45: 107–114. https://doi.org/10.1134/S0131164619020073. EDN: VXHKMF
28. Mey M., Bhatta S., Casadesus G. Luteinizing hormone and the aging brain. Vitam Horm. 2021; 115: 89–104. https://doi.org/10.1016/bs.vh.2020.12.005. PMID: 33706966; PMCID: PMC9853463
29. Кондакова Л.И., Багметова В.В., Сиротенко В.С. и др. Влияние мелатонина на динамику массы тела и уровень белка Клото в крови у животных с преждевременным старением, вызванным темновой депривацией. Вестник ВолгГМУ. 2022; 19(4): 110–117. https://doi.org/10.19163/1994-9480-2022-19-4-110-117. EDN: QOGVHB
30. Дубиков А.И., Калиниченко С.Г., Матвеева Н.Ю. Апоптоз как фактор организации аутоиммунного воспаления при ревматоидном артрите. Современная ревматология. 2019; 13(3): 95–101. https://doi.org/10.14412/1996-7012-2019-3-95-101. EDN: SBABJJ
31. Daugaard S., Markvart J., Bonde J.P., et al. Light exposure during days with night, outdoor, and indoor work. Ann Work Expo Health. 2019 Mar 13; 63(6): 651–665. https://doi.org/10.1093/annweh/wxy110. PMID: 30865270
32. Rahman S.A., Wright K.P., Lockley S.W., et al. Characterizing the temporal dynamics of melatonin and cortisol changes in response to nocturnal light exposure. Sci Rep. 2019 Dec 23; 9(1): 19720. https://doi.org/10.1038/s41598-019-54806-7. PMID: 31873098; PMCID: PMC6928018
33. Злобина О.В., Москвина А.О., Иванов А.Н. и др. Функциональная активность звеньев стресс-реализующей и стресс-лимитирующей систем в условиях светового десинхроноза. Российский физиологический журнал им. И.М. Сеченова. 2021; 107(3): 312–320. https://doi.org/10.31857/S0869813921030109. EDN: JMSSKN
34. Ершов А.В., Грошева М.Н., Степанянц С.В. и др. Влияние сна на структурно-функциональное состояние предстательной железы. Consilium Medicum. 2022; 24(11): 816–821. https://doi.org/10.26442/20751753.2022.11.202022. EDN: HZRRXT
35. Хабаров С.В., Стерликова Н.А. Мелатонин и его роль в циркадной регуляции репродуктивной функции (обзор литературы). Вестник новых медицинских технологий. 2022; 29(3): 17–31. https://doi.org/10.24412/1609-2163-2022-3-17-31. EDN: OQVYHS
Об авторах
Л. И. КондаковаРоссия
Кондакова Лариса Игоревна - канд. мед. наук, доцент кафедры гистологии, эмбриологии, цитологии.
пл. Павших Борцов, д. 1, Волгоград, 400066
С. А. Калашникова
Россия
Калашникова Светлана Александровна - д-р мед. наук, доцент, заведующая кафедрой анатомии.
пл. Павших Борцов, д. 1, Волгоград, 400066
Дополнительные файлы

|
1. The ARRIVE guidelines 2.0: author checklist | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(107KB)
|
Метаданные ▾ | |
Рецензия
JATS XML