Перейти к:
Алгоритм машинного обучения в прогнозировании госпитальной летальности после аневризматического субарахноидального кровоизлияния
https://doi.org/10.47093/2218-7332.2024.15.4.19-31
Аннотация
Применение современных методов машинного обучения (МО) для статистического анализа больших выборок пациентов существенно превышает возможности традиционных способов обработки информации в клинической медицине.
Цель. Разработать алгоритм применения рекуррентных нейронных сетей при анализе набора клинических данных пациентов с субарахноидальным кровоизлиянием (САК).
Материалы и методы. Регистр по типу «больших данных» содержал ретроспективные данные 2631 пациента с артериальными аневризмами. Из них для данного исследования было отобрано 390 человек, у которых САК потребовало лечения в условиях отделения интенсивной терапии, анестезии и реанимации (ИТАР). Исходный набор данных содержал 7290 признаков, из которых было отобрано 12 для обучения следующих моделей МО: логистическая регрессия, метод опорных векторов, метод случайного леса, градиентный бустинг, многослойный перцептрон, рекуррентная сеть с архитектурой долгой краткосрочной памяти (LSTM). Все этапы предобработки и моделирования данных выполнены на языке Python (версия 3.11.4) с использованием библиотек scikit-learn, tensorflow, keras и hyperopt. Вычислены значения и 95% доверительные интервалы (ДИ) AUROC и AURPC, прогностическая ценность, специфичность и чувствительность.
Результаты. В выборке было 246 (63%) женщин и 144 (37%) мужчины, средний возраст всех пациентов составил 54 ± 12,9 года. Летальный исход зарегистрирован у 133 (34%) пациентов, в том числе у 33 в течение 24 часов после поступления. Лучшей моделью, предсказывающей летальный исход, была рекуррентная нейронная сеть LSTM. При сравнении с другими моделями LSTM характеризовалась наибольшей предиктивной силой (AUROC – 0,83; 95% ДИ: 0,72–0,92, AURPC – 0,62; 95% ДИ 0,39–0,81) в отношении госпитальной летальности. Для периода времени нахождения в ИТАР с 3-х по 6-е сутки положительная прогностическая ценность модели составила 0,83, чувствительность– 0,95 и специфичность– 0,58.
Заключение. Рекуррентная нейронная сеть LSTM может быть адаптирована к разработке автоматизированных алгоритмов ведения пациентов с САК в критическом состоянии.
Ключевые слова
Субарахноидальное кровоизлияние (САК) вследствие разрыва артериальной аневризмы головного мозга характеризуется высокими показателями летальности и инвалидизации. Так, около 40% пациентов с САК погибают в первые сутки, а среди выживших лишь 15% возвращаются к нормальной жизнедеятельности [1–3]. Клинические и радиологические параметры пациентов с САК, зарегистрированные на догоспитальном этапе и при поступлении в профильный стационар, коррелируют с течением заболевания. Это отражено в таких общепринятых классификациях САК как Хант-Хесс, шкала Всемирной федерации нейрохирургов, шкала комы Глазго, шкала Фишера [4]. Несмотря на подтверждённую практическую ценность этих классификаций, они имеют определённые недостатки, связанные, в частности, с субъективностью оценок состояния больных с САК, а также с ограниченностью учитываемых переменных. Появление современных методов сбора и обработки медицинской информации в цифровом виде открывает возможности для переосмысления роли тех или иных факторов в течение САК, а также повышает объективность оценки прогноза заболевания.
Наличие выборок, содержащих большое количество цифровой медицинской информации, собранной без предварительной фильтрации и цензурирования (по типу «больших данных»), позволяет применять к ним методы искусственного интеллекта и машинного обучения (МО). Разработка прогностических моделей МО для пациентов с САК, особенно находящихся в критическом состоянии, важна не только с исследовательских позиций, но и в свете клинико-экономического анализа заболевания. Учитывая объёмность, комплексность и гетерогенность данных мониторирования пациентов в условиях отделения интенсивной терапии, анестезии и реанимации (ИТАР), применение современных методик МО для статистического анализа существенно превышает возможности традиционных способов обработки информации в клинической медицине.
Цель данного исследования: разработать алгоритм применения рекуррентных нейронных сетей при анализе набора клинических данных пациентов с САК.
МАТЕРИАЛЫ И МЕТОДЫ
Набор данных
В ретроспективное исследование включены данные 2631 пациента с артериальными аневризмами, госпитализированного в Университетскую клинику г. Турку (Финляндия) за период с 2002 по 2018 год. Согласно протоколу центра, в котором осуществлялось лечение, все пациенты с подтверждённым диагнозом аневризматического САК поступали в отделение ИТАР на период активного лечения с последующим переводом в стационарное отделение при стабилизации состояния. Таким образом, из общего количества отобрано 390 пациентов, у которых САК потребовало лечения в условиях отделения ИТАР.
Все данные были структурированы в виде двух блоков.
- Клинический блок включал демографическую информацию; список всех зафиксированных диагнозов; перечень подразделений больницы и даты всех контактов с ней; список проведённых инструментально-диагностических мероприятий лабораторной, лучевой и патоморфологической диагностики с отображением всех результатов обследования и заключениями специалистов в текстовом формате; информацию о вмешательствах, проведённых в условиях операционной, с данными кодов, названий, времени операций и основными параметрами анестезиологического пособия; данные о проведённой в стационаре лекарственной терапии с указанием названий и дозировок препаратов; записи базового мониторирования состояния средним медицинским персоналом, дневниковые и выписные записи лечащих врачей в текстовом формате.
- Реанимационный блок включал три подраздела: (а) записи мониторирования состояния пациента средним медперсоналом в текстовом формате, (б) числовые данные инструментального мониторирования (артериальное давление, частота сердечных сокращений (ЧСС), внутричерепное давление, параметры респираторной поддержки), которые в условиях реанимационного отделения автоматически вносились в медицинскую информационную систему каждые две минуты, независимо от продолжительности мониторирования; (в) назначения лечащего врача и лекарственная терапия (текст и/или числами).
Предобработка данных
Все данные представлены в виде векторов, содержащих признаки для каждого пациента и структурированных в хронологическом порядке. Числовые признаки (например, ЧСС) преобразовывали в упорядоченные по времени векторы. Нечисловые признаки (например, мышечный тонус конечностей со значениями «низкий», «умеренный» и «высокий») кодировали бинарными или порядковыми переменными. Значительная часть данных в виде текстовых значений (например, «реакция зрачков вялая» или «ликвор бледно-розовый») была удалена во избежание избыточности анализируемого материала.
Поскольку каждое событие могло иметь различную частоту измерений, векторы признаков были преобразованы в часовые временные интервалы t, начиная со времени поступления пациента в отделение ИТАР и заканчивая 24 часами, создавая последовательности длиной 24 временных интервала для каждого пациента. В пределах каждого временного интервала несколько измерений одного и того же признака агрегировали с помощью некоторой функции, например, среднего значения. При отсутствии измерения признака в течение интервала t оставляли пропуски. Среди всех пациентов было зарегистрировано 393 периода лечения в отделении ИТАР. Длительность каждого периода лечения варьировалась от 1 до 14 суток. Кроме того, в начало последовательностей были добавлены исторические данные пациентов за последний год. Таким образом, каждый временной интервал t включал левую часть и исключал правую часть (t, t + 1).
После предобработки матрица данных имела размерность 393×25×7290, где 393 – количество периодов в отделении ИТАР, 25 – 24 временных интервала пребывания плюс вектор исторических данных, и 7290 – количество признаков. Разреженность набора данных составила 98%. Ни один признак не имел 0% разреженности, то есть либо у пациента не было признаков, регистрируемых постоянно каждый час после поступления в отделение ИТАР, либо у пациента отсутствовали исторические данные.
Отбор признаков
Отбор признаков проведен с помощью специально написанной программы1. На первом этапе фильтрации данных были удалены признаки, встречаемое количество измерений которых было меньше или равно 10. Эта процедура привела к удалению 5281 (72,4%) признака. Далее были удалены 486 (6,7%) мультиколлинеарных признаков (с корреляцией более 90%). После этого из 7290 осталось 322 (4,4%) признака. На последнем шаге была реализована селекция признаков на основе метода обертывания, при котором удаляли сеты по пять признаков за раз. В ходе обработки данных учитывался процент пациентов, у которых было зарегистрировано хотя бы одно измерение каждого признака в первые 24 часа пребывания в ИТАР. После фильтрации было выявлено 14 признаков, релевантных для внесения в модель МО (рис. 1).
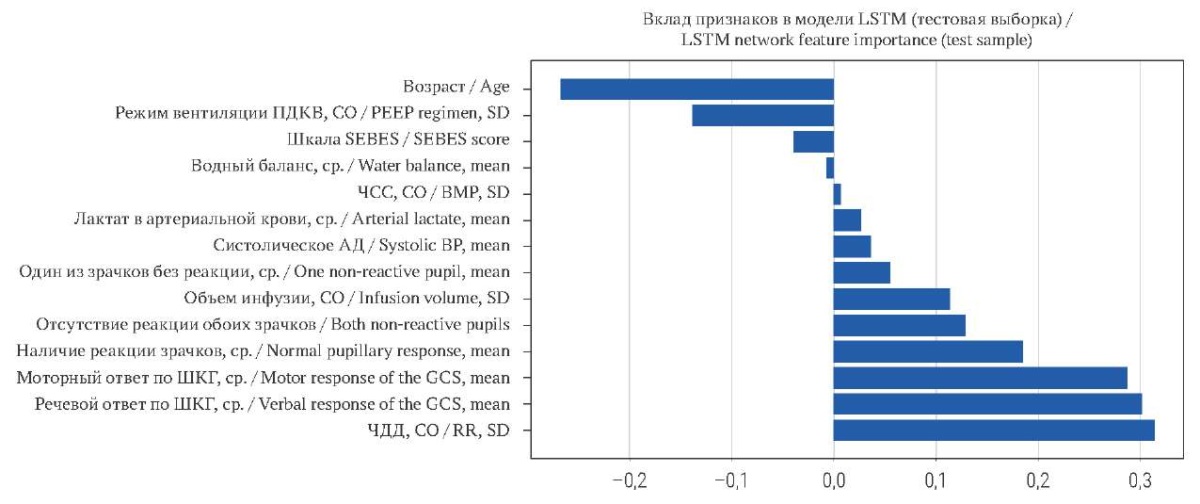
РИС. 1. Вклад признаков в модель LSTM.
Примечание: АД – артериальное давление; ПДКВ – положительное давление конца выдоха; СО – стандартное отклонение; ср. – среднее арифметическое ЧДД – частота дыхательных движений; ЧСС – частота сердечных сокращений; ШКГ – шкала комы Глазго; SEBES Score – Subarachnoid Hemorrhage Early Brain Edema Score (шкала раннего отёка мозга при субарахноидальном кровоизлиянии).
FIG. 1. LSTM network feature importance.
Note: BMP – beats per minute (heart rate); BP – blood pressure; GCS – Glasgow Coma Scale; PEEP regimen – positive end-expiratory pressure regimen, RR – Respiratory rate; SD – standard deviation.
Среди них 3 признака, характеризующих фотореакцию зрачков в разных комбинациях, в клиническом смысле представляли собой единую переменную, поэтому они были объединены математически, что дало в финальном наборе 12 признаков (табл. 1).
Таблица 1. Переменные, включённые в модель LSTM
Table 1. Features used in LSTM network
|
Переменная |
Значение р |
|
Моторный ответ по ШКГ, ср. / Motor response of the GCS, mean |
<0,00001 |
|
Речевой ответ по ШКГ, ср. / Verbal response of the GCS, mean |
<0,00001 |
|
Фотореакция зрачков / pupils photoreaction |
0,00001 |
|
Объём инфузии, ср. / Infusion volume, mean |
0,00058 |
|
Водный баланс, СО / Water balance, SD |
0,00032 |
|
ЧСС, СО / BPM, SD |
0,00029 |
|
ЧДД, СО / RR, SD |
0,00016 |
|
Шкала SEBES / SEBES score |
0,00062 |
|
Режим вентиляции ПДКВ, СО / PEEP regimen, SD |
0,93363 |
|
Лактат в артериальной крови, ср. / Arterial lactate, mean |
0,00719 |
|
Систолическое АД, ср. / Systolic BP, mean |
0,27905 |
|
Возраст / Age |
0,11413 |
Примечание: АД – артериальное давление; ПДКВ – положительное давление конца выдоха; СО – стандартное отклонение; ср. – среднее арифметическое; ЧДД – частота дыхательных движений; ЧСС – частота сердечных сокращений; ШКГ – шкала комы Глазго; SEBES Score – Subarachnoid Hemorrhage Early Brain Edema Score (шкала раннего отёка мозга при субарахноидальном кровоизлиянии).
Note: BMP – beats per minute (heart rate); BP – blood pressure; GCS – Glasgow Coma Scale; PEEP regimen – positive end-expiratory pressure regimen, RR – Respiratory rate; SD – standard deviation.
Признаки, используемые для работы модели, включили моторный и речевой ответ по шкале комы Глазго (ШКГ), фотореакцию зрачков, объём жидкости, водный баланс, ЧСС, частоту дыхательных движений (ЧДД), шкалу SEBES 8 (Subarachnoid Hemorrhage Early Brain Edema Score (шкала раннего отёка мозга при субарахноидальном кровоизлиянии), режим вентиляции с положительным давлением конца выдоха (ПДКВ), уровень лактата в артериальной крови, систолическое артериальное давление (АД), возраст.
Процесс отбора признаков представлен в виде блок-схемы в Приложении А (дополнительные материалы на сайте журнала https://doi.org/10.47093/2218-7332.2024.15.4.19-31-annex-a).
Разработка модели
В качестве модели, предсказывающей летальный исход, была использована рекуррентная нейронная сеть (recurrent neural network) с архитектурой долгой краткосрочной памяти (long short-term memory – LSTM)2. Производительность LSTM-моделей сравнивалась с пятью базовыми алгоритмами: логистическая регрессия, метод опорных векторов (support vector machine), метод случайного леса (random forest), подвид градиентного бустинга в виде XGBoost и многослойный перцептрон. Модели были выбраны на основе их распространенности и подтверждённой эффективности в литературе [5–9].
Базовые модели были оптимизированы и обучены на трех наборах признаков. Первый набор включал только средние значения данных временного ряда. Второй набор включал средние значения и стандартные отклонения данных временного ряда. Третий набор включал как средние значения, стандартные отклонения, так и дополнительно количество отсутствующих значений для каждого признака. Задача состояла в том, чтобы сначала оценить качество моделей только со средними значениями признаков, затем дополнительно предоставить моделям информацию о дисперсии и, наконец, выяснить, выигрывают ли модели от недостающей информации. Таким образом, для каждой из трех версий базовых моделей была проведена оптимизация гиперпараметров с 14, 28 и 36 признаками, соответственно. Кроме того, LSTM обучали на наборе из «пяти лучших признаков» (речевой ответ по ШКГ, моторный ответ по ШКГ, водный баланс, отсутствие реакции зрачков, ЧДД), которые были определены с помощью метода вычисления важности признаков (permutation feature importance) на валидационной выборке.
Статистический анализ
Все этапы предобработки и моделирования данных выполнены на языке Python (версия 3.11.4) с использованием библиотек scikit-learn, tensorflow и keras. Набор данных был разделен на обучающий (75% данных) и валидационный (25% данных) со стратификацией по летальному исходу. Подбор гиперпараметров проводили с помощью библиотеки hyperopt и ее реализации байесовской оптимизации в виде древовидно-структурированного оценщика Парсена (tree-structured Parzen estimator). Для расчетов признаков в процессе фильтрации данных были использованы средние значения за 24 часа пребывания в отделении ИТАР. Уровень значимости р рассчитан с помощью теста Колмогорова–Смирнова, U-теста Манна–Уитни или хи-квадрат Пирсона в зависимости от типа распределения признака. Порог значения p оценивался с поправкой Бонферрони (скорректированное пороговое значение = 0,05 / 12 ≈ 0,004167). Вычислена прогностическая ценность, специфичность и чувствительность моделей, точность оценивали с помощью площади под кривой ошибок (area under the receiver operating characteristic – AUROC) и площади под кривой точности-полноты (area under the precision-recall curve – AUPRC), средние значения и 95% доверительные интервалы рассчитывали при кросс-валидации на 4 блоках. Проведена оценка значимости признаков Шепли [10].
РЕЗУЛЬТАТЫ
Характеристика пациентов
В выборке было 246 (63%) женщин и 144 (37%) мужчин. Средний возраст всех пациентов составил 54 года (стандартное отклонение 12,9 года, диапазон от 18 до 89 лет). Средний возраст женщин был 54 года (стандартное отклонение 13,2 года, диапазон от 20 до 89 лет), мужчин – 55 лет (стандартное отклонение 12,5 года, диапазон от 18 до 83 лет).
Летальный исход зарегистрирован у 133 (34%) из 390 пациентов. Из общего количества для обучения моделей МО использовали данные 348 (89%) пациентов, у которых срок пребывания в отделении ИТАР составил более 24 часов. Остальные 42 (11%) пациента либо умерли (n = 33), либо выписаны из отделения ИТАР (n = 9) в течение 24 часов после поступления и были исключены из тренировочной выборки, но использовались в качестве дополнительного тестового набора данных.
Сравнение моделей
Предиктивная сила моделей LSTM, LSTM с пятью лучшими характеристиками и XGboost представлена на рисунке 2. Согласно представленным данным наилучшие показатели (AUROC и AUPRC) моделей наблюдаются в период с 3-х по 6-е сутки. После 7-х суток нахождения в ИТАР предиктивная сила моделей ослабевала, что показано на рисунке 2 в виде снижения показателей кривых AUROC и AUPRC.
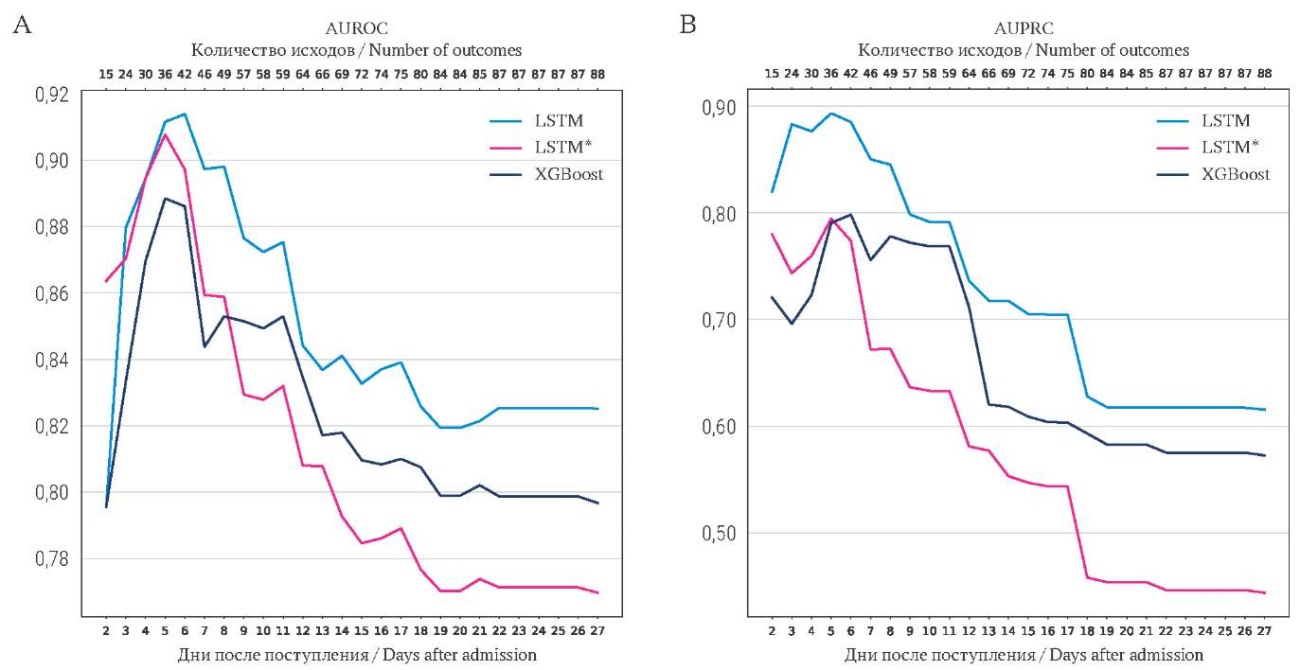
РИС. 2. Сравнение показателей AUROC (А) и AUPRC (В) моделей.
Примечание: * LSTM на наборе из пяти лучших признаков.
FIG. 2. Comparison of AUROC (А) and AUPRC (В) between models.
Note: *Five best features LSTM.
Наиболее высокое качество продемонстрировала полная модель LSTM, учитывающая средние значения всех признаков (табл. 2).
Таблица 2. Сравнительный анализ моделей машинного обучения
Table 2. Comparative analysis of machine learning models
|
AUROC |
После 4-кратной кросс-валидации / After 4-fold cross-validation |
||
|
AUROC |
AUPRC |
||
|
Логистическая регрессия / Logistic regression |
|||
|
Ср. / Mean |
0,86 |
0,76 (0,65–0,86) |
0,46 (0,27–0,65) |
|
Ср. + СО / Mean + SD |
0,85 |
0,73 (0,61–0,83) |
0,35 (0,22–0,54) |
|
Ср. + СО + пропуски / Mean + SD + missing values |
0,85 |
0,73 (0,62–0,84) |
0,37 (0,23–0,58) |
|
Метод опорных векторов / Support vector machine |
|||
|
Ср. / Mean |
0,86 |
0,77 (0,66–0,86) |
0,46 (0,26–0,66) |
|
Ср. + СО / Mean + SD |
0,85 |
0,73 (0,62–0,84) |
0,38 (0,23–0,60) |
|
Ср. + СО + пропуски / Mean + SD + missing values |
0,86 |
0,74 (0,62–0,85) |
0,44 (0,26–0,68) |
|
Многослойный перцептрон / Multilayer perceptron |
|||
|
Ср. / Mean |
0,87 |
0,68 (0,56–0,80) |
0,40 (0,22–0,58) |
|
Ср. + СО / Mean + SD |
0,86 |
0,79 (0,69–0,89) |
0,49 (0,30–0,69) |
|
Ср. + СО + пропуски / Mean + SD + missing values |
0,85 |
0,75 (0,63–0,86) |
0,45 (0,26–0,64) |
|
Метод случайного леса / Random forest |
|||
|
Ср. / Mean |
0,87 |
0,74 (0,62–0,85) |
0,45 (0,26–0,64) |
|
Ср. + СО / Mean + SD |
0,87 |
0,78 (0,66–0,89) |
0,55 (0,33–0,75) |
|
Ср. + СО + пропуски / Mean + SD + missing values |
0,86 |
0,76 (0,65–0,87) |
0,44 (0,26–0,65) |
|
Градиентный бустинг / XGBoost |
|||
|
Ср. / Mean |
0,87 |
0,76 (0,65–0,86) |
0,44 (0,26–0,65) |
|
Ср. + СО / Mean + SD |
0,87 |
0,80 (0,68–0,90) |
0,57 (0,35–0,79) |
|
Ср. + СО + пропуски / Mean + SD + missing values |
0,88 |
0,78 (0,65–0,89) |
0,50 (0,30–0,74) |
|
Рекуррентная сеть LSTM / LSTM recurrent network |
|||
|
Временной ряд / Time series |
- |
0,83 (0,72–0,92) |
0,62 (0,39–0,81) |
|
Временной ряд + пропуски / Time series + missing values |
0,94 |
0,82 (0,71–0,92) |
0,60 (0,38–0,80) |
|
Лучшие пять переменных / Five best features |
- |
0,77 (0,66–0,87) |
0,44 (0,27–0,70) |
Примечание: Ср. – среднее; СО – стандартное отклонение.
Note: SD – standard deviation.
Для периода с 3-х по 6-е сутки пребывания в отделении ИТАР положительная прогностическая ценность полной модели LSTM составила 0,83, специфичность – 0,58 и чувствительность – 0,95.
Уменьшенная LSTM и полная модель LSTM были дополнительно оценены путем анализа их производительности на разных временных интервалах. Это было сделано путем оценки обученных моделей на тестовых данных с длиной последовательности 2, 4, 6, ..., 24 часа (рис. 3).
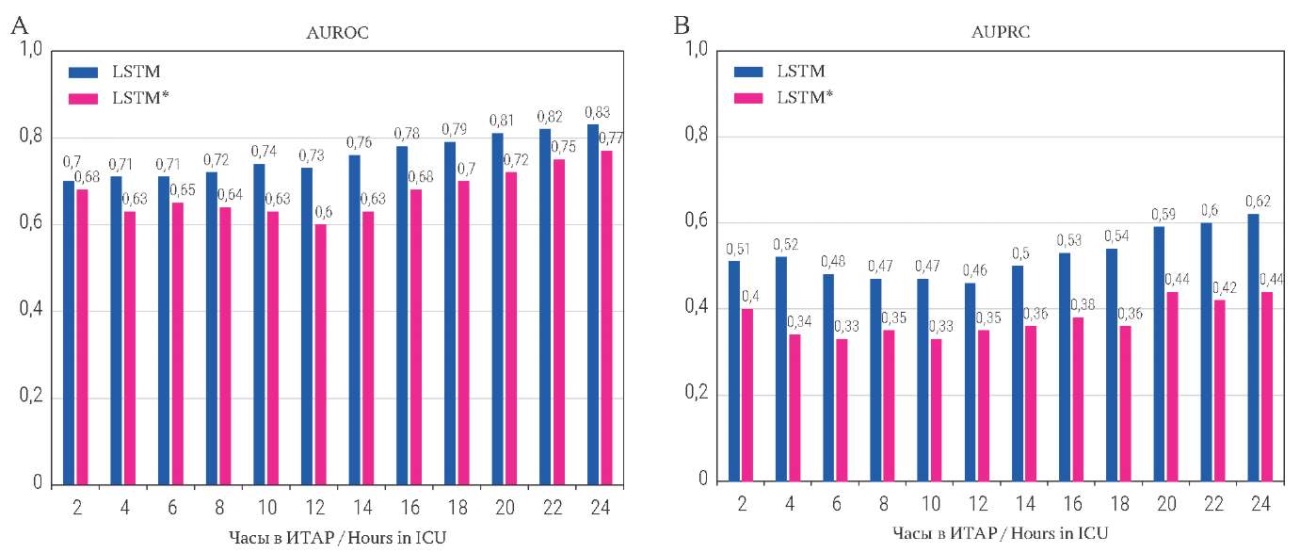
РИС. 3. Значения AUROC (А) и AUPRC (B) для моделей в зависимости от срока пребывания в отделении интенсивной терапии, анестезии и реанимации.
Примечание: *LSTM на наборе из пяти лучших признаков.
ИТАР – отделение интенсивной терапии, анестезии и реанимации.
FIG. 3. AUROC (А) and AUPRC (B) of models with respect to duration of stay in intensive care unit.
Note: *Five best features LSTM.
ICU – intensive care unit.
Вклад отдельных характеристик в модель LSTM оценивался на тестовой выборке. Оценка значимости признаков Шепли проводилась на основании данных тренировочной выборки. На рисунке 4А представлена полученная диаграмма влияния факторов в предиктивной модели (по типу «дерева решений») для всех пациентов. Согласно этой диаграмме вероятность летального исхода была наименее вариабельна у таких признаков, как содержание лактата в артериальной крови, реакция зрачков на свет, моторный и речевой ответ по ШКГ.
Наибольшую вариативность в отношении летальности продемонстрировали переменные шкалы SEBES, возраст и систолическое АД. На рисунке 4B показана вариативность летальности для каждого отрезка времени в течение первых суток нахождения пациентов в палате ИТАР. Так, разброс значений летальности существенно возрастает после 13–14 часов нахождения в отделении ИТАР.
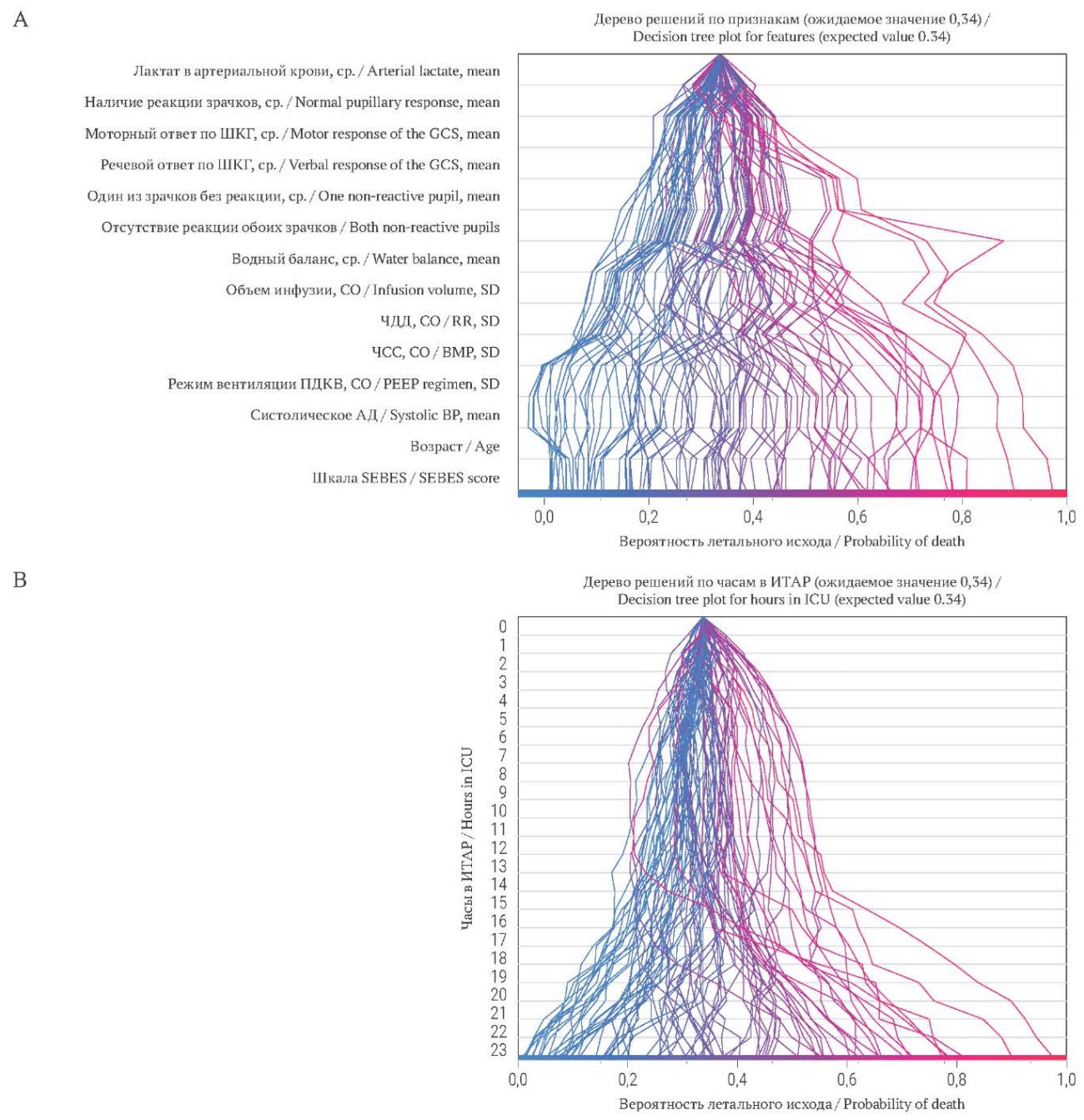
РИС. 4. Дерево решений по признакам (A), по часам (B) в отделении интенсивной терапии, анестезии и реанимации.
Примечание: АД – артериальное давление; ИТАР – отделении интенсивной терапии, анестезии и реанимации; ПДКВ – положительное давление конца выдоха; СО – стандартное отклонение; ср. – среднее арифметическое; ЧДД – частота дыхательных движений; ЧСС – частота сердечных сокращений; ШКГ – шкала комы Глазго; SEBES Score – Subarachnoid Hemorrhage Early Brain Edema Score (шкала раннего отёка мозга при субарахноидальном кровоизлиянии).
FIG. 4. Decision tree plot for features (A), hours (B) in intensive care unit.
Note: BMP – beats per minute (heart rate); BP – blood pressure; GCS – Glasgow Coma Scale; ICU – intensive care unit; PEEP regimen – positive end-expiratory pressure regimen; RR – Respiratory rate; SD – standard deviation.
Диаграммы по типу «пчелиного роя», показывающие влияние признаков, использованных в модели LSTM представлены в приложении B (дополнительные материалы на сайте журнала https://doi.org/10.47093/2218-7332.2024.15.4.19-31-annex-b). На этих рисунках красным цветом обозначены максимальные, а синим – минимальные значения по каждой из переменных, и их влияние на летальный исход в зависимости от часа регистрации в отделении ИТАР.
ОБСУЖДЕНИЕ
В ходе проведённого исследования создана модель МО по прогнозированию летальности у пациентов с аневризматическим САК на основании показателей мониторирования в отделении ИТАР в течение первых 24 часов от поступления. При сравнительном анализе эффективности вариантов алгоритмов МО наибольшей предиктивной мощностью характеризовалась модель с архитектурой LSTM. Так, значения AUROC и AUPRC для модели LSTM были самыми высокими, составив 0,83 и 0,62, соответственно. При этом необходимо отметить, что показатели AUROC и AUPRC имели отчётливую тенденцию к снижению при возникновении летального исхода после 6 суток от начала заболевания. На практике это означает, что применённый в этом исследовании алгоритм МО наиболее информативен в ближайшем периоде после поступления пациента в отделение ИТАР, а после 6 суток его прогностическая ценность ослабевает.
Разработанная модель МО включила 12 признаков, которые были отобраны в ходе предобработки первичной выборки в форме больших данных. Важно отметить, что первичная выборка содержала 7290 признаков, но после проведённых процедур по предобработке данных в анализ было оставлено только 322. Методы предобработки данных выборки, в которой информация имеет выраженную гетерогенность и комплексность описаны ранее3. При оценке значимости признаков установлены независимо ассоциированные с летальным исходом после САК. Выявленные факторы можно сгруппировать в несколько блоков: (1) переменные мониторирования, (2) переменные клинического статуса и (3) переменные нейровизуализации. Ниже мы рассмотрим эти переменные более подробно.
- Переменные мониторирования
В этот блок вошли такие показатели, как водный баланс, объём инфузии, ЧД, ЧСС, систолическое АД, режим вентиляции ПДКВ, уровень лактата в артериальной крови. Отметим, что такие переменные, как режим вентиляции ПДКВ и систолическое АД, не достигли порога статистической значимости. Оценка корреляции вышеуказанных факторов с летальностью показала увеличение вероятности неблагоприятного исхода при повышенных показателях объёма инфузии, положительном водном балансе, высоких значениях систолического АД и повышении лактата артериальной крови, а также при снижении показателей ЧД и ЧСС. Эти результаты согласуются с литературными данными [9][11–15]. В условиях ИТАР, как правило, уделяется повышенное внимание контролю водного баланса при ведении пациентов с САК, так как это составляющая часть традиционной модели профилактики вазоспазма, а именно 3Г-терапии (гипертензия, гиперволемия, гемодилюция) [16][17]. При этом современная литература содержит указания на неоднозначность такого подхода в отношении гиперволемии и гипергидратации [14]. Так, в работе N.R. Kissoon и соавт. [12] при анализе выборки, состоящей из 288 пациентов с САК, было обнаружено негативное влияние повышенных объёмов вводимых жидкостей и поддержания положительного водного баланса на функциональный исход. Каждому литру позитивного водного баланса соответствовало увеличение на 17% риска неблагоприятного функционального исхода. Позитивный водный баланс был статистически независимым фактором и ассоциировался с рисками кардиопульмональных осложнений. В качестве возможных механизмов негативного влияния гипергидратации при САК авторы отмечают развитие отёка мозга и нарушения электрохимических процессов в нервной ткани из-за альтераций электролитного гомеостаза [12]. В пользу гипотезы о повреждающем воздействии гипергидратации при САК R.P. Martini и соавт. [13] в группе из 356 пациентов обнаружили, что инфаркт мозга на контрольных снимках компьютерной томографии регистрировался чаще у пациентов с положительным, а не отрицательным водным балансом: 11% vs. 7%, соответственно. Кроме того, по данным других авторов положительный водный баланс был ассоциирован с развитием почечной и печёночной дисфункции, а также гематологических осложнений у пациентов с САК [18][19].
Одним из факторов, ассоциированных с увеличением риска летального исхода было содержание лактата в артериальной крови. Это наблюдение получает подтверждение и по данным литературы. Содержание лактата в крови даёт информацию о тяжести состояния и риске летальности у пациентов в отделении ИТАР [20], а также может использоваться в качестве предиктора исходов при сепсисе и тяжелых политравмах [21]. В работе, посвящённой исследованию влияния лактата крови на прогнозирование пациентов с САК летального исхода, C.H. Oh и соавт. [11] проанализировали выборку из 189 пациентов и обнаружили статистически значимую корреляцию между повышением концентрации лактата более 2,3 ммоль/л и риском смерти после САК. В качестве объяснения патофизиологии этого феномена авторы выдвинули гипотезу, согласно которой лактат крови выступает в качестве биомаркера тканевой гипоксии и гипоперфузии мозга, что вызвано гиперпродукцией катехоламинов, столь типичной для острого периода САК [11].
- Переменные клинического статуса
Эта группа факторов в модели МО включала моторный и речевой ответ по ШКГ, а также реакцию зрачков на свет в разных комбинациях. Отсутствие ответа на речь, ухудшение моторной реакции и снижение фотореакции зрачков коррелировали с неблагоприятным прогнозом. Влияние этих переменных на прогноз САК подробно проанализировано ранее [3] и подтверждаются реальной клинической практикой.
К этой группе переменных также относится возраст пациентов. Согласно полученной модели МО, этот фактор не имел статистической значимости в прогнозировании летального исхода. Подобный феномен, по-видимому, связан наличием корреляции возраста с остальными компонентами модели, что в математическом плане не позволяет рассматривать его как независимую переменную. Вместе с тем клинический опыт однозначно указывает на отрицательное влияние возраста на исход САК.
- Переменные нейровизуалиции
Разработанная модель МО включила шкалу SEBES, описывающую наличие ранних повреждений мозга и изменений на компьютерной томографии. Данная шкала была опубликована в 2018 году S.H. Ahn и соавт. [22] для оценки прогностической ценности ранних повреждений и отёка мозга на двух уровнях компьютерной томографии в первые часы после САК. Необходимость разработки подобной шкалы была продиктована наблюдениями о связи ранних повреждений мозга с развитием отсроченной ишемии мозга, в тяжелых случаях приводящей к летальному исходу [22–25]. Понятие ранних повреждений мозга (в англоязычной литературе – early brain injury) определено как повреждения мозга в течение 72 часов от начала симптомов САК [23]. Таким образом, шкала SEBES базируется на оценке снимков компьютерной томографии на раннем этапе нахождения пациента в отделении ИТАР. В последние годы при оценке изменений отёка мозга используется расширение зон интереса до трех (SEBES 6) и четырёх уровней (SEBES 8) [26]. В нашем анализе мы применяли модификацию SEBES 8. Данная переменная и её включение в разработанную прогностическую модель соответствует клинической логике течения заболевания и подтверждает необходимость её оценки, особенно к концу первых суток в отделении ИТАР.
Ограничения исследования
Ограничениями являются ретроспективный дизайн исследования, а также отсутствие валидационной выборки. Кроме того, разработанная модель базируется на переменных, которые были строго ограничены по времени регистрации первыми сутками от поступления в отделение ИТАР. Применение модели для прогнозирования летальности в более поздние сроки ограничено, поскольку отсроченные осложнения САК (например, гидроцефалия и симптоматический вазоспазм) не были приняты во внимание при разработке модели. С методологической точки зрения оценка модели, основанной на переменных, предварительно отфильтрованных из разреженных данных, смещает акцент анализа в сторону математической ценности, ограничивая клиническую релевантность признаков, включенных в модель. Однако такой подход был выбран нами в первую очередь для подтверждения возможности применения современных методов МО для анализа клинических выборок.
ЗАКЛЮЧЕНИЕ
В исследовании представлен алгоритм анализа необработанного набора данных с применением различных моделей МО. Лучшей моделью для предсказания летального исхода была рекуррентная нейронная сеть LSTM. Эта модель включила набор признаков, зарегистрированных в течение 24 часов от поступления в отделение ИТАР, и позволила предсказать госпитальную летальность в течение 7 суток после САК с показателем специфичности 0,58 и чувствительности 0,95. Положительная прогностическая ценность модели достигала максимума при регистрации переменных с 3-х по 6-е сутки нахождения в отделении ИТАР, составив 0,83. В перспективе модель может быть адаптирована к разработке автоматизированных алгоритмов ведения пациентов с САК в критическом состоянии.
ВКЛАД АВТОРОВ
Ю.В. Кивелёв разработал концепцию и дизайн исследования, провел сбор и обработку клинического материала, составил основной текст рукописи. Ю.В. Кивелёв, А.Л. Кривошапкин, А.А. Суфианов участвовали в редактировании текста рукописи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Juri V. Kivelev developed the concept and design of the study, collected and analyzed the data and drafted the manuscript. Juri V. Kivelev, Alexey L. Krivoshapkin, Albert A. Sufianov took part in editing of the text. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено в соответствии с разрешением Локального этического комитета Университетской клиники г. Турку, Финляндия (№ T04/005/18, 2018 г.)4. Ретроспективное исследование псевдонимизированного регистра не требует получения информированного согласия пациентов.
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу. Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study was conducted in accordance with the permission of the Local Bioethics Committee of the Turku University Hospital, No T04/005/18, 20185. Informed consent is not required for a retrospective study of a pseudonymised registry.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financing. The study was not sponsored (own resources).
1. Suvanto, Kalle-Oskari (2022-10-14). Machine learning based prediction of intensive care unit mortality for patients with aneurysmal subarachnoid hemorrhage https://oulurepo.oulu.fi/handle/10024/19706 (дата доступа: 08.01.2023).
2. Suvanto, Kalle-Oskari (2022-10-14). Machine learning based prediction of intensive care unit mortality for patients with aneurysmal subarachnoid hemorrhage https://oulurepo.oulu.fi/handle/10024/19706 (дата доступа: 08.01.2023).
3. Suvanto, Kalle-Oskari (2022-10-14). Machine learning based prediction of intensive care unit mortality for patients with aneurysmal subarachnoid hemorrhage https://oulurepo.oulu.fi/handle/10024/19706 (дата доступа: 08.01.2023).
4. База данных для представленного исследования собрана Кивелёвым Ю.В. во время его научной работы в Университете г. Турку (Финляндия) и является частью научного проекта с участием инженеров-программистов и биостатистиков.
5. The database for this study was collected by Juri V. Kivelev during his scientifi c work at the University of Turku (Finland). It is part of a scientifi c project involving software engineers and biostatisticians.
Список литературы
1. van Gijn J, Kerr R.S., Rinkel G.J. Subarachnoid haemorrhage. Lancet. 2007; 369(9558): 306–318. https://doi.org/10.1016/s0140-6736(07)60153-6. PMID: 17258671
2. Suarez J.I., Tarr R.W., Selman W.R. Aneurysmal subarachnoid hemorrhage. N Engl J Med. 2006; 354(4): 387–396. https://doi.org/10.1056/nejmra052732. PMID: 16436770
3. Lawton M.T., Vates G.E. Subarachnoid Hemorrhage. The New England journal of medicine. 2017; 377(3): 257–266. https://doi.org/10.1056/nejmcp1605827. PMID: 28723321
4. Brisman J.L., Song J.K., Newell D.W. Cerebral aneurysms. N Engl J Med. 2006; 355(9): 928–939. https://doi.org/10.1056/nejmra052760. PMID: 16943405
5. Wang R., Zhang J., Shan B., et al. XGBoost Machine Learning Algorithm for Prediction of Outcome in Aneurysmal Subarachnoid Hemorrhage. Neuropsychiatr Dis Treat. 2022; 18: 659–667. https://doi.org/10.2147/ndt.s349956. PMID: 35378822
6. Jaja B.N.R., Saposnik G., Lingsma H.F., et al. Development and validation of outcome prediction models for aneurysmal subarachnoid haemorrhage: the SAHIT multinational cohort study. Bmj. 2018; 360: j5745. https://doi.org/10.1136/bmj.j5745. PMID: 29348138
7. Dengler N.F., Madai V.I., Unteroberdörster M., et al. Outcome prediction in aneurysmal subarachnoid hemorrhage: a comparison of machine learning methods and established clinico-radiological scores. Neurosurg Rev. 2021; 44(5): 2837–2846. https://doi.org/10.1007/s10143-020-01453-6. PMID: 33474607
8. Yu D., Williams G.W., Aguilar D., et al. Machine learning prediction of the adverse outcome for nontraumatic subarachnoid hemorrhage patients. Ann Clin Transl Neurol. 2020; 7(11): 2178– 2185. https://doi.org/10.1002/acn3.51208. Epub 2020 Sep 29. PMID: 32990362
9. Tabaie A., Nemati S., Allen J.W., et al. Assessing contribution of higher order clinical risk factors to prediction of outcome in aneurysmal subarachnoid hemorrhage patients. AMIA Annu Symp Proc. 2019; 2019: 848–856. PMID: 32308881
10. Štrumbelj E., Kononenko I. Explaining prediction models and individual predictions with feature contributions. Knowledge and Information Systems. 2013; 41: 647–665. https://doi.org/10.1007/s10115-013-0679-x
11. Oh C.H., Kim J.W., Kim G.H., et al. Serum Lactate could predict mortality in patients with spontaneous subarachnoid hemorrhage in the emergency department. Front Neurol. 2020; 11: 975. https://doi.org/10.3389/fneur.2020.00975. PMID: 33013645
12. Kissoon N.R., Mandrekar J.N., Fugate J.E., et al. Positive fluid balance is associated with poor outcomes in subarachnoid hemorrhage. J Stroke Cerebrovasc Dis. 2015; 24(10): 2245–2251. https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.05.027. PMID: 26277290
13. Martini R.P., Deem S., Brown M., et al. The association between fluid balance and outcomes after subarachnoid hemorrhage. Neurocrit Care. 2012; 17(2): 191–198. https://doi.org/10.1007/s12028-011-9573-0. PMID: 21688008
14. Deem S., Diringer M., Livesay S., Treggiari M.M. Hemodynamic management in the prevention and treatment of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2023; 39(1): 81–90. https://doi.org/10.1007/s12028-02301738-w. PMID: 37160848
15. Hosmann A., Schnackenburg P., Rauscher S., et al. Brain tissue oxygen response as indicator for cerebral lactate levels in aneurysmal subarachnoid hemorrhage patients. J Neurosurg Anesthesiol. 2022; 34(2): 193–200. https://doi.org/10.1097/ANA.0000000000000713 PMID: 32701532
16. Treggiari M.M., Deem S. Which H. is the most important in triple-H therapy for cerebral vasospasm? Curr Opin Crit Care. 2009; 15(2): 83–86. https://doi.org/10.1097/mcc.0b013e32832922d1. PMID: 19276798
17. Sen J., Belli A., Albon H., et al. Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage. Lancet Neurol. 2003; 2(10): 614–621. https://doi.org/10.1016/s14744422(03)00531-3. PMID: 14505583
18. Solenski N.J., Haley E.C. Jr., Kassell N.F., et al. Medical complications of aneurysmal subarachnoid hemorrhage: a report of the multicenter, cooperative aneurysm study. Participants of the Multicenter Cooperative Aneurysm Study. Crit Care Med. 1995; 23(6): 1007–1017. https://doi.org/10.1097/00003246-19950600000004. PMID: 7774210
19. Festic E., Rabinstein A.A., Freeman W.D., et al. Blood transfusion is an important predictor of hospital mortality among patients with aneurysmal subarachnoid hemorrhage. Neurocrit Care. 2013; 18(2): 209–215. https://doi.org/10.1007/s12028-0129777-y PMID: 22965325
20. Bakker J., Nijsten M.W., Jansen T.C. Clinical use of lactate monitoring in critically ill patients. Ann Intensive Care. 2013; 3(1): 12. https://doi.org/10.1186/2110-5820-3-12. PMID: 23663301
21. Krishna U., Joshi S.P., Modh M. An evaluation of serial blood lactate measurement as an early predictor of shock and its outcome in patients of trauma or sepsis. Indian J Crit Care Med. 2009; 13(2): 66–73. https://doi.org/10.4103/0972-5229.56051. PMID: 19881186
22. Ahn S.H., Savarraj J.P., Pervez M., et al. The subarachnoid hemorrhage early brain edema score predicts delayed cerebral ischemia and clinical outcomes. Neurosurgery. 2018; 83(1): 137–145. https://doi.org/10.1093/neuros/nyx364. PMID: 28973675
23. Suzuki H. What is early brain injury? Transl Stroke Res. 2015; 6(1): 1–3. https://doi.org/10.1007/s12975-014-0380-8. PMID: 25502277
24. Fujii M., Yan J., Rolland W.B., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Transl Stroke Res. 2013; 4(4): 432–446. https://doi.org/10.1007/s12975-0130257-2. PMID: 23894255
25. Savarraj J., Parsha K., Hergenroeder G., et al. Early brain injury associated with systemic inflammation after subarachnoid hemorrhage. Neurocrit Care. 2018; 28(2): 203–211. https://doi.org/10.1007/s12028-017-0471-y. PMID: 29043545
26. Eibach M., Won S.Y., Bruder M., et al. Age dependency and modification of the Subarachnoid Hemorrhage Early Brain Edema Score. J Neurosurg. 2020; 134(3): 946–952. https://doi.org/10.3171/2019.12.jns192744. PMID: 32197254
Об авторах
Ю. В. КивелёвРоссия
Кивелёв Юрий Владимирович, канд. мед. наук, PhD Университета Хельсинки, врач-нейрохирург Клиники нейрохирургии,
ул. Щепкина, д. 35, г. Москва, 129090.
А. Л. Кривошапкин
Россия
Кривошапкин Алексей Леонидович, д-р мед. наук, профессор, заведующий отделением нейрохирургии; заведующий кафедрой нейрохирургии РУДН,
ул. Щепкина, д. 35, г. Москва, 129090
ул. Миклухо-Маклая, д. 6, г. Москва, 117198.
А. А. Суфианов
Россия
Суфианов Альберт Акрамович, д-р мед. наук, профессор, член-корреспондент РАН; главный врач; зав. кафедрой нейрохирургии; профессор РУДН,
ул. Миклухо-Маклая, д. 6, г. Москва, 117198;
ул. 4 км Червишевского тракта, д. 5, г. Тюмень, 625032;
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048.
Дополнительные файлы

|
1. Приложение А. Блок-схема процесса селекции признаков для последующей имплементации LSTM. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(145KB)
|
Метаданные ▾ | |

|
2. Приложение B. Диаграммы Шепли, демонстрирующие корреляции показателей и их вклад в модель по прогнозированию госпитальной летальности. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(597KB)
|
Метаданные ▾ | |
Рецензия
JATS XML








































