Перейти к:
Гиперэкспрессия белков теплового шока HSP70 у мышей с мутантным белком FUS сопровождается меньшими нейродегенеративными изменениями в структурах лимбической системы
https://doi.org/10.47093/2218-7332.2025.16.1.4-19
Аннотация
Цель. Изучить морфологические изменения в структурах лимбической системы у мышей с гиперэкспрессией белков теплового шока молекулярной массой 70 кДа (70 kDa heat shock proteins, HSP70) и экспрессией мутантного белка fused-in-sarcoma («слитый при саркоме»; FUS) с развитием бокового амиотрофического склероза.
Материалы и методы. Объектом исследования служили мыши (n = 36) линии C57Bl/6 (wild-type) и трансгенных линий, разделенные на 6 групп по 6 мышей в каждой. Три группы были FUS-отрицательные: контрольная, с вне и внутриклеточной гиперэкспрессией белка 1А семейства HSP70: HSP70out и HSP70in; три группы – FUS-положительные: FUS[1-359], FUS[1-359]/HSP70out и FUS[1-359]/HSP70in. У всех FUS положительных мышей развивалась мышечная слабость вплоть до паралича. На 20-й неделе жизни мышей выводили из эксперимента, гистологические препараты головного мозга окрашивали гематоксилином и эозином, толуидиновым синим по Нисслю или иммунофлуоресцентными антителами к нейрональному ядерному маркеру (NeuN) для препаратов каудопутамена, септальных ядер и гиппокампа, а также к глиальному фибриллярному кислому белку (GFAP), белку S100β и синаптофизину для препаратов гиппокампа; подсчитывали количество клеток. Сравнение средних значений между группами проводили при помощи однофакторного дисперсионного анализа и теста Тьюки.
Результаты. В группах с экспрессией FUS наблюдались статистически значимые различия по сравнению с FUS отрицательными группами: (1) снижение количества нейронов и NeuN+-клеток в каудопутамене и миндалевидном теле, наиболее выраженное изменение отмечено в группе FUS[1-359]/HSP70out; (2) увеличение количества гиперхромных нейронов в основании гиппокампа, зоне Аммонова рога (CA1) и зубчатой извилине, прирост был значимо больше в группах FUS[1-359] и FUS[1-359]/HSP70out по сравнению с FUS[1-359]/ HSP70in; (3) рост количества GFAP+и S100β+-клеток в гиппокампе, увеличение было значимо больше в группах FUS[1-359] и FUS[1-359]/HSP70out по сравнению с FUS[1-359]/HSP70in.
Заключение. Одновременная гиперэкспрессия белка 1А семейства HSP70 и экспрессия мутантного белка FUS в цитоплазме клеток сопровождается меньшей выраженностью нейродегенеративных изменений в структурах лимбической системы по сравнению с экспрессией только мутантного белка FUS.
Ключевые слова
Боковой амиотрофический склероз (БАС) представляет собой нейродегенеративное заболевание с преимущественным поражением моторных отделов нервной системы [1]. Заболевание характеризуется высокими показателями инвалидизации и смертности, эффективные методы его лечения отсутствуют [2]. Разработка принципов терапии БАС затруднена тем, что заболевание может возникать при мутациях в различных генах [3] и иметь разные клинические фенотипы [4]. С учетом этих различий востребованы исследования молекулярных механизмов, препятствующих ключевым патологическим изменениям в клетках при наиболее частых генетических вариантах БАС.
Один из генов, способных мутировать с последующим развитием БАС, кодирует у человека РНК-связывающий белок fused-in-sarcoma («слитый при саркоме»; FUS) с ядерной локализацией [5]. При мутации белок FUS покидает ядро клетки, а его патологическое накопление в цитоплазме нейронов лежит в основе FUS-варианта БАС и связанной с ним клеточной гибели [6]. Одним из перспективных направлений в изучении данной проблемы является поиск экспериментальных условий, при которых выраженность нейродегенеративных изменений, вызванных цитоплазматическим накоплением FUS, может уменьшаться.
Так, патологическое накопление белков в цитоплазме можно контролировать с помощью молекулярных шаперонов, особенно белков теплового шока молекулярной массой 70 кДа (70 kDa heat shock proteins, HSP70) [7]. Показано, что HSP70 могут воздействовать также на накопление мутантного белка FUS при FUS-варианте БАС [7][8].
Следует отметить, что белок 1А семейства HSP70 (HSP70 member 1A, HSPA1A) является постоянным компонентом цитозоля [9], что не препятствует развитию FUS-варианта БАС. Вероятно, количество или активность HSPA1A у пациентов с FUS-вариантом БАС низки для предотвращения патологического накопления FUS. Можно предположить, что избыточная экспрессия HSPA1A благоприятно скажется на выживаемости нейронов при БАС с цитоплазматическим накоплением FUS [7].
При БАС происходит повреждение моторных участков в коре больших полушарий головного мозга, лимбической системы, а также двигательных нейронов в спинном мозге и моторных бляшек [1][10]. При этом изменения в структурах лимбической системы изучены в наименьшей степени, хотя базальные ядра вовлечены в патогенез БАС [10]. Так, при поисковых запросах по базе данных «PubMed» на 01.12.2024 г. по тегам «FUS + amyotrophic lateral sclerosis (ALS) + brain», «FUS + ALS + spinal cord», «FUS + ALS + muscle» находится более 200 публикаций, «FUS + ALS + hippocampus» – 21 публикация, «FUS + ALS + striatum» – 2 публикации, «FUS + ALS + amygdala» – публикаций не найдено.
Цель исследования: изучить морфологические изменения в структурах лимбической системы у мышей с гиперэкспрессией HSP70 и экспрессией мутантного белка FUS с развитием БАС.
МАТЕРИАЛЫ И МЕТОДЫ
Манипуляции с животными
Исследование выполнено на 36 мышах дикого типа (wild-type, WT) и трансгенных линий массой тела 32,0 ± 2,5 г, распределенных на шесть групп (n = 6 в каждой группе). До исследования допускались особи без сопутствующих патологий. Мыши получены из вивария Сеченовского университета.
В 1-ю группу включали мышей линии C57Bl/6 (WT, контрольная группа), отбор производился методом случайных чисел. Распределение на группы со 2-й по 6-ю производили на основании генотипа животных. Ко 2-й группе отнесены трансгенные животные с человеческим геном FUS[ 1-359], экспрессирующие мутантный белок FUS с развитием FUS-варианта БАС. Использовали модель FUS-экспрессии, описанную в работе T.A. Shelkovnikova и соавт. [11]. В 3-ю группу (HSP70out) включали трансгенных мышей с внеклеточной экспрессией HSPA1A, в 4-ю группу (HSP70in) – с внутриклеточной экспрессией HSPA1A. В группы со 2-й по 4-ю с учетом данных полимеразной цепной реакции отбирали животных с гемизиготным характером наследования FUS[ 1-359] и HSPA1A. Гомозиготных животных групп со 2-й по 4-ю использовали для выведения двойных трансгенных мышей: группа 5 (FUS[ 1-359]/HSP70out) и группа 6 (FUS[ 1-359]/HSP70in).
Мышей содержали в виварии при температуре 20–22 °C и влажности воздуха 55–60% с доступом к чистой воде и гранулированному корму ad libitum. У групп с экспрессией FUS начиная с 10–12 недель жизни постепенно нарастали проявления мышечной слабости вплоть до паралича у отдельных животных. Данные симптомы в первую очередь поражали одну из задних конечностей и могли распространяться на обе, иногда проявляясь также в передних конечностях. При этом снижалась половая активность, но не снижалась пищевая. В FUS-отрицательных группах этих изменений не было.
На 20-й неделе животных выводили из эксперимента путем декапитации (рис. 1), для анестезии использовали 5 мг/кг ксилазина гидрохлорида (Interchemie, Нидерланды) и 40 мг/кг тилетамина/золазепама (Virbac, Франция).
РИС. 1. Дизайн эксперимента.
Примечание. WT – wild type (животные дикого типа).
Изготовление препаратов
Производили забор головного мозга с фиксацией в 10% нейтральном забуференном формалине (ООО «ЭргоПродакшн», Российская Федерация). Через сутки выполняли проводку через изопропиловый спирт возрастающей концентрации (ООО «Биовитрум», Российская Федерация) и заливку в парафин. На ротационном микротоме HM325 (Thermo Fisher Scientific, США) изготавливали корональные срезы толщиной 3 мкм, переносили их на предметные стекла с силановым адгезивным покрытием (ООО «Минимед», Российская Федерация) и подсушивали в термостате при температуре 37 °C.
Окрашивание препаратов
Для гистологического исследования препараты окрашивали гематоксилином и эозином или толуидиновым синим по методу Ниссля. Для иммунофлуоресцентного (ИФ) окрашивания после выдержки в демаскировочном растворе (рН 9,0, 20×, партия XF05RT4N9592, Elabscience, КНР) срезы промывали 10% PBS (ООО «Эко-Сервис», Российская Федерация), добавляли бычий сывороточный альбумин (партия RM-T1725/1000, Biosera, Франция) на 30 минут и использовали первичные антитела в соответствии с рекомендациями производителя.
Для выявления нейронов использовали моноклональные антитела к нейрональному ядерному маркеру (neuronal nuclear marker, NeuN, 1:1000, клон SR45-07, артикул ET1602-12, партия H661803001, Huabio, КНР). Для обнаружения активированных астроцитов применяли моноклональные антитела к глиальному фибриллярному кислому белку (glial fibrillary acidic protein, GFAP, 1:500, клон SA03-04, артикул ET1601-23, партия HO0913, Huabio, КНР), и к белку S100β (1:1000, клон SC57-02, артикул ET-1610-3, партия H661380007, Huabio, КНР). Для выявления уровня синаптических контактов использовали поликлональные антитела к белку синаптофизину (synaptophysin; SYP, 1:200, артикул O407-2, партия HG0614, Huabio, КНР). После окрашивания первичными антителами образцы трижды промывали и наносили поликлональные вторичные антитела (Anti-Rabbit-TRITC, 1:100, артикул E-AB-1053, партия 22038, Elabscience, КНР) и окрашивали DAPI (артикул E-IR-R103, Elabscience, КНР). Образцы промывали PBS и заключали в монтирующую среду.
Морфометрическое исследование
На полученных срезах определяли структуры лимбической системы грызунов (по 6 полей зрения от каждого животного). Согласно стереотаксическому атласу [12] выделяли: каудопутамен (caudoputamen, CP); каудальную часть латерального септального ядра (lateral septal nucleus, caudal or caudodorsal part; LSc); образования в гиппокампе, включая дорсальную часть основания гиппокампа, или субикулума (subiculum, dorsal part; SUBd), области собственно гиппокампа, или Аммонова рога (cornu Ammonis; CA1 и CA3), и зубчатую извилину (dentate gyrus; DG); ядра миндалевидного тела, а именно латеральное ядро (lateral amygdalar nucleus; LA), вентральную часть базолатерального ядра (basolateral amygdalar nucleus, ventral part; BLAv), переднюю и заднюю части базолатерального ядра (basolateral amygdalar nucleus, anterior and posterior parts; BLAa/BLAp) и латеральную часть центрального ядра (central amygdalar nucleus, lateral part; CeL). Фотографирование выполняли с помощью программно-аппаратного комплекса Axio Imager.A1 с увеличением объектива ×40 и ×100, включающего цветную камеру Axiocam 305 и программное обеспечение Zen 3.10 (Zeiss, Германия).
Подсчитывали количество нейронов в поле зрения для структур CP, LSc и миндалевидного тела. Для образований гиппокампа и LSc подсчитывали количество гиперхромных нейронов, а в CP учитывали количество нейронов с эозинофильной цитоплазмой. Для окрашивания антителами выполняли микрофотографии структур гиппокампа, CP и LSc при длине волны от 540 до 620 нм. Подсчитывали общее количество NeuN-положительных клеток в поле зрения в зонах CP и LSc и соотношение NeuN+-клеток к клеткам, окрашенным DAPI, в структурах гиппокампа.
Нейродегенеративными изменениями считали сокращение общего количества нейронов в поле зрения, появление гиперхромных нейронов или нейронов с эозинофильной цитоплазмой, а также сокращение количества NeuN-положительных клеток или значения соотношения NeuN/DAPI относительно группы контроля. В гиппокампе и зоне LSc также оценивали долю клеток с положительной реакцией к GFAP в поле зрения, выраженную в процентах, и количество S100β-положительных клеток в поле зрения. Увеличение экспрессии GFAP и S100β расценивали как активацию астроцитов, а вместе с нейродегенеративными изменениями – как показатель нейровоспаления. Для гиппокампа и зоны CP рассчитывали уровень экспрессии SYP, выраженный как соотношение между площадью экспрессии SYP к площади поля зрения в процентах. Площадь экспрессии SYP в поле зрения оценивалась при помощи программного обеспечения с машинным обучением и открытым кодом QuPath 0.5.0 [13].
Статистическая обработка
Данные ИФ исследования оценивали на нормальность распределения с помощью критерия Шапиро – Уилка. Средние значения выборок сравнивали при помощи однофакторного дисперсионного анализа (ANOVA) с использованием апостериорного критерия Тьюки. Различия при значении p менее 0,05 учитывали как статистически значимые, при этом размер выборки достаточен с учетом мощности 80% и соответствует принципам 3R. Статистические подсчеты выполнены с помощью программного обеспечения OriginPro (OriginLab, США).
РЕЗУЛЬТАТЫ
Гистологическое исследование
Микрофотографии и графики количества клеток для срезов головного мозга в зонах CP и LSc показаны на рисунке 2. В зоне CP общее количество нейронов снижалось во всех группах с экспрессией мутантного FUS по сравнению с группами WT, HSP70in и HSP70out (рис. 2E). При этом в группе FUS[ 1-359]/HSP70out количество нейронов было меньше, чем у животных групп FUS[ 1-359] и FUS[ 1-359]/HSP70in.
Нейроны с эозинофильной цитоплазмой при
гистологическом исследовании обнаружены только в зоне CP (рис. 2F). Их количество статистически значимо возрастало во всех группах с экспрессией FUS, достигая максимальных значений в группе FUS[ 1-359]/HSP70out. В группах FUS[ 1-359] и FUS[ 1-359]/HSP70in количество нейронов с эозинофильной цитоплазмой снижалось, но оставалось выше, чем в группах без FUS.
В отличие от зоны CP в зоне LSc количество нейронов снижалось не во всех группах с экспрессией FUS по сравнению с группой WT (рис. 2G). Уменьшение количества нейронов было характерно только для группы FUS[ 1-359]/HSP70out. При этом количество гиперхромных нейронов в зоне LSc (рис. 2H) было больше во всех группах с экспрессией FUS по сравнению с группой WT. Наименьшее количество гиперхромных нейронов было в группе FUS[ 1-359]/HSP70in, по сравнению с группами FUS[ 1-359] и FUS[ 1-359]/HSP70out.
Микрофотографии и графики количества клеток для срезов головного мозга в области гиппокампа приведены на рисунке 3. В зонах SUBd (рис. 3G), CA1 (рис. 3H) и DG (рис. 3J) количество гиперхромных нейронов повышалось во всех группах с экспрессией FUS по сравнению с группами WT, HSP70in и HSP70out. При этом в группе FUS[ 1-359]/HSP70in количество гиперхромных нейронов было ниже, чем в группах FUS[ 1-359] и FUS[ 1-359]/HSP70out. На срезах в зоне CA3 статистически значимых различий в количестве гиперхромных нейронов между группами обнаружено не было (рис. 3I).
Микрофотографии и графики количества клеток в поле зрения для срезов головного мозга в области миндалевидного тела представлены на рисунке 4. В зонах BLAv (рис. 4H), BLAa/BLAp (рис. 4I) и CeL (рис. 4J) общее количество нейронов снижалось в группах FUS[ 1-359] и FUS[ 1-359]/HSP70out по сравнению с группами WT, HSP70in и HSP70out. При этом в группе FUS[ 1-359]/HSP70in снижение количества нейронов относительно группы WT было зафиксировано только в зоне CeL. В зоне LA (рис. 4G) характер изменений при графическом анализе был аналогичен изменениям в других зонах миндалевидного тела, однако статистически значимо было только небольшое снижение количества нейронов в группе FUS[ 1-359] по сравнению с группой WT.
Иммунофлуоресцентное исследование
Результаты ИФ исследования зон CP и LSc приведены на рисунке 5. В обеих зонах отмечено снижение количества NeuN+-клеток в группах FUS[ 1-359] и FUS[ 1-359]/HSP70out. Уровень NeuN+-клеток в группе FUS[ 1-359]/HSP70in был выше, чем в других группах с экспрессией FUS, при этом в зоне CP – сопоставим с группой WT, а в зоне LSc – значимо ниже, чем в группе WT (рис. 5C, 5D).
На рисунке 6 представлены результаты ИФ исследования для структур гиппокампа. В зонах DG и CA1 доля GFAP+ и количество S100β+-клеток статистически значимо повышались в группах FUS[ 1-359], FUS[ 1-359]/HSP70out и менее выраженно в группе FUS[ 1-359]/HSP70in по сравнению c группой WT (рис. 6H, I, K, L). Небольшие различия в экспрессии SYP показаны только между группами с экспрессией FUS (рис. 6M).
В зоне CA1 отмечено резкое снижение соотношения NeuN+/DAPI+ (рис. 6J) в группах FUS[ 1-359] и FUS[ 1-359]/HSP70out. Напротив, в группе FUS[ 1-359]/HSP70in это соотношение было не только выше, чем в других группах с экспрессией FUS, но статистически значимо не отличалось от группы WT.
На рисунке 7 показаны результаты ИФ исследования в зоне LA. Во всех группах с экспрессией FUS (FUS[ 1-359], FUS[ 1-359]/HSP70out и FUS[ 1-359]/HSP70in) количество NeuN+-клеток было меньше по сравнению с группой WT и группами с моноэкспрессией HSP70. В то же время среди групп с мутантным FUS экспрессия NeuN была выше в группе FUS[ 1-359]/HSP70in, ниже – в группе FUS[ 1-359]/HSP70out.
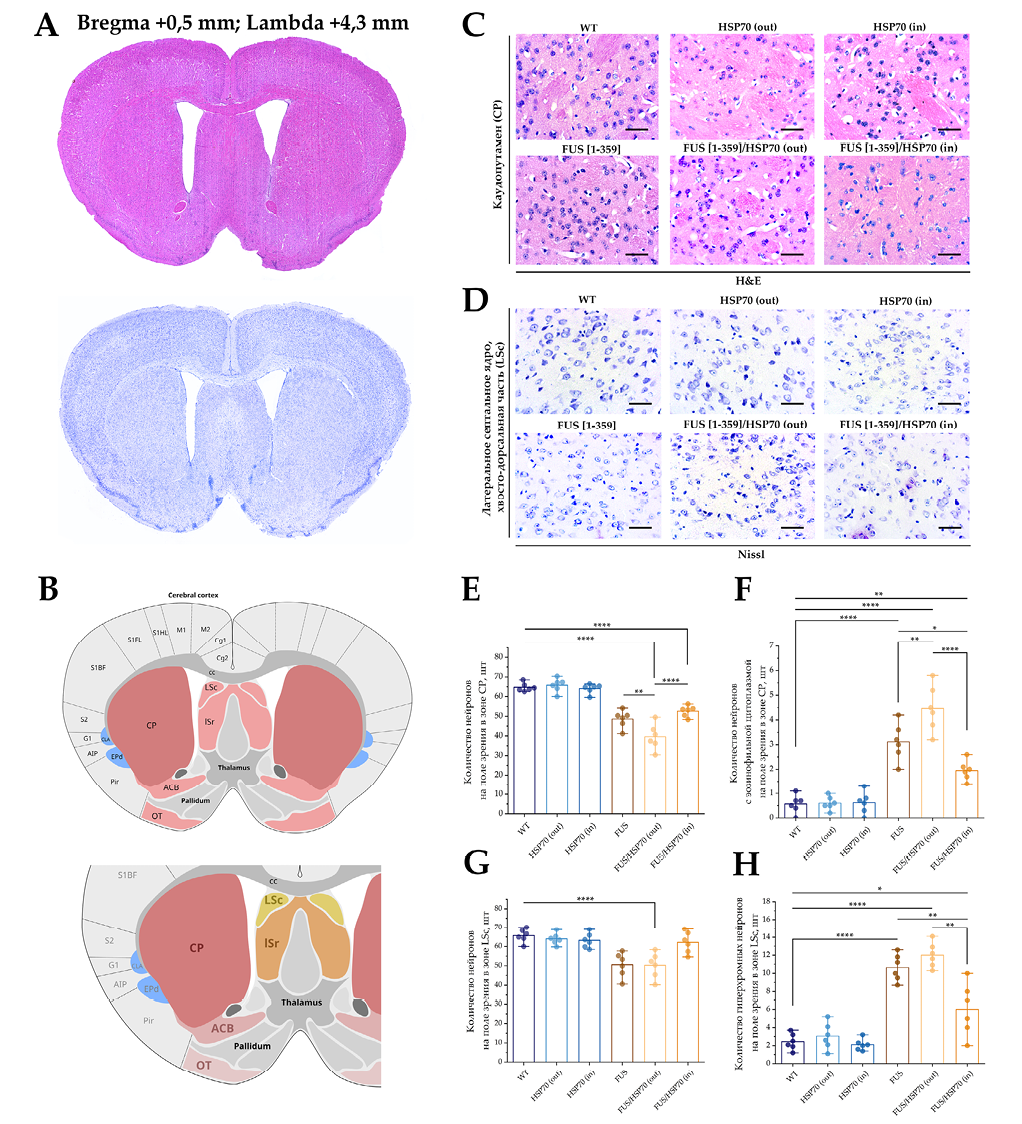
РИС. 2. Гистологическое исследование каудопутамена и каудальной части латерального септального ядра у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: * p < 0,05; ** p < 0,01; **** p < 0,0001; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; CP – каудопутамен; LSc – каудальная часть латерального септального ядра.
- Корональные срезы головного мозга, окрашенные гематоксилином и эозином (вверху) и толуидиновым синим по Нисслю (внизу).
- Стереотаксическое строение коронального среза с локализацией зон CP и LSc.
- Препараты головного мозга мышей, зона CP, гематоксилин и эозин, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга мышей, зона LSc, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Количество нейронов в поле зрения в зоне CP при окрашивании гематоксилином и эозином.
- Количество нейронов с эозинофильной цитоплазмой в зоне CP при окрашивании гематоксилином и эозином.
- Количество нейронов в поле зрения в зоне LSc при окрашивании толуидиновым синим.
- Количество гиперхромных нейронов в зоне LSc при окрашивании толуидиновым синим.
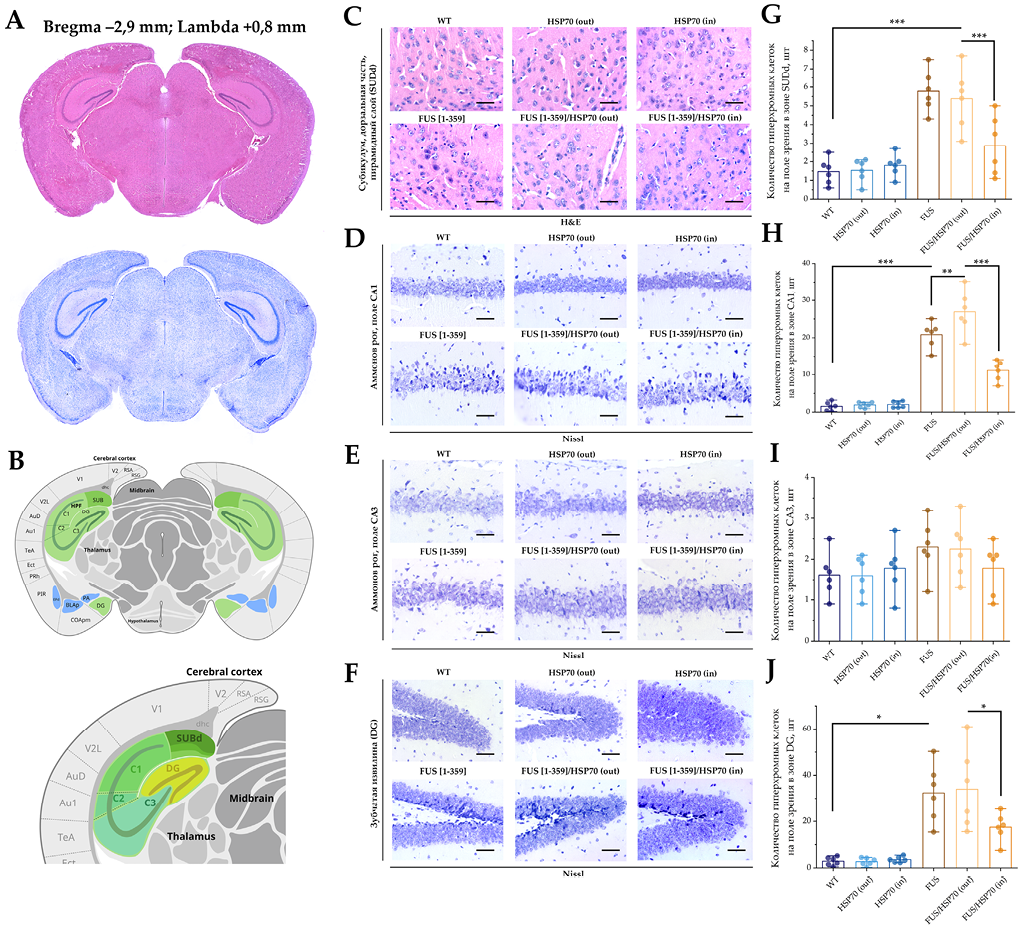
РИС. 3. Гистологическое исследование гиппокампа у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: * p < 0,05; ** p < 0,01; *** p < 0,001; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; SUBd – дорсальная часть основания гиппокампа; CA – Аммонов рог; DG – зубчатая извилина.
- Корональные срезы головного мозга, окрашенные гематоксилином и эозином (вверху) и толуидиновым синим по Нисслю (внизу).
- Стереотаксическое строение коронального среза с локализацией зон гиппокампа: SUBd, CA1 и CA3, DG.
- Препараты головного мозга мышей, зона SUBd, гематоксилин и эозин, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга мышей, зона CA1, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга мышей, зона CA3, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга мышей, зона DG, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Количество гиперхромных нейронов в зоне SUBd при окрашивании гематоксилином и эозином.
- Количество гиперхромных нейронов в зоне CA1 при окрашивании толуидиновым синим.
- Количество гиперхромных нейронов в зоне CA3 при окрашивании толуидиновым синим.
- Количество гиперхромных нейронов в зоне DG при окрашивании толуидиновым синим.
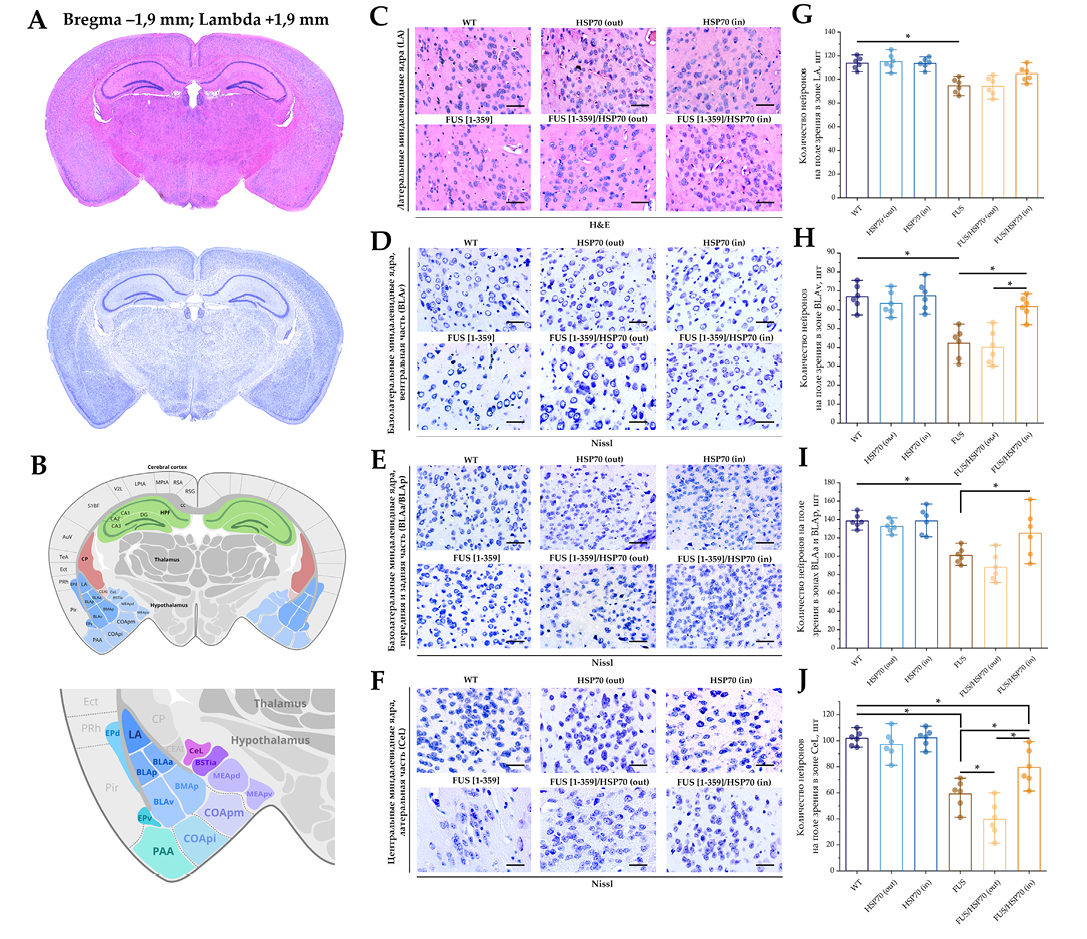
РИС. 4. Гистологическое исследование миндалевидного тела у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: * p < 0,05; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; LA – латеральное ядро миндалевидного тела; BLAv – вентральная часть базолатерального ядра миндалевидного тела; BLAa/BLAp – передняя и задняя части базолатерального ядра миндалевидного тела; CeL – латеральная часть центрального ядра миндалевидного тела.
- Корональные срезы головного мозга, окрашенные гематоксилином и эозином (вверху) и толуидиновым синим по Нисслю (внизу).
- Стереотаксическое строение коронального среза с локализацией ядер миндалевидного тела: LA, BLAv, BLAa/BLAp и CeL.
- Препараты головного мозга, зона LA, гематоксилин и эозин, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга, зона BLAv, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга, зона BLAa/BLAp, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Препараты головного мозга, зона CeL, толуидиновый синий, об. ×40. Размер шкалы: 20 мкм.
- Количество нейронов в поле зрения в зоне LA при окрашивании гематоксилином и эозином.
- Количество нейронов в поле зрения в зоне BLAv при окрашивании толуидиновым синим.
- Количество нейронов в поле зрения в зоне BLAa/BLAp при окрашивании толуидиновым синим.
- Количество нейронов в поле зрения в зоне CeL при окрашивании толуидиновым синим.
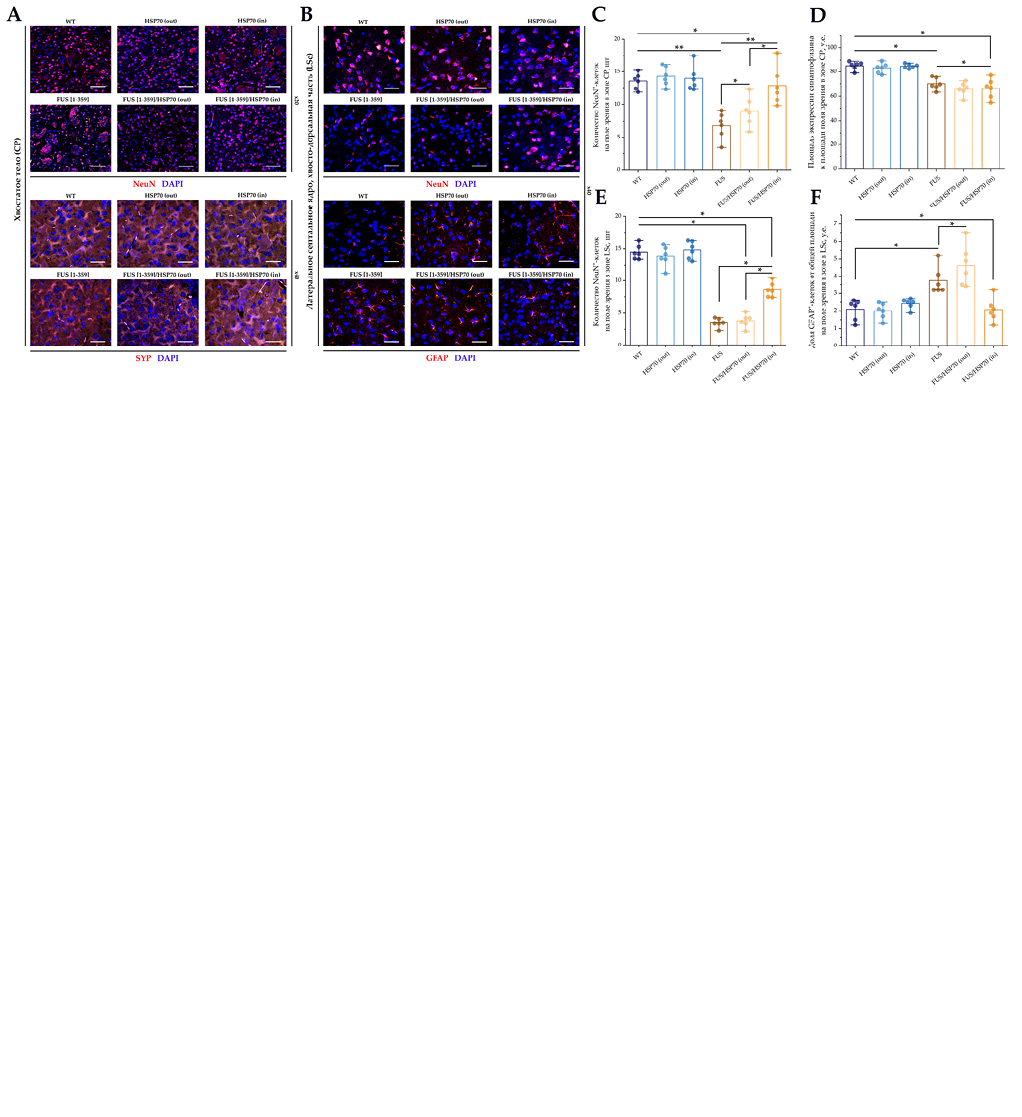
РИС. 5. Иммунофлуоресцентное исследование каудопутамена и септальных ядер у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: * p < 0,05; ** p < 0,01; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; CP – каудопутамен; LSc – каудальная часть латерального септального ядра; GFAP – глиальный фибриллярный кислый белок; NeuN – нейрональный ядерный маркер; SYP – синаптофизин.
- Препараты головного мозга, зона CP, об. ×100. Размер шкалы: 50 мкм. Anti-NeuN и DAPI (вверху), Anti-SYP и DAPI (внизу).
- Препараты головного мозга, зона LSc, об. ×100. Размер шкалы: 50 мкм. Anti-NeuN и DAPI (вверху), Anti-GFAP и DAPI (внизу)
- Количество NeuN+-клеток в поле зрения, зона CP.
- Площадь экспрессии синаптофизина к площади поля зрения, зона CP.
- Количество NeuN+-клеток в поле зрения, зона LSc.
- Доля GFAP+-клеток от общей площади на поле зрения, зона LSc.
FIG. 5. Immunofluorescent study of caudoputamen and septal nuclei in mice with FUS type of amyotrophic lateral sclerosis and overexpression of HSP70.
Note: * p <0.05; ** p <0.01; HSP70 – 70 kDa heat shock proteins; FUS – fused in sarcoma protein; WT – wild type, control group; CP – caudoputamen; LSc – caudal part of the lateral septal nucleus; GFAP – glial fibrillary acidic protein; NeuN – neuronal nuclear marker; SYP – synaptophysin.
- Brain sections, CP, ob. ×100. Scale bar: 50 μm. Anti-NeuN and DAPI (above), Anti-SYP and DAPI (below).
- Brain sections, LSc, ob. ×100. Scale bar: 50 μm. Anti-NeuN and DAPI (above), Anti-GFAP and DAPI (below).
- The number of NeuN+cells per field of view, CP.
- Area of SYP expression per field of view, CP.
- The number of NeuN+cells per field of view, LSc.
- Ratio of GFAP+-cells per field of view, LSc.
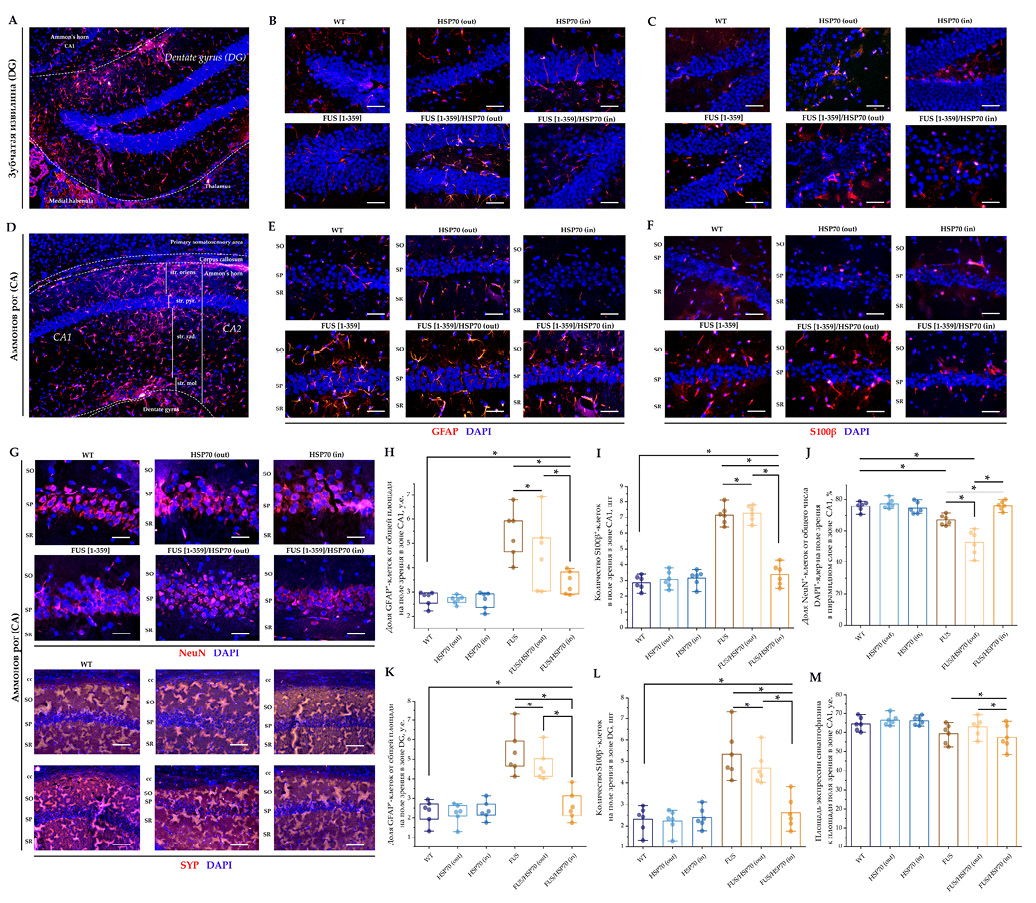
РИС. 6. Иммунофлуоресцентное исследование структур гиппокампа у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: * p < 0,05; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; DG – зубчатая извилина; CA – Аммонов рог; GFAP – глиальный фибриллярный кислый белок; NeuN – нейрональный ядерный маркер; SYP – синаптофизин.
- Препарат головного мозга, зона DG, об. ×40. Размер шкалы: 20 мкм. Anti-GFAP и DAPI.
- Препараты головного мозга, зона DG, об. ×100. Размер шкалы: 50 мкм. Anti-GFAP и DAPI.
- Препараты головного мозга, зона DG, об. ×100. Размер шкалы: 50 мкм. Anti-S100β и DAPI.
- Препарат головного мозга, зона CA1, об. ×40. Размер шкалы: 20 мкм. Anti-GFAP и DAPI.
- Препараты головного мозга, зона CA1, об. ×100. Размер шкалы: 50 мкм. Anti-GFAP и DAPI.
- Препараты головного мозга, зона CA1, об. ×100. Размер шкалы: 50 мкм. Anti-S100β и DAPI.
- Препараты головного мозга, зона CA1, об. ×100. Размер шкалы: 50 мкм. Anti-NeuN и DAPI (вверху), Anti-SYP и DAPI (внизу).
- Доля GFAP+-клеток в поле зрения, %, зона CA1.
- Количество S100β+-клеток в поле зрения, зона CA1.
- Соотношение NeuN+/DAPI+-клеток в поле зрения, %, зона CA1.
- Доля GFAP+-клеток в поле зрения, %, зона DG.
- Количество S100β+-клеток в поле зрения, зона DG.
- Площадь экспрессии SYPк площади поля зрения, %, зона CA1.
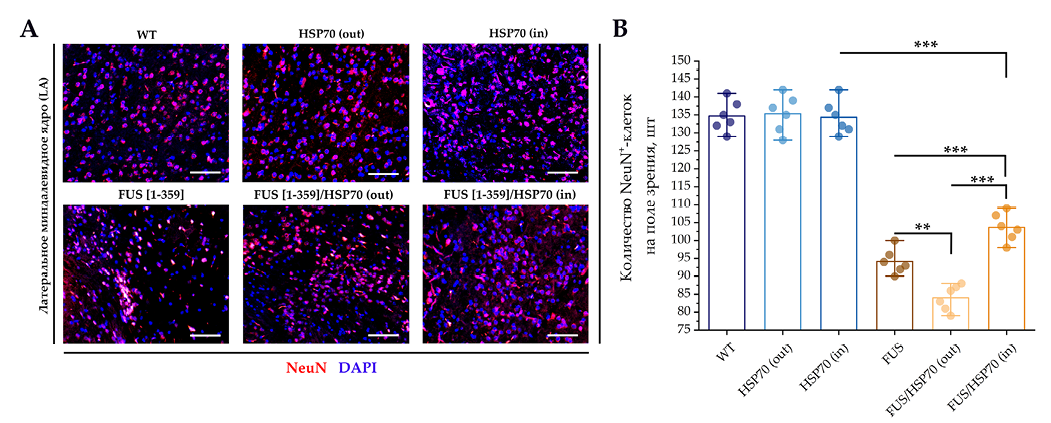
РИС. 7. Иммунофлуоресцентное исследование миндалевидного тела у мышей с FUS-вариантом бокового амиотрофического склероза и гиперэкспрессией HSP70.
Примечание: ** p < 0,01; *** p < 0,001; HSP70 – белки теплового шока молекулярной массой 70 кДа; FUS – белок, «слитый при саркоме»; WT – wild type, группа контроля; LA – латеральное ядро миндалевидного тела; NeuN – нейрональный ядерный маркер.
- Препараты головного мозга, зона LA, об. ×100. Размер шкалы: 50 мкм. Anti-NeuN и DAPI.
- Количество NeuN+-клеток в поле зрения, зона LA.
ОБСУЖДЕНИЕ
Ключевым компонентом настоящей работы был адекватный подбор линии трансгенных животных с экспрессией HSP70 и FUS. Линия с моделью БАС выбрана по следующим критериям: 1) эффективность в развитии патологических и клинических проявлений FUS-варианта БАС хорошо изучена с доказанной экспрессией FUS; 2) есть выраженные нейродегенеративные проявления; 3) мыши доживают до возраста, при котором их можно скрещивать с грызунами других линий для выведения двойных трансгенных животных [6][11]. Линии с экспрессией HSPA1A выбраны, поскольку именно этот вариант HSP70 способен взаимодействовать с белком FUS при его цитоплазматической локализации [14].
Исследование выявило нейродегенеративные изменения при экспрессии мутантного FUS: сокращение количества нейронов, увеличение числа гиперхромных нейронов, снижение экспрессии NeuN и NeuN+/DAPI+, а также то, что сочетанная экспрессия внутриклеточного HSPA1A и мутантного FUS у мышей связана с меньшими уровнями нейродегенерации. При изначальном описании данной модели БАС отмечено нейродегенеративное поражение структур ствола мозга без уточнения характера изменений, свойственных лимбической системе [11].
В настоящей работе продемонстрировано сокращение количества нейронов в зоне CP у всех животных с экспрессией FUS. По сведениям литературы, структуры СР подвержены нейродегенеративным изменениям у людей с FUS-ассоциированным БАС [15]. Также ранее было показано увеличение электрической активности в зоне CP у мышей с экспрессией FUS [16]. Отметим, что в проведенном исследовании у животных с внеклеточной экспрессией HSPA1A (группа FUS[ 1-359]/HSP70out) выживаемость нейронов в CP ниже, чем у монотрансгенных животных с экспрессией FUS (группа FUS[ 1-359]), а у животных с внутриклеточной экспрессией (группа FUS[ 1-359]/HSP70in) – выше. Такие же данные были получены для количества клеток с положительной реакцией к NeuN – маркеру зрелых нейронов. Поскольку введение HSPA1A не приводит к нейродегенеративным изменениям в центральной нервной системе [9], можно предполагать, что экспрессия HSPA1A внеклеточно усугубляет характер патологических изменений при FUS-варианте БАС. Вместе с тем совместная экспрессия HSPA1A и FUS в цитоплазме нейронов СР положительно влияет на их сохранность.
В зоне CP также обнаружены нейроны с эозинофильными включениями в цитоплазме, причем их количество увеличивалось в группах с экспрессией FUS, особенно FUS[ 1-359]/HSP70out. Подобные включения по типу «вишневого пятна» ранее обнаруживали в ядрах нейронов гиппокампа при FUS-варианте лобно-височной деменции [17]. A. Murakami и соавторы сообщали также об обнаружении FUS-положительных включений в стриатуме на аутопсийном материале [18]. Данная находка, возможно, представляет собой еще одно свидетельство FUS-ассоциированных нейродегенеративных изменений. Однако накопленного экспериментального материала для сравнения недостаточно, чтобы полагать эозинофильные включения специфическим маркером.
Для структур лимбической системы (септальные ядра, гиппокамп) с большой концентрацией нейронов на единицу площади и, следовательно, с большей вероятностью искажений при сравнении для исследования учитывали не общее количество нейронов, а количество гиперхромных клеток. Этот параметр распространен для оценки нейродегенеративных изменений [19]. При исследовании зоны LSc количество гиперхромных нейронов, а также клеток, экспрессирующих NeuN, увеличивалось во всех группах с экспрессией FUS. Эти данные соответствуют общей динамике изменений в зоне CP, а именно, более выраженный уровень нейродегенеративных изменений в группах FUS[ 1-359] и FUS[ 1-359]/HSP70out по сравнению с группой FUS[ 1-359]/HSP70in. К настоящему времени работ, демонстрирующих изменения количества нейронов или гиперхромных нейронов в септальных ядрах у животных с экспрессией FUS или у людей, опубликовано не было.
В областях гиппокампа SUBd, CA1 и DG сохранена описанная выше для зон CP и LSc динамика изменений между группами. Количество гиперхромных нейронов увеличивалось при экспрессии FUS, но у мышей с одновременной внутриклеточной гиперэкспрессией HSPA1A (группа FUS[ 1-359]/HSP70in) было ниже, чем у других мышей с экспрессией FUS. Эти изменения сочетались со снижением экспрессии NeuN в группах с мутантным FUS, наименее выраженным в группе FUS[ 1-359]/HSP70in. Следует подчеркнуть, что в гиппокампе также наблюдался рост количества GFAP+- и S100β+-клеток, и для этих показателей различия по группам полностью совпадали с различиями для увеличения количества гиперхромных нейронов. Поскольку GFAP и S100β являются маркерами активированных астроцитов, их увеличение, возможно, отражает участие астроглии в реакцию на накопление FUS.
Гиппокамп в силу реализации когнитивных функций представляет отдельный интерес при БАС. Его чувствительность к изменениям в активности FUS показана в исследовании Kino и соавторов [20]. При экспрессии мутантного FUS у мышей снижались когнитивные функции и образование шипиков в гиппокампе, хотя в нем не было цитоплазматической локализации FUS [21]. Также продемонстрировано снижение уровней шипиков в гиппокампе и когнитивных функций у трансгенных мышей с экспрессией FUS и развитием БАС [22]. Тем не менее в нашем исследовании не обнаружено различий по площади ткани гиппокампа с положительной реакцией к SYP. Возможно, синаптическая передача вовлечена в FUS-патологию при БАС в меньшей степени, чем уровни шипиков.
Повышение экспрессии FUS, нейродегенеративные изменения и последующее восстановление количества нейронов в исследовании, в котором изучали ишемическое воздействие на гиппокамп, в некоторых случаях сопровождались кратковременным увеличением экспрессии HSP70 [23]. Можно предположить, что HSP70 в гиппокампе позволяет уменьшить негативные эффекты накопления FUS (рис. 8).
В миндалевидном теле в зоне большинства ядер, кроме латерального, количество нейронов уменьшалось во всех FUS-экспрессирующих группах, но в группе FUS[ 1-359]/HSP70in было минимальным. Это соответствует динамике для других изученных структур. В литературе мало сведений о поражении миндалевидного тела при БАС, но сообщалось об отсутствии экспрессии FUS в миндалевидном теле при FUS-варианте БАС [24].
Кроме того, ранее нами рассмотрены изменения в первичной моторной коре и спинном мозге на тех же моделях [25]. Во всех случаях продемонстрировано уменьшение нейродегенеративных изменений при одновременной гиперэкспрессии цитозольной формы HSPA1A и мутантного белка FUS с цитоплазматической локализацией.
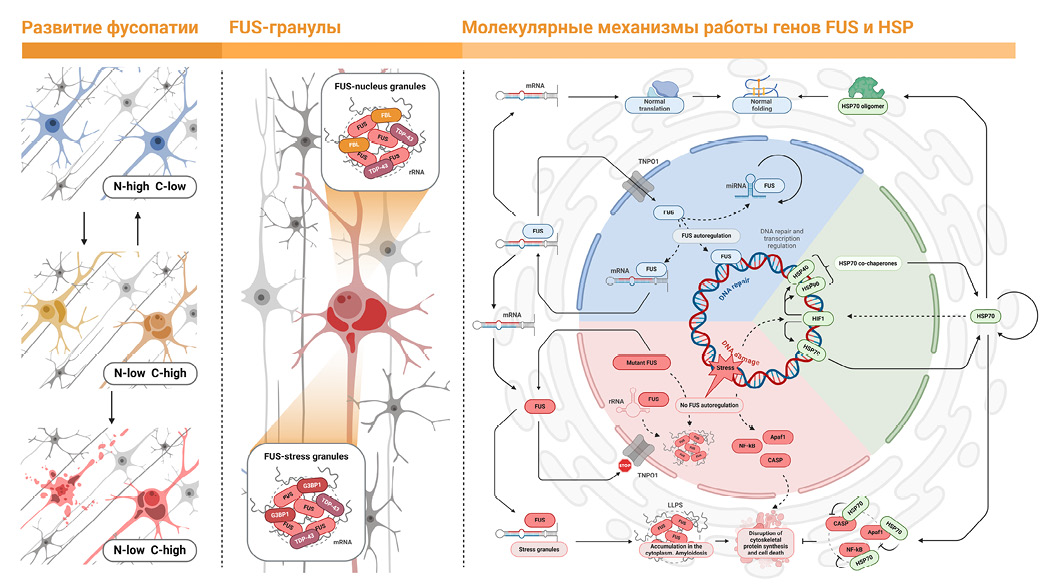
РИС. 8. Механизмы взаимодействия FUS и HSP70 в нейроне.
Слева: локализация белка fused-in-sarcoma (FUS) в ядрах (голубой). Потеря маркера ядерной локализации приводит к миграции FUS в цитоплазму (желтый). «N» – ядро, «С» – цитоплазма; «high» – много, «low» – мало. По центру: в ядрах FUS вместе с фибрилларином (FBL) и белком TDP-43 связывает рРНК (rRNA) с образованием ядерных гранул (nucleus granules). В цитоплазме находятся стрессовые гранулы (stress granules) с мРНК (mRNA) с маркером G3BP1. FUS в цитоплазме соединяется с ними. Справа: активность FUS (синий сектор) поддерживает репарацию ДНК и регуляцию транскрипции (DNA repair and transcription regulation) с саморегуляцией активности FUS (FUS autoregulation). FUS, оказавшийся вне ядра, возвращается через ядерную пору при помощи белка TNPO1, а шапероны HSP70 обеспечивают нормальные трансляцию (normal translation) и фолдинг (normal folding). Активность HSP70 (зеленый сектор) требует взаимодействия с HSP40 и HSP90. Повреждения приводят к индукции синтеза HSP70, например посредством фактора 1, индуцируемого гипоксией (hypoxia-inducible factor 1, HIF1). Стрессовое повреждение ДНК (stress, DNA damage) может приводить к мутации в гене FUS. При этом мутантный FUS теряет метку ядерной локализации. Накопление FUS в цитоплазме и его агрегация нарушает механизмы разделения жидких фаз (liquid-liquid phase separation, LLPS), вызывая амилоидоз (accumulation in the cytoplasm, amyloidosis), и вместе с активацией апоптоза (CASP; Apaf1; NF-κB) приводит к нарушению репарации цитоскелета и гибели клетки (disruption of cytoskeletal protein synthesis and cell death).
Ограничения исследования
Экстраполяция экспериментов с животными на человека ограничена. Настоящее исследование рассматривает не все зоны центральной нервной системы. Например, разнообразие зон коры у человека заведомо больше, поскольку у мышей нет извилин; мыши не имеют речевых центров.
Направления для дальнейших исследований
Целесообразно установить молекулярные механизмы, способствующие положительному влиянию гиперэкспрессии HSP70 на замедление нейродегенеративных проявлений при FUS-варианте БАС. Регистрация электрических изменений в структурах лимбической системы позволит в дальнейшем полнее описать полученные модели двойных трансгенных мышей.
ЗАКЛЮЧЕНИЕ
В настоящей работе изучены количественные показатели нейродегенеративных изменений в структурах лимбической системы у мышей с гиперэкспрессией белков теплового шока семейства HSP70 в форме HSPA1A и экспрессией мутантного человеческого белка FUS с транслокацией [ 1-359], свойственной для БАС. По данным исследования, одновременное присутствие белка HSPA1A вместе с мутантным белком FUS[ 1-359] в цитоплазме клеток нервной ткани в структурах лимбической системы сопровождается меньшими нейродегенеративными изменениями, чем при изолированной экспрессии мутантного FUS. При этом в наибольшей степени патологические изменения снижаются при сочетанной экспрессии FUS и внутриклеточной гиперэкспрессии HSPA1A в цитозольной форме. Выполненная работа демонстрирует, что гиперэкспрессия HSPA1A является потенциальным способом замедлить развитие FUS-варианта БАС.
1 Карточка проекта фундаментальных и поисковых научных исследований, поддержанного Российским научным фондом. Изучение нейроиммунологических эффектов экстра- и внутриклеточного HSP70 при нейродегенеративном повреждении мозга у мышей.
https://rscf.ru/project/23-25-00448/ (дата обращения: 01.12.2024).
2 Project card of fundamental and exploratory scientific research supported by the Russian Science Foundation. Study of neuroimmunological effects of extracellular and intracellular HSP70 in neurodegenerative brain damage in mice https://rscf.ru/project/23-25-00448/ (accessed: December 1, 2024).
Список литературы
1. Feldman E.L., Goutman S.A., Petri S., et al. Amyotrophic lateral sclerosis. Lancet. 2022 Oct 15; 400(10360): 1363–1380. https://doi.org/10.1016/S0140-6736(22)01272-7. Epub 2022 Sep 15. PMID: 36116464
2. Shoesmith C. Palliative care principles in ALS. Handb Clin Neurol. 2023; 191: 139–155. https://doi.org/10.1016/B978-0-12-824535-4.00007-0. PMID: 36599506
3. Yun Y., Ha Y. CRISPR/Cas9-Mediated Gene Correction to Understand ALS. Int J Mol Sci. 2020 May 27; 21(11): 3801. https://doi.org/10.3390/ijms21113801. PMID: 32471232
4. Grad L.I., Rouleau G.A., Ravits J., et al. Clinical Spectrum of Amyotrophic Lateral Sclerosis (ALS). Cold Spring Harb Perspect Med. 2017 Aug 1; 7(8): a024117. https://doi.org/10.1101/cshperspect.a024117. PMID: 28003278
5. Kwiatkowski T.J. Jr, Bosco D.A., Leclerc A.L., et al. Mutations in the FUS/TLS gene on chromosome 16 cause familial amyotrophic lateral sclerosis. Science. 2009 Feb 27; 323(5918): 1205–1208. https://doi.org/10.1126/science.1166066. PMID: 19251627
6. Nolan M., Talbot K., Ansorge O. Pathogenesis of FUS-associated ALS and FTD: insights from rodent models. Acta Neuropathol Commun. 2016 Sep 6; 4(1): 99. https://doi.org/10.1186/s40478-016-0358-8. PMID: 27600654
7. Venediktov A.A., Bushueva O.Y., Kudryavtseva V.A., et al. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front Mol Neurosci. 2023 Sep 19; 16: 1230436. https://doi.org/10.3389/fnmol.2023.1230436. PMID: 37795273
8. Li Y., Gu J., Wang C., et al. Hsp70 exhibits a liquid-liquid phase separation ability and chaperones condensed FUS against amyloid aggregation. iScience. 2022 May 5; 25(6): 104356. https://doi.org/10.1016/j.isci.2022.104356. PMID: 35620440
9. Пьявченко Г.А., Венедиктов А.А., Кузьмин Е.А. и др. Морфофункциональные изменения у мышей после однократного введения высоких и низких доз Hsp70. Сеченовский вестник. 2023; 14(4): 31–41. https://doi.org/10.47093/22187332.2023.918.13. EDN: WALXAM
10. Bede P., Iyer P.M., Schuster C., et al. The selective anatomical vulnerability of ALS: ‘disease-defining’ and ‘disease-defying’ brain regions. Amyotroph Lateral Scler Frontotemporal Degener. 2016 Oct-Nov; 17(7–8): 561–570. https://doi.org/10.3109/21678421.2016.1173702. PMID: 27087114
11. Shelkovnikova T.A., Peters O.M., Deykin A.V., et al. Fused in sarcoma (FUS) protein lacking nuclear localization signal (NLS) and major RNA binding motifs triggers proteinopathy and severe motor phenotype in transgenic mice. J Biol Chem. 2013 Aug 30; 288(35): 25266–25274. https://doi.org/10.1074/jbc.M113.492017. Epub 2013 Jul 18. PMID: 23867462
12. Paxinos G., Franklin K.B.J. The Mouse Brain in Stereotaxic Coordinates. 5th Edition. Academic Press. 2019. 376 p. eBook ISBN: 9780128161586
13. Bankhead P., Loughrey M.B., Fernández J.A, et al. QuPath: Opensource software for digital pathology image analysis. Sci Rep. 2017 Dec 4; 7(1): 16878. https://doi.org/10.1038/s41598-017-17204-5. PMID: 29203879
14. Gurskiy Y.G., Garbuz D.G., Soshnikova N.V., et al. The development of modified human Hsp70 (HSPA1A) and its production in the milk of transgenic mice. Cell Stress Chaperones. 2016 Nov; 21(6): 1055–1064. https://doi.org/10.1007/s12192-016-0729-x. PMID: 27511022
15. Mochizuki Y., Isozaki E., Takao M., et al. Familial ALS with FUS P525L mutation: two Japanese sisters with multiple systems involvement. J Neurol Sci. 2012 Dec 15; 323(1–2): 85–92. https://doi.org/10.1016/j.jns.2012.08.016. PMID: 22980027
16. Vorobyov V., Deev A., Sengpiel F., et al. Cortical and Striatal Electroencephalograms and Apomorphine Effects in the FUS Mouse Model of Amyotrophic Lateral Sclerosis. J Alzheimers Dis. 2021; 81(4): 1429–1443. https://doi.org/10.3233/JAD-201472. PMID: 33935079
17. Koga S., Murakami A., Soto-Beasley A.I., et al. Publisher Correction to: Diffuse argyrophilic grain disease with TDP43 proteinopathy and neuronal intermediate filament inclusion disease: FTLD with mixed tau, TDP-43 and FUS pathologies. Acta Neuropathol Commun. 2023 Jul 12;11(1):117. https://doi.org/10.1186/s40478-023-01621-x. Erratum for: Acta Neuropathol Commun. 2023 Jul 6; 11(1): 109. https://doi.org/10.1186/s40478-023-01611-z. PMID: 37438786
18. Murakami A., Nakamura M, Nakamura Y., et al. An autopsy case report of neuronal intermediate filament inclusion disease presenting with predominantly upper motor neuron features. Neuropathology. 2021 Oct; 41(5): 357–365. https://doi.org/10.1111/neup.12741. PMID: 34309938
19. Plekhova N.G., Radkov I.V., Zinoviev S.V., et al. Effect of Mild Traumatic Brain Injury on Behavioral Reactions and Neocortical Morphology in Rats. Bull Exp Biol Med. 2021 Mar;170(5):672– 676. https://doi.org/10.1007/s10517-021-05130-6. Epub 2021 Mar 31. PMID: 33788107
20. Kino Y., Washizu C., Kurosawa M., et al. FUS/TLS deficiency causes behavioral and pathological abnormalities distinct from amyotrophic lateral sclerosis. Acta Neuropathol Commun. 2015 Apr 25; 3: 24. https://doi.org/10.1186/s40478-015-0202-6. PMID: 25907258
21. Tzeplaeff L., Seguin J., Le Gras S., et al. Mutant FUS induces chromatin reorganization in the hippocampus and alters memory processes. Prog Neurobiol. 2023 Aug; 227: 102483. https://doi.org/10.1016/j.pneurobio.2023.102483. Epub 2023 Jun 15. PMID: 37327984
22. Ho W.Y., Agrawal I., Tyan S.H., et al. Dysfunction in nonsense-mediated decay, protein homeostasis, mitochondrial function, and brain connectivity in ALS-FUS mice with cognitive deficits. Acta Neuropathol Commun. 2021 Jan 6; 9(1): 9. https://doi.org/10.1186/s40478-020-01111-4. PMID: 33407930
23. Sun M., Yamashita T., Shang J., et al. Acceleration of TDP43 and FUS/TLS protein expressions in the preconditioned hippocampus following repeated transient ischemia. J Neurosci Res. 2014 Jan; 92(1): 54–63. https://doi.org/10.1002/jnr.23301. Epub 2013 Oct 28. PMID: 24265138
24. King A., Troakes C., Smith B., et al. ALS-FUS pathology revisited: singleton FUS mutations and an unusual case with both a FUS and TARDBP mutation. Acta Neuropathol Commun. 2015 Oct 9; 3: 62. https://doi.org/10.1186/s40478-015-0235-x. PMID: 26452761
25. Piavchenko G.A., Pokidova K.S., Kuzmin E.A., et al. Quantitative Immunofluorescence Mapping of HSP70’s Neuroprotective Effects in FUS-ALS Mouse Models. Appl. Sci. 2024; 14(24): 11614. https://doi.org/10.3390/app142411614
Об авторах
Г. А. ПьявченкоРоссия
Пьявченко Геннадий Александрович - кандидат медицинских наук, доцент кафедры анатомии и гистологии человека.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
К. С. Покидова
Россия
Покидова Ксения Сергеевна - стажер-исследователь кафедры анатомии и гистологии человека.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Е. А. Кузьмин
Россия
Кузьмин Егор Александрович - стажер-исследователь, кафедра анатомии и гистологии человека.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. А. Венедиктов
Россия
Венедиктов Артем Андреевич - аспирант, ассистент кафедры анатомии и гистологии человека.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
С. Л. Кузнецов
Россия
Кузнецов Сергей Львович - член-корр. РАН, д-р мед. наук, профессор кафедры анатомии и гистологии человека.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(192KB)
|
Метаданные ▾ | |

|
2. 1180_ARRIVE чек-лист | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(120KB)
|
Метаданные ▾ | |
Рецензия
Журнал "Сеченовский вестник". Лист редактора можно посмотреть здесь /
Sechenov Medical Journal. Editor's checklist you can find here
Название / Title | Гиперэкспрессия белков теплового шока HSP70 у мышей с мутантнымбелком FUS сопровождается меньшими нейродегенеративнымиизменениями в структурах лимбической системы / Overexpression of HSP70 in mice with mutant FUS protein is accompanied by a mitigated neurodegeneration in limbic system |
Раздел / Section
| КЛЕТОЧНАЯ БИОЛОГИЯ, ЦИТОЛОГИЯ, ГИСТОЛОГИЯ / CELL BIOLOGY, CITOLOGY, HISTOLOGY |
Тип / Article | Оригинальная статья / Original article |
Номер / Number | 1180 |
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian |
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 01.12.2024 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1180_А |
Научная степень / Scientific degree | Кандидат медицинских наук / Cand. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 26.02.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Актуальность цели исследования не вызывает сомнений. Боковой амиотрофический склероз, является заболеванием нервной системы, которое поражает нервные клетки в головном и спинном мозге. Состояние пациентов ухудшается с течением времени. Точная причина заболевания до сих пор неизвестна, однако, примерно у 10% людей с боковым амиотрофическим склерозом (БАС) можно определить генетическую причину с большим количеством вовлеченных генов. При этом достаточно многочисленные недавние генетические открытия предполагают, что наследственные формы БАС более распространены, чем считалось ранее.
В настоящее время не существует эффективного лечения или лечения, которое может обратить вспять ущерб, вызванный БАС. Накопленные научные данные, пока, не позволяют излечивать это смертельное заболевание.
БАС считается мультисистемным расстройством, которое может сопровождаться немоторными симптомами, такими как поведенческие и когнитивные нарушения, и даже проявляться как перекрестный синдром с признаками лобно-височной деменции (ЛВД), обнаружено, что анатомические и функциональные поражения при БАС выходят за рамки прецентральной коры и кортикоспинальных трактов, могут включать мозолистое тело, лобную, сенсорную и премоторную кору, таламус и другие отделы головного мозга. Поэтому морфологические исследования структур лимбической системы на трансгенных животных моделях заболевания, несомненно, актуальны.
Научная новизна результатов не вызывает сомнений. Получены количественные показатели нейродегенеративных изменений в структурах лимбической системы у мышей с гиперэкспрессией белков теплового шока семейства HSP70 в форме HSPA1A и экспрессией мутантного человеческого белка FUS с транслокацией [1-359], свойственной для БАС. Обнаружено, что одновременное присутствие белка HSPA1A вместе с мутантным белком FUS [1-359] в цитоплазме клеток нервной ткани в структурах лимбической системы сопровождается меньшими нейродегенеративными изменениями, чем при изолированной экспрессии мутантного FUS.
Практическая значимость результатов высокая, так как продемонстрированы определенные патологические изменения в лимбической системе в трансгенной животной модели БАС, а также сделано обоснованное предположение, что гиперэкспрессия HSPA1A является потенциальным способом замедлить развитие FUS-варианта БАС. Результаты расширяют представления о возможностях лечения БАС, терапевтического использования белков теплового шока и стратегий влияния на их экспрессию.
Статья соответствует правилам этики проведения исследований и публикации их результатов. Материалы и методы исследований соответствуют поставленной цели. За последнее десятилетие область изучения БАС значительно продвинулась вперед благодаря быстрому прогрессу в понимании генетической архитектуры и патофизиологических механизмов заболевания за счет разработки надежных, пригодных для использования доклинических модельных систем. Двойные трансгенные мыши в исследовании – свидетельство самого современного и высокого уровня техники при выполнении исследования.
Заключение обоснованно и не противоречит известным представлениям о БАС и адекватных животных моделях этого заболевания. Использование научной терминологии и ее соответствие принятой в рассматриваемой области знаний не вызывают замечаний.
Валидность и новизна выбранных литературных источников не вызывают возражений. Можно учесть информацию Mead, R.J., Shan, N., Reiser, H.J. et al. Amyotrophic lateral sclerosis: a neurodegenerative disorder poised for successful therapeutic translation. Nat Rev Drug Discov 22, 185–212 (2023). https://doi.org/10.1038/s41573-022-00612-2.
Целостность и непротиворечивость текста работы, стиль изложения и уровень русского языка – без замечаний.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1180_В |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 01.03.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Актуальность исследования и научная новизна его результатов не вызывает сомнений.
Работа проведена в соответствии с правилами этики проведения исследований и публикации их результатов. Материалы и методы соответствуют поставленной цели. Заключение достаточно обосновано.
Замечания (пожелания):
- В статье, при сравнении отличий между группами в рубрике «результаты исследования», авторами используется термины: «было меньше», «больше», «снижалось», «увеличивалось» без указания числовых значений (или уточнения «во сколько раз»), что в свою очередь улучшит восприятие и понимание материала.
- Не совсем понятна необходимость включения в рубрики статьи «актуальность исследования» и «материалы и методы» рисунков (схем), не обладающих новизной, оригинальностью и наглядностью материала. В частности, рис 1, отражающий механизм взаимодействия, не обладает новизной, оригинальностью, не содержит информационной составляющей, а только «занимает место в статье» и обладает функцией «приукрашивания работы». Рекомендовано удалить из текста статьи.
Рис 2. – Как правило, схематичное (графическое) отображение дизайна исследования является необходимым в научном докладе или тексте диссертационного исследования. В данном случае – это научная статья и демонстрируемый графический материал является лишним (учитывая наличие всей информации в тексте рубрики «материалы и методы») и избыточным. Рекомендуется удалить данный рисунок из текста научной статьи.







































