Перейти к:
Маркеры ремоделирования костной ткани в ротовой и зубодесневой жидкостях у детей с терминальной стадией хронической болезни почек
https://doi.org/10.47093/2218-7332.2025.16.1.34-44
Аннотация
Цель исследования. Изучить маркеры ремоделирования костной ткани в биологических жидкостях (моче, сыворотке крови, ротовой жидкости (РЖ) и зубодесневой жидкости (ЗДЖ)) на этапе планирования ортодонтической стратегии у детей с терминальной стадией хронической болезни почек (тХБП).
Материалы и методы. Проведено пилотное одномоментное многоцентровое исследование. Обследованы 48 детей в возрасте от 7 до 17 лет, разделенных на три группы: 14 – с тХБП, 14 – с дисфункцией трансплантата почки (ДТП), 20 практически здоровых детей. Определяли маркеры ремоделирования кости: остеокальцин (ОК) в РЖ, ЗДЖ и сыворотке крови, дезоксипиридинолин (ДПИД) в моче, уровень общего, ионизированного кальция и фосфора в крови и pH РЖ. Минеральную плотность костной ткани оценивали по данным конуснолучевой компьютерной томограммы по классификации С. Mish.
Результаты. Группы детей были сопоставимы по возрасту и полу. Все пациенты были без выраженных минерально-костных нарушений. Уровни общего и ионизированного кальция в крови не различались между исследуемыми группами. Уровень фосфора в крови был выше в группе тХБП по сравнению с группой ДТП и группой контроля. Концентрации ДПИД в моче и OК в ЗДЖ, а также уровень pH РЖ были выше в группах детей с ХБП по сравнению с контрольной группой, при этом статистически значимых различий между группами тХБП и ДТП не выявлено. В заднем отделе верхней челюсти индекс Хаунсфилда был выше в группе с ДТП по сравнению с группой тХБП (p < 0,01) и сопоставим с контрольной группой. В переднем отделе верхней челюсти, а также в переднем и заднем отделах нижней челюсти индекс Хаунсфилда был выше в контрольной группе, чем в группах тХБП и ДТП.
Заключение. Наиболее выраженные изменения маркеров ремоделирования кости выявлены у детей с тХБП. Уровни ДПИД в моче и ОК в ЗДЖ ассоциированы со степенью снижения функции почек и минеральной плотностью челюстных костей.
Ключевые слова
Хроническая болезнь почек (ХБП) – это персистирующее в течение трех или более месяцев поражение органа вследствие действия различных этиологических факторов. Патологоанатомической основой заболевания является процесс замещения нормальных анатомических структур фиброзом, что приводит к дисфункции органа. Диагностика ХБП основана на выявлении снижения расчетной скорости клубочковой фильтрации (рСКФ) и/или альбуминурии и других маркеров повреждения почек [1]. Распространенность ХБП среди мировой популяции составляет более 800 миллионов человек [2]. Смертность от ХБП в мире в 2017 году достигла 1,2 миллиона и прогнозируется ее увеличение [3].
В мировой детской популяции распространенность ХБП достигает 18,5–58,3 случая на 1 миллион детей [4]. В России с 2012 года общая заболеваемость ХБП у детей продолжает расти [3]. Подходы к диагностике ХБП едины для детской и взрослой популяции. Однако в связи с преобладанием у детей не гломерулярной этиологии ХБП альбуминурию выявляют реже, чем у взрослых [5]. Согласно данным Европейского педиатрического реестра, врожденные аномалии почек и мочевыводящих путей и генетические заболевания являются ведущими этиологическими факторами ХБП у детей, обусловливая 40–60 и 20–30% выявленных случаев заболевания соответственно; гломерулонефрит вносит этиологический вклад менее чем в 10% случаев [5].
На терминальной стадии ХБП (тХБП) требуется проведение заместительной почечной терапии в объеме гемодиализа, перитониального диализа или трансплантации почки, что сопровождается ухудшением качества жизни и неблагоприятными исходами [6]. Кроме того, формирование тХБП у детей сопровождается значительными минерально-костными нарушениями (ХБП-МКН) [7–9], возникающими вследствие гиперпаратиреоза и нарушения фосфорно-кальциевого обмена [10][11]. У детей при ХБП-МКН наблюдаются снижение роста костей [12], высокая склонность к переломам [13][14], а также множественные структурные изменения костной ткани, включающие в себя потерю объемов кортикальной пластинки, деминерализацию, разрежение костных трабекул, что связано с повышенной активностью остеокластов [13].
Маркерами костного метаболизма при ХБП-МКН являются: дезоксипиридинолин (ДПИД) и остеокальцин (ОК) [15]. ДПИД – соединение, которое образуется при разрушении коллагена в кости, выделяется в кровоток, а затем выводится с мочой, – отражает активность остеокластов; повышение его концентрации напрямую коррелирует с тяжестью нарушений функции почек в экспериментальном исследовании на крысах [16]. ОК – витамин К-зависимый белок, синтезируемый остеобластами, – отражает нарушение минерализации костной ткани при ХБП-ассоциированном гиперпаратиреозе [17][18].
Пациенты с ХБП склонны к различным изменениям костной ткани челюстно-лицевой области: снижению плотности кортикальной пластинки и увеличению пористости костной ткани челюстей [19], укорочению ветвей нижней челюсти, увеличению гониального угла и снижению задней высоты лица [8][20][21], изменению структур и функции височно-нижнечелюстного сустава [22][23], а также значительному замедлению процесса прорезывания зубов практически без изменения последовательности их прорезывания [22]. Вышеуказанные изменения требуют персонализированного подхода на этапах ортодонтического лечения у пациентов с ХБП и объективных маркеров для принятия врачебного решения.
До настоящего времени остаются открытыми вопросы относительно выбора оптимальных сроков начала ортодонтического лечения у детей с ХБП, особенностей выбора типа конструкций и мониторирования процесса костного ремоделирования на фоне проводимого лечения. Поиск биомаркеров, отражающих специфические изменения в костной ткани, в том числе в челюстно-лицевой области у пациентов с данной патологией, остается востребованным.
Цель исследования: изучить маркеры ремоделирования костной ткани в биологических жидкостях (моче, сыворотке крови, ротовой жидкости (РЖ) и зубодесневой жидкости (ЗДЖ)) на этапе планирования ортодонтической стратегии у детей с ХБП.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено пилотное одномоментное многоцентровое исследование пациентов с ХБП. Нормативной базой для его выполнения был Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011, № 48, ст. 6724)1. Необходимое число пациентов в подгруппах было определено на этапе планирования эксперимента. Размер выборки был достаточен с учетом мощности 80%.
Набор пациентов
Исследование проведено в период с 1 марта по 30 июня 2024 года на базе следующих клинических центров: Института стоматологии им. Е.В. Боровского Сеченовского Университета; хирургического отделения № 1 НМИЦ трансплантологии и искусственных органов им. академика В.И. Шумакова Минздрава России. Осуществлялся сплошной набор пациентов из обратившихся в вышеперечисленные лечебные учреждения.
Критерии включения:
- возраст от 7 до 17 лет;
- установленный диагноз ХБП (коды по МКБ-102:
N18 Хроническая болезнь почек; T86.1 Дисфункция трансплантата почки); - наличие зубочелюстных аномалий, включая аномалии прикуса;
- наличие письменного информированного добровольного согласия родителей / законных представителей на участие ребенка в исследовании.
Критерии невключения:
- активное/текущее ортодонтическое лечение (n= 5);
- наличие сопутствующих острых/хронических заболеваний, влияющих на костный метаболизм:
– эндокринные и метаболические заболевания (n = 10),
– аутоиммунные заболевания (n = 2),
– генетические заболевания (n = 4),
– онкологические заболевания (n = 1),
– заболевания желудочно-кишечного тракта (n = 3);
– хронические заболевания печени (n = 7),
– лекарственно-индуцированные нарушения костного метаболизма (n = 5).
Всего для участия в исследовании оценены 65 детей и подростков. Критерии невключения выявлены у 37 пациентов (рис.). В исследование включены 28 детей с ХБП, которые были разделены на две группы: 1 группа – 14 пациентов с тХБП с рСКФ по формуле CKiD U25 с постоянным коэффициентом креатинина ≤25 мл/мин/1,73 м2; 2 группа – 14 пациентов с дисфункцией трансплантата почки (ДТП) с рСКФ по формуле CKiD U25 с постоянным коэффициентом креатинина >25 мл/мин/1,73 м2.
В группу сравнения вошли 20 практически здоровых детей и подростков с отсутствием общесоматической патологии, подобранных по полу и возрасту аналогично группе детей с ХБП, проходивших стоматологическое обследование на кафедре детской, профилактической стоматологии и ортодонтии Института стоматологии имени Е.В. Боровского в сроки исследования.
Определение биомаркеров костного метаболизма
Материалом исследования служили биологические жидкости пациентов, взятые однократно утром натощак до проведения диагностических и лечебных процедур: кровь из кубитальной вены или вен тыла кисти в объеме 5 мл, стабилизированная гепарином (25 МЕ/мл), моча в объеме 50 мл, ротовая жидкость в объеме не менее 5 мл.
Проводили биохимический анализ крови фотоколориметрическими методами для определения уровня общего (Ca) и ионизированного (Ca2+) кальция, фосфора (P). Расчет общего кальция плазмы крови с поправкой на альбумин производили по формуле: измеренный уровень кальция плазмы (ммоль/л) + 0,02×(40 – измеренный уровень альбумина плазмы (г/л)).
Концентрация ДПИД в моче измерялась методом твердофазного хемилюминесцентного иммуноанализа.
Уровень OК определяли в сыворотке крови, ЗДЖ и РЖ с помощью коммерческих наборов «Osteocalcin ELISA» для твердофазного иммуноферментного анализа («BioVendor», США).
Для определения pH РЖ использовался портативный измеритель кислотно-щелочного баланса Milwaukee PH56 (Milwaukee Instruments, США).
Кроме того, по данным конусно-лучевой компьютерной томограммы оценивали рентгенологическую плотность костной ткани, выраженную в единицах Хаунсфилда (Hounsfield units, HU) по классификации С. Mish [24], на основании математической реконструкции коэффициентов ослабления рентгеновского излучения, присвоенных каждому пикселю. Рентгенологическая оценка проводилась в четырех отделах: передний и задний отдел верхней челюсти; передний и задний отдел нижней челюсти.
Статистический анализ
Исследуемые признаки групп пациентов были протестированы на нормальность распределения с помощью теста Шапиро – Уилка и на гомогенность дисперсий с помощью теста Левена. Переменные, соответствующие нормальному распределению и имеющие гомогенные дисперсии, представлены в виде средних значений и стандартного отклонения, средние значения сравнивали с использованием однофакторного дисперсионного анализа (ANOVA). Остальные переменные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили), для их сравнения применен метод Краскела – Уоллиса. Качественные признаки представлены в виде доли. Для post-hoc анализа применяли тест Тьюки. Результаты статистического анализа считали значимыми при уровне р < 0,05. Результаты экспериментов обрабатывались с помощью программы Prism 8.0.1 (GraphPad Software, США) и языка R 4.4.2 в программной среде R-Studio.
РЕЗУЛЬТАТЫ
В исследование включены пациенты без выраженных клинических проявлений ХБП-МКН и установленного диагноза «остеопороз». Основные характеристики исследуемых групп представлены в таблице 1.
Исследуемые группы были сопоставимы по возрасту, среднее значение которого составило 12,7 ± 2,9 года. Доля девочек в группе ДТП была ниже, чем в группе тХПН и контрольной группе, однако различия были статистически незначимы (табл. 1).
В группе пациентов с тХБП концентрации креатинина в сыворотке крови была значительно выше, а рСКФ ниже по сравнению с группой пациентов с ДТП и группой контроля. Пациенты группы тХБП получали лечение гемодиализом или перитонеальным диализом в среднем в течение от 6 месяцев до 3 лет.
Уровни общего и ионизированного кальция в крови не различались между исследуемыми группами (табл. 1). Уровень фосфора в крови был значительно выше в группе тХБП по сравнению с группой ДТП и группой контроля. В то же время статистически значимых различий в уровне фосфора между группой ДТП и контрольной группой выявлено не было (табл. 1).
Обобщенные результаты исследуемых маркеров в группах представлены в таблице 2.
Концентрация ДПИД в моче была выше в группах пациентов с ХБП по сравнению с контрольной группой (табл. 2). Однако статистически значимых отличий между концентрацией ДПИД в моче пациентов групп тХБП и ДТП не выявлено.
Концентрация OК в сыворотке крови была повышена в группе пациентов с тХБП по сравнению с контрольной группой (p < 0,05) и не отличалась от пациентов группы ДТП. Содержание ОК в ЗДЖ было выше в контрольной группе по сравнению с пациентами групп тХБП (p < 0,001) и ДТП (p < 0,001). При этом уровень ОК в РЖ был сопоставим во всех исследуемых группах (табл. 2).
У детей как с тХБП, так и с ДТП уровень pH РЖ был статистически значимо выше по сравнению с контрольной группой (табл. 2). При этом различия между группами ДТП и тХБП отсутствовали, что указывает на схожий уровень кислотности РЖ в этих двух группах.
При оценке рентгенологической плотности костной ткани установлено, что в заднем отделе верхней челюсти индекс Хаунсфилда был статистически значимо выше в группе ДТП по сравнению с группой тХБП (p < 0,01) и не отличался от значения в контрольной группе. В переднем отделе верхней челюсти значения индекса Хаунсфилда в контрольной группе были выше, чем в группе тХБП и в группе ДТП. Аналогичная закономерность обнаружена для переднего и заднего отделов нижней челюсти, где значение индекса Хаунсфилда у детей в контрольной группе были статистически значимо выше, чем у пациентов с тХБП и ДТП (табл. 2).
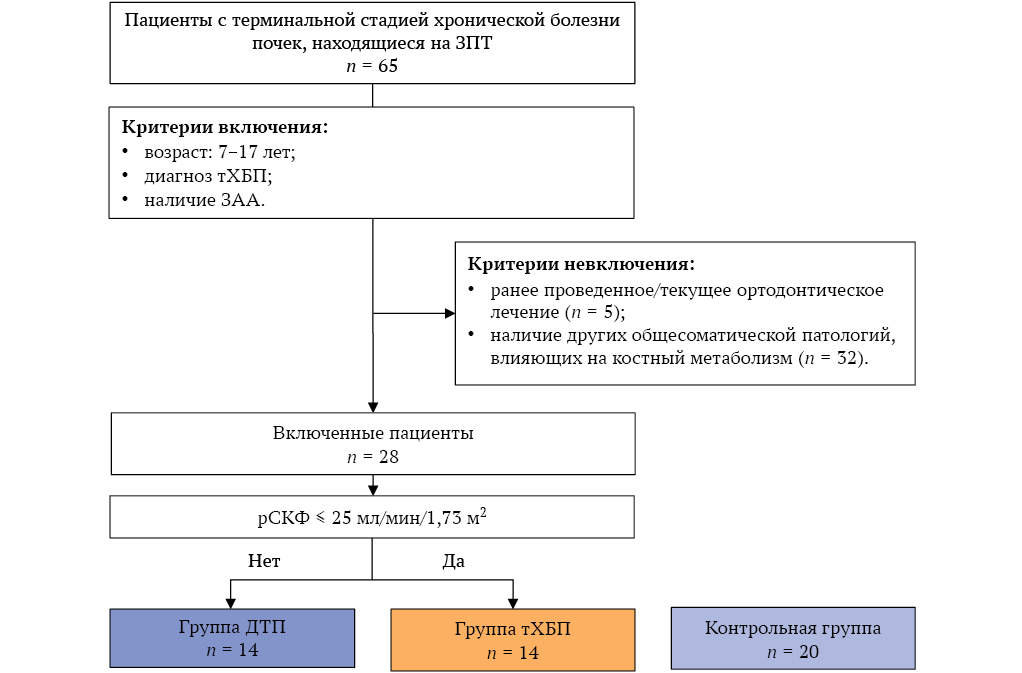
РИС. Потоковая диаграмма включения пациентов в исследование.
Примечание: тХБП – терминальная стадия хронической болезни почек, ЗЧА – зубочелюстные аномалии, ЗПТ – заместительная почечная терапия, ДТП – дисфункция трансплантата почки, рСКФ – расчетная скорость клубочковой фильтрации по формуле CKiD U25.
Таблица 1. Характеристики исследуемых групп пациентов
|
Признак |
Хроническая болезнь почек |
Группа контроля (n = 20) |
Значение р (ANOVA) |
|
|
тХБП (n = 14) |
ДТП (n = 14) |
|||
|
Возраст, лет |
12,1±2,4 |
13,4±3,0 |
12,6±3,4 |
n.s. |
|
Девочки, n (%) |
11 (79) |
6 (43) |
13 (65) |
n.s. |
|
рСКФ, мл/мин/1,73 м² |
10,51 ± 3,25a,c |
56,73 ± 15,31b,c |
90,01 ± 10,26a,b |
<0,0001 |
|
Креатинин в сыворотке крови, мкмоль/л |
477,8 (403,1; 571,6)a,c |
85,7 (73,2;131,9)b,c |
63,0 (50,35; 71,68)a,b |
<0,0001 |
|
Кальций общий в сыворотке крови, ммоль/л |
2,40 (2,14; 2,62) |
2,42 (2,34;2,46) |
2,40 (2,27; 2,49) |
<0,01 |
|
Кальций общий в сыворотке крови с поправкой на альбумин, ммоль/л |
2,34±0,28 |
2,39±0,13 |
2,37±0,14 |
n.s. |
|
Кальций ионизированный в сыворотке крови, ммоль/л |
1,16 (0,96; 1,21) |
1,18 (1,10; 1,23) |
1,21 (1,17; 1,24) |
<0,01 |
|
Фосфор в сыворотке крови, ммоль/л |
1,751 ± 0,490a,c |
1,342 ± 0,266c |
1,436 ± 0,195a |
<0,005 |
Примечание: ДТП – дисфункция трансплантата почки; рСКФ – расчетная скорость клубочковой фильтрации; тХБП – терминальная стадия хронической болезни почек; а – p < 0,05 при сравнении групп тХБП и контроля; b – p < 0,05 при сравнении групп ДТП и контроля;
c – p < 0,05 при сравнении групп ДТП и тХБП.
Таблица 2. Маркеры костного метаболизма
|
Признак |
Хроническая болезнь почек |
Группа контроля (n = 20) |
Значение р (ANOVA) |
|
|
тХБП (n = 14) |
ДТП (n = 14) |
|||
|
ДПИД в моче, нмоль/ммольКреат |
15,80 (12,68; 27,90)a |
15,08 (10,27; 24,61)b |
4,90 (2,95; 11,98)a,b |
<0,001 |
|
ОК в сыворотке крови, нг/мл |
213,1 ± 55,01a |
173,7 ± 86,78 |
153,9 ± 56,15a |
<0,05 |
|
ОК в ротовой жидкости, нг/мл |
11,78 ± 1,93 |
12,94 ± 1,76 |
13,46 ± 3,73 |
n.s. |
|
ОК в зубодесневой жидкости, нг/мл |
13,11 ± 3,98a |
11,92 ± 3,10b |
20,08 ± 4,69a,b |
<0,0001 |
|
рН ротовой жидкости |
7,080 (6,375; 8,153)a |
7,240 (6,875; 7,593)b |
6,250 (5,575; 6,800)a,b |
<0,001 |
|
Индекс Хаунсфилда передний отдел в/ч |
482,5 (394,5; 554,3)a |
439,0 (396,3; 503,0)b |
681,5 (449,0; 766,8)a,b |
<0,0001 |
|
Индекс Хаунсфилда задний отдел в/ч |
203,0 (194,8; 238,8)a,c |
363,0 (248,3; 485,0)c |
420,0 (329,0; 539,0)a |
<0,01 |
|
Индекс Хаунсфилда передний отдел н/ч |
1059 (951; 1451)a |
1670 (1083; 1985)b |
3098 (1985; 3538)a,b |
<0,0001 |
|
Индекс Хаунсфилда задний отдел н/ч |
824,4 ± 111,0a |
826,5 ± 89,5b |
1735 ± 377,2a,b |
<0,0001 |
Примечание: ДПИД – дезоксипиридинолин; ДТП – дисфункция трансплантата почки; тХБП – терминальная стадия хронической болезни почек; ОК – остеокальцин; в/ч – верхняя челюсть; н/ч – нижняя челюсть; а – p < 0,05 при сравнении групп тХБП и контроля;
b – p < 0,05 при сравнении групп ДТП и контроля; c – p < 0,05 при сравнении групп ДТП и тХБП.
ОБСУЖДЕНИЕ
Результаты нашего исследования продемонстрировали изменения маркеров костного ремоделирования и плотности костной ткани по данным конусно-лучевой компьютерной томографии, наиболее выраженные в группе детей с тХБП. Выявлено повышение содержания ДПИД в моче, снижение уровня ОК в сыворотке крови и ЗДЖ, снижение индекса Хаунсфилда как в передних, так и в задних отделах верхней и нижней челюсти. У пациентов группы с ДТП отмечались аналогичные изменения, однако концентрация ОК была снижена только в ЗДЖ. При сравнении плотности костной ткани по данным конусно-лучевой компьютерной томографии достоверных отличий между группами тХБП и ДТП установлено не было за исключением индекса Хаунсфилда в заднем отделе верхней челюсти.
Значимая роль в регуляции кальций-фосфорного обмена отводится почкам, которые обеспечивают практически полную канальциевую реабсорбцию этих ионов. При развитии ХБП данный гомеостаз нарушается. Так, в проведенном нами исследовании у пациентов тХБП при снижении рСКФ уровень фосфора в крови увеличивался. Контроль уровня P у пациентов с ХБП-МКН важен для поддержания костного гомеостаза, и наши результаты согласуются с исследованием А. Rastogi et al. [25]. У группы с ДТП уровень Р был приближен к значениям группы сравнения, что обратно коррелирует с более высоким значением рСКФ, это связано с улучшением фильтрационной функции почек после трансплантации, однако ввиду развития ДТП уровень фосфора оставался высоким. Эти тенденции соответствуют имеющимся в литературе данным о влиянии минерального метаболизма на костное ремоделирование у пациентов после трансплантации почки [26][27].
В это же время результаты нашего исследования показали, что концентрация кальция статистически не различается между группами, что свидетельствует о стабильности медианного значения этого показателя независимо от состояния почечной функции и трансплантата. Однако, учитывая особенности распределения данных, показатели в группе тХБП все же имеют больший разброс и менее однородны. Выраженных нарушений кальциевого обмена в исследуемой выборке пациентов не было выявлено. Вышеуказанные данные совпадают с работами J. Liu et al. и В. Hasanzamani et al. [28][29]. Необходимо отметить, что уровни паратгормона и костной фракции щелочной фосфатазы не были учтены.
На основании проведенного анализа было установлено, что уровень ДПИД в моче является высокочувствительным маркером нарушения костного обмена у пациентов с тХБП и ДТП. Так, нами выявлены четкие и значимые различия этого маркера между исследуемыми группами. Увеличение уровня ДПИД в группах детей с ХБП по сравнению с группой сравнения может свидетельствовать о высокой активности остеокластов, активации процессов резорбции костной ткани. Выявленные изменения ДПИД зарегистрированы одновременно со снижением индекса Хаунсфилда во всех точках верхней и нижней челюсти, что свидетельствует о распаде костного коллагена преимущественно I типа, выведении конечных продуктов костного метаболизма с мочой и подтверждает сохраняющиеся изменения костного обмена у детей с ХБП. Однако анализ литературных данных не подтвердил, что уровень ДПИД в моче может отражать состояние костного метаболизма у пациентов с ХБП-МКН [30]. В то же время оценка уровня ДПИД является одним из ведущих биохимических маркеров костного ремоделирования и используется в ранней диагностике остеопороза [31]. Таким образом, определение уровня ДПИД в моче пациентов с ХБП может быть перспективным для оценки активности остеокластов и процессов резорбции костной ткани и требует дальнейшего изучения на более крупной выборке пациентов с ХБП.
Результаты представленного исследования убедительно свидетельствуют, что ОК также является информативным маркером активности остеобластов у детей с тХБП и ДТП, а лучшая биологическая среда для его определения – ЗДЖ, поскольку именно в ней зарегистрированы наиболее значимые изменения, даже несмотря на ограниченную выборку. Установлено снижение уровня ОК в ЗДЖ в группах с тХБП и ДТП по сравнению с контрольной группой, что указывает на нарушение костного метаболизма. Повышение концентрации ОК в сыворотке крови выявлено только в группе пациентов с тХБП, что, вероятно, связано с ограниченной выборкой. Содержание ОК в РЖ статистически значимо не отличалось между пациентами трех групп, что, возможно, связано с высокой протеазной активностью данной биологической жидкости [32]. Исследования, оценивающие ОК в ЗДЖ у пациентов с ХБП, к настоящему времени не опубликованы. Однако в работе N. Fadli и соавт. имеются данные об использовании ЗДЖ для оценки ОК и провоспалительных маркеров [33]. Интерес к использованию ЗДЖ в качестве среды для детекции различных маркеров у пациентов с системными заболеваниями, в том числе ХБП, растет в связи с достаточной информативностью и малоинвазивностью.
Повышение pH РЖ и тенденция к щелочной среде РЖ у пациентов с тХБП могут быть связаны с нарушением общего метаболизма, в том числе с изменением кислотно-основного баланса, характерных для тХБП [34].
Кроме того, полученные данные свидетельствуют о выраженных нарушениях костной структуры у детей с тХБП и ДТП, что проявляется в значительном снижении индекса Хаунсфилда по сравнению с группой контроля, особенно в передних и задних отделах нижней челюсти. Эти изменения согласуются с ранее проведенными исследованиями [23], подтверждая нарушения костного обмена и снижение минерализации кости у пациентов с почечной дисфункцией.
Ограничения исследования и направления для дальнейших исследований
Интерпретация результатов исследования имеет ряд ограничений вследствие дизайна пилотного исследования: малый размер выборочной совокупности, одна точка наблюдения. При оценке ХБП-МКН не учитывались уровни паратгормона и костной фракции щелочной фосфатазы. Возможно, по причине недостаточной мощности исследования отсутствовали статистически значимые различия показателей общего кальция в сыворотке крови с поправкой на альбумин, а также ОК в ротовой жидкости. Для получения выводов по данным маркерам необходимо проведение продольных исследований на объемных выборках с применением вероятностного отбора единиц наблюдения.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании было продемонстрировано, что информативными маркерами костного метаболизма у детей с тХБП на представленной выборке были ДПИД в моче и ОК в ЗДЖ. Изменения содержания ДПИД в моче и ОК в ЗДЖ ассоциированы со степенью снижения рСКФ и минеральной плотностью кости по данным конусно-лучевой компьютерной томографии. Установленные сдвиги маркеров костного метаболизма подтверждают необходимость в разработке стратегии персонифицированного и мультидисциплинарного подхода к ортодонтическом лечению данной когорты пациентов. Кроме того, выявлено, что ЗДЖ является информативной биологической средой для детекции ОК как маркера ХБП-МКН у детей с тХБП и ДТП и перспективна для оценки нарушений костного метаболизма в челюстно-лицевой области.
1 Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (дата обращения: 19.08.2022). https://minzdrav.gov.ru/documents/7025
2 Международная классификация болезней 10-го пересмотра (МКБ-10) (дата обращения: 10.01.2025). https://mkb-10.com
Список литературы
1. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024 Apr; 105(4S): S117–S314. https://doi.org/10.1016/j.kint.2023.10.018. PMID: 38490803
2. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022 Apr; 12(1): 7–11. https://doi.org/10.1016/j.kisu.2021.11.003. Epub 2022 Mar 18. PMID: 35529086
3. Румянцева Е.И. Хроническая болезнь почек как глобальная проблема для общественного здоровья: динамика заболеваемости и смертности. Проблемы стандартизации в здравоохранении. 2021; 1–2: 41–49. https://doi.org/10.26347/16072502202101-02041-049. EDN: TFHKJB / Rumyantseva E.I.
4. Ахмедова E.A. Хроническая болезнь почек у детей (обзор литературы). ЖКМП. 2024; 1(1): 94–98. ISSN 2181-3531
5. Harambat J., van Stralen K.J., Kim J.J., Tizard E.J. Epidemiology of chronic kidney disease in children. Pediatr Nephrol. 2012 Mar; 27(3): 363–373. https://doi.org/10.1007/s00467-011-1939-1. Epub 2011 Jun 29. Erratum in: Pediatr Nephrol. 2012 Mar; 27(3): 507. PMID: 21713524
6. Borzych D., Rees L., Ha I.S., et al. The bone and mineral disorder of children undergoing chronic peritoneal dialysis. Kidney Int. 2010 Dec; 78(12): 1295–1304. https://doi.org/10.1038/ki.2010.316. Epub 2010 Sep 1. PMID: 20811335
7. Melo V.B., Silva D.B.D., Soeiro M.D., et al. Growth in children with chronic kidney disease and associated risk factors for short stature. J Bras Nefrol. 2024 Oct-Dec; 46(4): e20230203. https://doi.org/10.1590/2175-8239-JBN-2023-0203en. PMID: 39094068
8. Simic P. Bone and bone derived factors in kidney disease. Front Physiol. 2024 Mar 1;15:1356069. https://doi.org/10.3389/fphys.2024.1356069. PMID: 38496297
9. Карлович Н.В., Мохорт Т.В., Сазонова Е.Г. Костная патология при хронической болезни почек. Остеопороз и остеопатии. 2022; 25(1): 29–38. https://doi.org/10.14341/osteo12943 EDN: EOULOC
10. Elhusseiny G.A., Saleh W. Oral health in children with chronic kidney disease, hemodialysis, and renal transplantation: a comprehensive narrative review of the oral manifestations and dental implications. Clin Med Insights Pediatr. 2024 Aug 27; 18: 11795565241271689. https://doi.org/10.1177/11795565241271689. PMID: 39206206
11. Denburg M.R., Kumar J., Jemielita T., et al. Fracture burden and risk factors in childhood CKD: results from the CKiD cohort study. J Am Soc Nephrol. 2016 Feb; 27(2): 543–550. https://doi.org/10.1681/ASN.2015020152. Epub 2015 Jul 2. PMID: 26139439
12. Printza N., Dotis J., Sinha M.D., Leifheit-Nestler M. Editorial: Mineral and bone disorder in CKD. Front Pediatr. 2022 Feb 18; 10: 856656. https://doi.org/10.3389/fped.2022.856656. PMID: 35252071
13. Todisco T., Ubertini G.M., Bizzarri C., et al. Chronic kidney disease and growth failure in children. Children (Basel). 2024 Jul 1; 11(7): 808. https://doi.org/10.3390/children11070808. PMID: 39062256
14. Chi P.J., Hung S.Y., Hsiao F.T., et al. Serum osteocalcin concentration as an independent biomarker of osteoporosis in patients with chronic kidney disease. Clin Nephrol. 2022 Jul; 98(1): 1–9. https://doi.org/10.5414/CN110705. PMID: 35445659
15. Heimgartner N., Graf N., Frey D., et al. Predictive power of bone turnover biomarkers to estimate bone mineral density after kidney transplantation with or without denosumab: a post hoc analysis of the POSTOP study. Kidney Blood Press Res. 2020; 45(5): 758–767. https://doi.org/10.1159/000510565. Epub 2020 Sep 30. PMID: 32998144
16. Ziemińska M., Pawlak D., Sieklucka B., et al. Vitamin K-dependent carboxylation of osteocalcin in bone-ally or adversary of bone mineral status in rats with experimental chronic kidney disease? Nutrients. 2022 Oct 1; 14(19): 4082. https://doi.org/10.3390/nu14194082. PMID: 36235734
17. Tsugawa N., Shiraki M. Vitamin K Nutrition and Bone Health. Nutrients. 2020 Jun 27; 12(7): 1909. https://doi.org/10.3390/nu12071909. PMID: 32605143
18. Mohamed FF., Amadeu de Oliveira F., Kinoshita Y., et al. Dentoalveolar alterations in an adenine-induced chronic kidney disease mouse model. J Bone Miner Res. 2023 Aug; 38(8): 1192–1207. https://doi.org/10.1002/jbmr.4829. Epub 2023 May 27. PMID: 37191192
19. Lalayiannis A.D., Soeiro E.M.D., Moysés R.M.A., Shroff R. Chronic kidney disease mineral bone disorder in childhood and young adulthood: a ‘growing’ understanding. Pediatr Nephrol. 2024 Mar; 39(3): 723–739. https://doi.org/10.1007/s00467-023-06109-3. Epub 2023 Aug 25. PMID: 37624528
20. Munagala K.K., Nanda S., Chowdhary Z., et al. Severity of periodontal disease in chronic kidney disease patients: a hospitalbased study. Cureus. 2022; 14(6): e25646. Published 2022 Jun 3. https://doi.org/10.7759/cureus.25646
21. Морозова Н.С., Мамедов А.А., Лакомова Д.Ю. и др. Отдаленные изменения зубочелюстной системы крыс после экспериментальной интраабдоминальной гипертензии. Сеченовский вестник. 2021; 12(3): 38–46. https://doi.org/10.47093/2218-7332.2021.12.3.38-46. EDN: VDAIPF /
22. Морозова О.Л., Морозова Н.С., Мамедов А.А., и соавт. Изменения зубочелюстной системы у детей с хронической болезнью почек. Педиатрия им. Г.Н. Сперанского. 2018; 97(5): 104–112. https://doi.org/10.24110/0031-403X-2018-97-5-104-112. EDN: XZIRU
23. Морозова Н.С., Еловская А.А., Тимощенко Т.В. и др. Ортодонтическая реабилитация пациента с хронической болезнью почек после трансплантации. Врач, 2021; 32(10): 50–53. https://doi.org/10.29296/25877305-2021-10-09. EDN: YPDDTM
24. Misch C.E., Judy K.W. Classification of partially edentulous arches for implant dentistry. Int J Oral Implantol. 1987; 4(2): 7–13. PMID: 3269839
25. Rastogi A, Bhatt N, Rossetti S, Beto J. Management of hyperphosphatemia in end-stage renal disease: a new paradigm. J Ren Nutr. 2021 Jan; 31(1): 21–34. https://doi.org/10.1053/j.jrn.2020.02.003. Epub 2020 May 5. PMID: 32386937
26. Cseprekál O., Kis E., Dégi A.A., et al. Bone metabolism and arterial stiffness after renal transplantation. Kidney Blood Press Res. 2014; 39(6): 507–515. https://doi.org/10.1159/000368461. Epub 2014 Nov 28. PMID: 25531154
27. Bellorin-Font E., Rojas E., Martin K.J. Bone disease in chronic kidney disease and kidney transplant. Nutrients. 2022 Dec 29; 15(1): 167. https://doi.org/10.3390/nu15010167. PMID: 36615824
28. Liu J., Tio M.C., Verma A., et al. Determinants and outcomes associated with urinary calcium excretion in chronic kidney disease. J Clin Endocrinol Metab. 2022 Jan 1; 107(1): e281–e292. https://doi.org/.1210/clinem/dgab574. PMID: 34390334
29. Hasanzamani B., Karimi N., Sabbagh M.G., Majd H.M. The relationship between pre-transplant serum phosphorus before kidney transplantation with early graft dysfunction. Iran J Kidney Dis. 2021 Mar; 1(2): 148–154. PMID: 33764326
30. Coen G., Mantella D., Calabria S., et al. Urinary deoxypyridinoline excretion for the evaluation of bone turnover in chronic renal failure. Am J Nephrol. 2000 Jul-Aug; 20(4): 283–290. https://doi.org/10.1159/000013602. PMID: 10970981
31. Abdelfattah Abulfadle K., Refaat Abdelkader Atia R., Osama Mohammed H., et al. The potential anti-osteoporotic effect of exercise-induced increased preptin level in ovariectomized rats. Anat Sci Int. 2023 Jan; 98(1): 22–35. https://doi.org/10.1007/s12565-022-00666-7. Epub 2022 May 4. PMID: 35507276
32. Tavares L.T.R., Saavedra-Silva M., López-Marcos J.F., et al. Blood and salivary inflammatory biomarkers profile in patients with chronic kidney disease and periodontal disease: a systematic review. Diseases. 2022 Feb 17; 10(1): 12. https://doi.org/10.3390/diseases10010012. PMID: 35225864
33. Fadli N.A., Abdul Rahman M., Karsani S.A., Ramli R. Oral and gingival crevicular fluid biomarkers for jawbone turnover diseases: a scoping review. Diagnostics (Basel). 2024 Sep 30; 14(19): 2184. https://doi.org/10.3390/diagnostics14192184. PMID: 39410587
34. Rodrigues R.P.C.B., Vidigal M.T.C., Vieira W.A., et al. Salivary changes in chronic kidney disease and in patients undergoing hemodialysis: a systematic review and meta-analysis. J Nephrol. 2022 Jun; 35(5): 1339–1367. https://doi.org/10.1007/s40620-022-01274-4. Epub 2022 Mar 2. PMID: 35235185
Об авторах
А. А. ЕловскаяРоссия
Еловская Алина Алексеевна - ассистент кафедры детской, профилактической стоматологии и ортодонтии Института стоматологии им. Е.В. Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Е. С. Масликова
Россия
Масликова Екатерина Андреевна - ассистент кафедры детской, профилактической стоматологии и ортодонтии Института стоматологии им. Е.В. Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Н. С. Морозова
Россия
Морозова Наталия Сергеевна - д.м.н., профессор кафедры пропедевтики стоматологических заболеваний Института стоматологии им. Е.В. Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Н. Б. Захарова
Россия
Захарова Наталия Борисовна - д.м.н., профессор кафедры клинической лабораторной диагностики.
Ул. Большая Казачья, д. 112, г. Саратов, 410012
Л. Д. Мальцева
Россия
Мальцева Лариса Дмитриевна, канд. мед. наук, доцент кафедры патологической физиологии.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Е. Ю. Данилова
Россия
Данилова Елена Юрьевна - младший научный сотрудник лаборатории молекулярного моделирования и химии природных соединений Института молекулярной тераностики научно-технологического парка медицины.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
И. И. Шайхаттарова
Россия
Шайхаттарова Ильсияр Ильнуровна - студентка Института стоматологии им. Е.В. Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. А. Ширина
Россия
Ширина Ангелина Александровна - студентка Института стоматологии им. Е.В. Боровского Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
В. А. Шустова
Россия
Шустова Виолетта Александровна - студентка Института стоматологии им. Е.В. Боровского.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
О. Л. Морозова
Россия
Морозова Ольга Леонидовна - д.м.н., профессор кафедры патологической физиологии.
Ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Дополнительные файлы

|
1. STROBE Statement— Чек-лист по исследованию | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(199KB)
|
Метаданные ▾ | |
|
|
2. Graphic abstract | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(145KB)
|
Метаданные ▾ | |
Рецензия
Журнал "Сеченовский вестник". Лист редактора можно посмотреть здесь /
Sechenov Medical Journal. Editor's checklist you can find here
Название / Title | Маркеры ремоделирования костной ткани в ротовой и зубодесневой жидкостях у детей с терминальной стадией хронической болезни почек / Bone turnover markers in oral and gingival crevicular fluid in children with end-stage chronic kidney disease |
Раздел / Section
| ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ / PATHOLOGICAL PHYSIOLOGY |
Тип / Article | Оригинальная статья / Original article |
Номер / Number | 1170 |
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian |
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 17.01.2025 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1170_А |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 17.02.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Актуальность исследования не вызывает сомнений. Заболеваемость хронической болезнью почек (ХБП) у детей растет как в мире, так и в России. Известно, что ХБП сопровождается минерально-костными нарушениями вследствие нарушения фосфорно-кальциевого обмена. По данным литературы у таких больных наблюдаются проблемы с развитием скелета, склонность к переломам, нарушения структуры костной ткани. У пациентов с ХБП отмечаются, в том числе, и изменения костной ткани челюстно-лицевой области, замедляется процесс прорезывания зубов. При этом необходимо учитывать, что на терминальной стадии ХБП детям требуется проведение заместительной почечной терапии, что сопровождается дальнейшим ухудшением качества жизни и затрудняет лечение сопутствующей патологии.
Авторы поставили своей целью решить непростые вопросы об оптимизации и выборе оптимальных сроков начала ортодонтического лечения у таких детей, а также мониторирования процесса костного ремоделирования на фоне лечения ХБП. Для этого необходимы актуальные биомаркеры, четко и быстро показывающие специфические изменения в костной ткани. Поиск таких маркеров и разработка персонализированного подхода определяет научную новизну работы и несомненную практическую значимость.
Материалы и методы полностью адекватны поставленной цели. Авторами проведено пилотное проспективное одномоментное многоцентровое диагностическое исследование, направленное на анализ изменений маркеров костного метаболизма в различных биологических жидкостях до начала ортодонтического лечения, у детей с терминальной стадией ХБП и детей с дисфункцией трансплантата почки. Изучены показатели и у группы сравнения - практически здоровых детей и подростков без патологии мочевыделительной системы. Возраст и пол исследуемых пациентов сопоставим. Использованы адекватные методы исследования, проведена корректная статистическая обработка. Понятно представлен дизайн исследования, описаны критерии невключения в работу.
Полученные данные корректно описаны. Заключение соответствует поставленной цели. Наиболее значимые изменения маркеров ремоделирования кости выявлены у детей с терминальной ХБП. Определены перспективным для оценки ремоделирования кости маркеры.
Установленные сдвиги маркеров костного метаболизма подтверждают необходимость в разработке стратегии персонифицированного и мультидисциплинарного подхода к ортодонтическом лечению данной когорты пациентов.
Авторы в своей работе пользовались научной терминологией, полностью принятой в таких областях науки как патологическая физиология, стоматология, нефрология, клиническая лабораторная диагностика. Список использованной литературы валиден. Из представленных 37 литературных источников 32 - глубиной до пяти лет.
Работа представляет собой целостный законченный текст, разделы логичны, не противоречат друг другу. Стиль изложения понятный, применяемый английский язык представлен на достойном уровне.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1170_В |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 21.02.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Актуальность цели выполненного исследования достаточно высокая. Научная новизна и практическая значимость представленных результатов не вызывает сомнений.
Использованные в работе материалы и методы, вполне адекватны поставленной цели, статистическая обработка полученных данных соответствует их характеру.
Заключение в статье обосновано, сделано на основе глубокого и всестороннего анализа полученных результатов с использованием информативных и актуальных литературных источников.
Вся научная терминология в статье использована правильно и полностью соответствует принятой в рассматриваемой области знаний.
Использованные источники литературы валидные, современные, их цитирование является обоснованным и не вызывает сомнений.
Текст статьи является целостным и не содержит противоречий. Статья написана профессионально, академично, хорошим литературным языком, что существенно облегчает его восприятие и понимание сути работы.
В целом, представленная статья выполнена на высоком методическом уровне на актуальную тему, обладает научной новизной и высокой практической значимостью, ее результаты достаточно четко обоснованы и конкретны.







































