Перейти к:
Распространенность признаков пневмонии, ассоциированной с инфекцией COVID-19, на компьютерных томограммах органов грудной клетки у онкологических больных: исследование АРИЛИС
https://doi.org/10.47093/2218-7332.2025.16.2.4-17
Аннотация
Цель. Изучить распространенность признаков пневмонии, ассоциированной с коронавирусной инфекцией 2019 года (Coronavirus Disease 2019, COVID-19), у онкологических пациентов по данным компьютерной томографии (КТ) органов грудной клетки с помощью алгоритма искусственного интеллекта (ИИ).
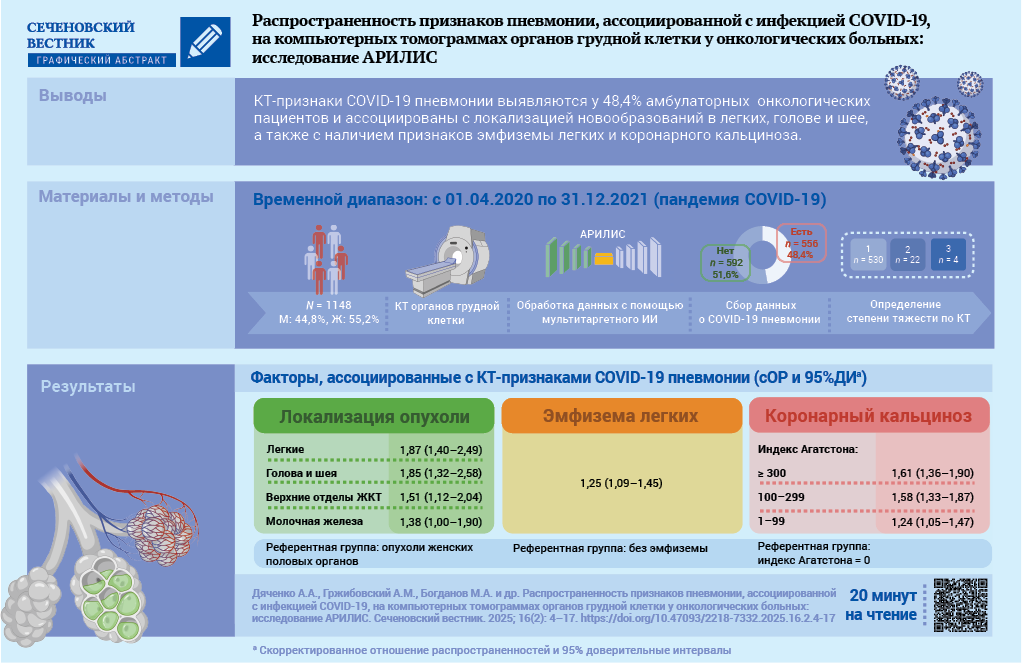
Материалы и методы. Проведено поперечное исследование в рамках проекта АРИЛИС. С помощью мультитаргетного ИИ проанализированы изображения КТ 1148 пациентов, проходивших обследование в Архангельском клиническом онкологическом диспансере за период с 01.04.2020 по 31.12.2021. Пациенты разделены на группы: без признаков пневмонии (n = 592, 51,6%) и с признаками пневмонии (n = 556, 48,4%). У 95,3% пациентов с пневмонией объем поражения составил менее 25% (КТ-1). С помощью многомерной регрессии Пуассона рассчитывали скорректированные отношения распространенностей (сОР, adjusted prevalence ratio) с 95% доверительными интервалами (ДИ).
Результаты. Для демографических признаков: пол, возраст, место жительства связи с наличием признаков пневмонии COVID-19 не установлено. Локализация опухоли ассоциирована с наличием признаков пневмонии COVID-19 (референтная группа – опухоли женских половых органов): рак легкого – сОР 1,87; 95% ДИ: 1,40–2,49; опухоли головы и шеи – сОР 1,85; 95%ДИ: 1,32–2,58; верхние отделы желудочно-кишечного тракта – сОР 1,51; 95% ДИ: 1,12–2,04; рак молочной железы – сОР 1,38; 95% ДИ: 1,00–1,90; р < 0,01. Наличие эмфиземы легких ассоциировано с признаками пневмонии COVID-19: сОР 1,25; 95% ДИ: 1,09–1,45, р = 0,002. С увеличением индекса Агатстона (Agatston score, AS) кальциноза коронарных артерий (референтная группа без кальциноза) увеличивалась ассоциация с наличием признаков пневмонии COVID-19 – для AS 1–99: сОР 1,24; 95% ДИ: 1,05–1,47; AS 100–299: сОР 1,58; 95% ДИ: 1,33–1,87; AS 300 и выше: сОР 1,61; 95% ДИ: 1,36–1,90; р < 0,001 для линейного тренда.
Заключение. Факторами, ассоциированными с выявлением пневмонии COVID-19, являются локализация новообразований в легком, органах головы и шеи, верхних отделах желудочно-кишечного тракта, молочной железе, а также наличие признаков эмфиземы и коронарного кальциноза по данным КТ.
Ключевые слова
Список сокращений:
- COVID-19 – COronaVIrus Disease 2019, коронавирусная инфекция 2019 года
- АКОД – Архангельский клинический онкологический диспансер
- ДИ – доверительный интервал
- ЖКТ – желудочно-кишечный тракт
- ЗНО – злокачественное новообразование
- ИИ – искусственный интеллект
- КТ – компьютерная томография
- МКБ-10 – Международная классификация болезней 10-го пересмотра
- НАО – Ненецкий автономный округ
- ОР – отношение распространенностей
- ОШ – отношение шансов
- ПРР – популяционный раковый регистр
- СНИЛС – страховой номер индивидуального лицевого счета
Пандемия коронавирусной инфекции 2019 года (Coronavirus Disease 2019, COVID-19) существенно повлияла на диагностику и лечение злокачественных новообразований (ЗНО). В период пандемии отмечалось существенное снижение показателей заболеваемости ЗНО в мире [1][2] и Российской Федерации [3], главным образом связанное с карантинными мерами. Программы скрининга рака молочной железы, шейки матки и других опухолей были приостановлены в период пандемии, а затем поэтапно возобновлены с учетом распределения времени посещений, чтобы обеспечить сокращение численности персонала и усиление режимов инфекционного контроля [4]. В Архангельской области во время пандемии COVID-19 уменьшение заболеваемости ЗНО произошло в основном за счет снижения выявления ранних стадий при раке шейки матки, легкого, ободочной и прямой кишки [5].
Компьютерная томография (КТ) органов грудной клетки по сравнению с другими методами лучевой диагностики имеет один из самых высоких показателей чувствительности в выявлении изменений в легких, характерных для пневмонии, ассоциированной с COVID-19. КТ позволяет диагностировать характерные изменения в легких у пациентов с COVID-19 еще до появления положительных лабораторных тестов на инфекцию [6]. В то же время алгоритмы искусственного интеллекта (ИИ) позволяют с высокой точностью диагностировать минимальные изменения в легких на КТ у пациентов с бессимптомной и легкой формами заболевания, которым не требуется госпитализация. Независимая оценка одного из них, разработанного ООО «АЙРА Лабс» (Москва, Россия) показала высокие операционные характеристики для выявления признаков пневмонии при COVID-19: площадь под кривой (Receiver Operating Characteristic Area Under the Curve, ROC AUC) – 0,98, чувствительность – 0,95, специфичность – 0,94 и точность – 0,94 [7].
В период пандемии COVID-19 популяционные раковые регистры (ПРР) с их большими размерами выборки и охватом населения имели хорошие возможности для мониторинга изменений распределения стадии при первичной диагностике и расчета выживаемости. При этом существовали трудности с определением точной стадии во время диагностики, поскольку хирургическое вмешательство и патологоанатомическая оценка задерживались. Учитывая, что КТ органов грудной клетки в период пандемии COVID-19 пациентам с ЗНО проводилась часто при амбулаторных посещениях и при госпитализации, признаки пневмонии, в том числе клинически невыраженной, также могли быть прослежены.
В 1998 году создан ПРР Архангельской области и Ненецкого автономного округа (НАО), с 2000 года он ведет удовлетворительную по полноте регистрацию и прослеживание пациентов с ЗНО от первичной постановки диагноза до исхода. Данные об умерших пациентах с ЗНО обновляются ежемесячно путем сопоставления списка умерших из Медицинского информационно-аналитического центра Архангельской области с базой данных регистра. Полнота, точность и своевременность данных регистра неоднократно подвергалась международным аудитам, в частности в ходе международных программ «Рак на пяти континентах», CONCORD, VENUSCANCER [8–10]. ПРР Архангельской области и НАО также располагает кодами непосредственных причин смерти онкологических пациентов, благодаря чему может рассчитывать опухолеспецифическую выживаемость, а также смертность от неопухолевых причин.
Цель исследования: изучить распространенность признаков пневмонии, ассоциированной с инфекцией COVID-19, у популяционной когорты пациентов с ЗНО по данным КТ органов грудной клетки с помощью алгоритма ИИ.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено поперечное исследование в рамках проекта АРхангельское исследование по влиянию мультицелевого искусственного Интеллекта для компьютерной томографии и на снижение неонкологических Летальных ИCходов у пациентов со злокачественными новообразованиями (АРИЛИС) [11].
Сбор данных
Для реализации поставленной цели из центрального архива медицинских изображений Архангельского клинического онкологического диспансера (АКОД) извлечены все серии КТ органов грудной клетки за период с 01.04.2020 по 31.12.2021, соответствующий периоду пандемии COVID-19.
КТ органов грудной клетки в этот период назначалась по двум основным показаниям: для планового уточнения диагностики и оценки распространенности ЗНО и для исключения признаков вирусной пневмонии, если в условиях стационара у пациента возникали симптомы COVID-19 (при этом на момент госпитализации выполнялось обязательное требование – отсутствие респираторных симптомов и отрицательный результат исследования мазка из ротоглотки и носа на вирус COVID-19). Всего за указанный период было выполнено 11 173 КТ-исследования, из которых 3533 были выполнены медицинскому персоналу и по каналу платных медицинских услуг пациентам без ЗНО.
Отбор валидных для обработки изображений осуществлялся с учетом ограничений алгоритма ИИ, в частности исключены случаи ателектаза легкого на основании протоколов описаний врачей-рентгенологов, серии КТ с внутривенным контрастированием на основании анализа DICOM тега (ProtocolName Tag 0018,1030),
После процедуры деидентификации все валидные серии КТ были направлены на анализ ИИ от ООО «АЙРА Лабс» (Москва, Россия). На этом этапе исключены случаи с выраженными двигательными артефактами, толщиной среза более 1,5 мм и неполной зоной сканирования легких. Общее число пациентов с валидными исследованиями КТ составило 1542.
После обработки всех изображений алгоритмом ИИ они были направлены по защищенному каналу в АКОД по ключу – страховому номеру индивидуального лицевого счета (СНИЛС), и объединены с базой данных ПРР Архангельской области и НАО, выгруженной 15.04.2024. Общая база данных ПРР содержала в себе сведения о 137 773 пациентах, зарегистрированных с диагнозом ЗНО на дату выгрузки, данные о СНИЛС были доступны у 62 988 пациентов. Данные о СНИЛС в ПРР Архангельской области и НАО заполняются с 1 января 2021 года для всех впервые зарегистрированных пациентов, а также в течение 2021 года номер СНИЛС был внесен для пациентов диспансерной категории. За весь период регистрации (01.01.2000–15.04.2024) полнота данных сведений о номере СНИЛС составила 45,7%. Выгрузка данных из ПРР была необходима для установления причин смерти пациентов при наличии у них данных СНИЛС. Из числа пациентов с валидными исследованиями КТ 394 пациента имели онкологическое заболевание, однако их данные СНИЛС были недоступны, что сделало невозможным оценку исходов (часть исследования АРИЛИС по оценке исходов рассматривается как самостоятельная и будет представлена отдельно). Пациенты без данных СНИЛС исключены из исследования.
В итоговый анализ включены 1148 пациентов (рис. 1).
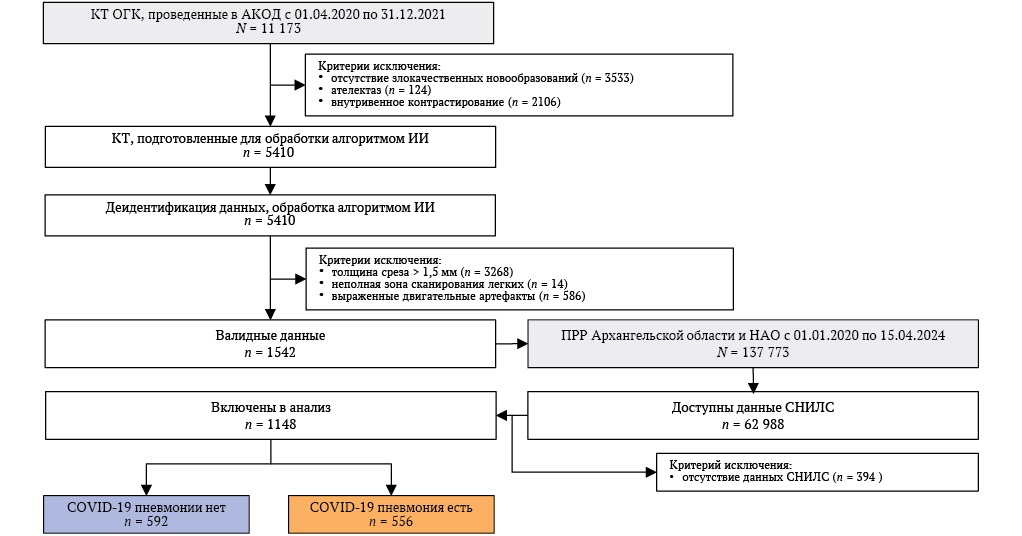
РИС. 1. Схема включения пациентов в исследование.
Примечание: АКОД – Архангельский клинический онкологический диспансер; ИИ – искусственный интеллект; КТ ОГК – компьютерная томография органов грудной клетки; НАО – Ненецкий автономный округ; ПРР – популяционный регистр рака; СНИЛС – страховой номер индивидуального лицевого счета.
Объединенная база данных для анализа содержала следующие переменные: служебный код пациента, СНИЛС, возраст на момент проведения КТ, пол, тип населенного пункта места жительства, код диагноза ЗНО по Международной классификации болезней 10-го пересмотра (МКБ-10). Все переменные за рассматриваемый период имели 100% полноту данных.
Алгоритм диагностики пневмонии, ассоциированной с инфекцией COVID-19
Для диагностики качественных и количественных (процент поражения) инфильтративных изменений в легких, характерных для вирусной пневмонии COVID-19 в условиях пандемии (U07 по МКБ-10) [12], использовалось медицинское изделие, разработанное OOO «АЙРА Лабс» (Москва, Россия) – «Программное обеспечение для анализа исследований КТ с помощью технологии ИИ “Intelligent Radiology Assistants” по ТУ 58.29.32-001-44270315-2021» OOO «АЙРА Лабс» (Москва, Россия) регистрационное удостоверение Росздравнадзора № РЗН 2024/228951 (рис. 2).
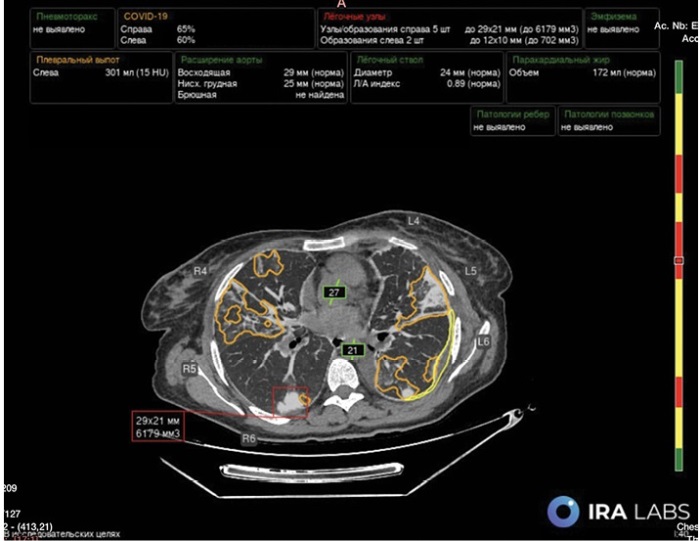
РИС. 2. Результат обработки изображений компьютерной томографии органов грудной клетки с помощью мультитаргетной технологии искусственного интеллекта.
Примечание: поражение легочной ткани пневмонией, ассоциированной с COVID-19 (оранжевый) представлено в процентах для каждого легкого; также выделены: узел в легком (красный) и представлены его размеры и объем, жидкость в плевральной полости (желтый) с расчетом объема и единиц денситометрической плотности, диаметры сосудов (зеленый).
В зависимости от наличия или отсутствия признаков пневмонии, ассоциированной с COVID-19, все включенные в базу данных пациенты (n = 1148) были разделены на две группы: без признаков пневмонии (n = 592, 51,6%) и с признаками пневмонии (n = 556, 48,4%). При этом у большинства пациентов во второй группе – 530 (95,3%) объем поражения составил менее 25% (КТ-1), признаки умеренно тяжелой (КТ-2) и среднетяжелой (КТ-3) пневмонии установлены у 22 (4%) и 4 (0,7%) пациентов.
Использованное программное обеспечение располагает алгоритмом мультитаргетного ИИ, что позволило оценить наличие эмфиземы легких, диаметра аорты и легочного ствола, кальциноза коронарных артерий и плотность костной ткани тел грудных позвонков (рис. 2).
Статистическая обработка данных
Для удобства анализа и интерпретации его результатов все переменные были представлены в виде порядковых (возраст, кальциноз коронарных артерий, плотность костной ткани), номинальных (код диагноза/группы ЗНО по МКБ-10) и биномиальных (пол, эмфизема легких, аневризма/дилатация аорты, дилатация легочного ствола). Для сравнения распределения частот использовался критерий хи-квадрат Пирсона.
В качестве меры силы связи рассчитывали нескорректированные (одномерные) и скорректированные (многомерные) отношения распространенностей (ОР, prevalence ratio) и 95% доверительные интервалы (ДИ). Расчет ОР проводился по формуле, представленной ниже, с помощью одномерной и многомерной регрессии Пуассона, которая, в отличие от широко распространенной логистической регрессии, не дает завышенных мер эффекта при высокой распространенности результативного признака. В многомерную регрессионную модель включали только те факторные признаки, которые были связаны с рентгенологическими признаками пневмонии на КТ на уровне значимости менее 0,15.

В качестве референтных категорий использовали возраст до 40 лет, проживание в городской местности, отсутствие признаков эмфиземы легких, дилатации аорты и остеопороза, ЗНО женских половых органов (блок МКБ С51–58), а также отсутствие признаков кальциноза коронарных артерий. Для ранговых переменных рассчитывали уровень значимости для линейного тренда посредством включения категорий, указанных в таблице, в виде непрерывных переменных.
Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принимался равным 0,05.
Статистический анализ выполняли с помощью пакета статистических программ Stata, v.18 (Stata Corp., TX, USA).
РЕЗУЛЬТАТЫ
Распределение признаков в зависимости от принадлежности к изученным группам представлено в таблице 1.
Таблица 1. Характеристики групп
|
Признак |
Всего (n = 1148) |
COVID-19 пневмонии нет (n = 592) |
COVID-19 пневмония (n = 556) |
Значение p |
|
Пол |
||||
|
женский |
634 (55,2) |
374 (63,2) |
260 (46,8) |
<0,001 |
|
мужской |
514 (44,8) |
218 (36,8) |
296 (53,2) |
|
|
Возраст, лет |
||||
|
0–39 |
43 (3,8) |
27 (4,6) |
16 (2,9) |
0,002 |
|
40–49 |
115 (10) |
72 (12,2) |
43 (7,7) |
|
|
50–59 |
236 (20,6) |
126 (21,3) |
110 (19,8) |
|
|
60–69 |
456 (39,7) |
238 (40,2) |
218 (39,2) |
|
|
70–79 |
250 (21,8) |
113 (19,1) |
137 (24,6) |
|
|
80 и старше |
48 (4,1) |
16 (2,6) |
32 (5,8) |
|
|
Место жительства |
||||
|
город |
860 (74) |
457 (72,5) |
403 (74,9) |
n.s. |
|
сельская местность |
288 (26) |
135 (27,5) |
153 (25,1) |
|
|
Коды МКБ-10, нозологии |
||||
|
С51–58, ЗНО женских половых органов |
122 (10,6) |
80 (13,5) |
42 (7,6) |
<0,001 |
|
С0–14, С30–32, ЗНО головы и шеи |
47 (4,1) |
19 (3,2) |
28 (5,0) |
|
|
С15, С16, ЗНО верхних отделов ЖКТ |
140 (12,2) |
60 (10,1) |
80 (14,4) |
|
|
С18–25, ЗНО нижних отделов ЖКТ |
238 (20,7) |
148 (25,0) |
90 (16,2) |
|
|
С34, рак легкого |
185 (16,1) |
55 (9,3) |
130 (23,4) |
|
|
С43–49, ЗНО кожи и мягких тканей |
74 (6,5) |
37 (6,3) |
37 (6,6) |
|
|
С50, рак молочной железы |
151 (13,2) |
79 (13,3) |
72 (13,0) |
|
|
С61, рак предстательной железы |
50 (4,4) |
29 (4,9) |
21 (3,7) |
|
|
С64–68, ЗНО мочевых путей |
76 (6,6) |
39 (6,6) |
37 (6,7) |
|
|
Другие ЗНО |
65 (5,6) |
46 (7,8) |
19 (3,4) |
|
|
Эмфизема легких |
||||
|
нет |
1064 (92,7) |
574 (97,0) |
490 (88,1) |
<0,001 |
|
выявлена |
84 (7,3) |
18 (3,0) |
66 (11,9) |
|
|
Аневризма аорты |
||||
|
нет |
1125 (98,4) |
581 (98,6) |
544 (98,2) |
n.s. |
|
выявлена |
18 (1,6) |
8 (1,4) |
10 (1,8) |
|
|
Дилатация аорты |
||||
|
нет |
777 (68,0) |
426 (72,3) |
351 (63,4) |
0,001 |
|
выявлена |
366 (32,0) |
163 (27,7) |
203 (36,6) |
|
|
Расширение легочного ствола |
||||
|
нет |
627 (65,8) |
305 (67,8) |
322 (64,0) |
n.s. |
|
выявлено |
326 (34,2) |
145 (32,2) |
181 (36,0) |
|
|
Кальциноз коронарных артерий, индекс Агатстона |
||||
|
0 |
518 (47,3) |
321 (57,6) |
197 (36,5) |
<0,001 |
|
1–99 |
264 (24,1) |
133 (23,9) |
131 (24,3) |
|
|
100–299 |
139 (12,7) |
48 (8,6) |
91 (16,9) |
|
|
300 и выше |
175 (16,0) |
55 (9,9) |
120 (22,3) |
|
|
Остеопороз, остеопения |
||||
|
нет |
355 (32,3) |
201 (35,5) |
154 (28,8) |
<0,05 |
|
остеопения |
428 (38,9) |
214 (37,9) |
214 (40,0) |
|
|
остеопороз |
317 (28,8) |
150 (26,6) |
167 (31,2) |
|
Примечания: Данные представлены как абсолютное число пациентов с признаком и доля в группе, выраженная в процентах (в круглых скобках). Патологические признаки аневризмы и дилатации аорты, расширения легочного ствола, коронарного кальциноза, остеопении определены не на всех сериях КТ из-за неполной визуализации органов или ограничений алгоритма.
COVID-19 – COronaVIrus Disease 2019 – коронавирусная инфекция 2019 года; n.s. – not significant, не значимо; ЖКТ – желудочно-кишечный тракт; ЗНО – злокачественные новообразования; КТ – компьютерная томография; МКБ-10 – Международная классификация болезней 10-го пересмотра.
В анализируемой когорте распределение по полу было примерно одинаковым, при этом признаки пневмонии на КТ значительно чаще выявлялись у мужчин. Распределение возрастных категорий было смещено в более старшие возрастные группы у пациентов с пневмонией COVID-19 (табл. 1).
В исследуемой популяции наиболее частыми локализациями опухоли служили нижний отдел желудочно-кишечного тракта (ЖКТ) – 20,7%, рак легкого – 16,1%, рак молочной железы – 13,2%, рак верхних отделов ЖКТ – 12,2%. Частота выявления пневмонии существенно различалась в зависимости от локализации опухоли: максимальная частота отмечена у пациентов при раке легкого – 70,3%, далее следовали ЗНО области головы и шеи – 59,6% и верхних отделов желудочно-кишечного тракта – 57,1%. При ЗНО кожи и мягких тканей частота пневмонии COVID-19 составила 50%, при раке молочной железы – 47,7%, предстательной железы – 42%, при ЗНО мочевых путей – 48,7%, нижних отделов ЖКТ – 37,8%, женских половых органов – 34,4% и других локализаций – 29,2% (табл. 1).
Индикаторы сердечно-сосудистой, легочной патологии, а также признаки остеопороза, выявленные мультитаргетным алгоритмом ИИ на КТ, были неравномерно распределены. Признаки эмфиземы легких, дилатации аорты, наличие и выраженность кальциноза коронарных артерий и остеопороза были выше в группе с признаками COVID-19 пневмонии. В то же время среди пациентов обеих групп не установлено значимых различий в распределении случаев аневризмы/дилатации аорты и расширения легочного ствола.
Результаты одномерного и многомерного анализа по Пуассону представлены в таблице 2.
Таблица 2. Оценка связи между наличием признаков COVID-19 пневмонии и изученными признаками
|
Признак |
нОР c 95% ДИ |
Значение p |
сОР c 95% ДИ |
Значение p |
|
Пол |
||||
|
женский |
1,00 (реф.) |
<0,001a |
1,00 (реф.) |
n.s. |
|
мужской |
1,40 (1,25–1,58) |
1,15 (0,98–1,35) |
||
|
Возраст, лет |
||||
|
0–39 |
1,00 (реф.) |
<0,001 |
1,00 (реф.) |
n.s.a |
|
40–49 |
1,00 (0,64–1,58) |
0,87 (0,56–1,36) |
||
|
50–59 |
1,25 (0,83–1,89) |
0,86 (0,56–1,30) |
||
|
60–69 |
1,28 (0,86–1,92) |
0,80 (0,53–1,21) |
||
|
70–79 |
1,47 (0,98–2,21) |
0,95 (0,63–1,45) |
||
|
80 и старше |
1,79 (1,16–2,77) |
1,09 (0,69–1,71) |
||
|
Место жительства |
||||
|
город |
1,00 (реф.) |
n.s. |
1,00 (реф.) |
n.s. |
|
сельская местность |
1,13 (1,00–1,29) |
1,06 (0,93–1,20) |
||
|
Коды МКБ-10, нозологии |
||||
|
С51–58, ЗНО женских половых органов |
1,00 (реф.) |
<0,001 |
1,00 (реф.) |
<0,001 |
|
С0–14, С30–32, ЗНО головы и шеи |
1,73 (1,23–2,43) |
1,85 (1,32–2,58) |
||
|
С15, С16, ЗНО верхних отделов ЖКТ |
1,66 (1,25–2,20) |
1,51 (1,12–2,04) |
||
|
С18–25, ЗНО нижних отделов ЖКТ |
1,10 (0,82–2,47) |
1,06 (0,78–1,45) |
||
|
С34, рак легкого |
2,04 (1,57–2,65) |
1,87 (1,40–2,49) |
||
|
С43–49, ЗНО кожи и мягких тканей |
1,45 (1,04–2,03) |
1,40 (0,99–1,93) |
||
|
С50, рак молочной железы |
1,39 (1,03–1,86) |
1,38 (1,00–1,90) |
||
|
С61, рак предстательной железы |
1,22 (0,81–1,83) |
1,07 (0,70–1,63) |
||
|
С64–68, ЗНО мочевых путей |
1,41 (1,01–1,98) |
1,39 (0,98–1,98) |
||
|
Другие ЗНО |
0,85 (0,54–1,33) |
0,78 (0,48–1,25) |
||
|
Эмфизема легких |
||||
|
нет |
1,00 (реф.) |
<0,001 |
1,00 (реф.) |
0,002 |
|
выявлена |
1,71 (1,50–1,94) |
1,25 (1,09–1,45) |
||
|
Дилатация аорты |
||||
|
нет |
1,00 (реф.) |
<0,001 |
1,00 (реф.) |
n.s. |
|
выявлена |
1,23 (1,09–1,38) |
0,96 (0,85–1,10 ) |
||
|
Кальциноз коронарных артерий, индекс Агатстона |
||||
|
0 |
1,00 (реф.) |
<0,001a |
1,00 (реф.) |
<0,001a |
|
1–99 |
1,30 (1,11–1,54) |
1,24 (1,05–1,47) |
||
|
100–299 |
1,72 (1,46–2,03) |
1,58 (1,33–1,87) |
||
|
300 и выше |
1,80 (1,55–2,09) |
1,61 (1,36–1,90) |
||
|
Остеопороз, остеопения |
||||
|
нет |
1,00 (реф.) |
0,015a |
1,00 (реф.) |
n.s.a |
|
остеопения |
1,15 (1,00–1,33) |
1,11 (0,95–1,27) |
||
|
остеопороз |
1,21 (1,05–1,39) |
1,10 (0,93–1,29) |
||
Примечания: a р для линейного тренда.
COVID-19 – COronaVIrus Disease 2019 – коронавирусная инфекция 2019 года; n.s. – not significant, не значимо; ДИ – доверительный интервал; ЖКТ – желудочно-кишечный тракт; ЗНО – злокачественные новообразования; КТ – компьютерная томография; МКБ-10 – Международная классификация болезней 10-го пересмотра; нОР – нескорректированное отношение распространенностей; реф. – референтная категория; сОР – скорректированное отношение распространенностей.
В нескорректированной модели распространенность признаков пневмонии у мужчин была значимо выше (на 40%), чем у женщин, но после коррекции на другие учтенные факторы различия распространенности в зависимости от пола оказались незначимыми. Распространенность признаков COVD-19 по данным КТ прогрессивно увеличивалась с возрастом (р < 0,001 для тренда), но межгрупповые различия достигали уровня статистической значимости только для возрастной группы 80 и старше, в которой признаки COVD-19 регистрировались в 1,8 раза чаще, чем в референтной группе (моложе 40). В то же время после включения остальных переменных в многомерную модель все возрастные различия в распространенности признаков COVD-19 нивелировались.
Жители сельской местности имели на 13% более высокую распространенность признаков COVD-19 по данным КТ в одномерном анализе, но различия не достигли уровня статистической значимости (р = 0,058). В многомерной модели различий между онкологическими пациентами из города и села в распространенности признаков COVID-19 выявлено не было.
Распространенность признаков пневмонии, ассоциированной с COVID-19 в многомерной модели при раке легкого, ЗНО головы и шеи, а также верхних отделов ЖКТ была на 51–87% выше, чем при ЗНО женских половых органов. Значимо более высокой она была также при раке молочной железы. При ЗНО нижних отделов ЖКТ и раке предстательной железы распространенность признаков пневмонии значимо не отличалась от референтной группы.
Признаки эмфиземы легких были значимо связаны с COVID-19 как в одномерном, так и в многомерном анализе. У пациентов с эмфиземой легких после поправки на все доступные факторы распространенность признаков пневмонии, ассоциированной с COVID-19, была на 25% выше, чем у лиц без признаков эмфиземы.
Рентгенологические признаки аневризмы или дилатации аорты были значимо связаны с COVID-19 в одномерном анализе, однако независимых связей между этим признаком и признаками пневмонии на КТ выявлено не было. Другой потенциальный предиктор повышенной сердечно-сосудистой смертности – уровень кальциноза коронарных артерий, измеренный по Агатстону – и в одномерном анализе, и в многомерной модели был ассоциирован с большей вероятностью пневмонии COVID-19. Скорректированные ОР признаков пневмонии возрастали с 1,24 (95% ДИ 1,05–1,47) до 1,61 (95% ДИ 1,36–1,90) при индексе 1–99 – 300 и выше по сравнению с референтной группой без кальциноза коронарных артерий. Аневризма аорты и расширение легочного ствола были связаны с признаками пневмонии по данным КТ на уровне значимости более 0,15 при одномерном моделировании и не были включены в многомерную модель.
Распространенность признаков COVID-19 прогрессивно возрастала с увеличением интенсивности остеопороза (р = 0,015 для тренда) в одномерном анализе. После включения в модель остальных факторов ОР уменьшились до статистически незначимых.
ОБСУЖДЕНИЕ
В нашем исследовании установлено, что у половины пациентов с ЗНО, обратившихся в АКОД в 2020–2021 гг. для специального лечения, были выявлены признаки пневмонии, ассоциированной с инфекцией COVID-19, при этом объем поражения не превышал 25% в большинстве случаев. Определены независимые факторы, ассоциированные с выявлением признаков пневмонии COVID-19: локализация новообразований в легком, органах головы и шеи, верхних отделах ЖКТ, а также наличие признаков эмфиземы и коронарного кальциноза по данным КТ.
Пандемия COVID-19 оказала большое влияние на организацию диагностики и лечения ЗНО: уровень смертности у госпитализированных составлял до 23,4% [13], в основном от пневмонии на фоне возрастания частоты тромбозов в 3–15 раз [14]. Примерно у 15–30% госпитализированных больных развивается острый респираторный дистресс-синдром, что приводит к повышению риска смерти [15]. Объем поражения легочной ткани по данным КТ является предиктором смертности от COVID-19-ассоциированной пневмонии [16]. Пневмония, ассоциированная с COVID-19, может протекать бессимптомно у 50% пациентов [17][18], с чем согласуются данные нашего исследования.
Факторы риска тяжелого течения заболевания включают пожилой возраст, мужской пол и сопутствующие заболевания. В нашем исследовании возраст и мужской пол не были независимыми факторами риска пневмонии COVID-19. В то же время у пожилых пациентов и мужчин в общей популяции присутствует более высокий риск поражения коронарных сосудов и выявления эмфиземы – факторов, которые в нашем исследовании показали независимое влияние на риск пневмонии. Это подчеркивает необходимость комплексного подхода к оценке риска пневмонии.
В нашем анализе у больных раком легкого, ЗНО верхнего отдела ЖКТ, головы и шеи распространенность признаков пневмонии была существенно выше, чем в среднем по когорте. Известным и наиболее важным модифицируемым фактором риска этих ЗНО является курение. Хотя некоторые ранние исследования указывали на защитную связь между курением и тяжестью течения COVID-19 (так называемый «парадокс курильщика» [19], большинство авторов связывает курение табака с повышенным риском симптоматической инфекции SARS-CoV-2, а также повышенным риском прогрессирования заболевания [20][21]. В более позднем анализе из США текущее курение табака было значимо связано с повышенным риском госпитализации (отношение шансов (ОШ) 1,72; 95% ДИ: 1,62–1,82; p < 0,001), поступления в отделение интенсивной терапии (ОШ 1,22; 95% ДИ: 1,10–1,34; p < 0,001) и смерти от всех причин (ОШ 1,37; 95% ДИ: 1,20–1,57; р < 0,001) после поправки на другие факторы [22]. Наше предположение о связи курения и вероятности выявления затемнений на КТ также подтверждается тем фактом, что признаки пневмонии чаще выявлялись у мужчин, в большей степени подверженных привычке курения.
Среди сервисов ИИ для здравоохранения наибольшее количество продуктов было создано для лучевой диагностики2. В РФ самым большим проектом, использующим ИИ для лучевой диагностики, является Эксперимент по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения города Москвы, в рамках которого было обработано более 12 миллионов лучевых исследований. В этом проекте ООО «АЙРА Лабс» возглавляет матрицу зрелости среди комплексных ИИ для КТ органов грудной клетки по качеству работы (ROC AUC) [7]. Использование данного алгоритма позволяет чаще, чем при работе без использования ИИ, выявлять признаки пневмонии.
Сильной стороной исследования является его популяционный характер, для анализа были взяты все доступные КТ для анализа. Полнота записей в базе данных ПРР была ранее оценена и находится на высоком уровне. Так, соотношение M:I (mortality/incidence ratio) в ПРР Архангельской области и НАО за период 2008–2017 гг. составляет 0,58, что позволяет сравнивать данные с регистрами Восточной Европы. Уровень DCO (death certificate only, только свидетельство о смерти) составляет 4,5%, что объясняется большим количеством проведенных случаев аутопсий на пациентов с ЗНО (более 60%). Разница между случаями заболеваний, зарегистрированных в ПРР за период 2008–2017 гг. и внесенными в годовой отчет за каждый отчетный период и данными о случаях заболеваемости спустя 5 лет после сдачи годового отчета, составляет менее 3% [10].
Достоверные данные о пациентах в ПРР позволили оценить распространенность инфекционного поражения легких в когорте, представляющей популяцию пациентов с ЗНО, и обеспечить высокую статистическую мощность. Кроме того, важным преимуществом нашего анализа является использование объективных рентгенологических критериев патологии, выявленной ИИ на КТ. Это позволило установить, что более высокая вероятность вирусной пневмонии была связана с хроническими заболеваниями легких (эмфизема) и коронарных сосудов.
Ограничения исследования
КТ органов грудной клетки использовали как для уточняющей диагностики и оценки распространенности ЗНО, так и при возникновении симптомов COVID-19. Отдельно обозначить эти потоки в условиях выбранного дизайна исследования невозможно. Однако по существовавшим в период пандемии правилам госпитализация в стационар подразумевала исходное подтверждение отсутствия заболевания. Поэтому риск заражения во время госпитализации можно считать случайным и зависящим только от факторов, которые были проанализированы.
В условиях исследования невозможно сопоставить обнаруженные данные о признаках пневмонии на КТ с результатами исследования респираторных образцов на SARS-CoV-2 методом полимеразной цепной реакции (ПЦР). Однако в период пандемии COVID-19 другие вирусные инфекции крайне редко вызывали пневмонию [23]. Кроме того, в значительной части случаев ПЦР-анализ мазка из носоглотки давал отрицательный результат даже при явных клинических проявлениях инфекции. В большинстве таких случаев COVID-19 был в дальнейшем подтвержден либо повторными исследованиями респираторных образцов, либо ростом антител к коронавирусу в сыворотке крови [24].
Недостаточна полнота сведений о СНИЛС, внесенных в ПРР Архангельской области и НАО. Однако мы исходим из предположения, что большая часть пациентов, которым была проведена КТ органов грудной клетки в период 01.04.2020–31.12.2021, входит в диспансерную категорию пациентов на начало 2021 года. На основе информации о проведенном КТ и валидированном ИИ на 1542 пациентах удалось сопоставить данные с раковым регистром и выявить 74,4% совпадений.
Регистр рака не собирает сведения о курении, поэтому в рамках нашего популяционного анализа невозможно установить независимое влияние этого фактора на риск выявления признаков пневмонии на КТ.
Направления для дальнейших исследований
Клиническое значение случайно обнаруженных признаков пневмонии на КТ у пациентов с ЗНО в дальнейшем будет оценено в рамках анализа их выживаемости и причин смерти.
В ряде исследований возраст был независимым фактором риска смерти при пневмонии COVID-19 [25][26], поэтому в последующем мы планируем проанализировать общую выживаемость пациентов в нашей когорте, в том числе, в зависимости от возраста.
ЗАКЛЮЧЕНИЕ
В представленном анализе у половины пациентов, поступавших в стационар и обследовавшихся в онкологическом диспансере Архангельской области в период пандемии COVID-19, обнаружены признаки пневмонии по данным КТ органов грудной клетки. Независимыми факторами, ассоциированными с выявлением признаков пневмонии COVID-19, являются: локализация новообразований в легком, органах головы и шеи, верхних отделах ЖКТ, молочной железе, а также наличие признаков эмфиземы и коронарного кальциноза по данным КТ.
ВКЛАД АВТОРОВ
А.А. Дяченко – разработка концепции исследования, разработка методологии, анализ работы, составление черновика рукописи, критический пересмотр текста, интерпретация результатов исследования, окончательное утверждение рукописи. А.М. Гржибовский – разработка методологии, статистический анализ и его интерпретация, критический пересмотр текста, интерпретация результатов исследования. М.А. Богданов, Д.В. Богданов, В.Ю. Чернина – анализ работы, критический пересмотр текста, интерпретация результатов исследования. Е.А. Назарова – анализ работы, критический пересмотр текста, интерпретация результатов исследования. А.А. Мелдо, М.Г. Беляев – критический пересмотр текста, интерпретация результатов исследования. В.А. Гомболевский, М.Ю. Вальков – научное руководство, разработка концепции исследования, развитие методологии, критический пересмотр текста, интерпретация результатов исследования. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTION
Andrey A. Dyachenko – development of the research concept, development of the methodology, analysis of the work, drafting the manuscript, critical revision of the text, interpretation of the research results, final approval of the manuscript. Andrej M. Grjibovski – development of the methodology, statistical analysis and its interpretation, critical revision of the text, interpretation of the research results. Maxim A. Bogdanov, Dmitriy V. Bogdanov, Valeria Yu. Chernina – analysis of the work, critical revision of the text, interpretation of the research results. Ekaterina A. Nazarova – analysis of the work, critical revision of the text, interpretation of the research results. Anna A. Meldo, Mikhail G. Belyaev – critical revision of the text, interpretation of the research results. Victor A. Gombolevsky, Mikhail Yu. Valkov – scientific supervision, development of the research concept, development of the methodology, critical revision of the text, interpretation of the research results. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено в соответствии с разрешением Локального этического комитета Северного государственного медицинского университета (№ 07/10-238, 2023 г.).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу. Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Чернина В.Ю. – руководитель отдела клинической оценки компании ООО «АЙРА Лабс», Беляев М.Ю. – генеральный директор компании ООО «АЙРА Лабс», Гомболевский В.А. – советник компании ООО «АЙРА Лабс».
Финансирование. Исследование проведено за счет средств и ресурсов компании «АЙРА Лабс».
Благодарность. Коллектив авторов выражает благодарность сотрудникам отделения лучевой диагностики ГБУЗ АО «Архангельский клинический онкологический диспансер» за интенсивную работу по сбору данных в период пандемии COVID-19. Также коллектив авторов благодарит сотрудников популяционного ракового регистра Архангельской области и Ненецкого автономного округа за сбор, анализ и интерпретацию данных о пациентах со злокачественными новообразованиями из двух регионов Российской Федерации на протяжении более двух десятков лет, что является поистине уникальным для страны.
Ethics statements. The study was conducted in accordance with the permission of the Local Bioethics Committee of the Northern State Medical University, No 07/10-238, 2023.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. Valeria Yu. Chernina – Head of the Clinical Evaluation Department of the LLC “IRA Labs”, Mikhail Yu. Belyaev – General Director of the LLC “IRA Labs”, Viktor A. Gombolevsky – Advisor of the LLC “IRA Labs”.
Financing. The study was conducted using funds and resources from LLC “IRA Labs”.
Acknowledgments. The authors express their gratitude to the staff of the radiation diagnostics department of the “AСOD” for their intensive work on data collection during the COVID-19 pandemic. The authors also thank the staff of the population cancer registry of the Arkhangelsk Region and the Nenets Autonomous Okrug for collecting, analyzing and interpreting data on patients with malignant neoplasms from two regions of the Russian Federation for more than two decades, which is truly unique for the country.
1. Сайт Федеральной службы по надзору в сфере здравоохранения. Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий. https://roszdravnadzor.gov.ru/services/misearch (дата обращения: 10.12.2024).
2. FDA. Artificial Intelligence and Machine Learning (AI/ML)-Enabled Medical Devices. Internet-resource. Available at https://www.fda.gov/medical-devices/software-medical-device-samd/artificial-intelligence-and-machine-learning-aiml-enabled-medical-devices (дата обращения: 12.12.2024).
Список литературы
1. Dinmohamed A.G., Visser O., Verhoeven R.H.A., et al. Fewer cancer diagnoses during the COVID-19 epidemic in the Netherlands. Lancet Oncol. 2020 Jun; 21(6): 750–751. doi: 10.1016/S1470-2045(20)30265-5. Epub 2020 Apr 30. Erratum in: Lancet Oncol. 2020 Jun; 21(6): e304. https://doi.org/10.1016/S1470-2045(20)30267-9. PMID: 32359403
2. Barclay N.L., Pineda Moncusí M., Jödicke A.M., et al. The impact of the UK COVID-19 lockdown on the screening, diagnostics and incidence of breast, colorectal, lung and prostate cancer in the UK: a population-based cohort study. Front Oncol. 2024 Mar 27; 14: 1370862. https://doi.org/10.3389/fonc.2024.1370862. PMID: 38601756
3. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой Злокачественные новообразования в России в 2020 году ( заболеваемость и смертность) – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 252 с.
4. Lohfeld L., Sharma M., Bennett D., et al. Impact of the COVID-19 pandemic on breast cancer patient pathways and outcomes in the United Kingdom and the Republic of Ireland – a scoping review. Br J Cancer. 2024 Sep; 131(4): 619–626. https://doi.org/10.1038/s41416-024-02703-w. Epub 2024 May 4. Erratum in: Br J Cancer. 2024 Sep; 131(4): 778. https://doi.org/10.1038/s41416-024-02791-8. PMID: 38704477
5. Валькова Л.Е., Дяченко А.А., Мерабишвили В.М. и др. Влияние пандемии COVID-19 на показатели заболеваемости злокачественными опухолями, подлежащими скринингу в рамках диспансеризации (популяционное исследование). Сибирский онкологический журнал. 2022; 21(6): 7–16. https://doi.org/10.21294/1814-4861-2022-21-6-7-16. EDN: COFCHN
6. Котляров П.М., Сергеев Н.И., Солодкий В.А., Солдатов Д.Г. Мультиспиральная компьютерная томография в ранней диагностике пневмонии, вызванной SARS-CoV-2, Пульмонология. 2020; 30(5): 561–568. https://doi.org/10.18093/0869-0189-2020-30-5-561-568. EDN: RJGOCV
7. Чернина В.Ю., Беляев М.Г., Силин А.Ю. и др. Диагностическая и экономическая оценка применения комплексного алгоритма искусственного интеллекта, направленного на выявление десяти патологических находок по данным компьютерной томографии органов грудной клетки. Digital Diagnostics. 2023; 4(2): 105–132. https://doi.org/10.17816/DD321963. EDN: UGUJWJ
8. Allemani C., Matsuda T., Di Carlo V., et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018 Mar 17; 391(10125): 1023–1075. https://doi.org/10.1016/S0140-6736(17)33326-3. Epub 2018 Jan 31. PMID: 2939526
9. Allemani C., Weir H.K., Carreira H., et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2). Lancet. 2015 Mar 14; 385(9972): 977–1010. https://doi.org/10.1016/S0140-6736(14)62038-9. Epub 2014 Nov 26. Erratum in: Lancet. 2015 Mar 14; 385(9972): 946. PMID: 25467588
10. Barchuk A., Tursun-Zade R., Nazarova E., et al. Completeness of regional cancer registry data in Northwest Russia 2008-2017. BMC Cancer. 2023 Oct 18; 23(1): 994. https://doi.org/10.1186/s12885-023-11492-z. PMID: 37853404
11. Вальков М.Ю., Гржибовский А.М., Кудрявцев А.В. и др. Использование искусственного интеллекта для прогнозирования и предотвращении неонкологической смертности у онкологических больных: протокол исследования АРИЛИС. Экология человека. 2024; 31(4): 314–330. https://doi.org/10.17816/humeco635357. EDN: DDFTVK
12. Морозов С.П., Гомболевский В.А., Чернина В.Ю. и др. Прогнозирование летальных исходов при COVID-19 по данным компьютерной томографии органов грудной клетки. Туберкулез и болезни легких. 2020; 98(6): 7–14. https://doi.org/10.21292/2075-1230-2020-98-6-7-14. EDN: IBBYVG /
13. Jazieh A.R., Bounedjar A., Abdel-Razeq H., et al. Impact of COVID-19 on Management and Outcomes of Oncology Patients: Results of MENA COVID-19 and Cancer Registry (MCCR). J Immunother Precis Oncol. 2024 May 2; 7(2): 82–88. https://doi.org/10.36401/JIPO-23-38. PMID: 38721403
14. Keene S., Abbasizanjani H., Torabi F., et al. Risks of major arterial and venous thrombotic diseases after hospitalisation for influenza, pneumonia, and COVID-19: A population-wide cohort in 2.6 million people in Wales. Thromb Res. 2025 Jan; 245: 109213. https://doi.org/10.1016/j.thromres.2024.109213. Epub 2024 Nov 19. PMID: 39608301
15. Attaway A.H., Scheraga R.G., Bhimraj A., et al. Severe covid-19 pneumonia: pathogenesis and clinical management. BMJ. 2021 Mar 10; 372: n436. https://doi.org/10.1136/bmj.n436. PMID: 33692022
16. Fan L., Wu S., Wu Y., et al. Clinical data and quantitative CT parameters combined with machine learning to predict short-term prognosis of severe COVID-19 in the elderly. Heliyon. 2024 Sep 7; 10(18): e37096. https://doi.org/10.1016/j.heliyon.2024.e37096. PMID: 39309817
17. Hu Z., Song C., Xu C., et al. Clinical characteristics of 24 asymptomatic infections with COVID-19 screened among close contacts in Nanjing, China. Sci China Life Sci. 2020 May; 63(5): 706–711. https://doi.org/10.1007/s11427-020-1661-4. Epub 2020 Mar 4. PMID: 32146694
18. Wang Y., Liu Y., Liu L., et al. Clinical outcomes in 55 patients with Severe Acute Respiratory Syndrome Coronavirus 2 who were asymptomatic at hospital admission in Shenzhen, China. J Infect Dis. 2020 May 11; 221(11): 1770–1774. https://doi.org/10.1093/infdis/jiaa119. PMID: 32179910
19. Leung J.M., Yang C.X., Tam A., et al. ACE-2 expression in the small airway epithelia of smokers and COPD patients: implications for COVID-19. Eur Respir J. 2020 May 14; 55(5): 2000688. https://doi.org/10.1183/13993003.00688-2020. PMID: 32269089
20. Simons D., Shahab L., Brown J., Perski O. The association of smoking status with SARS-CoV-2 infection, hospitalization and mortality from COVID-19: a living rapid evidence review with Bayesian meta-analyses (version 7). Addiction. 2021 Jun; 116(6): 1319–1368. https://doi.org/10.1111/add.15276. Epub 2020 Nov 17. PMID: 33007104
21. Oliveira F.E.S., Oliveira M.C.L, Martelli Júnior H. et al. The impact of smoking on COVID-19-related mortality: a Brazilian national cohort study. Addict Behav. 2024 Sep; 156: 108070. https://doi.org/10.1016/j.addbeh.2024.108070. Epub 2024 May 25. PMID: 38796931
22. Griffith N.B., Baker T.B., Heiden B.T., et al. Cannabis, tobacco use, and COVID-19 outcomes. JAMA Netw Open. 2024 Jun 3; 7(6): e2417977. doi: 10.1001/jamanetworkopen.2024.17977. Erratum in: JAMA Netw Open. 2024 Jul 1; 7(7): e2427937. https://doi.org/10.1001/jamanetworkopen.2024.27937. PMID: 38904961
23. Боева Е.В., Беляков Н.А., Симакина О.Е. и др. Эпидемиология и течение инфекционных заболеваний на фоне пандемии COVID-19. Сообщение 2. Реализация интерференции между SARS-CoV-2 и возбудителями острых респираторных вирусных инфекций. Инфекция и иммунитет. 2022; 12(6): 1029– 1039. https://doi.org/10.15789/2220-7619-EAC-1960. EDN: ZMXIGW
24. Martinez-Fierro M.L., González-Fuentes C., Cid-Guerrero D., et al. Radiological findings increased the successful of COVID-19 diagnosis in hospitalized patients suspected of respiratory viral infection but with a negative first SARS-COV-2 RT-PCR result. Diagnostics (Basel). 2022 Mar 11; 12(3): 687. https://doi.org/10.3390/diagnostics12030687. PMID: 35328241
25. Sahutoğlu E., Kabak M., Çil B., et al. Radiologic severity index can be used to predict mortality risk in patients with COVID-19. Tuberk Toraks. 2024 Dec; 72(4): 280–287. English. https://doi.org/10.5578/tt.202404994. PMID: 39745227
26. Schalekamp S., Bleeker-Rovers C.P., Beenen L.F.M., et al. Chest CT in the emergency department for diagnosis of COVID-19 pneumonia: Dutch experience. Radiology. 2021 Feb; 298(2): E98–E106. https://doi.org/10.1148/radiol.2020203465. Epub 2020 Nov 17. PMID: 33201791
Об авторах
А. А. ДяченкоРоссия
Дяченко Андрей Андреевич, канд. мед. наук., доцент кафедры лучевой диагностики, лучевой терапии и онкологии
пр-т Троицкий, д. 51, г. Архангельск, 163000
А. М. Гржибовский
Россия
Гржибовский Андрей Мечиславович, д-р медицины (PhD), начальник управления по научной и инновационной работе; профессор кафедры организации здравоохранения и профилактической медицины Медицинского института; советник ректора
пр-т Троицкий, д. 51, г. Архангельск, 163000
ул. Белинского, д. 58, г. Якутск, 677000
ул. Калинина, д. 8, корп. 2А, г. Санкт-Петербург,198095
М. А. Богданов
Россия
Богданов Максим Андреевич, ассистент кафедры лучевой диагностики, лучевой терапии и онкологии
пр-т Троицкий, д. 51, г. Архангельск, 163000
Д. В. Богданов
Россия
Богданов Дмитрий Васильевич, ассистент кафедры общественного здоровья, здравоохранения и социальной
работы; главный врач
пр-т Троицкий, д. 51, г. Архангельск, 163000
пр-т Обводный, д. 145, корп. 1, г. Архангельск, 163045
Е. А. Назарова
Россия
Назарова Екатерина Александровна, врач-методист
ул. Ленинградская, д. 68, пос. Песочный, г. Санкт-Петербург, 197758
А. А. Мелдо
Россия
Мелдо Анна Александровна, д-р мед. наук, профессор кафедры лучевой диагностики, лучевой терапии и онкологии
пр-т Троицкий, д. 51, г. Архангельск, 163000
В. Ю. Чернина
Россия
Чернина Валерия Юрьевна, ассистент кафедры лучевой
диагностики, лучевой терапии и онкологии; руководитель отдела клинической оценки
бульвар Большой, д. 30, стр. 1, г. Москва, 121205
М. Г. Беляев
Россия
Беляев Михаил Геннадьевич, канд. физ.-мат. наук, профессор, генеральный директор
бульвар Большой, д. 30, стр. 1, г. Москва, 121205
В. А. Гомболевский
Россия
Гомболевский Виктор Александрович, канд. мед. наук, советник, врач-рентгенолог; ведущий научный сотрудник; старший научный сотрудник Института персонализированной онкологии
бульвар Большой, д. 30, стр. 1, г. Москва, 121205
пр-т Кутузовский, д. 32, корп. 1, г. Москва, 121170
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
М. Ю. Вальков
Россия
Вальков Михаил Юрьевич, д-р мед. наук, профессор, заведующий кафедрой лучевой диагностики, лучевой терапии и онкологии
пр-т Троицкий, д. 51, г. Архангельск, 163000
пр-т Обводный, д. 145, корп. 1, г. Архангельск, 163045
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(198KB)
|
Метаданные ▾ | |
|
|
2. Graphic abstract | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(193KB)
|
Метаданные ▾ | |

|
3. STROBE checklist | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(736KB)
|
Метаданные ▾ | |
Рецензия
Sechenov Medical Journal. Editor's checklist for this article you can find here.
Журнал «Сеченовский вестник» |
| Sechenov Medical Journal |
Рецензии на рукопись |
| Peer-review reports |
Название / Title | Распространенность признаков пневмонии, ассоциированной с инфекцией COVID-19, на компьютерных томограммах органов грудной клетки у онкологических больных: исследование АРИЛИС / Prevalence of COVID-19-associated pneumonia signs on chest computed tomography in cancer patients: the ARILUS study
|
Раздел / Section
| ВНУТРЕННИЕ БОЛЕЗНИ / INTERNAL MEDICINE |
Тип / Article | Оригинальная статья / Original article
|
Номер / Number | 1191
|
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian
|
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 27.02.2025 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1191_А |
Научная степень / Scientific degree | Кандидат технических наук / Candidate of Technical Sciences |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 18.03.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Представленная для рецензирования работа описывает результаты научно-практического эксперимента, направленного на применение модели машинного обучения на данных реальной клинической практики, накопленных в системе здравоохранения Архангельской области.
Тема работы является актуальной и перспективной с точки зрения публикации, присутствует научная новизна и практическая значимость представленных результатов. В настоящее время имеется выраженный недостаток работ, проведенных на реальных данных субъектов РФ с оценкой метрик качества работы моделей ИИ и их эффективности.
Исследование соответствует правилам этики проведения исследований и публикации их результатов – дизайн исследования одобрен локальным этическим комитетом.
Цели, материалы и методы, результаты и обсуждение соответствуют друг другу. Заключение выглядит обоснованным, соответствующим представленным результатам. Научная терминология соответствует принятой в рассматриваемой области знаний, находится на достаточном уровне, замечаний не выявлено. Валидность и новизна выбранных литературных источников заслуживает доверие. Текст написан компактным и хорошим научным языком.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1191_В |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 23.03.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | Принять к публикации после небольшой доработки/ Minor revision |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Актуальность статьи обусловлена использованием искусственного интеллекта (ИИ) в клинической практике. Название отражает суть статьи. Введение: достаточно отражает суть проблемы. Методика соответствует требованиям журнала и отрасли знаний, не требует изменения. Статистика соответствует требованиям международных стандартов. Результаты изложены четко и не требуют изменений. Обсуждение результатов достаточно и соответствует основным полученным результатам. Литература достаточна для статьи и не требует переработки.
Краткие замечания, сделанные рецензентом:
- В описание пациентов (таблица 1) желательно добавить анамнез курения (индекс курения)
- Строка 302: уточнить, что повышается? (риск смерти? Тромбозов?)
РЕЦЕНЗЕНТ C / REVIEWER C
Инициалы / Initials | 1191_C |
Научная степень / Scientific degree | Доктор технических наук / Doctor of Technical Sciences |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 30.03.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | Принять к публикации после небольшой доработки/ Minor revision |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Статья соответствует тематике журнала и актуальна. В статье описан пример применения современных технологий искусственного интеллекта (ИИ), предназначенных для обработки медицинских диагностических изображений, и базы данных территориально-популяционного регистра для проведения эпидемиологического исследования. Статья написана хорошим профессиональным литературным языком и может быть рекомендована к публикации.
Вместе с тем имеется ряд замечаний и рекомендаций редакционного характера:
- При отборе случаев (КТ-снимков) из архива медицинских изображений АКОД для анализа с помощью ИИ следовало бы указать, были ли учтены ограничения алгоритмов ИИ, указанные разработчиком (в частности, для COVID-19: коллабированное легкое, ателектаз легкого; наличие внутривенного контрастирования).
- В тексте не описано, как осуществлялся последовательный отбор случаев (КТ- снимков), которые будут обработаны с помощью ИИ, показанный на рисунке 2 (блоки n = 11173 и n = 7640).
- Следует также заметить, что все анализируемые КТ-снимки изначально представлены и обрабатываются в формате DICOM. Поэтому надпись в 5-м сверху блоке в левой колонке на рисунке 2 "приведены в формат DICOM" некорректна.
- Абзац (предложение) "Для удобства анализа все переменные были представлены в виде порядковых ... " надо дополнить словом "признаков".
- Абзац "Среди сервисов ИИ для здравоохранения наибольшее количество продуктов было создано для лучевой диагностики ... " уместнее перенести в раздел "Материалы и методы" – перед описанием медицинского изделия от компании “АЙРА Лабс”.
РЕКОМЕНДАЦИИ НАУЧНЫХ РЕДАКТОРОВ ЖУРНАЛА / RECOMMENDATIONS
OF THE SCIENTIFIC EDITORS OF THE JOURNAL
Просьба унифицированно указывать везде по тексту две выделенные Вами подгруппы: с и без признаков пневмонии.
Текст требует согласования: «Программы скрининга рака молочной железы, шейки матки и др. опухолей были приостановлены в период пандемии, а затем поэтапно возобновлены с учетом рисков с более длительным временем, чтобы обеспечить сокращение численности персонала и усиление режимов инфекционного контроля»
«Более того, исследования, в которых бессимптомные лица с подтвержденным тяжелым острым респираторным синдромом, вызванным SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus 2 (коронавирус тяжелого острого респираторного синдрома — 2) проходили визуализацию органов грудной клетки, выявили изменения у 50% пациентов”
Для улучшения понимания текста просьба разбить на два предложения: «Популяционные регистры рака, с их большими размерами выборки и охватом населения, имеют хорошие возможности для мониторинга изменений распределения стадии при первичной диагностике и расчета выживаемости в период пандемии COVID-19, несмотря на трудности с определением точной стадии во время диагностики, поскольку хирургическое вмешательство и патологоанатомическая оценка задерживаются.»
Необходимо удалить повтор текста в обсуждении из введения. «В этом проекте ООО «АЙРА Лабс» возглавляет матрицу зрелости среди комплексных ИИ для КТ для органов грудной клетки по качеству работы (ROC AUC), оцененной … Значение этих минимальных изменений на КТ предстоит выяснить.»
Целесообразно уточнить смысл: «Достоверные данные о пациентах в ПРР позволили оценить распространенность инфекционного поражения легких в когорте, представляющей всю популяцию пациентов с ЗНО и обеспечить высокую статистическую мощность.» В Вашем исследовании есть критерии включения и исключения. Обо всей популяции речь вряд ли может идти.
Женщин в когорте 634 (55,2%) – далее в тексте - 2/3, просьба скорректировать описание.
Возраст по тексту представлен в виде интервалов и непрерывной переменной. Просьба уточнить это и указать как представлены значения: медиана? Среднее? Использовался ли тест на нормальность?
В таблицах проверить суммы по столбцам (99,9–100,1%)
Просьба к каждой таблице дать в примечаниях расшифровку всех перечисленных в ней аббревиатур
Просьба уточнить что обозначено разными цветами на рисунке.
Для унификации описания просьба: либо дать все синонимы одномерная / нескорректированная модель в разделе Материалы и методы либо использовать только введенные термины: одномерная, многомерная модель.
Необходимо согласовать описание текста и рисунок. Если исключены случаи ателектаза легкого, необходимо это обозначить на рисунке и уточнить количество таких случаев и описать на основании какого алгоритма они исключались.
Исключены серии КТ с внутривенным контрастированием: уточните сколько случаев и основании какого алгоритма?
Кейсы с артефактами: уточните число кейсов и что принималось за артефакты.
Неполная зона сканирования: уточните число пациентов и что принималось за неполную зону.
Зачем выгружались данные ПРР, если вторым этапом после КТ ОГК было подтверждение диагноза ЗНО? В текущей версии схемы диагноз ЗНО подтверждался дважды и не совпал по ПРР и данным АКОД у 394 человек. Из схемы получается, что у 25% пациентов наблюдающихся в АКОД нет ЗНО. Просьба объяснить такое расхождение.