Перейти к:
Этамзилат усиливает агрегацию тромбоцитов через рецепторы из семейства G-белков у пациентов с макрогематурией после уретеролитотрипсии: одноцентровое нерандомизированное исследование
https://doi.org/10.47093/2218-7332.2025.16.2.18-27
Аннотация
Цель. Оценить влияние этамзилата на активацию сигнальных путей, регулирующих агрегацию тромбоцитов, при макрогематурии, возникающей после контактной уретеролитотрипсии (КЛТ).
Материал и методы. Для участия в исследовании оценены 192 пациента, которым проводилась КЛТ с последующим введением этамзилата. Все пациенты принимали нестероидные противовоспалительные препараты. В анализ включены 42 пациента (20 мужчин, 22 женщины, средний возраст 54,2 ± 15,1 года), у которых после введения трех доз этамзилата (125 мг в/в первая доза через 6 часов после КЛТ, далее каждые 6 часов) сохранялась макрогематурия. До и после введения четвертой дозы этамзилата (125 мг в/в) оценена активность рецепторов тромбоцитов при введении стандартных (ЕС50) и субпороговых (ЕС10) концентраций агонистов: эпинефрин, аденозинтрифосфат, аденозиндифосфат (АДФ), аденозин, фактор активации тромбоцитов (ФАТ), растворимый коллаген IV типа и стабильный аналог тромбоксана А2.
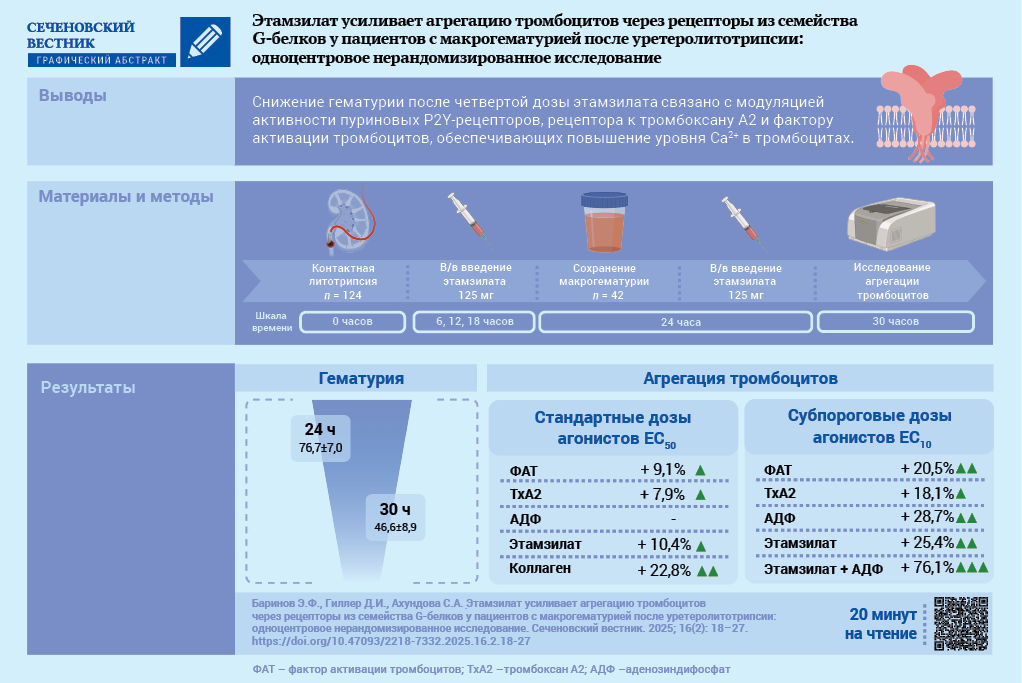
Результаты. После введения четвертой дозы этамзилата макрогематурия статистически значимо снижалась по сравнению с показателем до введения: 46,6 ± 8,9 vs. 76,7 ± 7,0 эритроцитов в поле зрения (р < 0,001). После введения четвертой дозы этамзилата при использовании стандартных доз агонистов (ЕС50) повышалась активность ФАТ-рецептора на 9,1% (р = 0,007), ТР-рецептора (thromboxane prostanoid, тромбоксан простаноид) – на 7,9% (р = 0,006), GPVI-рецептора (Glycoprotein VI, гликопротеин VI) – на 22,8% (р < 0,001), агрегация тромбоцитов, индуцированной этамзилатом, – на 10,4% (р < 0,05). Максимальный эффект агрегации после введения четвертой дозы этамзилата при использовании субпороговых (ЕС10) концентраций агонистов обнаружен при инкубации тромбоцитов одновременно с этамзилатом и АДФ: амплитуда, Slope и AUC (area under curve, площадь под кривой) были выше на 16,9, 60,0 и 54,7% соответственно относительно таковых при изолированной стимуляции P2Y-рецепторов (р < 0,05) и на 26,2, 77,2 и 65,6% больше, чем при инкубации тромбоцитов только с этамзилатом (р < 0,05).
Заключение. Максимальный проагрегантный эффект этамзилата осуществлялся посредством Р2Y- рецепторов, также отмечена модуляция ТР-рецепторов и ФАТ-рецепторов, обеспечивающих повышение уровня внутриклеточного Са2+.
Ключевые слова
Список сокращений:
- AUC – area under curve, площадь под кривой
- GPCR – G-protein-coupled receptors, рецепторы, связанные с G-белками
- GPVI – Glycoprotein VI, гликопротеин VI
- АДФ – аденозиндифосфат
- КЛТ – контактная уретеролитотрипсия
- НПВП – нестероидные противовоспалительные препараты
- ТР – thromboxane prostanoid, тромбоксан простаноид
- ТхА2 – тромбоксан А2
- ФАТ – фактор активации тромбоцитов
- ЦОГ – циклооксигеназа
Длительное сохранение гематурии после контактной уретеролитотрипсии (КЛТ), несмотря на введение гемостатиков, остается актуальной проблемой урологии [1]. Фактором риска развития гематурии является ингибирование циклооксигеназы (ЦОГ) тромбоцитов, возникающее при назначении неселективных нестероидных противовоспалительных препаратов (НПВП) с целью анальгезии после оперативного вмешательства у пациентов с нефролитиазом [2]. Нарушение канонической сигнализации, связанной с активацией рецептора к тромбоксану А2 (ТхА2), ограничивает возможности компенсаторных механизмов агрегации тромбоцитов [3].
В настоящее время в клинической практике для остановки кровотечения широко используется синтетический гемостатический препарат этамзилат (2,5-дигидрокси-бензолсульфонат диэтиламмониевая соль) [4]. Механизм действия препарата обусловлен активацией тканевого фактора в месте повреждения стенки сосудов, снижением образования в эндотелии сосудов простациклина I2, стимуляцией мегакариоцитопоэза, повышением адгезии и агрегации тромбоцитов, что приводит к прекращению или уменьшению кровотечения [5][6]. Экспериментальное исследование, проведенное на образцах крови собак, продемонстрировало способность этамзилата ингибировать антикоагулянтный эффект гепарина, при этом установлено его умеренное фибринолитическое действие [7].
Однако остается ряд не выясненных вопросов, касающихся различной гемостатической эффективности этамзилата: а) обусловлено ли снижение/прекращение послеоперационной гематурии активацией рецепторов, усиливающих экспрессию Р-селектина на плазмалемме тромбоцитов, и какова роль этамзилата в этом процессе; б) означает ли сохранение гематурии или ее уменьшение без достижения гемостаза недостаточную оптимизацию сигнальных путей рецепторов, связанных с G-белками (GPCR, G-protein-coupled receptors), способных усиливать агрегацию тромбоцитов.
Цель исследования: оценить влияние этамзилата на активацию сигнальных путей, регулирующих агрегацию тромбоцитов, при макрогематурии, возникающей после КЛТ.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одноцентровое проспективное нерандомизированное неконтролируемое исследование. Проводили сплошной набор пациентов с почечной коликой на фоне мочекаменной болезни из числа госпитализированных в отделение рентген-ударноволнового дистанционного дробления камней и эндоурологии Республиканской клинической больницы им. М.И. Калинина в период с 3 января 2022 по 29 ноября 2024 г. Размер выборки определен на этапе планирования исследования и был достаточным для выявления снижения гематурии на 5 эритроцитов в поле зрения при микроскопии осадка мочи в первые 24 часа после КЛТ со стандартным отклонением 9, мощностью 80% и уровнем значимости 5%.
Набор пациентов
Потоковая диаграмма включения пациентов представлена на рисунке. Для участия в исследовании оценены 192 пациента.
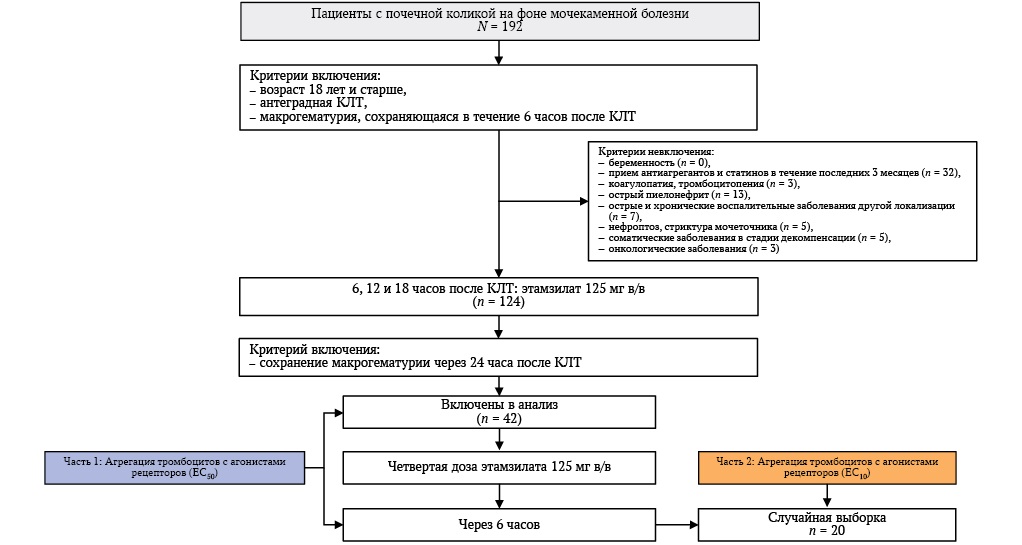
РИС. Потоковая диаграмма включения пациентов в исследование.
Примечание: КЛТ – контактная уретеролитотрипсия.
Критерии включения:
- возраст 18 лет и старше;
- подписанное информированное согласие на участие в исследовании;
- проведение антеградной КЛТ;
- макрогематурия, сохраняющаяся в течение 6 ч после КЛТ.
Показаниями к проведению антеградной КЛТ служили: отсутствие эффекта литокинетической терапии в течение 7–9 суток, размер конкремента более 6 мм, желание пациента удалить конкремент в связи с низкой переносимостью боли при почечной колике.
Критерии невключения:
- беременность (n = 0);
- прием антиагрегантов и статинов в течение последних 3 месяцев (n = 32);
- коагулопатия и/или тромбоцитопения (n = 3);
- острый пиелонефрит (n = 13);
- острые и хронические воспалительные заболевания другой локализации (n = 7);
- нефроптоз, стриктура мочеточника (n = 5);
- соматические заболевания в стадии декомпенсации (n = 5);
- онкологические заболевания (n = 3).
Критерии невключения выявлены у 68 пациентов. Из оставшихся 124 пациентов у 82 макрогематурии после введения трех доз этамзилата не отмечено. В дальнейший анализ включены 42 пациента с сохраняющейся гематурией через 6 часов после введения третьей дозы этамзилата. Им была введена четвертая доза этамзилата и произведена оценка агрегации тромбоцитов до и через 6 часов после введения четвертой дозы (рис). Отсутствие контрольной группы связано с необходимостью введения этамзилата всем пациентам с макрогематурией после КЛТ.
Протокол лечения мочекаменной болезни
Медикаментозная литокинетическая терапия включала α1А-адреноблокатор (тамсулозин в дозе 0,4 мг/сут).
Выбор антеградной КЛТ обусловлен следующими факторами: возможностью использования инструментов большего размера, низким риском дистальной миграции фрагментов при «вколоченном» характере конкремента, возможностью экстракции фрагментов конкремента без риска повреждения и отрыва мочеточника, уменьшением риска формирования грануляций в области слизистой мочеточника [8]. Всем пациентам КЛТ выполняли под эпидуральной анестезией с внутривенной седацией в положении на животе с использованием ригидного нефроскопа (размер петли 24–26 Fr, операционный тубус 27293BD, широкоугольная оптика прямого видения Hopkins 6о 27292AMA, Karl Storz, Германия).
Для уменьшения времени операции и стандартизации почечного доступа после выполнения ретроградной уретеронефрографии конкременты мочеточника смещали из средней или верхней трети мочеточника в лоханку почки с помощью ригидного уретерореноскопа (длина 43 см, размер 8,5 Fr, R.Wolf, Германия), после чего для подачи контрастного вещества и ирригационной жидкости в лоханку проводили мочеточниковый катетер размером 8–10 Fr. Фистулу во всех случаях формировали под комбинированным ультразвуковым и флюороскопическим контролем через сосочки малых чашечек нижнего или среднего бокала с помощью телескопических бужей (Karl Storz 27290А, Германия).
Выбор оптимального чрескожного доступа был основан на геометрической анатомии конкремента. Далее выполняли стандартную литотрипсию и/или литоэкстракцию. Для фрагментации конкрементов использовали электроимпульсный литотриптор «Уролит» («МедЛайн», Россия), ультразвуковой литотриптор (Karl Storz Calcuson, Германия), гольмиевый лазерный литотриптор (Karl Storz CalculaseII, Германия) или их комбинацию. Режимы дробления зависели от плотности и размера конкремента, плотность которых оценивали в единицах Хаунсфилда от 300 до 1360 HU при компьютерной томографии. Средний размер конкремента составил 14,3 ± 0,9 мм (диапазон от 8,0 до 30,0 мм). После ревизии лоханки почки на наличие фрагментов камня устанавливали нефростому размером 16–18 Fr, а при необходимости – стент мочеточника. Нефростому удаляли на 3–7-е сутки, стент мочеточника – на 3–20-е сутки.
В течение 2 суток после КЛТ с целью анальгезии все пациенты получали неселективные НПВП (диклофенак натрия, 150 мг/сут). Кроме того, для профилактики инфекционных осложнений пациенты получали антибактериальные препараты в соответствии с клиническими рекомендациями1.
Протокол введения этамзилата
Всем включенным пациентам внутривенно вводили 4 дозы этамзилата по 125 мг каждые 6 часов, суточная доза составила 500 мг (рис.).
Определение агрегационной способности тромбоцитов
Материалом исследования служили биологические жидкости пациентов, взятые утром натощак до проведения диагностических и лечебных процедур: кровь из кубитальной вены в объеме 10,0 мл, в качестве антикоагулянта использовался раствор цитрата натрия в объемном отношении 9:1; моча в объеме 50,0 мл.
Гематурию регистрировали через 6, 18, 24 и 30 ч после КЛТ. С учетом отбора пациентов с сохранением макрогематурии после трех доз этамзилата для исследования выбраны следующие временные точки оценки индуцированной агрегации тромбоцитов: перед введением четвертой дозы этамзилата (24 ч после КЛТ) и через шесть часов после ее введения (30 ч после КЛТ) (рис.).
Анализ функции рецепторов проводили in vitro на суспензии тромбоцитов, для чего из периферической крови путем центрифугирования выделяли обогащенную тромбоцитами плазму [9]. Количество тромбоцитов в исследуемом образце составляло 200 000 ± 50 000 клеток в 1,0 мкл.
Часть 1: Оценка активности рецепторов
Активность α2-адренорецептора, пуриновых Р2Х1- и Р2Y-рецепторов, аденозинового А2-рецептора, ТР (thromboxane prostanoid, тромбоксан простаноид) рецептора к ТхА2, ФАТ-рецептора (фактор активации тромбоцитов) и GPVI (Glycoprotein VI, гликопротеин VI) рецептора к коллагену IV типа исследовали у всех пациентов с использованием агонистов соответствующих рецепторов в концентрациях ЕС50 (median effect concentration, полумаксимальная эффективная концентрация), вызывающих амплитуду агрегации 50% у здоровых лиц: эпинефрин (5,0 мкМ), аденозинтрифосфат (500 мкМ), аденозиндифосфат (АДФ, 5,0 мкМ), аденозин (5,0 мкМ), ФАТ (150,0 мкМ), растворимый коллаген IV типа (2,0 мг/мл) и стабильный аналог ТхА2 U-46619 (7 мкМ) (Sigma-Aldrich Chemie GmbH, Германия). В качестве стимулятора агрегации также исследован эффект этамзилата in vitro путем его добавления в дозе 10 мкМ.
Часть 2: Моделирование синергизма путей сигнализации
Моделирование изучено через 6 часов после введения четвертой дозы этамзилата в образцах крови 20 пациентов, отобранных методом простой случайной выборки из 42 включенных в исследование пациентов. Проводилась инкубация тромбоцитов с этамзилатом в дозе 10 мкМ и субпороговыми концентрациями (ЕС10) АДФ, ФАТ, стабильного аналога ТхА2 U-46619, а также их комбинациями.
Исследование агрегационной способности тромбоцитов проводили в соответствии с Европейскими рекомендациями по стандартизации агрегатометрии [10][11]. Оценку агрегации тромбоцитов делали турбидиметрическим методом на анализаторе ChronoLog (США). Анализ агрегатограмм проводили по следующим параметрам: амплитуда агрегации тромбоцитов (%); максимальный наклон кривой (Slope, %/мин); площадь под кривой (AUC, area under curve).
Статистический анализ
Нормальность распределения проверяли с помощью критерия Шапиро – Уилка. Все непрерывные переменные имели нормальное распределение, при описании результатов вычисляли среднее арифметическое значение и стандартное отклонение. При анализе межгрупповых различий применяли критерий Стьюдента для зависимых выборок. Для выявления связи между признаками рассчитывали коэффициент корреляции Пирсона; для оценки силы связи использована шкала Чеддока.
Различие считали статистически значимым при уровне р < 0,05. Статистический анализ осуществляли с использованием программы MedCalc 18.10.2 (MedCalc Software, Бельгия).
РЕЗУЛЬТАТЫ
Основные результаты антропометрических, лабораторных и инструментальных исследований пациентов на этапе госпитализации представлены в таблице 1. Средний возраст, включенных пациентов составил 54 года, соотношение мужчин и женщин в исследование было равным, показатели общего анализа крови находились в пределах референсных значений, у большинства пациентов – 26 (62%) конкремент локализовался в верхней трети мочеточника, у 16 (38%) – в нижней.
Таблица 1. Характеристики пациентов в обоих частях исследования
|
Признак |
Часть 1 (n = 42) |
Часть 2 (n = 20) |
Значение р |
|
Возраст, лет |
54,2 ± 15,1 |
53,7 ± 14,2 |
n.s. |
|
Мужчины, n / Женщины, n |
20 / 22 |
10 / 10 |
n.s. |
|
Конкремент в верхней трети мочеточника, n (%) |
26 (62) |
14 (70) |
n.s. |
|
Конкремент в средней трети мочеточника, n (%) |
16 (38) |
6 (30) |
n.s. |
|
Гемоглобин, г/л |
135 ± 10,9 |
137 ± 11,3 |
n.s. |
|
Лейкоциты в крови, ×10⁹/л |
7,2 ± 1,9 |
6,9 ± 2,2 |
n.s. |
|
Тромбоциты в крови, ×10⁹/л |
228,9 ± 30,5 |
221,3 ± 31,7 |
n.s. |
|
Средний объем тромбоцита, fl |
8,9 ± 1,3 |
8,8 ± 1,5 |
n.s. |
|
Лейкоциты в моче, клеток в поле зрения |
11,2 ± 2,3 |
12,1 ± 2,6 |
n.s. |
|
Эритроциты в моче, клеток в поле зрения |
|||
|
до первой дозы этамзилата |
72,5 ± 6,7 |
74,6 ± 8,1 |
n.s. |
|
до четвертой дозы этамзилата |
76,7 ± 7,0 |
75,2 ± 7,8 |
n.s. |
|
через 6 ч после четвертой дозы этамзилата |
46,6 ± 8,9 |
44,9 ± 9,2 |
n.s. |
Примечание: n.s. – not significant, не значимо.
До введения четвертой дозы этамзилата количество эритроцитов в моче было сопоставимо с исходным данными (р = 0,42). Спустя шесть часов после введения четвертой дозы зарегистрировано уменьшение количества эритроцитов в моче до 46,6 ± 8,9 в поле зрения по сравнению со значениями до введения препарата (р < 0,001); гематурия снизилась на 39,3%. Пациенты, включенные во вторую часть исследования, не отличались по основным характеристикам от общего числа включенных пациентов.
Часть 1: агрегация тромбоцитов с использованием стандартных (ЕС50) доз агонистов
Установлено, что до введения четвертой дозы этамзилата имела место гиперреактивность ФАТ-рецептора, ТР-рецептора и Р2Y-рецепторов, а также нормореактивность Р2Х1-рецептора, α2-адренорецептора и гипореактивность аденозинового А2-рецептора, GPVI-рецептора. Через 6 часов после введения четвертой дозы этамзилата гиперреактивность ФАТ-рецептора повышалась на 9,1% (р = 0,007), ТР-рецептора на 7,9% (р = 0,006), сохранялись: гиперреактивность Р2Y-рецепторов, нормореактивность Р2Х1-рецептора и гипореактивность α2-адренорецептора. Агрегация тромбоцитов, индуцированная коллагеном после введения четвертой дозы этамзилата, увеличивалась на 22,8% (р < 0,001). Добавление этамзилата in vitro увеличивало агрегацию тромбоцитов на 10,4% (р = 0,014) (табл. 2).
Таблица 2. Амплитуда агрегации тромбоцитов с использованием стандартных доз агонистов (EC50) до и через 6 ч после введения четвертой дозы этамзилата
|
Агонист |
До, % |
После, % |
Значение р |
|
ФАТ |
60,3 ± 7,0 |
65,8 ± 5,4 |
0,007 |
|
ТхА2 |
58,5 ± 4,0 |
63,1 ± 3,4 |
0,006 |
|
АДФ |
56,8 ± 6,0 |
56,6 ± 9,1 |
n.s. |
|
АТФ |
52,6 ± 5,6 |
55,7 ± 9,3 |
n.s. |
|
Эпинефрин |
51,5 ± 5,2 |
51,4 ± 3,5 |
n.s. |
|
Аденозин |
43,5 ± 5,8 |
45,0 ± 7,0 |
n.s. |
|
Коллаген |
41,7 ± 5,0 |
51,2 ± 5,7 |
<0,001 |
|
Этамзилат |
47,2 ± 6,9 |
52,1 ± 5,1 |
0,014 |
Примечания: EC50 – median effect concentration, полумаксимальная эффективная концентрация, n.s. – not significant, не значимо. АДФ – аденозиндифосфат; АТФ – аденозинтрифосфат; ТхА2 – тромбоксан А2; ФАТ – фактор активации тромбоцитов.
Исследуемый комплекс «агонист-рецептор»: аденозин – А2-рецептор; АДФ – Р2Y-рецептор; АТФ – Р2Х1-рецептор; коллаген – GPVI (Glycoprotein VI, гликопротеин VI) – рецептор; ТхА2 – ТР (thromboxane prostanoid, тромбоксан простаноид) рецептор; ФАТ – ФАТ-рецептор; эпинефрин – α2-адренорецептор.
До введения четвертой дозы этамзилата при корреляционном анализе обнаружена слабая прямая связь между активностью Р2Y- и ФАТ-рецептора, Р2Y- и ТР-рецептора, Р2Y- и α2-адренорецептора, а также между агрегацией тромбоцитов, индуцированной этамзилатом, и активностью ФАТ-рецептора, ТР-рецептора и Р2Y-рецептора.
Через 6 ч после введения четвертой дозы этамзилата корреляционная связь между активностью Р2Y- и ФАТ-рецептора усиливалась до средней силы, Р2Y- и ТР-рецептора – до средней силы, появлялась слабая связь между активностью Р2Y- и GPVI-рецептора. Связь между агрегацией тромбоцитов, индуцированной этамзилатом, и активностью Р2Y-рецептора увеличивалась до средней силы, сохранялась слабая связь с ФАТ-рецептором и ТР-рецептором. Выявлена отрицательная связь средней силы между выраженностью гематурии и активностью ФАТ-рецептора, ТР-рецептора и Р2Y-рецептора (табл. 3).
Таблица 3. Корреляционный анализ между активностью тромбоцитарных рецепторов, этамзилатом и гематурией до и после введения четвертой дозы этамзилата
|
Фактор |
Р2Y-рецептор |
ФАТ-рецептор |
ТР-рецептор |
α2-адренорецептор |
GPVI-рецептор |
|||
|
До |
После |
До |
После |
До |
После |
До |
После |
|
|
Р2Y-рецептор |
0,43 |
0,51 |
0,41 |
0,57 |
0,4 |
0,4 |
||
|
Этамзилат |
0,39 |
0,58 |
0,32 |
0,44 |
0,31 |
0,41 |
||
|
Гематурия |
–0,6 |
–0,51 |
–0,55 |
|||||
Примечания: приведены коэффициенты корреляции Пирсона, для которых значение р < 0,05.
GPVI – Glycoprotein VI, гликопротеин VI; ТР – thromboxane prostanoid; тромбоксан простаноид; ФАТ – фактор активации тромбоцитов.
Часть 2: моделирование агрегации тромбоцитов с использованием субпороговых (ЕС10) доз агонистов
При моделировании взаимодействия рецепторов тромбоцитов in vitro с использованием субпороговой дозы агонистов после введения четвертой дозы этамзилата на выборке пациентов (n = 20) установлено, что при изолированной стимуляции тромбоцитов посредством ФАТ, ТхА2, АДФ и этамзилата воспроизводились сопоставимые характеристики агрегации (табл. 4).
Таблица 4. Индуцированная агрегация тромбоцитов после введения четвертой дозы этамзилата с использованием субпороговых доз агонистов (ЕС10)
|
Агонист |
Амплитуда агрегации, % |
Максимальный наклон кривой, %/мин |
Площадь под кривой |
|
АДФ |
13,6 ± 4,8 |
17,5 ± 5,9 |
21,2 ± 7,3 |
|
ТхА2 |
13,8 ± 4,3 |
16,3 ± 5,0 |
20,8 ± 7,1 |
|
ФАТ |
12,7 ± 3,2 |
15,3 ± 5,0 |
20,3 ± 6,2 |
|
Этамзилат 10 мкМ |
12,6 ± 2,5 |
15,8 ± 3,9 |
19,8 ± 5,5 |
|
плюс АДФ |
15,9 ± 2,7a,b |
28,0 ± 4,1a,b |
32,8 ± 5,5a,b |
|
плюс ТхА2 |
15,1 ± 2,3a |
18,5 ± 3,2a |
26,6 ± 6,8a,c |
|
плюс ФАТ |
15,4 ± 2,3a,d |
18,1 ± 2,9a,d |
25,1 ± 5,2a,d |
Примечания: р < 0,05 по сравнению с изолированным действием этамзилата (a), АДФ (b), ТхА2 (c), ФАТ (d).
АДФ – аденозиндифосфат; АТФ – аденозинтрифосфат; ТхА2 – тромбоксан А2; ФАТ – фактор активации тромбоцитов.
При инкубации тромбоцитов одновременно с этамзилатом и АДФ зарегистрирован максимальный эффект агрегации. Так, амплитуда, Slope и AUC были выше на 16,9, 60,0 и 54,7% соответственно относительно таковых при изолированной стимуляции P2Y-рецепторов (р < 0,05) и на 26,2, 77,2 и 65,6% больше, чем при инкубации тромбоцитов с этамзилатом (р < 0,05).
При одновременной стимуляции тромбоцитов этамзилатом и ТхА2 проагрегантный эффект был менее выраженным относительно такового при стимуляции тромбоцитов комбинацией этамзилата и АДФ (Slope меньше на 33,9%, AUC – на 18,9%) (р < 0,005).
Величина AUC при одновременной инкубации тромбоцитов с этамзилатом и ТхА2 была на 27,9% больше, чем при стимуляции только ТР-рецептора (р = 0,01). В то же время значения амплитуды, Slope и AUC при одновременной инкубации тромбоцитов с этамзилатом и ТхА2 были на 19,8, 17,1 и 34,3% больше, чем при изолированной инкубации тромбоцитов с этамзилатом (р < 0,05).
При инкубации тромбоцитов с этамзилатом и ФАТ параметры агрегации были сопоставимыми с таковыми при действии этамзилата и ТхА2. Синергизм этамзилата и ФАТ проявлялся более высокими значениями амплитуды, Slope и AUC по сравнению с изолированным эффектом этамзилата (на 22,2, 14,6 и 26,8% соответственно, р < 0,05) и ФАТ (на 21,2, 18,3 и 23,6% соответственно, р < 0,05).
ОБСУЖДЕНИЕ
Установлено, что уменьшение гематурии через 30 ч после КЛТ, обусловленное ингибированием ЦОГ в тромбоцитах, при системном введении этамзилата связано с модуляцией активности P2Y-рецепторов, ТР-рецептора и ФАТ-рецептора, обеспечивающих повышение уровня внутриклеточного Са²⁺, при этом наиболее выраженная синергия этамзилата связана с уровнем внеклеточного АДФ. Механизм активации тромбоцитов, опосредованный Gq-белком, является стереотипным для активации P2Y-рецепторов, ТР-рецептора и ФАТ-рецептора. Несмотря на длительный опыт применения этамзилата, интерес к его потенциалу в усилении гемостатического эффекта сохраняется [12][13]. С одной стороны, это свидетельствует о признании его фармакологических возможностей, а с другой – указывает на отсутствие полного понимания молекулярных механизмов действия препарата. Продолжавшиеся дискуссии привели к соглашению, в соответствии с которым этамзилат рассматривается как эффективный препарат второй линии (после транексамовой кислоты) для остановки геморрагии [14].
Выявленное снижение послеоперационной кровопотери при комбинированном введении транексамовой кислоты и этамзилата [15] усиливает интерес к таргетным механизмам регуляции гемостаза. Попытки объяснить возможные механизмы действия этамзилата предпринимаются с 2000 г. [16], когда была продемонстрирована роль Р-селектин-зависимого механизма в адгезии тромбоцитов, что, по сути, указывает на проагрегантный эффект препарата. До настоящего времени остается неясной вариабельность биологического действия этамзилата [17]. Предполагается, что реализация его эффекта опосредована GPCR, которые передают и усиливают сигналы к внутриклеточным эффекторам [18]. Известно, что GPCR участвуют в мобилизации ионов Са²⁺, функционировании Са²⁺-каналов и экзоцитозе телец Вейбеля [19][20], следствием чего является повышение адгезии и агрегации тромбоцитов.
Сохранение тяжелой степени микрогематурии через 24 ч после КЛТ, несмотря на введение этамзилата, по-видимому, обусловлено ингибированием активности ЦОГ тромбоцитов при назначении неселективных НПВП. Малоизученным вопросом остается эффективность этамзилата при геморрагиях, связанных с ингибированием ЦОГ. Одним из факторов, затрудняющих интерпретацию его действия, является отсутствие исследований о пластичности сигнальных путей тромбоцитов при изменении выраженности гематурии, что затрудняет поиск оптимальных механизмов усиления тромбогенеза и разработку новых гемостатических препаратов.
Изучение механизмов регуляции функций тромбоцитов при гематурии, сохраняющейся в течение 24 ч, позволило идентифицировать кластер рецепторов, участвующих в компенсаторной агрегации тромбоцитов при ингибировании ЦОГ, обусловленном назначением НПВП. Усиление передачи сигнала через рецепторы, связанные с Gq-белком (ФАТ-рецептор), Gq- и G12/13-белками (ТР-рецептор), а также с Gi- и Gq-белками (Р2Y-рецепторы), рассматривается как стереотипный механизм активации агрегации тромбоцитов [21–23]. Активация компенсаторных механизмов тромбоцитарной агрегации при сохраняющейся послеоперационной гематурии может быть обусловлена паракринным воздействием активированных лейкоцитов, продуцирующих ФАТ (в условиях пиелонефрита); восстановлением синтеза ТхА2 (как результат резидуальной активности ЦОГ); а также увеличением содержания АДФ, возникающим вследствие трансформации пуриновых нуклеотидов при ишемии/гипоксии тканей мочевыводящих путей [24–26].
Системное введение этамзилата сопровождалось модуляцией сигнальных путей, вовлеченных в реализацию компенсаторных механизмов агрегации тромбоцитов. Усиление проагрегантного эффекта этамзилата на фоне введения четвертой дозы препарата (через 30 ч после КЛТ) связано с возрастанием стимуляции ФАТ-рецептора и ТР-рецептора, что, вероятно, сопровождалось оптимизацией внутриклеточной сигнализации тромбоцитов. Поскольку механизм активации тромбоцитов, связанный с Gq-белком, является общим для функционирования P2Y-рецепторов, ТР-рецептора и ФАТ-рецептора, можно предположить, что гемостатический эффект этамзилата также связан с участием сигнальных путей, опосредованных Gi-белком. При этом нельзя исключить возможность синергизма АДФ, ТхА2 и ФАТ [27][28] в реализации проагрегантного эффекта этамзилата. Косвенным подтверждением этой гипотезы служит изменение кластера функционально активных рецепторов тромбоцитов при сохраняющейся послеоперационной гематурии, что, вероятно, связано с перепрограммированием фенотипа циркулирующих тромбоцитов в процессе мегакариоцитопоэза.
Ограничения исследования и направления для дальнейших исследований
Ограничением исследования является отсутствие контрольной выборки и рандомизации. Поскольку исследование пилотное, результаты справедливы для ограниченной категории пациентов с макрогематурией, возникшей после проведения антеградной КЛТ и не купирующейся тремя дозами этамзилата Полученные результаты требуют подтверждения в больших мультицентровых контролируемых исследованиях.
Мониторинг внутриклеточной сигнализации тромбоцитов, связанной с системой GPCR, при многократном введении этамзилата может быть одним из путей персонификации гемостатической терапии при гематурии после проведения КЛТ.
ЗАКЛЮЧЕНИЕ
У трети пациентов сохраняется макрогематурия в течение 24 ч после антеградной КЛТ несмотря на введение этамзилата. У пациентов с нефролитиазом, перенесших антеградную КЛТ, зарегистрировано усиление сигнализации через рецептор, связанный с Gq-белком (ФАТ-рецептор), и ко-активации сигнальных путей, связных с Gq-, G12/13-белками (ТР-рецептор) и Gi-, Gq-белками (пуриновые Р2Y-рецепторы). Гемостатический эффект этамзилата in vitro проявлялся сопряженностью сигнальных путей GPCR, отражением чего было увеличение показателей агрегатометрии (амплитуды агрегации, Slope и AUC). Максимальный эффект агрегации тромбоцитов воспроизводился in vitro при взаимодействии этамзилата и АДФ, что свидетельствует об оптимизации сигнальных путей, сопряженных с Gi- и Gq- белками.
ВКЛАД АВТОРОВ
Э.Ф. Баринов разработал концепцию и дизайн исследования, проводил анализ полученных данных и редактирование рукописи. Д.И. Гиллер проводила агрегатометрические исследования, обзор литературы и подготовила текст рукописи. С.А. Ахундова моделировала in vitro взаимодействия рецепторов, проводила статистическую обработку данных. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTIONS
Edward F. Barinov developed the study conception and design, performed the data analysis, and contributed to the editing of the manuscript. Dina I. Giller conducted aggregometry studies, carried out a literature review, and prepared the manuscript text. Sabina A. Akhundova performed in vitro receptor interaction modelling and the statistical data analysis. All the authors approved the final version of the article.
Соответствие принципам этики. Данное исследование проводилось в соответствии с Хельсинкской декларацией (версия 2024 года) Всемирной медицинской ассоциации об этических принципах проведения биомедицинских исследований и с разрешением Локального этического комитета ФГБОУ ВО «Донецкий государственный медицинский университет имени М. Горького» (протокол № 30/5-1 от 23.05.2024). У всех обследованных пациентов было получено письменное информированное согласие на участие в исследовании.
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу. Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The research was conducted in accordance with the World Medical Association Declaration of Helsinki (2024) and with the permission of the Local bioethics committee of the Donetsk State Medical University (protocol No. 30/5-1 dated May 23, 2024). Written informed consent was obtained from all patients included in the study.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interest. The authors declare that there is no conflict of interests.
Financing. The study had no sponsorship (own resources).
1. Клинические рекомендации «Мочекаменная болезнь» Российского общества урологов, 2024. https://cr.minzdrav.gov.ru/view-cr/7_2 (дата доступа: 10.10.2024).
Список литературы
1. Giulioni C., Castellani D., Somani B.K., et al. The efficacy of retrograde intra-renal surgery (RIRS) for lower pole stones: results from 2946 patients. World J Urol. 2023 May; 41(5): 1407–1413. https://doi.org/10.1007/s00345-023-04363-6. Epub 2023 Mar 17. PMID: 36930255
2. Škiljić S., Nešković N., Kristek G., et al. Point-of-care diagnostic approach in a critically ill patient with severe bleeding from urinary tract. Acta Clin Croat. 2023 Jul; 62(Suppl2): 138–142. https://doi.org/10.20471/acc.2023.62.s2.20. PMID: 38966024
3. Hashemzadeh M., Haseefa F., Peyton L., et al. A comprehensive review of the ten main platelet receptors involved in platelet activity and cardiovascular disease. Am J Blood Res. 2023 Dec 25; 13(6): 168–188. https://doi.org/10.62347/NHUV4765.eCollection 2023.PMID: 38223314
4. Bosilah A.H., Eldesouky E., Alghazaly M.M., et al. Comparative study between oxytocin and combination of tranexamic acid and ethamsylate in reducing intra-operative bleeding during emergency and elective cesarean section after 38 weeks of normal pregnancy. BMC Pregnancy Childbirth. 2023 Jun 12; 23(1): 433. https://doi.org/10.1186/s12884-023-05728-w. PMID: 37308871
5. Razak A., Patel W., Durrani N.U.R., Pullattayil A.K. Interventions to reduce severe brain injury risk in preterm neonates: a systematic review and meta-analysis. JAMA Netw Open. 2023 Apr 3; 6(4): e237473. https://doi.org/10.1001/jamanetworkopen.2023.7473. PMID: 37052920
6. Gardner J., Husbands E. Medical management of refractory haematuria in palliative patients. J Pain Symptom Manage. 2024 Nov; 68(5): e404–e408. https://doi.org/10.1016/j.jpainsymman.2024.07.023. Epub 2024 Jul 29. PMID: 39084409
7. Herrería-Bustillo V., Masiá-Castillo M., Phillips H.R.P., Gil- Vicente L. Evaluation of the effect of etamsylate on thromboelastographic traces of canine blood with and without the addition of heparin. Vet Q. 2023 Dec; 43(1): 1–6. https://doi.org/10.1080/01652176.2023.2260449. Epub 2023 Sep 16. PMID: 37715947
8. Bhat A., Singh V., Bhat M., et al. Comparison of antegrade percutaneous versus retrograde ureteroscopic lithotripsy for upper ureteric calculus for stone clearance, morbidity, and complications. Indian J Urol. 2019 Jan-Mar; 35(1): 48–53. https://doi.org/10.4103/iju.IJU_89_18. PMID: 30692724
9. Lian S.L., Huang J., Zhang Y., Ding Y. The effect of plateletrich plasma on ferroptosis of nucleus pulposus cells induced by Erastin. Biochem Biophys Rep. 2024 Dec 24; 41: 101900. https://doi.org/10.1016/j.bbrep.2024.101900. PMID: 39811190
10. Taguchi K., Hamamoto S., Osaga S., et al. Comparison of antegrade and retrograde ureterolithotripsy for proximal ureteral stones: a systematic review and meta-analysis. Transl Androl Urol. 2021 Mar; 10(3): 1179–1191. https://doi.org/10.21037/tau-20-1296. PMID: 33850753
11. Stépanian A., Fischer F., Flaujac C., et al. Light transmission aggregometry for platelet function testing: position paper on current recommendations and French proposals for accreditation. Platelets. 2024 Dec; 35(1): 2427745. https://doi.org/10.1080/09537104.2024.2427745. Epub 2024 Nov 18. PMID: 39555668
12. El-Masry S.M., Helmy S.A. Hydrogel-based matrices for controlled drug delivery of etamsylate: prediction of in-vivo plasma profiles. Saudi Pharm J. 2020 Dec; 28(12): 1704-1718. https://doi.org/10.1016/j.jsps.2020.10.016. Epub 2020 Nov 6. PMID: 33424262
13. Mukherjee S., Sasmal P.K., Reddy K.P., et al. Spatiotemporally controlled release of etamsylate from bioinspired peptide-functionalized nanoparticles arrests bleeding rapidly and improves clot stability in a rabbit internal hemorrhage model. ACS Biomater Sci Eng. 2024 Aug 12; 10(8): 5014–5026. https://doi.org/10.1021/acsbiomaterials.4c00743. Epub 2024 Jul 10. PMID: 38982893
14. Garay R.P., Chiavaroli C., Hannaert P. Therapeutic efficacy and mechanism of action of ethamsylate, a long-standing hemostatic agent. Am J Ther. 2006 May-Jun; 13(3): 236–247. https://doi.org/10.1097/01.mjt.0000158336.62740.54. PMID: 16772766
15. El Baser I.I.A., ElBendary H.M., ElDerie A. The synergistic effect of tranexamic acid and ethamsylate combination on blood loss in pediatric cardiac surgery. Ann Card Anaesth. 2021 Jan-Mar; 24(1): 17–23. https://doi.org/10.4103/aca.ACA_84_19. PMID: 33938826
16. Alvarez-Guerra M., Hernandez M.R., Escolar G., et al. The hemostatic agent ethamsylate enhances P-selectin membrane expression in human platelets and cultured endothelial cells. Thromb Res. 2002 Sep 15; 107(6): 329–335. https://doi.org/10.1016/s0049-3848(02)00353-5. PMID: 12565720
17. Cobo-Nuñez M.Y., El Assar M., Cuevas P., et al. Haemostatic agent etamsylate in vitro and in vivo antagonizes anti-coagulant activity of heparin. Eur J Pharmacol. 2018 May 15; 827: 167–172. https://doi.org/10.1016/j.ejphar.2018.03.028. Epub 2018 Mar 16. PMID: 29555505
18. Thibeault P.E., Ramachandran R. Biased signaling in platelet G-protein coupled receptors. Can J Physiol Pharmacol. 2021 Mar; 99(3): 255–269. https://doi.org/10.1139/cjpp-2020-0149. Epub 2020 Aug 26. PMID: 32846106
19. Woszczek G., Fuerst E. Ca2+ mobilization assays in GPCR drug discovery. Methods Mol Biol. 2015; 1272: 79–89. https://doi.org/10.1007/978-1-4939-2336-6_6. PMID: 25563178
20. Naß J., Terglane J., Gerke V. Weibel palade bodies: unique secretory organelles of endothelial cells that control blood vessel homeostasis. Front Cell Dev Biol. 2021 Dec 16; 9: 813995. https://doi.org/10.3389/fcell.2021.813995. PMID: 34977047
21. Obara K., Yoshioka K., Tanaka Y. Effects of platelet-activating factor (PAF) on the mechanical activities of lower urinary tract and genital smooth muscles. Biol Pharm Bull. 2024; 47(9): 1467– 1476. https://doi.org/10.1248/bpb.b24-00440. PMID: 39218668
22. Capranzano P., Moliterno D., Capodanno D. Aspirin-free antiplatelet strategies after percutaneous coronary interventions. Eur Heart J. 2024 Feb 21; 45(8): 572–585. https://doi.org/10.1093/eurheartj/ehad876. PMID: 38240716
23. von Kügelgen I. Pharmacological characterization of P2Y receptor subtypes – an update. Purinergic Signal. 2024 Apr; 20(2): 99–108. https://doi.org/10.1007/s11302-023-09963-w. Epub 2023 Sep 12. PMID: 37697211
24. Silva I.S., Almeida A.D., Lima Filho A.C.M., et al. Plateletactivating factor and protease-activated receptor 2 cooperate to promote neutrophil recruitment and lung inflammation through nuclear factor-kappa B transactivation. Sci Rep. 2023 Dec 7; 13(1): 21637. https://doi.org/10.1038/s41598-023-48365-1. PMID: 38062077
25. Kishore B.K., Robson S.C., Dwyer K.M. CD39-adenosinergic axis in renal pathophysiology and therapeutics. Purinergic Signal. 2018 Jun; 14(2): 109–120. https://doi.org/10.1007/s11302-017-9596-x. Epub 2018 Jan 13. PMID: 29332180
26. Minuz P., Meneguzzi A., Fumagalli L., et al. Calcium-dependent Src phosphorylation and reactive oxygen species generation are implicated in the activation of human platelet induced by thromboxane A2 analogs. Front Pharmacol. 2018 Sep 26; 9: 1081. https://doi.org/10.3389/fphar.2018.01081. PMID: 30319416
27. Honda N., Ohnishi K., Fujishiro T., et al. Alteration of release and role of adenosine diphosphate and thromboxane A2 during collagen- induced aggregation of platelets from cattle with Chediak- Higashi syndrome. Am J Vet Res. 2007 Dec; 68(12): 1399–1406. https://doi.org/10.2460/ajvr.68.12.1399. PMID: 18052747
28. Zhang J., Zhang Y., Zheng S., et al. PAK membrane translocation and phosphorylation regulate platelet aggregation downstream of Gi and G12/13 pathways. Thromb Haemost. 2020 Nov; 120(11): 1536–1547. https://doi.org/10.1055/s-0040-1714745. Epub 2020 Aug 27. PMID: 32854120
Об авторах
Э. Ф. БариновРоссия
Баринов Эдуард Федорович, д-р мед. наук, профессор, заведующий кафедрой гистологии, цитологии, эмбриологии и молекулярной медицины
пр-т Ильича, д. 16, г. Донецк, 283003
Д. И. Гиллер
Россия
Гиллер Дина Игоревна, ассистент кафедры гистологии, цитологии, эмбриологии и молекулярной медицины
пр-т Ильича, д. 16, г. Донецк, 283003
С. А. Ахундова
Россия
Ахундова Сабина Акбер кызы, ассистент кафедры гистологии, цитологии и эмбриологии и молекулярной медицины
пр-т Ильича, д. 16, г. Донецк, 283003
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(143KB)
|
Метаданные ▾ | |
|
|
2. Graphic abstract | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(139KB)
|
Метаданные ▾ | |

|
3. 1164_TREND checklist | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(378KB)
|
Метаданные ▾ | |
Рецензия
Sechenov Medical Journal. Editor's checklist for this article you can find here.
Журнал «Сеченовский вестник» |
| Sechenov Medical Journal |
Рецензии на рукопись |
| Peer-review reports |
Название / Title | Этамзилат усиливает агрегацию тромбоцитов через рецепторы из семействаG-белков у пациентов с макрогематурией после уретеролитотрипсии: одноцентровое нерандомизированное исследование / Etamsylate enhances platelet aggregation through G-proteincoupled receptors in patients with macrohematuria following ureteral lithotripsy: a single-center nonrandomized study
|
Раздел / Section
| ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ / PATHOLOGICAL PHYSIOLOGY
|
Тип / Article | Оригинальная статья / Original article
|
Номер / Number | 1164
|
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian
|
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 10.01.2025 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1164_А
|
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine)
|
Страна/территория / Country/Territory | Россия / Russia
|
Дата рецензирования / Date of peer-review | 25.02.2025
|
Число раундов рецензирования / Number of peer-review rounds | 2 |
Финальное решение / Final decision | Отклонить / Decline
|
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Статья представляет результаты исследования на актуальную тему. Однако, у рецензента есть ряд замечаний и вопросов к авторам.
- В названии говорится о компенсаторных механизмах, в цели – о компенсаторных реакциях. О каких компенсаторных механизмах речь и что они компенсируют?
- В аннотации сказано о пациентах, «у которых в течение 30ч после контактной уретеролитотрипсии (КЛТ) сохранялась тяжелая степень микрогематурии, в связи с чем системно вводили 250мг ЭЗ». В «Материалах и методах» статьи: «Через 30 ч после КЛТ при сохранении макрогематурии пациентам дополнительно вводили этамзилат (разовая доза составила 250мг)». У пациентов была микро- или макрогематурия? Сколько раз вводили этамзилат (ЭЗ) и каким пациентам?
- Заключение о кластере «рецепторов, регулирующих компенсаторную реакцию Тц» звучит неопределенно. Следует указать, о каких рецепторах речь и о какой компенсаторной реакции.
- Во введении рекомендуется дать общую информацию об этамзилате и показаниях для его использования.
- Методы: дать ссылку на метод получения обогащенной тромбоцитами плазмы; указать концентрации использованных агонистов и их источник (название компании).
- В методах указано: «В первые 24ч после КЛТ при наличии макрогематурии пациентам внутривенно вводили ЭЗ (суточная доза составила 500 мг)». Какова доля таких пациентов? В табл. 1 колонка «до введения этамзилата». Имеется в виду до повторного введения этамзилата через 6 ч? Или этамзилат вводили впервые через 30 ч после КЛТ? Числа в табл. 1 – выборочные средние арифметические?
- Аналогично при втором исследовательском вопросе: «отличается ли функциональная активность рецепторов, регулирующих агрегацию Тц через 30ч сохраняющейся послеоперационной гематурии?». Сколько раз вводили этамзилат этим 20 пациентам?
- Обсуждение: отсутствуют ссылки на статьи с 2000 по 2024 годы, хотя механизмы действия этамзилата активно изучали, например: Evaluation of the effect of etamsylate on thromboelastographic traces of canine blood with and without the addition of heparin. Herrería-Bustillo V, Masiá-Castillo M, Phillips HRP, Gil-Vicente L.Vet Q. 2023 Dec;43(1):1-6. doi: 10.1080/01652176.2023.2260449.
Заключение после первого раунда рецензирования/ Recommendation after the first round of peer-review:
Переработка с повторным рецензированием / Major revision and re-review.
ВТОРОЙ РАУНД РЕЦЕНЗИРОВАНИЯ/ SECOND ROUND OF PEER-REVIEW
Авторы отредактировали и улучшили текст статьи. Однако имеются замечания, вопросы и рекомендации.
- Ввести расшифровку аббревиатуры ЦОГ в тексте.
- В предложении «(а) является ли снижение/прекращение послеоперационной гематурии следствием активации рецепторов, обеспечивающих увеличение секреции Р-селектина тромбоцитами…» (стр. 5) авторы имеют в
- виду экспрессию Р-селектина на поверхности тромбоцитов или выделение растворимой формы Р-селектина?
- В предложении (б) после (а) (там же на стр. 5) предлагается редакция «…сигнальных путей, способных усиливать агрегацию тромбоцитов».
- В цели исследования говорится о «внутриклеточной сигнализации», но сигналы здесь поступают снаружи через поверхностные рецепторы.
- В предложении «Введение стандартной дозы этамзилата через 24ч после КЛТ…» (стр. 9 раздел «Результаты») есть смысл уточнить, что это было введение четвертой стандартной дозы этамзилата.
- Так же в табл. 2 следует уточнить заголовки столбцов: «До 4-го введения этамзилата» и «Через 6 ч после четвертого введения этамзилата». Иначе создается впечатление, что «До введения этамзилата» означает, что его до этого ни разу не вводили.
- В обсуждении и выводах не нашел объяснения тот факт, что проагрегантный эффект этамзилата при макрогематурии после КЛТ проявлялся только после 4-го введения препарата, но не после 3-го.
Статья нуждается в дополнительном редактировании, в настоящем виде рекомендуется отклонить.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1164_В
|
Научная степень / Scientific degree | Кандидат медицинских наук / Cand. of Sci. (Medicine)
|
Страна/территория / Country/Territory | Россия / Russia
|
Дата рецензирования / Date of peer-review | 03.03.2025
|
Число раундов рецензирования / Number of peer-review rounds | 2 |
Финальное решение / Final decision | Принять к публикации /Accept
|
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Работа посвящена изучению купированию макрогематурии путем применения гемостатиков после контактной уретеролитотрипсии. Представленная рукопись, несомненно, обладает теоретической и практической значимостью. Работа имеет высокую актуальность и соответствует тематике журнала. Авторами проанализирована активность рецепторов, участвующих в регуляции агрегации тромбоцитов и факторов активации тромбоцитов (лиганд ФАТ-рецептора), аденозин (лиганд А2А- рецептора). Моделирование синергизма путей сигнализации воспроизводили при инкубации тромбоцитов с субпороговыми концентрациями агонистов (ЕС10). Оценку агрегации тромбоцитов проводили с использованием турбидиметрического метода.
Одновременно с этим важно отметить, что есть ряд критических замечаний, на которые авторам стоит обратить внимание. Можно полагать, что эти замечания устранимы, однако, без их учета рукопись не может быть рекомендована к принятию в журнал.
Авторам предлагается внести корректировки и дать ответы на следующие замечания:
- В отечественной и зарубежной литературе при упоминании уретеролитотрипсии подразумевается, что производится ретроградный доступ к камню через естественные мочевые пути. Необходимо дополнить и обосновать выбор метода лечения в объеме чрескожного антеградного доступа к камню мочеточника, описание самой методики, используемого оборудования и метода завершения операции.
- Чем обосновано проведение такого короткого периода проведения медикаментозной литокинетической терапии (МЛТ)? Согласно актуальным клиническим рекомендациям РФ: «Рекомендуется медикаментозная литокинетическая (камнеизгоняющая) терапия (МЛТ) лекарственными препаратами фармакологической группы селективных α1- адреноблокаторов (АТХ группа Альфа-адреноблокаторы) пациентам c камнями мочеточника размерами ≤ 7 мм и отсутствием показаний к оперативному лечению, с целью ускорения отхождения конкрементов. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1). Комментарии: вероятность отхождения конкремента из мочеточника обусловлена его размером и локализацией. Так вероятность самопроизвольного отхождения камня из мочеточника составляет 87%, 72%, 47% и 27% при размере камня 1, 4, 7, 10 мм соответственно. Примерно две трети камней мочеточника выходят самопроизвольно в течение 4-х недель. Рекомендуется прекращение МЛТ при отсутствии положительной динамики миграции камня в течение 28 дней и применение хирургических методов лечения»
- В исследовании «Giulioni C, Castellani D, Somani BK, et al. The efficacy of retrograde intra-renal surgery (RIRS) for lower pole stones: results from 2946 patients. World J Urol. 2023 May;41(5):1407-1413. doi: 10.1007/s00345-023-04363-6», на которое ссылаются авторы, из 2946 пациентов всего в 5,6% проявлялась гематурия, которая самостоятельно купировалась и в исследование рассматривают не КУЛТ, а РИРХ камня нижней чашечки почки.
На данный момент согласно Российской и мировой литературе одним из самых безопасных эндоурологических вмешательств является контактная уретеролитотрисия, особенно при камнях нижней и средней трети мочеточника при ее классическом трансуретральном исполнении, что подтверждает возможность выполнения такого рода пособий даже при приеме антикоагулянтов. На мой взгляд для демонстрации эффекта гемостатической терапии полезнее для практической урологии было провести данное исследование у больных после трансуретральных резекций/энуклеаций при гиперплазии простаты или после чрескожной нефролитотрипсии. Для камней более 1 см, эффективней является применение лапароскопичекой уретеролитотомии или гибкой КУЛТ с применением мочеточникого кожуха, для избежания осложнений, связанных с длительностью операции.
Заключение после первого раунда рецензирования/ Recommendation after the first round of peer-review:
Переработка с повторным рецензированием / Major revision and re-review.
ВТОРОЙ РАУНД РЕЦЕНЗИРОВАНИЯ/ SECOND ROUND OF PEER-REVIEW
Авторами даны ответы на поставленные вопросы. Следует указать в материалах и методах, что камни располагались в верхней трети мочеточника. С учетом указанного замечания статья может быть принята к печати.
РЕЦЕНЗЕНТ С / REVIEWER С
Инициалы / Initials | 1164_В
|
Научная степень / Scientific degree | Кандидат медицинских наук / Cand. of Sci. (Medicine)
|
Страна/территория / Country/Territory | Россия / Russia
|
Дата рецензирования / Date of peer-review | 01.03.2025
|
Число раундов рецензирования / Number of peer-review rounds | 2 |
Финальное решение / Final decision | Принять к публикации после небольшой доработки /Minor revision
|
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Цель исследования, несомненно, актуальна и отражает суть проблемы, заключающейся в важности изучения нарушений функциональной активности тромбоцитов с целью дальнейшей профилактики и/или купирования послеоперационных кровотечений, особенно при применении нестероидных противовоспалительных средств.
В статье представлена попытка оценить участие G-сопряженных с рецепторами тромбоцитов белков в ответе тромбоцитов на проводимую гемостатическую терапию, но методология не отвечает поставленной задаче. Практическая значимость результатов исследования, несомненно, важна для прогнозирования развития геморрагических осложнений и их купирования и/или дальнейшей профилактики при малоинвазивных вмешательствах в нефрологической практике на основании изучения роли активности рецепторов тромбоцитов и их участия в реакциях адгезии и агрегации, но заявленный метод исследования агрегационной способности тромбоцитов способен оценить лишь функциональную активность клеток, но не отдельных рецепторов.
Этические нормы при подготовке исследования и публикации соблюдены. Данное исследование одобрено Локальным этическим комитетом (№30/5-1, 23.05.2024г). Все пациенты, включенные в исследование, дали письменное информированное согласие на участие в работе. Авторы заявляют об отсутствии конфликта интересов. Исследование не имело спонсорской поддержки (собственные ресурсы).
В разделе материалы и методы исследования указано 42 пациента, получающих хирургическое лечение, в таблицах же их количество – 20, но нет указания на то, что именно у этих 20 пациентов развился геморрагический синдром или только им назначался этамзилат. Не указано в каком режиме пациенты получали нестероидные противовоспалительные средства (сколько раз и с каким интервалом).
Указано, что больные получали этамзилат в первые 24 часа после инвазивного вмешательства при наличии макрогематурии в суточной дозировке 500 мг, но не указано в каком режиме вводился гемостатический препарат (сколько раз и с каким интервалом). Также отмечено, что через 30 часов после вмешательства при сохраняющейся макрогематурии пациентам вновь вводился этамзилат в дозировке 250 мг, но не указано через какое время от последней инфузии. На мой взгляд, это не совсем соответствует инструкции к применению препарата.
Классификация гематурии, приведенная в разделе материалы и методы исследования, не соответствует тяжелой степени микрогематурии, приведенной в разделе результаты. Таким образом, сложно понять, гематурия через 30 часов после инвазивного вмешательства оценивалась только при применении нестероидных противовоспалительных препаратов и каковы временные промежутки ее клинической оценки – указания в разделе материалы и методы исследования на это не представлено. Рекомендуется систематизировать данные о пациентах и проводимой терапии.
Метод исследования, который применялся авторами статьи, может оценивать функциональную активность тромбоцитов, но не участие G-сопряженных с рецепторами тромбоцитов белков. Функциональная активность рецепторов тромбоцитов может быть оценена другими методами исследования (проточная цитофлуориметрия).
В заключении авторами отмечено, что длительное сохранение тяжелой степени микрогематурии после инвазивного вмешательства обусловлено действием нестероидных противовоспалительных средств, что не вызывает возражения. В связи с этим определение функциональной активности тромбоцитов у данной категории пациентов позволит оценить степень снижения агрегации, а не оценку участия G-сопряженных с рецепторами тромбоцитов белков, и персонифицировать гемостатическую терапию при угрозе и/или развитии геморрагического синдрома.
Используемая научная терминология соответствует рассматриваемой области знаний. Валидность и новизна выбранных литературных источников не вызывает сомнения. Список литературы представлен иностранными источниками, 73% из которых не более 5 лет.
В работе четко обозначен замысел исследования. Все части работы подчинены общей идее, но, по моему мнению, выражены нечетко – есть противоречия в описании материалов и методов исследования. В таблицах приведены результаты индуцированной агрегации тромбоцитов, но в таблице 1 не указаны какие показатели оценивались, можно подумать, что в процентах может быть указана амплитуда агрегации, но точного указания нет. Для обеспечения целостности текста рекомендуется результаты корреляционного анализа изложить в таблице, а не в тексте, так как это затрудняет восприятие. В разделах материалы и методы исследования, обсуждение и заключение рекомендуется использовать точные и одинаковые формулировки, чтобы прослеживалась логика отдельных положений и их обоснования.
Заключение после первого раунда рецензирования/ Recommendation after the first round of peer-review:
Переработка с повторным рецензированием / Major revision and re-review.
ВТОРОЙ РАУНД РЕЦЕНЗИРОВАНИЯ/ SECOND ROUND OF PEER-REVIEW
Учитывая, что первоначальное название статьи изменилось на «Влияние этамзилата на агрегацию тромбоцитов при макрогематурии, ассоциированной с уретеролитотрипсией», рекомендуется цель исследования согласовать с названием: Цель: изучить влияние этамзилата на агрегацию тромбоцитов…
Метод исследования агрегации тромбоцитов оценивает функциональную активность тромбоцитов, как в норме, так и при патологии, а также воздействии антитромбоцитарных и гемостатических препаратов, а не участие G-сопряженных с
рецепторами тромбоцитов белков, о чем говорилось ранее.
- В аннотации к статье фигурирует «сохранялась тяжелая степень микрогематурии», в разделе материалы и методы «развивалась макрогематурия» и «в связи с наличием макрогематурии или тяжелой степени микрогематурии». Рекомендуется привести в соответствие.
- Во введении фразу «Механизм действия препарата обусловлен активацией формирования тромбопластина» рекомендуется заменить на «активацией тканевого фактора».
- В разделе материалы и методы исследования указано 42 пациента, получающих хирургическое лечение, в таблицах же их количество – 20, но нет указания на то, что именно у этих 20 пациентов развился геморрагический синдром или только им назначался этамзилат. В таблице 1 данной информации нет. Ошибка устранена в таблице 4.
- Рекомендуется в таблице «ключевые положения», разделе материалы и методы и далее по тексту определить конкретно временные промежутки введения этамзилата.
- В разделе материалы и методы рекомендуется заменить антибиотики на антибактериальные препараты.
- В разделе материалы и методы указано «назначали неселективные НПВП (внутримышечно вводили 75мг два раза с интервалом 12ч)» рекомендуется уточнить какой препарат назначали пациентам, диклофенак натрия, как указано ранее? Рекомендуется унифицировать дозировки, так как в начале и конце раздела они разные.
- Метод исследования, который применялся авторами статьи, может оценивать функциональную активность тромбоцитов и косвенную оценку действия (функцию) рецепторов тромбоцитов.
- В таблице 1 описано лечение анальгетиками. Ненаркотические анальгетики относятся к группе нестероидных противовоспалительных средств. Рекомендуется уточнить группу препаратов.
- В таблице 4 рекомендуется убрать из названия слово характеристика.
- В разделе обсуждение фразу «на систему коагуляции крови» рекомендуется заменить на «систему гемостаза».
- Рекомендуется определить конкретные временные промежутки исследования агрегации тромбоцитов, в тексте имеются несоответствия.
- Рекомендуется определить конкретные временные промежутки введения нестероидных противовоспалительных препаратов, в тексте имеются несоответствия.
- Рекомендуется определить конкретные временные промежутки развития гематурии, в тексте имеются несоответствия.
- В разделе материалы и методы указано «Препарат (этамзилат) вводили внутривенно 4 раза в течение первых суток с интервалом в 6ч (по 125мг; суточная доза этамзилата составила 500мг)», что не соответствует инструкции к применению препарата. Рекомендуется уточнить, с какой целью, дозировка этамзилата была снижена.
- Рекомендуется систематизировать данные о пациентах и проводимой терапии, особенно раздел материалы и методы, так как текст сложно воспринимается, приходится все время уточнять данные в разных разделах статьи.
РЕКОМЕНДАЦИИ НАУЧНЫХ РЕДАКТОРОВ ЖУРНАЛА / RECOMMENDATIONS
OF THE SCIENTIFIC EDITORS OF THE JOURNAL
В названии предлагается отразить основной вывод работы.
Материалы и методы.
- Уточнить дизайн исследования и приложить соответствующий чек-лист EQUATOR https://www.equator-network.org//reporting-guidelines/ (например, https://www.equator-network.org/reporting-guidelines/improving-the-reportingquality-of-nonrandomized-evaluations-of-behavioral-and-public-health-interventionsthe-trend-statement/).
- Описать алгоритм набора пациентов, название медицинского учреждения, где осуществлялся набор.
- Привести потоковую диаграмму включения пациентов в исследование.
- Уточнить критерии включения, не включения, исключения.
- Привести обоснование размера выборки и обоснование отсутствия контрольной группы (группы сравнения)
- Число пациентов в разделе Материалы и Методы – 42, в таблицах 20. Целесообразно описать сколько пациентов включено в каждую часть исследования.
- Нарисовать схему эксперимента (черновик в формате ppt). Четко указать в схеме предмет исследования, временные точки взятия биологического материала, этапы исследования.
- В разделе «Статистический анализ» указать все используемые описательные и сравнительные методы, обоснование применения параметрических или непараметрических критериев.
- В результатах использована регрессионная модель. Необходимо описать тип модели, ее параметры, методику расчета доверительных интервалов для амплитуды агрегации, AUC и наклона кривой.
Результаты
- привести исходную характеристику пациентов в виде таблицы (пол, возраст, клинические, лабораторные, инструментальные данные пациентов, проводимое лечение).
- Исследовательские вопросы перенести раздел Материалы и методы.
- В разделе Результаты для двух Ваших исследовательских вопросов просьба создать два подзаголовка.
- Данные в таблицах 1 и 2 привести унифицировано: среднее со стандартным отклонением или медиана и интерквартильный размах, значения р приводятся в отдельным столбце (см. публикации в журнале).
- Множественные корреляции представить в виде рисунка или таблицы.
- Рекомендовано добавить иллюстрации для ROC-кривых.
Обсуждение должно начинаться с собственных результатов.
Добавить подраздел «Ограничения исследования» и направления для дальнейших исследований.
Необходимо скорректировать текст в соответствии с научным академическим стилем.