Перейти к:
3D-моделирование на основании совмещенной позитронно-эмиссионной и компьютерной томографии в выявлении опухолевой инвазии парагастральной клетчатки при раке желудка: пилотное исследование
https://doi.org/10.47093/2218-7332.2025.16.2.39-51
Аннотация
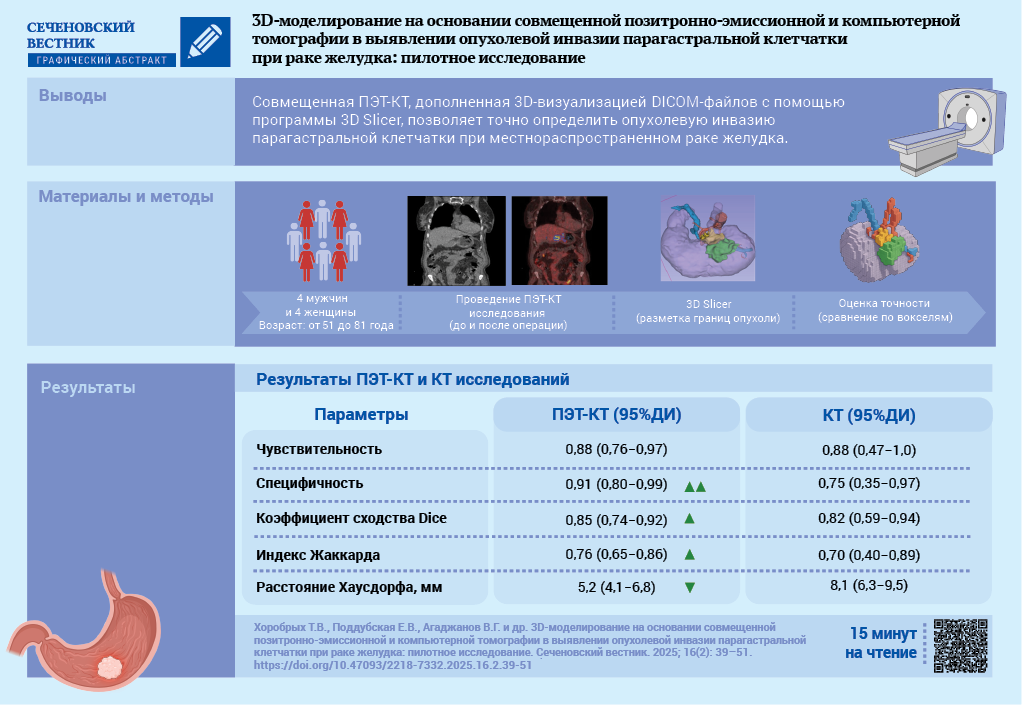
Цель. Оценить диагностические возможности совмещенной позитронно-эмиссионной томографии (ПЭТ) с накоплением 18-фтордезоксиглюкозы и компьютерной томографии (КТ), дополненных 3D-визуализацией DICOM-файлов с помощью программы 3D Slicer, в выявлении опухолевой инвазии парагастральной клетчатки при местнораспространенном раке желудка.
Материалы и методы. Проведено открытое проспективное исследование в рамках научно-исследовательского проекта «SmartGastro». В исследование включены 4 женщины и 4 мужчин в возрасте от 51 до 81 года с гистологически подтвержденным диагнозом «рак желудка». Всем пациентам выполняли совмещенную ПЭТ-КТ по протоколу «Whole body» на 60–80-й минуте после введения радиофармпрепарата (РФП). Обработка полученных результатов включала визуальный анализ КТ- и ПЭТ-изображений как по отдельности, так и совмещенных сканов, а также 3D-реконструкцию на основании денситометрического анализа DICOM-данных. Все пациенты были прооперированы. Удаленный макропрепарат поэтапно иссечен по периметру с последующим гистологическим исследованием краев резекции (парагастральной клетчатки). Во всех случаях подтверждена радикальность вмешательства R0. Первичную разметку границ опухоли по ПЭТ-КТ и КТ сравнивали по вокселям со вторичной разметкой, выполненной на основании визуального анализа удаленного макропрепарата.
Результаты. Компрометированная периопухолевая паракардиальная клетчатка по КТ в 5 из 8 наблюдений соответствовала зонам накопления РФП по ПЭТ. Участки повышенного накопления РФП в периопухолевой клетчатке и повышение денситометрической плотности этих же участков по данным КТ соответствовали истинной инвазии, подтвержденной при вторичной разметке, в 6 из 8 случаев. Чувствительность первичной разметки по совмещенной ПЭТ-КТ в сравнении по вокселям со вторичной разметкой составила 0,88 (95% доверительный интервал (ДИ) 0,76–0,97), специфичность – 0,91 (95% ДИ 0,80–0,99), расхождение границ опухоли, рассчитанное по расстоянию Хаусдорфа, составило 5,2 мм при средних размерах опухоли 38×30×39 мм.
Заключение. Совмещенная ПЭТ-КТ позволяет точно определить области компрометированного мезослоя жировой клетчатки. Создание 3D-моделей компрометированных опухолевым процессом парагастральных тканей в сочетании с визуализацией опухоли желудка и сосудов способствует комплексному предоперационному планированию онкологических операций.
Ключевые слова
Список сокращений
- ДИ – доверительный интервал
- КТ – компьютерная томография
- ПЭТ – позитронно-эмиссионная томография
- РФП – радиофармпрепарат
Рак желудка – четвертая по значимости причина в структуре смертности от злокачественных новообразований и пятая по распространенности в мире. Прогноз зависит от стадии заболевания. На момент постановки диагноза более чем у половины пациентов выявляется местнораспространенный процесс или отдаленные метастазы [1].
Диагностика рака желудка основана на совокупности инструментальных методов, таких как эзофагогастродуоденоскопия с биопсией, компьютерная томография (КТ) с внутривенным контрастированием, эндосонография, диагностическая лапароскопия с цитологическим исследованием перитонеальных смывов [2][3]. В последние годы появился метод совмещенной позитронно-эмиссионной томографии (ПЭТ) и КТ, который позволяет одновременно оценить морфологические и функциональные изменения. Данный метод можно использовать как для дооперационной оценки распространенности опухолей желудка, так и для оценки эффективности лечения. Совмещенная ПЭТ-КТ в предоперационной диагностике выполняется в тех случаях, когда стадирование стандартными методами исследования невозможно [4–7].
КТ с внутривенным контрастированием остается «золотым стандартом» диагностики и стадирования рака желудка и входит в список обязательных дооперационных исследований [8]. По данным литературы, чувствительность КТ в определении размеров первичной опухоли, при местнораспространенных процессах составляет от 68 до 85%, а при поражении регионарных лимфатических узлов – от 72 до 87%. Признаки вовлеченности клетчатки обычно ограничиваются визуальным анализом и ее описанием в виде перинодальных изменений, отека, уплотнения, тяжистости [9]. При анализе снимков КТ местнораспространенного рака желудка отмечается увеличение плотности парагастральной клетчатки, что визуально проявляется в виде крупной/мелкой тяжистости и измененных лимфатических узлов. Денситометрическая плотность этих участков клетчатки часто приближается к плотности опухоли, что затрудняет дифференцировку границ стенки желудка и окружающих тканей [10]. Разметка и реконструкция таких участков, а также их корреляция с уровнем накопления радиофармпрепарата (РФП) по данным ПЭТ и истиной морфологической картины может позволить визуализировать пути лимфооттока и создать персональную модель опухолевого процесса с целью предоперационной визуализации.
В связи с активным внедрением в онкологию методик эмбрионально-ориентированной хирургии понимание границ эмбрионального слоя позволяет резецировать орган в пределах его «зародышевых» фасциальных слоев, служащих естественными барьерами для опухолевых клеток. При этом в понятие мезогастрэктомии входит резекция не только отдельных лимфатических узлов, но и парагастральной клетчатки, лимфатических и кровеносных сосудов в ней [11–13].
Цель исследования: оценить диагностические возможности совмещенной ПЭТ-КТ с 18-фтордезоксиглюкозой и КТ, дополненными 3D-визуализацией DICOM-файлов с помощью программы 3D Slicer, в выявлении опухолевой инвазии парагастральной клетчатки при местнораспростаненном раке желудка.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено открытое проспективное исследование в рамках научно-исследовательского проекта «SmartGastro». Проводился сплошной набор пациентов из числа госпитализированных с впервые диагностированным раком желудка в клинику факультетской хирургии № 2 им. Г.И. Лукомского ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) в период с 1 марта 2021 г. по 30 октября 2024 г.
Набор пациентов
На рисунке 1 представлена потоковая диаграмма, отражающая включение пациентов в исследование. Осуществлялся сплошной набор пациентов. Всего для участия в исследовании оценено 37 пациентов, из которых ПЭТ-КТ выполнена 18. Критерии исключения выявлены у 10 пациентов. В исследование включены 8.
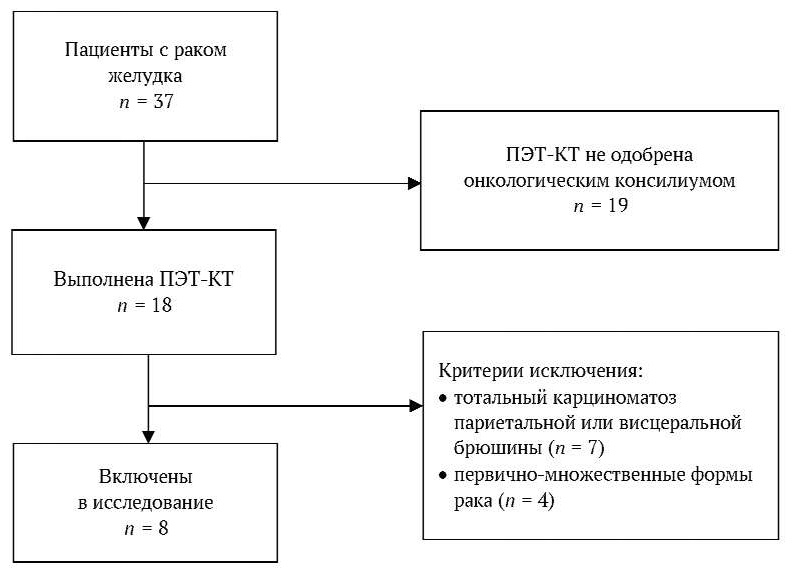
РИС. 1. Потоковая диаграмма включения пациентов в исследование.
Примечание: ПЭТ-КТ – позитронно-эмиссионная томография – компьютерная томография.
Критерии включения:
- Возраст 18 лет и старше.
- Общее состояние по шкале ECOG (Eastern Cooperative Oncology Group, Восточная кооперативная онкологическая группа) ≤2 [14].
- Морфологическая верификация рака желудка на дооперационном этапе методом эзофагогастродуоденоскопии с биопсией.
- Одобрение ПЭТ-КТ онкологическим консилиумом.
- Подписанное информированное согласие на участие в исследовании.
Критерии исключения:
- Тотальный канцероматоз париетальной или висцеральной брюшины (n = 7).
- Первично-множественные формы рака (n = 4).
Всем включенным в исследование пациентам выполняли хирургическое лечение рака желудка с последующим патоморфологическим исследованием операционного материала. Шести пациентам проводилась неоадъювантная химиотерапия.
Патоморфологическая оценка послеоперационного материала
Оценка гистологических препаратов производилась специалистами патологоанатомического отделения Сеченовского Университета в соответствии с рекомендациями Американского колледжа патологов1 и Классификации опухолей желудочно-кишечного тракта2. Удаленный препарат помещали в 10% раствор нейтрального формалина на 24 часа для фиксации. Определяли макроскопические характеристики препарата, морфологический тип роста, локализацию, размеры, расстояние от опухоли до границ резекции.
В препарате выделяли лимфатические узлы согласно классификации JGCA3. Затем препарат рассекали параллельными разрезами с последующей стандартной парафиновой проводкой и изготовлением серийных и ступенчатых гистологических срезов с окрашиванием гематоксилином и эозином. Микроскопически оценивали глубину инвазии опухоли, наличие опухолевых клеток вблизи зоны резекции, наличие метастазов в лимфатических узлах, малом и большом сальнике. Также оценивали общее число удаленных и метастатически пораженных лимфатических узлов. Радикальность оперативного вмешательства указывали следующим образом: R0 – отсутствие опухолевых клеток вблизи границ резекции, R1 – наличие опухолевых клеток в линии резекции микроскопически, R2 – наличие опухолевых клеток в линии резекции макроскопически, Rх – в случае невозможности оценить границы опухоли при ее фрагментации.
Методика проведения совмещенной ПЭТ-КТ
Совмещенная ПЭТ-КТ проводилась натощак на базе Центра «ПЭТ-Технолоджи» Сеченовского Университета. Пациентам вводили внутривенно РФП 18-фтордезоксиглюкозу в дозе 195–410 МБк (в зависимости от веса пациента), затем через 60–80 минут проводили сканирование. Всем пациентам выполняли стандартное исследование в режиме «Whole body» (от уровня глазниц до средней трети бедра) в сочетании с низкодозной КТ для коррекции аттенуации ПЭТ-данных.
Реконструкцию изображения осуществляли автоматически с дальнейшим совмещением ПЭТ- и КТ-снимков. Интерпретацию данных ПЭТ выполняли визуальным и полуколичественным способами. Визуальный анализ ПЭТ-сканов проводили с помощью серой и цветной шкал в трех проекциях с построением трехмерных изображений каждой проекции максимальной интенсивности. Обнаруженные на ПЭТ-сканах находки сравнивали с КТ-снимками, полученными в ходе одного и того же исследования.
Для полуколичественного анализа ПЭТ-снимков рассчитывали стандартизированное накопление РФП – standardized uptake value (SUVmax). Очаги повышенного накопления препарата (гиперметаболизма), не связанные с его физиологическим распределением, расценивали как патологические. Обработка полученных результатов включала визуальный анализ КТ- и ПЭТ-томограмм по отдельности, а также анализ совмещенных изображений. При этом точки периопухолевой жировой клетчатки сравнивали как по денситометрической плотности, так и по накоплению РФП.
Методика 3D-визуализации КТ-снимков
Дополнительно командой специалистов – онкологи, хирурги, радиологи (Л.М.Т. – лучевой диагност, стаж работы 5 лет, М.А.Ц. – лучевой диагност, стаж работы 3 года) выполняли реконструкцию опухолевого процесса в программе «3D Slicer image computing platform», которая распространяется под лицензией с открытым исходным кодом по инициативе «The Open Source Initiative» и не содержит ограничений на законное использование [15].
Лимфоваскулярную, периневральную или венозную инвазию клетчатки, а также наличие свободных опухолевых депозитов в ней обозначали термином «опухолевая инвазия парагастральной клетчатки». Процесс разметки компрометированной периопухолевой клетчатки происходил следующим образом: при наличии одного или нескольких визуальных признаков поражения клетчатки, таких как тяжистость, повышенное накопление контрастного препарата, наличие в клетчатке измененных лимфатических узлов, отмечались области с измерением ее средней денситометрической плотности. Для сравнения отмечали ряд областей с плотностями забрюшинной, околопочечной клетчатки, большого сальника. Рассчитывали среднее арифметическое значение нормальной клетчатки и сравнивали со значениями пораженной.
Методы компьютерного зрения и статистический анализ
Для оценки точности предоперационного определения локализации патологических очагов, обнаруженных с помощью совмещенной ПЭТ-КТ или КТ, проведено сравнение по вокселю с эталонной разметкой на КТ. Первичная разметка ПЭТ-КТ- и КТ-изображений выполнена лучевым диагностом в программе 3D Slicer методом объемной сегментации на основе денситометрического контрастного анализа. Послеоперационные («эталонные») границы опухоли вторично размечены на КТ другим лучевым диагностом в программе 3D Slicer на основании визуального анализа удаленного макропрепарата, который был поэтапно иссечен по периметру с последующим гистологическим исследованием краев резекции. Во всех случаях подтверждена радикальность вмешательства R0. Микрофотографии резецированных образцов желудка измерены в полностью развернутом виде для стандартизации объемных оценок. Вторичную разметку КТ-изображений использовали в качестве контрольной для расчета метрик точности, поскольку в данной модальности лучше видны края компрометированного мезослоя.
Ориентировочный объем опухоли был рассчитан на основе наибольших осевых диаметров, измеренных по КТ в трех ортогональных плоскостях: фронтальной (среднее значение 38 ± 2 мм), сагиттальной (среднее значение 30 ± 3 мм) и вертикальной (среднее значение 39 ± 3 мм). Эти размеры были использованы для ориентировочного определения гистологического эталонного объема опухоли, что обеспечило возможность интерпретации метрик, отражающих точность сегментации совмещенных ПЭТ-КТ-изображений и КТ-снимков.
Для количественной оценки пространственного соответствия границ опухоли по данным ПЭТ-КТ и КТ с гистологической разметкой были рассчитаны коэффициент сходства Dice (Dice Similarity Coefficient) и индекс Жаккарда (Intersection over Union). Для определения максимального расхождения границ опухоли по данным ПЭТ-КТ и КТ с гистологической разметкой было рассчитано расстояние Хаусдорфа.
Диагностическую эффективность первичной разметки (на ПЭТ-КТ или КТ) границ опухоли сравнивали с эталонной разметкой на КТ (построенной на основании макропрепарата и подтвержденной гистологически) с использованием показателей чувствительности и специфичности. Истинно положительными считали воксели, корректно идентифицированные как опухолевые как по первичной, так и по эталонной разметке; ложно положительными – воксели, определенные как опухолевые при первичной разметке, но не подтвержденные эталонной разметкой; ложно отрицательными – воксели, отнесенные к неопухолевым при первичной разметке, но относящиеся к опухолевым по эталонной разметке; истинно отрицательными – воксели, корректно классифицированные как неопухолевые и по первичной, и по эталонной разметке. Учитывая небольшой размер выборки (n = 8), 95% доверительные интервалы (ДИ) для определения чувствительности и специфичности были рассчитаны с использованием шкалы Уилсона.
При описании результатов вычисляли медиану, минимальное и максимальное значения. Анализ проводили на языке Python (версия 3.13) с использованием библиотек MONAI и SciPy. Статистически значимым считали значение p < 0,05.
РЕЗУЛЬТАТЫ
Исходные характеристики пациентов
Среди обследованных пациентов было 4 женщины и 4 мужчины в возрасте от 51 до 81 года. Физический статус по классификации ASA (The American Society of Anesthesiologists, Американское общество анестезиологов) [16] соответствовал у 6 из 8 пациентов II классу. В числе коморбидных заболеваний наиболее часто наблюдалась ишемическая болезнь сердца и сахарный диабет 2-го типа. Опухоль локализовалась у 3 пациентов в антральном отделе, у 4 в кардиальном отделе или теле и у 1 пациента наблюдалось субтотальное поражение. Локальные осложнения в виде кровотечения или стеноза наблюдались у половины пациентов (табл. 1).
Таблица 1. Клиническая характеристика пациентов
|
Признак |
Пациенты с раком желудка |
|
Мужчины, n (%) |
4 (50) |
|
Возраст, лет |
54 (51–81) |
|
Индекс массы тела, кг/м² |
23,8 (20,2–24,7) |
|
Физический статус по ASA, n (%) |
|
|
ASA I |
2 (25) |
|
ASA II |
6 (75) |
|
Состояние по шкале ECOG, n (%) |
|
|
0 |
2 (25) |
|
1 |
4 (50) |
|
2 |
2 (25) |
|
Коморбидность, n (%) |
|
|
ишемическая болезнь сердца |
3 (37,5) |
|
гипертоническая болезнь |
1 (12,5) |
|
фибрилляция предсердий |
1 (12,5) |
|
сахарный диабет 2-го типа |
2 (25) |
|
хроническая обструктивная болезнь легких |
2 (2) |
|
Локализация опухоли, n (%) |
|
|
кардия |
2 (25) |
|
тело |
2 (25) |
|
антральный отдел |
3 (37,5) |
|
субтотальное поражение |
1 (12,5) |
|
Осложнение опухолевого процесса, n (%) |
|
|
кровотечение |
1 (12,5) |
|
проксимальный стеноз |
1 (12,5) |
|
дистальный стеноз |
2 (25) |
Примечание: ASA – American Society of Anesthesiologists, система классификации физического статуса пациентов Американского общества анестезиологов; ECOG – Eastern Cooperative Oncology Group, Восточная кооперативная онкологическая группа.
В таблице 2 представлена характеристика опухолевого процесса и проведенного лечения. Патоморфологический тип опухоли у всех пациентов был идентичным как по результатам дооперационной биопсии, так и по результатам гистологического исследования макропрепарата, полученного после оперативного лечения.
Таблица 2. Характеристики рака желудка до и после лечения
|
№ |
Лок. |
cTNM, тип, степень дифференцировки |
Лечение |
pTNM |
Инвазия |
МГ, HU |
ПЭТ/КТ сходится с 3D-КТ |
||
|
ЛВ |
ПН |
ПГ |
|||||||
|
1 |
ПЖП |
cT3N2M0, аденокарцинома, G1 |
Резекция проксимального отдела желудка и терминального отдела пищевода D2 |
pT4aN2M0 |
+ |
+ |
+ |
32,8 |
+ |
|
2 |
ПЖП |
cT4aN1M1, плоскоклеточная карцинома |
НАХТ, гастрэктомия и резекция терминального отдела пищевода D2 |
pT4aN1M1 |
+ |
- |
+ |
26,4 |
+ |
|
3 |
ТЖ |
cT3N1M0, аденокарцинома, G2 |
НАХТ, гастрэктомия D2 |
pT3N2M0 |
+ |
- |
+ |
44,5 |
+ |
|
4 |
ТЖ |
cT3N1M0, аденокарцинома, G3 |
НАХТ, гастрэктомия D2 |
pT3N0M0 |
- |
- |
- |
56,3 |
- |
|
5 |
АОЖ |
cT3N2M0, аденокарцинома, G1; с перстневидными клетками |
НАХТ, дистальная резекция желудка D2 |
pT3N1M0 |
+ |
- |
+ |
54,3 |
- |
|
6 |
АОЖ |
cT4bN1M0, аденокарцинома, G2 |
НАХТ, дистальная резекция желудка D2 |
pT4bN1M0 |
+ |
+ |
+ |
30,7 |
+ |
|
7 |
АОЖ |
cT3N1M0, аденокарцинома, G1 |
НАХТ, дистальная резекция желудка D2 |
pT3N2M1 |
- |
+ |
- |
43,1 |
- |
|
8 |
СПЖ |
cT4aN2M1, перстневидно-клеточный рак |
НАХТ, гастрэктомия D2 |
pT3N2M1 |
+ |
- |
+ |
29,1 |
+ |
Примечание: cTNM – клиническая стадия; HU – Hounsfield unit, единицы Хаунсфилда; pTNM – патоморфологическая стадия; АОЖ – антральный отдел желудка; КТ – компьютерная томография; ЛВ – лимфоваскулярная; Лок. – локализация; МГ – мезогастрий; НАХТ – неоадъювантная химиотерапия; ПГ – парагастральная (свободные опухолевые клетки); ПЖП – пищеводно-желудочный переход (Siewert II); ПН – периневральная; ПЭТ – позитронно-эмиссионная томография; СПЖ – субтотальное поражение желудка; ТЖ – тело желудка.
Маркировка опухоли на основе совмещенной ПЭТ-КТ
Среднее максимальное значение уровня захвата (SUVmax) РФП в участках, где отмечался гиперметаболизм, у пациентов с опухолью антрального отдела составило 17,8 ± 1,3; тела желудка – 19,4; кардиоэзофагеального перехода – 14,7. Это позволило детализировать процесс разграничения области патологических изменений.
В опухолях с наименьшей дифференцировкой клеток наблюдалось более высокое накопление РФП, что связано с их повышенной способностью к делению. Однако в двух случаях, при перстневидном раке (пациент № 8) и аденокарциноме с перстневидными клетками (пациент № 5), уровень накопления был низким, что, вероятно, обусловлено биохимическими особенностями опухоли.
При совмещении визуально измененных по КТ регионарных лимфатических узлов с зонами гиперфиксации РФП по ПЭТ-КТ в 5 из 8 случаев установлено соответствие данных КТ и ПЭТ. Инвазия опухоли в прилежащие органы – поджелудочную железу (1 пациент) по данным совмещенной ПЭТ-КТ проявлялась наличием гиперметаболизма РФП и уменьшением денситометрических показателей поджелудочной железы и селезенки (до 20 HU) в участках, прилегающих к опухоли.
Согласно классификации TNM, характерными КТ-признаками при Т3 стадии (5 пациентов) были неровные контуры наружной стенки органа и инфильтрация парагастральной клетчатки. При распространенности Т4 (3 пациента) выход опухоли за пределы стенки желудка сопровождался инфильтрацией жировой клетчатки. При этом контур органа при КТ и ПЭТ становился нечетким и бахромчатым, а параэзофагеальная клетчатка была утолщена и окружала пищевод в виде звездчатого «ободка» с пониженными денситометрическими показателями (20–70 HU).
При прорастании опухолью стенки желудка выявляли изменения в парагастральной клетчатке, которые регистрировали и при КТ, и при ПЭТ. Если опухолевое поражение распространялось на связки, то наблюдали уплотнение различной интенсивности брюшинных листков связок и жировой клетчатки, содержащейся между связками. Компрометированная (денситометрически уплотненная) периопухолевая паракардиальная клетчатка по КТ в 5 из 8 наблюдений соответствовала зонам накопления РФП по ПЭТ.
Участки повышенного накопления РФП в периопухолевой клетчатке и повышение денситометрической плотности этих же участков по результатам КТ соответствовали истинной инвазии, подтвержденной при гистологическом исследовании удаленного макропрепарата в 6 из 8 случаев.
При сравнении по вокселям установлено, что первичная разметка совмещенной ПЭТ-КТ характеризуется более высокой диагностической точностью, чем первичная разметка только по КТ (табл. 3). Первичная разметка по совмещенной ПЭТ-КТ статистически значимо не отличалась от вторичной разметки по КТ с применением 3D-визуализации (р = 0,41). Первичная разметка только по КТ менее точна, чем вторичная разметка по КТ с применением 3D-визуализации (р = 0,033).
Таблица 3. Сравнение диагностической точности первичной разметки (на ПЭТ-КТ или КТ) границ опухоли с эталонной разметкой на КТ (построенной на основании макропрепарата и подтвержденной гистологически)
|
ПЭТ-КТ |
КТ |
|
|
Чувствительность |
0,88 (95% ДИ 0,76–0,97) |
0,88 (95% ДИ 0,47–1,0) |
|
Специфичность |
0,91 (95% ДИ 0,80–0,99) |
0,75 (95% ДИ 0,35–0,97) |
|
Коэффициент сходства Dice |
0,85 (95% ДИ 0,74–0,92) |
0,82 (95% ДИ 0,59–0,94) |
|
Индекс Жаккарда |
0,76 (95% ДИ 0,65–0,86) |
0,70 (95% ДИ 0,40–0,89) |
|
Расстояние Хаусдорфа, мм |
5,2 (95% ДИ 4,1–6,8) |
8,1 (95% ДИ 6,3–9,5) |
Примечание: ДИ – доверительный интервал; КТ – компьютерная томография; ПЭТ – позитронно-эмиссионная томография.
Примеры 3D-моделирования опухоли на основе КТ-снимков
При визуальном экспертном анализе границы опухоли по данным КТ без контрастирования не видны или дифференцируются нечетко (рис. 2А, 3А, 4А). По данным совмещенной ПЭТ-КТ опухоль визуализируется, однако затруднена дифференцировка между опухолью и парагастральной клетчаткой (рис. 4). При выполнении 3D-реконструкции на основании денситометрической плотности тканей, оцененной по DICOM-данным КТ, отмечена удовлетворительная визуализация как опухоли, так и парагастральной клетчатки (рис. 4).
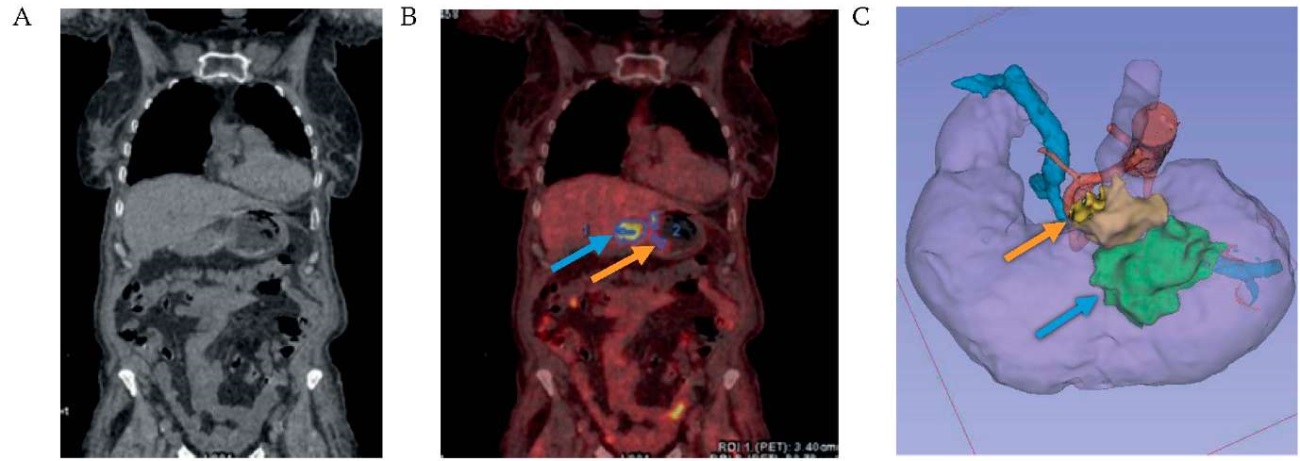
РИС. 2. Визуализация рака средней трети тела желудка.
А. Компьютерная томография без контрастирования.
В. Совмещенная позитронно-эмиссионная и компьютерная томография.
С. 3D-модель мезогастрия на основе DICOM-данных компьютерной томографии.
Примечание: уровень накопления радиофармпрепарата 18-фтордезоксиглюкозы в опухоли (голубая стрелка) и парагастральной клетчатке (оранжевая стрелка).
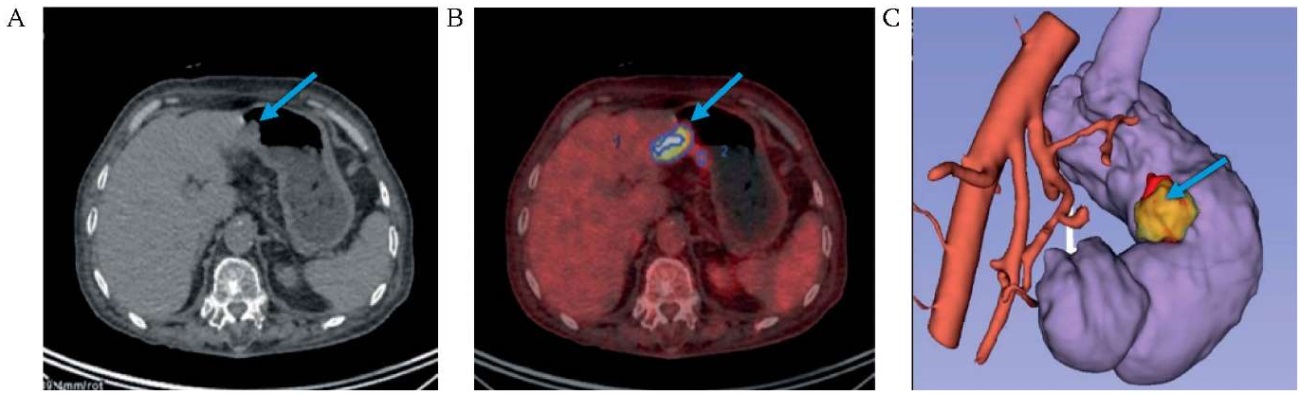
РИС. 3. Визуализация рака антрального отдела желудка (стрелка).
А. Компьютерная томография без контрастирования.
В. Совмещенная позитронно-эмиссионная и компьютерная томография.
С. 3D-модель мезогастрия на основе DICOM-данных компьютерной томографии.
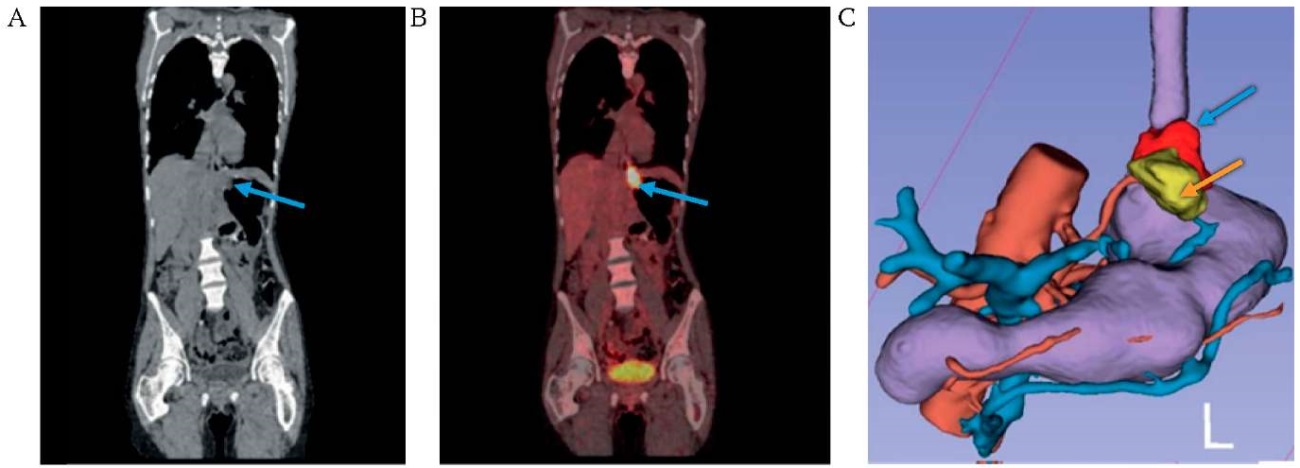
РИС. 4. Визуализация рака кардиоэзофагеального перехода.
А. Компьютерная томография без контрастирования.
В. Совмещенная позитронно-эмиссионная и компьютерная томография.
С. 3D-модель мезогастрия на основе DICOM-данных компьютерной томографии.
Примечание: уровень накопления радиофармпрепарата 18-фтордезоксиглюкозы в опухоли (голубая стрелка) и парагастральной клетчатке (оранжевая стрелка).
ОБСУЖДЕНИЕ
Маркировка границ опухоли на основе совмещенной ПЭТ-КТ характеризуется высокой точностью (чувствительность – 0,88, специфичность – 0,91) при сравнении с границами опухоли при гистологическом исследовании послеоперационного материала. При количественной оценке совпадения границ разметки, полученных при сегментации ПЭТ-КТ и гистологических микропрепаратов, зарегистрированы высокие коэффициенты сходства (коэффициент Dice 0,85, индекс Жаккарда 0,76), а максимальное расхождение границ опухоли по данным двух исследований, рассчитанное по расстоянию Хаусдорфа, составило в среднем 5,2 мм. Учитывая средние размеры опухоли 38×30×39 мм, данный показатель можно интерпретировать как удовлетворительный. При маркировке границ опухоли только на основе КТ показатели, оценивающие точность, были несколько ниже. Однако, несмотря на сопоставимые результаты, более широкие доверительные интервалы, наблюдаемые при сегментации компрометированного мезослоя на основе КТ, свидетельствуют о большей изменчивости и «случайности» определения границ в областях с едва заметной инвазией опухоли, таких как парагастральный слой. Таким образом, КТ обеспечивает менее последовательное очерчивание границ опухоли по сравнению с ПЭТ-КТ.
Периопухолевая жировая клетчатка – элемент «эмбрионального мезогастрия» – часто является компрометированной и уплотненной по данным КТ при местнораспространенных процессах. Опухолевая инвазия данной клетчатки (венозная, лимфоваскулярная и периневральная) считается негативным фактором прогноза [17–23]. В проведенном исследовании у 5 из 8 пациентов денситометрически уплотненная по данным КТ периопухолевая клетчатка соответствовала зонам накопления РФП при ПЭТ, что в совокупности с послеоперационными патоморфологическими данными позволило выявить зависимость между ее плотностью и истинной опухолевой инвазией.
В исследовании дополнительно анализировали плотность периопухолевой клетчатки, реконструировали данные участки в программе 3D Slicer на основе КТ-снимков в рамках выполнения совмещенной ПЭТ-КТ и сравнили полученные 3D-модели с данными «эталонной» разметки ПЭТ-КТ. Моделирование опухолевого процесса на основании DICOM-файлов КТ на протяжении нескольких лет используется в урологии, торакальной хирургии, панкреатологии. Например, отечественные ученые разработали нейронную сеть для построения 3D-моделей опухолей почек [24]. При этом главную роль в моделировании играет ангиоархитектоника – моделирование сосудов как основного ориентира для лимфодиссекции [25–28]. Методы предоперационного 3D-моделирования подразумевают построение модели самой опухоли и определение ее положения относительно сосудов [9][19]. С внедрением в практику лапароскопических операций, которые проводятся в условиях ограниченного визуального контроля и без тактильной чувствительности, появилась необходимость в создании единых анатомических ориентиров, анатомической навигации и стандартизации технических приемов [29][30].
Корейскими и японскими хирургами проведены успешные попытки создания программ по реконструкции желудка, сосудов чревного ствола и взаимоотношения желудка и окружающих органов на основании КТ. В качестве примера – последняя разработка Корейского национального института во главе с профессором W.J. Hyung – программа RUSтм, в которой моделируется интраоперационная картина с имитацией пневмоперитонеума на основании DICOM-файлов КТ, затем хирургами проводится оценка индивидуальной анатомии желудка, его сосудов и окружающих органов [25]. Имитация пневмоперитонеума позволяет максимально точно смоделировать интраоперационную картину и этапы операции. При валидации указанного программного обеспечения у пациентов с раком желудка авторы подтвердили точность 3D-реконструкции. Однако в данной программе периопухолевая жировая клетчатка авторами не упоминается.
Другой алгоритм 3D-реконструкции желудка и окружающих тканей для предоперационного планирования разработан Jin Woong Kim и соавт. [31], однако этот метод основан на данных КТ с контрастным усилением и виртуальной эзофагогастродуоденоскопии. В связи с этим снижается информативность и точность реконструкции опухоли и пораженных окружающих тканей при ранних стадиях онкологического процесса по сравнению с методом совмещенной ПЭТ-КТ, так как на КТ-изображениях цветовой спектр резко ограничен. При начальных стадиях (поверхностное пристеночное поражение) по данным стандартной эзофагогастродуоденоскопии только изменение цвета слизистой оболочки указывает на наличие опухоли без существенных изменений складок. Таким образом, если аномальное утолщение слизистой оболочки, связанное с опухолью, не регистрируется на 2D-изображениях, то основанная на данном методе 3D-реконструкция не позволит обнаружить опухоль и построить детальную трехмерную модель. Кроме того, следует отметить, что желудочная секреция, остатки пищи, линия механического шва/клипсы могут мимикрировать под рак желудка и быть спутаны с истинным поражением.
Преимуществами 3D моделирования опухолевого процесса с использованием программы 3D Slicer являются малая инвазивность метода и его экономическая эффективность, поскольку реконструкция основана на данных КТ с внутривенным контрастированием – рутинном, обязательном исследовании, включенном в клинические рекомендации. Кроме того, при 3D-реконструкции возможно воссоздание точной архитектоники периопухолевой клетчатки с прилежащими венами, лимфатическими сосудами и нервными волокнами, что позволяет улучшить радикальность оперативного вмешательства и увеличить 5-летнюю выживаемость пациентов. Предложенный метод позволит онкологам, хирургам на дооперационном этапе определять границы распространенности опухоли и удалять ее в пределах здоровых тканей, что должно улучшить прогноз и выживаемость пациентов с раком желудка.
Ограничения исследования и направления для дальнейших исследований
Ограничениями исследования являются небольшая выборка пациентов, малый срок наблюдения для оценки прогноза и выживаемости пациентов, а также низкая чувствительность КТ в диагностике поражения жировой клетчатки. Дальнейшая разработка дооперационного 3D-моделирования мезогастрального слоя может дать возможность обнаружить опухолевое поражение участков с большей денситометрической плотностью. При большей выборке пациентов возможно создание набора данных на основании размеченных DICOM-файлов и обучение более эффективных моделей, помогающих в принятии врачебных решений.
Заключение
В исследовании установлена высокая точность совмещенной ПЭТ-КТ: чувствительность – 0,88 (95% ДИ: 0,76–0,97), специфичность – 0,91 (95% ДИ: 0,80–0,99) в определении области компрометированного мезослоя жировой клетчатки у пациентов с раком желудка. Продемонстрировано, что ПЭТ-КТ обеспечивает более высокую точность при выявлении опухолевой инвазии по сравнению с КТ, поскольку в области компрометированного мезослоя жировой клетчатки границы опухоли на КТ слабо дифференцируются из-за схожей плотности тканей и отсутствия выраженного контрастирования, что затрудняет точную предоперационную оценку инвазии. Создание 3D-моделей этих зон на основе DICOM-файлов КТ в сочетании с визуализацией опухоли желудка и сосудов по совмещенной ПЭТ-КТ позволяет точно определять границы опухоли и способствует комплексному предоперационному планированию онкологических операций.
Вклад авторов
Т.В. Хоробрых, В.Г. Агаджанов, И.В. Ивашов выполняли операции, подготовку диагностических исследований, разметку DICOM-файлов, анализ результатов, разработку концепции и дизайна исследования. Л.М. Тулина выполняла позитронную эмиссионную томографию с 18-фтордезоксиглюкозой и компьютерную томографию с внутривенным контрастированием. А.В. Грачалов, М.А. Цай, З.А. Омарова выполняли разметку DICOM-файлов, построение и анализ 3D-моделей, сбор данных, подготовку текста рукописи. Е.В. Поддубская проводила коррекцию и критический пересмотр рукописи. Я.А. Драч проводил статистический анализ, разрабатывал методику сбора и анализа данных, подготовил текст рукописи, строил и анализировал 3D-модели. Все авторы одобрили окончательную версию статьи.
Author contributions
Tatiana V. Khorobrykh, Vadim G. Agadzhanov, Ivan V. Ivashov performed the surgical procedures, collected diagnostic data, marked up DICOM files, analyzed the results, and developed the concept and design of the study. Larisa M. Tulina performed positron emission tomography with 18-fluorodeoxyglucose and computed tomography with intravenous contrast. Anton V. Grachalov, Maria A. Tsai, Zumrud A. Omarova marked up DICOM files, created and analyzed the 3D models, collected data for research and prepared the manuscript. Elena V. Poddubskaya corrected and critically revisited the manuscript. Iaroslav A. Drach performed the statistical analysis, developed methods for collecting and analyzing data, prepared the text of the manuscript as well as constructed and analyzed the 3D models. All the authors approved the final version of the article.
Соответствие принципам этики. Исследование одобрено Локальным этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) № 09-24 от 04.04.2024. Все пациенты дали письменное информированное согласие на участие в исследовании.
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу. Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Благодарности. Авторы статьи выражают благодарность специалистам по лучевой диагностике Муравлеву Алексею Павловичу (Университетская клиническая больница № 4 Клинического центра ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)) и Кондрашиной Ольге Сергеевне (НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова) за помощь в консультации, интерпретации полученных диагностических данных.
Ethics statements. The study was approved by the Local Ethics Committee of Federal State Autonomous Educational Institution of Sechenov First Moscow State Medical University (Sechenov University), No. 09-24 from 04.04.2024. All patients signed an informed consent to participate in the study.
Data availability. The data confirming the findings of this study are available from the authors upon request. Data and statistical methods used in the article were examined by a professional biostatistician who sits on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interest.
Funding. The study was self-funded.
Acknowledgments. The authors would like to express their gratitude to Alexey P. Muravlev, a specialist in radiation diagnostics (Sechenov First Moscow State Medical University (Sechenov University)), and Olga S. Kondrashina (Kulakov Research Center for Obstetrics, Gynecology and Perinatology) for their assistance in consulting and interpreting the diagnostic data obtained.
1. College of American Pathologists. Stomach Cancer Resection Protocol. Версия 4.1.0.0. https://documents.cap.org/protocols/cpgiupper-stomach-20-4100.pdf (дата обращения: 23.08.2024).
2. WHO Classification of Tumours Editorial Board. Digestive System Tumours. 5th ed. Лион: IARC; 2019. https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/Digestive-System-Tumours-2019 (дата обращения: 23.08.2024).
3. Японская ассоциация по изучению рака желудка. Japanese Classification of Gastric Carcinoma. 2nd English ed. Токио: Kanehara; 1998. https://www.jgca.jp/wp-content/uploads/2023/08/JCGC-2E.pdf (дата обращения: 23.08.2024).
Список литературы
1. Yang W.J., Zhao H.P., Yu Y., et al. Updates on global epidemiology, risk and prognostic factors of gastric cancer. World J Gastroenterol. 2023 Apr 28;29(16):2452–2468. https://doi.org/10.3748/wjg.v29.i16.2452. PMID: 37179585
2. Withey S.J., Goh V., Foley K.G. State-of-the-art imaging in oesophago-gastric cancer. Br J Radiol. 2022 Sep 1;95(1137):20220410. https://doi.org/10.1259/bjr.20220410. Epub 2022 Jun 15. PMID: 35671095
3. Chen Q.Y., Zhong Q., Liu Z.Y., et al. Indocyanine green fluorescence imaging-guided versus conventional laparoscopic lymphadenectomy for gastric cancer: long-term outcomes of a phase 3 randomised clinical trial. Nat Commun. 2023 Nov 16;14(1):7413. https://doi.org/10.1038/s41467-023-42712-6. PMID: 37973806
4. Ruan D., Zhao L., Cai J., et al. Evaluation of FAPI PET imaging in gastric cancer: a systematic review and metaanalysis. Theranostics. 2023 Aug 21;13(13):4694–4710. https://doi.org/10.7150/thno.88335. PMID: 37649615
5. Lordick F., Carneiro F., Cascinu S., et al. Electronic address: clinicalguidelines@esmo.org. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Oct;33(10):1005–1020. https://doi.org/10.1016/j.annonc.2022.07.004. Epub 2022 Jul 29. PMID: 35914639
6. López Sala P., Leturia Etxeberria M., Inchausti Iguíñiz E., et al. Gastric adenocarcinoma: A review of the TNM classification system and ways of spreading. Radiologia (Engl Ed). 2023 Jan-Feb;65(1):66–80. https://doi.org/10.1016/j.rxeng.2022.10.011. PMID: 36842787
7. Ma D., Zhang Y., Shao X., Wu C., Wu J. PET/CT for predicting occult lymph node metastasis in gastric cancer. Curr Oncol. 2022 Sep 11;29(9):6523–6539. https://doi.org/10.3390/curroncol29090513. PMID: 36135082
8. Sun J., Wang Z., Zhu H., Yang Q., Sun Y. Advanced gastric cancer: CT radiomics prediction of lymph modes metastasis after neoadjuvant chemotherapy. J Imaging Inform Med. 2024 Dec;37(6):2910–2919. https://doi.org/10.1007/s10278-024-01148-0. Epub 2024 Jun 17. PMID: 38886288
9. Awiwi M.O., Ramanan R.V., Elshikh M., Vikram R. Imaging of gastric carcinoma. Part one: diagnosis and staging. J Gastrointest Abdom Radiol. 2021;4(03):194–205. https://doi.org/10.1055/s-0041-1735217. ISSN 2581-9933
10. Shinohara H., Kurahashi Y., Haruta S., Ishida Y., Sasako M. Universalization of the operative strategy by systematic mesogastric excision for stomach cancer with that for total mesorectal excision and complete mesocolic excision colorectal counterparts. Ann Gastroenterol Surg. 2017 Oct 23;2(1):28–36. https://doi.org/10.1002/ags3.12048. PMID: 29863126
11. Shinohara H. Illustrated abdominal surgery: based on embryology and anatomy of the digestive system. 2020. https://doi.org/10.1007/978-981-15-1796-9. ISBN: 978-981-15-1795-2
12. Nakamura T., Yamada S., Funatomi T., et al. Three-dimensional morphogenesis of the omental bursa from four recesses in staged human embryos. J Anat. 2020 Jul;237(1):166–175. https://doi.org/10.1111/joa.13174. Epub 2020 Feb 16. PMID: 32064626
13. Ma T., Li X., Zhang T., et al. Effect of visceral adipose tissue on the accuracy of preoperative T-staging of gastric cancer. Eur J Radiol. 2022 Oct;155:110488. https://doi.org/10.1016/j.ejrad.2022.110488. Epub 2022 Aug 17. PMID: 35988392
14. Sok M., Zavrl M., Greif B., Srpčič M. Objective assessment of WHO/ECOG performance status. Support Care Cancer. 2019 Oct;27(10):3793–3798. https://doi.org/10.1007/s00520-018-4597-z. Epub 2019 Feb 5. PMID: 30721369
15. Fedorov A., Beichel R., Kalpathy-Cramer J., et al. 3D Slicer as an image computing platform for the Quantitative Imaging Network. Magn Reson Imaging. 2012 Nov;30(9):1323–1341. https://doi.org/10.1016/j.mri.2012.05.001. Epub 2012 Jul 6. PMID: 22770690
16. Mak P.H.K., Campbell R.C.H., Irwin M.G. American Society of Anesthesiologists. The ASA Physical Status Classification: interobserver consistency. American Society of Anesthesiologists. Anaesth Intensive Care. 2002 Oct;30(5):633–640. https://doi.org/10.1177/0310057X0203000516. PMID: 12413266
17. Kulig P., Pach R., Majewska O., Kulig J. Clinicopathological prognostic factors determining outcomes of treatment in gastric cancer surgery. In Vivo. 2022 Nov-Dec;36(6):2927–2935. https://doi.org/10.21873/invivo.13035. PMID: 36309397
18. Kinami S., Nakamura N., Miyashita T., et al. Life prognosis of sentinel node navigation surgery for early-stage gastric cancer: Outcome of lymphatic basin dissection. World J Gastroenterol. 2021 Dec 14;27(46):8010–8030. https://doi.org/10.3748/wjg.v27.i46.8010. PMID: 35046627
19. Ebihara Y., Kyogoku N., Murakami Y., et al. Relationship between laparoscopic total gastrectomy-associated postoperative complications and gastric cancer prognosis. Updates Surg. 2023 Jan;75(1):149–158. https://doi.org/10.1007/s13304-022-01402-6. Epub 2022 Nov 11. PMID: 36369627
20. Liu H., Wang F., Liu B., et al. Application of three-dimensional reconstruction with a Hisense computer-assisted system in upper pancreatic lymph node dissection during laparoscopic-assisted radical gastrectomy. Asian J Surg. 2021 May;44(5):730–737. https://doi.org/10.1016/j.asjsur.2020.12.034. Epub 2021 Jan 23. PMID: 33500172
21. Guo D., Zhu X.Y., Han S., Liu Y.S., Cui D.P. Evaluating the use of three-dimensional reconstruction visualization technology for precise laparoscopic resection in gastroesophageal junction cancer. World J Gastrointest Surg. 2024 May 27;16(5):1311–1319. https://doi.org/10.4240/wjgs.v16.i5.1311. PMID: 38817296
22. Iino I., Kikuchi H., Suzuki T., et al. Comprehensive evaluation of three-dimensional anatomy of perigastric vessels using enhanced multidetector-row computed tomography. BMC Surg. 2022 Nov 21;22(1):403. https://doi.org/10.1186/s12893-022-01836-0. PMID: 36404317
23. Zhang L., Zheng F., Peng Z., Hu Z., Yang Z. A feasible method of angiogenesis assessment in gastric cancer using 3D microvessel density. Stem Cells Int. 2018 Apr 3;2018:7813729. https://doi.org/10.1155/2018/7813729. PMID: 29765420
24. Черненький И.М., Черненький М.М., Фиев Д.Н., Сирота Е.С. Сегментация почечных структур по изображениям контрастной компьютерной томографии с помощью сверточной нейронной сети. Сеченовский вестник. 2023;14(1):39–49. https://doi.org/10.47093/2218-7332.2023.14.1.39-49. EDN OKTADT
25. Park S.H., Kim K.Y., Kim Y.M., Hyung W.J. Patient-specific virtual three-dimensional surgical navigation for gastric cancer surgery: A prospective study for preoperative planning and intraoperative guidance. Front Oncol. 2023 Feb 21;13: 1140175. https://doi.org/10.3389/fonc.2023.1140175. PMID: 36895483
26. Lopez P., Belgacem A., Sarnacki S., et al. Enhancing surgical planning for abdominal tumors in children through advanced 3D visualization techniques: a systematic review of future prospects. Front Pediatr. 2024 May 7;12:1386280. https://doi.org/10.3389/fped.2024.1386280. PMID: 38863523
27. Cheng J., Wang Z., Liu J., et al. Value of 3D printing technology combined with indocyanine green fluorescent navigation in complex laparoscopic hepatectomy. PLoS One. 2022 Aug 11;17(8):e0272815. https://doi.org/10.1371/journal.pone.0272815. PMID: 35951521
28. Husarova T., MacCuaig W.M., Dennahy I.S., et al. Intraoperative imaging in hepatopancreatobiliary surgery. Cancers (Basel). 2023 Jul 20;15(14):3694. https://doi.org/10.3390/cancers15143694. PMID: 37509355
29. Han Z., Dou Q. A review on organ deformation modeling approaches for reliable surgical navigation using augmented reality. Comput Assist Surg (Abingdon). 2024 Dec;29(1):2357164. https://doi.org/10.1080/24699322.2024.2357164. Epub 2024 Sep 10. PMID: 39253945
30. Wang Y., Cao D., Chen S.L., et al. Current trends in three-dimensional visualization and real-time navigation as well as robot-assisted technologies in hepatobiliary surgery. World J Gastrointest Surg. 2021 Sep 27;13(9):904–922. https://doi.org/10.4240/wjgs.v13.i9.904. PMID: 34621469
31. Kim J.W., Shin S.S., Heo S.H., et al. The role of three-dimensional multidetector CT gastrography in the preoperative imaging of stomach cancer: emphasis on detection and localization of the tumor. Korean J Radiol. 2015 Jan-Feb;16(1):80–89. https://doi.org/10.3348/kjr.2015.16.1.80. Epub 2015 Jan 9. PMID: 25598676
Об авторах
Т. В. ХоробрыхРоссия
Хоробрых Татьяна Витальевна, д-р мед. наук, профессор РАН, директор клиники факультетской хирургии № 2 им. Г.И. Лукомского
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Е. В. Поддубская
Россия
Поддубская Елена Владимировна, канд. мед. наук, старший научный сотрудник Института персонализированной
онкологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
В. Г. Агаджанов
Россия
Агаджанов Вадим Гамлетович, канд. мед. наук, доцент кафедры факультетской хирургии № 2 им. Г.И. Лукомского
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Л. М. Тулина
Россия
Тулина Лариса Михайловна, канд. мед. наук, доцент кафедры фармакологии; главный врач
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
ул. Большая Пироговская, д. 2, стр. 8, г. Москва, 119435
И. В. Ивашов
Россия
Ивашов Иван Валерьевич – канд. мед. наук, доцент кафедры факультетской хирургии № 2 им. Г.И. Лукомского
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. В. Грачалов
Россия
Грачалов Антон Владимирович, аспирант кафедры факультетской хирургии № 2 имени Г.И. Лукомского
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
М. А. Цай
Россия
Цай Мария Александровна, врач-радиолог
ул. Большая Пироговская, д. 2, стр. 8, г. Москва, 119435
Я. А. Драч
Россия
Драч Ярослав Анатольевич, студент магистратуры
ул. 2-я Бауманская, д. 5, стр. 1, г. Москва, 105005
З. А. Омарова
Россия
Омарова Зумруд Артуровна, студентка, институт клинической медицины им. Н.В. Склифосовского
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(194KB)
|
Метаданные ▾ | |
|
|
2. Graphic abstract | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(196KB)
|
Метаданные ▾ | |

|
3. Standards for Reporting Diagnostic accuracy studies | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(765KB)
|
Метаданные ▾ | |
Рецензия
Журнал "Сеченовский вестник". Лист редактора можно посмотреть здесь.
Sechenov Medical Journal. Editor's checklist you can find here.
Рецензии на рукопись |
| Peer-review reports |
Название / Title | 3D-моделирование на основании совмещенной позитронно-эмиссионной икомпьютерной томографии в выявлении опухолевой инвазиипарагастральной клетчатки при раке желудка: пилотное исследование / Assessing 3D-modeling techniques based on a combination of positron emission tomography-and computed tomography as a means to detect tumor invasion of the paragastric tissue in gastric cancer: a pilot study
|
Раздел / Section
| ОНКОЛОГИЯ/ONCOLOGY
|
Тип / Article | Оригинальная статья / Original article
|
Номер / Number | 1139
|
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian
|
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 14.12.2024 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1139_А |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 24.01.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Злокачественные новообразования занимают ведущее положение в структуре заболеваемости и смертности населения мира. Рак желудка входит в пятерку наиболее распространенных раков в России по заболеваемости и в тройку по смертности от злокачественных новообразований. Актуальность темы исследования несомненна, так как в статье представлены пути улучшения диагностики рака желудка с помощью современных методов лучевой диагностики.
Значимость работы и научная новизна представленного исследования связаны разработкой и внедрением в гастроонкологию совмещенной позитронно-эмиссионной томографии (ПЭТ) и компьютерной томографии (КТ) при 3D-визуализации компрометированного «мезогастрия» с использованием 18 фтордезоксиглюкозы в качестве радиофармпрепарата на дооперационном этапе при местнораспространенном раке желудка. В исследовании проанализированы также плотность мезогастральной клетчатки, реконструированные в программе 3D-Slicer и оценена её корреляция с данными ПЭТ/КТ.
В статье четко определены методологические принципы применения современных технологий лучевой диагностики (ПЭТ/КТ в 3D-визуализации), позволившие достоверно оценить состояние мезогастрия при местнораспространенном раке желудка.
Результаты предварительных результатов исследования пациентов согласовываются с целью работы, выводы соответствующие. В статье в достаточном объеме отражено и обосновано состояние проблемы. Название темы полностью раскрыто и соответствует содержанию статьи. Литературные источники актуальные, в основном использованы публикации последних 5–7 лет по представленной теме статьи. Материал статьи изложен целостно, логически и последовательно в традиционном формате с использованием общепринятых научных терминов.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1139_В |
Научная степень / Scientific degree | Кандидат медицинских наук / Cand. of Sci. (Medicine) |
Страна/территория / Country/Territory | Германия / Germany |
Дата рецензирования / Date of peer-review | 02.02.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации /accept
|
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Цель исследования — анализ данных совмещенной ПЭТ/КТ при 3D-визуализации компрометированного мезогастрия с использованием 18-фтордезоксиглюкозы — является чрезвычайно актуальной. Учитывая высокую частоту местнораспространенных форм рака желудка и сложность их дооперационной оценки, представленная работа вносит значительный вклад в диагностику и предоперационное планирование.
Новизна исследования заключается в акценте на локальной оценке опухолевой инвазии мезогастрального слоя, что до сих пор недостаточно представлено в литературе. Впервые установлена корреляция между денситометрической плотностью периопухолевой клетчатки на КТ и накоплением 18-ФДГ при ПЭТ/КТ, что может существенно улучшить диагностику истинной опухолевой инвазии.
Предложенная методика 3D-визуализации мезогастрия с использованием ПЭТ/КТ обладает высоким потенциалом для применения в клинической практике. Она может быть использована для точного планирования хирургических вмешательств, что соответствует современным требованиям онкологической хирургии.
Авторы соблюдали все нормы этики. Исследование было одобрено Локальным этическим комитетом, а все участники дали письменное информированное согласие на участие.
Методы исследования логично связаны с заявленной целью и включают использование современных подходов (ПЭТ/КТ, 3D-моделирование). Описание протоколов проведения обследований и обработки данных представлено подробно и четко. Выводы статьи основаны на результатах визуального анализа, морфологических данных и 3D-реконструкции. Несмотря на ограниченную выборку пациентов, авторы обоснованно подчеркивают необходимость дальнейших исследований для подтверждения эффективности методики.
Научная терминология использована корректно, с соответствием стандартам области. В тексте отсутствуют двусмысленные или некорректные формулировки. Использованные литературные источники включают современные международные исследования и отечественные работы, что подтверждает валидность анализа. Однако дополнительное включение недавних публикаций могло бы расширить контекст. Текст работы структурирован логично, ключевые тезисы изложены последовательно. Описание методов, результатов и обсуждения выполнено на высоком уровне. Язык статьи грамотный, научный стиль выдержан. Для статьи на русском языке уровень изложения соответствует стандартам научных публикаций.
Учитывая высокую научную ценность статьи, у рецензента есть небольшое замечание:
- ограниченность выборки и отсутствие статистического анализа.
РЕКОМЕНДАЦИИ НАУЧНЫХ РЕДАКТОРОВ ЖУРНАЛА / RECOMMENDATIONS OF THE SCIENTIFIC EDITORS OF THE JOURNAL
- Просьба скорректировать заглавие, исключив из него аббревиатуры и «опыт первых наблюдений».
- Абстракт:
Цель исследования в абстракте и в последнем абзаце введения должна совпадать.
После цели исследования следует раздел Материалы и методы. Какой опыт Вами получен – это текст для обсуждения.
- Этика. Если исследование является частью научно-исследовательского проекта «SmartGastro» по 3D-моделированию опухолевого процесса при местнораспространенном раке желудка, просьба уточнить его номер одобрения ЛЭК и уточнить кто обеспечивает финансирование этого проекта, номер гранта (если таковой имеется).
- Во введении просьба четко сформулировать цель исследования: например, сравнить диагностическую возможность ПЭТ/КТ с накоплением 18-фтордезоксиглюкозы в выявлении опухолевой инвазии парагастральной клетчатки при местнораспростаненном раке желудка с методикой 3D-визуализацииDICOMфайлов КТ с помощью программы 3D Slicer.
- Материалы и методы
- Дизайн исследования: «Исследование являлось открытым интервенционным про- и ретроспективным.» В Вашем исследовании проспективно оценивался диагностический метод: необходимо соответствующим образом назвать исследование.
- Просьба четко обозначить критерии включения: «Морфологическая верификация первичной опухоли» - означает «рак желудка»?
- Необходимо уточнить критерии исключения из исследования.
- Необходимо добавить потоковую диаграмму включения пациентов согласно STARD
- «В качестве дополнительного исследования для оценки корреляции компрометированного мезогастрия по данным КТ были проанализированы данные совмещенной ПЭТ/КТ группы пациентов из 8 человек.» В Вашем исследовании цель оценить эти данные, это исследование не может быть отнесено к дополнительным.
- В описании Материалов и методов необходимо добавить все параметры, которые есть в таблицах в разделе Результаты.
- «Реконструкцию опухолевого процесса проводили в программе «3D Slicer image computing platform» командой специалистов, включая онкологов (указать ФИО авторов), хирургов (указать ФИО авторов), специалистов по лучевой диагностике (указать ФИО авторов и опыт работы).» - Просьба распределить авторов по участию. Необходимо добавить фирму-производитель и страну-производитель вышеозначенной программы.
- Статистика:
- в рукописи есть описательная статистика, необходимо добавить это в методы.
- для 8 пациентов целесообразно указать медиану, минимум и максимум для возраста, ИМТ.
- целесообразно рассчитать чувствительность и специфичность согласно общепринятым формулам, например, https://www.medcalc.org/calc/diagnostic_test.php , либо используя методы компьютерного зрения, взяв в качестве объекта наблюдения срез КТ
- Если Вы оставляете корреляцию, как метод сравнения, необходимо уточнить какой именно коэффициент корреляции использовался и отразить его значение с 95% доверительным интервалом.
6. Результаты.
- Во всех таблицах каждая строка должна быть в отдельной ячейке.
- Признаки со значением 0 (ноль) по всей строке необходимо удалить из таблиц, оставив только описание в тексте.
- «В ходе исследования в стенке желудка и парагастральной клетчатке определяли уровень метаболизма 18-ФДГ.» — это информация для раздела Материалы и методы.
- Если цель – сравнить два диагностических метода, основная таблица в разделе Результаты должна представлять данные сравнения по изученным признакам ПЭТ/КТ и 3D реконструкции и их соответствия или не соответствия данным, полученным во время операции.
- Диаграмма 1 – это не корреляция, на нее нет ссылки в тексте. Не совсем понятно, что она отражает
7. Обсуждение.
Должно начинаться с Ваших собственных данных. Необходимо их сравнить с уже опубликованными. В конце заключения необходимо уточнить ограничения проведенного исследования и обозначить направления для дальнейших исследований.
8. Заключение.
- Должно содержать конкретные выводы. Информация по ограничению исследования необходимо перенести в конец обсуждения.
9. Список литературы.
- По теме Вашего исследования есть актуальные источники за последние 3 года? Если да, целесообразно их добавить.
- Все статистические данные в виде ссылок необходимо перенести из списка литературы в подстрочные сноски (источники №1, 2, 4).
- Всю статистику представить максимально приближенную к 2024 году.
- Для атласа: H. Shinohara, Illustrated Abdominal Surgery, 2020 https://doi.org/10.1007/978-981-15-1796-9_2 необходимо указать название раздела, автора раздела, страницы раздела, редактора (автора) книги, ISBN print и online. Для источников на русском необходимо указать – EDN из РИНЦ (источники №3 и 7) 7. Источник 9 – источник на английском, необходимо дать информацию о нем на языке оригинала. Браун А.Е., Накакура Э.К. Оптимальное определение стадии рака желудка начинается с компьютерной томографии высокого разрешения. JAMASurg. 2021, 1 декабря;156(12): e215330. doi: 10.1001/jamasurg.2021.5330. Epub 2021, 8 декабря. PMID: 34705027.
10. Необходимо выполнить все технические требования журнала к оригинальным исследованиями в части аббревиатур, последовательной нумерации источников литературы, предоставить рисунки в отдельных файлах в требуемом качестве (ссылка на требования к изображениям на сайте https://www.sechenovmedj.com/jour/manager/files/1/Подготовка_иллюстраций_S MJ.pdf.