Перейти к:
Оценка фиброза печени методом транзиентной эластометрии у пациентов с циррозом печени после элиминации вируса гепатита С
https://doi.org/10.47093/2218-7332.2020.11.1.26-37
Аннотация
Применение препаратов прямого противовирусного действия (ПППД) ассоциировано с уменьшением фиброза у пациентов с циррозом печени в исходе хронического гепатита С (ЦП-ХГС).
Цель исследования. Оценить динамику фиброза печени у пациентов с ЦП-ХГС, достигших устойчивого вирусологического ответа (УВО) после лечения ПППД.
Материалы и методы. В ретроспективное когортное исследование включены 80 пациентов с ЦП-ХГС (мужчины 43%, медиана возраста 54). Эластичность печени (ЭП) определяли методом транзиентной эластометрии до лечения и после достижения УВО. Пациенты, достигшие снижения ЭП ≥30% (выраженное улучшение), включены в группу 1, остальные — в группу 2. Оценивали клинические, инструментальные и лабораторные данные. Независимые факторы риска отсутствия снижения ЭП ≥30% устанавливали методом бинарной логистической регрессии: рассчитано отношение шансов (ОШ) и 95% доверительный интервал (ДИ).
Результаты. В общей группе установлено статистически значимое снижение ЭП с 21,35 [15,2; 27,7] до 13,5 [10,1; 20,0] кПа (p < 0,001); медиана снижения составила 5,1 [2,6; 11,0] кПа. У 16 (20%) и 19 (24%) пациентов с исходным F4 отмечен регресс фиброза до стадии F2 и F3 соответственно. В группу 1 включены 36, в группу 2 — 44 пациента. В группе 1 по сравнению с группой 2 количество тромбоцитов увеличилось на 25% vs. 5% (р = 0,014), исчезновение или уменьшение размеров ВРВП отмечалось в 72% vs. 35% (p = 0,035). Значимых различий в динамике АЛТ, АСТ, альбумина, ПТИ не установлено. Уровень альбумина ≤35 г/л до лечения определен как независимый фактор риска отсутствия выраженного улучшения ЭП: ОШ = 6,7 (95% ДИ 1,7–25,9, р = 0,006)
Заключение. Достижение УВО сопровождается регрессом фиброза печени до F2-F3 стадии у 44% пациентов. Независимым фактором риска отсутствия выраженного улучшения ЭП является уровень альбумина ≤35 г/л до лечения.
Ключевые слова
Хронический гепатит С (ХГС) является одной из ведущих причин развития цирроза печени (ЦП), гепатоцеллюлярной карциномы и, как следствие, основным показанием к ортотопической трансплантации печени [1]. Риск развития неблагоприятных исходов зависит от стадии фиброза печени, что определяет важность его ранней диагностики [2][3].
Ранее было показано, что успешное лечение препаратами пегилированного интерферона-альфа (ПЭГ- ИФН) сопровождается обратным развитием фиброза печени [4][5][6][7]. Однако недостаточная эффективность лечения (элиминация вируса только в 30-40% случаев) и развитие тяжелых нежелательных явлений в 10-15% случаев значительно ограничивали применение ПЭГ- ИФН у пациентов с ЦП. К настоящему времени препараты прямого противовирусного действия (ПППД) доказали свою эффективность и безопасность в лечении хронической инфекции, вызванной вирусом гепатита С (ВГС), в том числе у пациентов с декомпенсированной стадией заболевания. Первые результаты применения ПППД продемонстрировали возможность уменьшения выраженности фиброза у пациентов с ЦП после элиминации вируса [8][9]. В настоящее время предметом активного изучения является долгосрочное влияние элиминации вируса на регресс фиброза и прогноз заболевания у пациентов с ЦП.
«Золотым стандартом» оценки выраженности воспаления и фиброза печени служит биопсия. Однако инвазивный характер процедуры ограничивает ее применение для динамического наблюдения. В последние годы чаще используются неинвазивные способы оценки фиброза, одним из которых является транзиентная эластометрия (ТЭ). Метод оценивает эластичность печени (ЭП) в кПа, на основании чего определяется стадия фиброза по шкале METAVIR. В сравнительных контролируемых исследованиях ТЭ продемонстрировала высокую диагностическую точность в определении выраженного фиброза печени [10][11][12]. Также установлено, что показатель ЭП коррелирует с печеночным венозным градиентом давления (ПВГД) и может использоваться в диагностике клинически значимой портальной гипертензии [13][14].
Цель исследования: оценить динамику фиброза печени у пациентов с циррозом в исходе ХГС, достигших устойчивого вирусологического ответа (УВО) после лечения ПППД.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное когортное исследование пациентов с ЦП в исходе ХГС (ЦП-ХГС). Клиническая база: клиника ревматологии, внутренних болезней и профпатологии им. Е.М. Тареева Университетской клинической больницы № 3 Первого МГМУ им. И.М. Сеченова. Даты проведения исследования: c 1 июня 2015 по 30 ноября 2019 года. Проведение исследования одобрено на заседании Локального этического комитета от 11.12.2019 (номер протокола 1719).
Критерии включения:
- мужчины и женщины 18 лет и старше;
- наличие ЦП-ХГС;
- курс ПППД с достижением УВО.
Критерии исключения:
- сочетанная этиология заболевания печени: HBV- инфекция (наличие HBsAg в сыворотке крови), аутоиммунные и холестатические заболевания печени, болезнь Вильсона — Коновалова, наследственный гемохроматоз;
- инфицирование вирусом иммунодефицита человека;
- наличие злокачественных новообразований;
- трансплантация печени в анамнезе;
- наличие факторов, способствующих повышению показателя ЭП (асцит II—III степени по шкале IAC (International Ascitis Club — Международный клуб по изучению асцита), высокая активность сывороточных аминотрансфераз).
Исходно для участия в исследовании оценены 113 пациентов с ЦП-ХГС, получавших терапию ПППД и достигших УВО, из которых у 33 выявлены критерии исключения, таким образом, в итоговый анализ включены 80 пациентов (рис. 1).
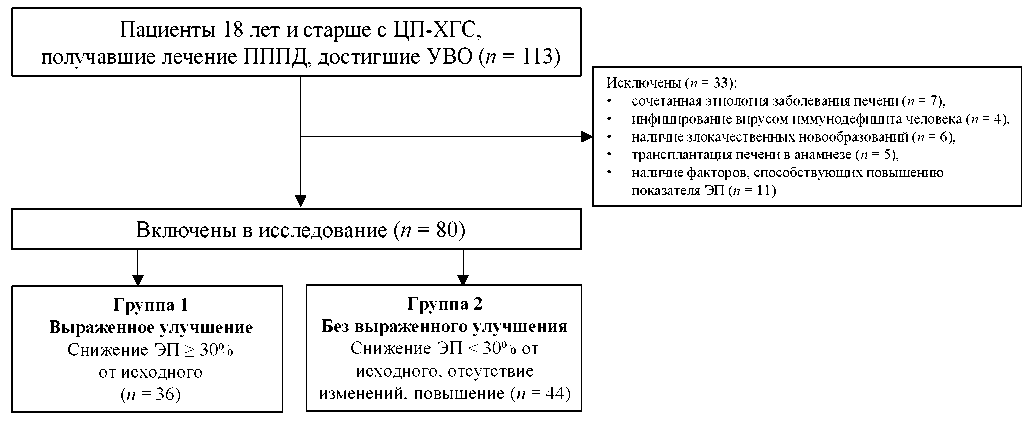
РИС. 1. Схема включения пациентов в исследование.
FIG. 1. Flowchart of the study inclusion.
Диагноз ЦП устанавливали на основании общепринятых клинико-лабораторных и инструментальных данных, а также результатов ТЭ: показатель ЭП >12,5 кПа. ХГС определяли как ведущий этиологический фактор ЦП при установлении факта длительного инфицирования ВГС (обнаружение анти-HCV и РНК ВГС в сыворотке крови методом полимеразной цепной реакции), при отсутствии или одновременном / более позднем присоединении других причин поражения печени: злоупотребление алкоголем, ожирение, сахарный диабет.
Ранее противовирусную терапию (ПВТ) получали 26 (33%) пациентов: 19 (24%) ПЭГ-ИФН и ри- бавирин, 5 (6%) — ингибиторы протеазы первого поколения (боцепревир, телапревир) в комбинации с ПЭГ-ИФН и рибавирином, 2 (3%) — только ПППД. Из всех пациентов, получавших ранее ПВТ, у 19 (73%) не достигнут УВО, у остальных лечение отменялось из-за развития нежелательных явлений.
Выбор препаратов ПППД у включенных в исследование пациентов зависел от генотипа ВГС, тяжести поражения печени и наличия предшествующего опыта ПВТ. Применялись следующие схемы: 31 (39%) пациент получал софосбувир + даклата- свир, 13 (16%) — паритапревир/ритонавир/омбитасвир + дасабувир, 12 (15%) — софосбувир/ле- дипасвир, 10 (12%) — асунапревир + даклатасвир, 9 (11%) — софосбувир/велпатасвир, 2 (3%) — софосбувир + симепревир, 3 (4%) — софосбувир + ри- бавирин. Всего 37 (46%) пациентов получали дополнительно рибавирин.
УВО определяли как отсутствие РНК ВГС в сыворотке крови методом полимеразной цепной реакции через 12 недель после окончания ПВТ.
До начала ПВТ проводили стандартное общеклиническое обследование, которое включало сбор жалоб, анамнеза, выявление сопутствующих заболеваний, определение индекса массы тела (ИМТ). Злоупотребление алкоголем в анамнезе определяли как потребление более 30 мл в сутки «чистого» алкоголя для мужчин и более 20 мл в сутки — для женщин [15]. На момент начала ПВТ и в ходе дальнейшего исследования все пациенты не злоупотребляли алкоголем.
Лабораторное исследование включало определение:
- количества тромбоцитов;
- активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), уровня альбумина, общего билирубина, креатинина, протромбинового индекса (ПТИ);
- определение генотипа ВГС и вирусной нагрузки с целью выбора схемы лечения и возможной коррекции схемы при сохранении виремии. Выполняли ультразвуковое исследование органов брюшной полости, измеряли размеры селезенки с подсчетом площади максимального продольного сечения; проводили эзофагогастродуоденоскопию для оценки варикозного расширения вен пищевода (ВРВП). При определении степени ВРВП использовали классификацию Soehendra, K. Binmoeller [16], согласно которой к первой степени относятся ВРВ диаметром до 5 мм, ко второй — диаметром от 5 до 10 мм, к третьей — ВРВ диаметром более 10 мм и с наличием «красных знаков».
Степень тяжести ЦП оценивали по шкале Child-Pugh [17], прогноз — по индексу модели терминальной стадии заболевания печени MELD (The Model for End-Stage Liver Disease — модель терминальной стадии заболевания печени), рассчитываемого по формуле: MELD = 0,957 × ln(креатинин, мкмоль/л) + 0,378 × ln(общий билирубин, мкмоль/л) +
1,120 × ln(МНО) + 0,643 [18].
Исходные характеристики пациентов представлены в таблице 1. В общей группе пациентов соотношение мужчины:женщины составило 1:1,4, медиана возраста — 54 года. Сахарный диабет 2-го типа и злоупотребление алкоголем в анамнезе отмечено у каждого пятого пациента. Медиана ИМТ соответствовала избыточному весу. Ожирение 1-й степени отмечено у 22 (28%) пациентов. У 64 (80%) пациентов выявлен генотип 1 ВГС, генотип 3 встречался у 15 (19%) пациентов, генотип 2 — у одного пациента.
Таблица 1. Общая характеристика пациентов
Table 1. Baseline characteristics of the patients
|
Параметр |
Общая группа (л = 80) |
|
Мужчины, n (%) |
34 (43) |
|
Возраст на момент начала ПВТ, лет |
54 [47; 61] |
|
Сахарный диабет 2-го типа, n (%>) |
17 (21) |
|
Злоупотребление алкоголем в анамнезе |
14 (18) |
|
Генотип 1 ВГС, n (%) |
64 (80) |
|
РНК ВГС, МЕ/мл |
4,8х104 [1,6х103; 6,2х106] |
|
ПВТ в анамнезе, n (%>) |
26 (33) |
|
ИМТ, кг/м2 |
27 [25; 30] |
Примечание. Все данные представлены как медиана [25-й и 75-й процентили], если не указано иначе.
Note. All data are presented as median [25th and 75th percentiles] unless otherwise stated.
У всех пациентов определяли ЭП методом ТЭ (Fibroscan®, Echosens, Франция). Результат регистрировали в кПа. Стадию фиброза определяли в соответствии с рекомендациями L. Castera и соавт. [19] (табл. 2).
Таблица 2. Стадии фиброза по шкале METAVIR
Table 2. The METAVIR fibrosis score
|
Стадия фиброза по METAVIR |
Значение эластичности печени, кПа |
|---|---|
|
F0 |
≤5,8 |
|
F1 |
от 5,9 до 7,2 |
|
F2 |
от 7,3 до 9,5 |
|
F3 |
от 9,6 до 12,5 |
|
F4 |
>12,5 |
После достижения УВО проводили повторное стандартное клинико-лабораторное и инструментальное обследование, рассчитывали индекс MELD, оценивали тяжесть цирроза по Child-Pugh, проводили ТЭ. В зависимости от результатов ЭП пациенты были разделены на две группы: группа 1 — достигшие выраженного улучшения (снижение ЭП на 30% и более) и группа 2 — не достигшие выраженного улучшения (снижение ЭП <30% от исходного, отсутствие изменений, повышение). Медиана времени между наиболее близким к началу лечения ПППД измерением ЭП и повторным исследованием после достижения УВО составила 30 [18; 36] месяцев.
Статистический анализ. Нормальность распределения количественных переменных проверяли с помощью критерия Колмогорова — Смирнова. В связи с ненормальным распределением для анализа данных использовали непараметрические методы статистики. Количественные переменные представлены в виде медианы (Ме) и интерквартильного размаха — ИКР (25-й и 75-й процентили), качественные признаки — в виде абсолютного числа и доли, выраженной в процентах.
Изучение динамики количественных и порядковых переменных проведено с помощью критерия знаков, качественных переменных — с помощью критерия Мак-Немара. Сравнительный анализ двух независимых групп проводился при помощи U-критерия Манна — Уитни для количественных переменных, критерия Фишера — для качественных переменных. Метод бинарной логистической регрессии использовался для выявления независимых факторов риска отсутствия выраженного улучшения ЭП.
Для преобразования количественных переменных в номинальные признаки (0 — нет признака, 1 — есть признак) использовались стандартные пороговые значения (лабораторные параметры: альбумин <35 г/л, общий билирубин >34 мкмоль/л, ПТИ <70%, тромбоциты <100х109/л) или медианы количественного ряда (возраст, ИМТ, АЛТ, АСТ, площадь селезенки, индекс MELD). Однофакторный анализ проводился методом пошагового включения предикторов, многофакторный анализ выполнен на основании результатов однофакторного анализа.
Результат представлен в виде отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Различия считали значимыми прир < 0,05. Статистическая обработка и графическое представление данных выполнены с помощью программ IBM SPSS Statistics 21.0 (IBM Corporation, США) и GraphPad Prism 8 (GraphPad Software, США).
РЕЗУЛЬТАТЫ
Динамика клинико-лабораторных и инструментальных данных в общей группе
После достижения УВО отмечено уменьшение размеров ВРВП у 14 (34%) пациентов, исчезновение ВРВП у 7 (17%) пациентов, купирование асцита достигнуто у 14 из 15 пациентов, исходно его имевших.
Показатели АЛТ, АСТ статистически значимо снижались, альбумин и ПТИ повышались по сравнению с данными до начала лечения. Уровень тромбоцитов значимо повышался и находился у значительной части пациентов в пределах низко-нормальных значений. Площадь селезенки, оцененная по данным ультразвукового исследования, существенно не изменялась. Индекс MELD статистически значимо снижался, 10 пациентов из 13 перешли из класса В-С в класс А по Child-Pugh (табл. 3).
Таблица 3. Динамика клинико-лабораторных параметров
Table 3. Dynamics of clinical and laboratory parameters

Примечание. Все данные представлены как мeдиана [25-й и 75-й процентили], если не указано иначе.
Note. All data are presented as median [25th and 75th percentiles] unless otherwise stated.
Динамика эластичности печени в общей группе
При сравнении показателей после достижения УВО с данными до лечения установлено снижение ЭП с 21,35 [15,2; 27,7] до 13,5 [10,1; 20,0] кПа (p < 0,001) (рис. 2). Медиана снижения составила 5,1 [2,6; 11,0] кПа или 26% [16,8; 47,4]. В целом ЭП снизилась у 66 (83%) пациентов, у 36 (45%) из них на 30% и более, что соответствовало выраженному улучшению. К концу наблюдения у 16 (20%) и 19 (24%) пациентов с исходным F4 отмечен регресс фиброза до стадии F2 и F3 соответственно. Среди пациентов без выраженного улучшения у 30 (38%) наблюдалось снижение ЭП на 10,0-29,9%, у 5 (6%) — повышение показателя, у остальных — отсутствие изменений (рис. 3).
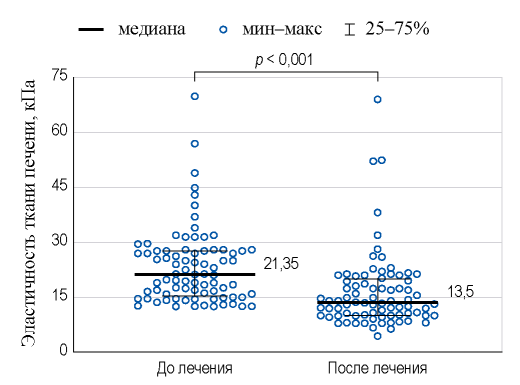
РИС. 2. Динамика эластичности ткани печени у пациентов с циррозом печени после элиминации вируса гепатита С.
FIG. 2. Dynamics of liver stiffness in patients with liver cirrhosis after hepatitis C virus eradication.
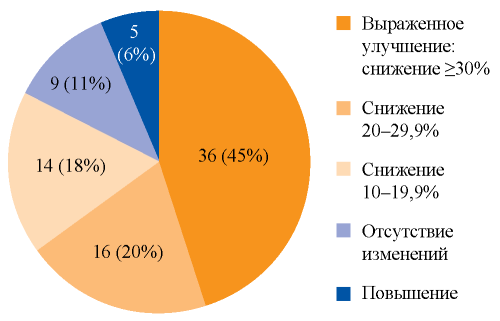
РИС. 3. Распределение пациентов по динамике эластичности печени.
FIG. 3. The distribution of the patients according to the dynamics of liver stiffness.
Сравнительная характеристика пациентов в зависимости от динамики эластичности печени
Пациенты в группах 1 и 2 (с и без выраженного улучшения ЭП) исходно не различались по полу, возрасту, ИМТ, частоте сахарного диабета и злоупотребления алкоголем в анамнезе, генотипу ВГС, уровню АЛТ, АСТ, ПТИ, тяжести портальной гипертензии (количество тромбоцитов, ВРВП, асцит, площадь селезенки). У пациентов в группе 2 до начала ПВТ отмечен более низкий уровень альбумина, более высокий уровень билирубина и индекс MELD, а также чаще декомпенсированный ЦП, чем в группе 1 (табл. 4). При этом статистически значимых различий между показателем ЭП до начала лечения не установлено.
Таблица 4. Сравнительная исходная характеристика пациентов с и без выраженного улучшения ЭП
Table 4. Baseline characteristics of the patients with and without significant improvement of liver stiffness
|
Показатель |
Группа 1 Выраженное улучшение ЭП (л = 36) |
Группа 2 Без выраженного улучшения ЭП (л = 44) |
Значение р |
|---|---|---|---|
|
Мужской пол, n (%) |
16 (44) |
18 (41) |
>0,05 |
|
Возраст на момент начала ПВТ, лет |
54 [36; 59] |
56 [52; 62] |
>0,05 |
|
ИМТ, кг/м2 |
27 [25,8;30,1] |
27 [25;29,3] |
>0,05 |
|
Сахарный диабет, n (%) |
8 (22) |
9 (20) |
>0,05 |
|
Злоупотребление алкоголем в анамнезе, n (%) |
6 (14) |
8 (18) |
>0,05 |
|
Генотип 1 ВГС, n (%) |
27 (75) |
27 (75) |
>0,05 |
|
ЦП класс В-С по Child-Pugh, n (%) |
2 (5) |
11 (25) |
<0,05 |
|
Индекс MELD |
9 [7; 11] |
11 [9; 13] |
<0,05 |
|
АЛТ, Ед/л |
75 [47; 127] |
66 [49; 90] |
>0,05 |
|
АСТ, Ед/л |
78 [47; 98] |
63 [55; 98] |
>0,05 |
|
Альбумин, г/л, |
40 [36; 42] |
36 [34; 40] |
<0,05 |
|
Общий билирубин, мкмоль/л |
15 [12; 20] |
20 [15; 28] |
<0,05 |
|
ПТИ, % |
73 [60; 86] |
73 [68; 83] |
>0,05 |
|
Тромбоциты, 109/л |
115 [76; 158] |
123 [81; 169] |
>0,05 |
|
Асцит, n (%) |
4 (11) |
11 (25) |
>0,05 |
|
ВРВП, 1-3 ст. n (%) |
18 (50) |
23 (52) |
>0,05 |
|
Площадь селезенки, см2 |
75 [57; 93] |
71 [60; 83] |
>0,05 |
|
ЭП на момент начала ПВТ, кПа |
24 [17; 31] |
19 [15; 27] |
>0,05 |
Примечание. Все данные представлены как мeдиана [25-й и 75-й процентили], если не указано иначе.
Note. All data are presented as median [25th and 75th percentiles] unless otherwise stated.
После достижения УВО показатель ЭП в группе 1 статистически значимо достигал более низких значений, чем в группе 2: 10кПа [8; 14] vs. 17кПа [13; 22] в группе 2 (р < 0,001). У пациентов в группе 1 по сравнению с пациентами в группе 2 после лечения наблюдалось более значительное увеличение количества тромбоцитов: на 25% vs. 5% (р = 0,014) и большая частота исчезновения или уменьшения размеров ВРВП: в 72% vs. 35% (p = 0,035). Эндоскопическое лигирование выполнено 8 пациентам, из них у 3 из группы 2 отмечен рецидив ВРВП.
Значимых различий в динамике сывороточных аминотрансфераз и параметров функции печени (альбумина, общего билирубина, ПТИ) не выявлено. ЦП класс В-С по Child-Pugh перешел в класс А у обоих пациентов в группе 1 и у восьми в группе 2 (у трех сохранялся декомпенсированный цирроз).
Многофакторный анализ, выполненный на основе данных однофакторного анализа, определил исходную гипоальбуминемию (уровень альбумина <35 г/л) как независимый фактор риска отсутствия выраженного улучшения ЭП: ОШ = 6,7 (95% ДИ 1,7-25,9, р = 0,006).
ОБСУЖДЕНИЕ
Одной из основных причин смерти у пациентов с ЦП являются осложнения портальной гипертензии (кровотечение из ВРВП, асцит, печеночная энцефалопатия) [20], которые обусловлены нарушением сосудистой архитектоники и повышением ПВГД вследствие фиброза.
Основной целью ПВТ у пациентов с ЦП является профилактика развития осложнений и улучшение выживаемости, которые возможны при условии элиминации вируса и последующего уменьшения выраженности или стабилизации фиброза. Мы представили результаты первого в России ретроспективного исследования динамики фиброза печени с помощью ТЭ на большой группе пациентов (n = 80) с ЦП-ХГС и элиминацией вируса после курса лечения ПППД.
Наши данные показывают значительное снижение ЭП после элиминации ВГС у 83% пациентов: медиана снижения — 5,1 кПа, или 26% от исходного значения, при этом регресс фиброза F4 до стадии F2 или F3 отмечен в 20 и 24% случаев соответственно. Полученные результаты в целом соответствуют данным зарубежных и отечественных исследований.
В работе I. Sporea и соавт. [21] из 170 пациентов с ЦП, достигших УВО в результате лечения ПППД, уменьшение выраженности фиброза наблюдалось в 75% случаев (в среднем ЭП уменьшилась с 27,4 до 21,3 кПа (р < 0,001) через 12 недель после окончания терапии.
В небольшом российском исследовании участвовали 13 пациентов с ЦП и УВО после лечения ПППД: уменьшение ЭП наблюдалось через 8-28 недель после окончания терапии (с 26 до 17,5 кПа, р < 0,005), у трети из них отмечался регресс фиброза печени до стадии F2 и F3 [22].
Метаанализ 24 исследований с участием 2214 пациентов с ХГС продемонстрировал уменьшение ЭП в среднем на 28,2% через 6-12 месяцев после достижения УВО. В 13 исследованиях применялись ИФН-содержащие схемы и в 11 — схемы без ИФН. Среди 181 пациента с ЦП показатель ЭП уменьшился в среднем на 5,1 кПа, в 26,6% случаев отмечен регресс фиброза печени до стадии F2 [23].
Исследование A. Facciorusso и соавт. включало 112 пациентов с ХГС, которые получали ИФН-содержащие (26,7%) или схемы лечения без ИФН (73,3%) и достигли элиминации вируса. У 36 (32,1%) пациентов показатель ЭП составлял >12,5 кПа до проведения ПВТ, т.е. соответствовал F4 стадии фиброза печени. В исследование не включались пациенты с ЦП класса B-C по Child-Pugh. Через 2 года после окончания лечения снижение ЭП ниже порогового значения 12,5 кПа отмечалось в 78% случаев (28/36). В нашем исследовании снижение ЭП ниже 12,5 кПа наблюдалось только в 44% случаев, что, вероятно, связано с более тяжелым поражением печени в нашей группе (16% пациентов с ЦП класса B-C по Child-Pugh) [24].
В нашем исследовании выраженное улучшение ЭП (снижение >30% от исходного значения) наблюдалось у 45% пациентов и сопровождалось значительным увеличением количества тромбоцитов и исчезновением или уменьшением размеров ВРВП. Положительная динамика со стороны клинических проявлений портальной гипертензии является следствием снижения ПВГД в результате уменьшения выраженности фиброза печени. Влияние УВО на величину ПВГД продемонстрировано в ряде зарубежных исследований.
Так, в серии из 8 случаев, проведенной в Испании, среди пациентов с ЦП и УВО после лечения ингибитором протеазы первого поколения (боцепре- вир) в комбинации с ПЭГ-ИФН и рибавирином наблюдалось снижение ЭП с 21,3 до 9,5 кПа и ПВГД с 10,3 до 6,1 мм рт. ст. через 72 недели после окончания ПВТ (все р < 0,001) [25].
В другом европейском ретроспективном исследовании с участием 60 пациентов с ЦП, достигших УВО после лечения ПППД, наблюдалось снижение ПВГД в 80% случаев (в среднем на -2,63 ± 0,38 мм рт. ст., р < 0,001). Показатель ЭП улучшился на 24,7 ± 3,7% [26].
В нашем исследовании исходная гипоальбумине- мия (уровень альбумина <35 г/л) оказалась независимым фактором риска отсутствия выраженного улучшения ЭП: ОШ = 6,7; 95% ДИ 1,7-25,9, р = 0,006.
В первых работах, посвященных оценке фиброза печени до и после ПВТ, выявлена взаимосвязь уровня АЛТ с динамикой показателя ЭП. Так, в работе M. Pons и соавт. [8] с участием 41 пациента с выраженным фиброзом наблюдалось снижение ЭП в течение первых 4 недель лечения ПППД с 20,8 до 17,5 кПа, р = 0,002. У пациентов с исходным уровнем АЛТ >2N отмечалось более выраженное уменьшение ЭП, чем у пациентов с уровнем АЛТ <2N (-5,7 и -1,6 кПа соответственно). Аналогичные результаты получены и в другой работе через 12 недель после окончания ПВТ [21].
Таким образом, можно предположить, что раннее снижение ЭП в большей степени является следствием уменьшения воспаления в печени. Динамика ЭП в более поздние сроки отражает регресс фиброза. В нашем исследовании исходная активность АЛТ не ассоциировалась с динамикой ЭП, что, вероятно, связано с более длительным периодом наблюдения (30 месяцев после окончания ПВТ).
Значение ЭП до ПВТ, более высокий ИМТ также рассматриваются в других работах как факторы риска отсутствия улучшения ЭП у пациентов ЦП после достижения УВО [6][23][24]. Высокий ИМТ, особенно в сочетании с другими метаболическими нарушениями, может свидетельствовать о наличии сопутствующей патологии печени — неалкогольной жировой болезни печени, которая оказывает существенное влияние на течение и прогноз заболевания. Результаты нашего исследования демонстрируют, что у пациентов с ЦП динамика ЭП определяется прежде всего исходной тяжестью заболевания (уровень альбумина <35 г/л) и не зависит от наличия сопутствующих факторов поражения печени (ИМТ >27 кг/м2, в том числе ожирение, сахарный диабет 2-го типа и злоупотребление алкоголем в анамнезе). Отсутствие улучшения фиброза печени у пациентов с исходно высоким значением ЭП при длительном наблюдении может свидетельствовать о достижении так называемой «точки невозврата», при которой элиминация ВГС не способна предотвратить или замедлить прогрессирование заболевания и повлиять на клинические исходы. Требуется дальнейшее изучение влияния динамики фиброза печени после достижения УВО на прогноз пациентов с ЦП в рамках более крупных исследований.
ЗАКЛЮЧЕНИЕ
У пациентов с ЦП-ХГС, достигших УВО после лечения ПППД, показатель ЭП уменьшился на 5,1 [2,6;11] кПа; регресс фиброза печени до стадии F2 и F3 наблюдался в 20 и 24% случаев соответственно. Выраженное улучшение ЭП (≥30% от исходного значения) наблюдалось у 45% пациентов и сопровождалось увеличением количества тромбоцитов и исчезновением или уменьшением размеров ВРВП. Независимым фактором риска отсутствия выраженного улучшения ЭП является уровень альбумина ≤35 г/л до лечения.
ВКЛАД АВТОРОВ
Е.А. Набатчикова внесла основной вклад в разработку концепции статьи, создание и ведение базы данных, выполнила статистический анализ, подготовила текст статьи и иллюстрации, окончательно утвердила публику емую версию статьи и согласна принять на себя ответственность за все аспекты работы. Д.Т. Абдурахманов внес существенный вклад в разработку концепции статьи, сбор данных, корректировал текст статьи. Е.Н. Никулкина, Т.П. Розина, Е.Л. Танащук внесли существенный вклад в сбор данных. С.В. Моисеев внес существенный вклад в разработку концепции статьи, корректировал текст статьи.
AUTHOR CONTRIBUTIONS
Ekaterina A. Nabatchikova made the major contribution to the concept of the article, created the database; analyzed and interpreted data; wrote the text of the article, de signed the figure, approved the final version of the pub lication and agreed to take responsibility for all aspects of the work. Dzhamal T. Abdurakhmanov made the major contribution to the concept of the article, acquisition of data, reviewed the text of the article. Elena N. Nikulkina, Teona P. Rozina, Elena L. Tanaschuk made the major contribution to the acquisition of data. Sergey V. Moiseev made the major contribution to the concept of the article and reviewed the text of the article.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Perz J.F., Armstrong G.L., Farrington L.A., et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006; 45(4): 529–38. https://doi.org/10.1016/j.jhep.2006.05.2013 PMID: 16879891
2. Yoshida H., Shiratori Y., Moriyama M., et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy. Ann Intern Med. 1999; 131(3): 174–81. https://doi.org/10.7326/0003-4819-131-3-19990803000003 PMID: 10428733
3. Стукова H.Ю., Кучерявый Ю.А., Маевская Е.А., Маев И.В. Оценка риска развития осложнений цирроза печени различной этиологии при использовании ультразвуковой эластографии печени. Терапевтический Архив. 2017; 89 (2): 38–44. https://doi.org/10.17116/terarkh201789238-44.
4. Calvaruso V., Di Marco V., Ferraro D., et al. Fibrosis evaluation by transient elastography in patients with long-term sustained HCV clearance. Hepat Mon. 2013; 13(5): e7176. https://doi.org/10.5812/hepatmon.7176 PMID: 23967020
5. Stasi C., Arena U., Zignego A.L., et al. Longitudinal assessment of liver stiffness in patients undergoing antiviral treatment for hepatitis C. Dig Liver Dis. 2013; 45(10): 840–3. https://doi.org/10.1016/j.dld.2013.03.023 PMID: 23660078
6. Wang J.-H., Changchien C.-S., Hung C.-H., et al. Liver stiffness decrease after effective antiviral therapy in patients with chronic hepatitis C: longitudinal study using FibroScan. J Gastroenterol Hepatol. 2010 May; 25(5): 964–9. https://doi.org/10.1111/j.1440-1746.2009.06194.x PMID: 20546451
7. D’Ambrosio R., Aghemo A., Fraquelli M., et al. The diagnostic accuracy of fibroscan for cirrhosis is influenced by liver morphometry in HCV patients with a sustained virological response. J Hepatol. 2013 Aug; 59(2): 251–6. https://doi.org/10.1016/j.jhep.2013.03.013 PMID: 23528378
8. Pons M., Santos B., Simon-Talero M., et al. Rapid liver and spleen stiffness improvement in compensated advanced chronic liver disease patients treated with oral antivirals. Therap Adv Gastroenterol. 2017; 10(8): 619–29. https://doi.org/10.1177/1756283x17715198 PMID: 28835776
9. Knop V., Hoppe D., Welzel T., et al. Regression of fibrosis and portal hypertension in HCV-associated cirrhosis and sustained virologic response after interferon-free antiviral therapy. J Viral Hepat. 2016; 23(12): 994–1002. https://doi.org/10.1111/jvh.12578 PMID: 27500382
10. Павлов Ч.С., Глушенков Д.В., Ивашкин В.Т. Современные возможности эластометрии, фибро- и акти-теста в диагностике фиброза печени. Рос. журн. гастроэнт. гепатол. колопроктол. 2008; 18(4): 43–52.
11. Afdhal N.H., Nunes D. Evaluation of liver fibrosis: a concise r view. Am J Gastroenterol 2004; 99 (6): 1160–74. https://doi.org/10.1111/j.1572-0241.2004.30110.x PMID: 15180741
12. Gomez-Dominguez E., Mendoza J., Rubio S., et al. Transient elastography: a valid alternative to biopsy in patients with chronic liver disease. Aliment Pharmacol Ther. 2006; 24(3): 513–8. https://doi.org/10.1111/j.1365-2036.2006.02999.x PMID: 16886917
13. Lemoine M., Katsahian S., Ziol M., et al. Liver stiffness measurement as a predictive tool of clinically significant portal hypertension in patients with compensated hepatitis C virus or alcoholrelated cirrhosis. Aliment Pharmacol Ther. 2008; 28(9): 1102–11. https://doi.org/10.1111/j.1365-2036.2008.03825.x PMID: 18691352
14. Robic M.A., Procopet B., Métivier S., et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol. 2011; 55(5): 1017–24. https://doi.org/10.1016/j.jhep.2011.01.051 PMID: 21354450
15. European Association for the Study of the Liver. EASL recommendation on treatment of hepatitis C 2018. J Hepatol. 2018; 69(2): 461–511. https://doi.org/10.1016/j.jhep.2018.03.026 PMID: 29650333
16. Soehendra N., Binmoeller K.F., Seifert H., Schreiber H.W. Therapeutic Endoscopy. Color Atlas of Operative Techniques for the Gastrointestinal Tract. Stuttgart — New York: Thieme; 2005: 74.
17. Pugh R.N., Murray-Lyon I.M., Dawson J.L., et al. Transection of oesophagus for bleeding oesophageal varices. Br J Surg. 1973; 60(8): 646–9. https://doi.org/10.1002/bjs.1800600817 PMID: 4541913
18. Kamath P.S., Wiesner R.H., Malinchoc M., et al. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001; 33(2): 464–70. https://doi.org/10.1053/jhep.2001.22172 PMID: 11172350
19. Castera L., Forns X., Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol. 2008; 48(5): 835-47. https://doi.org/10.1016/j.jhep.2008.02.008 PMID: 18334275
20. D’Amico G., Garcia-Tsao G., Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies. J Hepatol. 2006; 44(1): 217–31. https://doi.org/10.1016/j.jhep.2005.10.013 PMID: 16298014
21. Sporea I., Lupusoru R., Mare R., et al. Dynamics of liver stiffness values by means of transient elastography in patients with HCV liver cirrhosis undergoing interferon free treatment. J Gastrointestin Liver Dis. 2017; 26(2): 145–50. https://doi.org/10.15403/jgld.2014.1121.262.dyn PMID: 28617884
22. Морозов В.Г., Фролов А.В., Топорнина Л.М. и др. Эффективность и безопасность противовирусной терапии Паритапревир/ритонавир + Омбитасвир + Дасабувир + Рибавирин у больных циррозом печени в исходе хронического гепатита С. Инфекционные болезни. 2016; 14(4): 37–43. https://doi.org/10.20953/1729-9225-2016-4-37-43
23. Singh S., Facciorusso A., Loomba R., Falck-Ytte Y.T. Magnitude and kinetics of decrease in liver stiffness after antiviral therapy in patients with chronic hepatitis C: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2018; 16(1): 27–38. https://doi.org/10.1016/j.cgh.2017.04.038 PMID: 28479504
24. Facciorusso A., Del Prete V., Turco A., et al. Long-term liver stiffness assessment in HCV patients undergoing antiviral therapy: results from a 5-year cohort study. J Gastroenterol Hepatol. 2018; 33(4): 942–9. https://doi.org/10.1111/jgh.14008 PMID: 28976021
25. Puente Á., Cabezas J., López Arias M.J., et al. Influence of sustained viral response on the regression of fibrosis and portal hypertension in cirrhotic HCV patients treated with antiviral triple therapy. Rev Esp Enferm Dig. 2017; 109(1): 17–25. https://doi.org/10.17235/reed.2016.4235/2016 PMID: 27990835
26. Mandorfer M., Kozbial K., Schwabl P., et al. Sustained virologic response to interferon free therapies ameliorates HCV-induced portal hypertension. J Hepatol. 2016; 65(4): 692–9. https://doi.org/10.1016/j.jhep.2016.05.027 PMID: 27242316
Об авторах
Е. А. НабатчиковаРоссия
Набатчикова Екатерина Андреевна, аспирант кафeдры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Тел.: + 7 (916) 482-19-92
Д. Т. Абдурахманов
Россия
Абдурахманов Джамал Тинович, д-р мед. наук, профессор кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Е. Н. Никулкина
Россия
Никулкина Елена Николаевна, ассистент кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Т. П. Розина
Россия
Розина Тэона Павловна, канд. мед. наук, доцент кафедры внутренних, профессиональных болезней и ревматологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет); доцент кафедры внутренних болезней факультета фундаментальной медицины ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ленинские горы, д. 1, г. Москва, 119991
Е. Л. Танащук
Россия
Танащук Елена Львовна, канд. мед. наук, ассистент кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
С. В. Моисеев
Россия
Моисеев Сергей Валентинович, д-р мед. наук, профессор, заведующий кафедрой внутренних, профессиональных болезней и ревматологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет); профессор кафедры внутренних болезней факультета фундаментальной медицины ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ленинские горы, д. 1, г. Москва, 119991







































