Перейти к:
Ближайшие исходы одномоментной и этапной реконструкции расслоения аорты: одноцентровое исследование
https://doi.org/10.47093/2218-7332.2021.12.1.18-29
Аннотация
Введение. При коррекции расслоения аорты основной проблемой является оптимизация соотношения между объемом оперативного вмешательства и физиологическим резервом пациента. С целью увеличения радикальности вмешательства применяются этапные и комбинированные методики.
Материалы и методы. 21 пациенту производилась коррекция расслоения путем протезирования или имплантации стент-графта в области проксимальной фенестрации и имплантации голометаллических стентов на протяжении аорты. Средний возраст пациентов составил 50±3,5, среди них было две женщины 2 (9,5 %). Проксимальное расслоение имело место у 8 пациентов, дистальное у – 13. Замена аортального клапана и восходящей аорты кондуитом произведена у 5 (23,8%) пациентов, супракоронарное протезирование восходящей аорты - у 3(14,3%), протезирование всей дуги аорты и устьев брахиоцефальных сосудов - у 2(9,5%), протезирование половины дуги аорты у 3(14,3%), протезирование нисходящей грудной аорты и стентирование торакоабдоминальной аорты выполнено у 10 (47,6%) пациентов, имплантация стент-графта в нисходящую грудную аорту и стентирование торакоабдоминальной аорты - у 11 (52,4%).
Результаты. В ближайшем послеоперационном периоде имели место 5 (23,8%) летальных исходов, у одного пациента с исходным проксимальным расслоением и у четырех больных с первичным дистальным расслоением. У всех выживших отмечено увеличение диаметра истинного просвета аорты и отсутствие кровотока или значительное его уменьшение в ложном просвете.
Заключение. Полная протяженная реконструкция аорты с направлением основной массы кровотока по истинному каналу предупреждает развитие фатальных осложнений и существенно улучшает качество жизни пациентов.
Ключевые слова
Расслоение аорты, или проникновение кровяных масс в пространство между слоями стенки аорты через разрыв ее внутренней оболочки, интимы, является грозным заболеванием, которое встречается с частотой 2,5 случая на 100 тыс. населения в год. При этом каждый пятый пациент умирает до поступления в клинику, а каждый третий – в течение 24 часов от начала клинических проявлений [1].
Традиционно большинство классификаций расслоения, включая самую первую и наиболее распространенную, предложенную De Bakey, основываются на локализации первоначального разрыва интимы аорты, поскольку от этого во многом зависят тяжесть состояния пациента, дальнейшая тактика лечения и прогноз. Если проксимальный разрыв в интиме аорты располагается в восходящем отделе либо дуге до нижнего края устья левой подключичной артерии, то речь идет о вариантах расслоения, которые современные авторы объединяют в один тип – проксимальный (I и II тип по De Bakey). В случае расположения входного отверстия ниже устья левой подключичной артерии расслоение считается дистальным (III тип по De Bakey) [2]. Проксимальное расслоение составляет 67% из всех случаев расслоения аорты, оставшиеся 33% относятся к дистальному расслоению [1].
Дистальное расслоение можно условно подразделить на два подтипа. При первичном дистальном расслоении надрыв интимы изначально располагается ниже устья левой подключичной артерии, при вторичном – выше, с функционирующим ложным просветом в нижележащих отделах аорты после ранее произведенной реконструкции ее проксимального участка.
Используемые при лечении проксимального расслоения традиционные открытые и современные гибридные методы реконструкции позволяют полностью восстановить функцию аортального клапана, восходящего отдела, дуги, брахиоцефальных сосудов и даже начальной части нисходящего грудного отдела аорты [3]. Однако после подобных вмешательств сохраняется функционирование ложного просвета в нисходящих отделах аорты [4]. Это обусловлено тем, что в основе проксимального типа расслоения чаще всего лежат наследственные заболевания, характеризующиеся дегенеративными процессами на всем протяжении аорты. Соответственно помимо основного входного отверстия в интиме имеется большое количество дополнительных малых фенестраций, через которые осуществляется сообщение между истинным и ложным просветами [5]. Таким образом, проксимальное расслоение после его хирургического лечения переходит в дистальный тип. Отличие от истинного дистального расслоения заключается в том, что в большинстве случаев не имеется четко выраженного верхнего входного отверстия, поскольку до реконструкции оно находилось выше и уже было закрыто во время предыдущего вмешательства.
Некоторые авторы указывают на то, что наличие действующего ложного просвета в нисходящем отделе аорты после вмешательства при проксимальном расслоении не влияет на показатели летальности в отдаленном послеоперационном периоде, но может быть предиктором увеличения диаметра аорты. Данные других авторов свидетельствуют о том, что частичный тромбоз ложного канала в сравнении с полной его проходимостью является независимым предиктором летальности у пациентов после выписки из стационара [6].
Стратегия и тактика лечения дистального расслоения аорты, конвертированного из проксимального или истинного, являются предметом дискуссии [7][8]. В лечении таких пациентов решают два вопроса: показана ли операция в данном конкретном случае и какой вариант реконструкции следует предпочесть. Большинство авторов сходятся во мнении, что вмешательство показано при увеличении диаметра аорты до 5,5 см либо при наличии выраженных клинических симптомов [9]. Радикальная замена всей пораженной аорты синтетическим протезом с имплантацией в него висцеральных ветвей по отдельности либо на единой площадке сопровождается операционной летальностью до 27%, если производится в плановом порядке, и до 50% – в экстренных случаях [10]. Широкое применение открытых радикальных операций ограничивается исходной тяжестью состояния пациента, наличием сопутствующих заболеваний и физиологическим резервом. Операция локального протезирования только нисходящего грудного отдела аорты с герметизацией или фенестрацией ложного просвета также не является идеальной, так как нередко приводит к рецидивам и резидуальному расслоению в дистальном участке [11]. В настоящее время распространена методика имплантации стент-графта в грудной отдел аорты для перекрытия разрыва в проксимальной части и последующего ремоделирования кровотока. Имеются данные о том, что установка стент-графта может стимулировать заживление расслоения, а иногда и всей аорты, включая брюшные сегменты. Тем не менее возможны первичные подтекания и поздняя реперфузия ложного просвета вследствие прогрессирования основного заболевания [12][13].
Цель работы: оценка ближайших исходов после полной одномоментной или этапной реконструкции первичного и вторичного дистального расслоения аорты с использованием имплантации голометаллических стентов в грудобрюшной отдел аорты.
МАТЕРИАЛЫ И МЕТОДЫ
На базе государственного бюджетного учреждения «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения города Москвы с 01.01.2011 по 31.12.2016 выполнено проспективное исследование со сплошным набором пациентов, соответствующих критериям включения:
- возраст старше 18 лет;
- вторичное дистальное расслоение аорты при i типе расслоения по de bakey, операция перекрытия зоны проксимальной фенестрации протезом либо стент-графтом;
- первичное дистальное расслоение (iii тип расслоения по de bakey);
- имплантация голометаллических стентов в грудобрюшной отдел аорты по поводу дистального расслоения.
Критериям включения соответствовал 21 пациент, из них у 8 дистальное расслоение прогрессировало в различные сроки после коррекции проксимального расслоения аорты – i типа по de bakey (группа 1) и у 13 диагностировано первичное дистальное расслоение – iii тип по de bakey (группа 2).
Стадию заболевания определяли по классификации wheat от начала первых клинических симптомов расслоения или первого случая его диагностики у данного пациента [14].
Пациентам с проксимальным расслоением производилось протезирование восходящего отдела и дуги аорты и, таким образом, конвертация проксимального расслоения в дистальное. затем вторым этапом выполнялось протезирование либо имплантация стент-графта в нисходящий грудной отдел аорты и имплантация не покрытого тканью аортального стального стента в торакоабдоминальный отдел.
При наличии первичного дистального расслоения выполнялось протезирование нисходящей грудной аорты с имплантацией не покрытого тканью аортального стального стента в дистальный отдел либо полностью рентгенэндоваскулярная имплантация стент-графта и стента в дистальный отдел.
В исследовании оценивались: 30-дневная выживаемость после операции, причины летальных исходов, частота и характеристика нелетальных осложнений.
Статистический анализ
Категориальные переменные представлены в виде числа и доли, выраженной в процентах. Анализ распределения непрерывных случайных величин проводили по методу колмогорова – смирнова. нормально распределенные непрерывные величины представлены в виде среднего ± стандартное отклонение, остальные – как медиана и интерквартильный размах (25-й; 75-й перцентили). Для сравнения групп использовался точный критерий фишера, t-критерий стьюдента. принятый уровень статистической значимости: p < 0,05.
РЕЗУЛЬТАТЫ
Демографические и клинические показатели пациентов на момент первичной диагностики указаны в таблице 1.
Большинство пациентов в обеих группах было представлено мужчинами, средний возраст которых в группе 1 составил 43 года, что было на 13 лет меньше, чем в группе 2. Наиболее частой причиной расслоения в группе 1 была дисплазия соединительной ткани, в группе 2 – атеросклероз в сочетании с артериальной гипертензией.
В группе 1 реконструкция восходящего отдела аорты выполнена у 7 пациентов в острой фазе и у одного пациента в подострой (табл. 2). Показаниями для последующих вмешательств являлись: признаки мальперфузии в различных сосудистых бассейнах у всех пациентов, в том числе у 2 в сочетании с увеличением диаметра аорты более 0,5 см в течение полугода. Вмешательство на нисходящем отделе грудной аорты произведено в сроки от 1 до 24 месяцев после первых симптомов расслоения (рис.).
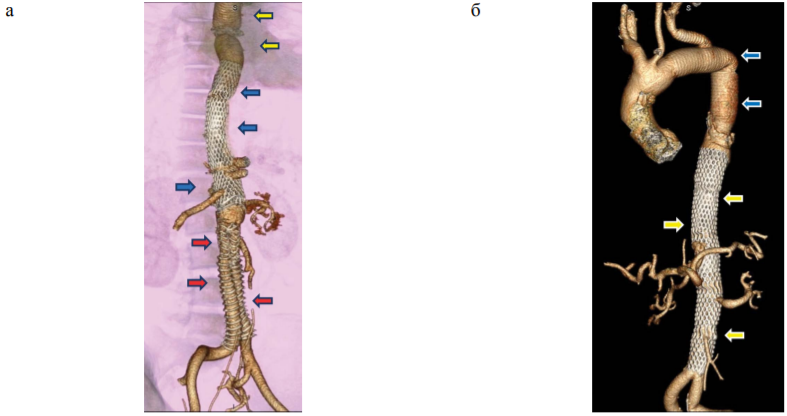
РИС. Мультиспиральная компьютерная томография: 3D-реконструкция. Окончательный вид аорты после завершения последнего этапа вмешательства у пациентов со вторичным дистальным расслоением:
а. Пациент № 1. Протезирование нисходящей грудной аорты: виден сосудистый протез (желтые стрелки), имплантация голометаллических стентов от средней трети нисходящей аорты до уровня ниже почечных артерий (синие стрелки), имплантация бифуркационного стент-графта ниже уровня почечных артерий (красные стрелки). Все висцеральные артерии проходимы;
б. Пациент № 2. Протезирование дистальной половины дуги аорты и левой подключичной артерии, нисходящей грудной аорты, виден сосудистый протез (синие стрелки), имплантация голометаллических стентов от средней трети нисходящей аорты до ее бифуркации (желтые стрелки). Кровоток по ложному просвету отсутствует. Все висцеральные артерии проходимы
FIG. Multi-slice spiral computed tomography scan: 3D reconstruction. The final view of the aorta after the completion of the last stage of the intervention in patients with secondary distal dissection:
a. Patient No. 1. Prosthetics of the descending thoracic aorta: vascular graft is visible (yellow arrows), implantation of bare metal stents from the middle third of the descending aorta to the level below the renal arteries (blue arrows), implantation of a bifurcation stent graft below the level of the renal arteries (red arrows). All visceral arteries are passable;
б. Patient No. 2. Prosthetics of the distal half of the aortic arch and the left subclavian artery, the descending thoracic aorta (vascular graft is visible (blue arrows), implantation of bare metal stents from the middle third of the descending aorta to its bifurcation (yellow arrows). There is no blood flow through the false lumen. All visceral arteries are passable
В группе 2 протезирование или стентирование нисходящего отдела грудной аорты и имплантация не покрытого стента в торакоабдоминальный отдел в острой фазе расслоения осуществлялись 6 пациентам, в подострой – 1 и в хронической – 6 пациентам (табл. 2). Показаниями для проведения вмешательства были признаки мальперфузии в одном или нескольких сосудистых бассейнах у всех пациентов в сочетании с непрекращающимся болевым синдромом у 6 или с увеличением совокупного диаметра аорты на 0,5 см в течение полугода у 3 пациентов.
Таблица 1. Демографические данные пациентов и характер патологии на момент первичной диагностики
Table 1. Demographic data of patients and the nature of pathology at the time of initial diagnosis
|
Параметр / Parameter |
Группа 1 / Group 1 (n = 8) |
Группа 2 / Group 2 (n = 13) |
Значение р / p value |
|
Демографические данные / demographic data |
|||
|
возраст, годы / age, years |
43,0 ± 3,1 |
56,0 ± 3,9 |
<0,05 |
|
мужчины / men (%) |
7 (88) |
12 (92) |
n.s. |
|
Этиология расслоения / aetiology of dissection |
|||
|
Артериальная гипертензия / arterial hypertension |
5 (63) |
12 (92) |
n.s. |
|
Атеросклероз / atherosclerosis |
2 (25) |
11 (85) |
<0,05 |
|
Дисплазия соединительной ткани / connective tissue dysplasia |
5 (63) |
2 (15) |
<0,05 |
|
синдром Марфана / Marfan syndrome |
1 (13) |
- |
n.s. |
Note: data presented as n (%) unless otherwise indicated; n.s. – non significant.
Таблица 2. Характер вмешательств у пациентов с расслоением аорты (n = 21)
Table 2. Types of interventions in patients with aortic dissection (n = 21)
|
№ |
Возраст Age |
Группа Group |
Фаза Phase of dissection |
Этап I Stage I |
Этап II / III / IV Stage II / III / IV |
Дополнительные вмешательства Additional |
Осложнения после Complications |
Исход Outcome |
|
1 |
40 |
1 |
Острая Аcute |
СПВАо SAAR |
ПНГАо / СНГАо / СТААо + ИСГБАо DTAR / DTAS / TAAS + BSGIAO |
Выжил Survive |
||
|
2 |
52 |
1 |
Острая Аcute |
СПВАо SAAR |
ПНГАо + СНГАо / СТААо / СОПА слева DTAR + DTAS / TAAS / CIAS from left |
Выжил Survive |
||
|
3 |
58* |
1 |
Острая Аcute |
СПВАо + ППДАо SAAR + HAAR |
СНГАо / СТААо DTAS / TAAS |
СОСА слева CCAS from left |
Полиорганная недостаточность, спинальные нарушения Multisystem organ failure, spinal disorders |
Выжила Survive |
|
4 |
45 |
1 |
Острая Аcute |
ПАКВАоК + ПДАо AAAVR + TAAR |
ИСГНГАо + СТААо SGIDTA + TAAS |
Выжил Survive |
||
|
5 |
36 |
1 |
Острая Аcute |
ПАКВАоК+ ППДАо AAAVR + HAAR |
СОСА справа / ППДАо + ПНГАо + СТААо / СБАо CCAS from right / HAAR + DTAR + TAAS / AAS |
СОСА справа + СОПА слева CCAS from right + CIAS from left |
Распространение расслоения выше стента в правой общей сонной артерии Progressing of the dissection above the stent in the right common carotid artery |
Выжил Survive |
|
6 |
36 |
1 |
Подострая Subacute |
ПАКВАоК + ПМК + ПТК + АКШ AAAVR + MVR + TVR + CABG |
ПНГАо + СТААо DTAR + TAAS |
Полиорганная |
Умер Die |
|
|
7 |
47 |
1 |
Острая Аcute |
ПАКВАоК AAAVR |
ИСГНГАо + СТААо SGIDTA + TAAS |
Выжил Survive |
||
|
8 |
35 |
1 |
Острая Аcute |
ПАКВАоК AAAVR |
ИСГНГАо + СТААо SGIDTA + TAAS |
СПШ слева CSBG from left |
Синдром обкрадывания Steal-syndrome |
Выжил Survive |
|
9 |
59 |
2 |
Острая Аcute |
ПНГАо+СНГАо DTAR + DTAS |
СТАо TAAS |
Выжил Survive |
||
|
10 |
67 |
2 |
Острая Аcute |
ЭФ в подвздошном сегменте слева + СНПА слева EF in left iliac segment + EIAS from left |
ПНГАо + СТААо DTAR + TAAS |
Острая сердечная Acute cardiac failure |
Умер Die |
|
|
11 |
33 |
2 |
Хроническая Chronic |
ПНГАо + СТААо DTAR + TAAS |
БПБАо BIAAR |
АБШ слева AFBG from left |
Мальперфузия левой ноги Malperfusion of the left lower limb |
Выжил Survive |
|
12 |
57* |
2 |
Подострая Subacute |
ПНГАо + СТААо DTAR + TAAS |
Выжила Survive |
|||
|
13 |
42 |
2 |
Хроническая Chronic |
ОФБАо + ПБП справа OAAF + IFBG from right |
ПНГАо + СТААо DTAR + TAAS |
Выжил Survive |
||
|
14 |
57 |
2 |
Острая Аcute |
ПНГАо + СТААо DTAR + TAAS |
Полиорганная |
Умер Die |
||
|
15 |
66 |
2 |
Хроническая Chronic |
ИСГНГАо + СТААо SGIDTA + TAAS |
Выжил Survive |
|||
|
16 |
72 |
2 |
Хроническая Chronic |
БПБАо + СГНГАо + СТААо через браншу протеза BIAAR + DTAS + TAAS though prosthetic branch |
Транзиторная ишемия Th 11–12, энцефалопатия Transient ischemia Th 11–12, encephalopathy |
Выжил Survive |
||
|
17 |
46 |
2 |
Острая Аcute |
ИСГНГАо + СТААо SGIDTA + TAAS |
Имплантация в ложный просвет Implantation in the false lumen |
Умер Die |
||
|
18 |
58 |
2 |
Острая Аcute |
СЧС CTS |
ИСГНГАо + СТААо SGIDTA + TAAS |
Прогресс расслоения, абдоминальная ишемия Progressing of the dissection, abdominal ischemia |
Умер Die |
|
|
19 |
70 |
2 |
Хроническая Chronic |
ИСГНГАо + СТААо SGIDTA + TAAS |
СПМЖВ до основного вмешательства LADS before the main intervention |
ОНМК Stroke |
Выжил Survive |
|
|
20 |
47 |
2 |
Острая Аcute |
ИСГНГАо + СТААо SGIDTA + TAAS |
Выжил Survive |
|||
|
21 |
56 |
2 |
Хроническая Chronic |
ИСГНГАо + СТААо SGIDTA + TAAS |
Выжил Survive |
Вмешательства на аорте: СПВАо – супракоронарное протезирование восходящей аорты; ПАКиВАоК – протезирование аортального клапана и восходящей аорты кондуитом; ППДАо – протезирование половины дуги аорты; ПДАо – протезирование всей дуги аорты; ПНГАо – протезирование нисходящей грудной аорты; БПБАо – бифуркационное протезирование инфраренального отдела брюшной аорты; ОФБАо – открытая фенестрация брюшной аорты; ИСГНГАо – имплантация стент-графта в нисходящую грудную аорту; ИСГБАо – имплантация бифуркационного стент-графта в инфраренальный отдел брюшной аорты; СТААо – стентирование торакоабдоминальной аорты; СНГАо – стентирование нисходящей грудной аорты; СБАо – стентирование брюшной аорты.
Дополнительные вмешательства: ПМК – протезирование митрального клапана; ПТК – протезирование трикуспидального клапана; АКШ – аортокоронарное шунтирование; АБШ – аорто-бедренное шунтирование; СПШ – сонно-подключичное шунтирование; ПБП – подвздошно-бедренное протезирование; СОСА – стентирование общей сонной артерии; СОПА – стентирование общей подвздошной артерии; СНПА – стентирование наружной подвздошной артерии; СЧС – стентирование чревного ствола; СПМЖВ – стентирование передней межжелудочковой ветви; ЭФ – эндоваскулярная фенестрация.
Notes: * – woman.
Aortic interventions: SAAR – supracoronary ascending aortic replacement; AAAVR – ascending aorta and aortic valve replacement; HAAR – hemi-aortic arch replacement; TAAR – total aortic arch replacement; DTAR – descending thoracic aortic replacement; BIAAR – bifurcational infrarenal abdominal aortic replacement; OAAF – open abdominal aortic fenestration; SGIDTA – stent-graft implantation in descending thoracic aorta; BSGIAO – bifurcational stent-graft implantation in infrarenal abdominal aorta; TAAS – thoracoabdominal aortic stenting; DTAS – descending thoracic aortic stenting; AAS – abdominal aortic stenting.
Additional interventions: MVR – mitral valve replacement; TVR – tricuspid valve replacement; CABG – coronary artery bypass grafting; AFBG – aorta-femoral bypass grafting; CSBG – carotid-subclavian bypass grafting; IFBG – iliac-femoral bypass grafting; CCAS – common carotid artery stenting; CIAS – common iliac artery stenting; EIAS – external iliac artery stenting; CTS – celiac trunk stenting; LADS – left anterior descending artery stenting; EF – endovascular fenestration.
30-дневная выживаемость после хирургического вмешательства
В группе 1 в течение 30 дней после операции выжили 7 пациентов (87%), в группе 2 – 9 (69%), разница между группами не значима.
Летальный исход в группе 1 имел место у пациента 36 лет с синдром Марфана (№ 6) от полиорганной недостаточности на следующие сутки после протезирования нисходящей грудной аорты и имплантации голометаллического стента. Поступил в тяжелом состоянии с явлениями выраженной висцеральной мальперфузии. За девять месяцев до этого ему были выполнены замена восходящей аорты и аортального клапана кондуитом, протезирование митрального и трикуспидального клапанов и аортокоронарное шунтирование правой коронарной артерии (табл. 2).
В группе 2 зафиксировано четыре летальных исхода у пациентов в острой стадии расслоения. Одному пациенту выполнено открытое вмешательство, троим – рентгенэдоваскулярные имплантации (табл. 2).
У пациента 57 лет (№ 14) летальный исход произошел на следующие сутки после операции. Поступил в тяжелом состоянии в острой фазе расслоения с прикрытым наружным разрывом грудной аорты в левую плевральную полость и полиорганной недостаточностью. По экстренным показаниям выполнено протезирование нисходящей грудной аорты и открытая имплантация голометаллического стента в торакоабдоминальный отдел. После завершения основного этапа операции отмечена диффузная кровоточивость вследствие коагулопатии. В послеоперационном периоде произошло нарастание полиорганной недостаточности на фоне гиперкоагуляции (табл. 2).
Пациенту 46 лет (№ 17) производилось экстренное вмешательство по поводу острого расслоения и выраженной компрессии истинного просвета, стент-графт, а затем и стент были имплантированы в ложный канал аорты. Смерть наступила на операционном столе (табл. 2).
Пациент 67 лет (№ 10) поступил по поводу острого дистального расслоения с синдромом выраженной абдоминальной мальперфузии. В тот же день по экстренным показаниям выполнены: эндоваскулярная фенестрация брюшной аорты и стентирование левой общей подвздошной артерии. На следующий день произведено протезирование нисходящей аорты с открытой имплантацией голометаллического стента длиной 14 см в дистальный сегмент нисходящей грудной и проксимальный сегмент брюшной аорты. Через двое суток полностью активизирован и переведен в клиническое отделение в удовлетворительном состоянии. Летальный исход наступил внезапно на третьи сутки после вмешательства в результате геморрагического шока на фоне острой кровопотери вследствие разрыва аорты (табл. 2).
Пациент 58 лет (№ 18) поступил в острой фазе расслоения с явлениями выраженной абдоминальной ишемии; в экстренном порядке выполнено стентирование чревного ствола, затем эндопротезирование проксимального сегмента нисходящей грудной аорты от дистальной полуокружности устья левой подключичной артерии эндопротезом и стентирование дистального сегмента нисходящей грудной и проксимального сегмента брюшной аорты голометаллическим стентом. В удовлетворительном состоянии выписан на восьмые сутки после проведенного вмешательства. Через 14 суток поступил с явлениями острой абдоминальной ишемии. По данными мультиспиральной компьютерной томографии и аортографии имели место признаки компрессии истинного просвета аорты ниже зоны стентирования и тромбоза верхней брыжеечной артерии. Выполнена диагностическая лапароскопия с последующей конверсией в лапаротомию, выявлен тотальный некроз тонкой кишки, случай признан не операбельным. Смерть наступила от нарастающих явлений эндогенной интоксикации на следующие сутки (табл. 2).
Нелетальные осложнения
В группе 1 нелетальные осложнения развились у 3 (38%), в группе 2 – у 3 (23%) пациентов, разница между группами не значима.
В группе 1 у женщины 58 лет (№ 3) в ближайшем послеоперационном периоде после супракоронарного протезирования и протезирования половины дуги аорты по поводу острого проксимального расслоения развилась острая полиорганная недостаточность, по поводу которой 56 дней находилась на лечении в отделении интенсивной терапии. Через пять месяцев после первого этапа операции выполнено стентирование левой общей сонной артерии, учитывая наличие ее расслоения, и стентирование нисходящего отдела грудной аорты по причине висцеральной мальперфузии (табл. 2).
Мужчине 36 лет (№ 5) через два месяца после проведения первого этапа вмешательства по поводу сохраняющегося расслоения выполнено стентирование правой общей сонной артерии, через двое суток произведено протезирование дистальной части дуги аорты, протезирование нисходящей грудной аорты и открытая имплантация голометаллического стента в зону висцеральных ветвей. В дальнейшем имело место распространение расслоения выше места имплантации стента в правой общей сонной артерии. Также сохранялся ложный просвет в дистальном отделе брюшной аорты, переходивший на левую подвздошную артерию, что вызывало мальперфузию левой нижней конечности. Через полтора месяца выполнена имплантация стента в правую общую сонную артерию, в край установленному ранее, имплантация голометаллического стента в брюшной отдел аорты, стентирование левой подвздошной артерии. Выписан в удовлетворительном состоянии (табл. 2).
У пациента 35 лет (№ 8) во время проведения второго этапа вмешательства при имплантации стент-графта было перекрыто устье левой подключичной артерии. На следующий день после вмешательства появились жалобы на головокружение, головную боль, шаткость походки. Учитывая наличие синдрома обкрадывания, выполнено сонно-подключичное шунтирование слева, которое полностью купировало симптомы.
Во второй группе у пациента 33 лет (№ 11) после протезирования нисходящей грудной аорты и имплантации голометаллического стента продолжалось прогрессирование дистального расслоения; вследствие сдавления ложным просветом сформировалась окклюзия устья левой наружной подвздошной артерии. Через два месяца выполнено протезирование инфраренальной порции брюшной аорты и аортобедренное шунтирование слева с формированием анастомоза между протезом аорты и бедренным шунтом. Течение послеоперационного периода – без осложнений (табл. 2).
У пациента 72 лет (№ 16) после бифуркационного протезирования инфраренального отдела аорты и подвздошных артерий, имплантации стент-графта в нисходящий грудной отдел аорты и стентирования голометаллическим стентом брюшной аорты на уровне висцеральных ветвей через браншу бифуркационного протеза аорты на вторые сутки после вмешательства развилось транзиторное нарушение спинномозгового кровообращения, выражавшееся в парезе и снижении чувствительности в нижних конечностях. Под воздействием интенсивной сосудистой терапии и сеансов гипербарической оксигенации неврологическая симптоматика регрессировала (табл. 2).
У пациента 70 лет (№ 19) после имплантации стент-графта в нисходящий грудной отдел аорты с перекрытием устья левой подключичной артерии и стентирования голометаллическим стентом на уровне висцеральных ветвей брюшной аорты на следующие сутки после вмешательства имело место острое нарушение мозгового кровообращения. Проводилась консервативная терапия с положительным эффектом (табл. 2).
ОБСУЖДЕНИЕ
Причины формирования расслоения аорты, так же как и отличительные особенности его проксимальной и дистальной форм, подробно описаны в специальной литературе [5]. Основными факторами, влияющими на формирование расслоения, являются структура стенки аорты, параметры движения потока крови внутри нее и геометрия аортального русла. Преобладающим этиологическим фактором, поражающим аортальную стенку при проксимальном расслоении, является дисплазия соединительной ткани, характеризующаяся дефицитом эластина – превалирующего элемента в структуре среднего слоя аортальной стенки в восходящем отделе аорты. Это приводит к разобщению функционирования аортальной стенки как единой структуры под воздействием переменных нагрузок по преобразованию пульсирующего потока крови в линейный, что влечет за собой уменьшение эластичности аорты и, как следствие, ее расслоение. В нисходящем грудном отделе аорты в среднем слое ее стенки наряду с эластином начинают преобладать более упругие коллагеновые структуры, способствующие сохранению инерции потока крови. В этой связи в основе первичного дистального расслоения чаще всего лежит атеросклероз и артериальная гипертензия. Этими факторами объясняются основные различия в возрасте пациентов и этиологии расслоения в первой и второй группах.
В представленном исследовании как при первичном, так и при вторичном дистальном расслоении применялись стандартные показания к вмешательству (симптомы мальперфузии) и единая тактика лечения.
Летальность в течение ближайших 30 дней после вмешательства составила 5 случаев (24%) для всей группы пациентов, что соответствует данным большинства авторов для осложненного дистального расслоения [9][10][11]. В первой группе зарегистрирован 1 (13%) летальный исход, во второй – 4 (31%) летальных исхода. Такое различие обусловлено прежде всего тем, что группу 1 составляли пациенты, перенесшие вмешательство на восходящем отделе аорты, у которых уже произошло ремоделирование гемодинамики. В группе 2 большинство вмешательств были выполнены в острой фазе расслоения. Летальные осложнения в этой группе были обусловлены прогрессированием процесса расслоения либо произошли на ранних этапах освоения методики. Эти показатели не отличаются от данных других авторов [11][12].
Для лечения пациентов была избрана комбинированная методика, которая заключалась в изоляции истинного просвета аорты в проксимальной части и стентировании ее дистального участка на уровне висцеральных сосудов и ниже. Протезирование грудного сегмента аорты и имплантация одного или нескольких стентов ниже дистального анастомоза в ее просвет применялась у 10 пациентов. Полностью рентгенэндоваскулярная имплантация стент-графта и затем голометаллических стентов – у 11.
В литературе комбинированные одноэтапные операции в основном упоминаются в качестве метода выбора при реконструкции проксимального расслоения [15]. Тем не менее комбинированный одноэтапный метод в применении к распространенному осложненному дистальному расслоению может решить многие проблемы [16]. Во-первых, проксимальный отдел грудной нисходящей аорты замещается синтетическим протезом, что полностью исключает его миграцию. Во-вторых, ложный канал герметизируется под прямым визуальным контролем, это дает возможность очистить ложный просвет от тромботических масс, более надежно перекрыть кровоток по нему и избежать частичного тромбоза. В-третьих, это позволяет более четко визуализировать истинный и ложный просветы аорты. Кроме того, при наличии сопутствующих заболеваний и ограничения физиологического резерва пациента всю операцию можно выполнить из одного торакотомного доступа. Недостатками данной методики являются высокая травматичность вмешательства и необходимость циркуляторного ареста, что при наличии тяжелого исходного состояния может привести к полиорганной недостаточности, как это произошло у одного из наших пациентов.
Полностью рентгенэндоваскулярная имплантация стент-графта и аортального голометаллического стента чрезбедренным доступом, безусловно, лишена указанных недостатков и гораздо менее травматична. Слабым ее местом является опосредованная визуализация и отсутствие возможности прямого доступа к зоне проведения манипуляций. Так, например, при сильной компрессии истинного просвета и наличии нескольких ложных каналов у пациента в острой фазе расслоения возможна постановка всей конструкции частично в истинный, частично в ложные просветы аорты. При наличии замкнутого пространства внутри стент-графта основная масса кровотока будет направлена по ложному каналу, что приведет к еще большей компрессии истинного. Как это произошло в одном из клинических наблюдений, на начальном этапе освоения методики. Кроме того, для успешной имплантации стент-графта необходимы определенные условия, например наличие посадочной площадки как в проксимальном, так и в дистальном участке аорты не менее 2 см, необходимо также, чтобы аорта не имела больших изгибов или кальцинатов [17].
Исследования показывают, что намеренное перекрытие левой подключичной артерии стент-графтом ведет к статистически значимому повышению риска инсульта и ишемии спинного мозга. Таким образом, современные рекомендации включают реваскуляризацию левой подключичной артерии. В описываемых нами группах, к сожалению, не удалось избежать указанных осложнений. Так, у одного из пациентов после перекрытия левой подключичной артерии стент-графтом возникло нарушение мозгового кровообращения, а у другого – синдром обкрадывания левой спинномозговой артерии.
Специфическим осложнением при имплантации стент-графта наряду с другими также является нарушение функции спинного мозга при длине стент-графта более 20 см [18][19]. В сочетании с применением голометаллического стента этот недостаток нивелируется.
С другой стороны, опубликованы серии наблюдений, где стентирование аорты производилось в качестве монометода [20]. Основной задачей вмешательства в данном случае была декомпрессия истинного просвета аорты и предотвращение развития связанных с ней серьезных осложнений.
По нашему мнению, одного закрытия проксимальной фенестрации недостаточно для того, чтобы полностью обеспечить адекватную перфузию по истинному просвету аорты ввиду множественности фенестраций на фоне генерализованного поражения всей аортальной стенки. Так, летальные исходы возникли вследствие незащищенности аортальной стенки ниже уровня стентирования у двух пациентов: у одного – с острым расслоением вследствие разрыва аорты после предшествующей рентгенэндоваскулярной фенестрации, у другого – по причине мезентериального тромбоза ниже уровня стентирования. Еще одному пациенту пришлось производить бифуркационное протезирование аорты и аортобедренное шунтирование ввиду выраженной компрессии истинного просвета двумя ложными ниже уровня стентирования.
ЗАКЛЮЧЕНИЕ
Выживаемость в течение 30 дней после полной одномоментной или этапной реконструкции первичного и вторичного дистального расслоения аорты с использованием имплантации голометаллических стентов в грудобрюшной отдел аорты составляет 76%, частота нелетальных осложнений – 28%. Среди нелетальных осложнений отмечались: мальперфузия верхних и нижних конечностей, потребовавшая установки стента, протезирования или шунтирования; нарушение спинномозгового кровообращения, острое нарушение мозгового кровообращения, полиорганная недостаточность, купированные консервативно.
ВКЛАД АВТОРОВ
М.А. Соборов разработал основную концепцию и дизайн исследования, осуществлял набор пациентов, написал основную часть финальной версии статьи. О.М. Канадашвили и Е.Н. Белых участвовали в разработке дизайна исследования, осуществляли анализ полученных результатов, написали часть финальной версии статьи. К.С. Баранов осуществлял сбор клинических, лабораторных и анкетных данных, статистическую обработку, написал часть финальной версии статьи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Mark A. Soborov developed the basic concept, design of the study, recruited patients, and wrote the main part of the final article. Omary V. Kanadashvili, Elena N. Belykh participated in the development of the study design, analyzed the results and wrote part of the final version of the article. Kirill S. Baranov collected clinical, laboratory and personal data, statistically processed and wrote part of the final version of the article. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Evangelista A., Isselbacher E.M., Bossone E., et al. Insights from the international registry of acute aortic dissection: a 20-year experience of collaborative clinical research. Circulation. 2018; 137(17): 1846–1860. https://doi.org/10.1161/CIRCULATIONAHA.117.031264 PMID: 29685932
2. Debakey M.E., Henly W.S., Cooley D.A., et al. Surgical management of dissecting aneurysms of the aorta. J Thorac Cardiovasc Surg. 1965; 49: 130–149. https://doi.org/10.1016/S0022-5223(19)33323-9 PMID: 14261867
3. Smith H.N., Boodhwani M., Ouzounian M., et al. Classification and outcomes of extended arch repair for acute type A aortic dissection: a systematic review and meta-analysis dagger. Interact Cardiovasc Thorac Surg. 2017; 24(3): 450–459. https://doi.org/10.1093/icvts/ivw355 PMID: 28040765
4. Leontyev S., Haag F., Davierwala P.M., et al. Postoperative changes in the distal residual aorta after surgery for acute type A aortic dissection: impact of false lumen patency and size of descending aorta. Thorac Cardiovasc Surg. 2017; 65(2): 90–98. https://doi.org/10.1055/s-0036-1571813 PMID: 27111499
5. Rylski B., Hahn N., Beyersdorf F., et al. Fate of the dissected aortic arch after ascending replacement in type A aortic dissection. Eur J Cardiothorac Surg. 2017; 51(6): 1127–1134. https://doi.org/10.1093/ejcts/ezx062 PMID: 28369453
6. Li D., Peng L., Wang Y., et al. Predictor of false lumen thrombosis after thoracic endovascular aortic repair for type B dissection. J Thorac Cardiovasc Surg. 2020; 160(2): 360–367. https://doi.org/10.1016/j.jtcvs.2019.07.091 PMID: 31558276
7. Комаров Р.Н., Винокуров И.А., Каравайкин П.А. и др. Этапный метод гибридного протезирования торакоабдоминальной аорты. Хирургия. Журнал им. Н.И. Пирогова. 2018; 2: 21–27. https://doi.org/10.17116/hirurgia2018221-27 PMID: 29460875
8. Соколов В.В., Рубцов Н.В., Редкобородый А.В. и др. Выбор оптимальной тактики лечения пациентов с расслоением нисходящей аорты. Ангиология и сосудистая хирургия. 2019; 25(1): 115–119. https://doi.org/10.33529/angio2019116 PMID: 30994617
9. Riambau V., Böckler D., Brunkwall J., et al. Editor’s choice – management of descending thoracic aorta diseases: clinical practice guidelines of the european society for vascular surgery (ESVS). Eur J Vasc Endovasc Surg. 2017; 53(1): 4–52. http://dx.doi.org/10.1016/j.ejvs.2016.06.005 PMID: 28081802
10. Tanaka A., Sandhu H.K., Afifi R.O., et al. Outcomes of open repairs of chronic distal aortic dissection anatomically amenable to endovascular repairs. J Thorac Cardiovasc Surg. 2019; 161(1): 36–43. E6. https://doi.org/10.1016/j.jtcvs.2019.09.083 PMID: 31699416
11. Boufi M., Patterson B.O., Loundou A.D., et al. Endovascular versus open repair for chronic type B dissection: a meta-analysis. Ann Thorac Surg. 2019; 107(5): 1559–1570. https://doi.org/10.1016/j.athoracsur.2018.10.045 PMID: 30481516
12. Norton E., Williams D., Kim K., et al. Management of acute type B aortic dissection with malperfusion via endovascular fenestration/stenting. J Thorac Cardiovasc Surg. 2020; 160(5): 1151–1161.e1. https://doi.org/10.1016/j.jtcvs.2019.09.065 PMID: 31669033
13. Burke C.R., Bavaria J.E. The role of thoracic endovascular repair in chronic type B aortic dissection. Semin Thorac Cardiovasc Surg. 2020; 32(1): 21–24. https://doi.org/10.1053/j.semtcvs.2019.08.010 PMID: 31493449
14. Wheat Jr. M.W., Palmer R.F., Bartley T.D., Seelman R.C. Treatment of dissecting aneurysms of the aorta without surgery. J Thorac Cardiovasc Surg. 1965; 50: 364–369 PMID: 14346544
15. Сирота Д.А., Хван Д.С., Ляшенко М.М. и др. Применение непокрытых металлических стентов в хирургии расслоения аорты. Ангиология и сосудистая хирургия. 2018; 24(4): 110–116. PMID: 30531778
16. Шломин В.В., Коровин И.В., Дрожжин И.Г. и др. Ликвидация позднего эндолика после протезирования расслоившейся торакоабдоминальной аневризмы аорты. Ангиология и сосудистая хирургия. 2019; 25(4): 173–180. https://doi.org/10.33529/ANGIO2019413 PMID: 31855215
17. Sharafuddin M.J., Bhama J.K., Bashir M., et al. Distal landing zone optimization before endovascular repair of aortic dissection. J Thorac Cardiovasc Surg. 2019; 157(1): 88–98. https://doi.org/10.1016/j.jtcvs.2018.06.095 PMID: 30557960
18. Voigt S.L., Bishawi M., Ranney D., et al. Outcomes of carotidsubclavian bypass performed in the setting of thoracic endovascular aortic repair. J Vasc Surg. 2019; 69(3): 701–709. https://doi.org/10.1016/j.jvs.2018.07.022 PMID: 30528402
19. Козлов Б.Н., Панфилов Д.С., Саушкин В.В. и др. Значение уровня имплантации гибридного стент-графта «E-vita open plus» в нисходящую аорту в развитии спинальных ишемических осложнений. Ангиология и сосудистая хирургия. 2017; 23(1): 82–86. PMID: 28574041
20. Чернявский М.А., Артюшин Б.С., Чернов А.В. и др. Клинический случай имплантации голометаллического стента при дистальном расслоении аорты. Трансляционная медицина. 2018; 5(5): 12–17. https://doi.org/10.18705/2311-4495-2018-5-5-12-17
Об авторах
М. А. СоборовРоссия
Соборов Марк Алексеевич, канд. мед. наук, доцент кафедры госпитальной хирургии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
О. В. Канадашвили
Россия
Канадашвили Омари Владимирович, канд. мед. наук, доцент кафедры госпитальной хирургии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Е. Н. Белых
Россия
Белых Елена Николаевна, канд. мед. наук, доцент кафедры госпитальной хирургии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
К. С. Баранов
Россия
Баранов Кирилл Сергеевич, студент Института клинической медицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991







































