Перейти к:
Алирокумаб в практике многопрофильного дневного стационара: результаты открытого несравнительного проспективного исследования
https://doi.org/10.47093/2218-7332.2020.11.4.15-22
Аннотация
Цель. Оценка эффективности и безопасности применения алирокумаба у пациентов с атерогенной дислипидемией в реальной клинической практике.
Материалы и методы. В проспективном несравнительном исследовании изучены 92 пациента (61 мужчина; средний возраст 59,8 ± 9,6 года) с атерогенной дислипидемией и отсутствием достижения целевых уровней липидов. Алирокумаб (Пралуэнт, «Санофи») вводился в дозе 150 мг подкожно 1 раз в 2 недели в течение 3 мес. Первичной конечной точкой являлось достижение целевого уровня холестерина липопротеинов низкой плотности (ХС-ЛПНП). Дополнительно оценивался уровень липопротеина(а) (ЛП(а)) и холестерин липопротеинов высокой плотности (ХС-ЛПВП). Для оценки безопасности исследовались печеночные тесты, уровень креатинина и гликемии; изучены побочные эффекты. Для проверки статистических гипотез применялся парный t-тест и критерий Вилкоксона.
Результаты. Через 3 мес. терапии наблюдалось статистически значимое снижение ХС-ЛПНП: 1,45 [0,99; 2,14] vs 3,00 ммоль/л [2,17; 3,81] исходно (р < 0,0001); медиана снижения составила –47% [–25; –65]; целевой уровень ХС-ЛПНП достигнут у 40 (43%) пациентов. Отмечено повышение ХС-ЛПВП: через 3 мес. лечения их уровень составил 1,36 ± 0,41 vs 1,31 ± 0,38 ммоль/л исходно (р < 0,01). Концентрация ЛП(а) повторно измерена у 21 пациента с исходным уровнем > 30 мг/дл: достигнуто статистически значимое снижение через 3 мес. 67 [46; 155] vs 85 мг/дл [58; 187] исходно (р < 0,001). Показатели печеночных тестов, креатинина и гликемии натощак значимо не менялись. Побочные эффекты и нежелательные явления не зафиксированы.
Заключение. В реальной клинической практике через 3 мес. лечения алирокумабом наблюдалось значимое снижение уровня ХС-ЛПНП, целевые уровни достигнуты у 43% пациентов, отмечено значимое снижение уровня ЛП(а) и повышение ХС-ЛПВП.
Атерогенная дислипидемия сопровождает многие заболевания печени. Наиболее типичны нарушения липидного обмена у пациентов с неалкогольной жировой болезнью печени (НАЖБП) [1], хроническим внутрипеченочным холестазом [2], реципиентов донорской печени (27–71%) [3]. Нарушения липидного обмена у пациентов с патологией печени сопряжены с серьезными осложнениями и нередко непосредственно влияют на прогноз. Так, в метаанализе, включавшем популяционные исследования и исследования типа «случай-контроль», продемонстрировано увеличение сердечно-сосудистых заболеваний, обусловленных атеросклерозом, на 64% у пациентов после трансплантации печени по сравнению с общей популяцией [4].
Применение статинов и фибратов при хронических холестатических болезнях печени, в частности при первичном билиарном холангите (циррозе), может быть оправдано не только в связи со снижением риска сердечно-сосудистой патологии, но и в отношении позитивного влияния на печеночные функциональные тесты [5][6]. Вместе с тем традиционные средства для борьбы с дислипидемией у пациентов с печеночной патологией нередко оказываются неэффективными.
В связи с этим представляет интерес алирокумаб — гуманизированное моноклональное антитело подкласса IgGl, мишенью которого служит пропротеиновая конвертаза субтилизин-кексин типа 9 (proprotein convertase subtilisin/kexin type 9, PCSK9). PCSK9 связывается с рецепторами липопротеинов низкой плотности (р-ЛПНП) на поверхности гепатоцитов, способствуя деградации р-ЛПНП в печени. Функция р-ЛПНП заключается в выведении из системного кровотока циркулирующих ЛПНП, поэтому уменьшение количества р-ЛПНП при связывании их с PCSK9 приводит к повышению концентрации холестерина липопротеинов низкой плотности (ХС-ЛПНП) в крови. Ингибируя связывание PCSK9 с р-ЛПНП, алирокумаб увеличивает количество р-ЛПНП, снижая, таким образом, концентрацию ХС-ЛПНП в крови [7]. Механизм действия алирокумаба представлен на рисунке 1.

РИС. 1. Функция PCSK9 и ее ингибирование алирокумабом.
FIG. 1. PCSK9 function and its inhibition by alirocumab.
Примечание. PCSK9 — пропротеиновая конвертаза субтилизин-кексинового типа 9, р-ЛПНП — рецепторы липопротеинов низкой плотности, ХС-ЛПНП — холестерин липопротеинов низкой плотности, Е — эндосома, L — лизосома, R — рециркуляция р-ЛПНП.
1. ХС-ЛПНП захватывается р-ЛПНП, и комплекс посредством E попадает в гепатоцит. Далее ХС-ЛПНП подвергается расщеплению в L, а р-ЛПНП возвращается на поверхность гепатоцита, что обеспечивает R.
2. PCSK9 связывается с р-ЛПНП на гепатоцитах, что препятствует R и способствует повышению концентрации ХС-ЛПНП.
3. Антитела к PCSK9 (алирокумаб) ингибируют связывание PCSK9 с р-ЛПНП, что увеличивает R, тем самым снижая концентрацию ХС-ЛПНП в крови.
Note. PCSK9 — proprotein convertase subtilisin / kexin type 9, r-LDL — low-density lipoprotein receptors, LDL-C — low-density lipoprotein cholesterol, E — endosome, L — lysosome, R — r-LDL recirculation.
1. LDL-C is taken up by r-LDL, and the complex enters the hepatocyte through E. After that LDL-C is degraded into L, and p-LDL returns to the surface of the hepatocyte, which provides the R.
2. PCSK9 binds to r-LDL on hepatocytes, which inhibits the R and increases the concentration of LDL-C.
3. Antibodies to PCSK9 (alirocumab) inhibit the binding of PCSK9 to r-LDL, which increases the R, contributing to a decrease in the concentration of LDL-C in the blood.
р-ЛПНП также связывают богатые триглицеридами ремнантные липопротеины очень низкой плотности и липопротеины промежуточной плотности. В связи с этим алирокумаб снижает также уровень этих ремнантных липопротеинов, о чем свидетельствует, в частности, уменьшение их содержания в аполипопротеине В. Необходимо отметить, что алирокумаб, в отличие от статинов, снижает уровень липопротеина(а) (ЛП(а)), представляющего собой ЛПНП с присоединенным аполипопротеином(а), который гомологичен плазминогену и, как было показано in vitro, ингибирует фибринолиз.
Уровень ЛП(а) генетически обусловлен и не зависит от пола, возраста, диеты и массы тела. Повышенный уровень ЛП(а) ассоциирован со значительным риском заболеваний, обусловленных атеросклерозом и атеротромбозом.
Эра применения ингибиторов PCSK9, начавшаяся в 2015 г., позволила совершить прорыв в лечении пациентов с различными вариантами дислипидемий, включая наследственные формы гиперхолестеринемии. Опубликованы работы, в которых показано, что длительная терапия алирокумабом снижает смертность от острого коронарного синдрома при высоком исходном уровне ХС-ЛПНП [8][9]. Кумулятивный анализ 14 исследований продемонстрировал безопасность алирокумаба, независимо от наличия или отсутствия сахарного диабета [10].
Несмотря на высокую эффективность, опыт клинического использования препаратов этой группы в России остается ограниченным, что, по всей видимости, связано как с низкой осведомленностью специалистов, так и с высокой стоимостью терапии.
Цель исследования. Оценка эффективности и безопасности применения алирокумаба у пациентов с атерогенной дислипидемией в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено проспективное несравнительное исследование применения алирокумаба в рамках реальной клинической практики. Исследование проведено на базе клиник АО «Группа компаний «Объединенные медицинские системы» с 01.11.2018 по 31.01.2020 г. Исследование одобрено Локальным этическим комитетом АО «Группа компаний «Объединенные медицинские системы» 30.10.2018 г. Критерии включения в исследование (наличие показаний к назначению алирокумаба):
- возраст старше 18 лет;
- атерогенная дислипидемия с отсутствием достижения целевых уровней липидов в соответствии с рекомендациями Европейского общества кардиологов и Европейского общества атеросклероза (European Society of Cardiology, ESC and the European Atherosclerosis Society, EAS) [11] на максимальной дозе статинов и эзетимиба. Целевой уровень ХС-ЛПНП для пациентов высокого риска составлял <1,8 ммоль/л, для пациентов очень высокого риска — <1,4 ммоль/л;
- наличие высокого и очень высокого сердечно-сосудистого риска в соответствии с рекомендациями ESC/ EAS 2019 года [11];
- семейная гетерозиготная дислипидемия;
- непереносимость статинов;
- противопоказания для назначения или продолжения терапии статинами (более чем трехкратное повышение уровня трансаминаз от верхней границы нормы, мышечная слабость или миалгия);
- подписанное информированное согласие.
Критерии невключения:
- беременность;
- лактация;
- указания на гиперчувствительность к алирокумабу.
Критерии исключения:
- реакция в месте введения препарата;
- реакция гиперчувствительности;
- желание пациента прекратить исследование.
Критериям включения/невключения соответствовало 118 пациентов, из которых 92 получили терапию алирокумабом (Пралуэнт, «Санофи») в дозе 150 мг подкожно 1 раз в 2 недели в течение 3 мес., 44 пациентам терапия проводилась в течение 6 мес. (рис. 2).
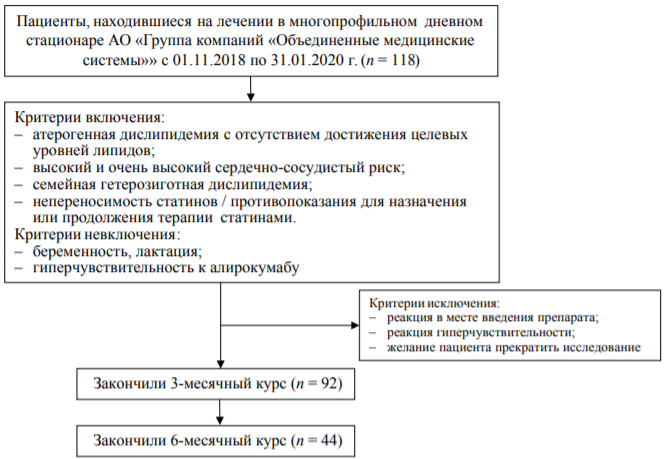
РИС. 2. Потоковая диаграмма включения пациентов в исследование.
FIG. 2. Patient enrollment flowchart.
Первичной конечной точкой являлось достижение целевого уровня ХС-ЛПНП. Оценка ХС-ЛПНП проводилась каждые 3 месяца. Первичная конечная точка оценивалась через 3 и 6 мес. лечения. Дополнительно оценивался уровень ЛП(а) и холестерин липопротеинов высокой плотности (ХС-ЛПВП).
Исследование уровня ХС-ЛПНП проводилось прямым измерением, колориметрией с использованием холестеролоксидазы и холестеролэстеразы, ХС-ЛПВП — гомогенным энзиматическим колориметрическим анализом и ЛП(а) — методом иммунотурбидиметрии.
Для оценки безопасности исследовались печеночные функциональные тесты: уровни аланиновой и аспарагиновой трансаминаз (АЛТ и АСТ), билирубин; а также уровень креатинина и гликемия натощак.
Оценивались такие побочные эффекты, как системные и местные реакции гиперчувствительности, реакции со стороны верхних дыхательных путей (боль при глотании, ринорея), кожный зуд.
Статистический анализ
Для проверки гипотез на нормальность применялись критерии Колмогорова — Смирнова и Шапиро — Уилка. Переменные с нормальным распределением представлены как среднее арифметическое и стандартное отклонение, переменные с ненормальным распределением — медиана и интерквартильный размах [ 25-й; 75-й процентили].
При сравнении данных в процессе лечения для проверки статистических гипотез применяли: парный t-тест (при нормальном распределении) и критерий Вилкоксона для переменных с ненормальным распределением. При сравнении показателей частот использовали критерий χ2 Пирсона. Различия считали значимыми при р < 0,05.
Данные обрабатывались с помощью программы Statistica 13.0 (TIBCO, США).
РЕЗУЛЬТАТЫ
В итоговый анализ включены данные 92 пациентов: 61 (66%) мужчины и 31 (34%) женщины в возрасте от 36 до 82 лет (средний возраст 59,8 ± 9,6 года).
Клиническая характеристика пациентов представлена в таблице 1. Почти все пациенты имели признаки периферического атеросклероза, 75 (81)% — указания на ишемическую болезнь сердца, 67% проводись эндоваскулярные процедуры (баллонная ангиопластика, стентирование). Семейная гиперхолестеринемия отмечена у каждого третьего пациента. Ожирение и НАЖБП встречались у 24 и 21% соответственно, сахарный диабет 2-го типа диагностирован у 13% пациентов, один пациент перенес ортотопическую траснплантацию печени. Из всех пациентов к подгруппе очень высокого риска развития сердечно-сосудистых осложнений отнесены 75 (82%) пациентов, остальные соответствовали подгруппе высокого риска.
Характеристика липидного спектра и биохимических параметров безопасности, до, в процессе и по завершении терапии алирокумабом представлена в таблице 2.
Таблица 1. Коморбидные заболевания и состояния у пациентов с атерогенной дислипидемией (n = 92)
Table 1. Comorbidity in patients with atherogenic dyslipidemia (n = 92)
Заболевание/состояние | Число пациентов (% от общего числа) |
Периферический атеросклероз | 89 (97) |
Ишемическая болезнь сердца | 75 (81) |
Реваскуляризация миокарда и стентирование периферического сосудистого русла | 62 (67) |
Семейная гиперхолестеринемия | 31 (34) |
Ожирение | 22 (24) |
НАЖБП | 19 (21) |
Сахарный диабет 2-го типа | 12 (13) |
Трансплантация печени | 1 (1) |
Таблица 2. Липидный спектр и биохимические параметры безопасности на фоне терапии алирокумабом
Table 2. Lipid spectrum and biochemical safety parameters during alirocumab therapy
Показатель | Исходно | Через 3 мес. лечения | Значение р |
ХС-ЛПНП, ммоль/л | 3,00 [ 2,17; 3,81] | 1,45 [ 0,99; 2,14] | <0,0001 |
ХС-ЛПНП, целевой уровень, n (%) | 40 (40%) | <0,001 | |
ХС-ЛПВП, ммоль/л | 1,31 ± 0,38 | 1,36 ± 0,41 | <0,01 |
ЛП(а) >30 мг/дл (n = 21) | 85 [ 58; 187 ] | 67 [ 46; 155 ] | <0,001 |
АЛТ, ед/л | 23,0 [ 16,5; 33,8 ] | 21,1 [ 17,2; 34,5 ] | ns |
АСТ, ед/л | 22,8 [ 18,2; 30,7 ] | 21,9 [ 18,8; 27,0 ] | ns |
Билирубин общий, мкмоль/л | 8,5 [ 5,8; 11,0 ] | 8,0 [ 6,1; 11,2 ] | ns |
Креатинин, мкмоль/л | 82,5 [ 69,0; 92,0 ] | 80,5 [ 68; 90 ] | ns |
Глюкоза, ммоль/л | 5,3 [ 5,0; 5,7 ] | 5,5 [ 5,0; 6,0 ] | ns |
Примечание. ns: not significant, не значимо.
Note. ns: not significant.
За время терапии наблюдалось статистически значимое снижение ХС-ЛПНП, из всей группы пациентов 40 (43%) достигли целевого уровня ХС-ЛПНП через 3 мес. терапии алирокумабом (6 инъекций).
Среди подгруппы пациентов, закончивших 6-мес. курс лечения, также наблюдалось статистически значимое снижение ХС-ЛПНП через 3 месяца лечения (исходно 2,80 [ 2,29; 3,55] ммоль/л, через 3 мес. 1,63 [ 1,20; 2,25] ммоль/л, р < 0,0001) и дальнейшее снижение еще через 3 мес. до 1,37 [ 1,10; 1,93] ммоль/л. Медиана снижения уровня ХС-ЛПНП через 3 мес. составила –47% [–25; –65]. Разница уровней ХС-ЛПНП между 6 и 3 мес. лечения была близка к статистически значимому уровню (р = 0,083). Целевого уровня ХС-ЛПНП в этой подгруппе достигли 16 (36%) пациентов к окончанию 3 мес. лечения и еще 7 (16%) пациентов — к 6 мес. лечения.
Наблюдалась положительная динамика уровня ХС-ЛПВП: к окончанию 3 мес. лечения их уровень статистически значимо повышался. Концентрация ЛП(а) исходно определена у 40 пациентов и составила 106,5 [ 65,5; 159,0] мг/дл, превышение уровня 30 мг/дл отмечено у 39 (98%) пациентов. Повторно, через 3 мес., уровень ЛП(а) измерен у 21 пациента (табл. 2). Через 3 мес. лечения алирокумабом отмечалось статистически значимое снижение ЛП(а), медиана снижения составила 20% [–27,5; –14,1]. Уровень ЛП (а) <30 мг/дл через 3 мес. лечения достигнут у 2 (10%) пациентов.
Показатели печеночных функциональных тестов: АЛТ, АСТ и общего билирубина существенно не изменялись на фоне трехмесячного курса терапии. Не было отмечено также изменения уровня креатинина и гликемии натощак.
У пациента после ортотопической трансплантации печени с крайне высоким сердечно-сосудистым риском наблюдался 2b тип дислипидемии по Фредриксону с повышением уровня ХС-ЛПНП до 3,66 ммоль/л и триглицеридов. Терапия алирокумабом проводилась на фоне применения такролимуса, циклоспорина и энтекавира. Через 3 мес терапии уровень ХС-ЛПНП снизился более чем на 73% и достиг 0,97 ммоль/л.
Терапия алирокумабом переносилась хорошо, побочные эффекты и нежелательные явления не зафиксированы.
ОБСУЖДЕНИЕ
Недавнее появление на фармацевтическом рынке нового класса липидснижающих лекарственных средств — ингибиторов PCSK9 позволило достичь значительных успехов в лечении больных атерогенной дислипидемией с неэффективностью либо непереносимостью статинов.
Применение алирокумаба в реальной клинической практике продемонстрировало убедительную эффективность в снижении уровня ХС-ЛПНП у пациентов с атерогенной дислипидемией. Принимая во внимание, что в исследование включались пациенты с отсутствием достижения целевых уровней липидов на максимальной дозе статинов и эзетимиба, можно говорить о клинически значимой эффективности алирокумаба в лечении дислипидемии; дополнительно к этому алирокумаб снижал уровень ЛП(а).
Медиана снижения ХС-ЛПНП составляла –47% через 3 мес. лечения, что несколько меньше по сравнению с исследованием ODYSSEY [12], где через 4 мес. уровень ХС-ЛПНП снижался по сравнению с плацебо на 62,7%.
В нашей работе за время наблюдения медиана снижения ЛП(а) составила 20% от исходного, что аналогично данным регистрационного исследования ODYSSEY [12], в рамках которого снижение этого показателя достигало 21,9%.
Несмотря на ограниченность клинического опыта, можно с осторожностью говорить об эффективности алирокумаба при терапии резистентной смешанной гиперхолестеринемии у группы пациентов, находящихся на постоянной иммуносупрессии после ортотопической трансплантации печени при наличии у них коморбидной сердечно-сосудистой патологии. С учетом отсутствия достижения целевых значений атерогенных липидов у данной группы пациентов на терапии ограниченным спектром статинов использование ингибиторов PCSK9 может быть единственно возможным фармакологическим ресурсом для достижения целевых уровней атерогенных липидов и предотвращения сердечно-сосудистых катастроф у этих пациентов в будущем.
Терапия алирокумабом хорошо переносилась; не было отмечено ни одного из побочных явлений, указанных в инструкции по использованию препарата. Ранее проведенные исследования продемонстрировали положительные эффекты ингибиторов PCSK9 на биохимическую картину у пациентов с НАЖБП, вне зависимости от влияния на уровень ЛПНП и течение сердечно-сосудистой патологии. Высокие как циркулирующие, так и внутрипеченочные уровни PCSK9 увеличивают депонирование липидов в мышцах и печени, тем самым внося свой вклад в патогенез НАЖБП. Результаты исследований на животных и людях, направленных на подавление PCSK9, указывают на регресс стеатоза посредством индукции деградации печеночного белка HNF1 и преодоления инсулинорезистентности [13]. В нашей работе, несмотря на обширный спектр коморбидности у большинства больных, на фоне терапии алирокумабом ни у одного из них не отмечено значимого роста трансаминаз. Влияние на этот показатель у большей части пациентов было либо нейтральным, либо позитивным. Этот факт подтверждает не только безопасность, но и весьма вероятные патогенетические терапевтические эффекты алирокумаба на процессы повреждения печеночных клеток, требующие дальнейшего изучения.
Наше исследование имеет очевидные ограничения, обусловленные в первую очередь отсутствием группы сравнения и рандомизации пациентов. Тем не менее оно может быть полезным для практикующих врачей, имеющих дело с резистентной к статинам атерогенной дислипидемией. Представляет интерес планирование исследований, позволяющих оценить эффективность и безопасность алирокумаба у отдельных категорий больных, в частности с хронической патологией печени и разной степенью нарушения ее функции.
ЗАКЛЮЧЕНИЕ
В реальной клинической практике результаты лечения алирокумабом оказались сходными с регистрационными исследованиями. Через 3 и 6 мес. лечения наблюдалось снижение уровня ХС-ЛПНП, целевые уровни достигнуты у 36–43 и 52% пациентов соответственно; также отмечено снижение уровня ЛП(а) на 20%, повышение ХС-ЛПВП. Показатели АЛТ, АСТ, общего билирубина, креатинина и гликемии натощак значимо не менялись. Побочные эффекты и нежелательные явления не зафиксированы.
ВКЛАД АВТОРОВ
А.О. Буеверов предложил основную концепцию и разработал дизайн исследования, контролировал его проведение, принимал участие в написании статьи. П.О. Богомолов подал идею исследования, принимал участие в разработке дизайна. А.А. Кучеров провел набор пациентов, их лечение, принимал участие в написании статьи. В.Е. Сюткин статистически обработал результаты исследования. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Alexey O. Bueverov proposed the main concept and developed the design of the study, supervised its conduct, took a part in writing the article. Pavel O. Bogomolov filed an idea of research, participated in the design of the design. Alexey A. Kucherov held a set of patients, their treatment, took a part in writing the article. Vladimir E. Syutkin statistically processed the results of the study. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Пациенты получали терапию за счет средств Фонда обязательного медицинского страхования.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. Patients received therapy at the expense of the Mandatory Health Insurance Fund.
Список литературы
1. Stols-Gonçalves D., Hovingh G.K., Nieuwdorp M., Holleboom A.G. NAFLD and atherosclerosis: two sides of the same dysmetabolic coin? Trends Endocrinol Metab. 2019 Dec; 30(12): 891–902. https://doi.org/10.1016/j.tem.2019.08.008 PMID: 31630897
2. Assis D.N. Chronic complications of cholestasis: evaluation and management. Clin Liver Dis. 2018; 22(3): 533–44. https://doi.org/10.1016/j.cld.2018.03.014 PMID: 30259851
3. Hüsing A., Kabar I., Schmidt H.H. Lipids in liver transplant recipients. World J Gastroenterol. 2016; 22(12): 3315–24. https://doi.org/10.3748/wjg.v22.i12.3315 PMID: 27022213
4. Madhwal S., Atreja A., Albeldawi M., et al. Is liver transplantation a risk factor for cardiovascular disease? A meta-analysis of observational studies. Liver Transpl. 2012; 18: 1140–6. https://doi. org/10.1002/lt.23508 PMID: 22821899. Erratum in: Liver Transpl. 2013 Jan; 19(1): 113. Albeldawdi, Mazen [corrected to Albeldawi, Mazen]. https://doi.org/10.1002/lt.23594 PMID: 22821899
5. Balmer M.L., Dufour J.F. Treatment of hypercholesterolemia in patients with primary biliary cirrhosis might be more beneficial than indicated. Swiss Med Wkly. 2008 Jul 26; 138(29–30): 415–9. PMID: 18654866
6. Burman B.E., Jhaveri M.A., Kowdley K.V. An update on the treatment and follow-up of patients with primary biliary cholangitis. Clin Liver Dis. 2017; 21(4): 709–23. https://doi.org/10.1016/j.cld.2017.06.005 PMID: 28987258
7. Roth E.M., Davidson M.H. PCSK9 inhibitors: mechanism of action, efficacy, and safety. Rev Cardiovasc Med. 2018; 19(S1): S31–46. PMID: 30207556
8. Tomlinson B., Hu M., Zhang Y., et al. Alirocumab for the treatment of hypercholesterolemia. Expert Opin Biol Ther. 2017; 17(5): 633–43. https://doi.org/10.1080/14712598.2017.1305354 PMID: 28277798
9. Steg P.G., Szarek M., Bhatt D.L., et al. Effect of alirocumab on mortality after acute coronary syndromes. Circulation. 2019; 140(2): 103–12. https://doi.org/10.1161/CIRCULATIONAHA.118.038840 PMID: 31117810
10. Leiter L.A., Tinahones F.J., Karalis D.G., et al. Alirocumab safety in people with and without diabetes mellitus: pooled data from 14 ODYSSEY trials. Diabet Med. 2018; 35(12): 1742–51. https://doi.org/10.1111/dme.13817 PMID: 30183102
11. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. European Heart Journal. 2020; 41: 111–88. https://doi.org/10.1093/eurheartj/ehz455 PMID: 31591002
12. Stroes E., Guyton J.R., Lepor N., et al. Efficacy and safety of alirocumab 150 mg every 4 weeks in patients with hypercholesterolemia not on statin therapy: the ODYSSEY CHOICE II study. J Am Heart Assoc. 2016 Sep 13; 5(9). PII: e003421. https://doi.org/10.1161/JAHA.116.003421 PMID: 27625344
13. Theocharidou E., Papademetriou M., Reklou A., et al. The role of PCSK9 in the pathogenesis of non-alcoholic fatty liver disease and the effect of PCSK9 inhibitors. Curr Pharm Des. 2018; 24(31): 3654–7. https://doi.org/10.2174/1381612824666181010123127 PMID: 30317984
Об авторах
А. О. БуеверовРоссия
Буеверов Алексей Олегович, д-р мед. наук, профессор, ведущий научный сотрудник отделения гепатологии; заместитель председателя правления
ул. Щепкина, д. 61/2, корп. 1, г. Москва, 129110
ул. Большая Академическая, д. 39, г. Москва, 125008
+7 (916) 678-43-94
П. О. Богомолов
Россия
Богомолов Павел Олегович, канд. мед. наук, научный руководитель отделения гепатологии; председатель правления
ул. Щепкина, д. 61/2, корп. 1, г. Москва, 129110
ул. Большая Академическая, д. 39, г. Москва, 125008
А. А. Кучеров
Россия
Кучеров Алексей Алексеевич, заведующий отделением кардиологии клиники
ул. Большая Академическая, д. 39, г. Москва, 125008
В. Е. Сюткин
Россия
Сюткин Владимир Евгеньевич, д-р мед. наук, ведущий научный сотрудник отделения трансплантации печени
Большая Сухаревская пл., д. 3, г. Москва,129090







































