Перейти к:
Ретроспективное когортное исследование патоморфологических особенностей рецидивных шванном и нейрофибром
https://doi.org/10.47093/2218-7332.2021.12.4.29-38
Аннотация
Рецидивы доброкачественных опухолей оболочек периферических нервов (ООПН) после тотальной резекции описаны у 2,6–11,0% пациентов. Значение гистологических особенностей рецидивирующих ООПН изучено недостаточно.
Цель исследования: сравнить патоморфологические особенности рецидивирующих и не рецидивирующих доброкачественных ООПН (шванном и нейрофибром).
Материалы и методы. Ретроспективно оценен 101 пациент с доброкачественными ООПН со степенью анаплазии, соответствующей не более Grade I. Рецидив ООПН развился у 13 (12,9%) человек. В исследование включены пациенты, имевшие гистологический архив: в группу исследования (n = 7) вошли пациенты с одним и более рецидивом ООПН, в группу контроля – пациенты (n = 5), не имевшие рецидивов после оперативного вмешательства в течение 5 и более лет. Изучали основные клинические характеристики и проводили гистологическое исследование.
Результаты. По исходным характеристикам: тип опухоли (шваннома, нейрофиброма), распределение по полу, возрасту, локализации, клиническим симптомам различий между группами не выявлено. Количество рецидивов среди пациентов с нейрофибромами: 8 у 3 пациентов vs. 6 у 5 пациентов со шванномами. Во всех случаях рецидивных шванном и в одной нейрофиброме гистологический паттерн был преимущественно монофазным с ритмичными структурами по типу телец Верокаи с подчеркнутым рисунком и гиперхроматозом ядер, в отличие от группы контроля, представленной опухолями со смешанным типом строения с равномерным чередованием различных гистологических паттернов (р < 0,05). Пролиферация эндотелия и лимфоцитарная инфильтрация в строме и располагающаяся периваскулярно наблюдались чаще в группе с рецидивами (р < 0,05). Патоморфологические признаки анаплазии: клеточно-ядерный полиморфизм, гиперхромия ядер, пролиферация эндотелия, митозы, а также малые признаки анаплазии: солидизация, муаризация фасцикулярного рисунка опухоли и апоптозные тельца встречались с одинаковой частотой в обеих группах. При рецидивировании наблюдалась потеря капсулы, ее истончение, прерывистость, иногда инвазия в окружающие ткани.
Заключение. Среди рецидивирующих доброкачественных ООПН преимущественно встречаются опухоли с начальными признаками анаплазии: пролиферацией эндотелия, тенденцией к гиперцеллюлярности и гистологический паттерн с подчеркнутыми тельцами Верокаи.
Ключевые слова
Список сокращений:
ООПН – опухоли оболочек периферических нервов
Шванномы – наиболее распространенные опухоли оболочек периферических нервов (ООПН) – составляют около 5% всех опухолей мягких тканей, ассоциированы с нейрофиброматозом 2-го типа и шванноматозом, характеризуются медленным ростом (0–3,9 мм в год), доброкачественным течением без тенденции к малигнизации и рецидивированию [1].
Нейрофибромы – вторые по частоте встречаемости доброкачественные опухоли мягких тканей (4–5%), ассоциированы с болезнью Реклингхаузена (нейрофиброматозом 1-го типа) и, в отличие от шванном, могут быть не инкапсулированы, также среди них выделяют атипичную форму с неизвестным биологическим потенциалом (Grade II).
Следует отметить отсутствие четких критериев градирования данных новообразований в рамках действующей классификации Всемирной организации здравоохранения (ВОЗ) от 2016 года [2]. В последние годы меняется отношение к степени злокачественности ООПН. Так, для меланотических шванном – опухолей, ранее считавшихся доброкачественными (Grade I), – появились исследования, продемонстрировавшие неблагоприятное клиническое течение, что обуславливает необходимость их отнесения к злокачественным меланотическим опухолям оболочек периферических нервов [3–5].
Для первичной диагностики ООПН используют методы нейровизуализации, однако достоверный дифференциальный диагноз возможен только при гистологической верификации опухоли [6–8].
Полное излечение шванном и нейрофибром достигается тотальной хирургической резекцией в виде интраневральной диссекции и энуклеации опухоли [9]. Несмотря на доброкачественность данных новообразований, в литературе описаны случаи рецидивов; так, после тотальной резекции рецидивы шванном развиваются у каждого 10-го пациента, а после субтотальной резекции – у каждого третьего. Выживаемость без прогрессирования после стереотаксической радиохирургии, по данным M. J. Huang, составляет 97% через 3 года, 95% через 5 лет и 90% через 10 лет [1].
Считается, что чаще рецидивируют многоузловые плексиформные опухоли, ассоциированные с семейными синдромами, трункальные (в средостении, забрюшинном пространстве, внутренних органах). Плексиформные нейрофибромы в 5% эволюционируют в злокачественную опухоль оболочек периферического нерва. Малигнизация не характерна для шванном, однако описаны редкие случаи их трансформации в злокачественную опухоль периферического нерва, в круглоклеточную мелкоклеточную опухоль и в ангиосаркому [10][11].
На настоящий момент остается неясной роль гистологических паттернов и малых признаков анаплазии (наличия апоптозных телец, тенденции к солидизации) доброкачественных ООПН в качестве прогностических факторов риска их рецидивов.
Цель исследования: сравнить патоморфологические особенности рецидивирующих и не рецидивирующих доброкачественных ООПН (шванном и нейрофибром).
МАТЕРИАЛЫ И МЕТОДЫ
Исследование одобрено этическим комитетом ФГБУ «НМИЦ им. В.А. Алмазова», Санкт-Петербург: выписка № 07122019 заседания № 12-19 от 09.12.2019 Г.
Ретроспективно изучен операционный гистологический материал пациентов 18 лет и старше, страдавших шванномами или нейрофибромами со степенью анаплазии, соответствующей не более Grade I и получавших хирургическое лечение в объеме тотального микрохирургического удаления опухоли в РНХИ им. проф. А.Л. Поленова (филиал НМИЦ им. В.А. Алмазова) в период с 1 января 2009 по 31 декабря 2019 года.
Критерии включения в группу исследования: один и более рецидив ООПН; наличие гистологического материала при первом удалении опухоли и минимум во время первого рецидива. В группу контроля включались пациенты с наличием гистологического материала при удалении опухоли и не имевшие рецидивов после оперативного вмешательства в течение 5 и более лет.
Для участия в исследовании был оценен 101 пациент, из которых рецидив развился у 13 (12,9%). У 6 из них отсутствовал гистологический архив. Таким образом, в группу исследования включены 7 пациентов (5 женщин и 2 мужчин в возрасте от 23 до 59 лет) с 13 рецидивами. Проанализирован гистологический материал от 13 оперативных вмешательств, находившийся в архиве РНХИ им. Поленова или предоставленный из других учреждений.
В группу контроля вошли 5 пациентов (4 женщины и 1 мужчина) в возрасте от 20 до 57 лет, гистологический материал которых был доступен для проведения исследования.
Операционный материал удаленных фрагментов тканей был фиксирован в 10% забуференном формалине, проведен по стандартной проводке по спиртам возрастающей концентрации, залит в парафин.
Изучали основные клинические характеристики и проводили гистологическое исследование. Срезы окрашивали гематоксилином и эозином, для оценки соединительнотканного компонента (фибропластика) проводилась окраска по Ван-Гизону, мукоидной дегенерации – альциановым синим. Гистологическая оценка включала в себя следующие признаки: тканевой рисунок опухоли (классический/неклассический гистотип, гистологические паттерны), признаки анаплазии (клеточно-ядерный полиморфизм, митозы, некроз, пролиферация эндотелия, гиперхромия ядер, отсутствие капсулы), малые признаки анаплазии (апоптозные тельца, солидизация), нарушения кровообращения (тромбоз, кровоизлияния), состояние стромы (фиброз, дезорганизация), выраженность лимфоцитарной инфильтрации, наличие дополнительных (окружающих опухоль) тканей.
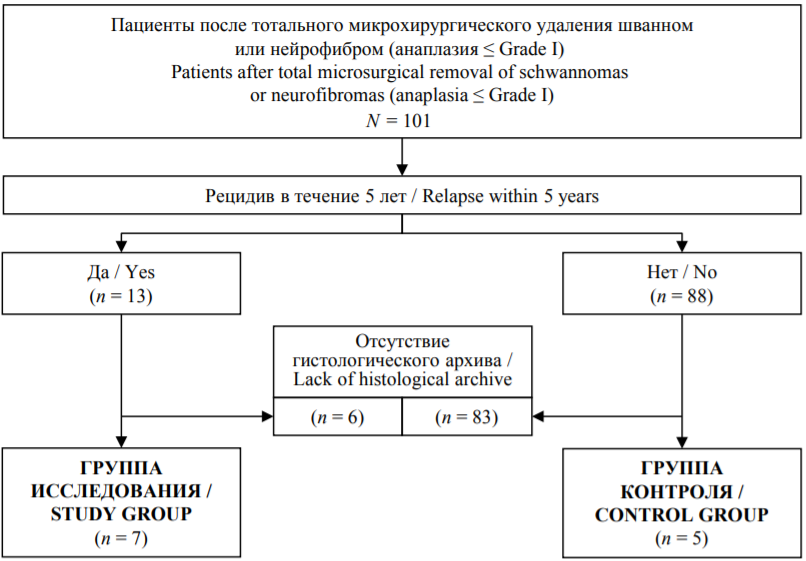
РИС. 1. Потоковая диаграмма включения пациентов в исследование.
FIG. 1. Flowchart of patient inclusion in the study.
Статистический анализ
Количественные показатели представлены в виде медианы и интерквартильного размаха (25–75-й процентили). Качественные параметры представлены в виде абсолютных значений. Для сравнения количественных данных использовался критерий Манна – Уитни, качественных – точный критерий Фишера. Различия считались статистически значимыми при p < 0,05. Статистическую обработку данных проводили с помощью Microsoft Office Excel 2016 (Microsoft, США).
РЕЗУЛЬТАТЫ
Общие характеристики пациентов
В соответствии с классификацией опухолей центральной нервной системы ВОЗ (2016 г.) выбранные для исследования доброкачественные рецидивные ООПН были представлены следующими гистотипами: в группе исследования – шванномой (n = 4) и нейрофибромой (n = 3), в группе контроля – шванномой (n = 2) и нейрофибромой (n = 3) (табл. 1, 2). Отношение женщины:мужчины для шванном составило 1:1, для нейрофибром – 6:0.
Таблица 1. Исходные характеристики пациентов группы исследования и группы контроля
Table 1. Baseline characteristics of patients in the study and control groups
|
Характеристика / Characteristic |
Группа исследования / Study group (n = 7) |
Группа контроля / Control group (n = 5) |
Значение р / р value |
|
Мужчины / Male, n |
2 |
1 |
n.s. |
|
Женщины / Female, n |
5 |
4 |
n.s. |
|
Возраст, годы, медиана и ИКР / Age, years, median and IQR |
44 [ 25; 53 ] |
35 [ 22; 54 ] |
n.s. |
|
Шванномы / Schwannomas, n |
4 |
2 |
n.s. |
|
Нейрофибромы / Neurofibromas, n |
3 |
3 |
n.s. |
|
Локализация / Localization |
|||
|
корешки шейного отдела спинного мозга / roots of the cervical spinal cord, n |
2 |
1 |
n.s. |
|
конский хвост / cauda equina, n |
- |
1 |
n.s. |
|
плечевое сплетение / brachial plexus, n |
1 |
n.s. |
|
|
нервы нижней конечности / lower limb nerves, n |
3 |
3 |
n.s. |
|
Клинические симптомы / Clinical symptoms |
|||
|
боль / pain, n |
5 |
2 |
n.s. |
|
снижение чувствительности/ decreased sensitivity, n |
1 |
- |
n.s. |
|
парез / paresis (1–3 балла), n |
1 |
3 |
n.s. |
|
Нейрофиброматоз / Neurofibromatosis, n |
1 |
- |
n.s. |
Note: IQR – Interquartile range; n.s. – non significant.
Таблица 2. Число рецидивов и время между дебютом и рецидивом, а также последующими рецидивами в группе исследования
Table 2. Relapse rate and time between onset and relapse, as well as subsequent relapses in the study group
|
№ пациента / patient № |
Опухоль / Tumor |
Число рецидивов / Relapse rate |
Длительность, мес. / Duration, mo |
||
|
дебют → рецидив 1 / onset → relapse 1 |
pецидив 1 → рецидив 2 / relapse 1 → relapse 2 |
pецидив 2 → рецидив 3 / relapse 2 → relapse 3 |
|||
|
1 |
Шваннома / Schwannoma |
2 |
72 |
96 |
|
|
2 |
Шваннома / Schwannoma |
1 |
9 |
||
|
3 |
Шваннома / Schwannoma |
1 |
12 |
||
|
4 |
Шваннома / Schwannoma |
1 |
10 |
||
|
5 |
Нейрофиброма / Neurofibroma |
1 |
43 |
||
|
6a |
Нейрофиброма / Neurofibroma |
1 |
300 |
||
|
6b |
Нейрофиброма / Neurofibroma |
3 |
60 |
36 |
8 |
|
7 |
Нейрофиброма / Neurofibroma |
3 |
9 |
4 |
7 |
Note: a – brachial plexus, b – lower limb nerves.
Опухоли демонстрировали билатеральное расположение без предпочтения к нервам сплетений верхних или нижних конечностей. Множественные нейрофибромы диагностированы в группе исследования у одной пациентки с болезнью Реклингхаузена.
Клинически новообразования манифестировали иррадиирующей болью, частично купируемой нестероидными противовоспалительными средствами, нарушением чувствительности кожи в проекции опухолевой локализации, парезом конечности.
Наибольшее количество рецидивов отмечалось среди пациентов с нейрофибромами: 8 рецидивов у 3 пациентов vs. 6 рецидивов у 5 пациентов со шванномами. У пациентки с болезнью Реклингхаузена (№ 6) зарегистрировано 4 рецидива: 1 в области плечевого сплетения и 3 в пояснично-крестцовом сплетении (табл. 2).
Время между дебютом и первым рецидивом составило 27,50 [ 9,75; 63,00 ] мес., у двух пациентов (6b и 7) второй рецидив развивался в течение меньшего промежутка времени, чем первый.
Микроскопические особенности опухолей
В изученных шванномах с рецидивами отмечалась тенденция к превалированию неклассических гистотипов по сравнению с группой сравнения, которую составил только классический фенотип, среди нейрофибром группы были идентичны по гистотипам (табл. 3).
Таблица 3. Сравнительная характеристика патоморфологических признаков опухолей в группе исследования и контроля во время дебюта заболевания
Table 3. Comparative characteristics of the pathomorphological signs of tumours in the study and control groups at the onset of the disease
|
Характеристика / Characteristic |
Группа исследования / Study group (n = 7) |
Группа контроля / Control group (n = 5) |
Значение р / р value |
|
Не классический гистотип шванном / Non-classical schwannoma histotype, n |
3 из 4 |
0 из 2 |
n.s. |
|
Не классический гистотип нейрофибром / Non-classical neurofibroma histotype, n |
1 из 3 |
1 из 3 |
n.s. |
|
Гистологический паттерн: тельца Верокаи с подчеркнутым рисунком |
5 |
- |
< 0,05 |
|
Признаки анаплазии / Signs of anaplasia: |
|||
|
выраженный клеточно-ядерный полиморфизм / |
6 |
2 |
n.s. |
|
митозы / mitosis, n |
1 |
- |
n.s. |
|
пролиферация эндотелия / endothelial proliferation, n |
5 |
- |
<0,05 |
|
гиперхромия ядер / nuclear hyperchromasia, n |
5 |
1 |
n.s. |
|
гиперцеллюлярность / hypercellularity, n |
6 |
1 |
n.s. |
|
отсутствие капсулы / lack of capsule, n |
2 |
1 |
n.s. |
|
Малые признаки анаплазии / Minor signs of anaplasia |
|||
|
солидизация, муаризация фасцикулярного рисунка опухоли / |
3 |
- |
n.s. |
|
апоптозные тельца / apoptosis, n |
3 |
- |
n.s. |
|
Нарушения кровообращения / Circulatory disorders |
|||
|
кровоизлияния (свежие) / hemorrhages (recent), n |
7 |
3 |
n.s. |
|
гемосидерин / hemosiderin, n |
5 |
1 |
n.s. |
|
Состояние стромы / state of stroma |
|||
|
фибропластика / fibroplasty, n |
7 |
5 |
n.s. |
|
мукоидная дегенерация / mucoid degeneration, n |
4 |
2 |
n.s. |
|
лимфоцитарная инфильтрация (в строме / периваскулярно) / |
7 |
1 |
<0,05 |
|
гиалиноз сосудов / vascular hyalinosis, n |
7 |
4 |
n.s. |
|
Дополнительные ткани (жир/мышцы) / |
4 |
- |
n.s. |
Note: n.s. – non significant.
Во всех случаях рецидивных шванном и в одной нейрофиброме гистологический паттерн был преимущественно монофазным и представлен ритмичными структурами по типу телец Верокаи с подчеркнутым рисунком и гиперхроматозом ядер (рис. 2), в отличие от группы контроля, представленной опухолями со смешанным типом строения с равномерным чередованием различных гистологических паттернов (р < 0,05).
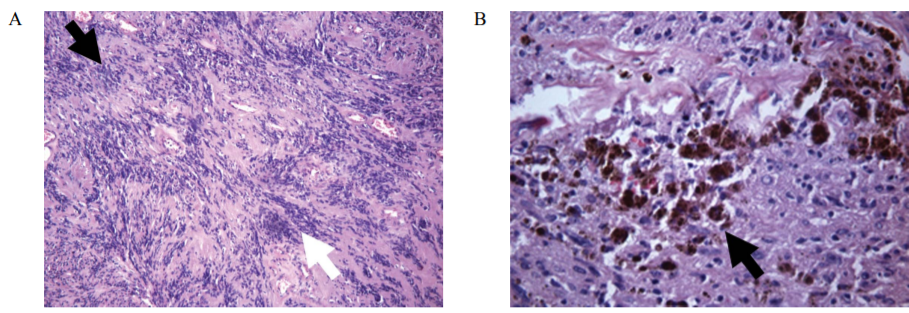
РИС. 2. Гистологические особенности рецидивных доброкачественных опухолей периферических нервов.
Окраска гематоксилином и эозином. Увеличение ×200.
А – выраженные тельца Верокаи (черная стрелка) и гиперхроматоз ядер (белая стрелка) в шванноме.
В – гемосидерин в шванноме (черная стрелка).
FIG. 2. Histological features of recurrent benign peripheral nerve tumours.
Staining with hematoxylin and eosin. Magnification ×200.
А – prominent Verocay bodies (black arrow) and nuclear hyperchromasia (white arrow) in schwannomas.
В – hemosiderin in schwannoma (black arrow).
Такие классические патоморфологические признаки анаплазии, как клеточно-ядерный полиморфизм, гиперхромия ядер, пролиферация эндотелия, митозы, а также малые признаки анаплазии: солидизация, муаризация фасцикулярного рисунка опухоли и апоптозные тельца, встречались с одинаковой частотой в обеих группах. Пролиферация эндотелия наблюдалась статистически значимо чаще в группе с рецидивами (р < 0,05). Гиперцеллюлярность отмечалась у 6 из 7 пациентов в группе исследования и у 1 из 5 в группе контроля (р = 0,072).
У одного пациента из группы исследования со шванномой изначально солидная опухоль во время третьего рецидива была представлена множественными узлами, что не исключает нарастания анаплазии новообразования.
Нарушение кровообращения в виде давних кровоизлияний (гемосидерин) встречалось с одинаковой частотой в обеих группах.
В образованиях из группы исследования, имеющих капсулу, при последующем рецидивировании наблюдалась потеря капсулы, ее истончение, прерывистость, иногда с инвазией в окружающие ткани; в 1 плексиформной шванноме в 1 случае нейрофибромы капсулы не было изначально, во время рецидива капсула отсутствовала у 5 пациентов (p < 0,05).
Изменения стромы опухоли в виде мукоидной дегенерации (отека), выявляющейся при окраске альциановым синим, и выраженная фибропластика стромы при окраске по Ван Гизону наблюдались примерно с одинаковой частотой в обеих группах. Лимфоцитарная инфильтрация в строме и располагающаяся периваскулярно выявлялась статистически значимо чаще в группе с рецидивами (р < 0,05).
В 4 наблюдениях из группы исследования обнаруживались дополнительные ткани в виде скелетных мышц и жира, которые попадали при удалении образований в связи с интимным прилеганием к опухоли. В 1 случае плексиформной нейрофибромы (без нейрофиброматоза) С7 плечевого сплетения гигантского размера (диаметром 12 см) отмечался крайне агрессивный характер роста: инвазия в позвоночную артерию с ее вторичным тромбозом, распространение в скелетные мышцы плеча и шеи, в позвоночный канал до твердой мозговой оболочки.
ОБСУЖДЕНИЕ
По данным нашего исследования, частота рецидивов в когорте пациентов с доброкачественными ООПН составила 12,9%, что согласуется с данными зарубежных исследований. Так, в работе группы ученых во главе с M.J. Huang [1] частота рецидивирования шванном после тотальной резекции составила 2,6–11,0%. По РФ подобные данные относительно доброкачественных ООПН ранее не предоставлялись.
Результаты нашего исследования показывают, что следует обращать внимание даже на одиночные признаки анаплазии в доброкачественных опухолях периферических нервов при оценке нарастания анаплазии рецидивирующих ООПН: пролиферацию эндотелия, а также на лимфоцитарную инфильтрацию, как периваскулярную, так и очаговую в строме опухоли, данные изменения ассоциированы с развитием рецидивов доброкачественных ООПН. Дополнительно обращает на себя внимание признак гиперцеллюлярности, имевший значение р близкое к принятому уровню значимости.
Более того, мы предлагаем обращать внимание на малые признаки анаплазии (тенденция к солидизации, муаризации фасцикулярного рисунка опухоли, апоптозные тельца), которые самостоятельно не имели статистически значимых отличий в группах с рецидивами и без таковых. Однако эти признаки могут настораживать патолога в поиске других признаков анаплазии и могут косвенно указывать на риск малигнизации. Подобные ассоциации описаны в литературе относительно эпителиальных опухолей (например, медуллярного рака щитовидной железы, плоскоклеточных карцином), атипичных менингиом; для шванном и нейрофибром на настоящий момент однозначных данных по этому вопросу нет [12, 13].
По классификации ВОЗ 2016 года классическими признаками анаплазии в злокачественных опухолях периферических нервов являются: наличие местных рецидивов, отсутствие перитуморозной капсулы, инвазия в окружающие ткани, рассеянные митотические фигуры и пролиферативная активность (более 10 митозов на 10 полей зрения или более 4 митозов на поле зрения при большом увеличении), наличие палисадных некрозов, гиперцеллюлярность, мономорфная цитология, цитологическая атипия (макронуклеолы, гиперхромазия) как проявления нарастания анаплазии новообразования и, соответственно, худший прогноз, особенно у пациентов с нейрофиброматозом, однако четких критериев градирования в классификации 2016 года нет и значение признаков анаплазии в доброкачественных опухолях не определено [14].
По литературным данным, паттерн с выраженными ритмичными структурами (Верокаи) не отражает ухудшение прогноза для пациента [15], однако при оценке рисунка опухоли в шванномах с рецидивами в наших наблюдениях были замечены фокусы с повышенным количеством телец Верокаи в сочетании с гиперхроматозом ядер.
По нашим наблюдениям выраженность фибропластики и мукоидной дегенерации стромы опухоли в обеих группах была сопоставима, что отражает изменение микроокружения опухоли. Следует отметить, что необходимо дальнейшее более детальное исследование данных изменений и их значения при рецидивировании шванном и нейрофибром.
Если говорить о состоянии стромы опухоли, то следует вспомнить гипотезу “seed and soil” («семени и почвы») Джеймса Педжета, опубликованную в журнале Lancet в 1889 г. и затем дополненную Лейденом в теорию «преметастической ниши», сущность которой сводится к следующему: в эволюции опухоли важную роль играет опухолевое микроокружение, представленное внеклеточным матриксом, большим количеством гетерогенных неопухолевых клеток (макрофагов, фибробластов и др.), которые воспринимают выделяемые опухолевыми клетками цитокины, медиаторы и хемоаттрактанты и ремоделируют внеклеточный матрикс тканей, делая его более «жестким», чтобы опухолевые клетки прикрепляясь к каркасу, например коллагеновому/фиброзному, и эксцентрично распространялись, либо делая матрикс менее плотным/миксоматозным, подготавливая «почву» для будущей имплантации опухолевых клеток в еще не пораженные ткани, что необходимо как для местного распространения опухоли, так и для органоспецифического метастазирования при последующей малигнизации [16–21].
Традиционно к признакам малигнизации относят отсутствие соединительно-тканной капсулы, четко очерчивающей новообразование от окружающих здоровых тканей [14]. В наших наблюдениях в части шванном и нейрофибром отмечалась тенденция к истончению, прерывистости и участкам потери капсулы при рецидивировании, что может быть связано с биологической прогрессией опухоли и с более интимным прилеганием, а возможно, и частичной инвазией в окружающие ткани, что интраоперационно вынуждало нейрохирургов удалять фрагменты поперечнополосатых мышц и жира.
К ограничениям исследования следует отнести ретроспективный дизайн и небольшое число пациентов в группах. Из-за крайней редкости рецидивных ООПН представляется очень сложным проведение широкомасштабных исследований без создания единого регистра таких пациентов. Полученные в исследовании данные могут использоваться для планирования будущих исследований, в том числе с целью разработки персонализированного подхода к лечению и наблюдению, основанного на патоморфологических особенностях опухоли.
ЗАКЛЮЧЕНИЕ
В представленной когорте пациентов частота рецидивирования ООПН составила 12,9%. Биологический потенциал опухоли находит отражение в ее морфологических характеристиках. Так, среди рецидивирующих доброкачественных ООПН преимущественно встречаются опухоли с начальными признаками анаплазии: пролиферацией эндотелия, тенденцией к гиперцеллюлярности и гистологический паттерн с подчеркнутыми тельцами Верокаи. Во время рецидива отмечается тенденция к истончению, прерывности и потере капсулы.
ВКЛАД АВТОРОВ
Д.А. Мурзаева внесла основной вклад в разработку концепции статьи, дизайн исследования, проанализировала данные, написала текст. Ю.М. Забродская и А.Ю. Орлов внесли значительный вклад в разработку концепции статьи, дизайн исследования, провели критический пересмотр рукописи с внесением ценного интеллектуального содержания. А.А. Долгушин изучал и анализировал литературу, собирал и анализировал данные, осуществлял статистическую обработку. Л.Н. Доброгорская участвовала в сборе данных и подготовила материалы для публикации. Все авторы одобрили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Dzhamilya A. Murzaeva made a major contribution to the concept and design of the article, analyzed the data, wrote the text. Yulia M. Zabrodskaya and Andrey Y. Orlov made a significant contribution to the concept and design of the article, made critical revisions of the manuscript for important intellectual content. Artem A. Dolgushin studied and analyzed the literature, participated in the acquisition and interpretation of data, provided statistical analysis. Lyubov N. Dobrogorskaya participated in the acquisition of data and prepared materials for publication. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование было выполнено в рамках государственного задания № 056-00109-21-01(34).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was carried out within the framework of state assignment No. 056-00109-21-01 (34).
Список литературы
1. Huang M.J., Kano H., Mousavi S.H., et al. Stereotactic radiosurgery for recurrent vestibular schwannoma after previous resection. J Neurosurg. 2017; May; 126(5): 1506–1513. https://doi.org/10.3171/2016.5.JNS1645. Epub 2016 Jul 29. PMID: 27471891.
2. Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016 Jun; 131(6): 803–820. https://doi.org/10.1007/s00401-016-1545-1. Epub 2016 May 9. PMID: 27157931.
3. Cheng X., Liu J., Le J., et al. Invasive intramedullary melanotic schwannoma: case report and review of the literature. Eur Spine J. 2018 Jul; 27(Suppl 3): 303–308. https://doi.org/10.1007/s00586-017-5207-3. Epub 2017 Jul 10. PMID: 28695275.
4. Meyer A. Review and update in the diagnosis of peripheral nerve sheath tumors. Curr Opin Neurol. 2020 Oct; 33(5): 575–586. https://doi.org/10.1097/WCO.0000000000000857. PMID: 32833749.
5. Meyer A., Billings S.D. What’s new in nerve sheath tumors. Virchows Arch. 2020 Jan; 476(1): 65–80. https://doi.org/10.1007/s00428-019-02671-0. Epub 2019 Nov 9. PMID: 31707590.
6. Garner H.W., Wilke B.K., Fritchie K., Bestic J.M. Epithelioid schwannoma: imaging findings on radiographs, MRI, and ultrasound. Skeletal Radiol. 2019 Nov; 48(11): 1815–1820. https://doi.org/10.1007/s00256-019-03199-9. Epub 2019 Mar 22. PMID: 30903261.
7. Ahlawat S., Blakeley J.O., Rodriguez F.J., Fayad L.M. Imaging biomarkers for malignant peripheral nerve sheath tumors in neurofibromatosis type 1. Neurology. 2019 Sep 10; 93(11): e1076–e1084. https://doi.org/10.1212/WNL.0000000000008092. Epub 2019 Aug 8. Erratum in: Neurology. 2020 Mar 17; 94(11): 504. PMID: 31395668.
8. Perry A., Graffeo C.S., Carlstrom L.P., et al. Is there a need for a 6-month postradiosurgery magnetic resonance imaging in the treatment of vestibular schwannoma? Neurosurgery. 2020 Feb 1; 86(2): 250–256. https://doi.org/10.1093/neuros/nyz052. PMID: 30980077.
9. Kalamarides M., Bernat I., Peyre M. Extracapsular dissection in peripheral nerve schwannoma surgery using bright light and fluorescein sodium visualization: case series. Acta Neurochir (Wien). 2019 Dec; 161(12): 2447–2452. https://doi.org/10.1007/s00701-019-04071-4. Epub 2019 Nov 2. PMID: 31679103.
10. Mahajan V., Rao S., Gupta P., et al. Angiosarcoma developing in a vagal schwannoma: A rare case report. Head Neck Pathol. 2015 Sep; 9(3): 405–411. https://doi.org/10.1007/s12105-014-0577-x. Epub 2014 Nov 5. PMID: 25371276.
11. Brown R.W., Tornos C., Evans H.L. Angiosarcoma arising from malignant schwannoma in a patient with neurofibromatosis. Cancer. 1992 Sep 1; 70(5): 1141–1144. https://doi.org/10.1002/1097-0142(19920901)70:5 < 1141::aid-cncr2820700519>3.0.co;2-q. PMID: 1515988.
12. Fuchs T.L., Nassour A.J., Glover A., et al. A proposed grading scheme for medullary thyroid carcinoma based on proliferative activity (ki-67 and mitotic count) and coagulative necrosis. Am J Surg Pathol. 2020 Oct; 44(10): 1419–1428. https://doi.org/10.1097/PAS.0000000000001505. PMID: 32452872.
13. Nambiar S., Hegde V. Apoptosis in oral epithelial dysplastic lesions and oral squamous cell carcinoma: A prognostic marker. Indian J Pathol Microbiol. 2016 Jul-Sep; 59(3): 284–286. https://doi.org/10.4103/0377-4929.188126. PMID: 27510661.
14. Prueter J., Norvell D., Backous D. Ki-67 index as a predictor of vestibular schwannoma regrowth or recurrence. J Laryngol Otol. 2019 Mar; 133(3): 205–207. https://doi.org/10.1017/S0022215119000549. PMID: 30983565.
15. Zelger B.G., Steiner H., Kutzner H., et al. Verocay body – prominent cutaneous schwannoma. Am J Dermatopathol. 1997 Jun; 19(3): 242–249. https://doi.org/10.1097/00000372-199706000-00007. PMID: 9185909.
16. Akhtar M., Haider A., Rashid S., Al-Nabet A.D.M.H. Paget’s “seed and soil” theory of cancer metastasis: An idea whose time has come. Adv Anat Pathol. 2019; Jan; 26(1): 69–74. https://doi.org/10.1097/PAP.0000000000000219. PMID: 30339548.
17. Amelot A., Terrier L.M., Mazeron J.J, et al. Timeline metastatic progression: in the wake of the “seed and soil” theory. Med Oncol. 2017 Oct 6; 34(11): 185. https://doi.org/10.1007/s12032-017-1045-8. PMID: 28986775.
18. Eble J.A., Niland S. The extracellular matrix in tumor progression and metastasis. Clin Exp Metastasis. 2019 Jun; 36(3): 171–198. https://doi.org/10.1007/s10585-019-09966-1. Epub 2019 Apr 11. PMID: 30972526.
19. Ishii G., Ochiai A., Neri S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment. Adv Drug Deliv Rev. 2016 Apr 1; 99(Pt B): 186–196. https://doi.org/10.1016/j.addr.2015.07.007. Epub 2015 Aug 14. PMID: 26278673.
20. Kuzet S.E., Gaggioli C. Fibroblast activation in cancer: when seed fertilizes soil. Cell Tissue Res. 2016 Sep; 365(3): 607–619. https://doi.org/10.1007/s00441-016-2467-x. Epub 2016 Jul 29. PMID: 27474009.
21. Liu Q., Zhang H., Jiang X., et al. Factors involved in cancer metastasis: a better understanding to “seed and soil” hypothesis. Mol Cancer. 2017 Dec 2; 16(1): 176. https://doi.org/10.1186/s12943-017-0742-4. PMID: 29197379.
Об авторах
Д. А. МурзаеваРоссия
ординатор
Тел.: +7 (929) 262-30-82
ул. Льва Толстого, д. 6–8, г. Санкт-Петербург, 197022, Россия
Ю. М. Забродская
Россия
д-р. мед. наук, профессор, руководитель НИЛ патоморфологии нервной системы; старший преподаватель кафедры патологической анатомии
ул. Маяковского, д. 12, Санкт-Петербург, 191014, Россия
ул. Академика Лебедева, д. 6, Санкт-Петербург, 194044, Россия
А. А. Долгушин
Россия
аспирант
ул. Маяковского, д. 12, Санкт-Петербург, 191014, Россия
Л. Н. Доброгорская
Россия
лаборант
ул. Маяковского, д. 12, Санкт-Петербург, 191014, Россия
А. Ю. Орлов
Россия
д-p. мед. наук, врач-нейрохирург
ул. Маяковского, д. 12, Санкт-Петербург, 191014, Россия
Дополнительные файлы

|
1. STROBE Statement— Чек-лист по исследованию .pdf | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(172KB)
|
Метаданные ▾ | |







































