Перейти к:
Предикторы исходов хирургического лечения пациентов с фармакорезистентной височной эпилепсией
https://doi.org/10.47093/2218-7332.2022.13.3.24-33
Аннотация
Цель. Выявить в многофакторной модели предикторы исходов хирургического лечения пациентов с фармакорезистентной височной эпилепсией.
Материалы и методы. В ретроспективное исследование включены 69 пациентов с фармакорезистентной височной эпилепсией, которым выполнена микрохирургическая передняя темпоральная лобэктомия. В исследование вошли 31 (45%) мужчина и 38 (55%) женщин; медиана возраста – 28 (21; 36). Исходы оценены по классификации Engel через 6, 12, 36 и 60 месяцев после хирургического лечения. Вычислены уравнения логистической регрессии, построена ROC-кривая, рассчитаны: отношение шансов (ОШ) и 95% доверительный интервал (ДИ), чувствительность, специфичность, площадь под ROC-кривой (AUC).
Результаты. Во всех оцененных временных периодах у 88,3–93,0% пациентов исходы соответствовали классам I и II по J.Jr. Engel. Распределение пациентов по классам исходов статистически значимо не изменялось за весь период наблюдения. Предикторами положительного исхода через 6 месяцев после хирургического лечения являлись: меньшая длительность активного течения заболевания (ОШ 0,719, 95% ДИ: 0,437–0,966, р < 0,05), отсутствие эпилептических статусов в анамнезе (ОШ 0,048, 95% ДИ: 0,002–0,472, р < 0,05), отсутствие субдоминантных очагов ирритативной активности (ОШ 0,123, 95% ДИ: 0,012–0,845, р < 0,01), наличие мезиального темпорального склероза (ОШ 1008, 95% ДИ: 21,59–1310851, р < 0,01), бóльшая протяженность хирургической резекции височной доли (ОШ 637,32, 95% ДИ: 5,431–960062, р < 0,05) и расположение эпилептогенной зоны в височной доле субдоминантного полушария (ОШ 0,103, 95% ДИ: 0,004–0,937, р = 0,0532). AUC составила 0,957 (0,917–0,997), p < 0,0001; чувствительность 87,5%, специфичность 82,8%.
Заключение. Независимыми предикторами положительных исходов микрохирургической передней темпоральной лобэктомии у пациентов с фармакорезистентной височной эпилепсией являются: меньшая длительность активного течения заболевания, отсутствие эпилептических статусов в анамнезе заболевания, отсутствие субдоминантных очагов ирритативной активности, наличие мезиального темпорального склероза, бóльшая протяженность хирургической резекции височной доли и расположение эпилептогенной зоны в височной доле субдоминантного полушария.
Ключевые слова
Список сокращений:
- AUC – area under the ROC Curve, площадь под ROC-кривой
- ROC – receiver operating characteristic, рабочая характеристика приемника
- ВЭМ – электроэнцефалография, совмещенная с видеозаписью, видео-ЭЭГ мониторинг
- ДИ – доверительный интервал
- МРТ – магнитно-резонансная томография
- МТС – мезиальный темпоральный склероз
- ОШ – отношение шансов
- ПЭП – противоэпилептические препараты
- ФРВЭ – фармакорезистентная височная эпилепсия
- ФРЭ – фармакорезистентная эпилепсия
Эпилепсия является одним из самых распространенных хронических неврологических заболеваний: так, по данным ВОЗ, активной формой эпилепсии с продолжающимися эпилептическими приступами илипотребностью в приеме противоэпилептических препаратов (ПЭП) в настоящее время страдают около 50 миллионов человек по всему миру, а ежегодно диагностируются около 5 миллионов новых случаев данного заболевания1. По результатам крупномасштабного исследования, проведенного в 14 регионах Российской Федерации, стандартизированная по возрасту распространенность эпилепсии составила 3,4 человека на 1000 населения [1].
К развитию эпилепсии может привести широкий спектр причин, включающий структурные изменения головного мозга, генетическую патологию, инфекционные агенты, токсические факторы, что обуславливает возможность дебюта заболевания у лиц обоего пола в различных возрастных группах [2][3].
Особенностью данной патологии является то, что даже при оптимальной фармакотерапии около 20–40% пациентов не могут избавиться от эпилептических приступов или значительно снизить их количество [4]. Такое течение заболевания называется фармакорезистентной эпилепсией (ФРЭ), а пациенты с ФРЭ считаются кандидатами на хирургическое лечение [5].
Наиболее часто хирургическому лечению подвергаются пациенты со структурной формой ФРЭ [6]. Установлено, что наибольшей эффективностью обладают резекционные оперативные вмешательства, которые нацелены на достижение «свободы от приступов» – полное отсутствие эпилептических приступов после хирургического лечения [7–9]. Разобщающие оперативные вмешательства имеют меньшую клиническую эффективность, нацелены на снижение частоты и тяжести эпилептических приступов и проводятся в тех случаях, когда эпилептогенный очаг невозможно удалить, например при локализации очага в пределах функциональных зон, обширности очага, двухсторонней локализации очагов, генерализованных формах эпилепсии [10–12]. При этом виде операций эпилептогенная зона продолжает оставаться в головном мозге и продуцировать патологическую активность, которая, однако, в меньшей степени передается на «здоровые» участки головного мозга, вовлекая их в патологический процесс [13][14]. Нейромодуляционные методы хирургического лечения эпилепсии нацелены на улучшение качества жизни пациента путем снижения частоты и тяжести эпилептических приступов в тех случаях, когда проведение иных видов оперативных вмешательств невозможно либо они оказались неэффективны [15].
Большинство взрослых пациентов, нуждающихся в хирургическом лечении, имеют фармакорезистентную височную эпилепсию (ФРВЭ) [5]. Из всех видов вмешательств наиболее часто в данной группе выполняется темпоральная лобэктомия, которая значительно снижает частоту приступов и, по данным различных авторов, позволяет достичь полного контроля над приступами у 35–80% пациентов [16][17]. В качестве морфологического субстрата эпилептогенной активности большинство пациентов, страдающих ФРВЭ, имеют мезиальный темпоральный склероз (МТС) [18].
По данным различных исследований, влияние на исходы хирургического лечения эпилепсии могут оказывать различные факторы, такие как возраст, наличие эпилептических статусов в анамнезе, латерализация эпилептогенной зоны, наличие МТС [18–20]. Однако совместное влияние этих факторов на исходы хирургического лечения изучено недостаточно.
Цель исследования: изучить в многофакторной модели влияние предоперационных характеристик пациентов с ФРВЭ на исходы хирургического лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное исследование (протокол одобрен на заседании локального комитета по этике), в которое включались пациенты с ФРВЭ, установленной на основании отсутствия клинического эффекта как минимум на две схемы приема ПЭП в качестве монотерапии или в комбинации в течение как минимум двух лет [5][6]. Всем пациентам исследуемой группы было проведено предоперационное обследование и хирургическое лечение в Федеральном центре нейрохирургии (Россия, Тюмень) с 01.10.2016 по 01.03.2022.
Для включения в исследование оценены все пациенты с ФРВЭ, находившиеся на обследовании в Центре за указанный период. Исходно оценены 116 пациентов, имевшие показания для выполнения передней темпоральной лобэктомии, из них 4 отказались от оперативного лечения.
Критерии включения в исследование: возраст 18 лет и старше, подписанное информированное согласие, выставленный врачом-эпилептологом диагноз «эпилепсия» (G40), верифицированная ФРЭ, локализация эпилептогенной зоны в височной доле, выполненная передняя темпоральная лобэктомия.
Критерии невключения: наличие иных структурных, потенциально эпилептогенных изменений головного мозга; сопутствующая неврологическая патология, потенциально влияющая на оценку исхода хирургического лечения; тяжелая соматическая патология, влияющая на течение послеоперационного периода и оценку исхода хирургического лечения; наличие злокачественных новообразований любой локализации; низкая приверженность пациента к приему ПЭП. Критерии невключения имели 43 пациента.
Всего в исследование включены 69 пациентов: 31 (45%) мужчина и 38 (55%) женщин. Медиана возраста составила 28 (21; 36) лет, различий по возрасту между мужчинами и женщинами не наблюдалось.
В рамках прехирургической диагностики все пациенты, включенные в исследование, проходили стандартный комплекс неинвазивных, а при необходимости инвазивных методов исследования специалистами мультидисциплинарной команды, в которую входили невролог-эпилептолог, нейрофизиолог, специалист лучевой диагностики, нейропсихолог, нейроофтальмолог.
Эпилептические приступы классифицировались в соответствии с рекомендациями R.S Fisher и соавт. (ILAE, 2017) [21]. Согласно рекомендациям Международной противоэпилептической лиги (ILAE 2016, 2019), для определения локализации и латерализации поражения выполнялась длительная транскраниальная электроэнцефалография, совмещенная с видеозаписью (видео-ЭЭГ мониторинг, ВЭМ), согласно рекомендациям W.O. Tatum и соавт. (ILAE 2018) [22], при необходимости проводился инвазивный ВЭМ с имплантацией субдуральных или внутримозговых электродов согласно рекомендациям P. Jayakar и соавт. (ILAE 2016) [23].
Для неинвазивной оценки МТС использовалась магнитно-резонансная томография (МРТ) согласно унифицированному МР-протоколу нейровизуализации структурных последовательностей при эпилепсии HARNESS-MRI [24] на томографе Discovery MR750 (General Electric, США) с напряженностью магнитного поля 3.0 Тесла.
У пациентов с МР негативной формой эпилепсии проводилась позитронно-эмиссионная томография с 18F-фтордезоксиглюкозой, при которой определялась область гипометаболизма радиофармпрепарата, соответствующая по локализации предполагаемой эпилептогенной зоне.
Всем включенным в исследование пациентам проведена микрохирургическая передняя темпоральная лобэктомия под нейрофизиологическим контролем [25].
Оценка исходов хирургического лечения среди пациентов исследуемой группы производилась по результатам контрольного исследования через 6, 12, 36 и 60 месяцев после оперативного вмешательства с проведением осмотра неврологом-эпилептологом, ночного/суточного ВЭМ, МРТ-исследования головного мозга, нейропсихологического осмотра с оценкой состоятельности высших психических функций.
Исходы оперативных вмешательств оценивали по классификации исходов хирургического лечения эпилепсии, предложенной J.Jr. Engel и соавт. [26].
Оценивались следующие факторы, которые потенциально могли влиять на исход: пол, возраст на момент хирургического лечения; длительность активного течения заболевания; тип наиболее характерных для пациента эпилептических приступов; среднее количество эпилептических приступов в месяц (за последние 12 месяцев); наличие эпилептических статусов в анамнезе; наличие вторичных по отношению к доминантному очагов интериктальной эпилептиформной активности в смежных либо контрлатеральных участках головного мозга по данным ВЭМ; наличие МТС по данным МРТ – МР-позитивная или МР-негативная форма; латерализация эпилептогенной зоны (доминантное/субдоминантное полушарие головного мозга); протяженность хирургической резекции височной доли, которая оценивалась по данным контрольного МРТ-исследования головного мозга в раннем послеоперационном периоде: измерение проводилось от передних отделов средней черепной ямки – проекция передней границы полюса височной доли – до задней границы резекции по линии проекции средней височной извилины.
Статистическая обработка данных
Категориальные данные представлены как абсолютное число и доля (%) от общей численности группы. Для определения нормальности распределения непрерывных данных в группах использовали тест Шапиро – Уилка. Для признаков с нормальным распределением переменных данные представлены в виде среднего и стандартного отклонения. Для групп с ненормальным распределением данные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили). При попарном сравнении признаков использовался коэффициент корреляции Пирсона и Спирмена. Для оценки независимого влияния изученных факторов вычислялись уравнения логистической регрессии, по которым строилась ROC-кривая (receiver operating characteristic, рабочая характеристика приемника), рассчитывались: отношение шансов (ОШ) и 95% доверительный интервал (ДИ), чувствительность, специфичность, площадь под ROC-кривой (AUC, Area under the ROC Curve). В качестве порогового значения принят уровень значимости р < 0,05. Статистическая обработка данных производилась с помощью статистических пакетов: IBM SPSS Statistics 21.0 (IBM Corporation, США).
РЕЗУЛЬТАТЫ
Исходные характеристики пациентов
Медиана длительности активной формы течения эпилепсии составила 12 (4; 20) лет, медиана возраста дебюта заболевания – 14 (6; 22) лет. Заболевание манифестировало у 42 (61%) пациентов сфокального эпилептического приступа с последующей генерализацией в тонико-клонический, у 19 (27%) пациентов с билатерального тонико-клонического с неизвестным дебютом и у 8 (12%) с фокального моторного с нарушением осознанности. В качестве провоцирующего фактора треть пациентов отмечала высокую стрессовую нагрузку в период, предшествовавший появлению первых симптомов заболевания.
Среднее количество эпилептических приступов в месяц за 12 месяцев до хирургического лечения составило 12 (5; 28). Согласно типу эпилептических приступов пациенты были классифицированы следующим образом: у 38 (55%) наблюдались фокальные моторные приступы, их них у 32 с нарушением осознанности и у 24 сгенерализацией в тонико-клонические приступы. У 25 (36%) развивались фокальные немоторные приступы, из них у 19 с нарушением осознанности и у 15 с генерализациейв тонико-клонические приступы. У 6 пациентов регистрировались билатеральные тонико-клонические приступы с фокальным дебютом. Эпилептические статусы в анамнезе отмечались у 26 (38%) пациентов.
За время проведения транскраниального ВЭМ, которое составило 148 (62; 168) часов, фиксировалось в среднем 3,5 (3; 5) приступа. Установить убедительные, непротиворечащие иным методам обследования, данные о локализации зоны начала приступов и зоны ирритации при использовании этого метода удалось у 40 (58%) пациентов, остальным понадобилось проведение инвазивного ВЭМ: 8 пациентам были имплантированы субдуральные электроды, 21 пациенту – внутримозговые электроды. Приступы, происходящие из правой височной доли, установлены у 38 (55%) пациентов, из левой – у 31 (45%) пациента. Вторичные, по отношению к основному очагу, участки интериктальной эпилептиформной активности в смежных либо контрлатеральных отделах головного мозга по данным ВЭМ имел 41 (59%) пациент.
По данным МРТ-исследования головного мозга у 32 (46%) пациентов был выявлен правосторонний МТС, у 26 (38%) пациентов – левосторонний МТС. У 11 (16%) пациентов изменений не выявлено, что расценивалось как МР-негативная форма эпилепсии, диагноз у всех этих пациентов подтвержден данными позитронно-эмиссионной томографии.
Средний объем резекции составил 5,18 ± 0,44 сантиметра. Операционный материал всех пациентов исследуемой группы был изучен в нейроморфологической лаборатории. Морфологическая картина склероза гиппокампа 1-го типа (по ILAE) выявлена у 38 (55%) пациентов, 2-го типа у 12 (17,4%), 3-го типа у 14 (20,3%), у оставшихся 5 (7,3%) пациентов морфологическая картина расценена как глиоз при отсутствии склероза.
Исходы хирургического лечения
Исходы лечения оценены через 6 месяцев у всех пациентов, через 12 мес. у 66 (96%), через 36 месяцев у 61 (88%) и через 60 месяцев у 43 (62%) пациентов, включенных в исследование.
Большинство пациентов – 88,3–93,0% во всех оцененных временных периодах вошли в группу с высокой эффективностью хирургии эпилепсии (классы I и II). Распределение пациентов по классам исходов статистически значимо не изменялось за весь период наблюдения (табл. 1).
При анализе пациентов с высокой эффективностью лечения за время наблюдения наблюдалась тенденция к небольшому снижению общей доли исходов класса I: с62,3% через 6 мес. после оперативного вмешательства к 58% через 5 лет и повышению доли исходов класса II: с 26% через 6 мес. после операции к 35% через 5 лет (табл. 1).
Таблица 1. Исходы хирургического лечения эпилепсии по Engel
Table 1. Epilepsy surgery outcomes according to the Engel scale
|
Исход / Outcome |
6 месяцев/ 6 months |
12 месяцев/ 12 months |
36 месяцев/ 36 months |
60 месяцев/ 60 months |
Значение р / |
|
|
Класс I / Class I |
43(62,3%) |
39 (59%) |
36 (59%) |
25 (58%) |
n.s. |
|
|
A |
38 |
36 |
32 |
22 |
||
|
B |
5 |
3 |
2 |
1 |
||
|
C |
0 |
0 |
1 |
2 |
||
|
D |
0 |
0 |
1 |
0 |
||
|
Класс II / Class II |
18 (26%) |
20 (30%) |
20 (33%) |
15 (35%) |
n.s. |
|
|
A |
10 |
11 |
12 |
10 |
||
|
B |
8 |
9 |
7 |
3 |
||
|
C |
0 |
0 |
1 |
2 |
||
|
D |
0 |
0 |
0 |
0 |
||
|
Класс III / Class III |
3 (4,4%) |
3 (5%) |
3 (5%) |
2 (5%) |
n.s. |
|
|
A |
3 |
3 |
2 |
1 |
||
|
B |
0 |
0 |
1 |
1 |
||
|
Класс IV / Class IV |
5 (7,3%) |
4 (6%) |
2 (3%) |
1 (2%) |
n.s. |
|
|
A |
2 |
1 |
0 |
0 |
||
|
B |
2 |
2 |
1 |
1 |
||
|
C |
1 |
1 |
1 |
0 |
Примечание: n.s. – not signifcant (не значимо).
Note: n.s. – not signifcant.
Среди пациентов с низкой эффективностью / неэффективностью оперативного лечения (классы III и IV) за период наблюдения доля пациентов с классом III не изменялась за весь период наблюдения и составляла 5%, доля пациентов с классом IV изменялась с 7,3% через 6 мес. до 2% через 5 лет (разница статистически незначима).
Влияние предоперационных характеристик пациентов на результаты хирургического лечения
Произведена оценка независимого влияния исследуемых исходных характеристик пациентов на исход хирургического лечения через 6 месяцев с помощью множественной логистической регрессии. В выбранное уравнение из всех проанализированных признаков вошли пять независимых переменных с уровнем значимости p < 0,05 (табл. 2).
Таблица 2. Переменные в уравнении логистической регрессии на положительный исход лечения через 6 месяцев (классы I и II по Engel)
Table 2. Variables in the logistic regression equation for a positive treatment outcome at 6 months (Engel Classes I and II)
|
Переменная /Variable |
β |
Отношение шансов / |
95% доверительный интервал / |
Значение р / |
|
Длительность активного течения заболевания (увеличение на 1 год) / |
–1,027 |
0,719 |
0,437–0,966 |
0,0431 |
|
Наличие эпилептических статусов в анамнезе /History of statusepilepticus |
–2,303 |
0,048 |
0,002–0,472 |
0,0336 |
|
Наличиесубдоминантныхочагов на ВЭМ / |
–7,069 |
0,123 |
0,012–0,845 |
0,0044 |
|
Наличие мезиального темпорального склероза на МРТ / |
4,141 |
1008 |
21,59–1310851 |
0,0098 |
|
Латерализация эпилептогенной зоны в доминантном полушарии / |
–1,994 |
0,103 |
0,004–0,937 |
0,0532 |
|
Протяженностьхирургическойрезекциивисочной доли(увеличение на 1см) / |
3,116 |
637,32 |
5,43–1960062 |
0,0189 |
Примечание: ВЭМ – электроэнцефалография, совмещенная с видеозаписью; МРТ – магнитно-резонансная томография.
Note: EEG – electroencephalography; MRI – magnetic resonance imaging.
Статистически значимыми предикторами положительного исхода хирургического лечения (по Engel классы I и II) являлись: меньшая длительность активного течения заболевания, отсутствие эпилептических статусов в анамнезе, отсутствие вторичных очагов по данным ВЭМ, наличие МТС по данным МРТ и больший объем хирургической резекции височной доли. Для одной из переменных, вошедших в уравнение, латерализация эпилептогенной зоны в пределах субдоминантного полушария – уровень значимости оказался близким к границе значимости (p = 0,0532).
На основе выбранного уравнения построена ROC-кривая, площадь под которой – AUC – составила 0,957 (0,917–0,997), p < 0,0001; чувствительность 87,5%; специфичность 82,8% (рис.).
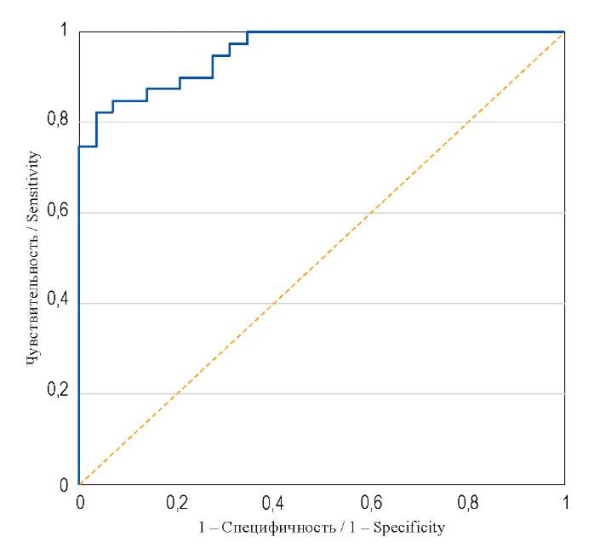
РИС. ROC-кривая.
FIG. ROC-Curve.
ОБСУЖДЕНИЕ
Большинство исследований, посвященных оценке резекционных оперативных вмешательств по поводу ФРЭ, сообщают об их высокой эффективности. В нашем исследовании у пациентов с ФРВЭ после темпоральной лобэктомии положительные исходы по Engel (классы I и II) достигнуты в течение года у 89% пациентов, что аналогично данным других исследовательских групп [17][20][27][28].
Необходимо отметить, что в отличие от согласующихся во многих исследованиях высоких показателей положительных ранних исходов (1–3 года) темпоральных лобэктомий отдаленные результаты (5–10 лет) этих хирургических вмешательств изучены в небольшом числе исследований [29–31]. В нашем исследовании через 5 лет наблюдения доля пациентов с положительным исходом по Engel (классы I и II) значимо не менялась по сравнению с исходом через год и составила 93%. При этом отмечалась незначительная тенденция к снижению общей доли исходов класса I: с 62,3% через 6 мес. после оперативного вмешательства к 58% через 5 лет и повышению доли исходов класса II: с 26% через 6 мес. после операции к 35% через 5 лет. Полученные результаты могут свидетельствовать о высокой долговременной эффективности проведенного хирургического лечения в исследуемой группе пациентов.
Среди работ, посвященных предикторам исходов хирургического лечения ФРВЭ, не представлено убедительных данных о различиях в эффективности между мужчинами и женщинами, что согласуется с полученными нами данными. Часть проведенных исследований свидетельствуют о влиянии возраста на исход хирургического лечения [19][32]. В проведенном нами исследовании возраст, несмотря на значимую корреляционную связь средней силы с исходом при попарном сравнении признаков, независимого влияния на исход хирургического лечения не имел. Это может объясняться прямой связью возраста с длительностью активного течения заболевания, которое и оказывает наиболее значимый эффект на исход, что показано в нашем исследовании и согласуется с данными других исследовательских групп [17][20]. При длительном течении заболевания все большие участки головного мозга вовлекаются в «эпилептическую сеть», начиная при этом продуцировать патологическую активность и формируя дополнительные, субдоминантные по отношению к основному эпилептогенные очаги [31]. В таком случае при удалении основного доминантного эпилептогенного очага не удается во всех случаях достичь полной «свободы от приступов». Это служит основой для рекомендаций различных авторов проводить оперативное вмешательство в первые 5 лет после установления диагноза ФРЭ.
Выявление по данным ВЭМ интериктальной эпилептиформной активности в участках головного мозга, которые явно выходят за пределы локализованной по данным прехирургического обследования эпилептогенной зоны (ипсилатеральные соседние доли головного мозга, контрлатеральные очаги), по данным C. Barba и соавт. [28] и M. Hemb и соавт. [30], также может свидетельствовать о прогнозируемой низкой эффективности планируемого хирургического лечения. Полученные в исследовании данные подтверждают высокую степень зависимости между отсутствием субдоминантных очагов по данным ВЭМ и положительным исходом хирургического лечения.
По данным исследования M.O. Krucoff и соавт. [19], наличие эпилептических статусов в анамнезе является предиктором низкой эффективности хирургического лечения, с чем согласуются результаты нашего исследования.
МР-негативная эпилепсия ассоциирована с меньшей эффективностью оперативного вмешательства [18][28][30]. В представленной группе пациентов наличие МТС по данным МРТ являлось самым сильным предиктором положительного исхода хирургического лечения (ОШ 1008; 95% ДИ: 21,59–1310851; p = 0,0098).
Исследования J. de Tisi и соавт. [20] установили зависимость исхода хирургического лечения от латерализации эпилептогенной зоны в височной доле доминантного (отрицательный исход) либо субдоминантного (положительный исход) полушария головного мозга. Сходные данные получены в нашем исследовании: уровень значимости независимого влияния данной переменной на исход хирургического лечения оказался близким к принятой границе значимости (p = 0,0532). Это может объясняться зависимостью данной переменной от объема хирургической резекции височной доли (в доминантном или субдоминантном полушарии), которая независимо и значимо влияет на исход хирургического лечения (ОШ 637,32; 95% ДИ: 5,431–960062; p = 0,0189).
Нам не удалось найти опубликованных данных по изучению влияния на исход хирургического лечения ФРВЭ таких характеристик, как тип характерных для пациента эпилептических приступов и средняя частота эпилептических приступов за предшествующие 12 мес. В проведенном исследовании установлено, что статистически значимого влияния на исход эти факторы не имеют.
Ограничением нашего исследования служит оценка предикторов исходов хирургического лечения эпилепсии в многофакторном анализе только на сроке через 6 месяцев после оперативного лечения. Учитывая, что исходы по Engel на этом сроке оставались без существенных изменений и в последующий период наблюдения, можно предположить, что выявленные факторы риска действуют и в других точках наблюдения, однако это требует подтверждения в будущих исследованиях.
ЗАКЛЮЧЕНИЕ
Высокая эффективность хирургии ФРВЭ достигнута у 88,3–93,0% пациентов при оценке в сроки от 6 мес. до 5 лет после оперативного лечения. Независимыми предикторами положительного исхода хирургического лечения являлись: меньшая длительность активного течения заболевания, отсутствие эпилептических статусов в анамнезе, отсутствие вторичных очагов по данным ВЭМ, наличие МТС поданным МРТ, латерализация эпилептогенной зоны в субдоминантном полушарии и сравнительно больший объем хирургической резекции височной доли. Пол пациента, возраст на момент хирургического лечения, тип эпилептических приступов, среднее количество эпилептических приступов значимо не влияли на исход хирургического лечения.
Полученные данные могут быть использованы в практической медицине, в частности, позволяя на этапе прехирургической диагностики по совокупности факторов прогнозировать вероятность достижения «свободы от приступов», что может влиять на тактику лечения пациента, а также является важной информацией для принятия пациентом решения о хирургическом лечении.
ВКЛАД АВТОРОВ
И.С. Шелягин внес основной вклад в разработку концепции и дизайна исследования, руководил процессом написания, редактирования и статистической обработки. П.О. Акимова, С.Ж. Стефанов и Р.А. Суфианов внесли равнозначный вклад в поиск литературных источников, написание и редактирование текста, статистическую обработку. Все авторы одобрили окончательный вариант статьи и готовы взять на себя ответственность за все аспекты представленной публикации.
AUTHOR CONTRIBUTIONS
Ivan S. Shelyagin made the main contribution to the development of the concept and design of the study, led the process of writing, editing and statistical processing. Polina O. Akimova, Stefan Zh. Stefanov and Rinat A. Sufianov made an equal contribution to the search for literary sources, writing and editing the text, statistical processing. All authors approved the final version of the article and are ready to take responsibility for all aspects of the submitted publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. https://www.who.int/news-room/fact-sheets/detail/epilepsy (дата доступа: 02.08.2022).
Список литературы
1. Guekht A., Hauser W.A., Milchakova L., et al. The epidemiology of epilepsy in the Russian Federation. Epilepsy Res. 2010 Dec; 92(2–3): 209–218. https://doi.org/10.1016/j.eplepsyres.2010.09.011. Epub 2010 Oct 28. PMID: 21035312.
2. Falco-Walter J. Epilepsy-Definition, Classification, Pathophysiology, and Epidemiology. Semin Neurol. 2020 Dec; 40(6): 617–623. https://doi.org/10.1055/s-0040-1718719. Epub 2020 Nov 5. PMID: 33155183.
3. Pitkänen A., Ekolle Ndode-Ekane X., Lapinlampi N., Puhakka N. Epilepsy biomarkers – Toward etiology and pathology specificity. Neurobiol Dis. 2019 Mar; 123: 42–58. https://doi.org/10.1016/j.nbd.2018.05.007. Epub 2018 May 18. PMID: 29782966.
4. Fattorusso A., Matricardi S., Mencaroni E., et al. The Pharmacoresistant Epilepsy: An Overview on Existant and New Emerging Therapies. Front Neurol. 2021 Jun 22; 12: 674483. https://doi.org/10.3389/fneur.2021.674483. PMID: 34239494.
5. Janmohamed M., Brodie M.J., Kwan P. Pharmacoresistance – Epidemiology, mechanisms, and impact on epilepsy treatment. Neuropharmacology. 2020 May 15; 168: 107790. https://doi.org/10.1016/j.neuropharm.2019.107790. Epub 2019 Sep 24. PMID: 31560910.
6. Thijs R.D., Surges R., O’Brien T.J., Sander J.W. Epilepsy in adults. Lancet. 2019 Feb 16; 393(10172): 689–701. https://doi.org/10.1016/S0140-6736(18)32596-0. Epub 2019 Jan 24. PMID: 30686584.
7. Jobst B.C., Cascino G.D. Resective epilepsy surgery for drug-resistant focal epilepsy: a review. JAMA. 2015 Jan 20; 313(3): 285–293. https://doi.org/10.1001/jama.2014.17426. PMID: 25602999.
8. Cramer S.W., McGovern R.A., Wang S.G., et al. Resective epilepsy surgery: assessment of randomized controlled trials. Neurosurg Rev. 2021 Aug; 44(4): 2059–2067. https://doi.org/10.1007/s10143-020-01432-x. Epub 2020 Nov 9. PMID: 33169227.
9. West S., Nolan S.J., Newton R. Surgery for epilepsy: a systematic review of current evidence. Epileptic Disord. 2016 Jun 1; 18(2): 113–121. https://doi.org/10.1684/epd.2016.0825. PMID: 27193634.
10. Matern T.S., DeCarlo R., Ciliberto M.A., Singh R.K. Palliative Epilepsy Surgery Procedures in Children. Semin Pediatr Neurol. 2021 Oct; 39: 100912. https://doi.org/10.1016/j.spen.2021.100912. Epub 2021 Aug 19. PMID: 34620461.
11. Vaddiparti A., Huang R., Blihar D., et al. The Evolution of corpus callosotomy for epilepsy management. World Neurosurg. 2021 Jan; 145: 455–461. https://doi.org/10.1016/j.wneu.2020.08.178. Epub 2020 Sep 2. PMID: 32889189.
12. Madaan P., Gupta A., Gulati S. Pediatric epilepsy surgery: indications and evaluation. Indian J Pediatr. 2021 Oct; 88(10): 1000–1006. https://doi.org/10.1007/s12098-021-03668-x. Epub 2021 Mar 19. PMID: 33740232.
13. Graham D., Tisdall M.M., Gill D. Corpus callosotomy outcomes in pediatric patients: A systematic review. Epilepsia. 2016 Jul; 57(7): 1053–1068. https://doi.org/10.1111/epi.13408. Epub 2016 May
14. Bello-Espinosa L.E., Olavarria G. Epilepsy surgery in children. Pediatr Clin North Am. 2021 Aug; 68(4): 845–856. https://doi.org/10.1016/j.pcl.2021.04.016. PMID: 34247713.
15. Ryvlin P., Rheims S., Hirsch L.J., et al. Neuromodulation in epilepsy: state-of-the-art approved therapies. Lancet Neurol. 2021 Dec; 20(12): 1038–1047. https://doi.org/10.1016/S1474-4422(21)00300-8. Epub 2021 Oct 25. Erratum in: Lancet Neurol. 2021 Dec;20(12):e7. PMID: 34710360.
16. Asadi-Pooya A.A., Rostami C. History of surgery for temporal lobe epilepsy. Epilepsy Behav. 2017 May; 70(Pt A): 57–60. https://doi.org/10.1016/j.yebeh.2017.02.020. Epub 2017 Apr 12. PMID: 28410466.
17. West S., Nevitt S.J., Cotton J., et al. Surgery for epilepsy. Cochrane Database Syst Rev. 2019 Jun 25;6(6):CD010541. https://doi.org/10.1002/14651858.CD010541.pub3. PMID: 31237346.
18. Muhlhofer W., Tan Y.L., Mueller S.G., Knowlton R. MRI-negative temporal lobe epilepsy-What do we know? Epilepsia. 2017 May; 58(5): 727–742. https://doi.org/10.1111/epi.13699. Epub 2017 Mar 7. PMID: 28266710.
19. Krucoff M.O., Chan A.Y., Harward S.C., et al. Rates and predictors of success and failure in repeat epilepsy surgery: A meta-analysis and systematic review. Epilepsia. 2017 Dec; 58(12): 2133–2142. https://doi.org/10.1111/epi.13920. Epub 2017 Oct 10. PMID: 28994113.
20. de Tisi J., Bell G.S., Peacock J.L., et al. The long-term outcome of adult epilepsy surgery, patterns of seizure remission, and relapse: a cohort study. Lancet. 2011 Oct 15; 378(9800): 1388–1395. https://doi.org/10.1016/S0140-6736(11)60890-8. PMID: 22000136.
21. Fisher R.S., Cross J.H., French J.A., et al. Operational classification of seizure types by the International League Against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017 Apr; 58(4): 522–530. https://doi.org/10.1111/epi.13670. Epub 2017 Mar 8. PMID: 28276060.
22. Tatum W.O., Rubboli G., Kaplan P.W., et al. Clinical utility of EEG in diagnosing and monitoring epilepsy in adults. Clin Neurophysiol. 2018 May; 129(5): 1056–1082. https://doi.org/10.1016/j.clinph.2018.01.019. Epub 2018 Feb 1. PMID: 29483017.
23. Jayakar P., Gotman J., Harvey A.S., et al. Diagnostic utility of invasive EEG for epilepsy surgery: Indications, modalities, and techniques. Epilepsia. 2016 Nov; 57(11): 1735–1747. https://doi.org/10.1111/epi.13515. Epub 2016 Sep 28. PMID: 27677490.
24. Bernasconi A., Cendes F., Theodore W.H., et al. Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy: A consensus report from the International League Against Epilepsy Neuroimaging Task Force. Epilepsia. 2019 Jun; 60(6): 1054–1068. https://doi.org/10.1111/epi.15612. Epub 2019 May 28. PMID: 31135062.
25. Gross R.E., Boulis N.M. Neurosurgical operative atlas: functional neurosurgery. 3d ed. New-York: Thieme/AANS, 2018. 362 p. ISBN-10: 9781626231115.
26. Engel J.Jr., Van Ness P.C., Rasmussen T.B., Ojemann L.M. Outcome with respect to epileptic seizures. In: Engel Jr.J. (Ed.), Surgical Treatment of the Epilepsies, 2nd Ed. Raven Press: New York, 1993. P. 609–621. ISBN-10: 0881679887
27. Giulioni M., Marucci G., Martinoni M., et al. Seizure outcome in surgically treated drug-resistant mesial temporal lobe epilepsy based on the recent histopathological classifications. J Neurosurg. American Association of Neurological Surgeons; 2013; 119: 37–47. https://doi.org/10.3171/2013.3.JNS122132. PMID: 23641822.
28. Barba C., Giometto S., Lucenteforte E., et al. Seizure outcome of temporal lobe epilepsy surgery in adults and children: A systematic review and meta-analysis. Neurosurgery. 2022 Nov 1; 91(5): 676–683. https://doi.org/10.1227/neu.0000000000002094. Epub 2022 Aug 16. PMID: 35960753
29. Mohan M., Keller S., Nicolson A., et al. The long-term outcomes of epilepsy surgery. PLoS One. 2018 May 16 13(5): e0196274. https://doi.org/10.1371/journal.pone.0196274. PMID: 29768433.
30. Hemb M., Palmini A., Paglioli E., et al. An 18-year follow-up of seizure outcome after surgery for temporal lobe epilepsy and hippocampal sclerosis. Journal of Neurology, Neurosurgery & Psychiatry. 2013; 84: 800–805. https://doi.org/10.1136/jnnp-2012-304038 PMID: 23408065
31. Alexandratou I., Patrikelis P., Messinis L., et al. Long-term neuropsychological outcomes following temporal lobe epilepsy surgery: An update of the literature. Healthcare (Basel). 2021 Sep 3; 9(9): 1156. https://doi.org/10.3390/healthcare9091156. PMID: 34574930; PMCID: PMC8466433.
32. Polkey C.E. Clinical outcome of epilepsy surgery. Curr Opin Neurol. 2004 Apr; 17(2): 173–178. https://doi.org/10.1097/00019052-200404000-00015. PMID: 15021245.
Об авторах
И. С. ШелягинРоссия
Шелягин Иван Сергеевич - ассистент кафедры фармакологии ТюмГМУ МЗ РФ; врач-нейрохирург ФЦ нейрохирургии МЗ РФ.
ул. Одесская, д. 54, Тюмень, 625023; 4-й км Червишевского тракта, д. 5, Тюмень, 625032
Тел.: +7 (919) 954-53-81
П. О. Акимова
Россия
Акимова Полина Олеговна - нейропсихолог.
4-й км Червишевского тракта, д. 5, Тюмень, 625032
С. Ж. Стефанов
Россия
Cтефанов Стефан Живков - заместитель главного врача по медицинской части.
4-й км Червишевского тракта, д. 5, Тюмень, 625032
Р. A. Суфианов
Россия
Cуфианов Ринат Альбертович - ассистент кафедры нейрохирургии.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Дополнительные файлы

|
1. Чек-лист STROBE | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(33KB)
|
Метаданные ▾ | |







































