Перейти к:
Затяжная желтуха после перенесенной SARS-CoV-2-инфекции: клинический случай
https://doi.org/10.47093/2218-7332.2022.13.3.45-53
Аннотация
В результате инфицирования новым коронавирусом (COVID-19), помимо органов дыхания, может быть поражена и гепатобилиарная система. Синдром исчезновения желчных протоков (vanishing bile duct syndrome, VBDS) – редкая причина желтухи – развивается, как правило, вследствие лекарственного повреждения печени, возможно сочетанное действие нескольких этиологических факторов.
Описание случая. Пациентка 77 лет госпитализирована по поводу желтушного окрашивания кожи и склер, кожного зуда и потемнения мочи. Симптомы впервые появились через 1 месяц после перенесенной COVID-19, в лечении которой использовался цефтриаксон, и сопровождались повышением биохимических маркеров холестаза. Исключена патология вне- и внутрипеченочных желчных протоков. По данным гистологии печени выявлен VBDS. Лечение препаратами урсодезоксихолевой кислоты в течение 11 мес. привело к полному разрешению желтухи, регрессу кожного зуда и уменьшению биохимических маркеров холестаза.
Обсуждение. Данное клиническое наблюдение представляет интерес в связи с развитием у пациентки VBDS после перенесенной коронавирусной пневмонии, леченной цефтриаксоном. VBDS редко входит в круг дифференциальной диагностики холестатического синдрома, что отчасти связано с недостаточной информированностью врачей об осложнениях, возникающих после COVID-19 и проведенной лекарственной терапии.
Ключевые слова
Список сокращений
- COVID-19 – Сoronavirus disease 2019, коронавирусная инфекция 2019 года
- SARS-CoV-2 – Severe acute respiratory syndrome-related coronavirus 2, коронавирус тяжелого острого респираторного синдрома – 2
- VBDS – vanishing bile duct syndrome, синдром исчезновения желчных протоков
- АЛТ – аланинаминотрансфераза
- АСТ – аспартатаминотрансфераза
- ГГТП – гамма-глютамилтранспептидаза
- УДХК – урсодезоксихолевая кислота
- ЩФ – щелочная фосфатаза
С увеличением масштабов заболеваемости новой коронавирусной инфекцией (Сoronavirus disease 2019, COVID-19), вызываемой новым типом коронавируса SARS-CoV-2 (severe acute respiratory syndrome-related coronavirus 2), помимо поражения легких, все чаще описывались случаи изменений со стороны гепатобилиарной системы. Патогенез этих изменений связывается с ишемией, иммуноопосредованным воздействием, лекарственным поражением и прямым цитотоксическим действием вируса, которое осуществляется с помощью ангиотензинпревращающего фермента 2-го типа, участвующего в проникновении вируса в клетку [1][2]. Этот фермент представлен в виде рецепторов на поверхности различных тканей: в сердце, почках, тонкой кишке, яичниках, щитовидной железе, жировой ткани. В печени экспрессия ангиотензинпревращающего фермента 2-го типа представлена на холангиоцитах и гепатоцитах, причем на холангиоцитах в несколько раз выше [3]. Описаны случаи постковидной холангиопатии, которая чаще всего ассоциирована с тяжелой формой поражения легких и представляет собой стриктуры желчных протоков, похожие на классический первичный склерозирующий холангит [4].
Синдром исчезновения желчных протоков (vanishing bile duct syndrome, VBDS) – орфанная форма холестатического заболевания печени [5], которая наиболее часто ассоциирована с лекарственным повреждением и клинически проявляется желтухой и/или кожным зудом, лабораторно – повышением маркеров холестаза: гамма-глютамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), прямой фракции билирубина, желчных кислот; гистологически – уменьшением количества и деструкцией внутрипеченочных желчных протоков (рис. 1). Гистологические признаки VBDS обычно появляются через 1–6 месяцев от начала приема лекарственного препарата или воздействия другого фактора риска [5–7].

РИС. 1. Синдром исчезновения желчных протоков.
FIG. 1. Vanishing bile duct syndrome.
Прогноз при возникновении в значительной степени зависит от регенераторной способности печеночной ткани. Заболевание может прогрессировать и приводить к почти полной потере желчных протоков, что сопровождается тяжелым холестазом, печеночной недостаточностью и необходимостью трансплантации печени в течение 1–3 лет после дебюта [6]. У части пациентов потеря желчных протоков может быть обратимой: в результате регенерации восстанавливается структура и функция печени [4][7].
Лекарственными препаратами, с которыми чаще всего связано развитие VBDS, являются антибактериальные, противогрибковые, нестероидные противовоспалительные, противосудорожные препараты, трициклические антидепрессанты2 [8][9]. Некоторые из этих препаратов применяются для лечения COVID-19. До настоящего времени случаев развития VBDS после лечения COVID-19 не описано.
Приводим клиническое наблюдение пожилой пациентки с гистологически подтвержденным VBDS, манифестировавшим через один месяц после перенесенного COVID-19, в схеме лечения которого применялся цефтриаксон.
ОПИСАНИЕ СЛУЧАЯ
Пациентка 77 лет поступила в Университетскую клиническую больницу № 2 в декабре 2021 г. с жалобами на желтушность кожи и склер, кожный зуд, возникающий преимущественно в вечернее время, потемнение мочи и осветление кала.
Из анамнеза: в конце июня 2021 г. появилась фебрильная лихорадка, при обследовании методом полимеразной цепной реакции подтверждена инфекция SARS-CoV-2. В течение недели проводилось амбулаторное лечение по месту жительства: парацетамол, ибупрофен – без эффекта: появилась одышка, что послужило причиной для госпитализации. По данным компьютерной томографии органов грудной клетки выявлена двусторонняя полисегментарная пневмония второй степени тяжести. В стационаре получала терапию: дексаметазон, цефтриаксон, ривароксабан с положительным клиническим эффектом. За время госпитализации печеночные функциональные тесты оставались в пределах референсных значений.
Через неделю после выписки впервые обратила внимание на желтушность кожи и склер, появился кожный зуд, потемнение мочи и обесцвечивание стула. Были исключены вирусные гепатиты А, В, С и E: HAV RNA, HBV DNA, HCV RNA, аnti-HEV IgM – отрицательные. Госпитализирована в отделение гастроэнтерологии. Показатели общего анализа крови находились в пределах референсных значений. В биохимическом анализе крови отмечалось повышение маркеров холестаза: общего билирубина до 125 мкмоль/л, прямого до 84 мкмоль/л, ГГТП до 423 Ед/л (до 55), ЩФ до 560 Ед/л (30–120); повышение маркеров цитолиза: аланинаминотрансферазы (АЛТ) до 88 Ед/л, аспартатаминотрансферазы (АСТ) до 68 Ед/л.
По данным визуализирующих методов исследования (ультразвуковое исследование, магнитно-резонансная холангиопанкреатография) была исключена механическая природа желтухи, изменений внеи внутрипеченочного билиарного дерева не было выявлено.
Аутоиммунные и первичные холестатические заболевания печени исключены на основании: отрицательных тестов на антитела к митохондриям (antimitochondrial antibodies M2, AMA-M2), микросомам печени и почек 1-го типа (liver kidney microsomes type 1, LKM1), цитозолю клеток печени (liver cytosol type 1, LC1), растворимому печеночному антигену (soluble liver antigen, SLA), к гладкой мускулатуре (anti-smooth muscles antibodies, ASMA), а также отсутствия антинуклеарного фактора (antinuclear antigen, ANA), антинейтрофильных цитоплазматических антител (anti-neutrophil cytoplasmatic antibodies, ANCA).
Пациентке был установлен диагноз: токсическое поражение печени с синдромом холестаза (К83.9, МКБ-10). Начато лечение преднизолоном 40 мг/сут, а также урсодезоксихолевой кислотой (УДХК) в дозе 1000 мг/сут. В течение месяца лечения интенсивность симптомов нарастала: усилились желтуха и зуд, появилась выраженная слабость. Отмечалось дальнейшее повышение маркеров холестаза: общего билирубина до 427 мкмоль/л, прямого до 203 мкмоль/л, ГГТП до 2398 Ед/л (до 55), ЩФ до 672 Ед/л (30–120), общего холестерина до 10 ммоль/л, активность АСТ преобладала над АЛТ – 165 и 84 Ед/л соответственно.
Для уточнения характера поражения печени была выполнена ее пункционная биопсия: подтверждено наличие холестаза и неспецифического гепатита без четких выводов о конкретной нозологической форме. Симптомы холестаза (кожный зуд и желтуха) сохранялись, появилась бессонница, что значительно снижало качество жизни. Терапия преднизолоном ввиду неэффективности была отменена, продолжено лечение препаратами УДХК (рис. 2).
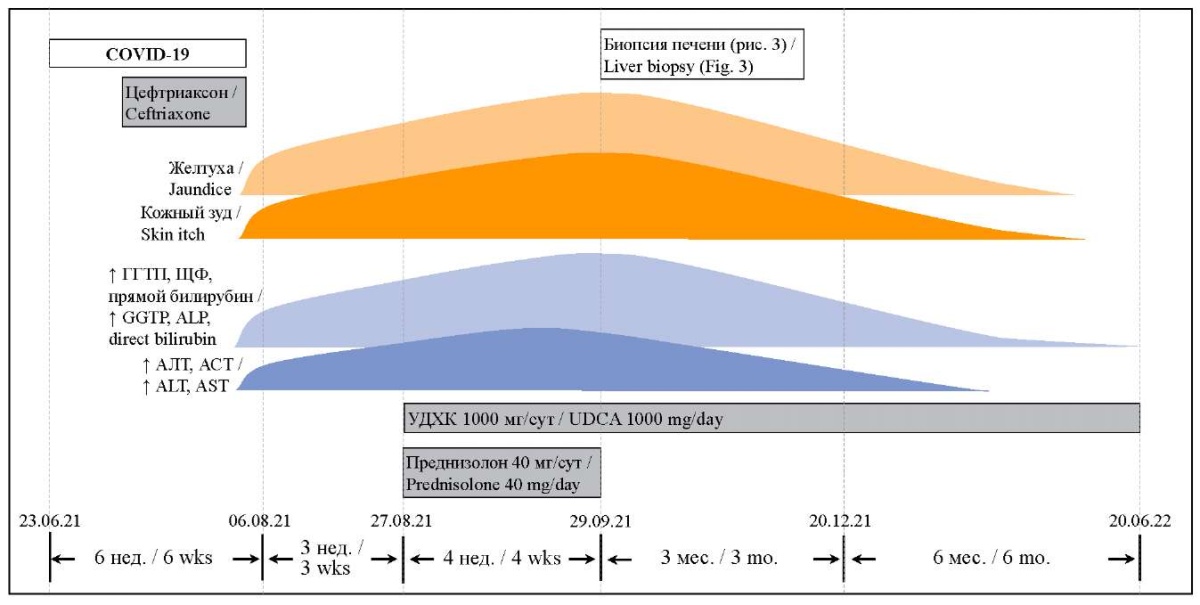
РИС. 2. Течение заболевания пациентки 77 лет.
FIG. 2. The course of disease in a 77-year-old woman.
Примечание: ГГТП – гамма-глютамилтранспептидаза; ЩФ – щелочная фосфатаза; АЛТ – аланинаминотрансфераза; АСТ – аспартатаминотрансфераза; УДХК – урсодезоксихолевая кислота
Note: GGTP – gamma-glutamyl transferase; ALP – alkaline phosphatase; ALT – alanine transaminase; AST – asparagine transaminase; UDCA – ursodeoxycholic acid.
Для дифференциальной диагностики сохраняющейся желтухи в декабре 2021 г. госпитализирована в отделение гепатологии Университетской клинической больницы № 2.
До настоящего заболевания пациентка не отмечала эпизодов желтухи, за последний год не получала лекарственных препаратов или биоактивных добавок (за исключением лечения по поводу COVID-19), не употребляла алкогольные напитки и психоактивные вещества. Тяжелых сопутствующих заболеваний не выявлено.
При объективном осмотре: рост 1,6 м, вес 58 кг, индекс массы тела 22,7 кг/м2, желтушность видимых слизистых, склер и кожного покрова, следы расчесов. Печень и селезенка не пальпируются, перкуторные размеры не увеличены. Со стороны других органов и систем без особенностей.
Показатели клинического анализа крови находились в пределах референсных значений: гемоглобин 123 г/л, эритроциты 4,1×1012/л, лейкоциты 7,1×109/л, тромбоциты 363×109/л. Оставались повышенными маркеры холестаза: общий билирубин до 279 мкмоль/л, прямой до 135 мкмоль/л, ГГТП 650 Ед/л (до 73), ЩФ 900 Ед/л (70–360), желчные кислоты 123 мкмоль/л (до 8,5), общий холестерин 15,7 ммоль/л, активность АЛТ 78 Ед/л, АСТ 87 Ед/л. Уровень иммуноглобулинов классов A, M, G – в пределах референсных значений, в электрофорезе белков сыворотки крови отклонений не выявлено. Показатели белок-синтетической функции печени на момент госпитализации, а также за все время наблюдения находились в пределах референсных значений.
По данным ультразвукового исследования и компьютерной томографии не выявлено гепатоспленомегалии, абдоминальной лимфаденопатии, портальной гипертензии, билиарной гипертензии и изменений внутрии внепеченочных желчных протоков (в т.ч. характерных для первичного холестатического заболевания печени).
Для уточнения диагноза ранее полученный гистологический материал пункционной биопсии печени был направлен на пересмотр и получено заключение о морфологической картине острого гепатита низкой гистологической активности с признаками выраженного паренхиматозно-канальцевого билирубиностаза и VBDS, стадия фиброза 1 (рис. 3).
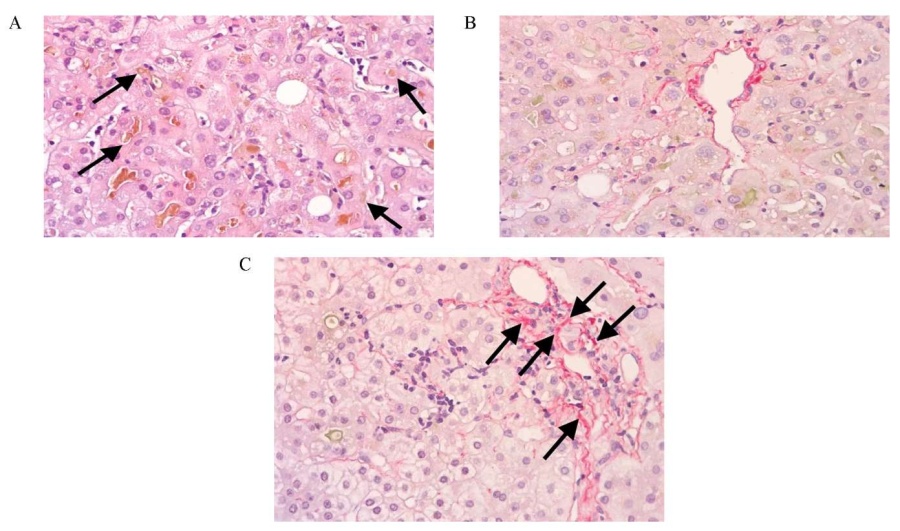
РИС. 3. Препараты ткани печени, полученные при пункционной биопсии через 4 мес. от дебюта синдрома холестаза.
A. Признаки выраженного очагово-распространенного билирубиностаза: в цитоплазме части гепатоцитов гранулы зеленовато-бурого цвета. В многочисленных неравномерно расширенных канальцах Геринга желчные пробочки (черные стрелки), несколько отличающиеся друг от друга по цвету и структуре, что свидетельствует о повторных эпизодах стаза. Окраска гематоксилином и эозином. Увеличение ×400.
B. Из 11 портальных трактов в 6 отсутствуют желчные протоки. Окраска пикросириусом. Увеличение ×400.
C. Слабая диффузная мелкокапельная и очаговая крупнокапельная жировая дистрофия гепатоцитов (до 33%). В просветах синусоидов увеличено количество лимфоцитов, макрофагов и нейтрофилов. В участках билирубиностаза очаговая капилляризация синусоидов (черные стрелки). Окраска пикросириусом. Увеличение ×400.
FIG. 3. Liver tissue obtained by biopsy, after 4 months from the onset of cholestasis syndrome.
A. Signs of significant focal widespread bilirubinostasis: cytoplasm of several hepatocytes contains granules of a greenish-brown color. Numerous unevenly dilated tubules of Hering contain bile plugs (black arrows) with slightly different color and structure, which indicates repeated episodes of stasis. Stained with hematoxylin and eosin. Magnification ×400.
B. There are no bile ducts in 6 out of 11 portal tracts. Stained with picrosirius. Magnification ×400.
C. Weak diffuse small droplet and focal large droplet fatty degeneration of hepatocytes (up to 33%). In the lumen of the sinusoids, the number of lymphocytes, macrophages and neutrophils is increased. Areas of bilirubinostasis contain focal capillarization of the sinusoids (black arrows). Stained with picrosirius. Magnification ×400.
Сформулирован заключительный клинический диагноз: «Лекарственное поражение печени: тяжелый холестатический гепатит, индуцированный приемом цефтриаксона. Синдром исчезновения желчных протоков (К71.0, МКБ-10). Перенесенная SARSCoV2-инфекция в июне 2021 г.» Рекомендовано продолжить лечение препаратами УДХК.
В течение 6 месяцев после выписки наблюдалось полное разрешение желтухи, регресс кожного зуда, уменьшение уровня маркеров холестаза: ЩФ 373 Ед/л (до 258), ГГТП 92 Ед/л (до 49), билирубин 27,1 мкмоль/л (рис. 1).
Учитывая прием гепатотоксических препаратов как наиболее частый фактор риска развития VBDS, для оценки вероятности лекарственного поражения печени мы использовали шкалу RUCAM (оценка вероятности причинно-следственной связи при лекарственно-индуцированном поражении печени RousselUclaf, Roussel Uclaf Causality Assessment Method)3 [10]. При оценке по этой шкале у нашей пациентки имелась высокая вероятность (9 баллов) лекарственного повреждения печени, ассоциированного с приемом цефтриаксона. Такой результат был получен на основании имеющихся данных о гепатотоксичности препарата [11], данных анамнеза: от начала приема цефтриаксона до дебюта желтухи прошло менее трех месяцев, с момента отмены препарата до начала симптомов прошло менее одного месяца; оценки факторов риска: возраст старше 55 лет; результатов лабораторно-инструментального обследования: в течение 6 месяцев отмечалось снижение лабораторных маркеров холестаза более чем на 50%, исключены другие причины холестатического поражения печени.
ОБСУЖДЕНИЕ
Поражение печени с холестатическим паттерном не является уникальным для той или иной нозологической формы и встречается как при лекарственно-индуцированном поражении печени, так и при инфекции SARS-CoV-2 [4]. Верификация диагноза у нашей пациентки в первую очередь осложнялась отсутствием специфических изменений, которые могли бы сузить диагностический поиск, а также равнозначной вероятностью указанных выше причин для развития холестаза, что, по нашему мнению, представляет особый интерес и уникальность представленного случая. Гистологическая картина после перенесенной COVID-19 и лекарственно-индуцированного поражения печени крайне неспецифична, и не всегда морфологическое исследование позволяет сделать однозначный вывод в пользу того или иного диагноза.
Накопленный мировой опыт ведения пациентов с поражением гепатобилиарной системы позволяет выделить такие гепатобилиарные осложнения инфекции SARS-CoV-2, как развитие острого гепатита, вторичного склерозирующего холангита, аутоиммунного гепатита [4]. Необходимо отметить, что данные осложнения сопутствуют обычно тяжелому течению COVID-19.
В пандемию применялось множество схем лечения, которые часто включали гепатотоксичные лекарственные средства, для которых описана ассоциация с развитием VBDS. Среди препаратов, применяемых нашей пациенткой, таким препаратом был цефалоспорин 3-го поколения – цефтриаксон [8][11]. Механизм развития VBDS при применении цефтриаксона не ясен.
Примерно у двух третей пациентов с бессимптомным течением VBDS в течение 2–4 лет появляются клинические симптомы холестаза [8].
УДХК оказывает действие при холестатических заболеваниях печени посредством нескольких механизмов: повышает гидрофильный индекс циркулирующих желчных кислот, стимулирует гепатоцеллюлярную и протоковую секрецию, значимо улучшает защитные свойства клеток печени от воздействия гидрофобных желчных кислот и от повреждающего действия цитокинов, а также обладает противовоспалительным действием [12][13].
Данных по влиянию препаратов УДХК на VBDS в литературе нет ввиду редкой распространенности самого синдрома и отсутствия клинических исследований в этом аспекте. Препарат назначен с целью уменьшения выраженности холестаза, а также ввиду его антиапоптотического действия на клетки печени. По результатам исследования, проведенного Российским обществом по изучению печени в 2021 г., применение УДХК у пациентов с COVID-19 способствовало уменьшению активности системного воспаления, тем самым предупреждая повреждение печени, а значит и выраженное патологическое повышение показателей цитолиза при развивающейся инфекции [14]. Исследований, посвященных применению УДХК при СOVID-19, немного – в частности, в литературе описаны результаты положительного влияния УДХК на эпителий респираторного тракта [15]. Немаловажным эффектом УДХК является возможность регуляции процесса апоптоза, который чрезмерно выражен при коронавирусной инфекции [12][13][16][17].
У части пациентов заболевание прогрессирует с развитием вторичного билиарного цирроза, в 25% случаев формируется печеночная недостаточность и может потребоваться трансплантация печени. Медиана выживаемости после установки диагноза VBDS варьирует от 12 до 15 лет [1].
Несмотря на то что у нашей пациентки есть прогностически неблагоприятные факторы: женский пол, возраст старше 50 лет и тяжелая дуктопения по морфологическим данным, за все время наблюдения отсутствовали признаки печеночной недостаточности, наблюдалась выраженная положительная клиническая динамика и снижение маркеров холестаза, что может расцениваться как благоприятный прогноз [11].
ЗАКЛЮЧЕНИЕ
VBDS является редким осложнением лекарственного повреждения печени, который необходимо включать в круг дифференциальной диагностики при наличии клинического и биохимического синдрома холестаза. Наиболее часто встречается как осложнение лекарственной терапии (антибиотики пенициллинового и тетрациклинового ряда, ко-тримоксазол, препараты иммунобиологической терапии и некоторые другие), как проявление ВИЧ-инфекции, реакции «трансплантат против хозяина» и некоторых системных заболеваний (саркоидоз, гистиоцитоз). Диагноз может быть установлен только на основании гистологических данных (дуктопения вплоть до полного отсутствия желчных протоков в поле зрения).
Эффективного лечения VBDS не разработано, в ряде случаев могут быть использованы препараты УДХК. Прогноз зависит от обратимости дуктопении в течение 6 месяцев.
Для оценки вероятности гепатотоксичности препарата врач любой специальности может использовать шкалу RUCAM.
ВКЛАД АВТОРОВ
Н.Г. Вачеишвили внесла основной вклад в разработку концепции статьи, подготовила текст и согласна принять на себя ответственность за все аспекты клинического наблюдения. М.С. Жаркова, И.Н. Тихонов, Н.И. Трофимовская принимали активное участие в лечении пациентки, подготовке материалов и описании клинического наблюдения. В.Т. Ивашкин участвовал в разработке концепции статьи и подготовке текста. Т.П. Некрасова предоставила снимки и подготовила описание гистологического материала. Все авторы одобрили окончательную версию публикации.
AUTHORS CONTRIBUTIONS
Nino G. Vacheishvili developed the main concept of the article, wrote the text, and agreed to take responsibility for all aspects of the article. Maria S. Zharkova, Igor N. Tikhonov, Natalia I. Trofimovskaya took an active part in the treatment of the patient, preparation of materials and description of the clinical case. Vladimir T. Ivashkin participated in the development of the concept of the article and the preparation of the text. Tatiana P. Nekrasova provided pictures and description of the histological material. All authors approved the final version of the publication.
Соблюдение этических норм
Заявление о согласии. Пациентка дала согласие на публикацию статьи «Затяжная желтуха после перенесенной SARS-CoV-2-инфекции: клинический случай» в журнале «Сеченовский вестник».
Ethical compliance statement of consent
Consent statement. The patient has consented to the submission of the article “Prolonged jaundice after previous SARS-CoV-2 infection: a clinical case report” to the Sechenov Medical Journal.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012. Vanishing Bile Duct Syndrome. [Updated 2019 Dec 11]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK548715/ (дата обращения: 15.08.2022).
2. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012. Vanishing Bile Duct Syndrome. [Updated 2019 Dec 11]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK548715/ (дата обращения: 15.08.2022).
3. https://clincasequest.hospital/rucam-scale/ (дата обращения: 15.08.2022).
Список литературы
1. Fix O.K., Hameed B., Fontana R.J., et al. Clinical best practice advice for hepatology and liver transplant providers during the COVID-19 Pandemic: AASLD Expert Panel Consensus Statement. Hepatol 2020; 72(1): 287–304. https://doi.org/10.1002/hep.31281. PMID: 32298473
2. Li Y., Xiao S-Y. Hepatic involvement in COVID-19 patients: Pathology, pathogenesis, and clinical implications. J Med Virol. 2020; 92(9): 1491–1494. https://doi.org/10.1002/jmv.25973. PMID: 32369204
3. Zhao B., Ni C., Gao R., et al. Recapitulation of SARS-CoV-2 infection and cholangiocyte damage with human liver ductal organoids. Prot Cell. 2020; 11(10): 771–775. https://doi.org/10.1007/s13238-020-00718-6. PMID: 32303993
4. Faruqui S.M., Okoli F.C., Olsen S.K., et al. Cholangiopathy after severe COVID-19: Clinical features and prognostic implications. Am J Gastroenterol 2021; 116(7): 1414–1425. https://doi.org/10.14309/ajg.0000000000001264. PMID: 33993134
5. Sundaram V., Björnsson E.S. Drug-induced cholestasis. Hepatol Commun. 2017; 1: 726–735. http://doi.org/10.1002/hep4.1088. PMID: 29404489
6. Bakhit M., McCarty T.R., Park S., et al. Vanishing bile duct syndrome in Hodgkin’s lymphoma: A case report and literature review. World J Gastroenterol 2017; 14; 23(2): 366–372. https://doi.org/10.3748/wjg.v23.i2.366. PMID: 28127210
7. Anugwom C., Goetz G., Mohamed H. Vanishing bile duct syndrome preceding the diagnosis of Hodgkin Lymphoma. ACG Case Rep J 2020; 7(2): p e00336. https://doi.org/10.14309/crj.0000000000000336. PMID: 32440528
8. Bonkovsky H.L., Kleiner D.E., Gu J., et al. Clinical presentations and outcomes of bile duct loss caused by drugs and herbal and dietary supplements. Hepatol 2017; 65: 1267. https://doi.org/10.1002/hep.28967. PMID: 27981596
9. Conrad M.A., Cui J., Lin H.C. Sertraline-associated cholestasis and ductopenia consistent with vanishing bile duct syndrome. J Pediatr 2016; 169: 313. https://doi.org/10.1016/j.jpeds.2015.10.065. PMID: 26597434
10. Brennan P.N., Cartlidge P., Manship T., et al. Guideline review: EASL clinical practice guidelines: drug-induced liver injury (DILI). Front Gastroenterol. 2022; 13: 332–336. https://doi.org/10.1136/flgastro-2021-101886. PMID: 35722609
11. Guarino M., Perna B., Pastorelli A., et al. A case of ceftriaxone-induced liver injury and literature review. Inf Med. 2022; 30(2): 293–297. https://doi.org/10.53854/liim-3002-16. PMID: 35693049
12. Robles-Díaz M., Nezic L., Vujic-Aleksic V., Björnsson E.S. Role of ursodeoxycholic acid in treating and preventing idiosyncratic drug-induced liver injury. A systematic review. Front Pharmacol. 2021; 12: 744488. https://doi.org/10.3389/fphar.2021.744488. PMID: 34776963
13. Simental-Mendía M., Sánchez-García A., Simental-Mendía L.E. Effect of ursodeoxycholic acid on liver markers: A systematic review and meta-analysis of randomized placebo-controlled clinical trials. Br J Clin Pharmacol. 2020 Aug; 86(8): 1476–1488. https://doi.org/10.1111/bcp.14311. PMID: 32285958
14. Тихонов И.Н., Ивашкин В.Т., Жаркова М.С. и др. Результаты неинтервенционной наблюдательной программы «Влияние нового КОроНавируса на состояние пациентов с заболеваниями печени и желудочно-кишечного Тракта и влияние препаратов Урсодезоксихолевой кислоты и Ребамипида на течение инфекции COVID-19 (КОНТУР)». Медицинский совет. 2021; (21-1): 106–119. https://doi.org/10.21518/2079-701X-2021-21-1-106-119. EDN: IYMVUM
15. Thuy P.X., Duy Bao T.D., Moon E.Y. Ursodeoxycholic acid ameliorates cell migration retarded by the SARS-CoV-2 spike protein in BEAS-2B human bronchial epithelial cells. Biomed Pharmacother. 2022; 150: 113021. https://doi.org/10.1016/j.biopha.2022.113021. PMID: 35658221
16. Izzo P., Gallo G., Codacci Pisanelli M., et al. Vanishing bile duct syndrome in an adult patient: Case report and review of the literature. J. Clin. Med. 2022, 11, 3253. https://doi.org/10.3390/jcm11123253. PMID: 35743323
17. André S., Picard M., Cezar R., et al. T cell apoptosis characterizes severe COVID-19 disease. Cell Death Differ 2022; 29: 1486–1499. https://doi.org/10.1038/s41418-022-00936-x. PMID: 35066575
Об авторах
Н. Г. ВачеишвилиРоссия
Вачеишвили Нино Георгиевна - клинический ординатор кафедры внутренних болезней.
Ленинские горы, д. 1, Москва, 119991
Тел.: +7 (495) 932-88-14
М. С. Жаркова
Россия
Жаркова Мария Сергеевна - кандидат медицинских наук, заведующая отделением гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии имени В.Х. Василенко.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Т. П. Некрасова
Россия
Некрасова Татьяна Петровна - кандидат медицинских наук, доцент Института клинической морфологии и цифровой патологии.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
И. Н. Тихонов
Россия
Тихонов Игорь Николаевич - ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии; врач-гастроэнтеролог отделения гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии имени В.Х. Василенко.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Н. И. Трофимовская
Россия
Трофимовская Наталья Игоревна - врач-гастроэнтеролог; аспирант кафедры внутренних болезней.
Ленинские горы, д. 1, Москва, 119991
В. Т. Ивашкин
Россия
Ивашкин Владимир Трофимович - доктор медицинских наук, профессор, академик РАН, заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и гепатологии, директор Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии имени В.Х. Василенко.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Дополнительные файлы

|
1. Чек-лист CARE | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(20KB)
|
Метаданные ▾ | |







































