Перейти к:
Ангиопоэтин-1 как маркер эндотелиальной дисфункции и фактор риска острого почечного повреждения у больных COVID-19: ретроспективное когортное исследование
https://doi.org/10.47093/2218-7332.2022.13.4.33-44
Аннотация
В последнее время опубликованы данные о ведущем значении эндотелиальной дисфункции в развитии тяжелого течения COVID-19, в том числе острого повреждения почек (ОПП) и неблагоприятного прогноза в этой группе больных.
Цель. Определить роль ангиопоэтина-1 (Ang-1), маркера эндотелиальной дисфункции, в развитии ОПП у госпитализированных больных COVID-19.
Материалы и методы. В исследование были включены 76 пациентов с подтвержденной коронавирусной инфекцией. ОПП было диагностировано согласно критериям KDIGO 2012 г. у 44 пациентов (группа 1), 32 пациента без признаков дисфункции почек вошли в группу 2. Помимо стандартных клинико-лабораторных показателей, при поступлении определяли уровень Ang-1 в сыворотке крови иммуноферментным анализом. Для оценки факторов риска ОПП был применен логистический регрессионный анализ, вычислены отношения шансов и 95% доверительные интервалы (ДИ). Для оценки риска летального исхода построена регрессионная модель Кокса.
Результаты. Уровень Ang-1 в сыворотке крови был статистически значимо выше у пациентов с ОПП: 1,8 (1,5; 2,1) нг/мл против 1,58 (1,29; 1,7) нг/мл в группе 2, р < 0,01. У умерших пациентов уровень Ang-1 при поступлении был статистически значимо более высоким, чем у выживших: 1,91 (1,71; 2,32) нг/мл против 1,58 (1,34; 1,67) нг/мл соответственно, p = 0,0001. По данным монофакторного логистического регрессионного анализа установлено, что повышение Ang-1 > 1,66 нг/мл в сыворотке крови при поступлении является фактором риска развития ОПП у пациентов с COVID-19 (отношение шансов 5,7; 95% ДИ 1,7–19,1; р < 0,01). В регрессионной модели Кокса присоединение ОПП повышало абсолютный риск летального исхода: Hazard ratio = 5,159 (95% ДИ 1,839–14,469), p = 0,002.
Заключение. Обнаружение высокого уровня Ang-1 в сыворотке крови больных COVID-19 при поступлении в стационар является отражением системной эндотелиальной дисфункции, фактором риска ОПП и неблагоприятного прогноза.
Ключевые слова
Список сокращений:
Ang-1 – angiopoietin-1, ангиопоэтин-1
AUC – area under curve, площадь под ROC-кривой
COVID-19 – COrona VIrus Disease 2019, коронавирусное заболевание 2019 года
SARS-CoV-2 – Severe acute respiratory syndrome-related coronavirus 2, коронавирус тяжелого острого респираторного синдрома – 2
АГ – артериальная гипертензия
ДИ – доверительный интервал
ИВЛ – искусственная вентиляция легких
ЛДГ – лактатдегидрогеназа
ОПП – острое почечное повреждение
ОШ – отношение шансов
СД2 – сахарный диабет 2-го типа
СРБ – С-реактивный белок
ФК – функциональный класс
ФП – фибрилляция предсердий
ХБП – хроническая болезнь почек
ХСН – хроническая сердечная недостаточность
Весной 2020 года Всемирной организацией здравоохранения была объявлена пандемия коронавирусного заболевания (COrona VIrus Disease 2019, COVID-19), вызванного коронавирусом тяжелого острого респираторного синдрома – 2 (Severe acute respiratory syndrome-related coronavirus 2, SARS-CoV-2). С тех пор вирус стремительно распространялся по планете, став вызовом как для систем здравоохранения многих стран мира, так и для их социально-экономических институтов [1].
Основными органами-мишенями для вируса являются легкие, кишечник и почки [2]. Одно из серьезных осложнений инфекции – острое почечное повреждение (ОПП), имеющее неблагоприятное прогностическое значение в отношении исхода заболевания [3–5].
Частота развития ОПП у пациентов с COVID-19, получающих лечение в стационаре, составляет, по данным разных авторов, от 0,5 до 37% [4–6]. По данным крупного метаанализа, в который было включено в общей сложности около 50 тысяч пациентов с COVID-19 со всего мира, ОПП развилось у 10,6% пациентов, из них 17,9% потребовалась заместительная почечная терапия; летальность пациентов с ОПП составила 26,7% [7]. В другом исследовании ОПП было выявлено у 36,6% пациентов, при этом 89,7% из них получали лечение в условиях отделений интенсивной терапии и респираторную поддержку посредством механической вентиляции легких [4].
Следует отметить, что ОПП чаще осложняет течение COVID-19 у пожилых пациентов с множеством сопутствующих заболеваний. В некоторых исследованиях установлено, что факторами риска развития ОПП при COVID-19 являются возраст старше 65 лет, тяжелое течение инфекции, потребность в искусственной вентиляции легких (ИВЛ) и вазопрессорах, а также наличие у пациентов ряда сопутствующей патологии, например сахарного диабета 2-го типа (СД2) и сердечно-сосудистых заболеваний: хронической сердечной недостаточности (ХСН) и артериальной гипертензии (АГ) [7–9].
Несмотря на то что ОПП считается одним из основных осложнений COVID-19, ведущие механизмы повреждения почек остаются до конца не изученными. Обсуждают прямое цитопатическое воздействие вируса на почечный эпителий, влияние системного воспаления, коагулопатии и гипоксического повреждения почечной паренхимы [10][11]. Полагают, что эти факторы могут действовать опосредованно через эндотелиальную дисфункцию, которая вносит вклад в патогенез не только легочного, но и почечного повреждения.
Одним из маркеров эндотелиальной дисфункции является ангиопоэтин-1 (angiopoietin-1 (Ang-1)) [12][13]. В некоторых работах доказана прогностическая роль Ang-1 в прогрессировании почечного повреждения. Например, у пациентов с СД2, даже при сохранной функции почек, было выявлено статистически значимое повышение уровня Ang-1 в сыворотке, что позволяет обсуждать его в качестве раннего маркера диабетической нефропатии [14]. В других работах концентрация Ang-1 в сыворотке крови имела прогностическое значение в отношении 28-дневной смертности у пациентов с сепсисом, поступивших в отделения интенсивной терапии [15][16]. Обсуждается неблагоприятное прогностическое значение повышения ангиопоэтинов сыворотки как маркеров повреждения эндотелия и у больных COVID-19 [17].
Цель нашего исследования: определить роль Ang-1, маркера эндотелиальной дисфункции, в развитии ОПП у госпитализированных пациентов с COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ
Проведение клинического исследования одобрено Локальным этическим комитетом Сеченовского университета на заседании от 09.12.2021 (протокол № 22-21). Исследование проведено с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей» (1964 г., с последующими дополнениями, включая версию 2000 г.) и отраженных в ГОСТ 42-511-99 «Правила проведения качественных клинических испытаний в Российской Федерации» и действующих нормативных требованиях.
В наше ретроспективное когортное исследование включены пациенты с COVID-19, госпитализированные в Клинику им. Е.М. Тареева Университетской клинической больницы № 3 Сеченовского университета с 1 октября 2020 по 1 февраля 2021 г. Диагноз COVID-19 был установлен на основании положительного результата полимеразной цепной реакции мазка из рото- и носоглотки на SARS-COV-2 и/или типичной рентгенологической картины по данным компьютерной томографии органов грудной клетки.
ОПП диагностировали по динамике креатинина сыворотки крови в соответствии с критериями kdigo 2012 г.1. В обследуемую когорту вошли 76 пациентов с COVID-19, отобранные из основной группы, описанной в нашем предыдущем исследовании [18]. Из данной когорты 44 пациента вошли в группу с ОПП, развившимся во время госпитализации, к этим больным подобраны 32 пациента с нормальной функцией почек, сопоставимые по полу, возрасту, тяжести состояния при поступлении.
При поступлении оценивали демографические показатели – пол, возраст, наличие сопутствующих заболеваний: АГ, ишемической болезни сердца (инфаркта миокарда в анамнезе), фибрилляции предсердий (ФП), ХСН и ее функциональный класс (ФК) по NYHA (New York Heart Association, Нью-Йоркская кардиологическая ассоциация), СД2, хронической болезни почек (ХБП) и ее стадию, тяжесть поражения легких по данным компьютерной томографии. При поступлении и в динамике оценивали лабораторные показатели: лимфоциты, тромбоциты, уровни: С-реактивного белка (СРБ), ферритина, лактатдегидрогеназы (ЛДГ), креатинина, D-димера, фибриногена.
Уровень Ang-1 в сыворотке крови определяли при поступлении в стационар методом иммуноферментного анализа Human ELISA kit (CN-SEA008Hu) на Cloud-Clone Corp. (Китай). Чувствительность метода составила 0,09 нг/мл, разброс определения: 0,24–15,00 нг/мл.
Статистическая обработка данных
Данные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили). Нормальность распределения оценивали методом Колмогорова – Смирнова. Различия между группами анализировали непараметрическими методами с использованием U-критерия Манна – Уитни и Краскела – Уоллиса. Для сравнения качественных признаков применяли метод хи-квадрат и точный тест Фишера. Для определения корреляционных взаимосвязей между показателями использовали расчет коэффициента ранговой корреляции Спирмена (rs).
Расчет отношений шансов (ОШ) и 95% доверительного интервала (ДИ) для факторов, ассоциированных с развитием ОПП, проводили с помощью логистической регрессионной модели. В логистическую регрессионную модель оценки риска ОПП включили следующие показатели: сопутствующие заболевания – АГ, ХСН, ФП, максимальные уровни: СРБ, ферритина, D-димера, ЛДГ; минимальные уровни: фибриногена, числа лимфоцитов, тромбоцитов; концентрация Ang-1 при поступлении; потребность в ИВЛ. Проведен ROC-анализ и вычислена площадь под ROC кривой (area under curve, AUC).
Расчет абсолютного риска (Hazard ratio) летального исхода и 95% ДИ проводили в зависимости от наличия и стадии ОПП с помощью регрессии Кокса.
Минимальным порогом статистической значимости считали р < 0,05.
Статистическую обработку полученных данных проводили с помощью программы IBM SPSS v.23.0 (SPSS: An IBM Company, США).
РЕЗУЛЬТАТЫ
Среди 44 пациентов из группы 1 у 27 (61%) диагностирована стадия 1, у 10 (23%) – стадия 2, у 7 (16%) – стадия 3 ОПП. Лечение гемодиализом не потребовалось ни одному пациенту.
Характеристика обследованных пациентов представлена в таблице 1.
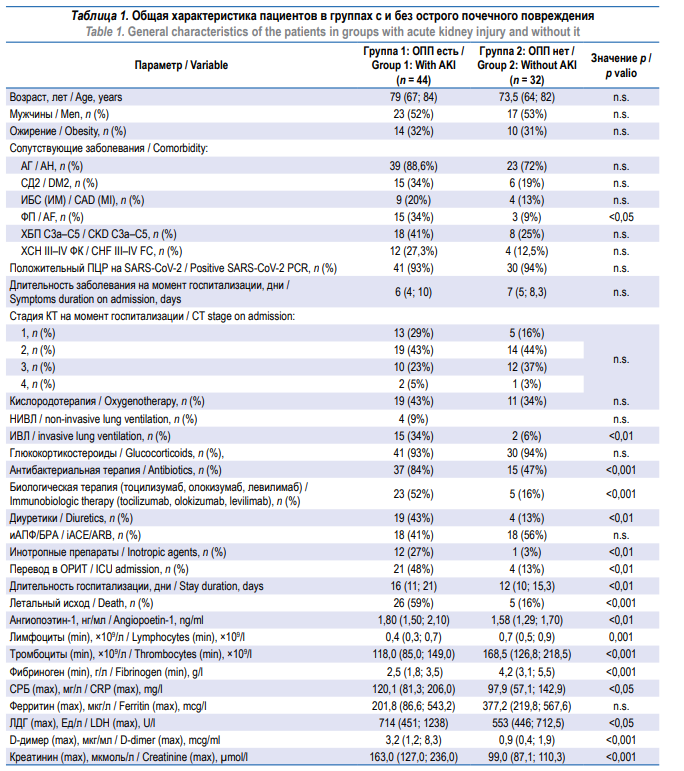
Примечание: n.s. – not significant, не значимо; АГ – артериальная гипертензия; СД2 – сахарный диабет 2-го типа; ИБС – ишемическая болезнь
сердца; ИМ – инфаркт миокарда; ФП – фибрилляция предсердий; ХБП – хроническая болезнь почек; ХСН – хроническая сердечная недостаточность; ФК – функциональный класс; ПЦР – полимеразная цепная реакция; SARS-CoV-2 – Severe acute respiratory syndrome-related
coronavirus 2, коронавирус тяжелого острого респираторного синдрома – 2; КТ – компьютерная томография; НИВЛ – неинвазивная вентиляция
легких; ИВЛ – инвазивная вентиляция легких; иАПФ – ингибиторы ангиотензин-превращающего фермента; БРА – блокаторы рецептора ангиотензина; ОРИТ – отделение реанимации и интенсивной терапии; СРБ – С-реактивный белок; ЛДГ – лактатдегидрогеназа.
Note: n.s. – not significant; AH – arterial hypertension; DM2 – diabetes mellitus type 2; CAD – coronary artery disease; MI – myocardial infarction; AF –
atrial fibrillation; CKD – chronic kidney disease; CHF – chronic heart failure; FC – functional class; SARS-CoV-2 – Severe acute respiratory syndromerelated coronavirus 2; CT – computed tomography; iACE – angiotensin converting enzyme inhibitor; ARB – angiotensin receptor blocker; ICU – intensive
care unit; CRP – C-reactive protein; LDH – lactate dehydrogenase.
Статистически значимых различий по частоте СД2, ожирения, ХБП, перенесенного инфаркта миокарда между группами не установлено. Среди сопутствующих заболеваний у пациентов с ОПП чаще выявлялась ФП (34% vs 9%, p < 0,05). В группе 1 отмечены более высокие показатели маркеров воспаления (СРБ, ЛДГ), D-димера и креатинина и более низкое число лимфоцитов, тромбоцитов и уровня фибриногена во время госпитализации. В группе 1 большее количество пациентов нуждались в назначении антибактериальных, генно-инженерных биологических препаратов, диуретиков, инотропной поддержке. В этой группе статистически значимо чаще требовались ИВЛ, перевод в отделение реанимации и интенсивной терапии и чаще наблюдался летальный исход. Группы не различались по площади вовлечения легочной ткани, оцененной по данным компьютерной томографии легких при поступлении, частоте назначения глюкокортикостероидов, ингибиторов ангиотензин-превращающего фермента / блокаторов рецепторов ангиотензина II.
Концентрация Ang-1 в сыворотке крови была статистически значимо выше у пациентов с ОПП различных стадий, чем в группе с сохранной функцией почек (рис. 1).
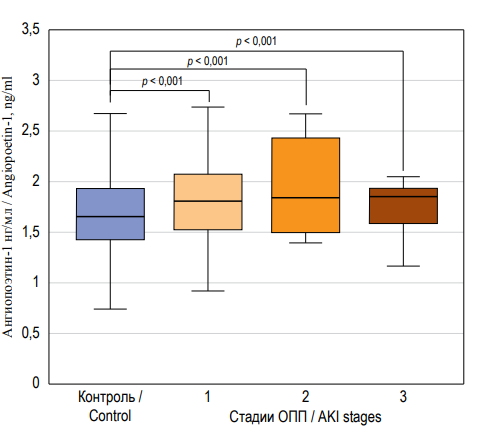
РИС. 1. Уровень ангиопоэтина-1 в сыворотке крови
при разных стадиях острого почечного повреждения
FIG. 1. Serum angiopoetin-1 levels at different stages of acute
kidney injury
Примечание: ОПП – острое повреждение почек.
Note: AKI – acute kidney injury.
Медиана времени от момента госпитализации / определения Ang-1 в сыворотке крови до развития ОПП составила 6 (1,0; 11,25) дней. Высокий уровень Ang-1 при поступлении предсказывал перевод пациентов на ИВЛ и прогнозировал летальный исход. Так, у пациентов, переведенных впоследствии на ИВЛ, концентрация Ang-1 при поступлении составила 1,88 (1,73; 2,12) нг/мл, а в подгруппе без ИВЛ 1,60 (1,38; 1,83) нг/мл, р = 0,017. У умерших пациентов уровень Ang-1 в сыворотке крови при поступлении был статистически значимо более высоким, чем у выживших – 1,91 (1,71; 2,32) нг/мл vs 1,58 (1,34; 1,67) нг/мл соответственно
(p = 0,0001).
В группе пациентов с ОПП выявлены прямые статистически значимые корреляции между концентрацией Ang-1 и максимальными уровнями СРБ, ЛДГ и D-димера, уровнем креатинина при поступлении и его максимальными значениями, потребностью в ИВЛ, летальным исходом; обратные корреляции установлены с минимальным количеством лимфоцитов, тромбоцитов и уровнем фибриногена. Установлена прямая корреляционная связь между концентрацией Ang-1 и стадиями ОПП (rs = 0,323; р < 0,01). В группе пациентов без ОПП статистически значимых корреляций концентрации Ang-1 с другими показателями выявлено не было (табл. 2).
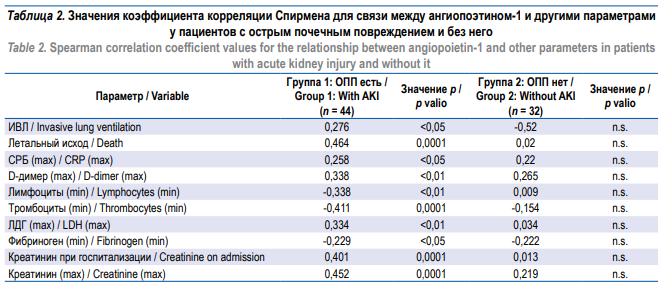
Примечание: ИВЛ – инвазивная вентиляция легких; n.s. – not significant, не значимо; СРБ – С-реактивный белок; ЛДГ – лактатдегидрогеназа.
Note: n.s. – not significant; CRP – C-reactive protein; LDH – lactate dehydrogenase.
Регрессионный анализ
При проведении монофакторного логистического регрессионного анализа значимое влияние на развитие ОПП имели: наличие ФП, потребность в ИВЛ, повышение Ang-1 более 1,66 нг/мл, снижение лимфоцитов менее 0,6×109/л, а также снижение фибриногена менее 2,5 г/л (табл. 3).
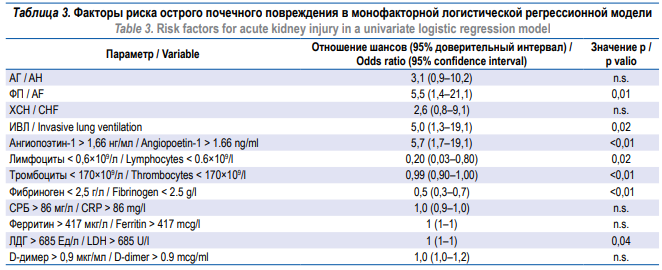
Примечание: n.s. – not significant, не значимо; АГ – артериальная гипертензия; ФП – фибрилляция предсердий; ХСН – хроническая сердечная
недостаточность; ИВЛ – инвазивная вентиляция легких; СРБ – С-реактивный белок; ЛДГ – лактатдегидрогеназа.
Note: n.s. – not significant; AH – arterial hypertension; AF – atrial fibrillation; CHF – chronic heart failure; CRP – C-reactive protein; LDH – lactate
dehydrogenase.
Для определения прогностической значимости концентрации Ang-1 в сыворотке крови в отношении риска развития ОПП был проведен ROC-анализ. Для прогнозирования ОПП точка разделения (cut-off) концентрации Ang-1 составила 1,66 нг/мл с чувствительностью 66% и специфичностью 70%, AUC 0,696 (95% ДИ 0,579–0,814), p = 0,004 (рис. 2).
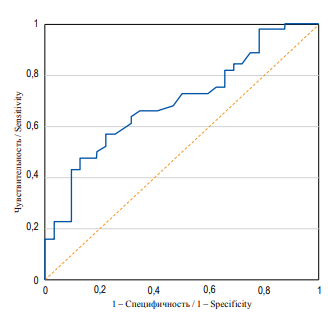
РИС. 2. ROC-кривая для ангиопоэтина-1
FIG. 2. ROC curve for angiopoetin-1
В регрессионной модели Кокса присоединение ОПП повышало абсолютный риск летального исхода (Hazard ratio) в общей группе пациентов с COVID-19: в 5,159 раза (95% ДИ 1,839–14,469), p = 0,002; при ОПП 1 стадии – в 1,346 раза (95% ДИ 0,523–3,467), p = 0,201; ОПП 2-й стадии – в 3,25 раза (95% ДИ 1,06–9,967), p = 0,039 и ОПП 3-й стадии – в 6 раз (95% ДИ 1,722–49,840), p = 0,047.
ОБСУЖДЕНИЕ
По данным нашего исследования, у пациентов с COVID-19 при развитии ОПП преобладает первая стадия: 61% от всех пациентов с ОПП, отражающая небольшое повышение креатинина сыворотки крови (не более чем в 2 раза от исходного уровня). Хотя в целом присоединение ОПП имеет неблагоприятное влияние на течение болезни, именно тяжелое повреждение почек – вторая и третья стадии ОПП – ассоциированы с более высоким риском летального исхода в этой когорте. По данным мировых исследований и опубликованного нами ранее исследования в российской когорте, частота развития ОПП среди больных COVID-19 составляет от 29 до 43,5% [19] и значимо не меняется в зависимости от циркулирующего штамма вируса и течения болезни, что может быть связано с более широким применением иммуносупрессивных препаратов, в том числе кортикостероидов и генно-инженерных биологических препаратов для лечения COVID-19 [20][21].
Вторая и третья стадии ОПП в нашем исследовании повышали абсолютный риск летального исхода в 3,3 и 6,0 раза соответственно, что сопоставимо с данными мировой литературы. Например, Н. Ali и соавт. [6] выявили, что развитие тяжелого повреждения почек повышает смертность в 4,2 раза. По данным L. Lin и соавт. [7], присоединение ОПП повышало риск неблагоприятного исхода в 11 раз. До настоящего времени неизвестны ведущие механизмы почечного повреждения при COVID-19 и факторы риска этого осложнения.
Предполагают, что развитие ОПП ассоциировано с рядом сопутствующих заболеваний, таких как АГ, СД2 и ХБП С3а–С5. В самом крупном исследовании, в которое было включено 13 тысяч пациентов с ОПП, наиболее значимыми сопутствующими заболеваниями являлись: СД2 (24,7%), ХБП (17,5%) и ожирение (14,2%) [22]. По данным проспективного исследования RECOVERY Collaborative Group [23][24], наличие ХБП С3а–С5 повышало риск развития ОПП в 1,6 раза. В исследовании J.S. Hirsch и соавт. [4] независимыми факторами риска развития ОПП являлись АГ (ОШ 1,25; 95% ДИ 1,04–1,50) и СД2 (ОШ 1,76; 95% ДИ 1,49–2,07). В работе S. Genovesi и соавт. [25] одним из частых сопутствующих заболеваний была ФП (6%). Авторы показали, что она повышает риск развития ОПП в 2,2 раза, и полагают, что это может быть связано с нестабильностью гемодинамики, приводящей к снижению фракции выброса левого желудочка и в итоге к снижению перфузии почечной ткани. В нашей когорте с ОПП преобладали больные с АГ, ФП, ХСН высоких функциональных классов.
По данным монофакторного анализа, риск ОПП повышался при снижении числа лимфоцитов периферической крови. В ряде работ продемонстрирована ассоциация лимфопении с тяжестью вирусной инфекции, в частности выраженностью дыхательной недостаточности [26]. Кроме того, риск ОПП, по нашим данным, повышался при снижении уровня фибриногена, что также согласуется с данными мировой литературы [27].
Среди механизмов почечного повреждения при COVID-19 обсуждают непосредственное влияние самого вируса и опосредованное воздействие факторов воспаления, отражающих цитокиновый шторм, однако в нашей регрессионной модели показатели воспаления (СРБ, ферритин) не продемонстрировали себя как значимые факторы риска ОПП. Поэтому вопрос о ведущем механизме ОПП – важном предикторе смерти больных COVID-19, остается дискуссионным.
Мы изучили в нашей когорте Ang-1, один из маркеров эндотелиальной дисфункции, и установили, что его уровень при поступлении был статистически значимо выше у пациентов с развитием в дальнейшем ОПП. В регрессионной модели факторами риска ОПП кроме повышенного уровня Ang-1 при поступлении являлись ФП, сниженный уровень фибриногена и числа лимфоцитов, а также потребность в ИВЛ.
Нами также были выявлены статистически значимые корреляции Ang-1 с уровнем СРБ и ЛДГ, а также степенью лимфопении в группе пациентов с ОПП. Ang-1 является антагонистом рецептора Tie-2, принадлежащего к семейству тирозинкиназ, синтезируется перицитами и гладкомышечными клетками сосудов. Ang-1, связываясь с Tie-2, участвует в поддержании стабильности сосудистой стенки, росте и ремоделировании сосудов, а во время воспаления регулирует проницаемость и тонус сосудов посредством оксида азота. Кроме того, Ang-1 является маркером эндотелиальной дисфункции [17][28].
По-видимому, не столько сами факторы воспаления, а индуцированная под действием этих факторов эндотелиальная дисфункция имеет значение в прогрессировании повреждений. Процесс эндотелиальной дисфункции приводит к активации свертывания крови и тромбообразования, о чем также свидетельствует корреляция уровня Ang-1 с концентрацией D-димера, количеством потребляемых тромбоцитов и фибриногена в группе пациентов с ОПП.
Выявление повышенного уровня Ang-1 в нашем исследовании является признаком системной (генерализованной) эндотелиальной дисфункции, лежащей в основе ОПП, и развития тяжелых осложнений COVID-19, приводящих к летальному исходу. При этом полученные нами данные согласуются с результатами работ зарубежных исследователей, выявивших высокую прогностическую значимость уровня Ang-1 в сыворотке в отношении 28-дневной смертности у пациентов с бактериальным сепсисом [16].
Определение Ang-1 в сыворотке крови может использоваться в клинической практике для оценки вероятности развития ОПП в группе больных COVID-19 на этапе госпитализации пациента в стационар. Более того, мы полагаем, что Ang-1 может являться универсальным маркером эндотелиальной дисфункции и фактором риска ОПП у больных с сепсисом, что обосновывает важность проведения дальнейших исследований в этом направлении.
Ограничением нашего исследования являлось небольшое число наблюдений. Ang-1 был исследован только у пациентов, госпитализированных в стационар. Мы не исследовали этот фактор в крови здоровых людей, больных с легким течением COVID-19, а также при переводе пациентов на ИВЛ, что не позволяет экстраполировать полученные данные на всех больных COVID-19.
ЗАКЛЮЧЕНИЕ
Одним из прогностически значимых осложнений COVID-19 является ОПП. Риск развития этого осложнения определяется несколькими факторами, включающими наличие АГ и ФП, тяжелое течение коронавирусной инфекции и гипоксемию, а также активацию микротромбообразования с потреблением фибриногена. Однако ранним нарушением, ассоциированным с развитием ОПП при COVID-19, может являться системная эндотелиальная дисфункция, которая влияет на почечный и общий прогноз пациента и может быть оценена с помощью определения уровня Ang-1 в сыворотке крови при поступлении.
ВКЛАД АВТОРОВ
А.А. Щепалина провела сбор материала, составление базы данных, статистическую обработку и написание чернового варианта статьи. Н.В. Чеботарева внесла основной вклад в разработку концепции статьи, статистическую обработку данных. Л.А. Акулкина провела сбор литературных данных и их анализ, статистическую обработку данных. М.Ю. Бровко, В. И. Шоломова и П.П. Потапов проводили сбор первичных данных. Д.С. Валиулина отрабатывала методику определения ангиопоэтина-1 в сыворотке крови у больных covid-19, проводила построение стандартной кривой. С.С. Моисеев предложил идею исследования, разработал концепцию статьи, провел редактирование текста. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTION
Anastasia A. Schepalina contributed to data collection, preparing the database, statistical analysis, writing a draft article. Natalia V. Chebotareva made a significant contribution to the concept of the article, statistical analysis. Larisa A. Akulkina contributed to collection and analysis of literature data, statistical analysis. Mikhail Yu. Brovko, Viktoriya I. Sholomova, and Pavel P. Potapov collected the material. Dinar S. Valiulina developed the methods of serum angiopoetin-1 levels assessment in patients with COVID-19, calculated the standard concentration curve. Sergey V. Moiseev proposed study concept and design, contributed to the concept of the article and edited the text. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Благодарности. Авторы выражают благодарность руководителю Централизованной лабораторно-диагностической службы Сеченовского Университета Н.М. Кашакановой и заведующей межклинической биологической лабораторией Централизованной лабораторно-диагностической службы Сеченовского Университета А.Ю. Федоровой за помощь в проведении иммуноферментного анализа для определения концентрации ангиопоэтина-1 в сыворотке крови.
Conflict of interests. The authors declare that is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Acknowledgments. Authors would like to thank Natalia M. Kashakanova, Head of the Central laboratory and diagnostic service of Sechenov University, and Alina Yu. Fedorova, Head of interclinical biochemical department of the Central laboratory and diagnostic service of Sechenov University for assistance in measuring the concentration of angiopoetin-1 with the enzyme-linked immunosorbent assay.
1. https://kdigo.org/wp-content/uploads/2016/10/KDIGO-AKI_Russian.pdf (дата обращения: 05.09.2022).
Список литературы
1. Hu B., Guo H., Zhou P., Shi Z.L. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol. 2021 Mar; 19(3): 141–154. https://doi.org/10.1038/s41579-020-00459-7. Epub 2020 Oct 6. Erratum in: Nat Rev Microbiol. 2022 May; 20(5): 315. PMID: 33024307.
2. Guan W.J., Ni Z.Y., Hu Y., et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020 Apr 30; 382(18): 1708–1720. https://doi.org/10.1056/NEJMoa2002032. Epub 2020 Feb 28. PMID: 32109013.
3. Prasad N., Novak J.E., Patel M.R. Kidney diseases associated with Parvovirus B19, Hanta, Ebola, and Dengue virus infection: A brief review. Adv Chronic Kidney Dis. 2019 May; 26(3): 207–219. https://doi.org/10.1053/j.ackd.2019.01.006. PMID: 31202393.
4. Hirsch J.S., Ng J.H., Ross D.W., et al. Acute kidney injury in patients hospitalized with COVID-19. Kidney Int. 2020 Jul; 98(1): 209–218. https://doi.org/10.1016/j.kint.2020.05.006. Epub 2020 May 16. PMID: 32416116.
5. Diao B., Wang C., Wang R., et al. Human kidney is a target for novel severe acute respiratory syndrome coronavirus 2 infection. Nat Commun. 2021 May 4; 12(1): 2506. https://doi.org/10.1038/s41467-021-22781-1. PMID: 33947851.
6. Ali H., Daoud A., Mohamed M.M., et al. Survival rate in acute kidney injury superimposed COVID-19 patients: a systematic review and meta-analysis. Ren Fail. 2020 Nov; 42(1): 393–397. https://doi.org/10.1080/0886022X.2020.1756323. PMID: 32340507.
7. Lin L., Wang X., Ren J., et al. Risk factors and prognosis for COVID-19-induced acute kidney injury: a meta-analysis. BMJ Open. 2020 Nov 10; 10(11): e042573. https://doi.org/10.1136/bmjopen-2020-042573. PMID: 33172950.
8. Wang D., Hu B., Hu C., et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020 Mar 17; 323(11): 1061–1069. https://doi.org/10.1001/jama.2020.1585. Erratum in: JAMA. 2021 Mar 16; 325(11): 1113. PMID: 32031570.
9. Wang L., Li X., Chen H., et al. Coronavirus disease 19 infection does not result in acute kidney injury: an analysis of 116 hospitalized patients from Wuhan, China. Am J Nephrol. 2020; 51(5): 343–348. https://doi.org/10.1159/000507471. Epub 2020 Mar 31. PMID: 32229732.
10. Su H., Yang M., Wan C., et al. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020 Jul; 98(1): 219–227. Epub 2020 Apr 9. https://doi.org/10.1016/j.kint.2020.04.003. PMID: 32327202.
11. Li X.Q., Liu H., Meng Y., et al. Critical roles of cytokine storm and secondary bacterial infection in acute kidney injury development in COVID-19: A multi-center retrospective cohort study. J Med Virol. 2021 Dec; 93(12): 6641–6652. https://doi.org/10.1002/jmv.27234. Epub 2021 Aug 14. PMID: 34314040.
12. van der Heijden M., Pickkers P., van Nieuw Amerongen G.P., et al. Circulating angiopoietin-2 levels in the course of septic shock: relation with fluid balance, pulmonary dysfunction and mortality. Intensive Care Med. 2009 Sep; 35(9): 1567–1574. Epub 2009 Jun 24. https://doi.org/10.1007/s00134-009-1560-y. PMID: 19551369.
13. Maisonpierre P.C., Suri C., Jones P.F., et al. Angiopoietin-2, a natural antagonist for Tie2 that disrupts in vivo angiogenesis. Science. 1997 Jul 4; 277(5322): 55–60. https://doi.org/10.1126/science.277.5322.55. PMID: 9204896.
14. Butler A.E., Al-Qaissi A., Sathyapalan T., Atkin S.L. Angiopoietin-1: an early biomarker of diabetic nephropathy? J Transl Med. 2021 Oct 13; 19(1): 427. https://doi.org/10.1186/s12967-021-03105-9. PMID: 34645474.
15. Hall A., Busse L.W., Ostermann M. Angiotensin in critical care. Crit Care. 2018 Mar 20; 22(1): 69. https://doi.org/10.1186/s13054-018-1995-z. PMID: 29558991.
16. Ricciuto D.R., dos Santos C.C., Hawkes M., et al. Angiopoietin-1 and angiopoietin-2 as clinically informative prognostic biomarkers of morbidity and mortality in severe sepsis. Crit Care Med. 2011 Apr; 39(4): 702–710. https://doi.org/10.1097/CCM.0b013e318206d285. PMID: 21242795.
17. Henry B.M., de Oliveira M.H.S., Cheruiyot I., et al. Circulating level of Angiopoietin-2 is associated with acute kidney injury in coronavirus disease 2019 (COVID-19). Angiogenesis. 2021 Aug; 24(3): 403–406. Epub 2021 Mar 23. https://doi.org/10.1007/s10456-021-09782-w. PMID: 33755876.
18. Щепалина А.А., Чеботарева Н.В., Китбалян А.А. и др. Факторы риска повреждения почек у пациентов с острой коронавирусной инфекцией COVID-19. Терапевтический архив. 2022; 94(6): 743–747. https://doi.org/10.26442/00403660.2022.06.201568. PMID: 36286851.
19. Shah S.J., Barish P.N., Prasad P.A., et al. Clinical features, diagnostics, and outcomes of patients presenting with acute respiratory illness: A retrospective cohort study of patients with and without COVID-19. EClinicalMedicine. 2020 Oct; 27: 100518. Epub 2020 Aug 26. https://doi.org/10.1016/j.eclinm.2020.100518. PMID: 32864588.
20. Chan L., Chaudhary K., Saha A., et al. AKI in hospitalized patients with COVID-19. J Am Soc Nephrol. 2021 Jan; 32(1): 151–160. Epub 2020 Sep 3. https://doi.org/10.1681/ASN.2020050615. PMID: 32883700.
21. Feng X., Li P., Ma L., et al. Clinical characteristics and shortterm outcomes of severe patients with COVID-19 in Wuhan, China. Front Med (Lausanne). 2020 Aug 6; 7: 491. https://doi.org/10.3389/fmed.2020.00491. PMID: 32850926.
22. Sullivan M.K., Lees J.S., Drake T.M., et al. Acute kidney injury in patients hospitalized with COVID-19 from the ISARIC WHO CCP-UK Study: a prospective, multicentre cohort study. Nephrol Dial Transplant. 2022 Jan 25; 37(2): 271–284. https://doi.org/10.1093/ndt/gfab303. PMID: 34661677.
23. RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2021 May 1; 397(10285): 1637–1645. https://doi.org/10.1016/S01406736(21)00676-0. PMID: 33933206.
24. RECOVERY Collaborative Group, Horby P., Lim W.S., et al. Dexamethasone in hospitalized patients with Covid-19. N Engl J Med. 2021 Feb 25; 384(8): 693–704. https://doi.org/10.1056/NEJMoa2021436. Epub 2020 Jul 17. PMID: 32678530.
25. Genovesi S., Rebora P., Occhino G., et al. Atrial fibrillation and clinical outcomes in a cohort of hospitalized patients with SarsCov-2 Infection and Chronic Kidney Disease. J Clin Med. 2021 Sep 11; 10(18): 4108. https://doi.org/10.3390/jcm10184108. PMID: 34575219.
26. Rydyznski Moderbacher C., Ramirez S.I., Dan J.M., et al. Antigen-Specific adaptive immunity to SARS-CoV-2 in acute COVID-19 and associations with age and disease severity. Cell. 2020 Nov 12; 183(4): 996–1012.e19. Epub 2020 Sep 16. https://doi.org/10.1016/j.cell.2020.09.038. PMID: 33010815.
27. Panigada M., Bottino N., Tagliabue P., et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost. 2020 Jul; 18(7): 1738–1742. Epub 2020 Jun 24. https://doi.org/10.1111/jth.14850. PMID: 32302438.
28. Lukasz A., Hellpap J., Horn R., et al. Circulating angiopoietin-1 and angiopoietin-2 in critically ill patients: development and clinical application of two new immunoassays. Crit Care. 2008; 12(4): R94. Epub 2008 Jul 29. https://doi.org/10.1186/cc6966. PMID: 18664247.
Об авторах
А. А. ЩепалинаРоссия
Щепалина Анастасия Александровна, аспирант кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Тел.: +7 (989) 836-21-31
Н. В. Чеботарева
Россия
Чеботарева Наталья Викторовна, д-р мед. наук, врач-
нефролог, профессор кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Л. А. Акулкина
Россия
Акулкина Лариса Анатольевна, врач-пульмонолог, ассистент кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
М. Ю. Бровко
Россия
Бровко Михаил Юрьевич, канд. мед. наук, врач-пульмонолог, доцент кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
В. И. Шоломова
Россия
Шоломова Виктория Игоревна, канд. мед. наук, врач-пульмонолог, ассистент кафедры внутренних, профессиональных болезней и ревматологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
П. П. Потапов
Россия
Потапов Павел Петрович, врач-терапевт Университетской клинической больницы № 3; аспирант кафедры внутренних болезней факультета фундаментальной медицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ленинские горы, д. 1, г. Москва, 119991
Д. С. Валиулина
Россия
Валиулина Динар Сандаровна, врач лабораторной диагностики, биолог Централизованной лабораторно-диагностической службы
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
С. В. Моисеев
Россия
Моисеев Сергей Валентинович, член.-корр. РАН, д-р мед. наук, профессор, зав. кафедрой внутренних, профессиональных болезней и ревматологии, директор Клиники ревматологии, нефрологии и профпатологии им. Е.М. Тареева Университетской клинической больницы № 3; профессор кафедры внутренних болезней факультета фундаментальной медицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Ленинские горы, д. 1, г. Москва, 119991
Дополнительные файлы

|
1. STROBE чек-лист | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(166KB)
|
Метаданные ▾ | |
Рецензия
JATS XML