РУКОВОДСТВО ПО БИОМЕДИЦИНСКОЙ СТАТИСТИКЕ
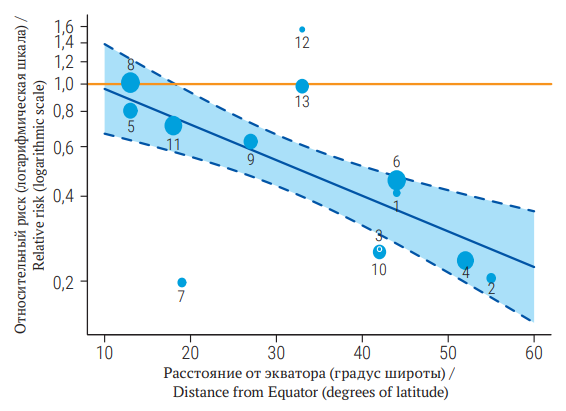
Мета-анализ объединяет результаты нескольких научных исследований для получения обобщенной количественной оценки величины эффекта, для сравнения результатов нескольких исследований, выявления в них закономерностей и возможных источников разногласий. Поскольку оригинальные научные исследования проводятся разными коллективами авторов, с разными пациентами, в разные временные промежутки, по разным протоколам и клиническим рекомендациям, все перечисленные факторы могут оказывать влияние на результаты отдельно взятого исследования, обусловливая статистическую гетерогенность. Мета- анализы занимают высшую степень достоверности в концепции доказательной медицины, так как позволяют учитывать влияние множества вмешивающихся факторов и публикационных смещений на истинный размер эффекта. Понимание возможных источников ошибочных заключений в исследованиях позволит научным сотрудникам критически относиться к интерпретации результатов и корректно планировать собственные эксперименты. В настоящей статье читатель познакомится с методами выявления и количественной оценки скрытой гетерогенности, такими как анализ подгрупп и метарегрессионный анализ. Кроме того, читатель научится производить расчет размера эффекта в исследованиях, математически и графически оценивать публикационные смещения, а также учитывать эту оценку при проведении мета-анализа в общей усредненной оценке размера эффекта.
КЛЕТОЧНАЯ БИОЛОГИЯ, ЦИТОЛОГИЯ, ГИСТОЛОГИЯ
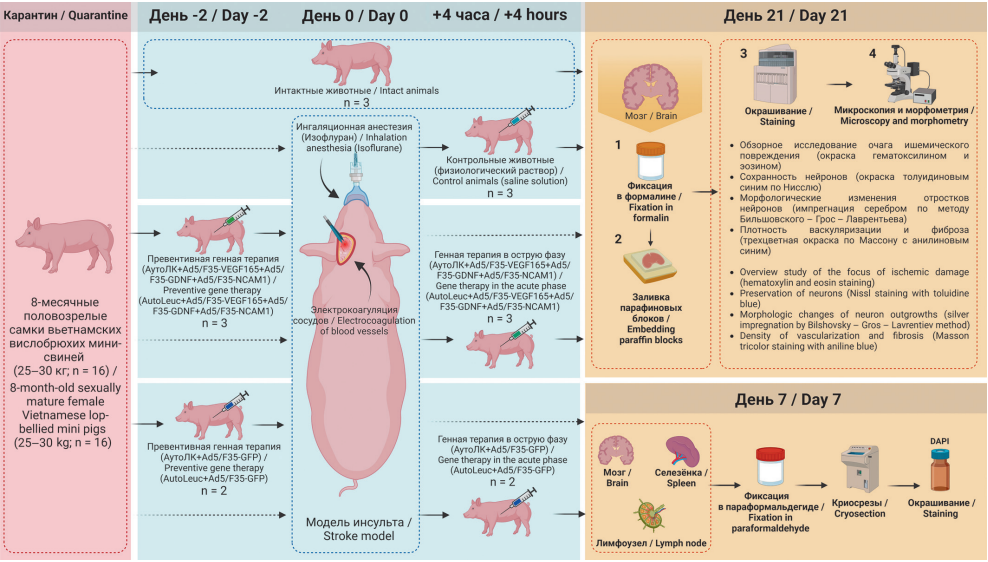
Цель. Изучить эффективность превентивной генной терапии (за 2 суток) и генной терапии в острую фазу (через 4 часа) ишемического инсульта у мини-свиньи с помощью аутологичного лейкоконцентрата (АутоЛК), обогащенного рекомбинантными генами сосудистого эндотелиального фактора роста (VEGF165), глиального нейротрофического фактора (GDNF) и нейрональной молекулы клеточной адгезии 1 (NCAM1), а также миграцию лейкоцитов, трансдуцированных химерным аденовирусным вектором 5 серотипа с фибером 35 серотипа (Ad5/F35) и геном зеленого флуоресцентного белка (GFP) в органы иммунной защиты.
Материалы и методы. Эксперимент проведен на 8-месячных вьетнамских вислобрюхих мини-свиньях (n = 16). Ишемический инсульт создавали путем окклюзии дистальных ветвей левой средней мозговой артерии и правой общей сонной артерии. Генетически модифицированный АутоЛК вводили превентивно внутривенно за 2 суток до или в острую фазу через 4 часа после моделирования инсульта, контрольной группе вводили 30 мл физиологического раствора. Морфологию коры мозга оценивали с помощью гистологических методов в пограничной с инфарктом и периинфарктной зонах через 21 сутки. Миграцию генетически модифицированных Ad5/F35-GFP лейкоцитов в головной мозг, селезенку, поднижнечелюстные лимфоузлы изучали через неделю после моделирования инсульта.
Результаты. В периинфарктной зоне содержание пикнотических нейронов у контрольных животных было выше, при этом количество капилляров было меньше, чем в группах генной терапии. У последних нейроны имели типичную морфологию с сохранными отростками, в контрольной группе отростки были извилисты и фрагментированы. Флуоресцентная микроскопия после введения АутоЛК с Ad5/F35-GFP выявила GFPпозитивные клетки в селезенке и поднижнечелюстных лимфатических узлах.
Заключение. Через 21 сутки после моделирования инсульта у мини-свиней на фоне превентивной генной терапии или генной терапии в острую фазу с помощью VEGF165/GDNF/NCAM1-АутоЛК установлена большая сохранность нейронов и выше плотность капилляров в периинфарктной зоне ишемического повреждения мозга. Лейкоциты с Ad5/F35-GFP обнаружены в селезенке и поднижнечелюстных лимфатических узлах.
ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ
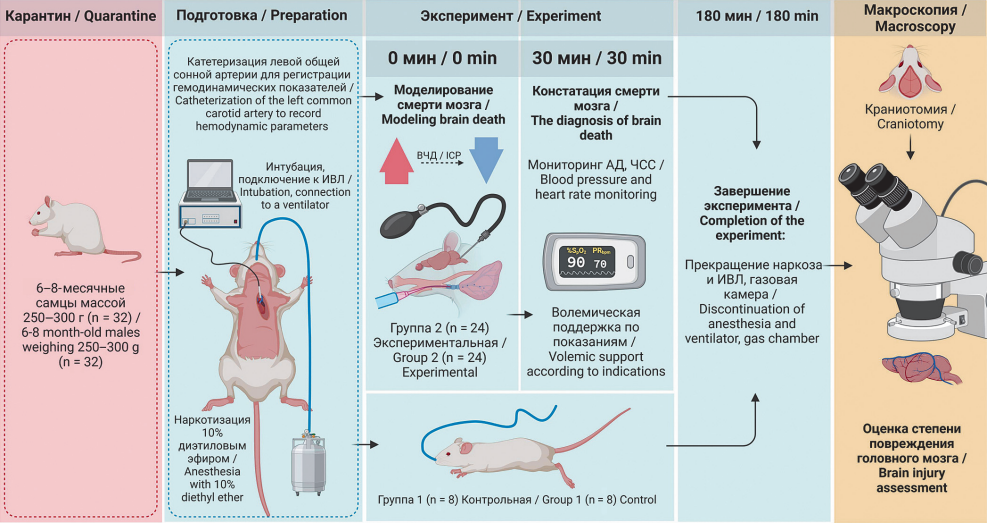
Цель. Апробировать в эксперименте патогенетически адекватную модель смерти мозга вследствие повышения внутричерепного давления с постепенной индукцией, позволяющую оценивать изменения, развивающиеся в органах потенциального донора.
Материалы и методы. 6–8-месячных беспородных крыс-самцов экспериментальной группы (n = 18) и контрольной группы (n = 8) наркотизировали, катетеризировали левую общую сонную артерию для регистрации систолического, диастолического артериального давления (АД) и частоты сердечных сокращений (ЧСС), рассчитывали среднее АД (АДср.). После перевода на искусственную вентиляцию легких в экспериментальной группе моделировали смерть мозга по разработанной методике.
Результаты. У всех животных в экспериментальной группе через 30 мин от начала эксперимента констатирована смерть мозга, в течение 3 ч вследствие прогрессирования недостаточности кровообращения погибло 10 крыс (56%). Исходно у наркотизированных животных АДср. составило 101 (90; 105) мм рт. ст., ЧСС 310 (297; 315) уд./мин. Через 5 мин от начала индукции смерти мозга АДср. повысилось до 147 (140; 150) мм рт. ст. (p = 0,01), ЧСС до 396 (384; 406) уд./мин (р = 0,03), затем в течение 20 мин АДср. постепенно снижалось до 94 (90; 100) мм рт. ст., ЧСС до 290 уд./мин. С 26 до 90 мин АДср. стабилизировалось на уровне 87–92 мм рт. ст., ЧСС от 263 до 274 уд/мин (p = 0,01), далее через 120–150 мин АДср. продолжало снижаться до 75–80 мм рт. ст. (p = 0,03), ЧСС до 256–264 уд./мин (p = 0,01). К завершению эксперимента, несмотря на волемическую поддержку, у животных продолжалось снижение АДср. до 64 (61; 67) мм рт. ст. (р = 0,02), усугублялась брадикардия до 250 (248; 260) уд./мин (р = 0,01), что свидетельствует о развитии декомпенсации гемодинамических расстройств.
Заключение. Апробация модели смерти мозга потенциального донора с постепенной индукцией на беспородных крысах показала себя патогенетически адекватной и позволяющей оценивать состояние потенциальных донорских органов в течение 3 ч после индукции смерти мозга.
ОНКОЛОГИЯ
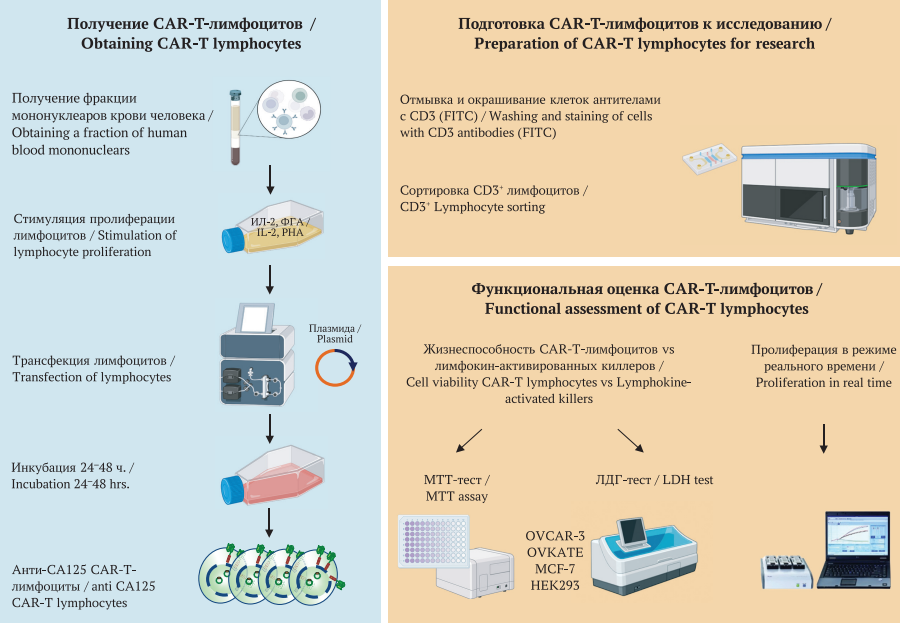
Цель. Оценить противоопухолевую эффективность разработанного нами препарата на основе цитотоксических Т-лимфоцитов, генетически модифицированных химерным антигенным рецептором (CAR), специфичным к антигену СА125 в отношении как СА125-позитивных, так и СА125-негативных клеточных культур.
Материалы и методы. Исследование было проведено в условиях in vitro на СА125-позитивных клетках рака яичника человека (OVCAR-3, OVKATE) и СА125-негативных клетках (рака молочной железы MCF-7, эмбриональной почки НЕК293). Цитотоксические эффекты в отношении опухолевых клеток оценивали через 0, 4, 8 и 24 часа с помощью бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиевого (МТТ) и лактатдегидрогеназного (ЛДГ) тестов. Также было проведено исследование изменения количества клеток в реальном времени при воздействии трансфецированных лимфоцитов при помощи прибора RTCA iCELLIgence (ACEA Biosciences, США). Контролем специфичности являлись лимфокин-активированные киллеры (ЛАК).
Результаты. На культурах клеток OVCAR-3 и OVKATE был получен выраженный цитотоксический эффект при использовании анти-СА125 CAR-T-лимфоцитов, превышающий воздействие ЛАК в 1,3 раза. Популяция клеток в исследуемых опытных образцах снижалась на 70 ± 4%, что превосходило эффект ЛАК на 9 ± 8,2%. В отношении MCF-7 цитотоксическое воздействие анти-СА125 CAR-T лимфоцитов имеет минимальное значение, что проявилось в снижении относительного количества живых клеток на 25,8%, по сравнению с цитотоксичностью ЛАК в 68%. Исследование изменения количества клеток в реальном времени доказало высокий специфический цитотоксический эффект анти-СА125 CAR-T-лимфоцитов в отношении опухолевых культур, экспрессирующих СА-125, при этом уступающий по эффективности ЛАК для культур, не экспрессирующих СА125 (MCF-7, HEK293).
Заключение. Применение анти-СА125 CAR-T-лимфоцитов в отношении СА125-позитивных опухолевых клеточных линий OVCAR-3 и OVKATE продемонстрировало выраженный специфический цитотоксический эффект, превышающий цитотоксическое воздействие ЛАК, чего не удалось достигнуть в отношении СА125негативных клеток MCF-7 и НЕК293.
ВНУТРЕННИЕ БОЛЕЗНИ
Цель исследования – изучить особенности профиля жирных кислот (ЖК) сыворотки крови и мембран эритроцитов у пациентов с двумя формами жировой болезни печени смешанного генеза (метаболическая и алкогольная): стеатозом и стеатогепатитом с нормальной активностью трансаминаз.
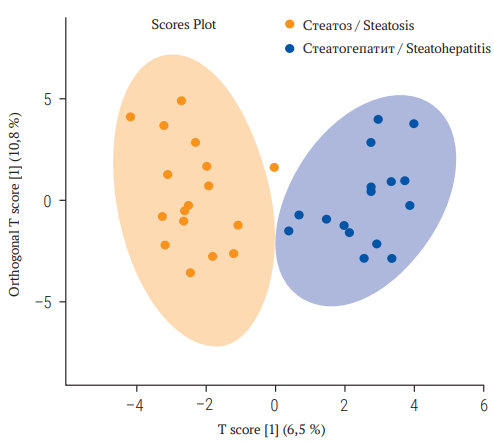
Материалы и методы. Обследованы 33 мужчины (50,7 ± 9,6 года) с жировой болезнью печени смешанного генеза (метаболическая и алкогольная) со степенью фиброза F ≤ 1 (FibroTest). По результатам ActiTest пациенты были разделены на группы стеатоза – с минимальной (А0–1) активностью (n = 17) и стеатогепатита – с умеренной/выраженной (А2–3) некровоспалительной активностью (n = 16). Исследование состава ЖК сыворотки крови и мембран эритроцитов проведено с помощью газовой хроматографии / масс-спектрометрии Agilent 7000B (Agilent Technologies, Inc., США). Применены методы непарной статистики с использованием volcano plot и дискриминантного анализа на основе ортогональных наименьших квадратов (Orthogonal Partial Least Squares Discriminant Analysis, OPLS-DA), ROC-анализ.
Результаты. Анализ volcano plot показал, что у пациентов с жировой болезнью печени смешанного генеза (метаболическая и алкогольная) с нормальной активностью трансаминаз в группе стеатогепатита сывороточные уровни стеариновой С18:0 (p = 0,016), арахиновой С20:0 (p = 0,023) кислот, соотношение насыщенные/полиненасыщенные жирные кислоты (ПНЖК) (p = 0,001) были статистически значимо выше, чем в группе стеатоза. Суммарное содержание в сыворотке крови всех ПНЖК (p = 0,003), маргариновой С17:0 (p = 0,011), суммы двух омега-3 ПНЖК – эйкозапентаеновой (С20:5n-3) и докозагексаеновой (С22:6n-3) (p = 0,04), суммарное содержание всех омега-3 ПНЖК (p = 0,042) были статистически значимо ниже в группе стеатогепатита. OPLS-DA продемонстрировал достаточно точное разделение стеатогепатита и стеатоза при использовании отдельных ЖК и их соотношений. При включении в анализ отдельных ЖК и их соотношений получена модель с AUC = 0,827 (95% доверительный интервал 0,499–1,0), чувствительностью 82,2% и спец ифичностью 80,7%.
Заключение. ЖК сыворотки крови и мембран эритроцитов представляются перспективными биомаркерами стеатогепатита при нормальном уровне трансаминаз.
ISSN 2658-3348 (Online)