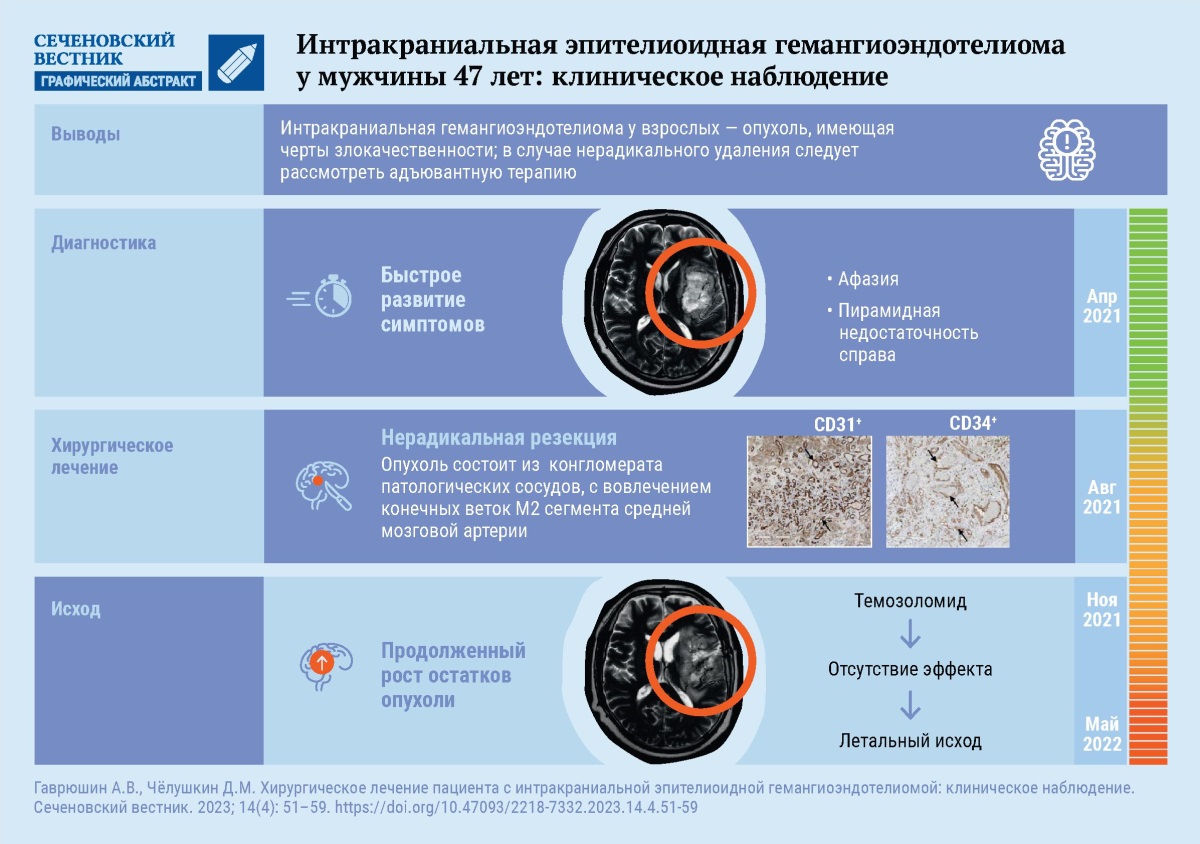
Перейти к:
Хирургическое лечение пациента с интракраниальной эпителиоидной гемангиоэндотелиомой: клиническое наблюдение
https://doi.org/10.47093/2218-7332.2023.14.4.51-59
Аннотация
Гемангиоэндотелиома (ГЭ) – крайне редкое сосудистое новообразование с промежуточным паттерном злокачественности между доброкачественными новообразованиями и ангиосаркомами. В литературе описано всего 46 случаев интракраниальной локализации первичной ГЭ у взрослых.
Описание случая. У пациента 47 лет в течение 3–4 дней появились выраженные нарушения речи по типу сенсорной и амнестической афазии, правосторонняя пирамидная недостаточность. По данным магнитно-резонансной томографии выявлено отграниченное новообразование островка мозга слева с признаками кровоизлияния и небольшим перифокальным отеком. Интраоперационно новообразование было представлено конгломератом патологических сосудов с вовлечением конечных веток М2 сегмента средней мозговой артерии, что не позволило выполнить радикальную резекцию новообразования. На основании гистологического и иммуногистохимического исследования операционного материала (положительная экспрессия CD31, CD34, индекс пролиферативной активности Ki-67 10%) установлен морфологический диагноз ГЭ. Спустя 3 месяца после оперативного вмешательства отмечен продолженный рост остаточной части новообразования. Химиотерапия темозоломидом оказалась клинически неэффективной. Через 9 месяцев пациент погиб из-за развития дислокационного синдрома.
Обсуждение. К злокачественным характеристикам ГЭ относится инвазивный рост, рецидивы и метастазирование, что чаще наблюдается при интракраниальной локализации новообразования. При подозрении на ГЭ следует стремиться к радикальному ее удалению при хирургическом лечении.
Список сокращений:
- ГЭ – гемангиоэндотелиома
- КТ– компьютерная томография
- МРТ– магнитно-резонансная томография
Гемангиоэндотелиома (ГЭ) или, как она называлась ранее, внутрисосудистая бронхиолоальвеолярная опухоль – это редко встречающееся новообразование, происходящее из предшественников эндотелиоцитов и занимающее пограничное положение между доброкачественной гемангиомой, с одной стороны, и ангиосаркомой – с другой. Относясь к группе мезенхимальных новообразований, ГЭ может поражать практически любые органы и ткани, как изолированно, так и системно, но наиболее часто она локализуется в трубчатых костях конечностей, печени и легких. В центральной нервной системе ГЭ наблюдается крайне редко, составляя менее 0,02% от всех первичных интракраниальных образований [1–3]. В литературе на сегодня опубликованы единичные наблюдения и несколько небольших серий (не более 5–7 пациентов), что указывает на малую изученность вопроса диагностики и тактики лечения пациентов данной группы.
Мы приводим собственное клиническое наблюдение ГЭ головного мозга, позволяющее расширить представление об этой патологии.
ОПИСАНИЕ СЛУЧАЯ
У пациента 47 лет в конце апреля 2021 года заболевание манифестировало быстрым развитием симптоматики поражения глубинных отделов доминантного полушария головного мозга: в течение 3–4 дней развились выраженные нарушения речи по типу сенсорной и амнестической афазии, а также правосторонняя пирамидная недостаточность (до 4 баллов). Госпитализирован в стационар по месту жительства.
18.05.2021 при проведении магнитно-резонансной томографии (МРТ) головного мозга визуализировано отграниченное новообразование изо-/гипоинтенсивного сигнала в режиме Т1 с участком повышенного сигнала по периферии в виде «неполного кольца» (рис. 1А). В режимах Т2 и DWI образование характеризовалось гипер-/изоинтенсивнымсигналом
с минимально выраженным перифокальным отеком и участками выпадения сигнала от сосудов (рис. 1B, C). Контрастное вещество накапливалось преимущественно по периферии образования, усиливая эффект «кольца» (рис. 1D).
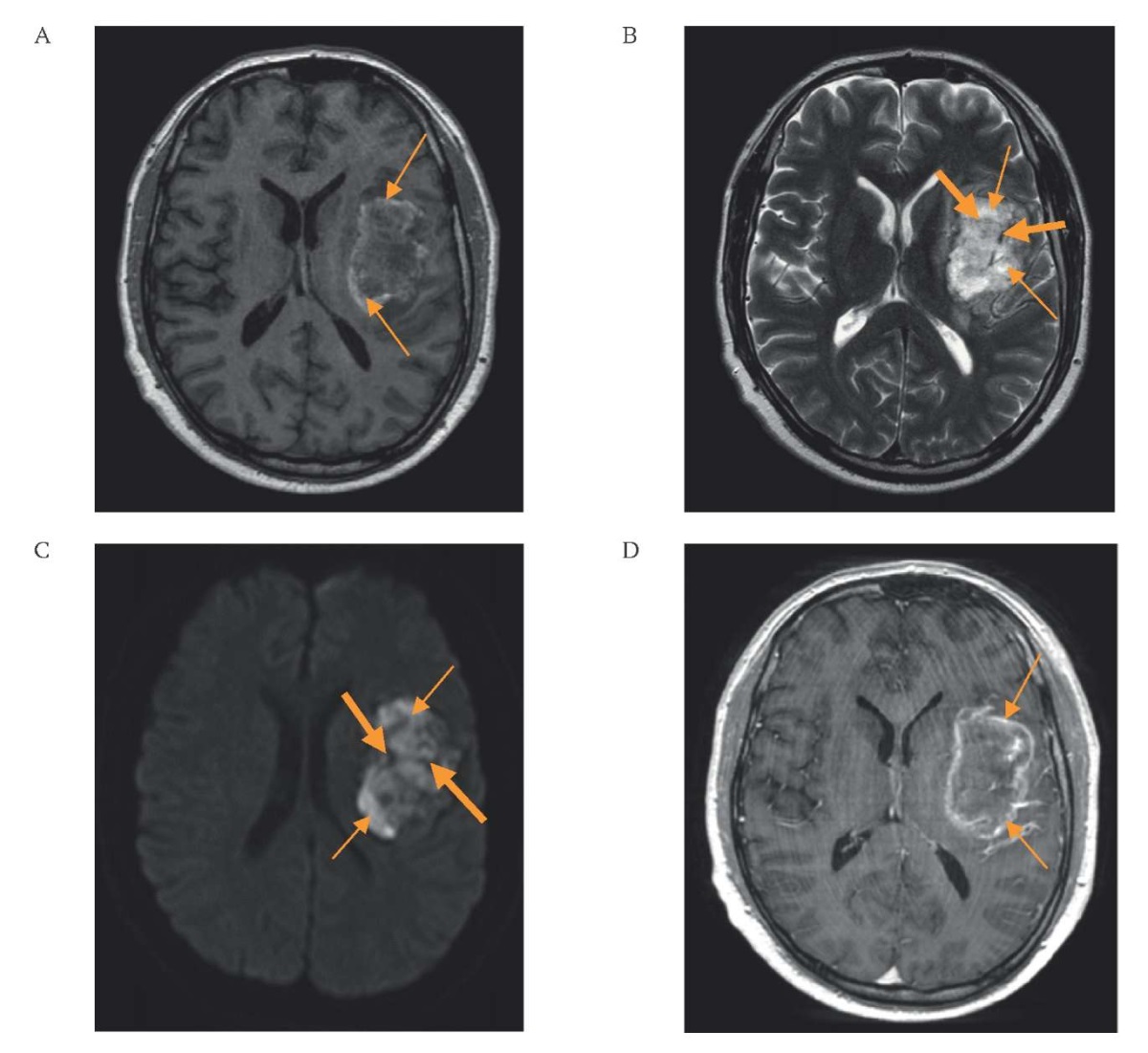
РИС. 1. Дооперационные данные (18.05.2021) магнитно-резонансной томографии
пациента 47 лет с гемангиоэндотелиомой островка мозга слева.
А. Т1, аксиальная проекция: зона изо-/гипоинтенсивного сигнала
с участком повышенного сигнала по периферии в виде «неполного кольца» (стрелки).
B, C. Т2, DWI, аксиальные проекции: зона гипер-/изоинтенсивного сигнала
с минимально выраженным перитуморальным отеком (толстые стрелки)
и участками выпадения сигнала от сосудов (тонкие стрелки).
D. Т1 с контрастным усилением, аксиальная проекция:
накопление контрастного вещества по периферии образования (стрелки).
FIG. 1. Pre-operative (18.05.2021) magnetic resonance imaging
of hemangioendothelioma of the left side of cerebral insula in 47-year-old male patient.
A. T1, axial plane: zone of iso-/hypointense signal, with an area of increased signal
along the periphery in the form of an “incomplete ring” (arrows).
B, C. T2, DWI, axial planes: zone of hyper-/isointense signal
with minimal peritumoral edema (thick arrows)
and areas of signal loss from the vessels (thin arrows).
D. T1 with contrast enhancement, axial plane:
contrast accumulation at the periphery of the neoplasm (arrows).
На данном этапе установлен диагноз новообразования левой островковой доли головного мозга. Пациент направлен на консультацию нейрохирурга в специализированный центр. С целью облегчения клини ческой симптоматики назначена гормональная терапия дексаметазоном в суточной дозе 8 мг, на фоне применения которой в течение 2 недель удалось достичь полного клинического разрешения неврологического дефицита.
09.08.2021 пациент в плановом порядке поступил в НМИЦ нейрохирургии им. ак. Н.Н. Бурденко. В неврологическом статусе: признаки выраженной сенсорной и амнестической афазии с элементами тахилалии, снижение памяти и внимания. В остальном неврологический статус без выраженной неврологической симптоматики, ECOG 1 балл, шкала Карновского 70 баллов. При поступлении консультирован офтальмологом: нейроофтальмологической симптоматики не выявлено. Дополнительное нейровизуализационное обследование не проводилось.
Установлен предварительный диагноз: D43.0 «Внутримозговое новообразование левой островковой доли». Консилиумом врачей-нейрохирургов в составе заведующего отделением, лечащего врача и сотрудников клинического отделения «Глиальные опухоли» было принято решение о проведении планового хирургического лечения.
Ход операции
Оперативное вмешательство проведено 11.08.2021 из небольшой краниотомии, выполненной в левой лобно-височной области с использованием хирургического микроскопа и микрохирургической техники. Из-за выраженного напряжения мозгового вещества не удалось подойти к новообразованию через средние отделы латеральной борозды головного мозга, в связи с чем на небольшом участке (не более 1 сантиметра) была рассечена покрышечная часть нижней лобной извилины.
Удаление новообразования, которое представляло собой конгломерат патологических сосудов, сгустков крови и ткани серо-розового цвета с кровоизлияниями различного срока давности, осуществлялось с использованием вакуумного аспиратора, ультразвукового деструктора и биполярной коагуляции. Достичь радикальной резекции не удалось ввиду того, что в состав новообразования были включены конечные ветки М2 сегмента средней мозговой артерии (участки, наиболее плотно спаянные со средней мозговой артерией, остались неудаленными). Тем не менее получилось удалить большую часть новообразования, что позволило достичь хорошего уровня декомпрессии и релаксации мозга.
В ходе оперативного вмешательства проводилось картирование моторных вызванных потенциалов и регистрация транскраниальных моторных вызванных потенциалов. Были зарегистрированы фоновые отчетливые М-ответы от всех отведений, снижения амплитуды М-ответов не отмечалось. При прямой электрической субкортикальной стимуляции монополярным стимулятором, подсоединенным к аспиратору, на силе тока 10–12 мА М-ответы не были зарегистрированы.
Оперативное вмешательство проводилось без интраоперационного пробуждения для картирования речевых центров по причине выраженной сенсорной и амнестической афазии. Кровопотеря составила около 500 мл.
Морфологическое исследование операционного материала
На основании исследования операционного материала был выставлен морфологический диагноз: гемангиоэндотелиома.
При окраске гематоксилином и эозином в микропрепарате были визуализированы фрагменты мозговой ткани с глиальной гиперплазией и очаговыми скоплениями атипических сосудов. Эти беспорядочно анастомозирующие сосуды были выстланы двумя слоями эндотелиальных клеток и частично тромбированы, также наблюдались периваскулярные некрозы сосудистого генеза (рис. 2А). Отмечалось присутствие отложений гранул гемосидерина, гематоидина и скоплений ксантомных клеток (рис. 2B).
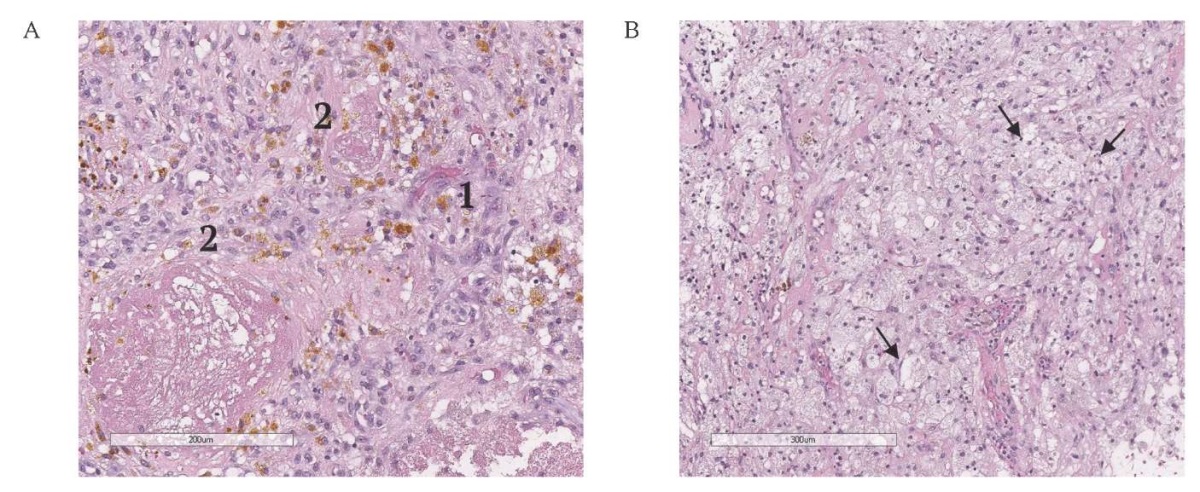
РИС. 2. Морфологическое исследование операционного материала пациента 47 лет
с гемангиоэндотелиомой островка мозга слева. Окраска гематоксилином и эозином.
А. Скопления атипических сосудов,
выстланных двумя слоями эндотелиальных клеток (1),
тромбированные сосуды с периваскулярными некрозами
сосудистого генеза (2), ув. 200.
B. Cкопления ксантомных клеток (стрелки), ув. 300.
FIG. 2. Histologic slides of hemangioendothelioma of the left side of cerebral insula
in 47-year-old male patient. Hematoxylin and eosin staining.
A. Clusters of atypical vessels lined with two layers of endothelial cells (1),
vascular thrombosis with perivascular necrosis of vascular origin (2), magnification 200.
B. Clusters of foam cells (arrows), magnification 300.
Проведенное иммуногистохимическое исследование выявило в сосудах положительную экспрессию CD31, CD34, очагово позитивную экспрессию в опухоли ЕМА (epithelial membrane antigen, эпителиальный мембранный антиген), позитивную экспрессию в стенках крупных сосудов Actin (актин), позитивную экспрессию в ксантомных клетках CD68, D2-40, позитивную экспрессию в глиальной ткани GFAP (glial fibrillary acidic protein, глиальный фибриллярный кислый протеин), отсутствие экспрессии в опухоли цитокератина (СК) АЕ1/3 (Monoclonal Mouse Anti-Human Cytokeratin, Clone AE1/AE3, антитела моноклональные мышиные к человеческим Цитокератин, клон AE1/AE3). Индекс пролиферативной активности Ki-67 составил до 10% (рис. 3). В целом морфологическая картина и иммунофенотип в большей степени соответствовали сосудистому пороку развития с фокусами сосудистой опухоли с выраженной экспрессией СD31 и повышенным индексом митотической активности Ki-67, что в большей мере соответствовало эпителиоидной ГЭ низкой степени злокачественности.
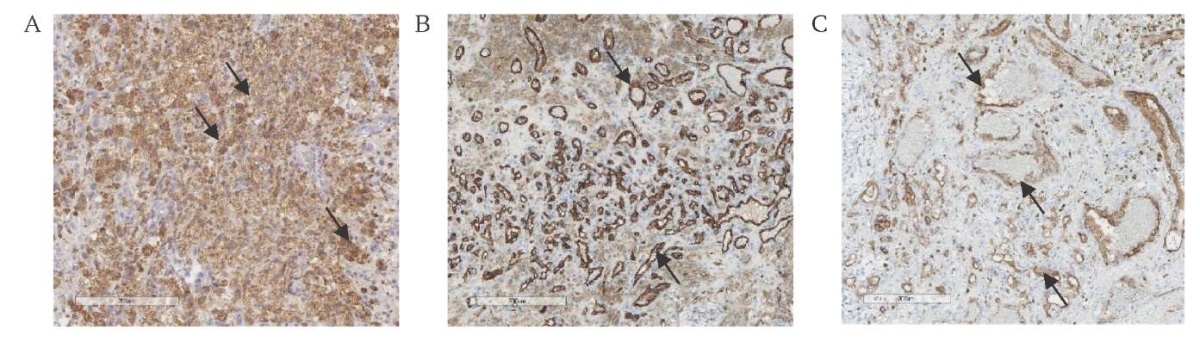
РИС. 3. Иммуногистохимическое исследование операционного материала
пациента 47 лет с гемангиоэндотелиомой островка мозга слева.
A. Позитивное окрашивание ксантомных клеток
иммуногистохимическим маркером CD68 в коричневый цвет (стрелки), ув. 300.
B. Позитивная экспрессия сосудистого маркера CD31 (стрелки), ув. 300.
C. Позитивная экспрессия сосудистого маркера CD34 (стрелки), ув. 200.
FIG. 3. Immunohistochemical staining of hemangioendothelioma
of the left side of cerebral insula in 47-year-old male patient.
A. Positive brown staining of foam cells
with the immunohistochemical marker CD68 (arrows), magnification 300.
B. Positive expression of the vascular marker CD31 (arrows), magnification 300.
C. Positive expression of the vascular marker CD34 (arrows), magnification 200.
Послеоперационное наблюдение и лечение
По данным послеоперационной КТ от 12.08.2021 интракраниальных осложнений не выявлялось (рис. 4А). К моменту выписки из стационара на 7-е сутки наблюдался существенный регресс имевших место до операции речевых нарушений. После операции нарастания неврологической симптоматики не отмечено.
В дальнейшем, с учетом гистологически подтвержденного диагноза ГЭ и доброкачественного характера течения данного заболевания, на онкологическом консилиуме было принято решение о динамическом наблюдении за пациентом.
Спустя 3 месяца после хирургического лечения, при отсутствии изменений в клинической картине заболевания, был отмечен продолженный рост остатков опухоли при проведении контрольного нейровизуализационного исследования головного мозга (рис. 4B–F). Назначена монохимиотерапия темозоломидом, на фоне которой стабилизации процесса не удалось достичь. В связи с высокими рисками появления грубого неврологического дефицита повторное хирургическое лечение не проводилось. Из-за прогрессии заболевания в виде продолженного роста новообразования с развитием дислокационного синдрома пациент погиб спустя 9 месяцев после хирургического лечения. С учетом всех данных клинический диагноз может быть представлен следующим образом: «Эпителиоидная гемангиоэндотелиома левой островковой доли головного мозга. Состояние после микрохирургического удаления опухоли от 11.08.2021. Продолженный рост».
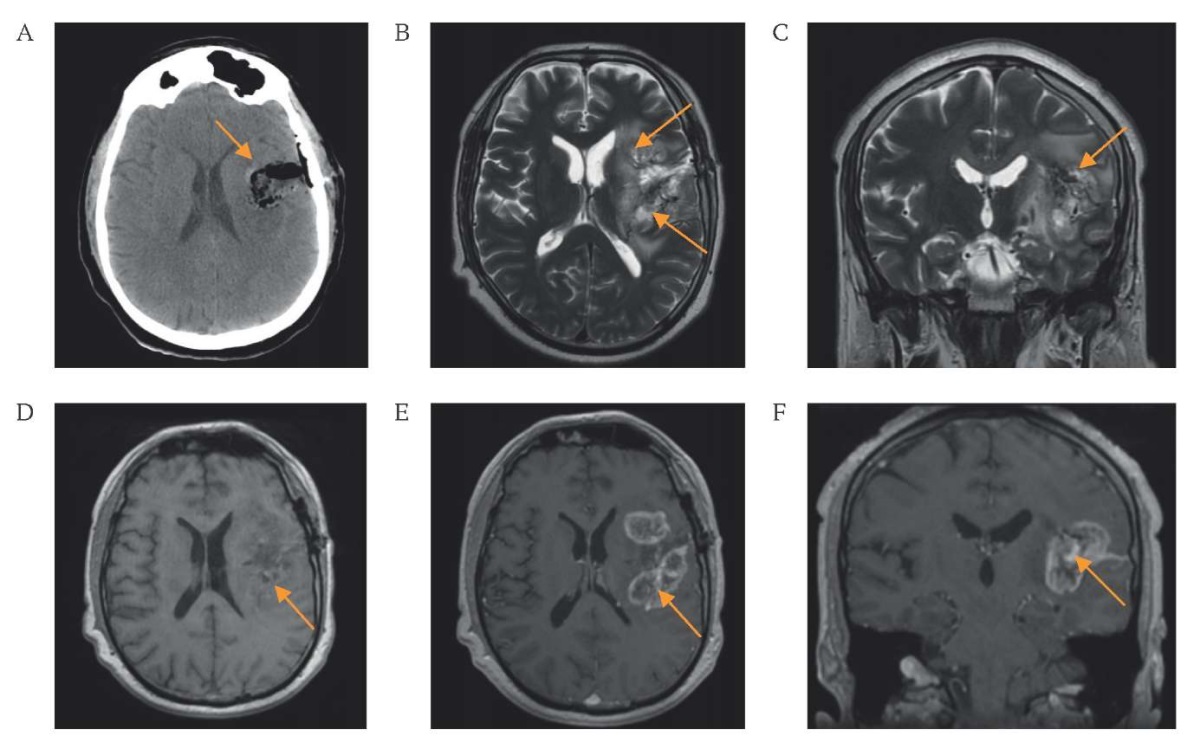
РИС. 4. Послеоперационные данные компьютерной томографии
через сутки после операции (А)
и магнитно-резонансной томографии через 3 месяца после операции (B–F)
пациента 47 лет с гемангиоэндотелиомой островка мозга слева.
A. КТ, аксиальная проекция: послеоперационные изменения
с небольшими остаточными фрагментами опухоли (стрелка).
B. Т2, аксиальная проекция: зоны продолженного роста остаточной части опухоли,
накапливающие контрастный препарат (стрелки).
C. Т2, фронтальная проекция: зоны продолженного роста остаточной части опухоли,
накапливающие контрастный препарат (стрелка).
D. Т1 без контрастного усиления, аксиальная проекция:
зоны продолженного роста остаточной части опухоли (стрелка).
E. Т1 с контрастным усилением, аксиальная проекция:
зоны продолженного роста остаточной части опухоли,
накапливающие контрастный препарат (стрелка).
F. Т1 с контрастным усилением, фронтальная проекция:
зоны продолженного роста остаточной части опухоли,
накапливающие контрастный препарат (стрелка).
FIG. 4. Postoperative computed tomography scans one day after surgery (A)
and magnetic resonance imaging 3 months after surgery (B–F)
of a 47-year-old patient with hemangioendothelioma
of the left part of cerebral insula (examination dates).
A. CT scan, axial plane: postoperative changes
with small residual tumor fragments (arrow).
B. T2, axial plane: areas of continued growth of the residual part of the tumor,
accumulating contrast agent (arrows).
C. T2, frontal plane: areas of continued growth of the residual part of the tumor,
accumulating contrast agent (arrow).
D. T1 without contrast enhancement, axial plane:
areas of continued growth of the residual part of the tumor (arrow).
E. T1 with contrast enhancement, axial plane:
areas of continued growth of the residual part of the tumor,
accumulating contrast agent (arrow).
F. T1 with contrast enhancement, frontal plane:
areas of continued growth of the residual part of the tumor,
accumulating contrast agent (arrow).
ОБСУЖДЕНИЕ
Впервые ГЭ была описана D.H. Dail и соавт. в 1975 году [4]. Изначально считалось, что это одна из агрессивных форм бронхиолоальвеолярного рака, и только в 1979 г. Weiss и Enzinger, используя методику иммуногистохимического исследования, доказали происхождение этого новообразования из клеток предшественников эндотелиальной клеточной линии и ввели ее современное название [5]. Эндотелиальная природа была подтверждена положительной экспрессией таких маркеров, как CD34 и CD31. В 1995 г. эти же авторы разделили ГЭ на 4 морфологических типа: эпителиодная, ретиформная (англ. «spindle cell»), капошиформная и эндолимфатическая папиллярная ангиоэндотелиома [6]. При интракраниальной локализации чаше встречаются именно эпителиоидные ГЭ, а ретиформная и капошиформная формы – значительно реже [6].
На сегодня выделяют две степени злокачественности ГЭ: низкая и умеренная. Последняя встречается наиболее часто (71%), в связи с чем в классификации Всемирной организации здравоохранения опухолей центральной нервной системы эти новообразования были отнесены к мезенхимальным опухолям Grade III, тогда как ранее они относились к образованиям Grade II1 [3]. Основными характеристиками, определяющими злокачественность ГЭ, являются инфильтративный рост, склонность к рецидивам и метастазированию, что наиболее характерно при интракраниальной ее локализации [3].
Являясь мезенхимальным новообразованием, ГЭ может развиваться из костей основания черепа, из твердой мозговой оболочки либо из самой паренхимы головного мозга. В связи с этим ГЭ может локализоваться в различных долях полушарий головного мозга, хиазмально-селлярной области [6], в кавернозном синусе [1], в области ската [2] и петрокливальной зоне [2][7], а также в намете [1] и черве мозжечка [3]. Данные литературы позволяют говорить лишь о том, что локализация ГЭ в задней черепной ямке является более редкой, чем ее супратенториальное расположение [3]. Из-за такой вариабельной локализации ГЭ часто расценивают как менингиому, гемангиому, метастаз, хондросаркому или глиобластому [1][2][7][8]. Заподозрить ГЭ можно на основании медленного развития неврологической симптоматики у пациентов среднего (20–50 лет) возраста [9] и таких неспецифических рентгенологических признаков, как: дольчатость строения, кровоизлияния в структуре новообразования с выраженной сосудистой сетью, и небольшого перифокального отека [1].
В нашем наблюдении на основании нейровизуализационных данных можно было еще на дооперационном этапе заподозрить у пациента ГЭ, но быстрое развитие неврологической симптоматики (выраженные нарушения речи по типу сенсорной и амнестической афазии и правосторонняя пирамидная недостаточность, развившиеся в течение 3–4 дней) склоняло наше предположение в сторону глиального новообразования высокой степени злокачественности, и лишь гистологическое исследование операционного материала, выявившее картину новообразования с беспорядочной сосудистой сетью и повышенной экспрессией эндотелиальных маркеров, позволило подтвердить диагноз ГЭ.
Принятых стандартов лечения ГЭ при ее интракраниальной локализации на сегодня нет по причине редкой встречаемости данной формы патологии. Основным методом является хирургическое лечение, по возможности радикальное [1][2][6][10][11], так как, по мнению ряда авторов, это связано с лучшим прогнозом [1]. Но достичь полного удаления не всегда удается из-за повышенной кровоточивости ткани новообразования и его инфильтративного роста. Для снижения кровопотери во время оперативного вмешательства некоторые авторы рекомендуют проводить предоперационную эмболизацию сосудов [2]. В нашем наблюдении предоперационная эмболизация сосудов новообразования не проводилась.
Эффективность адъювантной терапии на сегодня не доказана [2][6][10]. Считается, что дистанционная гамма-терапия может способствовать склерозированию сосудов внутри ГЭ [10], в связи с чем некоторые авторы рекомендуют ее в качестве дополнительной терапии после хирургического лечения [7] или даже самостоятельного метода лечения. На сегодня из всех 35 наблюдений, которые были описаны в литературе, лучевая терапия была применена лишь в 6 случаях, а химиотерапия – в 5, что не позволяет однозначно оценивать их эффективность [10]. Среди химиопрепаратов приоритет отдавался использованию препаратов с антиангиогенным эффектом: интерферона альфа [2][6] и леналидомида [9].
В нашем наблюдении, с учетом пограничного характера новообразования и отсутствия стандартов его лечения, первоначально было решено воздержаться от дополнительной терапии после хирургического лечения. Но прогрессия заболевания развилась достаточно быстро, и в качестве адъювантной терапии была использована химиотерапия, так как проведение лучевой терапии было сопряжено с высоким риском ухудшения состояния пациента из-за вероятности развития отека мозгового вещества на фоне остатков новообразования. Применение первой линии химиотерапии (темозоломид), используемой в лечении высокозлокачественных глиальных новообразований головного мозга, оказалось неэффективным.
Очевидно, что для дифференциальной диагностики, например с глиобластомой или ангиосаркомой, требовалось проведение дополнительного спектра молекулярно-генетических (IDH1, IDH2, TERT, EGFR, амплификации MYC, FLT4) и иммуногистохимических (к антителам ERG, factor VIII, VEGF, FLI-1) анализов, однако выполнение подобных исследований на сегодня все еще остается затруднительным ввиду малой доступности и высокой экономической нагрузки.
Мы считаем, что в таких случаях, как наше наблюдение, когда клинико-рентгенологическая картина нетипична для ГЭ, а диагноз основывается на морфологическом анализе и иммуногистохимическом исследовании, следует проводить расширенные молекулярно-генетические и иммуногистохимические исследования, а при невозможности их выполнения и частичном удалении опухоли обязательно дополнять лечение адъювантной терапией.
ЗАКЛЮЧЕНИЕ
ГЭ – редко встречающееся мезенхимальное новообразование с признаками злокачественности в виде инвазивного роста и склонности к рецидивированию. При интракраниальной локализации ГЭ может иметь схожую нейровизуализационную картину с высокозлокачественными глиальными новообразованиями головного мозга.
При подозрении на ГЭ следует стремиться, по возможности, к ее радикальной резекции, так как это улучшает прогноз заболевания. В случаях, когда радикальной резекции новообразования при хирургическом лечении по каким-либо причинам достичь не удалось, может быть рассмотрена возможность лечения адъювантной дистанционной гамма-терапией. Применение темозоломида в нашем наблюдении оказалось неэффективным.
ВКЛАД АВТОРОВ
А.В. Гаврюшин внес основной вклад в разработку концепции статьи, подготовил текст и согласен принять на себя ответственность за все аспекты клинического наблюдения. Д.М. Чёлушкин участвовал в разработке концепции статьи и подготовке текста. А.В. Гаврюшин, Д.М. Чёлушкин принимали активное участие в лечении пациента. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTIONS
Andrey V. Gavrjushin developed the main concept of the article, wrote the text, approved the final version, and agreed to take responsibility for all aspects of the case report. Danil M. Chelushkin participated in the development of the concept of the article and the preparation of the text. Andrey V. Gavrjushin, Danil M. Chelushkin took an active part in the treatment of the patient. All authors approved the final version of the article.
Соблюдение этических норм. Заявление о согласии. Родственники пациента дали согласие на публикацию представленной выше статьи «Хирургическое лечение пациента с интракраниальной эпителиоидной гемангиоэндотелиомой: клиническое наблюдение» в журнале «Сеченовский вестник».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Compliance with ethical standards. Consent statement. The patient’s relatives consented to the publication of the article “Surgical treatment of intracranial epithelioid hemangioendothelioma: a case report” in the “Sechenov Medical Journal”.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. WHO Classification of Tumours Editorial Board. WHO classification of tumours. Central nervous system tumours. 5th ed., vol. 6. France, Lyon: International Agency for Research on Cancer; 2021. https://tumourclassification.iarc.who.int (дата обращения: 17.07.2023).
Список литературы
1. Tian W.Z., Yu X.R., Wang W.W., et al. Computed tomography and magnetic resonance features of intracranial hemangioendothelioma: A study of 7 cases. Oncol Lett. 2016 May; 11(5): 3105–3110. https://doi.org/10.3892/ol.2016.4356. Epub 2016 Mar 21. PMID: 27123072
2. Zheng J., Liu L., Wang J., et al. Primary intracranial epithelioid hemangioendothelioma: a low-proliferation tumor exhibiting clinically malignant behavior. J Neurooncol. 2012 Oct; 110(1): 119–127. https://doi.org/10.1007/s11060-012-0945-x. Epub 2012 Aug 11. PMID: 22886511
3. Omerhodžić I., Bilalović N., Rovčanin B., et al. Primary epithelioid hemangioendothelioma in the cerebellum: case report with reference to drastic change in the WHO classification. Acta Clin Croat. 2018 Sep; 57(3): 570–576. https://doi.org/10.20471/acc.2018.57.03.21. PMID: 31168191
4. Dail D.H., Liebow A.A., Gmelich J.T., et al. Intravascular, bronchiolar, and alveolar tumor of the lung (IVBAT). An analysis of twenty cases of a peculiar sclerosing endothelial tumor. Cancer. 1983 Feb 1; 51(3): 452–464. https://doi.org/10.1002/1097-0142(19830201)51:3<452::aid-cncr2820510317>3.0.co;2-m. PMID: 6295602
5. Weiss S.W., Enzinger F.M. Epithelioid hemangioendothelioma: a vascular tumor often mistaken for a carcinoma. Cancer. 1982 Sep 1; 50(5): 970–981. https://doi.org/10.1002/1097-0142(19820901)50:5<970::aid-cncr2820500527>3.0.co;2-z. PMID: 7093931
6. Hamlat A., Casallo-Quilliano C., Saikali S., et al. Epithelioid hemangioendothelioma of the infundibular-hypothalamic region: case report and literature review. J Neurooncol. 2004 May; 67(3): 361–366. https://doi.org/10.1023/b:neon.0000024240.97378.d0. PMID: 15164993
7. Watanabe T., Saito N., Shimaguchi H., et al. Primary epithelioid hemangioendothelioma originating in the lower petroclival region: case report. Surg Neurol. 2003 May; 59(5): 429–433; discussion 434. https://doi.org/10.1016/s0090-3019(03)00068-5. PMID: 12765826
8. Davis J.L., Tihan T., Kilpatrick S.E. 14 – Mesenchymal tumors of the central nervous system, Editor(s): Arie Perry, Daniel J. Brat, Practical surgical neuropathology: A diagnostic approach (Second Edition), Elsevier, 2018: 299–322. ISBN 9780323449410. https://doi.org/10.1016/B978-0-323-44941-0.00014-X
9. Sumrall A., Fredericks R., Berthold A., Shumaker G. Lenalidomide stops progression of multifocal epithelioid hemangioendothelioma including intracranial disease. J Neurooncol. 2010 Apr; 97(2): 275–277. https://doi.org/10.1007/s11060-009-0017-z. Epub 2009 Nov 7. PMID: 19898746
10. Parajón A., Vaquero J. Meningel intracranial epithelioid hemangioendothelioma: case report and literature review. J Neurooncol. 2008 Jun; 88(2): 169–173. https://doi.org/10.1007/s11060-008-9543-3. PMID: 18278439
11. Stacchiotti S., Miah A.B., Frezza A.M., et al. Epithelioid hemangioendothelioma, an ultra-rare cancer: a consensus paper from the community of experts. ESMO Open. 2021 Jun; 6(3): 100170. https://doi.org/10.1016/j.esmoop.2021.100170. Epub 2021 Jun 2. PMID: 34090171
Об авторах
А. В. ГаврюшинРоссия
Гаврюшин Андрей Владимирович - канд. мед. наук, врач-нейрохирург 7-го клинического отделения.
ул. 4-я Тверская-Ямская, д. 16, Москва, 125047
Д. М. Чёлушкин
Россия
Чёлушкин Данил Михайлович – аспирант.
ул. 4-я Тверская-Ямская, д. 16, Москва, 125047
Тел.: +7 (925) 837-51-12
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(316KB)
|
Метаданные ▾ | |

|
2. Чек-лист CARE | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(20KB)
|
Метаданные ▾ | |
Рецензия
JATS XML