Перейти к:
Перспективы модуляции микробиома при аутоиммунных заболеваниях: обзор литературы
https://doi.org/10.47093/2218-7332.2024.15.1.4-19
Аннотация
Аутоиммунные заболевания (АИЗ) характеризуются дисрегуляцией иммунных реакций и поражением здоровых тканей организма. Их полное излечение остается труднодостижимым, а существующие методы терапии часто сопровождаются побочными эффектами. Последние исследования показали значимую роль нарушений состава микробиома в развитии аутоиммунных реакций; более того, модуляция микробиома посредством различных терапевтических вмешательств представляет собой перспективное направление в рамках комплексной терапии основного заболевания. Внеклеточные везикулы, в частности экзосомы, переносят биологически активные вещества между клетками, и в ряде работ был показан их лечебный эффект при АИЗ. Однако роль внеклеточных везикул в модуляции микробиома остается недостаточно изученной, поэтому для более глубокого понимания их влияния на патогенез АИЗ и связанных с ним изменений микробиома, а также для разработки новых стратегий лечения необходимы дальнейшие исследования. В представленном обзоре литературы на основании изучения англоязычных источников рассматривается значение микробиоты разных локусов организма человека (кишечника, кожи, ротовой полости) в развитии таких АИЗ, как рассеянный склероз, псориаз, болезнь Шёгрена. Обсуждается роль внеклеточных везикул в модуляции микробиома при терапии АИЗ.
Ключевые слова
Список сокращений:
- CD – cluster of differentiation, кластер дифференцировки
- АИЗ – аутоиммунные заболевания
- БШ – болезнь Шёгрена
- ВВ – внеклеточные везикулы
- ГЭБ – гематоэнцефалический барьер
- ИЛ – интерлейкин
- МСК – мультипотентные мезенхимные стромальные клетки
- РС – рассеянный склероз
- ЦНС – центральная нервная система
Аутоиммунные заболевания (АИЗ) представляют собой гетерогенную группу патологических состояний, обусловленных дисрегуляцией иммунных реакций, вследствие чего ткани организма повреждаются цитотоксическими клетками или аутоантителами. АИЗ существенно снижают качество жизни пациентов, могут приводить к инвалидизации и летальному исходу. Несмотря на определенные успехи, терапия аутоиммунных заболеваний по-прежнему является вызовом, и интерес к разработке новых методов лечения только растет [1][2].
В последние годы все больше внимания уделяется обсуждению микробиома человека в контексте поддержания гомеостаза организма – многие исследователи отмечают роль этой сложной и динамичной экосистемы в формировании иммунного ответа, возникновении и прогрессировании аутоиммунных реакций [3]. В частности, была показана связь микробиоты кишечника с системной красной волчанкой [4][5], диабетом I типа [6], рассеянным склерозом [7], ревматоидным артритом [8][9]. Появляется все больше данных о роли микробиоты кожи и ротовой полости в развитии АИЗ [10–12]. Более того, терапевтические вмешательства, направленные на модуляцию микробиоты разных локусов (антибактериальная терапия, применение пробиотиков, трансплантация микробиоты от здорового донора), продемонстрировали клиническую эффективность в лечении АИЗ [13–25] (рис.).
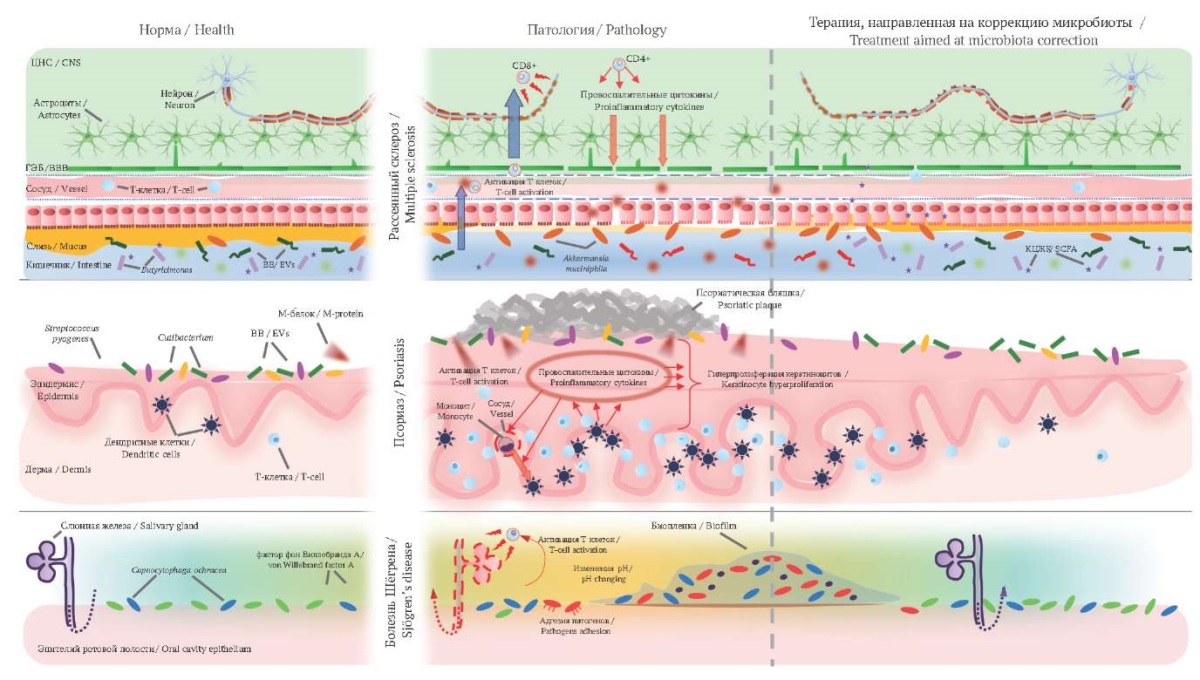
РИС. Роль микробиома в патогенезе ряда аутоиммунных заболеваний.
При рассеянном склерозе увеличение числа бактерий Akkermansia municiphila в кишечнике может приводить к повышению деградации слизи и проницаемости кишечного барьера, что способствует поступлению в кровь соединений, активирующих иммунные клетки. С другой стороны, стимулирование роста микробиоты, синтезирующей короткоцепочечные жирные кислоты, например бактерий рода Butyricimonas, может способствовать восстановлению проницаемости как кишечного, так и гематоэнцефалического барьеров и облегчать симптомы заболевания. М-белок, выделяемый бактериями Streptococcus pyogenes при псориазе, и фактор фон Виллебранда А, выделяемый бактериями Capnocytophaga ochracea при болезни Шёгрена, способствуют активации Т-клеток, продуцирующих провоспалительные цитокины.
FIG. The role of the microbiome in the pathogenesis of several autoimmune pathologies.
In multiple sclerosis, an increase in the number of Akkermansia municiphila bacteria in the intestine may lead to increased mucus and intestinal barrier permeability, which promotes the entry of compounds that activate immune cells into the blood. On the other hand, stimulating the growth of microbiota synthesizing short-chain fatty acids, such as bacteria of the genus Butyricimonas, may contribute to the restoration of both intestinal and blood-brain barrier permeability and alleviate disease symptoms. M-protein secreted by Streptococcus pyogenes bacteria in psoriasis and von Willebrand factor A secreted by Capnocytophaga ochracea bacteria in Sjögren’s disease contribute to the activation of T cells producing proinflammatory cytokines.
Примечание: ЦНС – центральная нервная система;
ГЭБ – гематоэнцефалический барьер; ВВ – внеклеточные везикулы;
CD – cluster of differentiation, кластер дифференцировки;
КЦЖК – короткоцепочечные жирные кислоты.
Note: CNS – central nervous system;
BBB – blood-brain barrier; EVs – extracellular vesicles;
CD – cluster of differentiation; SCFA – short-chain fatty acid.
Одним из многообещающих терапевтических агентов являются внеклеточные везикулы (ВВ) – синтезируемые клетками мембранные наночастицы, способные регулировать патофизиологические процессы в организме. По биогенезу ВВ подразделяют на апоптотические тельца, экзосомы и микровезикулы, отличающиеся способом образования, размером и специфичными маркерами [26].
Наиболее широко изучаемым классом ВВ являются экзосомы, образующиеся путем двойной инвагинации мембраны родительской клетки. Их диаметр составляет около 30–150 нм. Эффективность экзосом была показана, в частности, на экспериментальной модели рассеянного склероза (РС) (аутоиммунного энцефаломиелита): применение экзосом мультипотентных мезенхимных стромальных клеток (МСК) костного мозга человека позволило значительно увеличить число новообразованных и зрелых олигодендроцитов, а также долю противовоспалительных М2 макрофагов [27]. В другом подобном эксперименте экзосомы МСК костного мозга человека, полученные после стимуляции культуры интерфероном-гамма, также способствовали снижению выраженности воспаления и демиелинизации в центральной нервной системе (ЦНС) и увеличению доли регуляторных Т-клеток в спинном мозге [28]. Регуляторные Т-клетки представляют собой особую популяцию Т-хелперов и играют важную роль в поддержании адекватного иммунного ответа, в том числе за счет подавления чрезмерного воспаления при АИЗ [29].
В исследованиях было продемонстрировано, что экзосомы эмбриональных МСК человека уменьшали экспрессию интерлейкина 17 (ИЛ-17) и белка системы комплемента C5b-9 в коже [30], а экзосомы МСК пупочного канатика человека подавляли гиперпролиферацию кератиноцитов и способствовали снижению индекса распространенности и тяжести псориаза (Psoriasis Area and Severity Index, PASI) на модели имиквимод-индуцированного псориаза у мышей [31]. Снижение признаков акантоза, а также повышение содержания регуляторных Т-клеток в коже мышей с имиквимод-индуцированным псориазом также наблюдалось при введении ВВ мононуклеаров пуповинной крови человека [32].
На модели диабета без ожирения (Non-Obese Diabetes, NOD) у мышей с аутоиммунным поражением слюнных желез (экспериментальная модель болезни Шёгрена (БШ)) применение экзосом МСК мелких слюнных желез слизистой оболочки губ человека позволило добиться снижения воспалительной инфильтрации и улучшения слюноотделения [33], а везикулы, полученные из стволовых клеток человека с индуцированной плюрипотентностью, способствовали индукции макрофагов в селезенке в сторону противовоспалительного М2-фенотипа и снижали количество Т-хелперов 17 [34].
Исследователи выделяют разнообразные молекулярные механизмы, лежащие в основе терапевтического эффекта ВВ, в том числе с участием везикулярных белков, липидов или переносимых везикулами микроРНК. Однако их потенциальное воздействие на микробиом при АИЗ ранее практически не обсуждалось. Примечательно, что в контексте терапевтического эффекта и прямого влияния на иммунную систему в большей мере обсуждаются ВВ клеток человека, в то время как влияние на микробиом показано главным образом для бактериальных везикул [27][28][30–41].
Цель данного обзора – рассмотреть роль микробиоты разных локусов организма человека в развитии АИЗ и возможности ее модуляции. Нами были рассмотрены роли: микробиоты кишечника на примере РС, микробиоты кожи на примере псориаза, микробиоты ротовой полости на примере БШ. Отдельно обсуждается роль ВВ и возможности их применения для модуляции микробиома при терапии аутоиммунных заболеваний.
В обзоре использованы англоязычные источники из PubMed и Scopus с 1995 по 2023 год, две трети источников – статьи, опубликованные за последние 5 лет. При поиске были использованы следующие ключевые слова и словосочетания: «exosomes», «extracellular vesicles», «autoimmune diseases», «psoriasis», «multiple sclerosis», «autoimmune encephalomyelitis», «sjogren’s syndrome», «sjogren’s disease», «microbiome», «skin microbiota», «gut microbiota», «oral microbiota»
Представленный обзор обращен к врачам-исследователям, заинтересованным вопросами разработки инновационных методов терапии аутоиммунных заболеваний.
РОЛЬ МИКРОБИОТЫ КИШЕЧНИКА В РАЗВИТИИ РАССЕЯННОГО СКЛЕРОЗА
РС представляет собой хроническое аутоиммунное нейродегенеративное заболевание, характеризующееся поражением миелиновых оболочек нервных волокон ЦНС и проявляющееся двигательными, чувствительными и когнитивными нарушениями вплоть до инвалидизации и летального исхода [42][43]. По последним оценкам, в мире РС страдают 2,3–2,8 миллиона человек [44][45], причем заболевание манифестирует преимущественно у молодых трудоспособных людей, что имеет не только социальные, но и экономические последствия [46]. Несмотря на разработку препаратов, изменяющих течение РС [47], заболевание по-прежнему считается неизлечимым.
При РС эффекторные Т-клетки активируются и проникают через гематоэнцефалический барьер (ГЭБ) в ЦНС, где происходит их реактивация [48]. Т-киллеры, несущие гликопротеины кластера дифференцировки 8 (cluster of differentiation 8, CD8+), будучи сенсибилизированными к антигенам миелина, оказывают прямое цитотоксическое действие, в то время как CD4+ Т-хелперы, в частности популяции Т-хелперов 1 и 17, способствуют дальнейшему прогрессированию воспаления за счет синтеза провоспалительных цитокинов. Так, Т-хелперы 1 продуцируют интерферон-гамма [49], в то время как Т-хелперы 17 синтезируют ИЛ-17, который не только способствует активации клеток микроглии [50][51], но и вносит вклад в дестабилизацию ГЭБ [52], приводя к усилению притока воспалительных клеток в ЦНС [53]. В-клетки также участвуют в патогенезе РС, как за счет образования аутоантител [54][55] и цитокинов [48] (преимущественно при первично-прогрессирующем типе), так и за счет презентации антигенов Т-клеткам (при рецидивирующем течении заболевания) [48].
Дисбиоз кишечной микробиоты был неоднократно описан в литературе как у пациентов с РС (табл.), так и при моделировании аутоиммунного энцефаломиелита на животных [7][56–61].
При этом до сих пор нет однозначного ответа на вопрос, является дисбиоз следствием или одним из триггеров заболевания [56][58]. Значимость роли микробиоты кишечника в развитии РС признана ученым сообществом, широко изучаются возможные механизмы сложных взаимодействий между иммунной, нервной системами и микробами кишечника по оси «кишечник–мозг» (англ. gut-brain axis).
Таблица. Изменения в составе микробиоты
при рассеянном склерозе, псориазе и болезни Шёгрена
Table. Changes in the composition of microbiota
in multiple sclerosis, psoriasis, and Sjögren’s disease
|
Тип / Phylum |
Класс / Class |
Порядок / Order |
Семейство / Family |
Род / Genus |
Болезнь / Disease |
|||
|
Actinomycetota |
↑ [59] |
Coriobacteriia |
Eggerthellales |
Eggerthellaceae |
↑ [60] |
Eggerthella |
↑ [60] |
РС / МS |
|
Adlercreutzia |
↓ [61] |
|||||||
|
↓ [86] |
Actinomycetes |
Propionibacteriales |
Propionibacteriaceae |
Cutibacterium |
↓ [86–89] |
П / P |
||
|
Micrococcales |
Micrococcaceae |
Kocuria |
↓ [88] |
|||||
|
Mycobacteriales |
Corynebacteriaceae |
Corynebacterium |
↑ [86] |
|||||
|
↑ [109][110] |
Actinomycetes |
Actinomycetales |
Actinomycetaceae |
Actinomyces |
↓ [111] |
БШ / SD |
||
|
Micrococcales |
Micrococcaceae |
Rothia |
↓ [111] |
|||||
|
Bacillota (Firmicutes) |
↓ [59] |
Clostridia |
Lachnospirales |
Lachnospiraceae |
Blautia |
↑ [60][61] |
РС / МS |
|
|
Anaerostipes |
↓ [59] |
|||||||
|
Dorea |
↑ [61] |
|||||||
|
Eubacteriales |
Clostridiaceae |
Hungatella |
↑ [60] |
|||||
|
Oscillospiraceae |
↓ [60] |
Faecalibacterium |
↓ [59] |
|||||
|
↑ [86][89], ↓ [90] |
Bacilli |
Lactobacillales |
Streptococcaceae |
Streptococcus |
↑ [86] |
П / P |
||
|
Bacillales |
Staphylococcaceae |
Staphylococcus |
↓ [87][90], ↑ [86][88] |
|||||
|
↑ [109][110][112–114] |
Bacilli |
Lactobacillales |
Streptococcaceae |
Streptococcus |
↑ [112], ↓ [109][110] |
БШ / SD |
||
|
Bacillales |
Gemellaceae |
Gemella |
↑ [109] |
|||||
|
Negativicutes |
Veillonellales |
Veillonellaceae |
Veillonella |
↑ [109–112] |
||||
|
Clostridia |
Peptostrepto- coccales |
Peptostreptococcaceae |
Peptostreptococcus |
↓ [111] |
||||
|
Bacteroidota (Bacteroidetes) |
↓ [59] |
Bacteroidia |
Bacteroidales |
Tannerellaceae |
Parabacteroides |
↓ [61] |
РС / МS |
|
|
Prevotellaceae |
Prevotella |
↓ [59–61] |
||||||
|
Odoribacteraceae |
Odoribacter |
↓ [60] |
||||||
|
Butyricimonas |
↓ [7] |
|||||||
|
Barnesiellaceae |
↓ [60] |
Barnesiella |
↓ [60] |
|||||
|
↑ [86] |
Chitinophagia |
Chitinophagales |
Chitinophagaceae |
Flavisolibacter |
↓ [91] |
П / P |
||
|
↑ [113][114] |
Bacteroidia |
Bacteroidales |
Porphyromonadaceae |
Porphyromonas |
↓ [111] |
БШ / SD |
||
|
Pseudomonadota (Proteobacteria) |
Gammaproteobacteria |
Pseudomonadales |
Pseudomonadaceae |
Pseudomonas |
↑ [61] |
РС / МS |
||
|
Pasteurellales |
Pasteurellaceae |
Haemophilus |
↑ [61] |
|||||
|
Alphaproteobacteria |
Hyphomicrobiales |
Rhizobiaceae |
Mycoplana |
↑ [61] |
||||
|
↓ [86], ↑ [87][89] |
Alphaproteobacteria |
Hyphomicrobiales |
Methylobacteriaceae |
Methylobacterium |
↓ [91] |
П / P |
||
|
Betaproteobacteria |
Burkholderiales |
Burkholderiaceae |
Lautropia |
↑ [89] |
||||
|
Cupriavidus |
↓ [91] |
|||||||
|
Sphaerotilaceae |
Caldimonas (Schlegelella) |
↓ [91] |
||||||
|
↓ [109][110][113][114] |
Gammaproteobacteria |
Pasteurellales |
Pasteurellaceae |
Haemophilus |
↓ [109–111] |
БШ / SD |
||
|
Betaproteobacteria |
Neisseriales |
Neisseriaceae |
Neisseria |
↓ [111] |
||||
|
Verrucomicrobiota |
↑ [7] |
Verrucomicrobiae |
Verrucomicrobiales |
Akkermansiaceae |
Akkermansia |
↑ [7][60] |
РС / МS |
|
|
Euryarchaeota |
↑ [7] |
Methanobacteria |
Methanobacteriales |
Methanobacteriaceae |
Methanobrevibacter |
↑ [7] |
||
|
Fusobacteriota (Fusobacteria) |
↓ [89] |
П / P |
||||||
|
Cyanobacteriota (Cyanobacteria) |
↓ [89] |
|||||||
Примечание: ↑ – повышение численности; ↓ – снижение численности.
При изучении рассеянного склероза (РС) оценивались изменения микробиоты кишечника,
болезни Шёгрена (БШ) – ротовой полости, псориаза (П) – кожи.
Note: ↑ – increase in numbers; ↓ – decrease in numbers.
In the study of multiple clerosis (MS), changes in gut microbiota were evaluated,
Sjögren's disease (SD) – oral cavity, psoriasis (P) – skin.
Наряду с повышенной проницаемостью ГЭБ, при РС отмечается повышенная проницаемость кишечного барьера, которая может способствовать проникновению в кровь соединений, активирующих иммунные клетки и влияющих на развитие воспаления в ЦНС [62][63]. При моделировании заболевания на мышах было показано, что признаки повышенной проницаемости кишечника отмечаются уже на 7-й день эксперимента, до проявления неврологических симптомов [62].
Предполагается, что при РС именно микробиота кишечника вносит вклад в нарушение его проницаемости как за счет потери одних бактерий, так и за счет чрезмерного роста других в результате дисбиоза [64]. Так, бактерии вида Akkermansia muciniphila разрушают муцины – гликопротеины слизи, покрывающей кишечник. В норме данный процесс способствует обновлению и укреплению кишечного барьера [65], однако при чрезмерном увеличении числа данных бактерий при РС равновесие между процессами образования и деградации слизи нарушается и проницаемость кишечника может повышаться [66]. С другой стороны, численность бактерий рода Butyricimonas, производящих бутират (эфир масляной кислоты, относящейся к короткоцепочечным жирным кислотам, способным восстанавливать проницаемость кишечного барьера), у пациентов с РС, напротив, снижается [67].
Показано, что метаболиты многих бактерий-комменсалов толстой кишки могут оказывать непосредственное влияние на патогенез РС. Так, вышеупомянутые короткоцепочечные жирные кислоты, продукт ферментации пищевых волокон, способны восстанавливать не только проницаемость кишечного барьера, но и проницаемость ГЭБ [68].
Возможность восстанавливать проницаемость кишечного барьера также была показана для уролитина А и индолов [69–71]. Индолы, бактериальные метаболиты триптофана, могут также оказывать влияние на астроциты через арил-гидрокарбоновые рецепторы, снижая воспаление в ЦНС [72]. Для полисахарида А, продукта бактерий вида Bacteroides fragilis, была показана индукция CD4+ Т-хелперов в ИЛ-10-продуцирующие регуляторные FOXP3+ T-клетки [73]. Более того, по некоторым данным, микробиота кишечника может оказывать влияние на регуляцию миелинизации в ЦНС [74].
В экспериментах на трансгенных мышах и мышах с аутоиммунным энцефаломиелитом, индуцированным миелиновым гликопротеином олигодендроцитов, трансплантация микробиоты пациентов с РС повышала частоту развития заболевания и ухудшала его симптомы по сравнению с трансплантацией кишечной микробиоты здоровых доноров [75][76]. В свою очередь, микробиота здоровых доноров способствовала облегчению симптомов заболевания, в том числе за счет снижения активации микроглии и восстановления проницаемости ГЭБ [13], а также позволила нормализовать уровень мозгового нейротрофического фактора в сыворотке крови и улучшить показатели походки у пациентов с РС [14].
Аналогично, применение пробиотиков оказывало влияние на течение заболевания: так, например, на животной модели аутоиммунного энцефаломиелита применение штамма Escherichia coli Nissle 1917 приводило к снижению миграции аутореактивных CD4+ T-клеток в ЦНС и восстановлению проницаемости кишечника [18]. Штаммы Lactobacillus paracasei DSM 13434, Lactobacillus plantarum DSM 15312 и Lactobacillus plantarum DSM 15313 способствовали индукции регуляторных Т-клеток, причем при их применении по отдельности наблюдали исключительно профилактический эффект, в то время как совместное применение имело выраженное терапевтическое воздействие [19]. Сходный синергический эффект наблюдался при совместном применении Lactobacillus plantarum A7 и Bifidobacterium animalis [20].
Таким образом, сложные взаимодействия между микроорганизмами в некоторых случаях могут приводить к новым терапевтическим эффектам, как благоприятным, так и неблагоприятным, и это важно учитывать при подборе пробиотической терапии. В двух независимых исследованиях было показано, что терапевтическое применение бактерий Lactobacillus reuteri может быть ассоциировано как с облегчением симптомов аутоиммунного энцефаломиелита, так и с его обострением [21][77], что может объясняться особенностями взаимодействия с другими комменсалами кишечной микробиоты, а также экспрессией Lactobacillus reuteri пептидов, потенциально имитирующих миелиновый гликопротеин олигодендроцитов [78].
РОЛЬ МИКРОБИОТЫ КОЖИ В РАЗВИТИИ ПСОРИАЗА
Псориаз представляет собой хроническое иммуноопосредованное мультифакториальное заболевание, характеризующееся поражением кожи. По эпидемиологическим данным, псориазом страдает 2–3% населения планеты; это социально значимое заболевание, резко снижающее качество жизни пациентов и в некоторых случаях приводящее к их социальной изоляции и стигматизации [79][80].
Ключевую роль в развитии псориаза играет иммунная система: в здоровой коже Т-клетки и дендритные клетки присутствуют в небольшом количестве и участвуют в защите от патогенов. При псориазе число активированных Т-клеток и дендритных клеток в коже возрастает; они выделяют провоспалительные цитокины, которые, в свою очередь, запускают каскад реакций, обусловливающих характерные признаки псориаза, включая гиперпролиферацию кератиноцитов, их аномальную дифференцировку и ангиогенез [81].
Так, ИЛ-6 блокирует работу Т-регуляторных клеток, что усугубляет воспаление [82][83]. В то же время популяция Т-хелперов 17 активируется, что стимулирует синтез ИЛ-17, ИЛ-22 и пролиферацию кератиноцитов [84][85]. Секретируемые интерлейкины также способствуют привлечению из кровяного русла моноцитов, которые под действием провоспалительных цитокинов дифференцируются в макрофаги и дендритные клетки и также начинают синтезировать провоспалительные цитокины, в частности фактор некроза опухоли-альфа [81].
Несмотря на широкий спектр разработанных подходов к терапии псориаза и возможность достижения стойкой ремиссии во многих случаях, данное заболевание продолжает считаться неизлечимым. В настоящее время для псориаза легкой степени предлагается местное лечение (глюкокортикостероиды, витамин D, фототерапия), в то время как при более тяжелом течении может быть рассмотрена системная терапия ретиноидами, метотрексатом, циклоспорином, препаратами моноклональных антител. Однако пациенты не всегда реагируют на подобранное лечение, более того, длительная системная терапия зачастую сопряжена с развитием побочных эффектов, в связи с чем растет интерес к изучению новых стратегий лечения псориаза [30].
В последние годы появляется все больше сведений о вовлеченности микробиома в патогенез псориаза [10][11]. Системный характер развития заболевания ассоциирован с изменениями в микробиоте разных локусов организма, в том числе кожи [86–91] (табл.).
Примечательно, что для некоторых таксонов при псориазе, в частности для рода Staphylococcus, в разных исследованиях было показано как увеличение [86][88], так и снижение [87][90] численности. Данный феномен можно объяснить разными методологическими подходами при проведении исследований. Известно, что микробиота непораженной кожи пациентов с псориазом отличается от микробиоты пораженных участков, однако она также отличается от микробиоты кожи здоровых добровольцев [92][93]. Так, в исследованиях Z. Gao и соавт. [86], A. Boix-Amorós и соавт. [88] анализировались особенности микробиоты пораженной и непораженной кожи при псориазе, а также микробиота кожи здоровых добровольцев, в то время как в исследовании A. Fahlen и соавт. [87] не анализировали образцы непораженной кожи пациентов с псориазом, а в исследовании M. Assarsson и соавт. [90] отсутствовала группа здоровых добровольцев. Выбор анатомической области для взятия образца также оказывает влияние на результат исследования, что объясняется особенностями физиологии кожи разных участков тела [94][95]. Наконец, способ получения образцов – биопсия либо мазки кожи – также может влиять на результат исследования, что необходимо учитывать при интерпретации и обсуждении полученных результатов [86–88][90][92].
В ходе экспериментов на модели имиквимод-индуцированного псориаза у мышей, а также в ходе клинических испытаний было неоднократно показано уменьшение псориазоподобного воспаления у животных и симптомов псориаза у пациентов, получавших антибиотики и пробиотики [15][16][23–25][96]. Однако в то время как эффект пробиотиков на микробиоту кишечника при псориазе освещен в литературе достаточно подробно, данных о модуляции микробиоты кожи при псориазе посредством местного применения препаратов практически нет [97][98].
Микробиота кожи при псориазе изменяется в ответ на биологическую терапию: так, лечение устекинумабом – ингибитором ИЛ-12 и ИЛ-23, приводило к увеличению численности бактерий семейства Acinetobacter и уменьшению бактерий класса Bacilli и порядка Gemellales на коже туловища, а также к увеличению численности бактерий семейства Bradyrhizobiaceae и снижению бактерий рода Staphylococcus в области волосистой части головы [94]. В результате курса облучения ультрафиолетом как в области псориатической бляшки, так и в непораженной коже пациентов значительно снижалась численность бактерий рода Pseudomonas, в то время как численность бактерий рода Clostridium возрастала [90]. Кроме того, фототерапия значительно сокращала численность бактерий класса Bacteroidia, порядка Enterobacteriales, семейств Bacteroidaceae, Odoribacteraceae, Prevotellaceae, Enterobacteriaceae, а также родов Bacteroides, Odoribacter, Prevotella в области пораженной кожи [92].
Механизмы влияния микробиоты кожи на развитие псориаза разнообразны. Например, повышенная численность бактерий вида Streptococcus pyogenes при псориазе ведет к повышенной выработке ими М-белка, способного активировать аутореактивные Т-клетки ввиду феномена молекулярной мимикрии с 50-кДа кератином I типа [99][100]. Кроме того, в результате взаимодействия с некоторыми микроорганизмами-комменсалами кератиноциты способны вырабатывать антимикробные пептиды кателицидины (cathelicidin antimicrobial peptides, LL-37), которые связываются с нуклеиновыми кислотами клеток эпителия, подвергнувшихся апоптозу. Комплексы LL-37 с ДНК стимулируют синтез интерферонов I типа плазмоцитоидными дендритными клетками, в то время как комплексы с РНК способствуют выработке фактора некроза опухоли-альфа и индуцибельной синтазы оксида азота (Inducible Nitric Oxide Synthase, iNOS) миелоидными дендритными клетками. Данные цитокины способствуют дифференцировке Т-клеток в Т-хелперы 17, вырабатывающие ИЛ-17 и ИЛ-22, там самым играя ключевую роль в развитии псориаза [11]. Микробиота кожи способна запускать аберрантную иммунную реакцию [101] и оказывать влияние на пролиферацию кератиноцитов [102], участвуя в развитии псориаза.
РОЛЬ МИКРОБИОТЫ РОТОВОЙ ПОЛОСТИ В РАЗВИТИИ БОЛЕЗНИ ШЁГРЕНА
БШ представляет собой системное аутоиммунное поражение желез внешней секреции, прежде всего слюнных и слезных. При развитии симптомов на фоне других аутоиммунных патологий, например системной красной волчанки или ревматоидного артрита [103], заболевание рассматривается как синдром Шёгрена. БШ – одно из самых частых АИЗ: распространенность данной патологии в мире составляет 0,5–1% [12][104].
При БШ инфильтрация CD4+ Т-клетками, вырабатывающими провоспалительные цитокины, и выработка антинуклеарных аутоантител B-клетками повреждает экзокринные железы, что проявляется ксеростомией, сухим конъюнктивитом, дисфагией; характерны и внежелезистые проявления [105]. Помимо значительного снижения качества жизни, данное заболевание ассоциировано с развитием лимфопролиферативных заболеваний у пациентов, в частности неходжкинских лимфом [103]. Как и для других АИЗ, в лечении БШ применяется главным образом иммуносупрессивная терапия, однако ведется разработка новых таргетных патогенетических подходов [105].
Предполагается, что дисрегуляция иммунного ответа на метаболиты микроорганизмов-комменсалов может быть предрасполагающим фактором для развития аутоиммунной реакции при БШ [12]. Так, например, было показано, что фактор фон Виллебранда типа А, синтезируемый комменсалом ротовой полости Capnocytophaga ochracea, ввиду феномена перекрестной реактивности может вести к активации Т-клеток в отношении антигена А синдрома Шёгрена (Sjogren’s syndrome A antigen, SS-A), также называемого Ro60 [106]. С другой стороны, нарушение гомеостаза в полости рта ввиду ксеростомии может вносить вклад в дальнейшее усугубление дисбиоза [107]. Было продемонстрировано, что при БШ микробиота ротовой полости может стать одной из терапевтических мишеней [108]. В частности, лечение низкими дозами доксициклина нормализовало уровень ряда метаболитов, связанных с дисбиозом микробиоты полости рта у пациентов с БШ [17]. Более подробная информация об особенностях изменения микробиоты ротовой полости при БШ [109–114] приведена в таблице.
ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ КАК ПОТЕНЦИАЛЬНЫЙ ИНСТРУМЕНТ МОДУЛЯЦИИ МИКРОБИОМА ПРИ АУТОИММУННЫХ ЗАБОЛЕВАНИЯХ
ВВ вовлечены во множество физиологических и патологических процессов и участвуют в межклеточной коммуникации. Коммуникационная сеть охватывает не только везикулы, продуцируемые клетками человека, но и везикулы прокариотических клеток микробиома, и именно последние обсуждаются как потенциальный инструмент его модуляции. Было показано, что экзосомы способны оказывать влияние на состав микробиоты кишечника, однако возможные механизмы данных взаимодействий пока не до конца установлены [115]. Несмотря на то что кишечник является наиболее подробно изученным локусом в контексте связи микробиома человека и АИЗ, модуляция его микробиоты посредством ВВ при АИЗ на данный момент практически не представлена в литературе. Более того, большинство исследований, посвященных изучению взаимодействия между ВВ и микробиотой кишечника при аутоиммунных и воспалительных заболеваниях, преимущественно сосредоточено на моделях колита. В представленном обзоре намеренно рассматривалась менее широко освещенная взаимосвязь между микробиотой кишечника и РС, таким образом мы стремились подчеркнуть, что при АИЗ нарушение гомеостаза микробиома выходит за рамки пораженного органа. Впрочем, некоторые результаты, полученные на моделях колита, могут быть экстраполированы на модуляцию микробиоты кишечника, в частности при РС, и подсказать возможные направления для дальнейших исследований.
Так, многообещающими кандидатами для воздействия на микробиоту кишечника являются ВВ лактобактерий, которые играют первостепенную роль в поддержании гомеостаза кишечной микробиоты и обладают определенным иммуномодулирующим потенциалом [116–118]. Было показано, что ВВ Lactobacillus plantarum Q7 способствуют снижению количества провоспалительных (Proteobacteria) и увеличению количества противовоспалительных бактерий (Bifidobacteria и Muribaculaceae) в кишечнике [39].
В последние годы широко изучают ВВ, выделенные из молока: данный подход позволяет получить смесь везикул ряда полезных бактерий, включая лактобактерии. Сообщается, что ВВ, полученные из молока, способствуют увеличению количества бактерий родов Dubosiella, Bifidobacterium, Lachnoclostridium и Lachnospiraceae в кишечнике [40]. Более того, in vitro было продемонстрировано избирательное воздействие экзосом молока на бактерии: так, они не оказывают бактерицидного действия на грамположительные бактерии Staphylococcus aureus, Micrococcus luteus и Enterococcus faecalis, однако обладают бактериостатическим действием против грамотрицательных штаммов Escherichia coli, Pseudomonas aeruginosa и Proteus mirabilis, а также фунгистатическим действием на Candida albicans [41]. Кроме того, было показано, что ВВ молока способствовали восстановлению целостности кишечного барьера на модели индуцированного декстрансульфатом натрия колита у мышей [35]. Этот феномен может быть связан со стимуляцией синтеза короткоцепочечных жирных кислот в кишечнике и их эфиров, в частности бутирата и ацетата [40]. Экзосомы МСК плаценты человека влияют на синтез короткоцепочечных жирных кислот в кишечнике. В эксперименте L. Yang и соавт., в отличие от экзосом молока, они не оказали значительного влияния на синтез уксусной кислоты, однако способствовали синтезу масляной, валериановой и изомасляной кислот [36].
Говоря о потенциальной модуляции микробиоты кожи посредством ВВ необходимо отметить, что термины «пребиотики» (неперевариваемые ферментируемые соединения, стимулирующие рост и активность полезных бактерий), «пробиотики» (живые микроорганизмы, оказывающие положительный эффект на здоровье организма-хозяина) и «постбиотики» (продукты метаболизма микроорганизмов, оказывающие положительный эффект на здоровье организма-хозяина) традиционно применялись в контексте микробиоты кишечника, а в последние годы они также активно используются в контексте микробиоты кожи и местного применения [98][119–121].
ВВ богаты полиненасыщенными жирными кислотами, следовательно, способны выступать в качестве пребиотиков, способствуя росту липофильных бактерий, в частности Cutibacterium (ранее Propionibacterium), численность которых при псориазе снижается [122–125]. Подобное изменение микробиома имеет большое значение в патогенезе псориаза, поскольку известно, что данные бактерии способствуют развитию иммунного ответа, опосредованного Т-хелперами 2, а при снижении их количества баланс смещается в сторону ответа, опосредованного Т-хелперами 1, связанного с аутоиммунной активностью [121].
С другой стороны, ВВ самих бактерий, будучи продуктом их метаболизма, могут выступать в роли постбиотиков, причем, по некоторым данным, эффективность экзосом бактерий сравнима с эффективностью самих живых бактерий [37][38]. Более того, используя для терапии ВВ вместо самих бактерий, возможно избежать ограничений, связанных с тем, что живые бактерии могут быть ослаблены или повреждены на этапах культивирования или хранения. В ряде работ были продемонстрированы благоприятные эффекты ВВ бактерий здоровой микробиоты (Lactobacillus plantarum, Cutibacterium acnes, Staphylococcus epidermidis) на кожу, в том числе на регуляцию секреции кожного сала [126], снижение пигментации и образования морщин [127], уменьшение проявлений атопического дерматита [128][129].
Модуляция микробиоты ротовой полости на данный момент остается непростой задачей и часто рассматривается в комбинации с модуляцией кишечной микробиоты. Тем не менее для ряда пробиотиков было показано влияние на адгезию патогенов, формирование биопленок и поддержание оптимального рН в ротовой полости [130]. Штамм Lactobacillus acidophilus LA5 способен снижать адгезию патогенных микроорганизмов Porphyromonas gingivalis и Fusobacterium nucleatum, а бактерии Lactobacillus fermentum – адгезию Streptococcus mutans [131][132]. В свою очередь, бактерии Lactobacillus salivarius способствуют повышению буферной емкости слюны (способности слюны нейтрализовать кислоты и щелочи, поддерживая оптимальный рН) [133]. Таким образом, лактобактерии представляют собой перспективный источник ВВ как для борьбы с дисбиозом кишечника, так и для модуляции микробиоты ротовой полости, в том числе при АИЗ.
Как показывает анализ литературных данных, наблюдается определенный дисбаланс в исследованиях эффектов ВВ эу- и прокариотического происхождения. Несмотря на то что научным сообществом признается основополагающая роль в межклеточной коммуникации и поддержании гомеостаза любых ВВ, продуцируемые микробиомом человека ВВ чаще рассматриваются в контексте влияния на микробиом, а продуцируемые клетками человека – на организм в целом. В то же время взаимодействие и тех и других везикул остается областью малоизученной, при этом перспективной с точки зрения разработки новых лекарственных препаратов.
ЗАКЛЮЧЕНИЕ
Последние исследования подчеркивают важную роль микробиома организма человека в развитии АИЗ. Несмотря на то что на данный момент не установлено, является ли дисбиоз причиной или следствием дисрегуляции иммунных реакций, в ряде работ было продемонстрировано, что воздействие на микробиом облегчает симптомы основного заболевания, и это может оказаться эффективной терапевтической стратегией. ВВ, как было показано ранее, обладают широким спектром терапевтической активности за счет биологически активных веществ в составе; кроме того, результаты последних исследований позволяют предположить, что они могут быть также эффективны при воздействии на микробиоту разных локусов организма человека, в том числе при АИЗ. Полученные из разных источников ВВ способны стимулировать рост здоровой микробиоты и подавлять рост патогенных микроорганизмов. Для разработки новых стратегий терапии АИЗ необходимо более глубокое понимание сложных механизмов взаимодействия ВВ, микробиома и иммунной системы человека.
ВКЛАД АВТОРОВ
М.А. Пешкова, А.А. Корнеев и П.И. Котенева участвовали в сборе и анализе литературных источников, написании текста статьи, оформлении списка литературы, подготовке материала для публикации. Н.В. Кошелева провела научное редактирование статьи, доработала текст. П.С. Тимашев отвечал за отбор ключевой информации по тематике, финальную подготовку текста. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTIONS
Maria A. Peshkova, Alexander A. Korneev, and Polina I. Koteneva contributed to the compilation and analysis of literary sources, drafting the article, compiling the reference list, and preparing the manuscript for publication. Nastasia V. Kosheleva conducted scientific editing of the manuscript, refining its content. Peter S. Timashev curated essential information pertaining to the subject matter and coordinated the finalization of the manuscript. All the authors approved the final version of the article.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Соглашения о предоставлении из федерального бюджета грантов в форме субсидий в соответствии с пунктом 4 статьи 78.1 Бюджетного кодекса Российской Федерации на обеспечение проведения научных исследований российскими научными организациями и (или) образовательными организациями высшего образования совместно с иностранными организациями научных исследований в рамках обеспечения реализации программы двух- и многостороннего научно-технологического взаимодействия № 075–15-2021–951 от 28 сентября 2021 г.
Conflict of interest. The authors declare that there is no conflict of interest.
Financing. The study was financially supported by the Ministry of Science and Higher Education of the Russian Federation, under the Agreement on granting from the federal budget in the form of subsidies in accordance with paragraph 4 of Article 78.1 of the Budget Code of the Russian Federation to ensure the conduct of scientific research by Russian research organizations and (or) Educational organizations of higher education together with foreign research organizations in the framework of ensuring the implementation of the program of bilateral and multilateral scientific and technological cooperation No. 075–15-2021–951 dated September 28, 2021.
Список литературы
1. Guo H., Li L., Liu B., et al. Inappropriate treatment response to DMARDs: A pathway to diffi cult-to-treat rheumatoid arthritis. Int Immunopharmacol. 2023 Sep; 122: 110655. https://doi.org/10.1016/J.INTIMP.2023.110655. Epub 2023 Jul 21. PMID: 37481847
2. Laigle L., Chadli L., Moingeon P. Biomarker-driven development of new therapies for autoimmune diseases: current status and future promises. Expert Rev Clin Immunol. 2023 Mar; 19(3): 305–314. https://doi.org/10.1080/1744666X.2023.2172404. Epub 2023 Jan 27. PMID: 36680799
3. Vangoitsenhoven R., Cresci G.A.M. Role of microbiome and antibiotics in autoimmune diseases. Nutr Clin Pract. 2020 Jun; 35(3): 406–416. https://doi.org/10.1002/NCP.10489. Epub 2020 Apr 22. PMID: 32319703
4. Rosser E.C., Mauri C. A clinical update on the signifi cance of the gut microbiota in systemic autoimmunity. J Autoimmun. 2016 Nov; 74: 85–93. https://doi.org/10.1016/J.JAUT.2016.06.009. Epub 2016 Jul 29. PMID: 27481556
5. López P., De Paz B., Rodríguez-Carrio J., et al. Th17 responses and natural IgM antibodies are related to gut microbiota composition in systemic lupus erythematosus patients. Sci Rep. 2016 Apr 5; 6: 24072. https://doi.org/10.1038/SREP24072. PMID: 27044888; PMCID: PMC4820712
6. Needell J.C., Zipris D. The role of the intestinal microbiome in type 1 diabetes pathogenesis. Curr Diab Rep. 2016 Oct; 16(10): 89. https://doi.org/10.1007/S11892-016-0781-Z. PMID: 27523648
7. Jangi S., Gandhi R., Cox L.M., et al. Alterations of the human gut microbiome in multiple sclerosis. Nat Commun. 2016 Jun 28; 7: 12015. https://doi.org/10.1038/NCOMMS12015. PMID: 27352007; PMCID: PMC4931233
8. Chen J., Wright K., Davis J.M., et al. An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis. Genome Med. 2016 Apr 21; 8(1): 43. https://doi.org/10.1186/S13073-016-0299-7. PMID: 27102666; PMCID: PMC4840970
9. Coit P., Sawalha A.H. The human microbiome in rheumatic autoimmune diseases: A comprehensive review. Clin Immunol. 2016 Sep; 170: 70–79. https://doi.org/10.1016/J.CLIM.2016.07.026. Epub 2016 Aug 2. PMID: 27493014
10. Wang W.M., Jin H.Z. Skin microbiome: an actor in the pathogenesis of psoriasis. Chin Med J (Engl). 2018 Jan 5; 131(1): 95–98. https://doi.org/10.4103/0366-6999.221269. PMID: 29271387; PMCID: PMC5754965
11. Olejniczak-Staruch I., Ciążyńska M., Sobolewska-Sztychny D., et al. Alterations of the skin and gut microbiome in psoriasis and psoriatic arthritis. Int J Mol Sci. 2021 Apr 13; 22(8): 3998. https://doi.org/10.3390/ijms22083998. PMID: 33924414; PMCID: PMC8069836
12. Nikitakis N.G., Papaioannou W., Sakkas L.I., et al. The autoimmunity–oral microbiome connection. Oral Dis. 2017 Oct; 23(7): 828–839. https://doi.org/10.1111/ODI.12589. Epub 2016 Nov 24. PMID: 27717092
13. Li K., Wei S., Hu L., et al. Protection of fecal microbiota transplantation in a mouse model of multiple sclerosis. Mediators Infl amm. 2020 Aug 5; 2020: 2058272. https://doi.org/10.1155/2020/2058272. PMID: 32831634; PMCID: PMC7426773
14. Engen P.A., Zaferiou A., Rasmussen H., et al. Single-arm, nonrandomized, time series, single-subject study of fecal microbiota transplantation in multiple sclerosis. Front Neurol. 2020 Sep 8; 11: 978. https://doi.org/10.3389/fneur.2020.00978. PMID: 33013647; PMCID: PMC7506051
15. Vijayashankar M., Raghunath N. Pustular psoriasis responding to probiotics – a new insight. Our Dermatology Online. 2012; 3: 326–329. https://doi.org/10.7241/OURD.20124.71
16. Choy C.T., Chan U.K., Siu P.L.K., et al. A novel E3 probiotics formula restored gut dysbiosis and remodelled gut microbial network and microbiome dysbiosis index (MDI) in Southern Chinese adult psoriasis patients. Int J Mol Sci. 2023 Mar 31; 24(7): 6571. https://doi.org/10.3390/ijms24076571. PMID: 37047542; PMCID: PMC10094986
17. Herrala M., Turunen S., Hanhineva K., et al. Low-dose doxycycline treatment normalizes levels of some salivary metabolites associated with oral microbiota in patients with primary sjögren’s syndrome. Metabolites. 2021 Sep 3; 11(9): 595. https://doi.org/10.3390/metabo11090595. PMID: 34564411; PMCID: PMC8470364
18. Secher T., Kassem S., Benamar M., et al. Oral administration of the probiotic strain Escherichia coli Nissle 1917 reduces susceptibility to neuroinfl ammation and repairs experimental autoimmune encephalomyelitis-induced intestinal barrier dysfunction. Front Immunol. 2017 Sep 14; 8: 1096. https://doi.org/10.3389/fimmu.2017.01096. PMID: 28959254; PMCID: PMC5603654
19. Lavasani S., Dzhambazov B., Nouri M., et al. A novel probiotic mixture exerts a therapeutic effect on experimental autoimmune encephalomyelitis mediated by IL-10 producing regulatory T cells. PLoS One. 2010 Feb 2; 5(2): e9009. https://doi.org/10.1371/JOURNAL.PONE.0009009. PMID: 20126401; PMCID: PMC2814855
20. Salehipour Z., Haghmorad D., Sankian M., et al. Bifi dobacterium animalis in combination with human origin of Lactobacillus plantarum ameliorate neuroinfl ammation in experimental model of multiple sclerosis by altering CD4+ T cell subset balance. Biomed Pharmacother. 2017 Nov; 95: 1535–1548. https://doi.org/10.1016/J.BIOPHA.2017.08.117. Epub 2017 Sep 22. PMID: 28946394
21. He B., Hoang T.K., Tian X., et al. Lactobacillus reuteri reduces the severity of experimental autoimmune encephalomyelitis in mice by modulating gut microbiota. Front Immunol. 2019 Mar 7; 10: 385. https://doi.org/10.3389/FIMMU.2019.00385. PMID: 30899262; PMCID: PMC6416370
22. Zhao Q., Yu J., Zhou H., et al. Intestinal dysbiosis exacerbates the pathogenesis of psoriasis-like phenotype through changes in fatty acid metabolism. Sig Transduct Target Ther. 2023 Jan 30; 8(1): 40. https://doi.org/10.1038/s41392-022-01219-0. PMID: 36710269; PMCID: PMC9884668
23. Lu W., Deng Y., Fang Z., et al. Potential role of probiotics in ameliorating psoriasis by modulating gut microbiota in imiquimod-induced psoriasis-like mice. Nutrients. 2021 Jun 11; 13(6): 2010. https://doi.org/10.3390/NU13062010. PMID: 34207960; PMCID: PMC8230682
24. Chen Y.H., Wu C.S., Chao Y.H., et al. Lactobacillus pentosus GMNL-77 inhibits skin lesions in imiquimod-induced psoriasislike mice. J food drug Anal. 2017 Jul; 25(3): 559–566. https://doi.org/10.1016/J.JFDA.2016.06.003. Epub 2016 Aug 5. PMID: 28911642; PMCID: PMC9328808
25. Rather I.A., Bajpai V.K., Huh Y.S., et al. Probiotic lactobacillus sakei proBio-65 extract ameliorates the severity of imiquimod induced psoriasis-like skin infl ammation in a mouse model. Front Microbiol. 2018 May 17; 9: 1021. https://doi.org/10.3389/fmicb.2018.01021. PMID: 29867905; PMCID: PMC5968580
26. Akers J.C., Gonda D., Kim R., et al. Biogenesis of extracellular vesicles (EV): exosomes, microvesicles, retrovirus-like vesicles, and apoptotic bodies. J Neurooncol. 2013 May; 113(1): 1–11. https://doi.org/10.1007/s11060-013-1084-8. Epub 2013 Mar 2. PMID: 23456661; PMCID: PMC5533094
27. Zhang J., Buller B.A., Zhang Z.G., et al. Exosomes derived from bone marrow mesenchymal stromal cells promote remyelination and reduce neuroinfl ammation in the demyelinating central nervous system. Exp Neurol. 2022 Jan; 347: 113895. https://doi.org/10.1016/J.EXPNEUROL.2021.113895. Epub 2021 Oct 13. PMID: 34653510
28. Riazifar M., Mohammadi M.R., Pone E.J., et al. Stem cellderived exosomes as nanotherapeutics for autoimmune and neurodegenerative disorders. ACS Nano. 2019 Jun 25; 13(6): 6670–6688. https://doi.org/10.1021/acsnano.9b01004. Epub 2019 May 29. PMID: 31117376; PMCID: PMC6880946
29. Kimura K. Regulatory T cells in multiple sclerosis. Clin Exp Neuroimmunol. 2020 Aug; 11: 148–155. https://doi.org/10.1111/CEN3.12591
30. Zhang B., Lai R.C., Sim WK., et al. Topical application of mesenchymal stem cell exosomes alleviates the imiquimod induced psoriasis-like infl ammation. Int J Mol Sci. 2021 Jan 13; 22(2): 720. https://doi.org/10.3390/IJMS22020720. PMID: 33450859; PMCID: PMC7828312
31. Zhang Y., Yan J., Li Z., et al. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate psoriasis-like skin infl ammation. J Interferon Cytokine Res. 2022 Jan; 42(1): 8–18. https://doi.org/10.1089/JIR.2021.0146. PMID: 35041513
32. Rodrigues S.C., Cardoso R.M.S., Freire P.C., et al. Immunomodulatory properties of umbilical cord blood-derived small extracellular vesicles and their therapeutic potential for infl ammatory skin disorders. Int J Mol Sci. 2021 Sep 10; 22(18): 9797. https://doi.org/10.3390/IJMS22189797. PMID: 34575956; PMCID: PMC8468428
33. Xing Y., Li B., He J., et al. Labial gland mesenchymal stem cell derived exosomes-mediated miRNA-125b attenuates experimental Sjogren’s syndrome by targeting PRDM1 and suppressing plasma cells. Front Immunol. 2022 Apr 4; 13: 871096. https://doi.org/10.3389/fimmu.2022.871096. PMID: 35444638; PMCID: PMC9014006
34. Zhao Q., Bae E.H., Zhang Y., et al. Inhibitory effects of extracellular vesicles from iPS-cell-derived mesenchymal stem cells on the onset of sialadenitis in Sjögren’s syndrome are mediated by immunomodulatory splenocytes and improved by inhibiting miR125b. Int J Mol Sci. 2023 Mar 9 ; 24(6): 5258. https://doi.org/10.3390/ijms24065258 PMID: 36982329; PMCID: PMC10049013
35. Tong L., Zhang S., Liu Q., et al. Milk-derived extracellular vesicles protect intestinal barrier integrity in the gut-liver axis. Sci Adv. 2023 Apr 14; 9(15): eade5041. https://doi.org/10.1126/SCIADV.ADE5041. Epub 2023 Apr 12. PMID: 37043568; PMCID: PMC10096581
36. Yang L., Wang T., Zhang X., et al. Exosomes derived from human placental mesenchymal stem cells ameliorate myocardial infarction via anti-infl ammation and restoring gut dysbiosis. BMC Cardiovasc Disord. 2022 Feb 17; 22(1): 61. https://doi.org/10.1186/S12872-022-02508-W. PMID: 35172728; PMCID: PMC8851843
37. Barros C.P., Guimarães J.T., Esmerino E.A., et al. Paraprobiotics and postbiotics: concepts and potential applications in dairy products. Curr Opin Food Sci. 2020; 32: 1–8. https://doi.org/10.1016/J.COFS.2019.12.003
38. González-Lozano E., García-García J., Gálvez J., et al. Novel horizons in postbiotics: Lactobacillaceae extracellular vesicles and their applications in health and disease. Nutrients. 2022 Dec 13; 14(24): 5296. https://doi.org/10.3390/NU14245296. PMID: 36558455; PMCID: PMC9782203
39. Hao H., Zhang X., Tong L., et al. Effect of extracellular vesicles derived from lactobacillus plantarum Q7 on gut microbiota and ulcerative colitis in mice. Front Immunol. 2021 Dec 2; 12: 777147. https://doi.org/10.3389/FIMMU.2021.777147. PMID: 34925349; PMCID: PMC8674835
40. Du C., Wang K., Zhao Y., et al. Supplementation with milk-derived extracellular vesicles shapes the gut microbiota and regulates the transcriptomic landscape in experimental colitis. Nutrients. 2022 Apr 26; 14(9): 1808. https://doi.org/10.3390/NU14091808. PMID: 35565775; PMCID: PMC9104790
41. Shaban A.M., Raslan M., Sharawi Z.W., et al. Antibacterial, antifungal, and anticancer effects of camel milk exosomes: an in vitro study. Vet Sci. 2023 Feb 6; 10(2): 124. https://doi.org/10.3390/VETSCI10020124. PMID: 36851428; PMCID: PMC9963947
42. Wajda D.A., Sosnoff J.J. Cognitive-motor interference in multiple sclerosis: a systematic review of evidence, correlates, and consequences. Biomed Res Int. 2015; 2015: 720856. https://doi.org/10.1155/2015/720856. Epub 2015 Mar 9. PMID: 25839039; PMCID: PMC4369906
43. Rutsch A., Kantsjö J.B., Ronchi F. The gut-brain axis: how microbiota and host infl ammasome infl uence brain physiology and pathology. Front Immunol. 2020 Dec 10; 11: 604179. https://doi.org/10.3389/FIMMU.2020.604179. PMID: 33362788; PMCID: PMC7758428
44. Dyńka D., Kowalcze K., Paziewska A. The role of ketogenic diet in the treatment of neurological diseases. Nutrients. 2022 Nov 24; 14(23): 5003. https://doi.org/10.3390/NU14235003. PMID: 36501033; PMCID: PMC9739023
45. Mora P., Chapouly C. Astrogliosis in multiple sclerosis and neuroinfl ammation: what role for the notch pathway? Front Immunol. 2023 Oct 23; 14: 1254586. https://doi.org/10.3389/FIMMU.2023.1254586. PMID: 37936690; PMCID: PMC10627009
46. Schauf M., Chinthapatla H., Dimri S., et al. Economic burden of multiple sclerosis in the United States: A systematic literature review. J Manag care Spec Pharm. 2023 Dec; 29(12): 1354-1368. https://doi.org/10.18553/JMCP.2023.23039. Epub 2023 Nov 17. PMID: 37976077; PMCID: PMC10776266
47. Hauser S.L., Cree B.A.C. Treatment of multiple sclerosis: a review. Am J Med. 2020 Dec; 133(12): 1380-1390.e2. https://doi.org/10.1016/J.AMJMED.2020.05.049. Epub 2020 Jul 17. PMID: 32682869; PMCID: PMC7704606
48. Baecher-Allan C., Kaskow B.J., Weiner H.L. Multiple sclerosis: mechanisms and immunotherapy. Neuron. 2018 Feb 21; 97(4): 742–768. https://doi.org/10.1016/J.NEURON.2018.01.021. PMID: 29470968
49. Prajeeth C.K., Dittrich-Breiholz O., Talbot S.R., et al. IFN-γ producing Th1 cells induce different transcriptional profi les in microglia and astrocytes. Front Cell Neurosci. 2018 Oct 10; 12: 352. https://doi.org/10.3389/fncel.2018.00352. PMID: 30364000; PMCID: PMC6191492
50. Chen J., Liu X., Zhong Y. Interleukin-17A: The Key cytokine in neurodegenerative diseases. Front Aging Neurosci. 2020 Sep 29; 12: 566922. https://doi.org/10.3389/fnagi.2020.566922. PMID: 33132897; PMCID: PMC7550684
51. Yu A., Duan H., Zhang T., et al. IL-17A promotes microglial activation and neuroinfl ammation in mouse models of intracerebral haemorrhage. Mol Immunol. 2016 May; 73: 151–157. https://doi.org/10.1016/J.MOLIMM.2016.04.003. Epub 2016 Apr 22. PMID: 27107665
52. Huppert J., Closhen D., Croxford A., et al. Cellular mechanisms of IL-17-induced blood-brain barrier disruption. FASEB J. 2010 Apr; 24(4): 1023–1034. https://doi.org/10.1096/FJ.09-141978. Epub 2009 Nov 25. PMID: 19940258
53. Alvarez J.I., Cayrol R., Prat A. Disruption of central nervous system barriers in multiple sclerosis. Biochim Biophys Acta – Mol Basis Dis. 2011 Feb; 1812(2): 252–264. https://doi.org/10.1016/J.BBADIS.2010.06.017. Epub 2010 Jul 7. PMID: 20619340
54. Fraussen J., de Bock L., Somers V. B cells and antibodies in progressive multiple sclerosis: Contribution to neurodegeneration and progression. Autoimmun Rev. 2016 Sep; 15(9): 896–899. https://doi.org/10.1016/J.AUTREV.2016.07.008. Epub 2016 Jul 7. PMID: 27396817
55. Holloman J.P., Axtell R.C., Monson N.L., et al. The role of B Cells in primary progressive multiple sclerosis. Front Neurol. 2021 Jun 7; 12: 680581. https://doi.org/10.3389/FNEUR.2021.680581. PMID: 34163430; PMCID: PMC8215437
56. Ochoa-Reparaz J., Magori K., Kasper L.H. The chicken or the egg dilemma: intestinal dysbiosis in multiple sclerosis. Ann Transl Med. 2017 Mar; 5(6): 145. https://doi.org/10.21037/ATM.2017.01.18. PMID: 28462225; PMCID: PMC5395488
57. Gandy K.A.O., Zhang J., Nagarkatti P., et al. The role of gut microbiota in shaping the relapse-remitting and chronicprogressive forms of multiple sclerosis in mouse models. Sci Rep. 2019 May 6; 9(1): 6923. https://doi.org/10.1038/S41598-019-43356-7. PMID: 31061496; PMCID: PMC6502871
58. Parodi B., Kerlero de Rosbo N. The gut-brain axis in multiple sclerosis. Is Its dysfunction a pathological trigger or a consequence of the disease? Front Immunol. 2021 Sep 21; 12: 718220. https://doi.org/10.3389/FIMMU.2021.718220. PMID: 34621267; PMCID: PMC8490747
59. Miyake S., Kim S., Suda W., et al. Dysbiosis in the gut microbiota of patients with multiple sclerosis, with a striking depletion of species belonging to Clostridia XIVa and IV clusters. PLoS One. 2015 Sep 14; 10(9): e0137429. https://doi.org/10.1371/JOURNAL.PONE.0137429. PMID: 26367776; PMCID: PMC4569432
60. Yadav M., Ali S., Shrode R.L., et al. Multiple sclerosis patients have an altered gut mycobiome and increased fungal to bacterial richness. PLoS One. 022 Apr 26; 17(4): e0264556. https://doi.org/10.1371/JOURNAL.PONE.0264556. PMID: 35472144; PMCID: PMC9041819
61. Chen J., Chia N., Kalari K.R., et al. Multiple sclerosis patients have a distinct gut microbiota compared to healthy controls. Sci Rep. 2016 Jun 27; 6: 28484. https://doi.org/10.1038/SREP28484. PMID: 27346372; PMCID: PMC4921909
62. Nouri M., Bredberg A., Weström B., et al. Intestinal barrier dysfunction develops at the onset of experimental autoimmune encephalomyelitis, and can be induced by adoptive transfer of auto-reactive T cells. PLoS One. 2014 Sep 3; 9(9): e106335. https://doi.org/10.1371/JOURNAL.PONE.0106335. PMID: 25184418; PMCID: PMC4153638
63. Buscarinu M.C., Cerasoli B., Annibali V., et al. Altered intestinal permeability in patients with relapsing-remitting multiple sclerosis: A pilot study. Mult Scler. 2017 Mar; 23(3): 442–446. https://doi.org/10.1177/1352458516652498. Epub 2016 Jul 11. PMID: 27270497
64. Kinashi Y., Hase K. Partners in leaky gut syndrome: intestinal dysbiosis and autoimmunity. Front Immunol. 2021 Apr 22; 12: 673708. https://doi.org/10.3389/FIMMU.2021.673708. PMID: 33968085; PMCID: PMC8100306
65. Pellegrino A., Coppola G., Santopaolo F., et al. Role of Akkermansia in human diseases: from causation to therapeutic properties. Nutrients. 2023 Apr 8; 15(8): 1815. https://doi.org/10.3390/NU15081815. PMID: 37111034; PMCID: PMC10142179
66. Derrien M., Van Baarlen P., Hooiveld G., et al. Modulation of mucosal immune response, tolerance, and proliferation in mice colonized by the mucin-degrader Akkermansia muciniphila. Front Microbiol. 2011 Aug 1; 2: 166. https://doi.org/10.3389/FMICB.2011.00166. PMID: 21904534; PMCID: PMC3153965
67. Wu N., Li X., Ma H., et al. The role of the gut microbiota and fecal microbiota transplantation in neuroimmune diseases. Front Neurol. 2023 Feb 1; 14: 1108738. https://doi.org/10.3389/FNEUR.2023.1108738. PMID: 36816570; PMCID: PMC9929158
68. Braniste V., Al-Asmakh M., Kowal C., et al. The gut microbiota infl uences blood-brain barrier permeability in mice. Sci Transl Med. 2014 Nov 19; 6(263): 263ra158. https://doi.org/10.1126/SCITRANSLMED.3009759. PMID: 25411471; PMCID: PMC4396848
69. Venkatesh M., Mukherjee S., Wang H., et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and toll-like receptor 4. Immunity. 2014 Aug 21; 41(2): 296–310. https://doi.org/10.1016/J.IMMUNI.2014.06.014. Epub 2014 Jul 24. PMID: 25065623; PMCID: PMC4142105
70. Scott S.A., Fu J., Chang P.V. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor. Proc Natl Acad Sci USA. 2020 Aug 11; 117(32): 19376–19387. https://doi.org/10.1073/pnas.2000047117. Epub 2020 Jul 27. PMID: 32719140; PMCID: PMC7431026
71. Singh R., Chandrashekharappa S., Bodduluri S.R., et al. Enhancement of the gut barrier integrity by a microbial metabolite through the Nrf2 pathway. Nat Commun. 2019 Jan 9; 10(1): 89. https://doi.org/10.1038/S41467-018-07859-7. PMID: 30626868; PMCID: PMC6327034
72. Rothhammer V., Mascanfroni I.D., Bunse L., et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and CNS infl ammation via the aryl hydrocarbon receptor. Nat Med. 2016 Jun; 22(6): 586–597. https://doi.org/10.1038/NM.4106. Epub 2016 May 9. PMID: 27158906; PMCID: PMC4899206
73. Ochoa-Repáraz J., Mielcarz D.W., Wang Y., et al. A polysaccharide from the human commensal Bacteroides fragilis protects against CNS demyelinating disease. Mucosal Immunol. 2010 Sep; 3(5): 487–495. https://doi.org/10.1038/MI.2010.29. Epub 2010 Jun 9. PMID: 20531465
74. Hoban A.E., Stilling R.M., Ryan F.J., et al. Regulation of prefrontal cortex myelination by the microbiota. Transl Psychiatry. 2016 Apr 5; 6(4): e774. https://doi.org/10.1038/TP.2016.42. PMID: 27045844; PMCID: PMC4872400
75. Berer K., Gerdes L.A., Cekanaviciute E., et al. Gut microbiota from multiple sclerosis patients enables spontaneous autoimmune encephalomyelitis in mice. Proc Natl Acad Sci U S A. 2017 Oct 3; 114(40): 10719–10724. https://doi.org/10.1073/pnas.1711233114. Epub 2017 Sep 11. PMID: 28893994; PMCID: PMC5635914
76. Cekanaviciute E., Yoo B.B., Runia T.F., et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models. Proc Natl Acad Sci USA. 2017 Oct 3; 114(40): 10713–10718. https://doi.org/10.1073/pnas.1711235114. Epub 2017 Sep 11. PMID: 28893978; PMCID: PMC5635915
77. Montgomery T.L., Künstner A., Kennedy J.J., et al. Interactions between host genetics and gut microbiota determine susceptibility to CNS autoimmunity. Proc Natl Acad Sci U S A. 2020 Nov 3; 117(44): 27516–27527. https://doi.org/10.1073/pnas.2002817117. Epub 2020 Oct 19. PMID: 33077601; PMCID: PMC7959502
78. Miyauchi E., Kim S.W., Suda W., et al. Gut microorganisms act together to exacerbate infl ammation in spinal cords. Nature. 2020 Sep; 585(7823): 102–106. https://doi.org/10.1038/S41586-020-2634-9. Epub 2020 Aug 26. PMID: 32848245
79. Zhang H., Yang Z., Tang K., et al. Stigmatization in patients with psoriasis: a mini review. Front Immunol. 2021 Nov 15; 12: 715839. https://doi.org/10.3389/FIMMU.2021.715839. PMID: 34867945; PMCID: PMC8634029
80. Jankowiak B., Krajewska-Kułak E., Jakoniuk M., et al. Stigmatization among patients with plaque psoriasis. J Clin Med. 2023 Oct 9; 12(19): 6425. https://doi.org/10.3390/JCM12196425. PMID: 37835068; PMCID: PMC10573936
81. Zhou X., Chen Y., Cui L., et al. Advances in the pathogenesis of psoriasis: from keratinocyte perspective. Cell Death Dis. 2022 Jan 24; 13(1): 81. https://doi.org/10.1038/S41419-022-04523-3. PMID: 35075118; PMCID: PMC8786887
82. Goodman W.A., Levine A.D., Massari J.V., et al. IL-6 signaling in psoriasis prevents immune suppression by regulatory T cells. J Immunol. 2009 Sep 1; 183(5): 3170–3176. https://doi.org/10.4049/JIMMUNOL.0803721. Epub 2009 Jul 31. PMID: 19648274; PMCID: PMC2903207
83. Yang L., Li B., Dang E., et al. Impaired function of regulatory T cells in patients with psoriasis is mediated by phosphorylation of STAT3. J Dermatol Sci. 2016 Feb; 81(2): 85–92. https://doi.org/10.1016/J.JDERMSCI.2015.11.007. Epub 2015 Nov 17. PMID: 26627723
84. Harris T.J., Grosso J.F., Yen H.-R., et al. Cutting edge: An in vivo requirement for STAT3 signaling in TH17 development and TH17dependent autoimmunity. J Immunol. 2007 Oct 1; 179(7): 4313–4317. https://doi.org/10.4049/JIMMUNOL.179.7.4313. PMID: 17878325
85. Chen Z., Laurence A., Kanno Y., et al. Selective regulatory function of Socs3 in the formation of IL-17-secreting T cells. Proc Natl Acad Sci USA. 2006 May 23; 103(21): 8137–8142. https://doi.org/10.1073/PNAS.0600666103. Epub 2006 May 12. PMID: 16698929; PMCID: PMC1459629
86. Gao Z., Tseng C.H., Strober B.E., et al. Substantial alterations of the cutaneous bacterial biota in psoriatic lesions. PLoS One. 2008 Jul 23; 3(7): e2719. https://doi.org/10.1371/JOURNAL.PONE.0002719. PMID: 18648509; PMCID: PMC2447873
87. Fahlén A., Engstrand L., Baker B.S., et al. Comparison of bacterial microbiota in skin biopsies from normal and psoriatic skin. Arch Dermatol Res. 2012 Jan; 304(1): 15–22. https://doi.org/10.1007/S00403-011-1189-X. Epub 2011 Nov 8. PMID: 22065152
88. Boix-Amorós A., Badri M.H., Manasson J., et al. Alterations in the cutaneous microbiome of patients with psoriasis and psoriatic arthritis reveal similarities between non-lesional and lesional skin. Ann Rheum Dis. 2023 Apr; 82(4): 507–514. https://doi.org/10.1136/ARD-2022-223389. Epub 2022 Dec 12. PMID: 36600182
89. Assarsson M., Söderman J., Dienus O., et al. Signifi cant differences in the bacterial microbiome of the pharynx and skin in patients with psoriasis compared with healthy controls. Acta Derm Venereol. 2020 Sep 30; 100(16): adv00273. https://doi.org/10.2340/00015555-3619. PMID: 32852562; PMCID: PMC9234991
90. Assarsson M., Duvetorp A., Dienus O., et al. Signifi cant changes in the skin microbiome in patients with chronic plaque psoriasis after treatment with narrowband ultraviolet B. Acta Derm Venereol. 2018 Apr 16; 98(4): 428–436. https://doi.org/10.2340/00015555-2859. PMID: 29199351
91. Alekseyenko A.V., Perez-Perez G.I., Souza A. De, et al. Community differentiation of the cutaneous microbiota in psoriasis. Microbiome. 2013 Dec 23; 1(1): 31. https://doi.org/10.1186/2049-2618-1-31. PMID: 24451201; PMCID: PMC4177411
92. Rungjang A., Meephansan J., Payungporn S., et al. Skin microbiota profi les from tape stripping and skin biopsy samples of patients with psoriasis treated with narrowband ultraviolet B. Clin Cosmet Investig Dermatol. 2022 Aug 30; 15: 1767–1778. https://doi.org/10.2147/CCID.S374871. PMID: 36065340; PMCID: PMC9440725
93. Aslan Kayıran M., Sahin E., Koçoğlu E., et al. Is cutaneous microbiota a player in disease pathogenesis? Comparison of cutaneous microbiota in psoriasis and seborrheic dermatitis with scalp involvement. Indian J Dermatol Venereol Leprol. 2022 NovDec; 88(6): 738–748. https://doi.org/10.25259/IJDVL_323_21. PMID: 35389020
94. Loesche M.A., Farahi K., Capone K., et al. Longitudinal study of the psoriasis-associated skin microbiome during therapy with Ustekinumab in a randomized phase 3b clinical trial. J Invest Dermatol. 2018 Sep; 138(9): 1973–1981. https://doi.org/10.1016/jjid.2018.03.1501. Epub 2018 Mar 17. PMID: 29559344
95. Grice E.A., Kong H.H., Conlan S., et al. Topographical and temporal diversity of the human skin microbiome. Science. 2009 May 29; 324(5931): 1190–1192. https://doi.org/10.1126/SCIENCE.1171700. PMID: 19478181; PMCID: PMC2805064
96. Zákostelská Z., Málková J., Klimešová K., et al. Intestinal microbiota promotes psoriasis-like skin infl ammation by enhancing Th17 response. PLoS One. 2016 Jul 19; 11(7): e0159539. https://doi.org/10.1371/JOURNAL.PONE.0159539. PMID: 27434104; PMCID: PMC4951142
97. França K. Topical probiotics in dermatological therapy and skincare: a concise review. Dermatol Ther (Heidelb). 2021 Feb; 11(1): 71–77. https://doi.org/10.1007/S13555-020-00476-7. Epub 2020 Dec 19. PMID: 33340341; PMCID: PMC7859136
98. Habeebuddin M., Karnati R.K., Shiroorkar P.N., et al. Topical probiotics: more than a skin deep. Pharmaceutics. 2022 Mar 3; 14(3): 557. https://doi.org/10.3390/PHARMACEUTICS14030557. PMID: 35335933; PMCID: PMC8955881
99. Leung D.Y.M., Travers J.B., Giorno R., et al. Evidence for a streptococcal superantigen-driven process in acute guttate psoriasis. J Clin Invest. 1995 Nov; 96(5): 2106–2112. https://doi.org/10.1172/JCI118263. PMID: 7593594; PMCID: PMC185858
100. Valdimarsson H., Baker B.S., Jónsdóttir I., et al. Psoriasis: a T-cell-mediated autoimmune disease induced by streptococcal superantigens? Immunol Today. 1995 Mar; 16(3): 145–149. https://doi.org/10.1016/0167-5699(95)80132-4. PMID: 7718088
101. Rendon A., Schäkel K. Psoriasis pathogenesis and treatment. Int J Mol Sci. 2019 Mar 23; 20(6): 1475. https://doi.org/10.3390/ijms20061475. PMID: 30909615; PMCID: PMC6471628
102. Hsu D.K., Fung M.A., Chen H.-L. Role of skin and gut microbiota in the pathogenesis of psoriasis, an infl ammatory skin disease. Med Microecol. 2020 June; 4: 100016. https://doi.org/10.1016/j.medmic.2020.100016
103. Kim H., Cho S.K., Kim H.W., et al. The prevalence of Sjögren’s syndrome in rheumatoid arthritis patients and their clinical features. J Korean Med Sci. 2020 Nov 23; 35(45): e369. https://doi.org/10.3346/JKMS.2020.35.E369. PMID: 33230982; PMCID: PMC7683240
104. Xu J., Chen C., Yin J., et al. Lactate-induced mtDNA accumulation activates cGAS-STING signaling and the infl ammatory response in Sjögren’s syndrome. Int J Med Sci. 2023 Aug 15; 20(10): 1256– 1271. https://doi.org/10.7150/IJMS.83801. PMID: 37786436; PMCID: PMC10542019
105. Zhan Q., Zhang J., Lin Y., et al. Pathogenesis and treatment of Sjogren’s syndrome: Review and update. Front Immunol. 2023 Feb 2; 14: 1127417. https://doi.org/10.3389/fimmu.2023.1127417. PMID: 36817420; PMCID: PMC9932901
106. Szymula A., Rosenthal J., Szczerba B.M., et al. T cell epitope mimicry between Sjögren’s syndrome Antigen A (SSA)/ Ro60 and oral, gut, skin and vaginal bacteria. Clin Immunol. 2014 May-Jun; 152(1–2): 1–9. https://doi.org/10.1016/J.CLIM.2014.02.004. Epub 2014 Feb 19. PMID: 24576620; PMCID: PMC4004658
107. Bellando-Randone S., Russo E., Venerito V., et al. Exploring the oral microbiome in rheumatic diseases, state of art and future prospective in personalized medicine with an AI approach. J Pers Med. 2021 Jun 30; 11(7): 625. https://doi.org/10.3390/JPM11070625. PMID: 34209167; PMCID: PMC8306274
108. Lee J., Alam J., Choi E., et al. Association of a dysbiotic oral microbiota with the development of focal lymphocytic sialadenitis in IκB-ζ-defi cient mice. NPJ Biofi lms Microbiomes. 2020 Oct 30; 6(1): 49. https://doi.org/10.1038/S41522-020-00158-4. PMID: 33127905; PMCID: PMC7599236
109. van der Meulen T.A., Harmsen H.J.M., Bootsma H., et al. Dysbiosis of the buccal mucosa microbiome in primary Sjögren’s syndrome patients. Rheumatology (Oxford). 2018 Dec 1; 57(12): 2225–2234. https://doi.org/10.1093/RHEUMATOLOGY/KEY215. PMID: 30060225
110. Rusthen S., Kristoffersen A.K., Young A., et al. Dysbiotic salivary microbiota in dry mouth and primary Sjögren’s syndrome patients. PLoS One. 2019 Jun 18; 14(6): e0218319. https://doi.org/10.1371/JOURNAL.PONE.0218319. PMID: 31211815; PMCID: PMC6581286
111. Zhou Z., Ling G., Ding N., et al. Molecular analysis of oral microfl ora in patients with primary Sjögren’s syndrome by using high-throughput sequencing. PeerJ. 2018 Sep 28; 6: e5649. https://doi.org/10.7717/PEERJ.5649. PMID: 30280027; PMCID: PMC6166617
112. Siddiqui H., Chen T., Aliko A., et al. Microbiological and bioinformatics analysis of primary Sjogren’s syndrome patients with normal salivation. J Oral Microbiol. 2016 Oct 20; 8: 31119. https://doi.org/10.3402/JOM.V8.31119. PMID: 27770517; PMCID: PMC5075221
113. Wang X., Pang K., Wang J., et al. Microbiota dysbiosis in primary Sjögren’s syndrome and the ameliorative effect of hydroxychloroquine. Cell Rep. 2022 Sep 13; 40(11): 111352. https://doi.org/10.1016/J.CELREP.2022.111352. PMID: 36103827
114. Alam J., Lee A., Lee J., et al. Dysbiotic oral microbiota and infected salivary glands in Sjögren’s syndrome. PLoS One. 2020 Mar 24; 15(3): e0230667. https://doi.org/10.1371/JOURNAL.PONE.0230667. PMID: 32208441; PMCID: PMC7092996
115. Zhou F., Paz H.A., Sadri M., et al. Nutrient Sensing, nutrition, and metabolism: dietary bovine milk exosomes elicit changes in bacterial communities in C57BL/6 mice. Am J Physiol – Gastrointest Liver Physiol. 2019 Nov 1; 317(5): G618–G624. https://doi.org/10.1152/AJPGI.00160.2019. Epub 2019 Sep 11. PMID: 31509432; PMCID: PMC6879888
116. Rastogi S., Singh A. Gut microbiome and human health: exploring how the probiotic genus Lactobacillus modulate immune responses. Front Pharmacol. 2022 Oct 24; 13: 1042189. https://doi.org/10.3389/fphar.2022.1042189. PMID: 36353491; PMCID: PMC9638459
117. Walter J. Ecological role of lactobacilli in the gastrointestinal tract: implications for fundamental and biomedical research. Appl Environ Microbiol. 2008 Aug; 74(16): 4985–4996. https://doi.org/10.1128/AEM.00753-08. Epub 2008 Jun 6. PMID: 18539818; PMCID: PMC2519286
118. Dempsey E., Corr S.C. Lactobacillus spp. for gastrointestinal health: current and future perspectives. Front Immunol. 2022 Apr 6; 13: 840245. https://doi.org/10.3389/FIMMU.2022.840245. PMID: 35464397; PMCID: PMC9019120
119. De Almeida C.V., Antiga E., Lulli M. Oral and topical probiotics and postbiotics in skincare and dermatological therapy: a concise review. Microorganisms. 2023 May 27; 11(6): 1420. https://doi.org/10.3390/MICROORGANISMS11061420. PMID: 37374920; PMCID: PMC10301930
120. Gelmetti C., Rigoni C., Cantù A.M., et al. Topical prebiotics/ postbiotics and PRURISCORE validation in atopic dermatitis. International study of 396 patients. J Dermatolog Treat. 2023 Dec; 34(1): 2131703. https://doi.org/10.1080/09546634.2022.2131703. Epub 2022 Oct 17. PMID: 36205596
121. Knackstedt R., Knackstedt T., Gatherwright J. The role of topical probiotics in skin conditions: A systematic review of animal and human studies and implications for future therapies. Exp Dermatol. 2020 Jan; 29(1): 15–21. https://doi.org/10.1111/EXD.14032. Epub 2019 Sep 18. PMID: 31494971
122. Hussey G.S., Molina C.P., Cramer M.C., et al. Lipidomics and RNA sequencing reveal a novel subpopulation of nanovesicle within extracellular matrix biomaterials. Sci Adv. 2020 Mar 20; 6(12): eaay4361. https://doi.org/10.1126/SCIADV.AAY4361. PMID: 32219161; PMCID: PMC7083606
123. Manzaneque-López M.C., Sánchez-López C.M., Pérez-Bermúdez P., et al. Dietary-derived exosome-like nanoparticles as bacterial modulators: beyond microRNAs. Nutrients. 2023 Mar 3; 15(5): 1265. https://doi.org/10.3390/NU15051265. PMID: 36904264; PMCID: PMC10005434
124. Skowron K., Bauza-Kaszewska J., Kraszewska Z., et al. Human skin microbiome: impact of intrinsic and extrinsic factors on skin microbiota. Microorganisms. 2021 Mar 5; 9(3): 543. https://doi.org/10.3390/MICROORGANISMS9030543. PMID: 33808031; PMCID: PMC7998121
125. Quan C., Chen X.Y., Li X., et al. Psoriatic lesions are characterized by higher bacterial load and imbalance between Cutibacterium and Corynebacterium. J Am Acad Dermatol. 2020 Apr; 82(4): 955–961. https://doi.org/10.1016/J.JAAD.2019.06.024. Epub 2019 Jun 19. PMID: 31228520
126. Cros M.P., Mir-Pedrol J., Toloza L., et al. New insights into the role of Cutibacterium acnes-derived extracellular vesicles in infl ammatory skin disorders. Sci Rep. 2023 Sep 25; 13(1): 16058. https://10.1038/S41598-023-43354-W. PMID: 37749255; PMCID: PMC10520063
127. Jo C.S., Myung C.H., Yoon Y.C., et al. The effect of lactobacillus plantarum extracellular vesicles from Korean women in their 20s on skin aging. Curr Issues Mol Biol. 2022 Jan 21;44(2):526–540. https://doi.org/10.3390/CIMB44020036. PMID: 35723322; PMCID: PMC8928950
128. Zhou H., Tan X., Chen G., et al. Extracellular vesicles of commensal skin microbiota alleviate cutaneous infl ammation in atopic dermatitis mouse model by re-establishing skin homeostasis. J Invest Dermatol. 2023 Mar 11: S0022-202X(23)00169-0. https://doi.org/10.1016/J.JID.2023.02.023. Epub ahead of print. PMID: 36907322
129. Kim M.H., Choi S.J., Choi H., et al. Lactobacillus plantarumderived extracellular vesicles protect atopic dermatitis induced by Staphylococcus aureus-derived extracellular vesicles. Allergy Asthma Immunol Res. 2018 Sep; 10(5): 516–532. https://doi.org/10.4168/AAIR.2018.10.5.516. PMID: 30088371; PMCID: PMC6082821
130. Rebelo M.B., Oliveira C.S., Tavaria F.K. Novel strategies for preventing dysbiosis in the oral cavity. Front Biosci. 2023 Oct 16; 15(4): 23. https://doi.org/10.31083/j.fbe1504023. PMID: 38163934
131. Zhang Y., Ding Y., Guo Q. Probiotic species in the management of periodontal diseases: an overview. Front Cell Infect Microbiol. 2022 Mar 25; 12: 806463. https://doi.org/10.3389/FCIMB.2022.806463. PMID: 35402306; PMCID: PMC8990095
132. Bizzini B., Pizzo G., Scapagnini G., et al. Probiotics and oral health. Curr Pharm Des. 2012; 18(34): 5522–5531. https://doi.org/10.2174/138161212803307473. PMID: 22632388
133. Abikshyeet P., Mishra P., Bhuyan L., et al. Probiotics: dawn of a new era in dental caries management. J Pharm Bioallied Sci. 2022 Jul; 14(Suppl 1): S34–S38. https://doi.org/10.4103/JPBS.JPBS_801_21. Epub 2022 Jul 13. PMID: 36110745; PMCID: PMC9469361
Об авторах
М. А. ПешковаРоссия
Пешкова Мария Алексеевна*, младший научный сотрудник Научного центра мирового уровня «Цифровой биодизайн и персонализированное здравоохранение»
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
А. А. Корнеев
Россия
Корнеев Александр Александрович, лаборант Лаборатории синтеза полимеров медицинского назначения Института регенеративной медицины Научно-технологического парка биомедицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
П. И. Котенева
Россия
Котенева Полина Игоревна, лаборант Дизайн-центра «Биофабрика» Института регенеративной медицины Научно-технологического парка биомедицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Н. В. Кошелева
Россия
Кошелева Настасья Владимировна, канд. биол. наук, доцент, заведующая лабораторией клинических смартнанотехнологий Института регенеративной медицины Научно-технологического парка биомедицины
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
П. С. Тимашев
Россия
Тимашев Петр Сергеевич, д-р хим. наук, профессор Научного центра мирового уровня «Цифровой биодизайн и персонализированное здравоохранение», научный руководитель Научно-технологического парка биомедицины; старший научный сотрудник химического факультета
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119048
Ленинские горы, д. 1, стр. 3, г. Москва, 119991







































