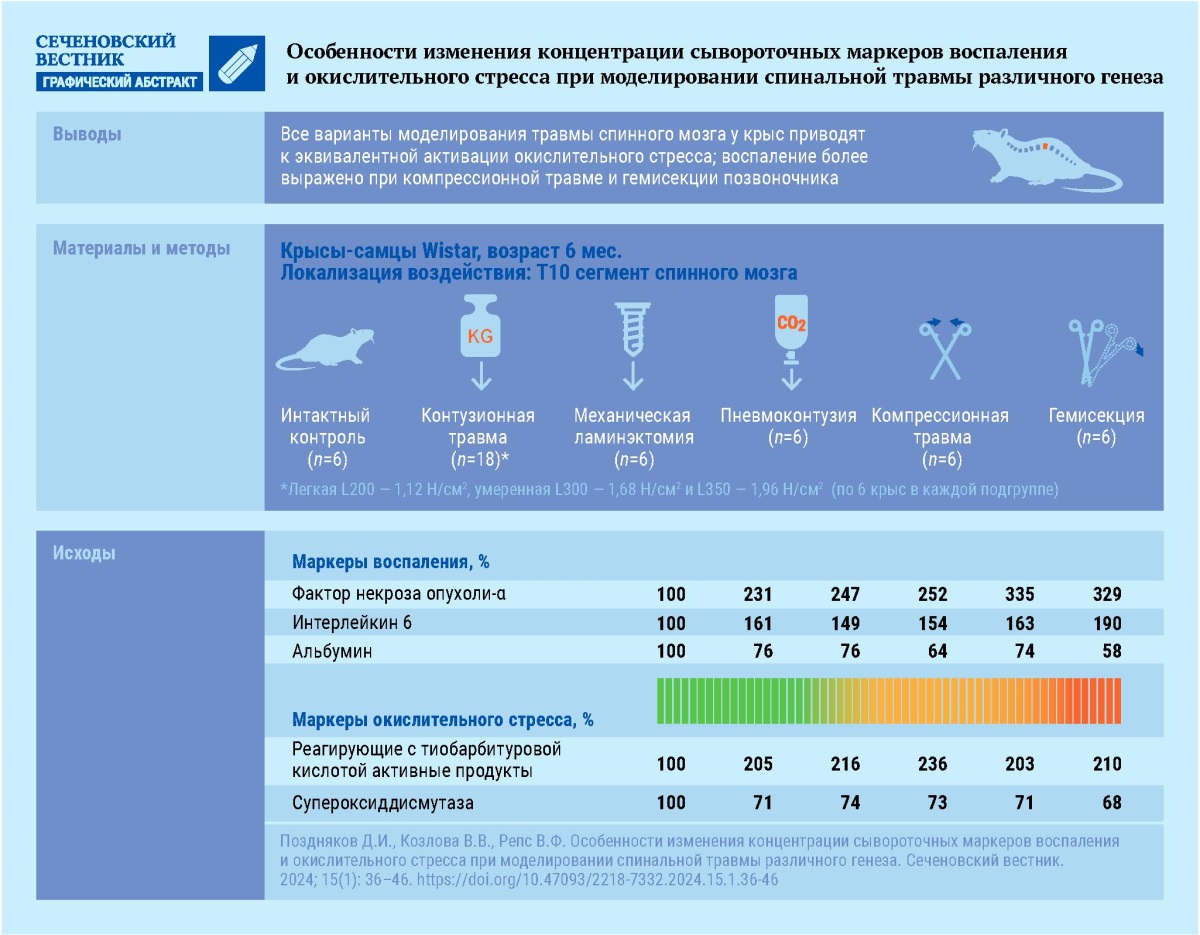
Перейти к:
Особенности изменения концентрации сывороточных маркеров воспаления и окислительного стресса при моделировании спинальной травмы различного генеза
https://doi.org/10.47093/2218-7332.2024.15.1.36-46
Аннотация
Цель исследования. В условиях экспериментальной травмы спинного мозга (ТСМ) различного генеза оценить изменение концентрации молекул-маркеров нейродеструктивного процесса.
Материалы и методы. ТСМ моделировали у шестимесячных крыс-самцов Wistar путем воздействия на позвонок Т10: углекислого газа под давлением 2 Н/см² (пневмоконтузия); свободнопадающего груза трех весов: 1,12, 1,68, 1,96 Н/см² (контузионная травма); сжатия щипцами (компрессионная травма); частичной гемисекции спинного мозга; механической ламинэктомии с использованием механического бура. В каждой группе, в том числе контрольной, было по 6 крыс. На 28-е сутки после однократного нанесения ТСМ у крыс в сыворотке крови оценивали концентрацию: фактора некроза опухоли-альфа (ФНО-α), интерлейкина 6 (ИЛ-6), альбумина, реагирующих с тиобарбитуровой кислотой активных продуктов (ТБК-АП) и активность супероксиддисмутазы (СОД).
Результаты. При моделировании ТСМ различного генеза у крыс отмечается повышение концентрации в сыворотке крови ФНО-α (от 115,5% (p < 0,05) при легкой контузии до 234,5% (p < 0,05) при компрессионной травме в сравнении с интактным контролем) и ИЛ-6 (от 49,2% (p < 0,05) при механической ламинэктомии до 89,8% (p < 0,05) при гемисекции в сравнении с интактным контролем), что может свидетельствовать об активации реакций воспаления. Концентрация альбумина в сыворотке крови крыс с ТСМ была ниже, чем у интактных животных, особенно в группе гемисекции – на 41,9% (p < 0,05). Также было установлено, что у животных с ТСМ наблюдается увеличение концентрации ТБК-АП (на 103,2% (p < 0,05) при легкой контузии и компрессии до 135,5% (p < 0,05) при пневмоконтузии) при снижении активности СОД (от 26,3% (p < 0,05) при ламинэктомии до 31,7% (p < 0,05) при гемисекции). При этом травмы, вызванные компрессией позвоночника и гемисекцией, приводили к более выраженной активации воспалительного процесса, о чем свидетельствует повышенное по сравнению с остальными вариантами моделирования ТСМ содержание ФНО-α.
Заключение. Все варианты моделирования ТСМ привели к эквивалентной активации окислительного стресса, тогда как воспаление более выражено при воспроизведении компрессионной травмы и травмы, вызванной гемисекцией спинного мозга.
Ключевые слова
Список сокращений:
- АФК – активные формы кислорода
- ИЛ-6 – интерлейкин 6
- Н/см² – ньютон на квадратный сантиметр
- СОД – супероксиддисмутаза
- ТБК-АП – активные продукты, реагирующие с тиобарбитуровой кислотой
- ТСМ – травма спинного мозга
- ФНО-α – фактор некроза опухоли-альфа
Одной из наиболее острых и социально значимых задач современной реабилитационной медицины остается функциональное восстановление структурных дефектов спинного мозга различного генеза [1][2]. Согласно данным W. Ding и соавт. [3] заболеваемость и бремя травм спинного мозга (ТСМ) увеличились за последние 30 лет; в 2019 г. во всем мире частота ТСМ составила 900 000, распространенность – 20 600 000, общее число лет, прожитых с инвалидностью, оценено в 6,2 года. Мужчины и пожилые люди подвержены ТСМ в большей степени, чем женщины и молодые люди [3].
В экспериментальных моделях установлено, что повреждение спинного мозга после травматического воздействия развивается не только в эпицентре травмы, но и в удаленных участках спинного мозга, что может затруднять последующую реабилитацию [4]. ТСМ подвержены лица трудоспособного возраста, у более чем 50% пациентов не происходит восстановления функции спинного мозга после травматического воздействия, что влечет за собой необходимость ежедневного ухода за ними. Подобные травмы представляют значимую медико-социальную проблему [5]. На сегодня постоянно принимаются попытки разработать эффективные методы лечения и реабилитации пациентов с ТСМ [2][5].
Современные подходы к терапии ТСМ сосредоточены прежде всего на восстановлении двигательной функции и мало касаются целенаправленной коррекции инволюционных процессов, происходящих в нейронах спинного мозга [6]. Во многом это связано с патофизиологической гетерогенностью ТСМ, особенностями вторичного повреждения спинного мозга после действия травмирующего фактора и ограниченным количеством биохимических маркеров ТСМ, используемых на доклиническом этапе изучения эффективности тестируемого подхода к лечению и/или реабилитации таких пациентов [7].
Патогенез ТСМ опосредуется первичными и вторичными механизмами повреждения. Так, первичное повреждение связано с действием травмирующего фактора, в результате чего наблюдается смещение позвонков или переломы, а также разрушение паренхимы нервов, нарушение аксональной сети, кровоизлияние и разрыв глиальной мембраны [8]. Фаза вторичного повреждения отражает многообразие патологических процессов, вызванных первичным повреждением, и длится несколько недель. На данном этапе ТСМ отмечаются следующие клеточные реакции: активация апоптоза, эксайтотоксичность, нарушение ионной регуляции, повышение продукции цитокинов и окислительный стресс, лежащие в основе тканевых изменений (ишемия, повреждение сосудов, отек). Следует отметить, что процессы первичного и вторичного повреждений не являются изолированными, они протекают практически одновременно и имеют множество точек соприкосновения. Например, разрыв сосудов вызывает кровоизлияние с последующей инфильтрацией моноцитов, нейтрофилов, Т- и В-лимфоцитов и макрофагов в ткани позвоночника, что сопровождается высвобождением провоспалительных цитокинов: интерлейкина 1а, интерлейкина 1b, интерлейкина 6 (ИЛ-6) и фактора некроза опухоли-альфа (ФНО-α), которые вызывают нейровоспаление [9]. Изменение биомаркеров воспалительной реакции при ТСМ было изучено в некоторых работах.
D. Sabirov и соавт. оценивали изменение цитокинового профиля в сыворотке крови и спинном мозге животных с ТСМ и показали, что после ее моделирования высокие уровни цитокинов (CCL26, интерферон-γ, ИЛ-6) обнаруживаются как в ткани спинного мозга, так и в сыворотке крови, что свидетельствует о развитии системной воспалительной реакции. Стоит отметить, что данное исследование выполнено на одной модели ТСМ – контузионной [10]. Также повышенные уровни цитокинов в крови были обнаружены у пациентов с острой и подострой ТСМ [11]. Вышеперечисленное делает цитокины ценным прогностическим инструментом при проведении не только доклинических, но и клинических исследований [12].
Кроме того, B. Tong и соавт. установили, что одним из достоверных сывороточных маркеров, коррелировавшим с тяжестью течения ТСМ, является альбумин [13]. При ретроспективном анализе данных 591 пациента с ТСМ было показано, что сывороточный альбумин в значительной степени коррелировал с неврологическими исходами. Так, во временном отрезке 52 недели высокие концентрации сывороточного альбумина были сопряжены с высоким показателем двигательной активности нижних конечностей и достижением «выраженного неврологического восстановления» [13]. Также стоит отметить, что изменение концентрации сывороточного альбумина может являться маркером интенсивности воспалительного процесса, что отражено в работе A. Sheinenzon и соавт. [14].
В результате первичного и вторичного повреждения спинного мозга отмечается развитие не только нейровоспаления, но и других патофизиологических реакций. Первичным триггером окислительного стресса при ТСМ является увеличение концентрации Ca2+, который ингибирует митохондриальное дыхание, вызывает истощение энергии и нарушает ионный гомеостаз. Изменение функции Na+/K+ аденозинтрифосфатазы (АТФазы) повышает деполяризацию аксональных мембран и приводит к избыточному притоку Na+ в аксоны. Эта ионная дисрегуляция вызывает набухание, аксональный ацидоз, активацию фосфолипаз и повышенную генерацию активных форм кислорода (АФК) [15].
Высокие уровни АФК и активных форм азота запускают патологические реакции, включая перекисное окисление липидов. Оно протекает в три этапа:
- АФК реагируют с компонентом мембраны, содержащим полиненасыщенные жирные кислоты, акцептируя электрон. Этот электрон связывается с молекулами липидов и генерирует их активные формы;
- активируемые формы липидов запускают реакции с участием свободных радикалов, в результате чего генерируется еще большее количество АФК;
- продуцируются активные формы других молекул, включая 4-гидроксиноненал и 2-пропенал, оказывающие цитотоксическое действие [16].
Поскольку свободные радикалы недолговечны и трудно оценить их содержание, измеряют концентрацию конечного продукта окисления липидов и белков в реакции с тиобарбитуровой кислотой (их называют ТБК-продуктами) – например, малонового диальдегида. Также важно оценить активность эндогенной антиоксидантной защиты, действие которой направлено на уменьшение цитотоксичности АФК. Антиперекисная защита клетки представлена антиоксидантными ферментами и эндогенными скэвенджерами радикалов, которые демонстрируют разную активность детоксикации АФК. Наиболее выраженным потенциалом обладают антиоксидантные ферменты, например супероксиддисмутаза (СОД).
Таким образом, оценка изменения концентрации биомаркеров воспаления и окислительного стресса при ТСМ позволит в значительной степени спрогнозировать течение заболевания и его клинический исход. При этом особое значение приобретает изучение параметров, характеризующих ход воспалительных реакций и окислительного стресса как одних из основных патогенетических путей ТСМ.
Цель исследования: в условиях экспериментальной ТСМ различного генеза: контузионной, компрессионной, вызванной механической ламинэктомией и гемисекцией спинного мозга у крыс в сопоставимых условиях оценить изменение концентрации биомаркеров воспаления и окислительного стресса в сыворотке крови.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 48 шестимесячных половозрелых крысах-самцах Wistar массой 240–260 г, полученных из питомника лабораторных животных «Рапполово», Ленинградская область. На время исследования животные размещались в контролируемых условиях вивария при температуре окружающего воздуха 22 ± 2 °С, относительной влажности 60 ± 5% и естественной смене суточного цикла. Доступ крыс к полнорационному корму и воде не ограничивали.
ТСМ моделировали у животных путем воздействия 7 различных травмирующих факторов на сегмент спинного мозга T10, выделяемый пальпацией, анестезия осуществлялась хлоралгидратом (350 мг/кг, внутрибрюшинно).
Для моделирования контузионной травмы использовали свободнопадающий груз разного веса (легкой L200 – 1,12 ньютона на квадратный сантиметр (Н/см²), умеренной L300 – 1,68 Н/см² и L350 – 1,96 Н/см²) при помощи установки, состоящей из штатива с закрепленным на ним цилиндром фиксированного диаметра 3 см и фиксирующей подставки под тело животного [17][18].
Гемисекцию спинного мозга воспроизводили путем терминального смещения позвонков (перелома позвоночника). Позвонок Т10 смещался относительно Т9 и Т11 путем приложения внешней механической силы (щипцы с контролем приложения силы, «Force», КНР), до аудиовизуального подтверждения перелома [17].
Для моделирования пневмоконтузии использовали давление углекислого газа (2 Н/см²) при помощи баллона со сжатым воздухом, снабженным редуктором и соплом диаметром 7 мм [19].
Механическую ламинэктомию проводили при помощи механического бура, как описано V.S. Harikrishnan и соавт. [20]. Животным делали надрез кожи длиной около 2,5 см, осторожно отделяли паравертебральную мускулатуру. Остистый отросток позвонка удаляли. Буром Marathon («Marathon», Корея) с обеих сторон просверливали дорсальную пластинку, после чего на спинной мозг воздействовали актуатором с пружинной регулировкой приложенной силы 2 Н/см².
Компрессионную травму моделировали сжатием позвонка Т10 (сила 2 Н/см²) зажимом кровоостанавливающим Surgicon instr. («Surgicon instr», Пакистан) [21].
Количество животных в каждой из 7 экспериментальных групп равнялось 6 (n = 42). Сравнение анализируемых показателей осуществляли с группой интактного контроля (n = 6). После моделирования ТСМ крыс помещали в индивидуальные клетки под согревающей лампой до пробуждения, наблюдение за ними в первые сутки осуществляли непрерывно. Корм и чистая водопроводная вода подавались ad libitum и контролировались ежедневно. В случае снижения потребления корма и воды крысой через 3–5 дней после ТСМ ей вводили раствор Рингера (1 мл/100 г подкожно). С целью предотвращения задержки мочи и облегчения процесса мочеиспускания мочевой пузырь дважды в день вручную массировали, для чего осторожно пальпировали живот, определяли местонахождение мочевого пузыря, затем легко надавливали на него по направлению «сверху вниз», пока мочевой пузырь не опорожнялся. Гематурии в ходе эксперимента не зафиксировано, в связи с чем антибиотикотерапию не проводили.
ТСМ воспроизводили однократно. Время экспозиции до забора биоматериала составило 28 дней, что отражает наиболее выраженные изменения, опосредованные М1 фенотипом макрофагов, протекающие в условиях хронического воспаления после перенесенной травмы, как установлено K.A. Kigerl и соавт. [22].
По истечении указанного времени у наркотизированных хлоралгидратом (350 мг/кг, внутрибрюшинно) животных из брюшной части аорты осуществляли забор крови в вакуумные пробирки с этилендиаминтетраацетатом. Для забора крови вскрывали брюшную полость, отодвигали кишечник с содержимым, обнажая нижнюю полую вену и брюшную часть аорты, которые отделяли от прилегающих тканей, в аорту вводили шприц объем 5 мл c иглой 22 G («SF Medical», КНР), предварительно промытый этилендиаминтетраацетатом и отбирали кровь в объеме 3,0 мл. Далее животных выводили из эксперимента путем цервикальной дислокации.
Цельную кровь центрифугировали в режиме 1000 g 15 минут с последующим получением сыворотки и определением концентрации маркеров, характеризующих интенсивность реакций провоспаления: ФНО-α, ИЛ-6, альбумин, а также маркеров окислительного стресса: СОД, активных продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-АП).
Концентрацию ФНО-α и ИЛ-6 оценивали методом твердофазного иммуноферментного анализа с использованием видоспецифичных наборов реактивов (CloudClone corp., США) согласно инструкции производителя. Аналитический сигнал регистрировали на микропланшетном ридере Infinite F50 (Tecan, Австрия). Содержание альбумина определяли с применением системы автоматического биохимического анализатора BS-380 (Mindray, КНР) и стандартного набора для оценки концентрации альбумина в сыворотке крови (DiaSyS, Германия).
Концентрацию ТБК-АП оценивали в сыворотке спектрофотометрическим методом в реакции конденсации с 2-тиобарбитуровой кислотой, в ходе которой образующийся окрашенный комплекс имеет максимум поглощения при 532 нм. При этом окраска раствора пропорциональна концентрации ТБК-АП. Количество ТБК-АП рассчитывали по величине молярного коэффициента экстинкции малонового диальдегида (1,56×105 лмоль-1см-1), полученные результаты выражали в мкмоль/мг белка. Содержание белка определяли по методу Бредфорда [23][24].
Активность СОД оценивали ксантин-ксантиноксидазным методом, основанным на реакции дисмутации супероксидного радикала, образующегося в ходе окисления ксантина и восстановления 2-(4-йодофенил)-3-(4-нитрофенол)-5-фенилтетразолия хлорида. Среда инкубации содержала: ксантин 0,05 ммоль/л; 2-(4-йодофенил)-3-(4-нитрофенол)-5-фенилтетразолия хлорид 0,025 ммоль/л; этилендиаминтетраацетат 0,94 ммоль/л, ксантиноксидаза 80 ед/л, CAPS – 40 ммоль/л. Оптическую плотность смеси регистрировали при 505 нм. Активность СОД выражали в ед/л. Содержание белка определяли по методу Бредфорда [24][25].
Статистический анализ
Полученные данные подвергались тесту на нормальность распределения согласно критерию Шапиро – Уилка. Для сравнения групповых средних применяли параметрические методы: ANOVA с апостериорным (post hoc) тестом Тьюки, критерий Даннета при сравнении каждой из экспериментальных групп с контрольной. Отличия считались статистически значимыми при p < 0,05. Результаты экспериментов обрабатывались с помощью программы Statistica 13.0 (TIBCO, США).
РЕЗУЛЬТАТЫ
При моделировании различных вариантов ТСМ по сравнению с интактным контролем отмечено статистически значимое повышение концентрации ФНО-α в сыворотке крови (рис. 1). При этом в случае контузионной травмы (L200; L350; L300) содержание ФНО-α было выше такового у интактных животных на 142,9% (p < 0,05); 133,9% (p < 0,05); 115,5% (p < 0,05) соответственно. Пневмоконтузия и механическая ламинэктомия приводили к повышению концентрации ФНО-α по отношению к группе контроля на 151,8% (p < 0,05) и 147% (p < 0,05) соответственно. Наиболее выраженные изменения ФНО-α наблюдались в случае моделирования компрессионной травмы и гемисекции: содержание ФНО-α было выше в сравнении с интактным контролем на 234,5% (p < 0,05) и 229,2% (p < 0,05) соответственно. При воспроизведении компрессионной травмы и частичной гемисекции концентрация ФНО-α была статистически значимо выше, чем при других типах ТСМ.
Аналогично изменялась концентрация ИЛ-6. Так, при моделировании контузионной травмы (L200; L350; L300), пневмоконтузии, компрессионной травмы, механической ламинэктомии и частичной гемисекции содержание ИЛ-6 было статистически значимо выше (p < 0,05) показателей группы интактного контроля на 54,2; 72,9; 55,9; 54,2; 62,7; 49,2 и 89,8% соответственно.
Концентрация альбумина в сыворотке крови при моделировании ТСМ была ниже, чем у интактных животных: в группе контузионной травмы (L200; L350; L300) на 24,2% (p < 0,05); 23,5% (p < 0,05); 24,2 % (p < 0,05) соответственно; пневмоконтузии на 36,3% (p < 0,05), компрессионной травмы на 25,8% (p < 0,05), механической ламинэктомии – 24,2% (p < 0,05) и частичной гемисекции – 41,9% (p < 0,05). В группе частичной гемисекции концентрация альбумина в сыворотке крови крыс была ниже, чем у животных, которым ТСМ моделировали путем контузии, компрессии и механической ламинэктомии (p < 0,05).
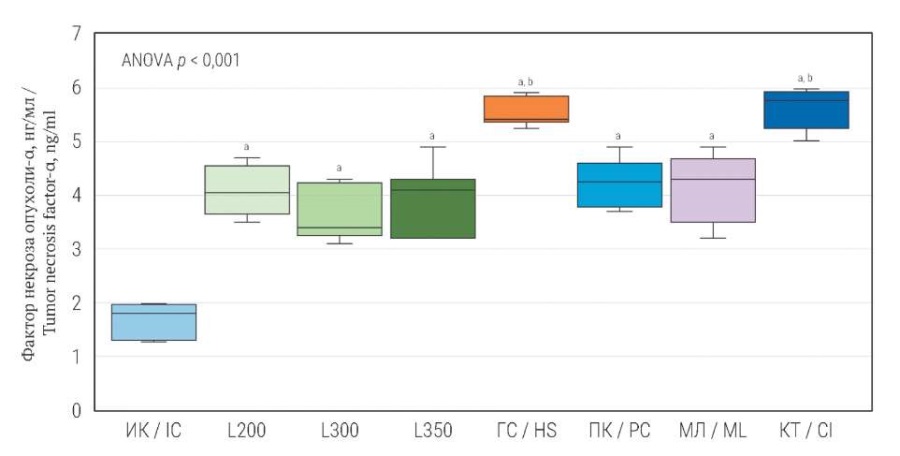
РИС. 1. Концентрация фактора некроза опухоли-α в сыворотке крови
через 28 дней после моделирования различных вариантов травмы спинного мозга.
FIG. 1. Concentration of tumor necrosis factor-α in blood serum
28 days after modeling various types of spinal cord injury.
Примечание: a Критерий Даннета: p < 0,001 при сравнении
каждой из экспериментальных групп с интактным контролем.
b Критерий Тьюки: p < 0,001 при попарном сравнении с L200, L300, L350, ПК, МЛ.
ИК – интактный контроль; L200 – легкая контузионная травма (1,12 Н/см²);
L300 – умеренная контузионная травма (1,68 Н/см²);
L350 – умеренная контузионная травма (1,96 Н/см²); ГС – гемисекция;
ПК – пневмоконтузия; МЛ – механическая ламинэктомия;
КТ – компрессионная травма.
Note: a Dunnett’s test p < 0.001 when comparing each of the experimental groups
with the intact control.
b Tukey’s test p < 0.001 for pairwise comparison with L200, L300, L350, PC, ML.
IC – intact control; L200 – mild contusion injury (1.12 N/cm²);
L300 – moderate contusion injury (1.68 N/cm²);
L350 – moderate contusion injury (1.96 N/cm²); HS – hemisection;
PC – pneumocontusion; ML – mechanical laminectomy; CI – compression injury.
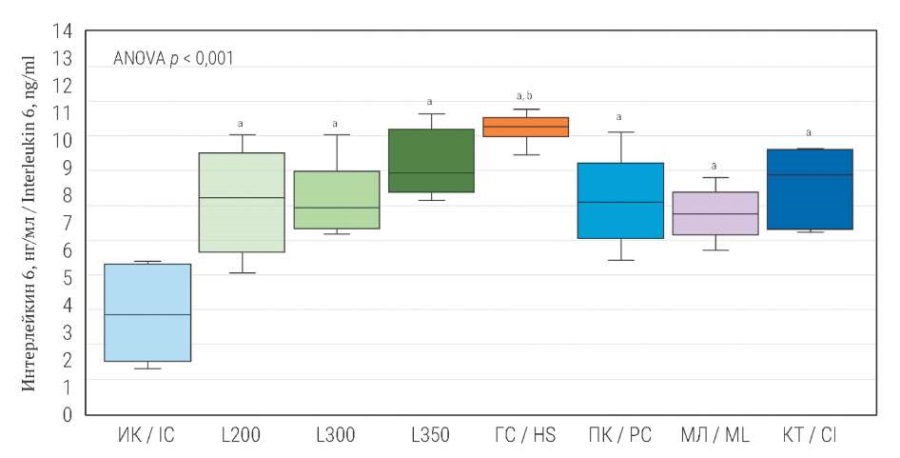
РИС. 2. Концентрация интерлейкина 6 в сыворотке крови
через 28 дней после моделирования различных вариантов травмы спинного мозга.
FIG. 2. Concentration of interleukin 6 in blood serum
28 days after modeling various types of spinal cord injury.
Примечание: a Критерий Даннета: p < 0,001 при сравнении
каждой из экспериментальных групп с интактным контролем.
b Критерий Тьюки: p < 0,05 при попарном сравнении с L200, ПК, МЛ.
ИК – интактный контроль; L200 – легкая контузионная травма (1,12 Н/см²);
L300 – умеренная контузионная травма (1,68 Н/см²);
L350 – умеренная контузионная травма (1,96 Н/см²); ГС – гемисекция;
ПК – пневмоконтузия; МЛ – механическая ламинэктомия;
КТ – компрессионная травма.
Note: a Dunnett’s test p < 0.001 when comparing each of the experimental groups
with the intact control.
b Tukey’s test p < 0.001 for pairwise comparison with L200, PC, ML.
IC – intact control; L200 – mild contusion injury (1.12 N/cm²);
L300 – moderate contusion injury (1.68 N/cm²);
L350 – moderate contusion injury (1.96 N/cm²); HS – hemisection;
PC – pneumocontusion; ML – mechanical laminectomy; CI – compression injury.
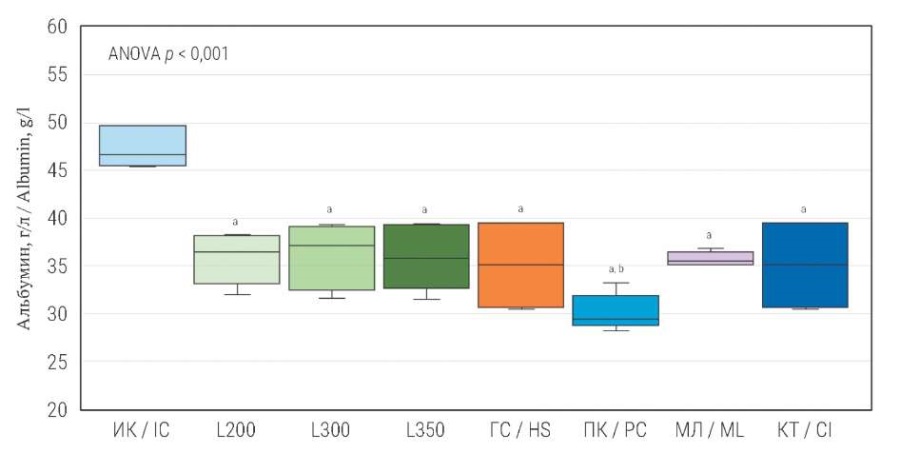
РИС. 3. Концентрация альбумина в сыворотке крови
через 28 дней после моделирования различных вариантов травмы спинного мозга.
FIG. 3. Albumin concentration in blood serum
28 days after modeling various types of spinal cord injury.
Примечание: a Критерий Даннета: p < 0,001 при сравнении
каждой из экспериментальных групп с интактным контролем.
b Критерий Тьюки: p < 0,001 при попарном сравнении с L200, L300, L350, МЛ.
ИК – интактный контроль; L200 – легкая контузионная травма (1,12 Н/см²);
L300 – умеренная контузионная травма (1,68 Н/см²);
L350 – умеренная контузионная травма (1,96 Н/см²); ГС – гемисекция;
ПК – пневмоконтузия; МЛ – механическая ламинэктомия;
КТ – компрессионная травма.
Note: a Dunnett’s test p < 0.001 when comparing each of the experimental groups
with the intact control.
b Tukey’s test p < 0.05 for pairwise comparison with L200, L300, L350, ML.
IC – intact control; L200 – mild contusion injury (1.12 N/cm2);
L300 – moderate contusion injury (1.68 N/cm2);
L350 – moderate contusion injury (1.96 N/cm2); HS – hemisection;
PC – pneumocontusion; ML – mechanical laminectomy; CI – compression injury.
Нами продемонстрировано, что при моделировании различных вариантов ТСМ у крыс в сыворотке крови отмечается активация окислительного стресса (табл.). Выражается это в виде повышения концентрации ТБК-АП: при контузионной травме (L200; L350; L300) на 103,2% (p < 0,05); 106,5% (p < 0,05); 106,5% (p < 0,05) соответственно, при пневмоконтузии на 135,5% (p < 0,05), компрессионной травме на 103,2% (p < 0,05), механической ламинэктомии на 116,1% (p < 0,05) и частичной гемисекции на 109,7% (p < 0,05). В то время как активность СОД снижается: при контузионной травме (L200; L350; L300) на 30,9% (p < 0,05); 28,3% (p < 0,05); 28,6% (p < 0,05) соответственно; при пневмоконтузии на 26,9% (p < 0,05), компрессионной травме на 29% (p < 0,05), механической ламинэктомии на 26,3% (p < 0,05) и частичной гемисекции на 31,7% (p < 0,05).
Таблица. Концентрация про/антиоксидантов в сыворотке крови
через 28 дней после моделировании различных вариантов травмы спинного мозга
Table. Concentration of pro/antioxidants in blood serum
28 days after modeling various types of spinal cord injury
|
Параметр / Parameter |
Группа / Group |
|||||||
|
ИК / IC |
L200 |
L300 |
L350 |
ГС / HS |
ПК / PC |
МЛ /ML |
КТ / CI |
|
|
ТБК-АП, мкмоль/мг белка / |
3,1 ± 0,5 |
6,3 ± 1,9a |
6,4 ± 1,4a |
6,4 ± 1,4a |
6,5 ± 1,6a |
7,3 ± 1,3a |
6,7 ± 1,8a |
6,3 ± 1,3a |
|
СОД, Ед/мл / |
109 ± 6,2 |
75,3 ± 3,4a |
77,8 ± 3,9a |
78,2 ± 3,6a |
74,5 ± 3,2a |
79,6 ± 4,3a |
80,3 ± 4,2a |
77,4 ± 5,4a |
Примечание: a Критерий Даннета: p < 0,01 при сравнении
каждой из экспериментальных групп с интактным контролем.
ИК – интактный контроль; L200 – легкая контузионная травма (1,12 Н/см²);
L300 – умеренная контузионная травма (1,68 Н/см²);
L350 – умеренная контузионная травма (1,96 Н/см²);
ГС – гемисекция; ПК – пневмоконтузия;
МЛ – механическая ламинэктомия; КТ – компрессионная травма;
ТБК-АП – активные продукты, реагирующие с тиобарбитуровой кислотой;
СОД – супероксиддисмутаза.
Note: a Dunnett’s test p < 0.01 when comparing each of the experimental groups
with the intact control.
IC – intact control; L200 – mild contusion injury (1.12 N/cm²);
L300 – moderate contusion injury (1.68 N/cm²);
L350 – moderate contusion injury (1.96 N/cm²); HS – hemisection;
PC – pneumocontusion; ML – mechanical laminectomy; CI – compression injury;
TBA-RS – thiobarbituric acid reactive substances; SOD – superoxide dismutase.
ОБСУЖДЕНИЕ
Моделирование ТСМ в условиях in vivo эксперимента представляет собой трудоемкий процесс, и зачастую перед исследователями встает выбор релевантной модели ТСМ и оцениваемых параметров, позволяющих с высоким уровнем достоверности определить тяжесть ТСМ и вероятный клинический исход.
Одним из основных критериев оценки адекватности модели является выявление морфологических изменений (регенерация аксонов, миелинизация, васкуляризация, плотность глиального рубца, воспалительная реакция) в зоне повреждения, а также прилежащих проксимальных и дистальных областей с помощью гистологического изучения поперечных и сагиттальных срезов [3][26]. Кроме того, на релевантность доклинической модели ТСМ может указывать изменение биомаркеров, например реакций воспаления и окислительного стресса, определяемых как в спинномозговой жидкости, так и в сыворотке крови [27].
Проведенное исследование показало, что из оцениваемых вариантов моделирования ТСМ, а именно контузионной травмы (сила воздействия 1,12; 1,68; 1,96 Н/см²); пневмоконтузионной травмы (сила воздействия 2 Н/см²), компрессионной травмы (сила воздействия 2 Н/см²), травм, вызванных механической ламинэктомией, а также гемисекцией спинного мозга, наиболее выраженные изменения концентрации сывороточных маркеров воспаления наблюдаются при моделировании травмы, вызванной механической ламинэктомией и гемисекцией спинного мозга, что выражалось в более высоких показателях содержания ФНО-α в сыворотке крови крыс. В то же время на фоне всех экспериментальных вариантов ТСМ данной работы отмечены сопоставимые изменения концентрации ИЛ-6, альбумина и маркеров окислительного стресса: активности СОД и содержания ТБК-АП. Подобные различия в изменении концентрации маркеров воспаления и окислительного стресса, вероятно, опосредуются тяжестью повреждения спинного мозга, что отмечает в свой работе X. Hu и соавт. [28].
В то же время похожие результаты были получены M. Kayabaşe и соавт., которые при изучении нейропротективного действия обогащенного водородом физиологического раствора при ТСМ, вызванной ламинэктомией, продемонстрировали достоверное увеличение концентрации ФНО-α и ИЛ-6 в сыворотке крови участвовавших в эксперименте крыс [29]. В условиях ТСМ, вызванной гемисекцией спинного мозга, исследовательская группа W.M. Kung и соавт. продемонстрировала повышение экспрессии мРНК ФНО-α у нелеченых животных [30]. Развитие окислительного стресса в условиях ТСМ также неоднократно изучалось и, по данным M. Yu и соавт., отмечается практически во всех патогенетических вариантах ТСМ, независимо от этиологии и степени тяжести [31].
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ И ПЕРСПЕКТИВЫ ДАЛЬНЕЙШИХ ИССЛЕДОВАНИЙ
Данная работа выполнена на крысах-самцах, в дальнейшем необходимо оценить возможные гендерные различия. В исследовании не представлены результаты гистологического анализа, в перспективе необходимо изучить интенсивность реакций воспаления и окислительного стресса в разрезе иммуногистохимического анализа, позволяющего оценить зависимость наблюдаемых изменений от типа активных иммунных клеток.
ЗАКЛЮЧЕНИЕ
Все использованные в данной работе экспериментальные модели ТСМ приводят к активации реакций воспаления и окислительного стресса. В случае анализа интенсивности липопероксидативных процессов изучаемые модели ТСМ демонстрируют сопоставимые данные. В то же время реакции воспаления были более выражены в случае моделирования компрессионной травмы и гемисекции, о чем свидетельствует повышенное содержание ФНО-α по сравнению с остальными вариантами травмы.
ВКЛАД АВТОРОВ
Д.И. Поздняков, В.В. Козлова, В.Ф. Репс разработали концепцию исследования, участвовали в проведении эксперимента. Д.И. Поздняков и В.Ф. Репс подготовили рукопись. В.В. Козлова провела статистическую обработку данных. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTION
The concept of the study was developed by Dmitry I. Pozdnyakov, Viktoriya V. Kozlova, and Valentina F. Reps, who also participated in the experiment. The article was drafted by Dmitry I. Pozdnyakov and Valentina F. Reps. Statistical processing of the data was performed by Viktoriya V. Kozlova. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета Пятигорского медико-фармацевтического института – филиала ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России (№ 15-11.04.2023).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Pyatigorsk Medical and Pharmaceutical Institute, No. 15 of 11.04.2023.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interest. The authors declare that there is no conflict of interest.
Financing. The study had no sponsorship (own resources).
Список литературы
1. Eli I., Lerner D.P., Ghogawala Z. Acute traumatic spinal cord injury. Neurol Clin. 2021 May; 39(2): 471–488. https://doi.org/10.1016/j.ncl.2021.02.004. Epub 2021 Mar 31. PMID: 33896529
2. Leemhuis E., Favieri F., Forte G., Pazzaglia M. Integrated neuroregenerative techniques for plasticity of the injured spinal cord. Biomedicines. 2022 Oct 13; 10(10): 2563. https://doi.org/10.3390/biomedicines10102563. PMID: 36289825; PMCID: PMC9599452
3. Ding W., Hu S., Wang P., et al. Spinal cord injury: the global incidence, prevalence, and disability from the Global Burden of Disease study 2019. Spine (Phila Pa 1976). 2022 Nov 1; 47(21): 1532–1540. https://doi.org/10.1097/BRS.0000000000004417. Epub 2022 Jun 30. PMID: 35857624
4. Гарифулин Р.Р., Измайлов А.А., Маркосян В.А. и др. Характеристика нейроглии в эпицентре и в удаленной от травмы области при контузионном повреждении спинного мозга у мини-свиньи. Сеченовский вестник. 2023; 14(3): 19–27. https://doi.org/10.47093/2218-7332.2023.14.3.19-27
5. Elliott C.S., Dallas K.B., Zlatev D., et al. Volitional voiding of the bladder after spinal cord injury: validation of bilateral lower extremity motor function as a key predictor. J Urol. 2018 Jul; 200(1): 154–160. https://doi.org/10.1016/j.juro.2018.02.064. Epub 2018 Feb 17. PMID: 29458066.
6. Ramalho B.D.S., de Almeida F.M., Martinez A.M.B. Cell therapy and delivery strategies for spinal cord injury. Histol Histopathol. 2021 Sep; 36(9): 907–920. https://doi.org/10.14670/HH-18-350. Epub 2021 Jun 10. PMID: 34109994
7. Liu Y., Liu J., Liu B. Identifi cation of Circular RNA expression profi les and their implication in spinal cord injury rats at the immediate phase. J Mol Neurosci. 2020 Nov; 70(11): 1894–1905. https://doi.org/10.1007/s12031-020-01586-9. Epub 2020 Jun 10. PMID: 32524420
8. Alizadeh A., Dyck S.M., Karimi-Abdolrezaee S. Traumatic spinal cord injury: an overview of pathophysiology, models and acute injury mechanisms. Front Neurol. 2019 Mar 22; 10: 282. https://doi.org/10.3389/fneur.2019.00282. PMID: 30967837; PMCID: PMC6439316
9. Huang Z., Wang J., Li C., et al. Application of natural antioxidants from traditional Chinese medicine in the treatment of spinal cord injury. Front Pharmacol. 2022 Oct 5; 13: 976757. https://doi.org/10.3389/fphar.2022.976757. PMID: 36278149; PMCID: PMC9579378
10. Sabirov D., Ogurcov S., Shulman I., et al. Comparative analysis of cytokine profi les in cerebrospinal fl uid and blood serum in patients with acute and subacute spinal cord injury. Biomedicines. 2023 Sep 26; 11(10): 2641. https://doi.org/10.3390/biomedicines11102641. PMID: 37893015; PMCID: PMC10604120
11. Sabirov D., Ogurcov S., Baichurina I., et al. Molecular diagnostics in neurotrauma: Are there reliable biomarkers and effective methods for their detection? Front Mol Biosci. 2022 Sep 29; 9: 1017916. https://doi.org/10.3389/fmolb.2022.1017916. PMID: 36250009; PMCID: PMC9557129
12. Anjum A., Yazid M.D., Fauzi Daud M., et al. Spinal cord injury: pathophysiology, multimolecular interactions, and underlying recovery mechanisms. Int J Mol Sci. 2020 Oct 13; 21(20): 7533. https://doi.org/10.3390/ijms21207533. PMID: 33066029; PMCID: PMC7589539
13. Tong B., Jutzeler C.R., Cragg J.J., et al. Serum albumin predicts long-term neurological outcomes after acute spinal cord injury. Neurorehabil Neural Repair. 2018 Jan; 32(1): 7–17. https://doi.org/10.1177/1545968317746781. Epub 2017 Dec 24. PMID: 29276840
14. Sheinenzon A., Shehadeh M., Michelis R., et al. Serum albumin levels and infl ammation. Int J Biol Macromol. 2021 Aug 1; 184: 857–862. https://doi.org/10.1016/j.ijbiomac.2021.06.140. Epub 2021 Jun 25. PMID: 34181998
15. Jha R.M., Kochanek P.M., Simard J.M. Pat hoph ysiology and treatment of cerebral edema in traumatic brain injury. Neuropharmacology. 2019 Feb; 145 (Pt B): 230–246. https://doi.org/10.1016/j.neuropharm.2018.08.004. Epub 2018 Aug 4. PMID: 30086289; PMCID: PMC6309515
16. Zhang C., Zhai T., Zhu J., et al. Research progress of antioxidants in oxidative stress therapy after spinal cord injury. Neurochem Res. 2023 Dec; 48(12): 3473–3484. https://doi.org/10.1007/s11064-023-03993-x. Epub 2023 Aug 1. PMID: 37526867
17. Frantsuzov R., Mondal S., Walsh C.M., et al. A fi nite element model of contusion spinal cord injury in rodents. J Mech Behav Biomed Mater. 2023 Jun; 142: 105856. https://doi.org/10.1016/j.jmbbm.2023.105856. Epub 2023 Apr 17. PMID: 37087955
18. Csomó K.B., Varga G., Belik A.A., et al. A minimally invasive, fast spinal cord lateral hemisection technique for modeling open spinal cord injuries in rats. J Vis Exp. 2022 Mar 23; (181). https://doi.org/10.3791/63534. PMID: 35404342
19. Marcol W., Slusarczyk W., Gzik M., et al. Air gun impactor−a novel model of graded white matter spinal cord injury in rodents. J. Reconstr. Microsurg. 2012 Oct; 28(8): 561–568. https://doi.org/10.1055/s-0032-1315779. Epub 2012 Jun 18. PMID: 22711195
20. Harikrishnan V.S., Krishnan L.K., Abelson K.S.P. A novel technique to develop thoracic spinal laminectomy and a methodology to assess the functionality and welfare of the contusion spinal cord injury (SCI) rat model. PLoS One. 2019 Jul 2; 14(7): e0219001. https://doi.org/10.1371/journal.pone.0219001. PMID: 31265469; PMCID: PMC6605676
21. Shen Y., Wang Y.P., Cheng X., et al. Autophagy regulation combined with stem cell therapy for treatment of spinal cord injury. Neural Regen Res. 2023 Aug; 18(8): 1629–1636. https://doi.org/10.4103/1673-5374.363189. PMID: 36751772; PMCID: PMC10154487
22. Kigerl K.A., Gensel J.C., Ankeny D.P., et al. Identifi cation of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord. J Neurosci. 2009 Oct 28; 29(43): 13435–13444. https://doi.org/10.1523/JNEUROSCI.3257-09.2009. PMID: 19864556; PMCID: PMC2788152
23. Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges. Anal Biochem. 2017 May 1; 524: 13– 30. https://doi.org/10.1016/j.ab.2016.10.021. Epub 2016 Oct 24. PMID: 27789233
24. Kielkopf C.L., Bauer W., Urbatsch I.L. Bradford assay for determining protein concentration. Cold Spring Harb Protoc. 2020 Apr 1; 2020(4): 102269. https://doi.org/10.1101/pdb.prot102269. PMID: 32238597
25. Gumral N., Aslankoc R., Senol N., Cankara F.N. Protective effect of alpha-lipoic acid against liver damage induced by cigarette smoke: an in vivo study. Saudi J Med Med Sci. 2021 May-Aug; 9(2): 145–151. https://doi.org/10.4103/sjmms.sjmms_387_20. Epub 2021 Apr 29. PMID: 34084105; PMCID: PMC8152379
26. Doblado L.R., Martínez-Ramos C., Pradas M.M. Multimodular bio-inspired organized structures guiding long-distance axonal regeneration. Biomedicines. 2022 Sep 8; 10(9): 2228. https://doi.org/10.3390/biomedicines10092228. PMID: 36140328; PMCID: PMC9496454
27. Sun S., Li J., Wang S., et al. CHIT1-positive microglia drive motor neuron ageing in the primate spinal cord. Nature. 2023 Dec; 624(7992): 611–620. https://doi.org/10.1038/s41586-023-067831. Epub 2023 Oct 31. PMID: 37907096
28. Hu X., Xu W., Ren Y., et al. Spinal cord injury: molecular mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2023 Jun 26; 8(1): 245. Published 2023 Jun 26. https://doi.org/10.1038/s41392-023-01477-6. PMID: 37357239; PMCID: PMC10291001
29. Kayabaş M., Şahin L., Makav M., et al. Protective effect of hydrogen-rich saline on spinal cord damage in rats. Pharmaceuticals (Basel). 2023 Apr 1; 16(4): 527. https://doi.org/10.3390/ph16040527. PMID: 37111284; PMCID: PMC10143771
30. Kung W.M., Chang C.J., Chen T.Y., Lin M.S. Cryogen spray cooling mitigates infl ammation and injury-induced CISD2 decline in rat spinal cord hemisection model. J Integr Neurosci. 2020 Dec 30; 19(4): 619–628. https://doi.org/10.31083/j.jin.2020.04.255. PMID: 33378836
31. Yu M., Wang Z., Wang D., et al. Oxidative stress following spinal cord injury: From molecular mechanisms to therapeutic targets. J Neurosci Res. 2023 Oct; 101(10): 1538–1554. https://doi.org/10.1002/jnr.25221. Epub 2023 Jun 5. PMID:
Об авторах
Д. И. ПоздняковРоссия
Поздняков Дмитрий Игоревич – канд. фарм. наук, доцент, заведующий кафедрой фармакологии с курсом клинической фармакологи; ведущий научный сотрудник
пр. Калинина, д. 11, г. Пятигорск, 357532
пр. Кирова, д. 30, г. Пятигорск, 357501
В. В. Козлова
Россия
Козлова Виктория Вячеславовна – канд. фарм. наук, доцент кафедры фармакологии с курсом клинической фармакологии; заведующая экспериментальной лабораторией с виварием
пр. Калинина, д. 11, г. Пятигорск, 357532
пр. Кирова, д. 30, г. Пятигорск, 357501
В. Ф. Репс
Россия
Репс Валентина Федоровна – д-р биол. наук, профессор кафедры терапевтических дисциплин; ведущий научный сотрудник
пр. Калинина, д. 11, г. Пятигорск, 357532
пр. Кирова, д. 30, г. Пятигорск, 357501
Дополнительные файлы
|
|
1. Графический абстракт | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(255KB)
|
Метаданные ▾ | |

|
2. Чек-лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(108KB)
|
Метаданные ▾ | |