Перейти к:
Факторы риска и профилактика развития фибрилляции предсердий в послеоперационном периоде коронарного шунтирования: обзор литературы
https://doi.org/10.47093/2218-7332.2024.15.3.4-14
Аннотация
Возросший объем выполняемых операций коронарного шунтирования неизбежно способствует росту количества послеоперационных осложнений. Фибрилляция предсердий (ФП) развивается у каждого второго-третьего пациента. Данное осложнение продлевает сроки стационарного этапа и увеличивает расходы системы здравоохранения. В обзоре представлены данные о факторах риска послеоперационной ФП, а также предлагаемые методы профилактики и лечения. Результаты исследований свидетельствуют о роли сахарного диабета 2-го типа, ожирения, артериальной гипертензии; среди лабораторных показателей прогностическое значение отводится среднему объему тромбоцитов, ширине распределения эритроцитов по объему, С-реактивному белку, скорости оседания эритроцитов, соотношению уровня моноцитов к уровню холестерина липопротеинов высокой плотности. Обсуждены медикаментозные и немедикаментозные способы профилактики и лечения послеоперационной ФП. Указанные методы в представленных работах показали эффективность, однако имели ряд ограничений.
Ключевые слова
Список сокращений
- HbA1С – Glycated Hemoglobin, гликированный гемоглобин
- ДИ – доверительный интервал
- КШ – коронарное шунтирование
- ОШ – отношение шансов
- ПНЖК – полиненасыщенные жирные кислоты
- РЧА – радиочастотная абляция
- СД – сахарный диабет
- ФП – фибрилляция предсердий
Последние десятилетия в России наблюдается значительный рост числа проводимых операций хирургической реваскуляризации миокарда: с 2 590 в 1996 г. до 35 458 в 2022 г. [1]. Прогресс в области коронарной хирургии привел к увеличению 5-летней выживаемости до 85–95% и 10-летней до 75% [2]. Вместе с тем остается высокий риск послеоперационных осложнений: так фибрилляция предсердий (ФП) после хирургической реваскуляризации миокарда развивается в 40% случаев [3]. Помимо этого, при возникающей в послеоперационном периоде ФП возрастает риск острой сердечной недостаточности, тромбоэмболических осложнений в виде острого нарушения мозгового кровообращения или инфаркта миокарда, госпитальной летальности [4]. ФП также является экономически значимым заболеванием, так как ее наличие у пациента связано с увеличением длительности его пребывания в стационаре [5].
Учитывая, что сердечно-сосудистая патология занимает первое место в структуре заболеваемости и смертности как в России1, так и во всем мире и объем выполняемых операций коронарного шунтирования (КШ) продолжает расти, встает задача профилактики послеоперационных осложнений и сокращения сроков восстановления пациентов после хирургического лечения [1][6][7].
Цель данного обзора – обобщить литературные данные, посвященные факторам риска послеоперационной ФП, способам ее лечения и профилактики у пациентов, перенесших хирургическую реваскуляризацию миокарда.
Проведен анализ 66 публикаций за 2004–2024 гг., включающих клинические исследования, рекомендации и обзоры, полный текст которых доступен на ресурсах PubMed, Scopus, Web of Science, Cochrane Library, Google Scholar и eLibrary. Поиск проводился по ключевым словам и их сочетаниям: «коронарное шунтирование», «послеоперационные осложнения», «послеоперационная фибрилляция предсердий», «искусственное кровообращение», «лечение фибрилляция предсердий», «факторы риска», «снижение риска», «профилактика», “coronary artery bypass grafting”, “postoperative complications”, “postoperative atrial fibrillation”, “cardiopulmonary bypass”, “treatment of atrial fibrillation”, “risk factors”, “risk reduction”, “prevention”.
Факторы риска возникновения ФП разделены на дооперационные, интра- и послеоперационные.
Дооперационные факторы
С увеличением возраста пациентов, направляемых на хирургическую реваскуляризацию, отмечается рост частоты развития послеоперационной ФП [8][9]. Средний возраст таких пациентов (без эпизодов ФП в анамнезе) составляет 64,3 ± 7,0 года против 61,1 ± 8,0 у лиц без ФП после КШ (р = 0,045) [10]. Аналогичные данные получены в другом исследовании: многофакторный регрессионный анализ подтвердил, что возраст является значимым независимым предиктором развития послеоперационной ФП: средний возраст у пациентов с ФП составил 65,3 ± 5,3 года против 54,5 ± 6,7 без нее (р < 0,001) [11].
В ряде работ, посвященных изучению механизмов и причин возникновения ФП в послеоперационном периоде, в качестве фактора риска определена дилатация левого предсердия: увеличение объема на 1 мл/м² ассоциировано с повышением риска аритмии [9][12–14]. Определенная роль в развитии ФП отводится артериальной гипертензии и, как следствие, диастолической дисфункции и гипертрофии миокарда, ассоциированных со структурным ремоделированием левого предсердия [14][15]. Так, при наличии диастолической дисфункции левого желудочка риск возникновения послеоперационной ФП вырастает в 3,5 раза [14]. Увеличение длительности пароксизмов ФП и развитие нарушений ритма в ранние сроки после операции чаще отмечаются среди пациентов с индексом объема левого предсердия более 36 мл/м² [14]. В отдельных исследования показано, что риск возникновения послеоперационной ФП выше у пациентов с фракцией выброса левого желудочка < 30% [16].
Среди пациентов с ишемической болезнью сердца растет коморбидность по сахарному диабету 2-го типа (СД 2), достигая 22–48%, и 33% среди пациентов, перенесших инфаркт миокарда [17–19]. Показано, что при СД повышается риск послеоперационной ФП за счет развития интерстициального фиброза, который в последующем вызывает изменения предсердной проводимости [20]. Выраженные колебания гликемии связаны с выработкой митохондриального супероксида, высвобождением воспалительных цитокинов и окислительным повреждением клеточных структур. Окислительный стресс, хроническое воспаление тканей, а также повышение уровня свободных жирных кислот, наблюдающиеся при СД, вызывают электрофизиологические и структурные изменения предсердий, приводящие к развитию ФП [20].
Наиболее чувствительным и специфичным предиктором ранних послеоперационных осложнений является вариабельность гликемии в первые сутки после госпитализации и на протяжении суток до хирургического лечения [21]. У пациентов с более выраженным колебанием уровня глюкозы в крови отмечается увеличение сроков пребывания в палате интенсивной терапии до 24 ч [21].
Мнения по уровню гликированного гемоглобина (Glycated Hemoglobin, HbA1c) как фактора риска послеоперационной ФП расходятся. Так, в одном из исследований показано, что повышенный уровень HbA1c ассоциирован с меньшей частотой развития послеоперационной ФП – 15,1% при HbA1c ≥ 7,0%, в то время как у пациентов с уровнем HbA1c < 7,0% частота ФП была выше: 20,9% [22]. В качестве объяснения полученных результатов исследователи предположили, что при высоком уровне HbA1c проводится интенсивная инсулинотерапия, которая способствует снижению риска развития послеоперационной ФП [22]. В другом исследовании уровень HbA1c > 6,5% рассматривается в качестве биологического маркера послеоперационной ФП и ассоциирован с двукратным увеличением риска развития аритмии: отношение шансов (ОШ) 2,0; 95% доверительный интервал (95% ДИ): 1,3–3,1; p = 0,001 [23].
Значимым фактором, способствующим развитию послеоперационной ФП, считается индекс массы тела более 30 кг/м² [24]. Наличие метаболического синдрома способствует повышению риска послеоперационной ФП в 2,46 раза [25].
Повышенный уровень мозгового натрийуретического пептида (N-Terminal Pro-brain Natriuretic Peptide, Pro-B-Type Natriuretic Peptide, NT-proBNP) также связан с повышенным риском послеоперационной ФП [26][27].
Дискутируется вопрос о роли дефицита витамина D в возникновении ФП после КШ [28][29]. Считается, что данный дефицит активирует ренин-ангиотензин-альдостероновую систему, которая отвечает за электрофизиологическое ремоделирование предсердий [29]. Появились данные о том, что прием высоких доз витамина D – назначение 50 тыс. МЕ витамина D трижды в день за 3 дня до КШ – значимо снижает частоту послеоперационной ФП в сравнении с группой контроля (11,4 и 26% соответственно, р = 0,003) [30]. В другом исследовании показано отсутствие связи между уровнем витамина D и возникновением послеоперационной ФП [31].
Средний объем тромбоцитов [32] и гематологические индексы [33] могут рассматриваться в качестве предикторов развития послеоперационной ФП в дооперационном и раннем послеоперационном периодах. Продемонстрирована прогностическая значимость ширины распределения эритроцитов: повышенные значения указывают на наличие анизоцитоза, отражающего хроническое воспаление и высокий уровень окислительного стресса [33]. Прямой связи между повышенным уровнем ширины распределения эритроцитов и сердечно-сосудистыми заболеваниями не определено, однако данный показатель коррелирует с маркерами хронического воспаления: интерлейкинами 6, 8, 12, 17, 18 и фактором некроза опухоли альфа [33]. Также были выявлены значимые различия уровней С-реактивного белка и скорости оседания эритроцитов между группами пациентов с послеоперационной ФП и без нарушений ритма сердца [33]. Метаанализ с участием более 6 000 пациентов показал значимость таких показателей, как средний объем тромбоцитов, ширина распределения эритроцитов и отношение нейтрофилов к лейкоцитам [32]. В качестве маркера послеоперационной ФП и ранней послеоперационной смертности было предложено использовать и отношение уровня моноцитов к уровню холестерина липопротеинов высокой плотности (monocyte/high-density lipoprotein cholesterol ratio, M/HDL-C ratio) [34]. Ранее было установлено, что повышение этого индекса является предиктором сердечно-сосудистых событий [35].
Нарушение функции почек, в частности, скорость клубочковой фильтрации < 60 мл/мин/1,73 м², является независимым фактором риска послеоперационной ФП [36][37].
В качестве других предикторов предлагается использование продолжительности зубца Р на электрокардиограмме [38], а также атеросклеротическое поражение правой коронарной артерии, кровоснабжающей синусовый узел [39]. Пациенты с продолжительностью зубца Р > 100 мс имели риск послеоперационной ФП в 2,69 раза выше, чем с показателем < 100 мс [38].
Не было выявлено связи между степенью атеросклеротического поражения русла правой коронарной артерии и развитием послеоперационной ФП у пациентов с высоким функциональным классом стенокардии, как и связи с локализацией атеросклеротического поражения в коронарных артериях [40].
Интраоперационные и послеоперационные факторы
Исследователями изучалась связь нарушений ритма с особенностями проведения операции КШ и состоянием пациентов в ближайшем послеоперационном периоде [41]. Наблюдаемый при использовании аппарата искусственного кровообращения системный воспалительный ответ организма, вызывающий в том числе отек миокарда и изменения электрофизиологических свойств кардиомиоцитов, может приводить к нарушению процессов деполяризации, рефрактерного периода и, как результат, развитию ФП. Было установлено, что время искусственного кровообращения ≥ 100 мин (p = 0,001), а также интенсивность инотропной поддержки (добутамин > 15–30 мг/кг мин, p = 0,016) были значительно больше у пациентов, у которых развилась послеоперационная ФП [16][42]. В другом исследовании было установлено, что КШ с искусственным кровообращением не является предиктором возникновения послеоперационной ФП [43]. Также не было выявлено различий в продолжительности операции, искусственного кровообращения и ишемии миокарда, объеме кровопотери, степени поражения коронарных артерий и количестве наложенных шунтов между группами пациентов с послеоперационной ФП и без нее [10].
Интраоперационная ишемия миокарда предсердий, как и интраоперационное повреждение перикарда и миокарда, считаются важными факторами развития послеоперационной ФП. Во время оперативного вмешательства в целях снижения потребности миокарда в кислороде локально охлаждают структуры сердца. Высказывается мнение, что при охлаждении межпредсердная перегородка и предсердия остаются более теплыми, чем миокард левого желудочка. Применение более интенсивной кардиоплегии ассоциировано со снижением частоты послеоперационной ФП. Предложено ввести понятие «индекс ишемии миокарда» (Myocardial Ischemia Index, MII), который рассчитывался по формуле:
MII = [VC × FC × (PD – PS)] / [B.M.I. × I.i. × TC],
где VC = volume of cardioplegia (объем раствора для кардиоплегии), FC = cardioplegia flow (скорость введения раствора для кардиоплегии – постоянный параметр 250 мл/мин), TC = cardioplegia temperature (температура вводимого раствора для кардиоплегии – постоянный показатель 6 °C), (PD – PS) = давление доставляемого раствора для кардиоплегии минус давление в коронарном синусе, постоянный показатель 100 мм рт. ст., I.i. = ischemia interval (время между каждым введением раствора для кардиоплегии для каждого анастомоза), B.M.I. – индекс массы тела. Использование предлагаемой модели позволило установить, что значение среднего показателя MII менее 0,27 мл/м²/кг/мин было связано с более высокой частотой послеоперационной ФП (p = 0,011) [16].
Развившийся во время операции инфаркт миокарда может усиливать ишемию предсердий в зависимости от локализации: задние инфаркты непосредственно влияют на стенку и перегородку предсердий, передние способствуют повышению давления наполнения предсердий. С увеличением частоты послеоперационной ФП связано и оглушение миокарда желудочков [16]. Наблюдаемая во время операции КШ объемная перегрузка камер сердца способствует нарушению гемодинамики и развитию послеоперационной ФП. В этой ситуации имеет значение уровень центрального венозного давления, повышение которого на каждые 5 мм рт. ст. способствует увеличению риска внутрибольничной и 30-дневной смертности после операции [41].
К послеоперационным факторам риска развития ФП относят электролитные нарушения, продолжительность искусственной вентиляции легких, наличие гиперволемии, гиповолемии [41][44]. Было установлено, что гипокалиемия < 3,5 ммоль/л вызывает гиперполяризацию клеток, увеличивает потенциал покоя, приводит к ускорению деполяризации, повышению автоматизма и возбудимости клеток, что является основой развития ФП [44]. Однако не все исследователи в своих работах отметили связь гипокалиемии и послеоперационной ФП [45]. Так, не было выявлено различий по уровню калия между пациентами с и без ФП со дня операции по 5-й день после вмешательства [45]. В другой работе было продемонстрировано, что уровень калия < 4,5 ммоль/л связан с повышенным риском послеоперационной ФП (ОШ: 1,43; 95% ДИ: 1,17–1,75; p < 0,001) [46].
Медикаментозные способы профилактики и лечения
Для профилактики и лечения ФП, возникшей после хирургической реваскуляризации миокарда, предлагают медикаментозные и хирургические методы. Согласно клиническим рекомендациям по фибрилляции и трепетанию предсердий, с целью профилактики послеоперационной ФП применяется терапия бета-адреноблокаторами2. У пациентов с пароксизмальной или персистирующей формами ФП целесообразно применять изоляцию устьев легочных вен или операцию «Лабиринт». В случае гемодинамической нестабильности пациентам с послеоперационной ФП рекомендуется восстановление синусового ритма с помощью электрической или медикаментозной кардиоверсии. Пациентам с ФП без нарушений гемодинамики рекомендуется контроль частоты желудочкового ритма2.
Появились данные о новом высокоселективном бета-адреноблокаторе ландилоле, который снижает частоту сердечных сокращений, при этом минимально воздействуя на уровень артериального давления [47]. Использование препарата в послеоперационном периоде является перспективным направлением, поскольку уменьшает риск развития послеоперационной ФП в 2,8 раза без увеличения частоты развития осложнений [47].
Известно о профилактическом использовании антиаритмического препарата III класса амиодарона. При его применении коротким курсом в периоперационном периоде наблюдается снижение риска развития послеоперационной ФП на 50%, но вместе с этим имеется риск развития побочных эффектов [48]. Показано, что амиодарон превосходит плацебо в снижении риска послеоперационной ФП, однако не установлено преимущество его использования в сравнении с бета-адреноблокаторами. При профилактическом применении амиодарона в дозе 900 мг (разведенной на 500 мл 5% раствора декстрозы) со скоростью 1 мг/мин в первые 6 часов после реваскуляризации и последующим снижением скорости инфузии до 0,5 мг/мин на протяжении 18 часов наблюдалось снижение риска развития послеоперационной ФП (16,8% в группе амиодарона против 25,5% в группе плацебо, р = 0,0001) [49]. При эпикардиальном применении гидрогеля с амиодароном (60 мг) отмечалось значимое снижение частоты развития послеоперационной ФП в сравнении с контрольной группой (3,3 и 37% соответственно, р < 0,001), уменьшалось время пребывания в стационаре [50].
В отношении профилактического эффекта недигидропиридиновых блокаторов кальциевых каналов данные противоречивы. Одни работы свидетельствуют о снижении риска возникновения ФП на фоне их приема: ОШ 0,62; 95% ДИ: 0,41–0,93; p = 0,02 [51]. По данным других исследований не установлено влияния верапамила на риск развития ФП в послеоперационном периоде: ОШ: 0,73, 95% ДИ: 0,48–1,12 [51][52].
Во многих исследованиях продемонстрирована эффективность статинов в профилактике послеоперационной ФП. В группе пациентов, принимавших аторвастатин в дозе 40 мг за 7 дней до операции, было установлено снижение риска послеоперационной ФП по сравнению с группой плацебо (35 и 57% соответственно, р = 0,003), а также снижение продолжительности госпитализации (6,3 ± 1,2 против 6,9 ± 1,4 дня; р = 0,001) [53]. Вместе с тем есть данные исследований, в которых не было выявлено различий по частоте развития послеоперационной ФП у пациентов, принимающих розувастатин [54]. Использование статинов для профилактики послеоперационной ФП остается спорным. Очевидны их плейотропные эффекты при активации воспалительной реакции. Поскольку в настоящее время статины принимают большинство пациентов, страдающих ишемической болезнью сердца, их использование играет положительную роль при активации системного воспалительного ответа.
Влияние омега-3 полиненасыщенных жирных кислот (ПНЖК) на структурное ремоделирование миокарда было изучено in vivo и in vitro. Омега-3-ПНЖК оказывают мембраностабилизирующее действие и подавляют индуцированное растяжением миокарда сокращение рефрактерного периода. Отмечается снижение риска послеоперационной ФП при приеме омега-3 ПНЖК (отношение рисков: 0,84; 95% ДИ: 0,73–0,98; р = 0,03) [55]. Крупный метаанализ подтвердил эффективность омега-3 ПНЖК в профилактике ФП после КШ (ОШ: 0,66; 95% ДИ: 0,48–0,90; p = 0,008) [56]. Замедленный антиаритмический эффект омега-3 ПНЖК может быть связан с достижением стабильных концентраций в плазме с последующим их включением в фосфолипиды мембран клеток предсердий [57].
Учитывая, что одним из основных факторов в развитии послеоперационной ФП является индукция воспалительного ответа, исследователи предположили, что прием кортикостероидов может способствовать предупреждению послеоперационной ФП посредством снижения высвобождения провоспалительных цитокинов. Наиболее выраженный эффект по снижению частоты развития аритмии наблюдался при назначении средних доз кортикостероидов (эквивалент дексаметазона 50–210 мг), в то время как более низкие (до 8 мг) и более высокие (236–2850 мг) дозировки приводят к ослаблению эффекта [58]. Метаанализ 72 исследований с участием 17 282 пациентов не выявил влияния кортикостероидов на риск развития ФП после операций на сердце [59].
Более 10 лет назад было показано, что ботулинический токсин блокирует холинергическую нейротрансмиссию и носит временный характер. Привлекательность данной гипотезы была обоснована сохранением анатомической целостности структур и достижением эффекта временного подавления вагус-опосредованной ФП у собак [60]. В ходе совместной работы отечественных и зарубежных исследователей выполнялась инъекция ботулотоксина в четыре основные эпикардиальные жировые подушки во время выполнения КШ. По результатам трехлетнего наблюдения частота предсердных тахиаритмий в группе лечения составила 23,3% против 50% в группе плацебо (p = 0,02). Сделан вывод, что инъекция ботулотоксина приводит к устойчивому снижению частоты послеоперационной ФП, а также снижению частоты госпитализаций [61]. В настоящий момент проводится уникальное перспективное исследование применения ботулотоксина типа А в дозах 125 и 250 Ед с целью профилактики послеоперационной ФП NOVA (Botulinum Toxin Type A [ AGN-151607] for the Prevention of Post-operative Atrial Fibrillation in Adult Participants Undergoing Open-chest Cardiac Surgery) [62][63]. У пациентов 65 лет и моложе, получавших ботулотоксин в дозе 125 Ед, реже развивалась ФП (р = 0,02) [63].
Немедикаментозные способы профилактики
В качестве немедикаментозных способов профилактики послеоперационной ФП длительное время применяется биатриальная синхронная стимуляция с помощью временных эпикардиальных электродов [63]. Она способствует предотвращению повторного входа волны возбуждения (механизм re-entry) посредством коррекции асинхронности и разнонаправленности активации волны возбуждения при органической или функциональной блокаде проведения. При использовании биатриальной синхронной стимуляции наблюдается укорочение времени проведения импульсов по предсердиям, удлиняется интервал сцепления предсердных экстрасистол. Установлено, что независимо от места или алгоритма профилактическая стимуляция предсердий снижает частоту послеоперационной ФП [64]. Предполагается, что стимуляция предсердий с частотой, превышающей собственный предсердный ритм, способствует подавлению предсердной эктопической активности. У пациентов, которым проводилась биатриальная синхронная стимуляция, снижалась частота послеоперационной ФП в сравнении с контрольной группой (6,7 и 33,3% соответственно, р = 0,0082), а также сокращались сроки госпитального периода (7,27 ± 1,41 и 8,49 ± 1,68 дня соответственно, р = 0,0011) [65].
В превентивных целях послеоперационной ФП можно рассматривать радиочастотную абляцию (РЧА) устьев легочных вен. Проведено исследование с включением 96 пациентов без эпизода ФП в анамнезе, которым проводили КШ. Пациентов разделили на три группы: первой не проводилась профилактика ФП; второй профилактика проводилась с помощью РЧА; третьей – с помощью РЧА и назначения амиодарона. Амиодарон назначался в послеоперационном периоде в насыщающей дозе 5–10 мг/кг массы тела с последующим пероральным приемом по 200 мг 3 раза в сутки. Частота послеоперационной ФП снижалась в третьей группе: при сочетании РЧА с амиодароном после операции КШ [66]. При этом превентивная биполярная РЧА устьев легочных вен значимо не усложняла выполнение КШ, а также не вызывала изменений частоты и структуры осложнений, что, по мнению авторов, может свидетельствовать о безопасности методики [66].
Ограничения исследования
Данный обзор имеет ограничения, обусловленные несистематическим поиском литературы и выбором источников только с полными текстами.
ЗАКЛЮЧЕНИЕ
Послеоперационная ФП – частое осложнение после КШ, которое существенно влияет на качество жизни пациента и затраты системы здравоохранения. К факторам риска послеоперационной ФП относятся: возраст старше 64–65 лет, наличие ожирения, СД, метаболического синдрома, хронической болезни почек, дилатации предсердий, хронического воспаления, дефицита витамина D, повышенный уровень NT-proBNP, электролитные нарушения, низкий индекс ишемии миокарда. В качестве профилактики применяются медикаментозные средства (бета-адреноблокаторы), немедикаментозные средства (временная биатриальная синхронная стимуляция) и сочетанное лечение: РЧА с введением амиодарона (рис.). Ведется поиск новых средств, направленных на уменьшение воспалительной реакции и окислительного стресса. Данный обзор имеет ограничения, обусловленные выбором источников только с полными текстами и несистематическим поиском литературы.
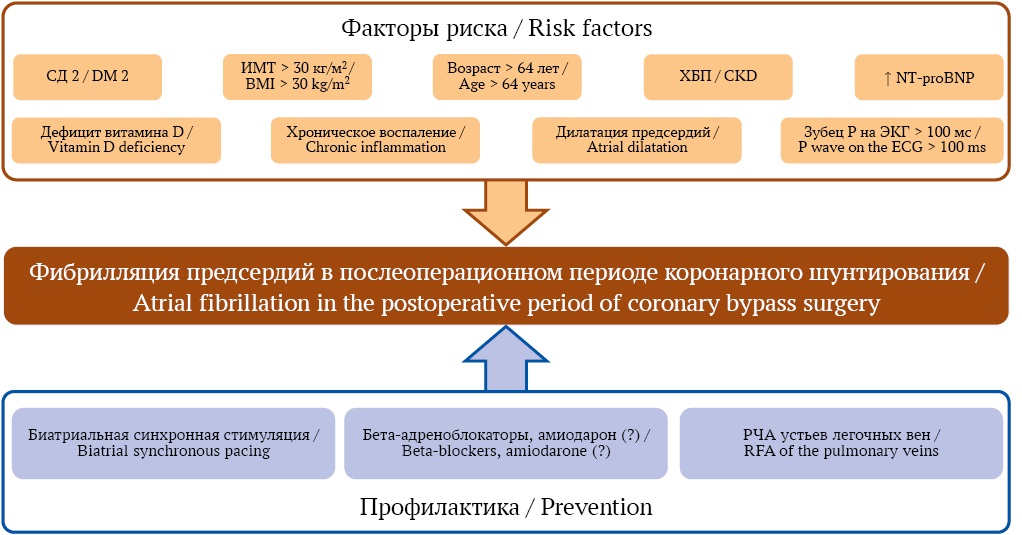
РИС. Факторы риска развития фибрилляции предсердий после коронарного шунтирования и методы профилактики.
Примечание: СД 2 – сахарный диабет 2-го типа; ИМТ – индекс массы тела; ХБП – хроническая болезнь почек; NT-proBNP – N-Terminal Pro-brain Natriuretic Peptide, мозговой натрийуретический пептид; ЭКГ – электрокардиограмма; РЧА – радиочастотная абляция.
FIG. Risk factors in the development of atrial fibrillation after coronary artery bypass grafting and prevention methods.
Note: DM 2 – type 2 diabetes mellitus; BMI – body mass index; CKD – chronic kidney disease; NT-proBNP – N-Terminal Pro-brain Natriuretic Peptide; ECG – electrocardiogram; RFA – radiofrequency ablation.
ВКЛАД АВТОРОВ
Кузьмичкина М.А., Кавешников В.С. участвовали в обсуждении концепции обзора, редактировании текста. Кузьмичкина М.А. отвечала за отбор источников литературы, написание статьи. Кавешников В.С. доработал исходный вариант рукописи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Maria A. Kuzmichkina, Vladimir S. Kaveshnikov participated in the discussion of the review concept, editing the text. Maria A. Kuzmichkina was responsible for selecting literature sources, writing the article. Vladimir S. Kaveshnikov revised the original version of the manuscript. All authors approved the final version of the article.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interest. The authors declare that there is no conflict of interest.
Financial support. The study had no sponsorship (own resources).
1. Клинические рекомендации по стабильной ишемической болезни сердца. 2020 г. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_IBS-unlocked.pdf (дата обращения: 11.09.2024).
2. Клинические рекомендации по фибрилляции и трепетанию предсердий. 2020. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_IBS-unlocked.pdf (дата обращения: 11.09.2024).
Список литературы
1. Бокерия Л.А., Семенов В.Ю., Милиевская Е.Б. и др. Хирургическое и интервенционное лечение пациентов с ишемической болезнью сердца в Российской Федерации (статистика: 1996–2022 годы). Грудная и сердечно-сосудистая хирургия. 2024; 3 (66): 291–301. https://doi.org/10.24022/0236-2791-2024-66-3-291-301. EDN: KDWONA
2. Head S.J., Milojevic M., Taggart D.P., et al. Current practice of state-of-the-art surgical coronary revascularization. Circulation. 2017 Oct 3; 136(14): 1331–1345. https://doi.org/10.1161/circulationaha.116.022572. PMID: 28972063
3. Bonilla-Bonilla D.M., Osorio-Toro L.M., Daza-Arana J.E., et al. Risk factors for postoperative atrial fibrillation in myocardial revascularization surgery: a 15-year experience. J Clin Med. 2024 Aug 31; 13(17): 5171. https://doi.org/10.3390/jcm13175171. PMID: 39274384
4. Rizza V., Maranta F., Cianfanelli L., et al. Subacute postoperative atrial fibrillation after heart surgery: Incidence and predictive factors in cardiac rehabilitation. J Arrhythm. 2023 Nov 27; 40(1): 67–75. https://doi.org/10.1002/joa3.12956. PMID: 38333376
5. Бокерия Л.А., Бокерия О.Л., Гафуров Ф.С. Современное состояние проблемы профилактики фибрилляции предсердий в раннем периоде после операций аортокоронарного шунтирования. Новости хирургии. 2018; 26(5): 605–615. https://doi.org/10.18484/2305-0047.2018.5.605. EDN: YOWDBR
6. Кузьмичкина М.А., Серебрякова В.Н. Инвалидность и возврат к труду среди пациентов, перенесших хирургическую реваскуляризацию миокарда. Сибирский журнал клинической и экспериментальной медицины. 2020; 35(2): 44–49. https://doi.org/10.29001/2073-8552-2020-35-2-44-49
7. Кузьмичкина М.А., Серебрякова В.Н. Реабилитация пациентов, подвергшихся коронарному шунтированию, с позиции восстановления трудоспособности. Клиническая медицина. 2020; 98(4): 266–274. https://doi.org/10.30629/0023-2149-2020-98-4-266-274. EDN: YBMTAQ
8. Шахгельдян К.И., Рублев В.Ю., Гельцер Б.И. и др. Оценка предиктивного потенциала дооперационных факторов риска фибрилляции предсердий у больных ишемической болезнью сердца после коронарного шунтирования. Сибирский журнал клинической и экспериментальной медицины. 2020; 35(4): 128–136. https://doi.org/10.29001/2073-8552-2020-35-4-128-136. EDN: ZFTVWF
9. Mekonen Gdey M., Buch P., Pareesa F., et al. Predictors of developing postoperative atrial fibrillation in patients undergoing coronary artery bypass graft: A systematic review and meta-analysis. Cureus. 2023 Dec 30; 15(12): e51316. https://doi.org/10.7759/cureus.51316. PMID: 38288215
10. Ревишвили А.Ш., Попов В.А., Коростелев А.Н. и др. Предикторы развития фибрилляции предсердий после операции аортокоронарного шунтирования. Вестник аритмологии. 2018 Nov; (94): 11–16. https://doi.org/10.25760/va-2018-94-11-16. EDN: VNFTHO
11. Mohamed Sabry A.S., El-Kader Mansour H.A., Abo El-Azm T.H., et al. Clinical and echocardiographic predictors of atrial fibrillation after coronary artery bypass grafting. J Atr Fibrillation. 2020 Dec 31; 13(4): 2320. https://doi.org/10.4022/jafib.2320. PMID: 34950315
12. Gerçek M., Börgermann J., Gummert J., et al. Postoperative atrial fibrillation prediction by left atrial size in coronary artery bypass grafting and five-year survival outcome. J Clin Med. 2024 Jun 26; 13(13): 3738. https://doi.org/10.3390/jcm13133738. PMID: 38999309
13. Cui X., Xu C., Chen C., et al. New-onset post-operative atrial fibrillation in patients undergoing coronary artery bypass grafting surgery – A retrospective case-control study. Braz J Cardiovasc Surg. 2023 Feb 10; 38(1): 149–156. https://doi.org/10.21470/1678-9741-2021-0220. PMID: 35436075
14. Lotter K., Yadav S., Saxena P., et al. Predictors of atrial fibrillation post coronary artery bypass graft surgery: new scoring system. Open Heart. 2023 Jun; 10(1): e002284. https://doi.org/10.1136/openhrt-2023-002284. PMID: 37316327
15. Metkus T.S., Suarez-Pierre A., Crawford T.C., et al. Diastolic dysfunction is common and predicts outcome after cardiac surgery. J Cardiothorac Surg. 2018 Jun 15; 13(1): 67. https://doi.org/10.1186/s13019-018-0744-3. PMID: 29903030
16. Koletsis E.N., Prokakis C., Crockett J.R., et al. Prognostic factors of atrial fibrillation following elective coronary artery bypass grafting: the impact of quantified intraoperative myocardial ischemia. J. Cardiothorac. Surg. 2011; 6: 127. https://doi.org/10.1186/1749-8090-6-127
17. Петракова Е.С., Савина Н.М., Молочков А.В. Фибрилляция предсердий после операций аортокоронарного шунтирования: факторы риска, профилактика и лечение. Кардиология. 2020 Октябрь 14; 60(9): 134–148. https://doi.org/10.18087/cardio.2020.9.n1074. PMID: 33131484. EDN: VQVACV
18. D’Agostino R.S., Jacobs J.P., Badhwar V., et al. The Society of Thoracic Surgeons adult cardiac surgery database: 2018 update on outcomes and quality. Ann Thorac Surg. 2018 Jan; 105(1): 15–23. https://doi.org/10.1016/j.athoracsur.2017.10.035. PMID: 29233331
19. Ferrannini G., Norhammar A., Gyberg V., et al. Is coronary artery disease inevitable in type 2 diabetes? From a glucocentric to a holistic view on patient management. Diabetes Care. 2020 Sep; 43(9): 2001–2009. https://doi.org/10.2337/dci20-0002. Epub 2020 Jul 13. PMID: 32661109
20. Zakynthinos G.E., Tsolaki V., Oikonomou E., et al. Metabolic syndrome and atrial fibrillation: different entities or combined disorders. J Pers Med. 2023 Aug 28; 13(9): 1323. https://doi.org/10.3390/jpm13091323. PMID: 37763092
21. Sim M.A., Liu W., Chew S.T.H., et al. Wider perioperative glycemic fluctuations increase risk of postoperative atrial fibrillation and ICU length of stay. PLoS One. 2018 Jun 8; 13(6): e0198533. https://doi.org/10.1371/journal.pone.0198533. PMID: 29883468; PMCID: PMC5993260
22. Kinoshita T., Asai T., Suzuki T., et al. Preoperative hemoglobin A1c predicts atrial fibrillation after off-pump coronary bypass surgery. Eur. J. Cardiothorac. Surg. 2012; 41(1): 102–107. https://doi.org/10.1016/j.ejcts.2011.04.011
23. Turkkolu S.T., Selçuk E., Köksal C. Biochemical predictors of postoperative atrial fibrillation following cardiac surgery. BMC Cardiovasc Disord. 2021 Apr 9; 21(1): 167. https://doi.org/10.1186/s12872-021-01981-z. PMID: 33836659
24. Serban C., Arinze J.T., Starreveld R., et al. The impact of obesity on early postoperative atrial fibrillation burden. J. Thorac. Cardiovasc. Surg. 2020 Mar; 159(3): 930–938.e2. https://doi.org/10.1016/j.jtcvs.2019.03.073. Epub 2019 Apr 4. PMID: 31043315
25. Vural Ü., Ağlar A.A. What is the role of metabolic syndrome and obesity for postoperative atrial fibrillation after coronary bypass grafting? BMC Cardiovasc Disord. 2019 Jun 17; 19(1): 147. https://doi.org/10.1186/s12872-019-1130-3. PMID: 31208345
26. Thet M.S., Hlwar K.E., Thet K.S., et al. Preoperative B-type natriuretic peptides to predict postoperative atrial fibrillation in cardiac surgery: A systematic review and meta-analysis. Heart Lung. Circ. 2024 Jan; 33(1): 23–32. https://doi.org/10.1016/j.hlc.2023.10.015. Epub 2023 Dec 23. PMID: 38143193
27. Ahmadzadeh K., Hajebi A., Adel Ramawad H. Value of N-Terminal Pro-Brain Natriuretic Peptide for embolic events risk prediction in patients with atrial fibrillation; a systematic review and meta-analysis. Arch Acad Emerg Med. 2023 Jan 1; 11(1): e8. https://doi.org/10.22037/aaem.v11i1.1808. PMID: 36620735
28. Belen E., Aykan A.C., Kalaycioglu E., et al. Low-level vitamin D is associated with atrial fibrillation in patients with chronic heart failure. Adv Clin Exp Med. 2016 Jan-Feb; 25(1): 51–57. https://doi.org/10.17219/acem/34690. PMID: 26935498
29. Ozsin K.K., Sanrı U.S., Toktaş F., et al. Effect of plasma level of vitamin D on postoperative atrial fibrillation in patients undergoing isolated coronary artery bypass grafting. Brazilian Journal of Cardiovascular Surgery. 2018 May-Jun; 33(3): 217–223. https://doi.org/10.21470/1678-9741-2017-0214. PMID: 30043913
30. Alirezaei T., Ansari Aval Z., Karamian A., et al. Effect of preoperative vitamin D on postoperative atrial fibrillation incidence after coronary artery bypass grafting. Gen. Thorac. Cardiovasc. Surg. 2024 Mar 15: Published online. https://doi.org/10.1007/s11748-024-02020-2. Epub ahead of print. PMID: 38485852
31. Daie M., Hajhossein Talasaz A., Karimi A., et al. Relationship between Vitamin D levels and the incidence of post coronary artery bypass graft surgery atrial fibrillation. J. Tehran. Heart Cent. 2018 Oct; 13(4): 159–165. PMID: 30972113
32. Pala A.A., Urcun Y.S. Is the mean platelet volume a predictive factor for atrial fibrillation developing after coronary artery bypass grafting in elderly patients? Heart Surg. Forum. 2020 Nov 2; 23(6): E809–E814. https://doi.org/10.1532/hsf.3201. PMID: 33234211
33. Şaşkın H., Görür D.A. A new biomarker to predict atrial fibrillation and its adverse events after coronary artery bypass surgery: red blood cell distribution volume. Cardiovasc. J. Afr. 2023 Nov-Dec 23; 34(5): 299–306. https://doi.org/10.5830/cvja-2022-063. Epub 2023 Jan 11. PMID: 36637452
34. Saskin H., Serhan Ozcan K., Yilmaz S. High preoperative monocyte count/high-density lipoprotein ratio is associated with postoperative atrial fibrillation and mortality in coronary artery bypass grafting. Interact Cardiovasc Thorac Surg. 2017 Mar 1; 24(3): 395–401. https://doi.org/10.1093/icvts/ivw376. PMID: 28040764
35. Sucato V., Comparato F., Ortello A., et al. Residual cardiovascular risk: role of remnants cholesterol, monocyte/HDL ratio and lipoprotein ratios on personalized cardiovascular prevention. J Pers Med. 2024 Apr 26; 14(5): 460. https://doi.org/10.3390/jpm14050460. PMID: 38793042
36. Perrier S., Meyer N., Hoang Minh T., et al. Predictors of atrial fibrillation after coronary artery bypass grafting: A Bayesian analysis. Ann Thorac Surg. 2017 Jan; 103(1): 92–97. https://doi.org/10.1016/j.athoracsur.2016.05.115. Epub 2016 Aug 28. PMID: 27577036
37. Taha A., Hjärpe A., Martinsson A., et al. Cardiopulmonary bypass management and risk of new-onset atrial fibrillation after cardiac surgery. Interdiscip Cardiovasc Thorac Surg. 2023 Sep 2; 37(3): ivad153. https://doi.org/10.1093/icvts/ivad153. PMID: 37713475
38. Kawczynski M.J., Van De Walle S., Maesen B., et al. Preoperative P-wave parameters and risk of atrial fibrillation after cardiac surgery: A meta-analysis of 20 201 patients. Interact Cardiovasc Thorac Surg. 2022 Sep 9; 35(4): ivac220. https://doi.org/10.1093/icvts/ivac220. PMID: 35993895
39. Jannati M. Atrial fibrillation post coronary artery graft surgery: a review of literature. Int J Gen Med. 2019 Nov 7; 12: 415–420. https://doi.org/10.2147/IJGM.S227761. PMID: 31807054
40. Мингалимова А.Р., Драпкина О.М., Сагиров М.А. и др. Роль поражения коронарного русла в развитии фибрилляции предсердий, впервые развившейся после операции коронарного шунтирования. Кардиология. 2021 Дек 31; 61(12): 41–48. https://doi.org/10.18087/cardio.2021.12.n1541. PMID: 35057720. EDN: OCOWLS
41. Williams J.B., Peterson E.D., Wojdyla D., et al. Central venous pressure after coronary artery bypass surgery: Does it predict postoperative mortality or renal failure? Journal of Critical Care. 2014; 29(6): 1006–1010. https://doi.org/10.1016/j.jcrc.2014.05.027
42. Lotter K., Yadav S., Saxena P., et al. Predictors of atrial fibrillation post coronary artery bypass graft surgery: new scoring system. Open Heart. 2023 Jun; 10(1): e002284. https://doi.org/10.1136/openhrt-2023-002284. PMID: 37316327
43. Taha A., Nielsen S.J., Bergfeldt L., et al. New-onset atrial fibrillation after coronary artery bypass grafting and long-term outcome: a population-based nationwide study from the SWEDEHEART Registry. J Am Heart Assoc. 2021 Jan 5; 10(1): e017966. https://doi.org/10.1161/JAHA.120.017966. Epub 2020 Nov 30. PMID: 33251914
44. Greenberg J.W., Lancaster T.S., Schuessler R.B., et al. Postoperative atrial fibrillation following cardiac surgery: a persistent complication. Eur J Cardiothorac Surg. 2017 Oct 1; 52(4): 665–672. https://doi.org/10.1093/ejcts/ezx039. PMID: 28369234
45. Puscas A., Harpa M.M., Brinzaniuc K., et al. Evaluation of perioperative beta-blockers and factors associated with postoperative atrial fibrillation in cardiac surgery: a single center experience. Rev Cardiovasc Med. 2023 Dec 27; 24(12): 370. https://doi.org/10.31083/j.rcm2412370. PMID: 39077087
46. Howitt S.H., Grant S.W., Campbell N.G., et al. Are serum potassium and magnesium levels associated with atrial fibrillation after cardiac surgery? J Cardiothorac Vasc Anesth. 2020 May; 34(5): 1152–1159. https://doi.org/10.1053/j.jvca.2019.10.045. Epub 2019 Nov 2. PMID: 31948890
47. Balik M., Sander M., Trimmel H., et al. Landiolol for managing post-operative atrial fibrillation. Eur Heart J Suppl. 2018 Jan; 20(Suppl_A): A10–A14. https://doi.org/10.1093/eurheartj/sux036. Epub 2018 Jan 8. PMID: 30188958
48. Alqahtani A.A. Atrial fibrillation post cardiac surgery trends toward management. Heart Views. 2010; 11(2): 57–63. https://doi.org/10.4103/1995-705x.73212
49. Mehaffey J.H., Hawkins R.B., Byler M., et al. Amiodarone protocol provides cost-effective reduction in postoperative atrial fibrillation. Ann Thorac Surg. 2018 Jun; 105(6): 1697–1702. https://doi.org/10.1016/j.athoracsur.2017.12.029. Epub 2018 Jan 31. PMID: 29374511
50. Бокерия Л.А., Бокерия О.Л., Канаметов Т.Н. и др. Рандомизированное исследование эпикардиального применения гидрогеля с амиодароном для профилактики послеоперационной фибрилляции предсердий у пациентов после аортокоронарного шунтирования. Анналы аритмологии. 2018; 15(4): 196–203. https://doi.org/10.15275/annaritmol.2018.4.1. EDN: WYLOVP
51. Gaudino M., Di Franco A., Rong L.Q., et al. Postoperative atrial fibrillation: from mechanisms to treatment. Eur Heart J. 2023 Mar 21; 44(12): 1020–1039. https://doi.org/10.1093/eurheartj/ehad019. PMID: 36721960
52. Turagam M.K., Downey F.X., Kress D.C., et al. Pharmacological strategies for prevention of postoperative atrial fibrillation. Expert Review of Clinical Pharmacology. 2015; 8(2): 233–250. https://doi.org/10.1586/17512433.2015.1018182
53. Patti G., Chello M., Candura D., et al. Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery: results of the ARMYDA-3 (Atorvastatin for reduction of myocardial dysrhythmia after cardiac surgery) study. Circulation. 2006 Oct 3; 114(14): 1455–1461. https://doi.org/10.1161/circulationaha.106.621763. Epub 2006 Sep 25. PMID: 17000910
54. Nomani H., Mohammadpour A.H., Reiner Ž., et al. Statin therapy in post-operative atrial fibrillation: focus on the anti-inflammatory effects. J Cardiovasc Dev Dis. 2021 Feb 26; 8(3): 24. https://doi.org/10.3390/jcdd8030024. PMID: 33652637
55. Wang H., Chen J., Zhao L. N-3 polyunsaturated fatty acids for prevention of postoperative atrial fibrillation: updated meta-analysis and systematic review. J Interv Card Electrophysiol. 2018 Mar; 51(2): 105–115. https://doi.org/10.1007/s10840-018-0315-5. Epub 2018 Jan 29. PMID: 29380237
56. Gupta R., Jacobson J., Cooper H.F., et al. Meta-analysis of n-3 polyunsaturated fatty acid supplementation for the prevention of post-operative atrial fibrillation in patients undergoing coronary artery bypass surgery. Journal of Cardiac Failure. 2019; 25(8): S83. https://doi.org/10.1016/j.cardfail.2019.07.236
57. Camm A.J., Savelieva I. Fish oil for secondary prevention of atrial fibrillation: should we still believe in its antiarrhythmic effect? Circulation. 2011; 124(10): 1093–1096. https://doi.org/10.1161/circulationaha.111.048140. PMID: 21900094
58. Nomani H., Mohammadpour A.H., Moallem S.M.H., et al. Anti-inflammatory drugs in the prevention of post-operative atrial fibrillation: a literature review. Inflammopharmacology. 2020 Feb; 28(1): 111–129. https://doi.org/10.1007/s10787-019-00653-x. Epub 2019 Oct 31. PMID: 31673892
59. Abbasciano R.G., Olivieri G.M., Chubsey R., et al. Prophylactic corticosteroids for cardiopulmonary bypass in adult cardiac surgery. Cochrane Database Syst Rev. 2024 Mar 20; 3(3): CD005566. https://doi.org/10.1002/14651858.CD005566.pub4. PMID: 38506343
60. Oh S., Choi E.K., Zhang Y., et al. Botulinum toxin injection in epicardial autonomic ganglia temporarily suppresses vagally mediated atrial fibrillation. Circ Arrhythm Electrophysiol. 2011 Aug; 4(4): 560–565. https://doi.org/10.1161/circep.111.961854. Epub 2011 Jun 9. PMID: 21659633
61. Romanov A., Pokushalov E., Ponomarev D., et al. Long-term suppression of atrial fibrillation by botulinum toxin injection into epicardial fat pads in patients undergoing cardiac surgery: Three-year follow-up of a randomized study. Heart Rhythm. 2019 Feb; 16(2): 172–177. https://doi.org/10.1016/j.hrthm.2018.08.019. Epub 2018 Nov 7. PMID: 30414841
62. Piccini J.P., Ahlsson A., Dorian P., et al. Design and rationale of a phase 2 study of NeurOtoxin (Botulinum Toxin Type A) for the PreVention of Post-Operative Atrial Fibrillation – The NOVA Study. Am. Heart J. 2022 Mar; 245: 51–59. https://doi.org/10.1016/j.ahj.2021.10.114. Epub 2021 Oct 20. PMID: 34687654
63. Piccini J.P., Ahlsson A., Dorian P., et al. NOVA-AF Investigators. Efficacy and safety of Botulinum Toxin Type A for the prevention of postoperative atrial fibrillation. JACC Clin Electrophysiol. 2024 May; 10(5): 930–940. https://doi.org/10.1016/j.jacep.2024.01.020. Epub 2024 Apr 24. PMID: 38661602
64. Quan I., Belley-Côté E.P., Spence J., et al. A systematic review of ongoing registered research studies on post-operative atrial fibrillation after cardiac surgery. J Clin Med. 2024 Aug 22; 13(16): 4948. https://doi.org/10.3390/jcm13164948. PMID: 39201089
65. Бокерия Л.А., Бокерия О.Л., Фатулаев З.Ф. и др. Влияние временной биатриальной электрокардиостимуляции на профилактику фибрилляции предсердий после коронарного шунтирования в условиях искусственного кровообращения. Анналы аритмологии. 2018; 15(2): 123–132. https://doi.org/10.15275/annaritmol.2018.2.7. EDN: YSOAJN
66. Ревишвили А.Ш., Попов В.А., Плотников Г.П. и др. Сравнительная оценка эффективности радиочастотной изоляции устьев легочных в сочетании с медикаментозной терапией амиодароном для профилактики фибрилляции предсердий после аортокоронарного шунтирования. Вестник аритмологии. 2019; 26(3): 29–36. https://doi.org/10.35336/va-2019-3-29-36. EDN: IYNKCQ
Об авторах
М. А. КузьмичкинаРоссия
Кузьмичкина Мария Анатольевна - канд. мед. наук, научный сотрудник лаборатории регистров сердечно-сосудистых заболеваний, высокотехнологичных вмешательств и телемедицины НИИ кардиологии Томского НИМЦ.
ул. Киевская, д. 111а, Томск, 634012
В. С. Кавешников
Россия
Кавешников Владимир Сергеевич - канд. мед. наук, ведущий научный сотрудник лаборатории регистров сердечно-сосудистых заболеваний, высокотехнологичных вмешательств и телемедицины НИИ кардиологии Томского НИМЦ.
ул. Киевская, д. 111а, Томск, 634012







































