Перейти к:
Система гемостаза у пациентов с первичным миелофиброзом на фоне таргетной терапии с применением руксолитиниба
https://doi.org/10.47093/2218-7332.2024.15.3.26-35
Аннотация
Цель. Оценить влияние терапии руксолитинибом на состояние системы гемостаза у пациентов с первичным миелофиброзом (ПМФ).
Материалы и методы. Обследованы 30 пациентов с ПМФ, из них 16 человек получали руксолитиниб (группа 1) на момент обследования и 14 были без лечения (группа 2). Контрольную группу составили 30 практически здоровых лиц. Исследовался общий анализ крови, оценена функциональная активность тромбоцитов, активность фактора Виллебранда, фактора VIII и естественных антикоагулянтов. В тесте генерации тромбина определен эндогенный потенциал тромбина (ЭПТ, нмоль×мин); рассчитана чувствительность к тромбомодулину (ЧТМ) и индекс коагуляции. Для сравнения групп применялся тест Краскела – Уоллиса с апостериорным тестом Данна.
Результаты. Уровень гемоглобина и тромбоцитов был ниже в группе 1 по сравнению с группой 2 и контролем. Функциональная активность тромбоцитов при индукции коллагеном у пациентов с ПМФ была ниже, чем в контроле, а в группе 1 ниже, чем в группе 2: 2,2 (1,6; 5,7) % vs 41,6 (3,4; 64,8) %, р < 0,05. У пациентов в группе 1 активность фактора Виллебранда – 150,0 (122,5; 195) % и фактора VIII – 173 (148,5; 200)% была выше (р < 0,05), чем в контроле – 97 (84,8; 110) % и 104 (85; 130) % соответственно. Активность антитромбина не различалась в группах ПМФ и контроле. Активность протеина S была снижена в обеих группах с ПМФ: группа 1 – 70 (58; 86,6) %, группа 2 – 65 (43,6; 107,5) %, контроль – 102 (86; 109,0) %, р < 0,001. ЭПТ и ЧТМЭПТ в группах 1 и 2 были статистически значимо ниже, а индекс коагуляции имел тенденцию к более высоким значениям, чем в контроле: 5,3 (3,0; 11,4) – группа 1; 3,2 (2,4; 7,3) – группа 2; контроль – 1,9 (1,6; 2,2), р = 0,073.
Заключение. На фоне терапии руксолитинибом отмечена несостоятельность тромбоцитарного звена гемостаза и прокоагулянтная направленность в плазменном звене с увеличением активности фактора Виллебранда и фактора VIII и снижением активности протеина S.
Ключевые слова
Список сокращений:
- JAK2 – Januskinase 2, янус-киназа 2
- АЧТВ – активированное частичное тромбопластиновое время
- ПМФ – первичный миелофиброз
- ТГТ – тест генерации тромбина
- ЧТМ – чувствительность к тромбомодулину
- ЭПТ – эндогенный потенциал тромбина
- ЧТМЭПТ– чувствительность к тромбомодулину, выраженная в процентах падения эндогенного потенциала тромбина
- ЧТМПик– чувствительность к тромбомодулину, выраженная в процентах падения пика тромбина
Первичный миелофиброз (ПМФ) – одна из нозологий Ph-негативных миелопролиферативных новообразований, которые характеризуются клональной пролиферацией гемопоэтических стволовых клеток миелоидного ростка кроветворения и соединительнотканных структур костного мозга [1]. Как правило, данные аномальные изменения реализуются на фоне приобретенных мутаций в генах JAK2 (Janus kinase 2, янус-киназа 2), CALR (сalreticulin, кальретикулин) и MPL (myeloproliferative leukemia virus, thrombopoietin receptor, вирус миелопролиферативного лейкоза, рецептор тромбопоэтина).
ПМФ ассоциируется с развитием фиброза костного мозга и экстрамедуллярного гемопоэза, приводящего к гепато- и спленомегалии. Сосудистые осложнения, такие как тромбоэмболические события или кровотечения, в значительной степени влияют на течение заболевания, приводя не только к ухудшению качества жизни, но и к росту смертности. По данным ряда авторов, тромбозы и тромбоэмболии при ПМФ встречаются у 9,5% пациентов, кровотечения, среди которых значительную часть составляют желудочно-кишечные, отмечаются у 6,4–8,9% пациентов [2][3]. Полагают, что подобные осложнения могут возникать как из-за особенностей самого заболевания, так и под влиянием терапии, направленной на купирование патологических проявлений различного генеза [3].
Известно, что гиперактивация JAK-STAT5 сигнального пути, зависимая в основном от наличия драйверных мутаций в генах JAK2, CALR и MPL, лежит в основе патогенеза ПМФ [4]. Руксолитиниб, являясь селективным ингибитором JAK1 и JAK2 киназ и, следовательно, JAK-STAT5 сигнального пути, стал первым препаратом таргетной терапии ПМФ [5]. Применение руксолитиниба ассоциировано с уменьшением аллельной нагрузки мутации в гене JAK2, уменьшением спленомегалии, повышением качества жизни пациентов за счет облегчения симптомов, обусловленных заболеванием, и улучшением прогноза [6].
Предполагается, что отличительные особенности ПМФ: фиброз костного мозга, экстрамедуллярное кроветворение с развитием спленомегалии, мобилизация незрелых миелоидных клеток в периферическую кровь, лейкоцитоз – частично обусловлены повышением продукции провоспалительных цитокинов: фактора некроза опухоли-α, интерлейкина-1, интерлейкина-6 [7]. На фоне лечения руксолитинибом отмечается снижение концентрации этих маркеров воспаления [8]. Однако подобная терапия сопровождается развитием выраженной тромбоцитопении и анемии, которые достигают наиболее значительных изменений к 4–8 и к 8–12 неделям лечения соответственно [5][9][10]. В связи с наличием данных побочных эффектов, которые могут быть напрямую связаны с развитием тромботических или геморрагических осложнений, встает вопрос об их влиянии на состояние системы гемостаза у пациентов, получающих руксолитиниб.
Цель исследования: изучить влияние терапии руксолитинибом на состояние системы гемостаза у пациентов с ПМФ.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одномоментное исследование пациентов с ПМФ, проходивших лечение и обследование в ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства» (ФГБУ «РосНИИГТ ФМБА России») с 01.01.2019 по 31.12.2022, осуществлялся сплошной набор пациентов.
Критерии включения в исследование: возраст 18 лет и старше; подписанное информированное согласие на участие в исследовании; установленный диагноз ПМФ на основании критериев классификации ВОЗ 2016 г.
Критерии невключения в исследование представлены на рисунке.
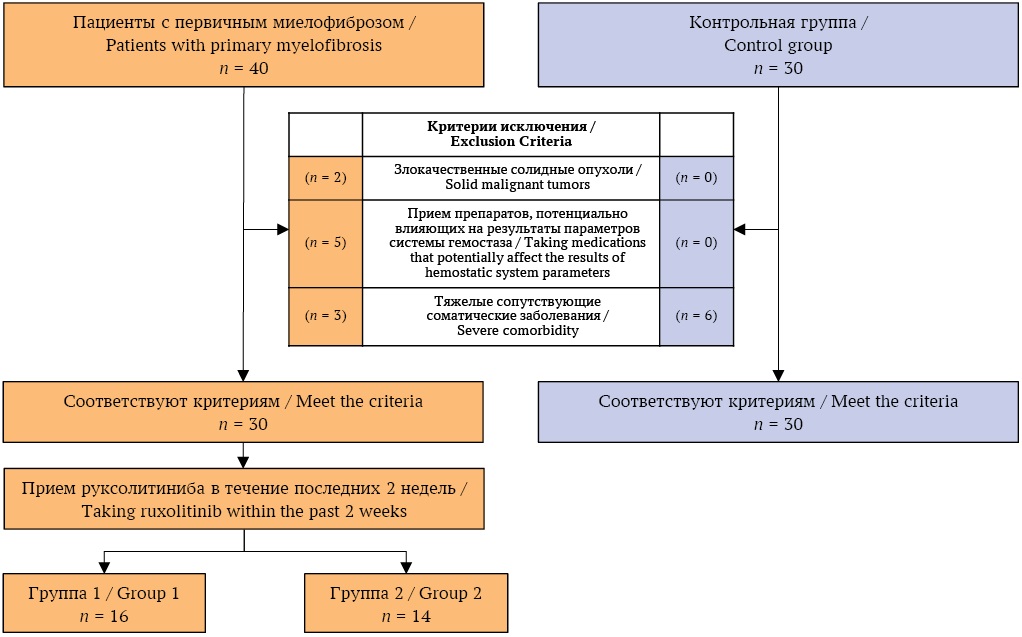
РИС. Потоковая диаграмма включения пациентов и лиц контрольной группы в исследование.
FIG. Flowchart for inclusion of patients and controls in the study.
В исследование включены 30 пациентов с ПМФ, из них 24 женщины и 6 мужчин в возрасте от 38 до 88 лет. Пациенты были разделены на две группы: группа 1 – получавшие на момент включения в исследование руксолитиниб две и более недели (n = 16) и группа 2 – не получавшие никакого лечения в течение двух недель до включения в исследование (n = 14). В группе 1 длительность приема руксолитиниба колебалась от 2 недель до 12 месяцев, доза препарата составляла 10–30 мг/сут.
В обеих группах изучены социально-демографические признаки (пол, возраст), проведена оценка заболевания по прогностической шкале DIPSS+1, исследованы параметры общего анализа крови, определено наличие тромботических, геморрагических осложнений.
Контрольную группу составили 30 практически здоровых лиц: сотрудников ФГБУ «РосНИИГТ ФМБА России».
Методы исследования системы гемостаза
Подсчет концентрации тромбоцитов производили на автоматическом гематологическом анализаторе Sysmex XN-10 (XN-1000) (Sysmex, Япония) комбинацией импедансного, оптического и флюоресцентного методов.
Оценку функциональной активности тромбоцитов осуществляли с помощью метода оптической индуцированной агрегатометрии по Борну на 4-канальном анализаторе агрегации тромбоцитов АТ-02 (НПФ «Медицина-Техника», Россия). В качестве индукторов агрегации использовали аденозиндифосфат (АДФ) в двух концентрациях (1 и 5 мкМ), коллаген в концентрации 2 мкг/мл и ристомицин в концентрации 1,2 мг/мл. Оценивали максимальную амплитуду агрегации.
Для изучения состояния плазменного звена гемостаза выполняли рутинную коагулограмму, а также определяли активность отдельных факторов свертывания крови. Определение параметров скрининговой коагулограммы, таких как индекс активированного частичного тромбопластинового времени (АЧТВ), который рассчитывался как отношение АЧТВ больного (сек) к АЧТВ контрольной плазмы (сек), протромбиновый тест по Квику и концентрация фибриногена, а также активность фактора VIII, фактора Виллебранда, антитромбина, протеина С и свободного протеина S осуществляли на автоматических коагулометрах серии ACL: ACL Top 300 CTS и ACL Elite Pro (Automated Coagulation Laboratory, Instrumentation Laboratory, США) с использованием реактивов HemosIL (Instrumentation Laboratory, США). Уровень фактора Виллебранда (антиген) оценивали при помощи иммунотурбидиметрического метода.
Оценку суммарного эффекта про- и антикоагулянтов на общий гемостатический потенциал плазмы крови проводили с помощью теста генерации тромбина (ТГТ), который выполняли без добавления и с добавлением рекомбинантного тромбомодулина на планшетном флюориметре (Fluoroskan Ascent, ThermoFisher Scientific, Финляндия). Конечная концентрация тканевого фактора и фосфолипидов составила 5 пМ и 4 мкМ соответственно; определяли следующие показатели ТГТ: эндогенный потенциал тромбина (ЭПТ, нмоль×мин), максимальную концентрацию тромбина (Пик, нмоль). Рассчитывали чувствительность к тромбомодулину (ЧТМ), которую выражали как процент падения ЭПТ (ЧТМЭПТ) и пик (ЧТМПик) после добавления тромбомодулина.
Чтобы оценить сохранность гемостатического баланса между про- и антикоагулянтными влияниями, вычислили индекс коагуляции, который представляет собой отношение про- и антикоагулянтных потенциалов плазмы крови, определяемых в ТГТ. Индекс коагуляции вычисляли по формуле: индекс коагуляции = ЭПТ(ТМ-) / ЧТМЭПТ, где ЭПТ (ТМ-) – эндогенный потенциал тромбина пациента, полученный в ТГТ без добавления тромбомодулина, выраженный в процентах по отношению к значению медианы ЭПТ в группе лиц контрольной группы.
Статистическая обработка данных
Распределение показателей непрерывных переменных не подчинялось нормальному распределению (критерий Колмогорова – Смирнова, Крамера фон Мизеса), для их описания использовали медиану и межквартильный интервал (25-й; 75-й процентили). Для сравнения трех групп применялся аналог межгруппового ANOVA – тест Краскела – Уоллиса с апостериорным тестом Данна.
Для выявления различий по качественным признакам между обследованными группами пациентов с ПМФ применяли критерий хи-квадрат и точный тест Фишера. Корреляционные связи оценивали, определяя коэффициент ранговой корреляции Спирмена (rs); шкала Чеддока применена для оценки силы связи: при значениях коэффициентов 0–0,3 связь оценена как очень слабая; 0,3–0,5 – слабая; 0,5–0,7 – средняя; 0,7–0,9 – высокая; 0,9–1 – очень высокая. Различия считали статистически значимыми при p < 0,05. Статистическую обработку проводили при помощи программы Statistica 13.0 (TIBCO, США).
РЕЗУЛЬТАТЫ
Общие характеристики пациентов
Общие характеристики представлены в таблице 1. Возраст пациентов с ПМФ был статистически значимо выше, чем у лиц контрольной группы, соотношение по полу в исследованных группах не различалось.
Таблица 1. Общие характеристики пациентов с первичным миелофиброзом, получавших и не получавших руксолитиниб, и лиц контрольной группы
Table 1. General characteristics of patients with primary myelofibrosis treated and not treated with ruxolitinib, and controls
|
Параметр / Parameter |
Контроль / Control (n = 30) |
Группа 1: ПМФ + руксолитиниб / Group 1: PMF + ruxolitinib (n = 16) |
Группа 2: ПМФ / Group 2: PMF (n = 14) |
Значение р / p value |
|
Возраст, годы / Age, years |
45 (35; 53,5) |
65 (59; 68)a |
51 (38; 68) a,b |
<0,01 |
|
Мужчины, n (%) / Men, n (%) |
14 (47) |
4 (25) |
2 (14) |
n.s. |
|
Женщины, n (%) / Women, n (%) |
16 (53) |
12 (75) |
12 (86) |
n.s. |
|
DIPSS+ риск / DIPSS + score: |
||||
|
низкий, n (%) / low, n (%) |
0 |
2 (14) |
n.s. |
|
|
промежуточный 1, n (%) / intermediate-1, n (%) |
2 (13) |
7 (50) |
<0,05 |
|
|
промежуточный 2, n (%) / intermediate-2, n (%) |
12 (75) |
2 (14) |
<0,01 |
|
|
высокий, n (%) / high, n (%) |
2 (13) |
3 (22) |
n.s. |
|
|
JAK2, n (%): |
11 (69) |
12 (86) |
n.s. |
|
|
CALR, n (%): |
5 (31) |
2 (14) |
n.s. |
|
|
Гемоглобин, г/л / Hemoglobin, g/L |
125 (121; 131,75) |
91,5 (83,3; 103) |
121,0 (72,2; 156,9)b |
<0,05 |
|
Лейкоциты, ×10⁹/л / white blood cells, ×10⁹/L |
8,10 (6,26; 9,83) |
9,2 (4,4; 15,5)a |
8,3 (6,1; 10,7) |
n.s. |
|
Тромботические осложнения, n (%) / Thrombotic complications, n (%) |
3 (19) |
3 (21) |
n.s. |
|
|
Геморрагические осложнения, n (%) / Hemorrhagic complications, n (%) |
3 (19) |
3 (21) |
n.s. |
Примечание: ПМФ – первичный миелофиброз; DIPSS – Dynamic International Prognostic Scoring System, динамическая международная шкала оценки прогноза; JAK2 – Janus kinase 2, янус-киназа 2; CALR – сalreticulin, кальретикулин; n.s. – not significant, не значимо.
a р < 0,05 при сравнении с группой контроля.
b р < 0,05 при сравнении с группой 1.
Note: PMF – primary myelofibrosis; DIPSS – Dynamic International Prognostic Scoring System; JAK2 – Janus kinase 2; CALR – сalreticulin; n.s. – not significant.
aр < 0.05 when compared to the control group.
bр < 0.05 when compared to the group 1.
Выявлены статистически значимые различия в составе обследованных групп с ПМФ по количеству пациентов, принадлежащих к промежуточным 1 и 2 классу по шкале DIPSS+. В группе получавших руксолитиниб большая часть – 12 (75 %) пациентов – относилась к промежуточному классу риска 2; в группе 2 к этому классу отнесены только 2 (14 %). Обратная ситуация наблюдалась для промежуточного риска 1: к нему относилась половина пациентов – 7 (50 %) в группе 2 и только 2 (13 %) – в группе 1. Высокий и низкий риск по шкале DIPSS+ имели несколько пациентов в обеих группах без статистически значимых различий между ними.
Мутация JAK2V617F выявлялась наиболее часто в обеих группах с ПМФ (69–86%), у оставшихся пациентов выявлена мутация в гене CALR.
Венозные тромбозы в анамнезе встречались у 3 (19%) в группе 1 (у 2 – тромбоз глубоких вен нижних конечностей, 1 – тромбоэмболия легочной артерии) и у аналогичного числа пациентов в группе 2 (у всех – тромбоз глубоких вен нижних конечностей). Проявления геморрагического синдрома (желудочно-кишечные кровотечения) выявлены у 3 (19%) в группе 1 и у 3 (21%) пациентов в группе 2.
Уровень гемоглобина на фоне приема руксолитиниба был статистически значимо ниже, чем у пациентов без таргетной терапии. Количество лейкоцитов в группах пациентов с ПМФ не различалось.
Показатели системы гемостаза
Результаты исследования системы гемостаза представлены в таблице 2.
Таблица 2. Показатели системы гемостаза у пациентов с первичным миелофиброзом, получавших и не получавших руксолитиниб, и у лиц контрольной группы
Table 2. Hemostasis parameters in patients with primary myelofibrosis receiving and not receiving ruxolitinib and in the control group
|
Параметр / Parameter |
Контроль / Control (n = 30) |
Группа 1: ПМФ + руксолитиниб / Group 1: PMF + ruxolitinib (n = 16) |
Группа 2: ПМФ / Group 2: PMF (n = 14) |
Значение р / p value |
|
Тромбоциты, ×10⁹/л / Platelets, ×10⁹L |
250 (238,5; 265,0) |
146,5 (78,1; 196,1) a,b |
224,5 (153,4; 564,8) |
<0,001 |
|
Агрегация тромбоцитов / Platelets aggregation |
||||
|
АДФ 1 мкМ, % / ADP, 1 µM, % |
19,6 (16,5; 23,6) |
7,9 (5,1; 12,7)a |
6,8 (4,7; 10,6)a |
<0,05 |
|
АДФ 5 мкМ, % / ADP, 5 µM, % |
54,1 (47,6; 62,3) |
25,5 (17,1; 37,0) |
40,0 (18,0; 51,7)a |
n.s. |
|
Коллаген, % / Collagen, % |
53,3 (44,9; 70,1) |
2,2 (1,6; 5,7) a,b |
41,6 (3,4; 64,8)a |
<0,001 |
|
Ристомицин, % / Ristocetin, % |
73,7 (66,3; 80,0) |
57,4 (31,5; 75,1) |
75,4 (63,3; 82,6) |
n.s. |
|
АЧТВ, индекс / APTT, index |
1,01 (1,0; 1,07) |
1,05 (0,9; 1,1) |
1,09 (0,9; 1,4)a |
n.s. |
|
Протромбиновый тест по Квику, % / Prothrombin Quick’s test, % |
93,4 (91,2; 105,4) |
79,8 (70,2; 84,6)a |
81,2 (61,8; 88,2)a |
<0,05 |
|
Фибриноген, г/л / Fibrinogen, g/L |
2,7 (2,5; 2,9) |
3,5 (3,0; 4,4) |
2,9 (2,0; 5,3) |
n.s. |
|
Уровень (антиген) фактора Виллебранда, % / Willebrand factor (antigen), % |
107 (77,9; 144,0) |
201,5 (151,4; 216,1)a |
123,6 (77,9; 385,4) |
0,087 |
|
Активность фактора Виллебранда, % / Activity of Willebrand factor, % |
97 (84,8; 110,0) |
150,0 (122,5; 195,0)a |
88 (69,3; 332,4) |
< 0,00001 |
|
Фактор VIII, % / Factor VIII, % |
104 (85,0; 130,0) |
173,0 (148,5; 200,0)a |
135 (90,8; 155,3) |
< 0,00001 |
|
Антитромбин, % / Antithrombin, % |
94 (81,5; 105,5) |
104,0 (93,8; 115,5) |
102,5 (60,5; 127,1) |
n.s. |
|
Протеин С, % / Protein C, % |
102 (89,5; 114,3) |
94 (88,0; 102,5) |
80,0 (78,0; 91,0) |
n.s. |
|
Протеин S, % / Protein S, % |
102 (86,0; 109,0) |
70,0 (58,0; 86,6)a |
65,0 (43,6; 107,5)a |
< 0,001 |
|
Эндогенный потенциал тромбина, нмоль×мин / Endogenous thrombin potential, nM×min |
1642,3 (1489,9; 1777,0) |
1368,4 (1114,9; 1700,0)a |
1239,6 (1202,4; 1460,9)a |
< 0,001 |
|
Пик, максимальная концентрация тромбина, нмоль / Peak, maximal thrombin concentration, nM |
285,6 (265,5; 311,8) |
232,0 (157,7; 258,3)a |
227,3 (165,3; 254,5)a |
n.s. |
|
ЧТМЭПТ, % / Sensitivity to thrombomodulinETP, % |
52,9 (47,8; 57,7) |
17,8 (5,5; 30,3)a |
22,6 (12,3; 30,2)a |
< 0,001 |
|
ЧТМПик, % / Sensitivity to thrombomodulinPeak, % |
42,1 (36,2; 47,0) |
9,4 (2,5; 17,1)a |
8,5 (5,0; 17,6)a |
0,063 |
|
Индекс коагуляции / Coagulation index |
1,9 (1,6; 2,2) |
5,3 (3,0; 11,4)a |
3,2 (2,4; 7,3)a |
0,073 |
Примечание: ПМФ – первичный миелофиброз; АДФ – аденозиндифосфат; АЧТВ – активированное частичное тромбопластиновое время; ЧТМЭПТ – чувствительность к тромбомодулину, выраженная в процентах падения эндогенного потенциала тромбина; ЧТМПик – чувствительность к тромбомодулину, выраженная в процентах падения пика тромбина; n.s. – not significant, не значимо.
a р < 0,05 при сравнении с группой контроля.
b р < 0,05 при сравнении с группой 2.
Note: PMF – primary myelofibrosis; ADP – adenosine diphosphate ; APTT – activated partial thromboplastin time; ETP – endogenous thrombin potential; n.s. – not significant.
aр < 0.05 when compared to the control group.
bр < 0.05 when compared to the group 2.
Как видно из представленных данных, число тромбоцитов у пациентов с ПМФ, получавших руксолитиниб, было статистически значимо ниже, чем в группе без таргетной терапии и в контроле. Функциональная активность тромбоцитов при индукции аденозиндифосфатом 1 мкМ и коллагеном у пациентов обеих групп с ПМФ оказалась статистически значимо ниже, чем у лиц контрольной группы. При этом на фоне приема руксолитиниба функциональная активность тромбоцитов при индукции коллагеном была статистически ниже по сравнению с группой ПМФ, не получавших лечения.
Показатели рутинной коагулограммы АЧТВ и фибриноген не отличались в группах ПМФ от контроля, при этом наблюдалось статистически значимое снижение протромбинового теста по Квику (табл. 2)
В группе таргетной терапии по сравнению с контролем отмечены более высокие значения активности фактора Виллебранда и фактора VIII. Также выявлены значения р, близкие к уровню значимости для показателя антигена фактора Виллебранда с тенденцией к более высоким значениям в группе получавших руксолитиниб (р = 0,087).
При изучении естественных антикоагулянтов в обеих группах пациентов с ПМФ по сравнению с контролем выявлено статистически значимое снижение уровня свободного протеина S. Активность антитромбина и протеина С у лиц с ПМФ не имела различий с группой контроля, независимо от терапии.
Выполнение ТГТ дало возможность оценить суммарное действие про- и антикоагулянтов на общий гемостатический потенциал плазмы крови обследованных пациентов. Полученные результаты свидетельствуют о выраженных отклонениях (снижении) показателей ЭПТ и ЧТМЭПТ от группы контроля как у пациентов, не получающих руксолитиниб, так и на фоне таргетной терапии (табл. 2).
Индекс коагуляции у пациентов с ПМФ обнаружил значения р, близкие к уровню значимости (р = 0,073).
Изучение корреляционных связей показало наличие обратной корреляции средней силы между уровнем гемоглобина и индексом коагуляции в группе пациентов с ПМФ, получающих руксолитиниб (rs = -0,536; р = 0,039).
Между активностью протеина С и индексом коагуляции обнаружена обратная корреляционная зависимость высокой силы (rs = -0,781; р < 0,001) в группе получавших руксолитиниб и средней силы (rs = -0,615; р = 0,033) в группе без таргетной терапии.
У пациентов с ПМФ, не получающих руксолитиниб, прослеживается прямая корреляция средней-высокой силы между индексом коагуляции и активностью и содержанием фактора Виллебранда (rs = 0,781; р = 0,002 и rs = 0,824; р < 0,001), активностью фактора VIII (rs = 0,593; р = 0,033) и обратная корреляция с протромбином (rs = -0,604; р = 0,029). В группе пациентов, получавших руксолитиниб, статистически значимых корреляционных зависимостей между индексом коагуляции и перечисленными факторами не выявлено; отмечена слабая прямая связь с концентрацией фибриногена (rs = 0,469; р = 0,049).
ОБСУЖДЕНИЕ
В выполненном исследовании проведено сравнение показателей системы гемостаза пациентов с редким Ph-негативным миелопролиферативным новообразованием – ПМФ с контрольной группой. Несмотря на разницу по возрасту в этих группах, мы посчитали правомерным данное сравнение, поскольку влияние самого заболевания на показатели системы гемостаза было более выражено, чем возрастные отличия.
Разница в распределении обследуемых пациентов по группам риска по шкале DIPSS+ свидетельствует о различном клиническом статусе лиц, получавших таргетную терапию или не проходящих лечения на момент обследования, что и учитывалось при назначении терапии. Возникает вопрос о правомерности сравнения состояния плазменного звена гемостаза в данных группах пациентов. Учитывая, что усугубление воспалительного статуса ассоциируется с прокоагулянтной направленностью изменений гемостаза, было проведено сравнение обеих обследованных групп пациентов по уровню лейкоцитов, который является одним из основных показателей активности воспаления. Различий по этому параметру между группами пациентов с ПМФ не наблюдалось, что позволило провести сравнение состояния системы гемостаза. Несмотря на обнаруженную разницу по количеству пациентов, относящихся к промежуточной – 2-й группе риска, и учитывая известные данные о влиянии руксолитиниба на снижение количества тромбоцитов [5][10], мы посчитали возможным оценить не только количество тромбоцитов, но и их функциональную активность в обследованных группах.
Известно, что нарушения тромбоцитарного звена гемостаза оказывают существенное влияние на реализацию гемостаза и/или тромбоза. У обследованных пациентов с ПМФ на фоне лечения руксолитинибом обнаружены не только снижение количества тромбоцитов, но и выраженная несостоятельность их функциональной активности, что может быть причиной развития кровоточивости. Патологические изменения рецепторного аппарата тромбоцитов при Ph-негативных миелопролиферативных новообразованиях, отмеченные в ряде работ, способствуют нарушению их функциональной активности [11].
Оценка состояния плазменного звена гемостаза при ПМФ не обнаружила значимых различий между пациентами, проходящими лечение руксолитинибом и не получающими терапии. Об этом свидетельствуют как показатели коагулограммы, так и параметры интегрального ТГТ и индекса коагуляции.
В нашем исследовании активность и содержание фактора Виллебранда и активность фактора VIII у пациентов с ПМФ, получающих руксолитиниб, были значимо повышены по сравнению с контролем, что может указывать на наличие прокоагулянтной составляющей [12]. Однако, учитывая различный клинический статус пациентов, составляющих обследованные группы, не представляется возможным сделать однозначный вывод о влиянии таргетной терапии на показатели коагуляционного гемостаза. Возможно, воспалительный статус пациентов, получающих руксолитиниб, до назначения терапии значительно превышал таковой, определяемый на фоне лечения. В этом случае можно говорить о противовоспалительном действии таргетной терапии руксолитинибом, что было подчеркнуто рядом других авторов [13].
Необходимо отметить особенности состояния естественных антикоагулянтов у пациентов с ПМФ. Нормальная активность одного из основных антикоагулянтов – антитромбина – сохранялась в обеих группах. В то же время обнаружена выраженная несостоятельность системы протеина С, отмеченная у пациентов независимо от терапии, обусловленная низкими значениями уровня свободного протеина S. Можно предположить, что перечисленные изменения способствуют ограничению прокоагулянтной направленности гемостатического баланса у пациентов.
Результаты интегрального теста ТГТ обнаружили снижение ЭПТ у пациентов с ПМФ в обеих обследованных группах. В то же время недостаточная чувствительность к тромбомодулину указывает на наличие выраженного тромботического риска [14].
Полученные данные не выявили значимого влияния руксолитиниба на состояние плазменного звена гемостаза. С целью получения однозначных выводов о состоянии плазменного гемостаза у обследованных пациентов с ПМФ был определен индекс коагуляции, который оценивает отношение про- и антикоагулянтных влияний у конкретного пациента. Увеличение индекса коагуляции относительно нормальных значений свидетельствует о сдвиге гемостатического баланса в сторону гиперкоагуляции, снижение указывает на гипокоагуляционные изменения [15]. Высокие значения индекса коагуляции у обследованных пациентов обеих групп с ПМФ не имеют значимых различий между собой и указывают на преобладание прокоагулянтных влияний. Заметная степень обратной корреляционной связи между уровнем гемоглобина и индексом коагуляции на фоне приема руксолитиниба указывает на усугубление прокоагулянтной составляющей при развитии анемии.
К ограничениям исследования относятся малое количество пациентов в обследованных группах, значимая разница их распределения по шкале риска DIPPS+, несоответствие по возрасту пациентов и лиц контрольной группы. При проведении будущих исследований необходимо учитывать эти факторы.
ЗАКЛЮЧЕНИЕ
Прием руксолитиниба ассоциируется со снижением числа тромбоцитов и их качественной неполноценностью, изменения плазменного звена гемостаза характеризуются прокоагулянтной направленностью, что в целом способствует поддержанию общего гемостатического баланса. Выявление выраженных отклонений показателей, характеризующих состояние гемостаза у конкретного пациента, позволит своевременно оценивать риски сосудистых осложнений.
ВКЛАД АВТОРОВ
О.Г. Головина, Н.Н. Силина и Н.Е. Корсакова участвовали в разработке основной идеи исследования, формулировке цели и задач, сборе материала, лабораторной и клинической диагностике, статистической обработке, написании рукописи. О.Ю. Матвиенко осуществляла лабораторную и клиническую диагностику. Л.Р. Тарковская и Т.В. Морозова проводили лабораторную диагностику. Все авторы одобрили финальную версию статьи.
AUTHORS CONTRIBUTIONS
Olga G. Golovina, Natalia N. Silina and Natalia E. Korsakova developed the idea of the study, the goals and objectives, participated in the collection of material, laboratory and clinical diagnostics, statistical processing, writing the article. Olesya U. Matvienko conducted laboratory and clinical diagnostics. Lana R. Tarkovskaya and Tatyana V. Morozova conducted laboratory diagnostics. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено в соответствии с разрешением Локального этического комитета ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства» № 41-13.05.2021. Все пациенты, включенные в исследование, дали письменное информированное согласие на участие в работе.
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Благодарности. Авторы выражают искреннюю благодарность врачу-гематологу клинического отделения гематологии, химиотерапии и трансплантации костного мозга с блоком интенсивной терапии ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства» Ефремовой Елизавете Викторовне за помощь в подборе пациентов.
Ethics statements. The study was conducted in accordance with the permission of the Local Bioethics Committee of the Russian Research Institute of Hematology and Transfusiology No. 41, of 13.05.2021. Written informed consent was obtained from all patients included in the study.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Acknowledgments. The authors express their deep gratitude to Elizaveta Efremova, a hematologist at the Clinical Department of Hematology, Chemotherapy and Bone Marrow Transplantation with Intensive Care Unit of the Russian Research Institute of Hematology and Transfusiology, for her assistance in the selection of patients.
1. https://qxmd.com/calculate/calculator_315/dipss-plus-score-for-prognosis-in-myelofibrosis (дата обращения: 10.09.2024).
Список литературы
1. Mahmud M., Vasireddy S., Gowin K., Amaraneni A. Myeloproliferative neoplasms: contemporary review and molecular landscape. Int J Mol Sci. 2023 Dec 12; 24(24): 17383. https://doi.org/10.3390/ijms242417383. PMID: 38139212
2. Hernández-Boluda J.C., Pastor-Galán I., Arellano-Rodrigo E., et al.; Spanish MPN Group (GEMFIN). Predictors of thrombosis and bleeding in 1613 myelofibrosis patients from the Spanish registry of myelofibrosis. Br J Haematol. 2022 Nov; 199(4): 529–538. https://doi.org/10.1111/bjh.18440. Epub 2022 Sep 12. PMID: 36089912
3. Papageorgiou L., Elalamy I., Vandreden P., Gerotziafas G.T. Thrombotic and hemorrhagic issues associated with myeloproliferative neoplasms. Clin Appl Thromb Hemost. 2022 Jan-Dec; 28: 10760296221097969. https://doi.org/10.1177/10760296221097969. PMID: 35733370
4. Gangat N., Tefferi A. Myelofibrosis biology and contemporary management. Br J Haematol. 2020 Oct; 191(2): 152–170. https://doi.org/10.1111/bjh.16576. Epub 2020 Mar 20. PMID: 32196650
5. Verstovsek S., Mesa R.A., Livingston R.A., et al. Ten years of treatment with ruxolitinib for myelofibrosis: a review of safety. Journal of Hematology & Oncology. 2023; 16: 82. https://doi.org/10.1186/s13045-023-01471-z. PMID: 37501130
6. Ross D.M., Babon J.J., Tvorogov D., Thomas D. Persistence of myelofibrosis treated with ruxolitinib: biology and clinical implications. Haematologica. 2021 May 1; 106(5): 1244–1253. https://doi.org/10.3324/haematol.2020.262691. PMID: 33472356
7. Fisher D.A.C., Miner C.A., Engle E.K., et al. Cytokine production in myelofibrosis exhibits differential responsiveness to JAK-STAT, MAP kinase, and NFκB signaling. Leukemia. 2019 Aug; 33(8): 1978–1995. https://doi.org/10.1038/s41375-019-0379-y. Epub 2019 Feb 4. PMID: 30718771
8. Parampalli Yajnanarayana S., Stübig T., Cornez I., et al. JAK1/2 inhibition impairs T cell function in vitro and in patients with myeloproliferative neoplasms. Br J Haematol. 2015 Jun; 169(6): 824–833. https://doi.org/10.1111/bjh.13373. Epub 2015 Mar 30. PMID: 25824483
9. Passamonti F., Harrison C.N., Mesa R.A., et al. Anemia in myelofibrosis: Current and emerging treatment options. Crit Rev Oncol Hematol. 2022 Dec; 180: 103862. https://doi.org/10.1016/j.critrevonc.2022.103862. Epub 2022 Nov 1. PMID: 36332787
10. Виноградова О.Ю., Панкрашкина М.М., Шихбабаева Д.И. и др. Возможности таргетной терапии миелофиброза: опыт применения в Москве. Онкогематология. 2022; 17(4): 94–105. https://doi.org/10.17650/1818-8346-2022-17-4-94-105. EDN: SSBTCO
11. Ross D.M., Liang H.P.H., Iqra Z., et al. Platelets from patients with myeloproliferative neoplasms have increased numbers of mitochondria that are hypersensitive to depolarization by thrombin. Sci Rep. 2023 Jun 6; 13(1): 9172. https://doi.org/10.1038/s41598-023-36266-2. PMID: 37280424
12. van Paridon P.C.S., Panova-Noeva M., van Oerle R., et al. Relationships between coagulation factors and thrombin generation in a general population with arterial and venous disease background. Thromb J. 2022 Jun 8; 20(1): 32. https://doi.org/10.1186/s12959-022-00392-0. PMID: 35676710
13. Masciulli A., Ferrari A., Carobbio A., et al. Ruxolitinib for the prevention of thrombosis in polycythemia vera: a systematic review and meta-analysis. Blood Adv. 2020 Jan 28; 4(2): 380-386. https://doi.org/10.1182/bloodadvances.2019001158. PMID: 31985808
14. Силина Н.Н., Корсакова Н.Е., Головина О.Г. и др. Влияние проводимой терапии на состояние плазменного гемостаза у больных истинной полицитемией. MEDLINE.RU. 2020; 21: 75–86. URL: http://medline.ru/public/art/tom21/art7.html (дата публикации: 12.02.2020)
15. Матвиенко О.Ю., Головина О.Г., Кобилянская В.А. и др. Состояние системы гемостаза у пациентов, перенесших новую коронавирусную инфекцию. Эффективность антикоагулянтной профилактики. Бюллетень медицинской науки. 2022; 27(3): 30–36. https://doi.org/10.31684/25418475_2022_3_30. EDN: DUWJNC
Об авторах
О. Г. ГоловинаРоссия
Головина Ольга Георгиевна - канд. биол. наук, ведущий научный сотрудник научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
ул. 2-я Советская, д. 16, Санкт-Петербург, 191024
Н. Н. Силина
Россия
Силина Наталья Николаевна - канд. мед. наук, руководитель научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
улица 2-я Советская, д. 16, Санкт-Петербург, 191024
Н. Е. Корсакова
Россия
Корсакова Наталья Евгеньевна - канд. биол. наук, старший научный сотрудник научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
ул. 2-я Советская, д. 16, Санкт-Петербург, 191024
О. Ю. Матвиенко
Россия
Матвиенко Олеся Юрьевна - канд. мед. наук, ведущий научный сотрудник научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
ул. 2-я Советская, д. 16, Санкт-Петербург, 191024
Л. Р. Тарковская
Россия
Тарковская Лана Ростиславна - канд. биол. наук, старший научный сотрудник научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
ул. 2-я Советская, д. 16, Санкт-Петербург, 191024
Т. В. Морозова
Россия
Морозова Татьяна Владимировна - канд. мед. наук, научный сотрудник научно-исследовательского отдела патологии гемостаза ФГБУ «РосНИИГТ ФМБА России».
ул. 2-я Советская, д. 16, Санкт-Петербург, 191024
Дополнительные файлы

|
1. STROBE Statement—Checklist of items that should be included in reports of cohort studies | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(158KB)
|
Метаданные ▾ | |







































