Перейти к:
Экспрессия маркеров нейроглии в цингулярной и ретросплениальной коре больших полушарий головного мозга мышей при введении несептической дозы липополисахарида
https://doi.org/10.47093/2218-7332.2024.15.3.48-57
Аннотация
Цель. Изучить экспрессию глиального фибриллярного кислого белка (glial fibrillary acidic protein, GFAP) и ионизированной кальций-связывающей адаптерной молекулы 1 (ionized calcium-binding adapter molecule 1, Iba1) в нейроглии цингулярной и ретросплениальной коры больших полушарий головного мозга у мышей на 5-е сутки после внутрибрюшинного (в/б) введения бактериального липополисахарида (ЛПС) в дозе, не вызывающей воспаление нервной ткани.
Материалы и методы. Работа выполнена на 10 самках мышей линии C57BL6 возрастом 90 ± 3 суток, массой 28,0 ± 3,2 г. На протяжении 4 дней в одно и то же время животным группы 1 вводили в/б физиологический раствор (NaCl 0,9%), группы 2 – эндотоксин ЛПС E. coli в дозе 1 мг/кг/сутки. На пятые сутки мышей выводили из эксперимента путем декапитации после введения ксилазина и тилетамина/золазепама, после чего изготавливали гистологические препараты цингулярной и ретросплениальной коры, окрашивали антителами к GFAP и Iba1. При помощи программного обеспечения QuPath подсчитывали количество: (1) GFAP-положительных клеток, (2) участки Iba1-положительной цитоплазмы. Для сравнения групп использовали U-критерий Манна – Уитни.
Результаты. Количество GFAP-положительных клеток после введения ЛПС в группе 2 было статистически значимо больше, чем в группе 1, и составило 22,5 (8,0; 32,0) vs. 9,0 (4,3; 17,0), p = 0,0038. Количество Iba1-положительных участков цитоплазмы также было статистически значимо больше в группе 2: 207,5 (154,8; 295,8) vs. 128 (89,3; 165,5), p = 0,014. В обеих группах не выявлено признаков воспаления: повышенного кровенаполнения сосудов и кровоизлияний, периваскулярного отека или миграции лейкоцитов.
Заключение. Доза ЛПС 1 мг/кг/сутки, вводимая в/б мышам в течение 4 дней, позволяет оценить изменения в центральной нервной системе со стороны глии при повреждении, не сопровождающемся развитием воспалительной реакции: в цингулярной и ретросплениальной коре увеличивается количество астроцитов с положительной реакцией антител к GFAP, а также макрофагов с экспрессией белка Iba1.
Ключевые слова
Список сокращений:
- GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок
- Iba1 – ionized calcium-binding adapter molecule 1, ионизированная кальций-связывающая адаптерная молекула 1
- PBS – phosphate-buffered saline, фосфатно-солевой буферный раствор
- в/б – внутрибрюшинное
- ГЭБ – гематоэнцефалический барьер
- ИГХ – иммуногистохимическое
- ЛПС – липополисахарид
- ЦНС – центральная нервная система
Астроциты и клетки микроглии центральной нервной системы (ЦНС) в первую очередь подвергаются изменениям при воздействии проникающих через гематоэнцефалический барьер (ГЭБ) и повреждающих структуру нервной ткани химических соединений [1][2]. В то же время изменения в астроцитах и клетках микроглии характерны для нейродегенеративных расстройств [1], нарушений памяти и обучения [3], старения [4].
Воздействия различных инфекционных и неинфекционных агентов на нервную ткань, приводящие к изменениям в популяциях макро- и микроглии, позволяют моделировать повреждение ЦНС и изучать его особенности. Исследования в этой области актуальны в связи с ростом нейродегенеративных заболеваний ЦНС и их влиянием на эпидемиологические и социально-экономические показатели благополучия населения, что побуждает искать терапевтические подходы и модели их апробации [5][6].
Отмечено, что внутрибрюшинное (в/б) введение грызунам несептических доз бактериального липополисахарида (ЛПС) может быть использовано для оценки повреждения нейроглии [7]. После первого введения ЛПС астроциты и клетки микроглии реагируют выделением различных цитокинов, а спустя несколько суток в них становятся заметны структурные изменения. Это продемонстрировано при исследовании морфологии астроцитов и клеток микроглии в префронтальной коре больших полушарий головного мозга и гиппокампе после введения мышам высоких доз ЛПС однократно или невысоких доз ЛПС на протяжении нескольких дней [2].
В качестве направлений дальнейших исследований в ряде обзоров было предложено изучить изменения в астроцитах и микроглии при введении мышам несептических доз ЛПС в течение нескольких дней. Эти клетки цингулярной и ретросплениальной коры больших полушарий первыми затрагиваются при возрастных заболеваниях ЦНС, нарушениях памяти и аффекта [8][9].
Одним из ключевых маркеров для оценки состояния астроцитов является глиальный фибриллярный кислый белок (glial fibrillary acidic protein, GFAP). Он входит в состав промежуточных филаментов в астроцитах и обладает высокой специфичностью к ним. Количество GFAP в цитоплазме клеток глии увеличивается при повреждении нервной ткани и при старении [10]. Применение другого маркера, ионизированной кальций-связывающей адаптерной молекулы 1 (ionized calcium-binding adapter molecule 1, Iba1), позволяет выявить клетки микроглии в ЦНС [11]. Основная роль этого белка состоит в стабильном связывании нитей актина в пучки, поэтому его экспрессия в клетке нарастает при переходе микроглии из покоящегося состояния в активированное [12]. Следовательно, изменения экспрессии GFAP и Iba1 служат наиболее приемлемым показателем воздействия ЛПС на клетки астро- и микроглии [13].
Цель исследования: изучить экспрессию GFAP и Iba1 в нейроглии цингулярной и ретросплениальной коры больших полушарий головного мозга у мышей на 5-е сутки после в/б введения бактериального ЛПС в дозе, не вызывающей воспаление нервной ткани.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на самках мышей линии С57BL/6 (n = 10), полученных из филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий» ФМБА России. Возраст животных на начало эксперимента составлял 90 ± 3 суток, средняя масса 28,0 ± 3,2 г. Выбор пола грызунов обусловлен данными литературы о более стойкой экспрессии толл-подобного рецептора 4 в нейроглии у самок, тогда как именно он опосредует ЛПС-сигнализацию [14]. Возраст мышей удовлетворяет двум принципам: избежать связанной со старением перестройки нервной ткани и не допустить искажения, которое у более молодых особей возможно из-за незавершенного прунинга и образования синапсов. Минимальное количество животных для разработки модели отобрано согласно концепции 3R и стандартным правилам для дизайна экспериментов на грызунах [15].
Схема эксперимента
Мышей содержали в лабораторном виварии в условиях постоянной комнатной температуры 20–22 °C и относительной влажности 50–60% с доступом к чистой воде и гранулированному корму ad libitum. Перед экспериментом животные прошли двухнедельный карантин и осмотр ветеринарным врачом. После этого грызунов рандомизировали методом случайных чисел на две равные группы и с этого момента содержали мышей каждой группы в отдельной клетке.
Животным группы 1 (n = 5) вводили 0,1 мл физиологического раствора (NaCl 0,9%) в/б, а мышам группы 2 (n = 5) ЛПС 1 мг/кг E. coli O111:B4 (партия 091M4031V, Sigma-Aldrich, США), разведенного физиологическим раствором до 0,1 мл. По данным литературы, экспрессия GFAP и Iba1 нарастает после введения мышам ЛПС 0,5–2 мг/кг в/б [2][7]. На основе анализа этих методик для эксперимента выбрана усредненная доза ЛПС в 1 мг/кг. Инъекции выполняли в одно и то же время суток в течение последовательных 4 дней согласно общепринятой методике [16]. Выведение животных из эксперимента осуществляли путем декапитации с предварительным введением 5 мг/кг ксилазина гидрохлорида (Interchemie, Нидерланды) и 40 мг/кг тилетамина/золазепама (Vibrac, Франция) (рис. 1).
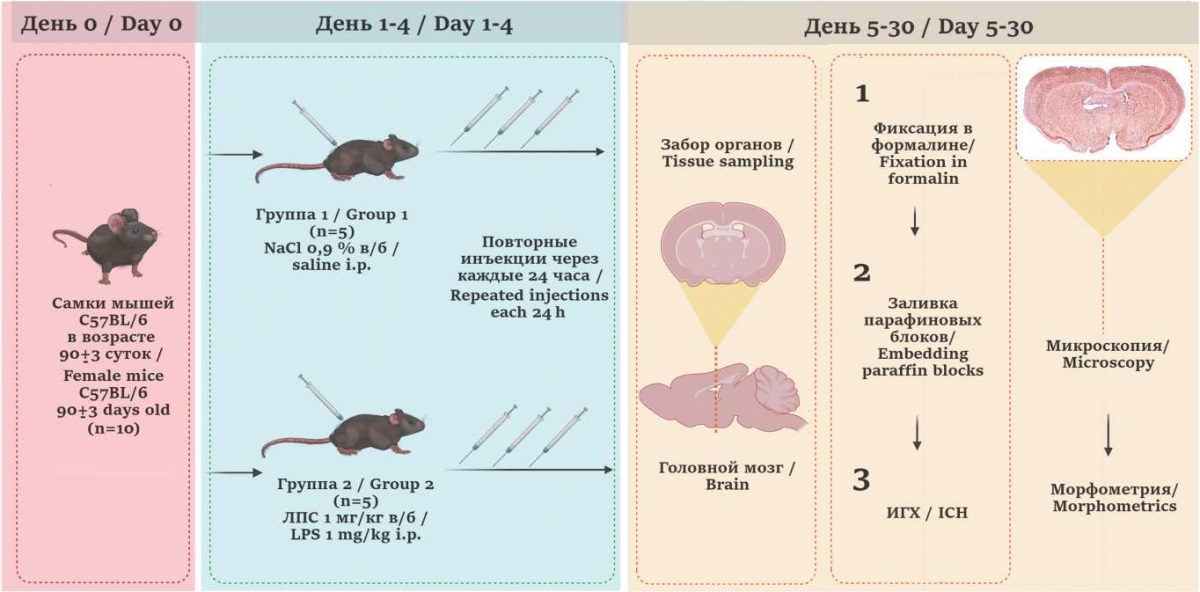
РИС. 1. Схема эксперимента.
Примечание: в/б – внутрибрюшинно; ЛПС – бактериальный липополисахарид; GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок; ИГХ – иммуногистохимическое исследование; Iba1 – ionized calcium-binding adapter molecule 1, ионизированная кальций-связывающая адаптерная молекула 1.
FIG. 1. Experimental design.
Note: i.p. – intraperitoneally; LPS – bacterial lipopolysaccharide; IHC – Immunohistochemistry; GFAP – glial fibrillary acidic protein; Iba1 – ionized calcium-binding adapter molecule 1.
Забор органов и тканей осуществляли по следующей методике. Ножницами разрезали кожу на уровне затылка и делали продольный разрез по направлению к носу. После отделения кожи рассекали череп поперечно на уровне носовой перегородки и далее продолжали разрезать затылочную и теменную кости так, чтобы ножницы не слишком глубоко проникали в носовую полость. Удалив череп, извлекали головной мозг. Фиксацию проводили в 10% нейтральном забуференном формалине (ООО «ЭргоПродакшн», Россия). После этого выполняли стандартную проводку через изопропиловый спирт возрастающей концентрации и заливку в парафиновые блоки. На ручном ротационном микротоме HM 325 (Thermo Fisher Scientific, США) изготавливали фронтальные срезы головного мозга толщиной 5 мкм, переносили на предметные стекла с адгезивным покрытием силан (ООО «Минимед», Россия) и подсушивали в термостате при температуре 37 °C в течение 25 суток.
Иммуногистохимическое исследование
Перед окрашиванием срезы головного мозга выдерживали в депарафинизирующем и демаскировочном фосфатном растворе (партия XF05RT4N9592) (Elabscience, США), разведенном дистиллированной водой 1:20, с нагревом в течение 20 мин. После этого промывали каждый срез фосфатно-солевым буферным раствором (phosphate-buffered saline, PBS) (ООО «ЭКО-СЕРВИС», Россия) трижды по 2 мин и во избежание собственной пероксидазной активности тканей инкубировали с 3% перекисью водорода в течение 20 мин. Далее, после вторичной промывки PBS трижды по 2 мин, наносили на срезы бычий сывороточный альбумин на 20 мин. После удаления альбумина препараты инкубировали с первичными моноклональными антителами к GFAP1 в разведении 1:500 и поликлональными антителами к Iba12 в разведении 1:200. Сразу же после этого каждый срез промывали PBS трижды по 2 мин и наносили вторичные поликлональные антитела кролика с пероксидазой хрена3, за чем следовала получасовая инкубация и промывка PBS раствором. В качестве хромогена использовали 3,3’-диаминобензидин (CDH, Индия), излишки которого смывали дистиллированной водой и докрашивали препараты гематоксилином Карацци (ГК «Биовитрум», Россия) с заключением в монтирующую среду.
Гистологическое исследование и морфометрия
Морфологические изменения изучали при помощи микроскопа Axio Imager.A1 с камерой Axiocam 305 color и программного обеспечения Zen 3.3 (все – производство Zeiss, Германия). Гистологическую оценку нормальной цито- и миелоархитектоники проводили на серийных срезах изокортекса. На микрофотографиях больших полушарий определяли зоны цингулярной и ретросплениальной коры при помощи стереотаксического атласа G. Paxinos и K.B.J. Franklin [17]: для подсчета были отобраны 12 корональных срезов между уровнями брегмы -0,2 и -0,3 на каждую группу. Для подсчета макрофагов снимки, полученные при увеличении объектива ×40 и фотографировании камерой Axiocam 305 color, обрабатывали с помощью программного обеспечения с открытым кодом QuPath 0.5.0 (Queen’s University Belfast, Великобритания)4 [18] в режиме обнаружения 3,3’-диаминобензидин положительных структур в одном поле зрения.
Проведенное иммуногистохимическое (ИГХ) исследование показало неравномерное распределение белка Iba1 по цитоплазме клеток – обнаружены клетки как с множеством зон с Iba1-положительным окрашиванием, так и с единичными структурами. Поэтому в качестве показателя активации клеток микроглии интерпретировали участки Iba1-положительной цитоплазмы, а не сами клетки.
Маркер GFAP, напротив, распределялся в цитоплазме клеток равномерно, поэтому для количественной оценки его экспрессии учитывали число окрашенных клеток. Подсчет количества GFAP-положительных клеток производили в программном обеспечении Zen 3.3 по снимкам, сделанным при увеличении объектива ×10 и фотографировании камерой Axiocam 305 color, в одном поле зрения.
Несмотря на то что олигодендроциты также относятся к нейроглии, их оценка в рамках настоящей работы представляется нецелесообразной. Поскольку олигодендроциты не входят в состав ГЭБ, изменения их морфологии при воздействии несептических доз ЛПС маловероятны. Реакция олигодендроцитов показана у новорожденных животных при в/б введении ЛПС 1 мг/кг массы тела [19], а также у животных при прямом стереотаксическом введении ЛПС в структуры головного мозга [20] и при моделировании острого нарушения мозгового кровообращения [21].
Статистический анализ
Значения представлены в виде медианы и межквартильного размаха (25-й; 75-й процентили). Для межгруппового сравнения использовали U-критерий Манна – Уитни. Уровень статистической значимости в эксперименте принят как p < 0,05. Статистическую обработку данных выполняли при помощи программного обеспечения Microsoft Excel (Microsoft, США) и OriginPro (OriginLab, США).
РЕЗУЛЬТАТЫ
При гистологическом исследовании срезов головного мозга у мышей обеих групп не выявлено повышенного кровенаполнения сосудов и кровоизлияний. Также ни в одной структуре головного мозга не отмечено периваскулярного отека или миграции лейкоцитов. ИГХ исследование выявило положительную реакцию на антитела к белкам GFAP и Iba1 на срезах коры больших полушарий головного мозга в обеих группах. Экспрессия маркеров GFAP и Iba1 показана на рисунке 2.
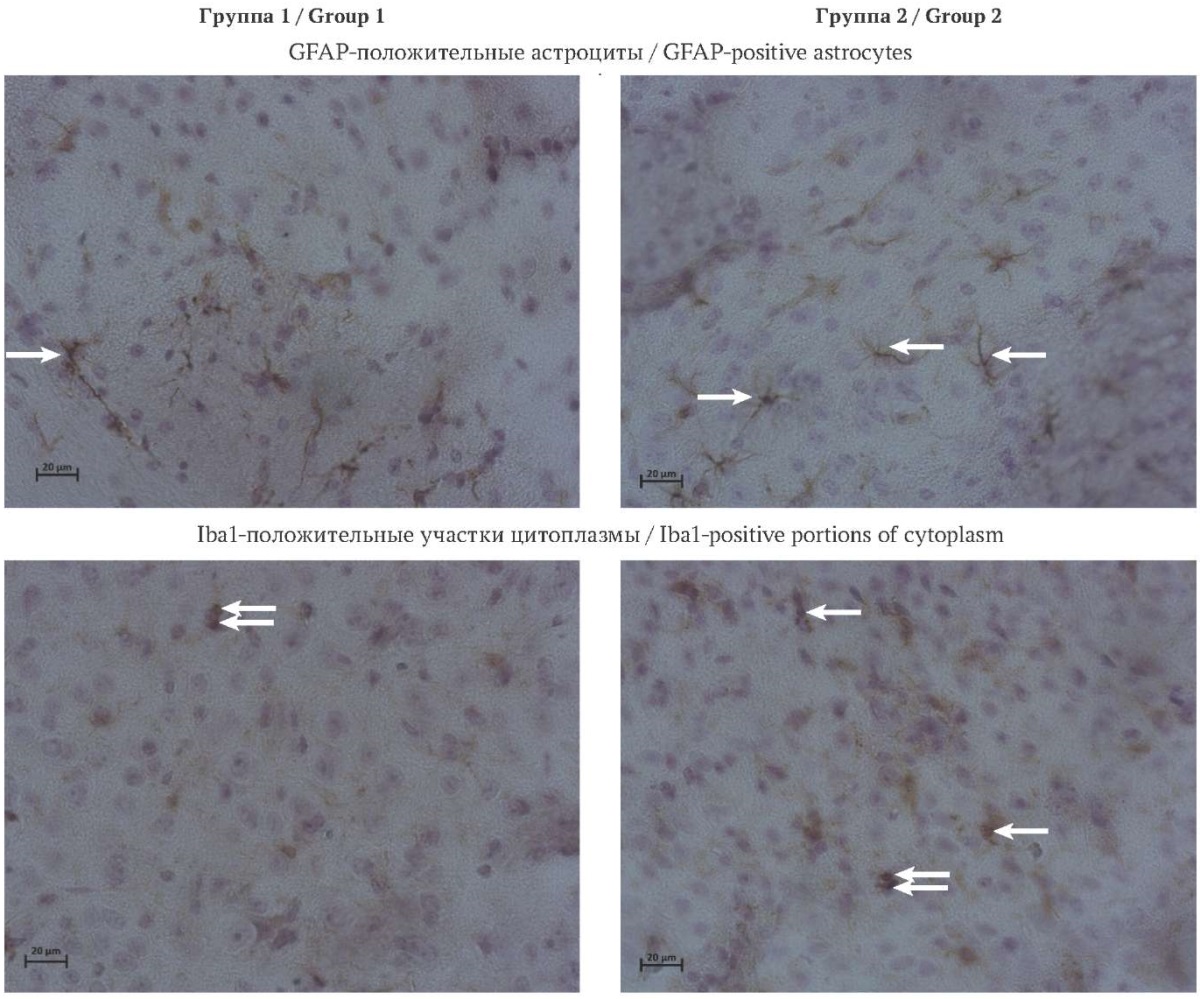
РИС. 2. Гистологические препараты цингулярной и ретросплениальной коры больших полушарий головного мозга мышей на пятые сутки эксперимента. Корональные срезы, d = 5 мкм. Окраска 3,3’-диаминобензидином и гематоксилином Карацци, об.×40.
Примечание: стрелками указаны клетки или участки их цитоплазмы с положительной реакцией антител к GFAP или Iba1, двойными стрелками указаны клетки с несколькими зонами Iba1-положительного окрашивания.
GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок; Iba1 – ionized calcium-binding adapter molecule 1, ионизированная кальций-связывающая адаптерная молекула 1.
FIG. 2. Histological slides of cerebral cingulate and retrosplenial cortex of mice on Day 5 of the experiment. Coronal sections, d = 5 μm. 3,3’-diaminobenzidine and Carazzi hematoxylin staining, ob.×40.
Note: arrows mark cells or portions of their cytoplasm with positive reaction of antibodies to GFAP or Iba1, double arrows mark cells with multiple Iba1-positive areas.
GFAP – glial fibrillary acidic protein; Iba1 – ionized calcium-binding adapter molecule 1.
При подсчете количества клеток, экспрессирующих GFAP, в группе 1 выявлено 9,0 (4,3; 17,0), в группе 2 – 22,5 (8,0; 32,0). Различие между медианными значениями статистически значимо с величиной p = 0,0038 (рис. 3А).
Анализ участков цитоплазмы, экспрессирующих Iba1, выявил 128 (89,3; 165,5) Iba1-положительных участков цитоплазмы в поле зрения в группе 1 и 207,5 (154,8; 295,8) в группе 2 (рис. 3B). Различия между медианными значениями статистически значимы (p = 0,014).
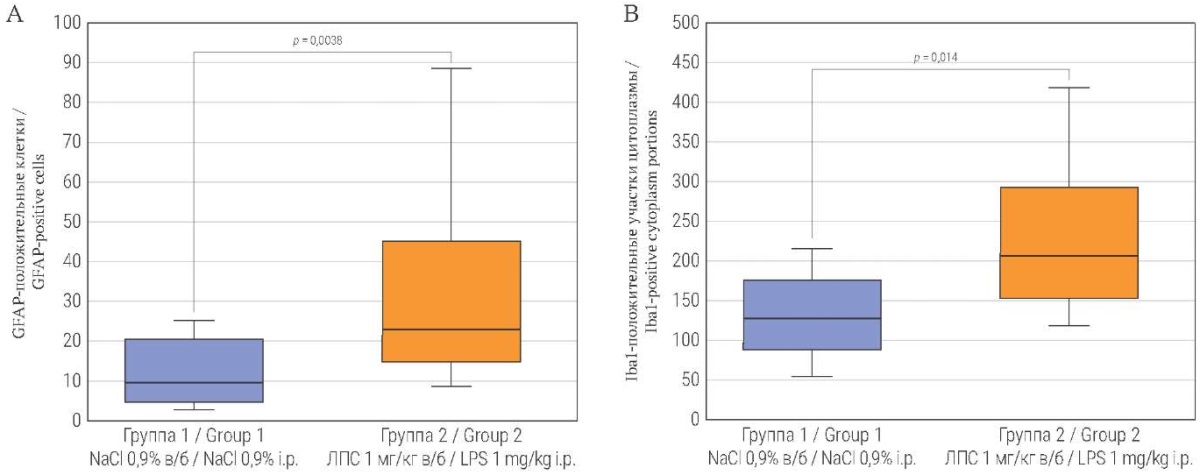
РИС. 3. Количество GFAP-положительных клеток (A) и Iba1-положительных участков цитоплазмы (B) в цингулярной и ретросплениальной коре больших полушарий головного мозга у мышей на пятые сутки эксперимента.
Примечание: GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок; Iba1 – ionized calcium-binding adapter molecule 1, ионизированная кальций-связывающая адаптерная молекула 1; ЛПС – бактериальный липополисахарид; в/б – внутрибрюшинный.
FIG. 3. The number of GFAP-positive cells (A) and the number of Iba1-positive cytoplasm areas (B) in the cingulate and retrosplenial cerebral cortex in mice on Day 5 of the experiment.
Note: GFAP – glial fibrillary acidic protein; Iba1 – ionized calcium-binding adapter molecule 1; LPS – bacterial lipopolysaccharide; i.p. – intraperitoneally.
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о статистически значимом повышении экспрессии GFAP и Iba1 в цингулярной и ретросплениальной коре больших полушарий головного мозга у мышей после введения ЛПС 1 мг/кг/сутки в течение 4 дней.
Известно, что белок GFAP характерен для промежуточных филаментов в астроцитах [22], хотя его можно выявить не только в астроглии [23]. При гистологическом исследовании в описанном эксперименте увеличение экспрессии GFAP наблюдалось именно в астроцитах мышей экспериментальной группы.
Белок Iba1 характерен для популяций реактивных макрофагов, в том числе и в нейроглии [24]. Кроме того, Iba1 является маркером не только клеток микроглии, но и клеток моноцитарно-макрофагального звена [24][25]. Это обеспечивает широкий спектр применения Iba1, но не позволяет отличить клетки микроглии от макрофагов, если последние проникнут через ГЭБ при воспалительной инфильтрации. В то же время выбранные для эксперимента дозы ЛПС не привели к появлению признаков воспалительной инфильтрации или иных патологических изменений, видимых при световой микроскопии.
Эти данные согласуются с литературными источниками. Так, при режиме введения ЛПС мышам в дозе 2 мг/кг/сутки в/б в течение 3 суток, выбранном для моделирования нарушений аффекта и поведения, происходила активация как астроцитов, так и макрофагов [1]. Аналогичные морфологические изменения отмечены при в/б введении мышам ЛПС 0,25 мг/кг 7 раз в течение двух недель, что сопровождалось развитием повреждения нервной ткани, с помощью которого моделировали нейродегенеративные процессы [26]. Более высокие дозы ЛПС приводят к увеличению экспрессии Iba1 в клетках микроглии уже через несколько часов [27], поскольку ведут к нарушению целостности и проницаемости ГЭБ для большого количества популяций лейкоцитов [28–30].
Результаты проведенного исследования демонстрируют, что воздействие бактериального агента, приводящее к активации нейроглии, доступно количественной оценке по экспрессии ИГХ маркеров. В первые часы после введения ЛПС уровень Iba1 может не изменяться, а уровень GFAP реагирует и восстанавливается быстрее, чем уровень Iba1 [31].
Новизна настоящего исследования состоит в том, что режим введения ЛПС в течение 4 суток показан как эффективный с точки зрения одновременного изучения экспрессии GFAP и Iba1 в клетках нейроглии.
Следует подчеркнуть, что клетки, экспрессирующие GFAP, производят разное количество белков цитоскелета при различных повреждениях [18]. Другими словами, экспрессия GFAP является показателем активации астроцитов при воздействии типовым внешним сигналом повреждения, каковым является ЛПС. Именно такие сигналы в большей степени моделируют возрастные изменения при взаимодействии нейроглии и микробиоты толстой кишки, где E. coli составляет значительную долю бактерий [32].
В последнее время появляются сведения о положительной экспрессии маркера GFAP нейронами в ходе структурных изменений в нервной ткани при травматическом повреждении [33]. В сером веществе коры больших полушарий экспрессия GFAP наступает позже, чем в белом веществе, и в большей степени отражает усиление механической, опорной функции цитоскелета в астроцитах для укрепления ГЭБ [34].
Следует отметить, что введение ЛПС в некоторых случаях сопровождается морфологическими изменениями в нервной ткани головного мозга, например снижением количества клеток, которые могут быть определены при рутинных методах окрашивания (по Нисслю) [35]. Однако увеличение экспрессии ИГХ маркеров GFAP и Iba1 в нервной ткани является более специфичной оценкой.
Ограничения исследования
Размер выборки в эксперименте был ограничен этической целесообразностью и концепцией 3R. Тем не менее полученные данные статистически значимы. Экстраполяция результатов эксперимента, выполненного на мышах, ограниченно возможна на человека.
Направления для дальнейших исследований
Структурные изменения в нервной ткани при введении ЛПС могут развиваться в результате воздействия цитокинов, приводящего к изменению в жизненном цикле клеток нейроглии. Представляется перспективным изучение молекулярных каскадов и изменений в популяции нейронов при аналогичных дозе и способе введения ЛПС у мышей, а также реакции нейроглии и нейронов при воздействии других доз, режимах и способах введения ЛПС.
ЗАКЛЮЧЕНИЕ
Введение в/б несептической дозы ЛПС в течение 4 суток приводит к астроцитарной и микроглиальной активации: увеличивается количество астроцитов с повышенным содержанием промежуточных филаментов (GFAP-положительных клеток), а также экспрессия маркеров макрофагов (Iba1) в цингулярной и ретросплениальной коре больших полушарий головного мозга. Изученная доза позволяет оценить изменения в ЦНС со стороны глии при повреждении, не сопровождающемся развитием воспалительной реакции.
ВКЛАД АВТОРОВ
А.А. Венедиктов, Г.А. Пьявченко и С.Л. Кузнецов сформулировали идею и разработали дизайн исследования. А.А. Венедиктов, Д.М. Оганесян и В.В. Голоборщева изучили литературные источники, провели эксперименты с животными и изготовили гистологические препараты. А.А. Венедиктов выполнил статистическую обработку результатов. А.А. Венедиктов, В.В. Голоборщева, Г.А. Пьявченко и С.Л. Кузнецов написали текст статьи. А.А. Венедиктов и К.С. Покидова оформили иллюстрации. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTION
Artem A. Venediktov, Gennadii A. Piavchenko, and Sergey L. Kuznetsov developed the idea and design of the study. Artem A. Venediktov, David M. Oganesyan, and Valeria V. Goloborshcheva studied the literature sources, carried out the experiments with animals and made the histological slides. Artem A. Venediktov carried statistical calculations for the results. Artem A. Venediktov, Valeria V. Goloborshcheva, Gennadii A. Piavchenko and Sergey L. Kuznetsov wrote the text of the article. Artem A. Venediktov and Ksenia S. Pokidova designed graphic elements of the work. All authors approved the final version of the article.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (№ 01-22 от 20.01.2022).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. All manipulations with animals were approved by the Local Bioethics Committee of the Sechenov First Moscow State Medical University (Sechenov University), No. 01-22 of 20.01.2022.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request.
Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare no conflict of interest.
Financing. The study was not sponsored (own resources).
1. Артикул ET1601-23, партия HO0913, Huabio, США. https://huabioresearch.com/datasheet/ET1601-23 (дата обращения: 11.07.2024).
2. Артикул ER1802-20, партия HL0213, Huabio, США. https://huabioresearch.com/datasheet/ER1802-20 (дата обращения: 11.07.2024).
3. Артикул HA1119, партия M05-22-P2, Huabio, США. https://huabioresearch.com/datasheet/HA1119 (дата обращения: 11.07.2024).
4. QuPath Open Software for Bioimage Analysis. https://qupath.github.io (дата обращения 07.10.2024).
Список литературы
1. Li W., Ali T., He K., et al. Ibrutinib alleviates LPS-induced neuroinflammation and synaptic defects in a mouse model of depression. Brain Behav Immun. 2021 Feb; 92: 10–24. https://doi.org/10.1016/j.bbi.2020.11.008. Epub 2020 Nov 10. PMID: 33181270
2. Norden D.M., Trojanowski P.J., Villanueva E., et al. Sequential activation of microglia and astrocyte cytokine expression precedes increased Iba-1 or GFAP immunoreactivity following systemic immune challenge. Glia. 2016 Feb; 64(2): 300–316. https://doi.org/10.1002/glia.22930. Epub 2015 Oct 15. PMID: 26470014
3. Sekio M., Seki K. Lipopolysaccharide-induced depressive-like behavior is associated with α₁-adrenoceptor dependent downregulation of the membrane GluR1 subunit in the mouse medial prefrontal cortex and ventral tegmental area. Int J Neuropsychopharmacol. 2014 Oct 31; 18(1): pyu005. https://doi.org/10.1093/ijnp/pyu005. Erratum in: Int J Neuropsychopharmacol. 2016 Apr 27; 19(10): pyw031. https://doi.org/10.1093/ijnp/pyw031. PMID: 25539502
4. Allen W.E., Blosser T.R., Sullivan Z.A., et al. Molecular and spatial signatures of mouse brain aging at single-cell resolution. Cell. 2023 Jan 5; 186(1): 194–208.e18. https://doi.org/10.1016/j.cell.2022.12.010. Epub 2022 Dec 28. PMID: 36580914.
5. Пьявченко Г.А., Венедиктов А.А., Кузьмин Е.А. и др. Морфофункциональные изменения у мышей после однократного введения высоких и низких доз Hsp70. Сеченовский вестник. 2023. 14(4): 31–41. https://doi.org/10.47093/2218-7332.2023.918.13. Публикация онлайн 29.11.2023. EDN: WALXAM
6. Venediktov A.A., Bushueva O.Y., Kudryavtseva V.A., et al. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front Mol Neurosci. 2023 Sep 19; 16: 1230436. https://doi.org/10.3389/fnmol.2023.1230436. PMID: 37795273
7. Catorce M.N., Gevorkian G. LPS-induced murine neuroinflammation model: main features and suitability for pre-clinical assessment of nutraceuticals. Curr Neuropharmacol. 2016; 14(2), 155–164. https://doi.org/10.2174/1570159x14666151204122017. PMID: 26639457
8. Rolls E.T. The cingulate cortex and limbic systems for emotion, action, and memory. Brain Struct Funct. 2019 Dec; 224(9): 3001–3018. https://doi.org/10.1007/s00429-019-01945-2. Epub 2019 Aug 26. PMID: 31451898
9. Balcerek E., Włodkowska U., Czajkowski R. Retrosplenial cortex in spatial memory: focus on immediate early genes mapping. Mol Brain. 2021 Dec 4; 14(1): 172. https://doi.org/10.1186/s13041-021-00880-w. PMID: 34863215
10. Middeldorp J., Hol E.M. GFAP in health and disease. Progress in neurobiology. 2011; 93(3): 421–443. https://doi.org/10.1016/j.pneurobio.2011.01.005
11. Kierdorf K., Prinz M. Factors regulating microglia activation. Frontiers in cellular neuroscience. 2013; 7: 44. https://doi.org/10.3389/fncel.2013.00044
12. Ohsawa K., Imai Y., Sasaki Y., Kohsaka S. Microglia/macrophage-specific protein Iba1 binds to fimbrin and enhances its actin-bundling activity. Journal of neurochemistry. 2004; 88(4): 844–856. https://doi.org/10.1046/j.1471-4159.2003.02213.x
13. Huang H., He W., Tang T., et al. Immunological markers for central nervous system glia. Neurosci Bull. 2023 Mar; 39(3): 379–392. https://doi.org/10.1007/s12264-022-00938-2. Epub 2022 Aug 26. PMID: 360286412023
14. Balu D., Valencia-Olvera A.C., Nguyen A., et al. A small-molecule TLR4 antagonist reduced neuroinflammation in female E4FAD mice. Alzheimers Res Ther. 2023 Oct 19; 15(1): 181. https://doi.org/10.1186/s13195-023-01330-6. PMID: 37858252
15. Festing M.F.W., Altman D.G. Guidelines for the design and statistical analysis of experiments using laboratory animals. ILAR J. 2002; 43(4): 244–258. https://doi.org/10.1093/ilar.43.4.244. Erratum in: ILAR J. 2005; 46(3): 320. PMID: 12391400
16. Harland M., Torres S., Liu J., et al. Neuronal mitochondria modulation of LPS-induced neuroinflammation. J Neurosci. 2020 Feb 19; 40(8): 1756–1765. https://doi.org/10.1523/JNEUROSCI.2324-19.2020. Epub 2020 Jan 14. PMID: 31937559
17. Paxinos G., Franklin K.B.J. The Mouse Brain in Stereotaxic Coordinates. 5th Edition. Academic Press. 2019. 376p. eBook ISBN: 9780128161586
18. Bankhead P., Loughrey M.B., Fernández J.A., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 2017 Dec 4; 7(1): 16878. https://doi.org/10.1038/s41598-017-17204-5. PMID: 29203879
19. Huang P., Zhou Q., Lin Q., et al. Complement C3a induces axonal hypomyelination in the periventricular white matter through activation of WNT/β-catenin signal pathway in septic neonatal rats experimentally induced by lipopolysaccharide. Brain Pathol. 2020 May; 30(3): 495–514. https://doi.org/10.1111/bpa.12798. Epub 2019 Nov 6. PMID: 31622511
20. Yao S.Y., Ljunggren-Rose A., Chandramohan N., et al. In vitro and in vivo induction and activation of nNOS by LPS in oligodendrocytes. Journal of Neuroimmunology. 2010; 229(1-2): 146–156. https://doi.org/10.1016/j.jneuroim.2010.07.023
21. Cammarota M., Boscia F. Contribution of oligodendrocytes, microglia, and astrocytes to myelin debris uptake in an explant model of inflammatory demyelination in rats. Cells. 2023 Sep 3; 12(17): 2203. https://doi.org/10.3390/cells12172203. PMID: 37681935
22. Romero-Sandoval A., Chai N., Nutile-McMenemy N., Deleo J.A. A comparison of spinal Iba1 and GFAP expression in rodent models of acute and chronic pain. Brain research. 2008; 1219: 116–126. https://doi.org/10.1016/j.brainres.2008.05.004
23. Oberheim N.A., Goldman S.A., Nedergaard M. Heterogeneity of astrocytic form and function. Methods Mol Biol. 2012; 814: 23–45. https://doi.org/10.1007/978-1-61779-452-0_3. PMID: 2214429
24. Woodburn S.C., Bollinger J.L., Wohleb E.S. The semantics of microglia activation: neuroinflammation, homeostasis, and stress. J Neuroinflammation. 2021 Nov 6; 18(1): 258. https://doi.org/10.1186/s12974-021-02309-6. PMID: 34742308
25. Zhang X., Wang L.P., Ziober A., et al. Ionized Calcium Binding Adaptor Molecule 1 (IBA1). Am J Clin Pathol. 2021 Jun 17; 156(1): 86–99. https://doi.org/10.1093/ajcp/aqaa209. PMID: 33582751
26. Muhammad T., Ikram M., Ullah R., et al. Hesperetin, a citrus flavonoid, attenuates LPS-induced neuroinflammation, apoptosis and memory impairments by modulating TLR4/NF-κB signaling. Nutrients. 2019 Mar 17; 11(3): 648. https://doi.org/10.3390/nu11030648. PMID: 30884890
27. Arioz B.I., Tastan B., Tarakcioglu E., et al. Melatonin attenuates LPS-induced acute depressive-like behaviors and microglial NLRP3 inflammasome activation through the SIRT1/Nrf2 pathway. Front Immunol. 2019 Jul 2; 10: 1511. https://doi.org/10.3389/fimmu.2019.01511. PMID: 31327964
28. Dumbuya J.S., Chen X., Du J., et al. Hydrogen-rich saline regulates NLRP3 inflammasome activation in sepsis-associated encephalopathy rat model. Int Immunopharmacol. 2023 Oct; 123: 110758. https://doi.org/10.1016/j.intimp.2023.110758; Epub 2023 Aug 8. PMID: 37556997
29. Park J.H., Hwang J.W., Lee H.J., et al. Lomerizine inhibits LPS-mediated neuroinflammation and tau hyperphosphorylation by modulating NLRP3, DYRK1A, and GSK3α/β. Front Immunol. 2023 Jun 26; 14: 1150940. https://doi.org/10.3389/fimmu.2023.1150940. PMID: 37435081
30. Xingi E., Koutsoudaki P.N., Thanou I., et al. LPS-induced systemic inflammation affects the dynamic interactions of astrocytes and microglia with the vasculature of the mouse brain cortex. Cells. 2023 May 17; 12(10): 1418. https://doi.org/10.3390/cells12101418. PMID: 374082522023
31. Anderson M.A., Ao Y., Sofroniev M.V. Heterogeneity of reactive astrocytes. Neuroscience letters. 2014; 565: 23–29. https://doi.org/10.1016/j.neulet.2013.12.030
32. Mayer E.A., Nance K., Chen S. The gut-brain axis. Annu Rev Med. 2022 Jan 27; 73: 439–453. https://doi.org/10.1146/annurev-med-042320-014032. Epub 2021 Oct 20. PMID: 34669432022
33. Zwirner J., Lier J., Franke H., et al. GFAP positivity in neurons following traumatic brain injuries. Int J Legal Med. 2021 Nov; 135(6): 2323–2333. https://doi.org/10.1007/s00414-021-02568-1. Epub 2021 Jun 11. PMID: 34114049
34. Jurga A.M., Paleczna M., Kadluczka J., et al. Beyond the GFAP-astrocyte protein markers in the brain. Biomolecules. 2021 Sep 14; 11(9): 1361. https://doi.org/10.3390/biom11091361. PMID: 345725722021
35. Weng J., Wang Y., Tan Z., et al. Glabridin reduces neuroinflammation by modulating inflammatory signals in LPS-induced in vitro and in vivo models. Inflammopharmacology. 2024 Apr; 32(2): 1159–1169. https://doi.org/10.1007/s10787-023-01424-5. Epub 2024 Feb 19. PMID: 38372849
Об авторах
А. А. ВенедиктовРоссия
Венедиктов Артем Андреевич - аспирант, ассистент кафедры анатомии и гистологии человека ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
К. С. Покидова
Россия
Покидова Ксения Сергеевна - студентка ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
Д. М. Оганесян
Россия
Оганесян Давид Михайлович - студент ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
В. В. Голоборщева
Россия
Голоборщева Валерия Владимировна - канд. мед. наук, младший научный сотрудник лаборатории общей патологии нервной системы ФГБНУ «НИИОПП».
ул. Балтийская, д. 8, Москва, 125315
Г. А. Пьявченко
Россия
Пьявченко Геннадий Александрович - канд. мед. наук, доцент кафедры анатомии и гистологии человека ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
С. Л. Кузнецов
Россия
Кузнецов Сергей Львович - член-корр. РАН, д-р мед. наук, профессор кафедры анатомии и гистологии человека ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
ул. Трубецкая, д. 8, стр. 2, Москва, 119048
Дополнительные файлы

|
1. The ARRIVE guidelines 2.0: author checklist | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(136KB)
|
Метаданные ▾ | |
Рецензия
JATS XML







































