Перейти к:
Превентивная декомпрессивная краниоэктомия при разрыве церебральной аневризмы в первом триместре беременности: успешный исход для матери и плода
https://doi.org/10.47093/2218-7332.2024.15.4.32-42
Аннотация
Одним из путей улучшения функциональных исходов у пациентов с разорвавшимися церебральными аневризмами является превентивная декомпрессивная краниоэктомия (ДК). Такая тактика не исследована при беременности.
Описание случая. Пациентка 34 лет, находящаяся на 10-й неделе беременности, госпитализирована по поводу острой головной боли. По данным методов визуализации диагностирован разрыв аневризмы правой внутренней сонной артерии (ВСА), субарахноидально-паренхиматозно-субдуральное кровоизлияние, выраженный распространенный артериоспазм. Согласие на оперативное лечение с условием пролонгации беременности получено только на 4-е сутки заболевания на фоне нарастания объема субдуральной гематомы и смещения срединных структур. Выполнена ДК, клипирование аневризмы. Течение послеоперационного периода благоприятное. На 40-й неделе беременности проведено родоразрешение кесаревым сечением, ребенок здоров. В последующем выполнена краниопластика дефекта костей черепа.
Обсуждение. Представлен первый случай успешного лечения пациентки с разрывом аневризмы ВСА в первом триместре беременности с использованием ДК. Лечение беременных с разрывами церебральных аневризм в первом триместре беременности представляет значительные сложности в медицинском, морально-этическом и правовом отношении. Мультидисциплинарный подход, взвешенная оценка тяжести течения заболевания и беременности, индивидуальных рисков оперативного вмешательства и потенциальных осложнений, объема выполняемых диагностических процедур и мероприятий интенсивной терапии дают возможность сохранить жизнь и здоровье матери и плода.
Ключевые слова
В настоящее время стратегия раннего лечения разорвавшихся церебральных аневризм является доминирующей, так как максимально быстрое выключение аневризм из кровообращения, независимо от тяжести состояния и возраста пациента, снижает летальность от повторных кровотечений [1–3]. Вместе с тем при выполнении операций вне оптимального хирургического окна – с 4-х по 14-е сутки после субарахноидального кровоизлияния (САК) – улучшения результатов не отмечается [2–4]. Поэтому поиск путей улучшения функциональных исходов пациентов, оперируемых на фоне развивающегося артериоспазма и ишемии мозга, остается актуальной проблемой. Применение у пациентов с осложненным течением аневризматической болезни головного мозга превентивной хирургической декомпрессивной краниоэктомии (ДК) является одним из вариантов эффективного лечения [5–8].
Особую сложность представляет лечение аневризматического кровоизлияния у беременных из-за ограничений в использовании необходимого арсенала диагностических, хирургических и фармакологических методов. Умеренная гипертензия, необходимая для поддержания нормального церебрального перфузионного давления на фоне развивающегося у всех пациентов вазоспазма, может стать у беременных пусковым механизмом преэклампсии и оказаться губительной для матери и плода [9][10]. Агрессивная хирургическая тактика, оптимальная при осложненном течении субарахноидального кровоизлияния, не исследована при беременности. Стандартной рекомендацией служит прерывание беременности.
Представляем первый случай успешного лечения пациентки с разрывом аневризмы внутренней сонной артерии (ВСА) в первом триместре беременности с использованием ДК.
ОПИСАНИЕ СЛУЧАЯ
Пациентка 34 лет, находящаяся на 10-й неделе беременности, в связи с развитием острой головной боли госпитализирована 16.10.2021 в первичное сосудистое отделение одной из больниц Краснодарского края. По результатам компьютерной томографии (КТ) головного мозга и церебральной ангиографии верифицирован разрыв аневризмы правой ВСА, субарахноидально-паренхиматозно-субдуральное кровоизлияние, выраженный распространенный артериоспазм (рис. 1A–D).
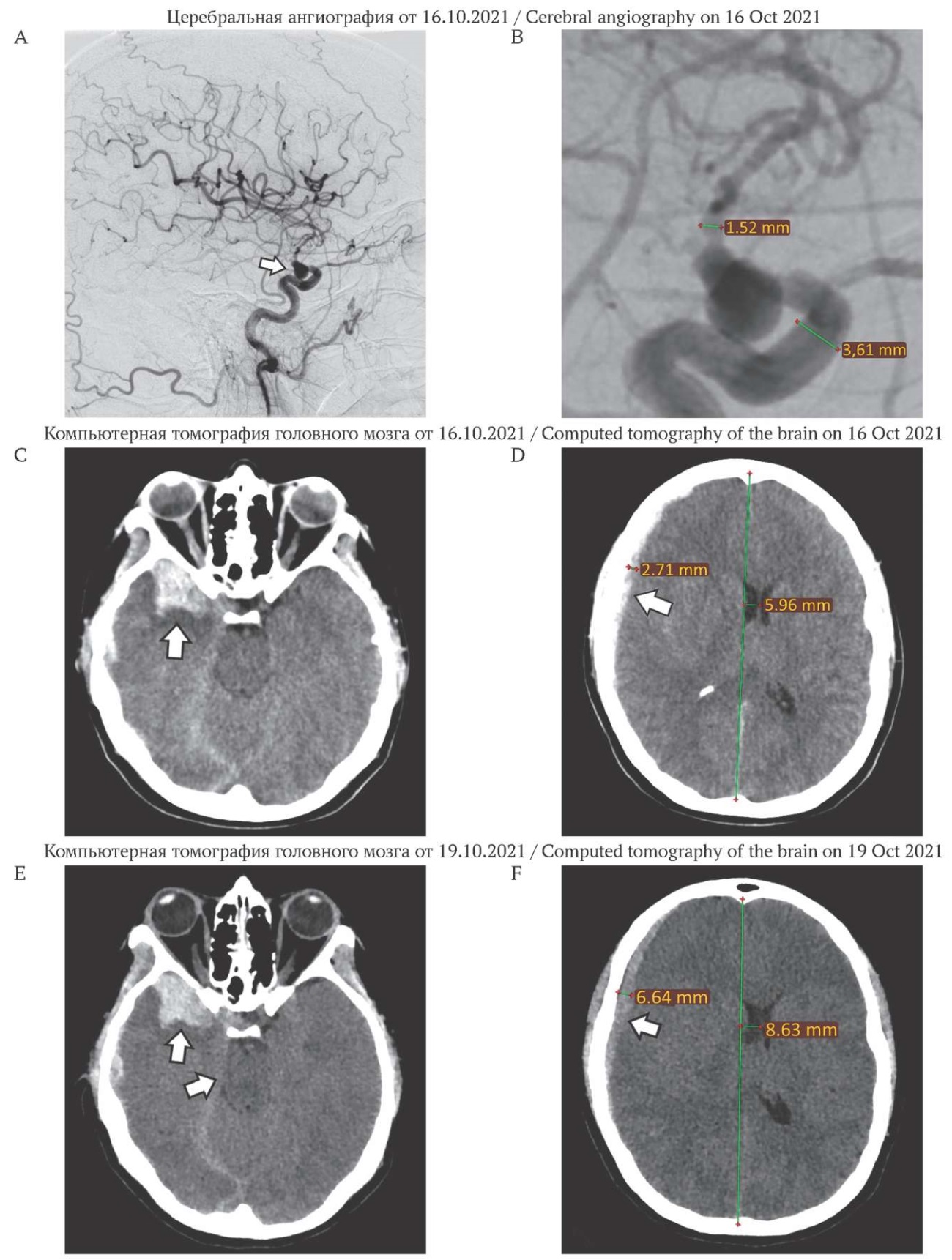
РИС. 1. Церебральная ангиография и компьютерная томография головного мозга пациентки 34 лет, находящейся на 10-й неделе беременности, на момент поступления и через 3 дня.
A–B: Церебральная ангиография (боковая проекция).
A. Аневризма коммуникантного сегмента правой внутренней сонной артерии (стрелка).
B. Аневризма коммуникантного сегмента правой внутренней сонной артерии (диаметр артерии 3,61 мм). Признаки выраженного распространенного артериоспазма (диаметр правой средней мозговой артерии в М1 сегменте 1,52 мм).
C–F: Компьютерная томография (аксиальная проекция).
C. Внутримозговая гематома правой височной доли (стрелка).
D. Пластинчатая субдуральная гематома правого полушария головного мозга 2,71 мм (стрелка). Смещение срединных структур влево на 5,96 мм.
E. Увеличение внутримозговой гематомы правой височной доли и компрессия обходной цистерны моста (стрелки), отек правой височной доли.
F. Увеличение субдуральной гематомы головного мозга до 6,64 мм (стрелка). Нарастание смещения срединных структур влево до 8,63 мм.
FIG. 1. Cerebral angiography and computed tomography of the brain of a 34-year-old female patient at 10 weeks' gestation on admission to hospital and three days later.
A–B: Cerebral angiography (lateral projection).
A. Aneurysm of the communicant segment of the right internal carotid artery (arrow).
B. Aneurysm of the communicant segment of the right internal carotid artery (artery 3.61 mm in diameter). Signs of pronounced widespread arteriospasm (diameter of the right middle cerebral artery in the M1 segment 1.52 mm).
C–F: Computed tomography (axial projection).
C. Intracerebral hematoma of the right temporal lobe (arrow).
D. Lamellar subdural hematoma of the right hemisphere of the brain 2.71 mm (arrow). Displacement of the median structures to the left by 5.96 mm.
E. Enlagement of the intracerebral haematoma of the right temporal lobe and compression of the cistern of the bypass bridge (arrows), edema of the right temporal lobe.
F. Enlargement of the subdural cerebral haematoma to 6.64 mm (arrow) and displacement of the medial structures to the left to 8.63 mm.
Для дальнейшего лечения переведена в ГБУЗ «НИИ – ККБ № 1 им. проф. С.В. Очаповского» МЗ Краснодарского края. При поступлении: состояние средней тяжести, сознание ясное (по шкале комы Глазго 15 баллов), грубый менингеальный синдром, зрачки равновеликие, легкий левосторонний гемипарез, гемигипестезия слева, патологических рефлексов нет. В соматическом статусе без патологии. Гинекологический осмотр: беременность 11–12 недель, прогрессирующая.
Решением консилиума в составе нейрохирург, терапевт, акушер-гинеколог пациентке объяснены риски разорвавшейся аневризмы ВСА и была предложена микрохирургическая операция на аневризме с предварительным прерыванием беременности с целью уменьшения нагрузки на организм матери и устранения возможных тератогенных последствий на плод.
Пациентка отказалась от прерывания беременности и оперативного лечения аневризмы и была госпитализирована для интенсивной терапии в отделение нейрореанимации. Клинический статус оставался без изменений, однако на контрольных КТ от 19.10.2021 отмечена отрицательная динамика в виде увеличения внутримозговой гематомы правой височной доли, увеличения субдуральной гематомы головного мозга и нарастания смещения срединных структур влево (рис. 1E, F).
После повторных объяснений пациентке увеличившихся рисков разорвавшейся аневризмы ВСА для ее жизни и жизни плода получено согласие на от крытую операцию на аневризме; от прерывания беременности отказалась.
Ход операции на аневризме
20.10.2021 проведена операция ДК справа, выделен сосудисто-нервный пучок шеи справа. Выполнена экстрадуральная резекция переднего наклоненного отростка. Удалены острая субдуральная гематома объемом 50 см³ и внутримозговая гематома правой височной доли объемом 15 см³. Разорвавшаяся аневризма правой ВСА в месте отхождения задней соединительной артерии клипирована. Проведена расширяющая пластика твердой мозговой оболочки аутонадкостницей.
Послеоперационный период
В первые сутки после операции сознание восстановилось до умеренного оглушения (по шкале комы Глазго 13 баллов). Пациентка была экстубирована и переведена на самостоятельное дыхание. По данным транскраниальной доплерографии сосудов головного мозга зафиксирован артериоспазм в правом каротидном бассейне, скорость кровотока 162 см/сек, индекс Линдегарда 3,13. С целью снижения лучевой нагрузки в качестве контрольного исследования выполнена магнитно-резонансная томография головного мозга: гематома удалена, отмечены зоны ишемии правой височной и теменной долей, пролабирование вещества головного мозга в дефект (рис. 2).
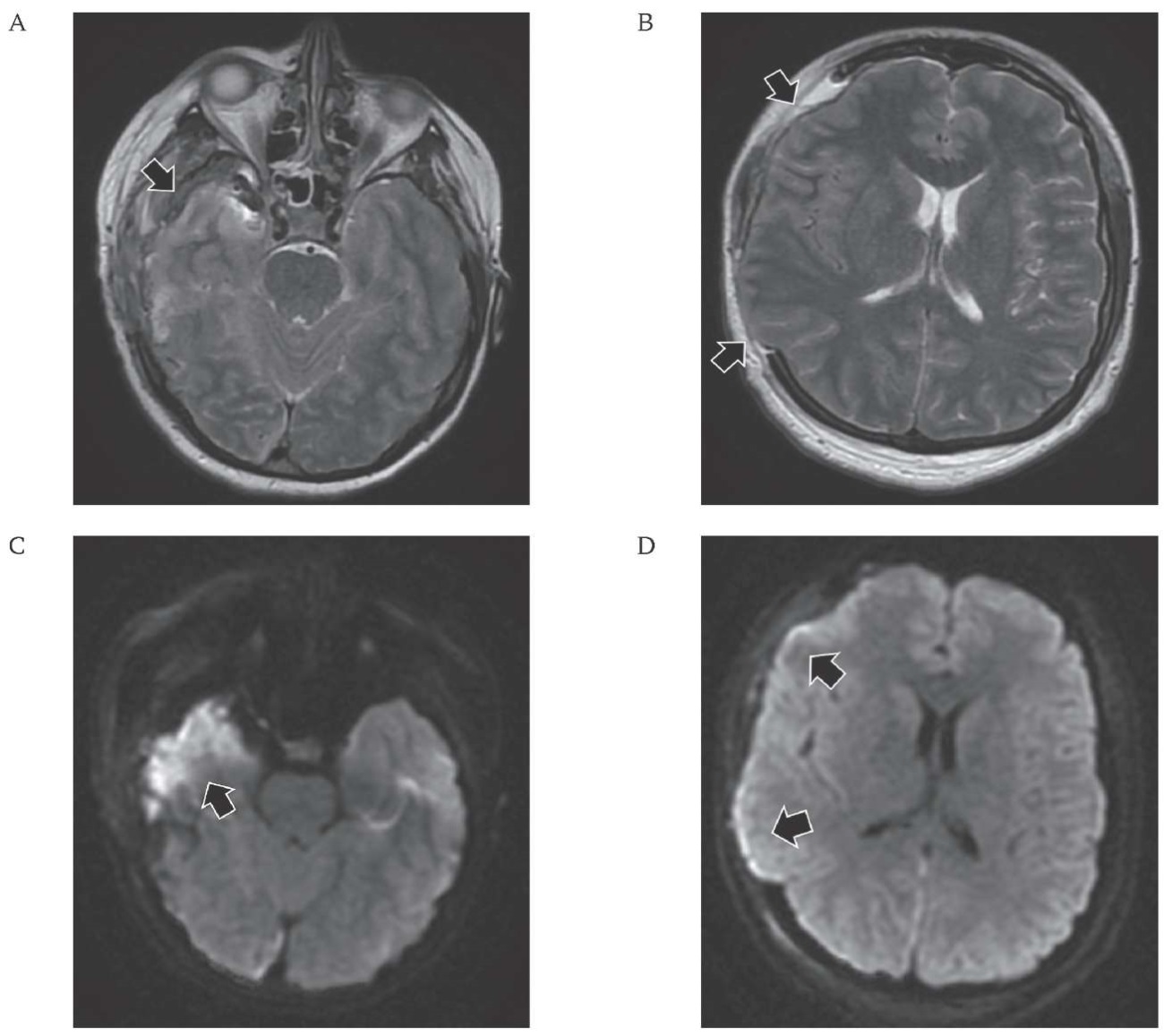
РИС. 2. Магнитно-резонансная томография головного мозга пациентки 34 лет, находящейся на 11-й неделе беременности, на вторые сутки после декомпрессивной краниоэктомии и клипирования аневризмы (22.10.2021).
A, B: режим Т2, аксиальная проекция.
A. Субдуральная и внутримозговая гематомы удалены (стрелка).
B. Вещество головного мозга пролабирует в костный дефект на 0,65 мм (стрелки). Смещения срединных структур нет.
C, D: режим DWI, аксиальная проекция.
C. Зона ишемии правой височной и теменной долей (стрелка).
D. Пролабирование вещества головного мозга в дефект (стрелки).
FIG. 2. Magnetic resonance imaging of the brain of a 34-year-old female patient at 11 weeks of pregnancy on the second day after decompressive craniectomy and aneurysm clipping (22 Oct 2021).
A, B: T2 mode, axial projection.
A. Subdural and intracerebral hematomas removed (arrow).
B. The brain substance prolapses into the bone defect by 0.65 mm (arrows). Medial brain structures are not dislocated.
C, D: DWI mode, axial projection.
C. Ischemic zones of the right temporal and parietal lobes (arrow).
D. Prolapse of the brain substance into the defect (arrows).
Пациентка находилась в нейрореанимации в течение 10 дней, до разрешения вазоспазма. Проводилась инфузионная терапия под контролем водного баланса и электролитов крови, ежедневная транскраниальная доплерография. При выписке на 26-е сутки: состояние удовлетворительное, легкий левосторонний гемипарез, который через месяц на фоне вертикализации и расширения двигательной активности полностью регрессировал.
Беременность и роды
Беременность развивалась нормально. На 40-й неделе беременности, 12.04.2022, родоразрешение кесаревым сечением; родился здоровый ребенок. Ранний послеродовой период протекал без осложнений, были выписаны 24.04.2022.
Послеродовый период
После выписки из роддома появились признаки «синдрома трепанированных»: диффузная головная боль и локальная боль в зоне трепанационного дефекта. От предложенной краниопластики отказалась по причине грудного вскармливания.
Через семь месяцев после родов, 08.11.2022, развился генерализованный судорожный припадок, в связи с чем было назначено противоэпилептическое лечение (леветирацетам 1500 мг в сутки) и рекомендовано срочное закрытие дефекта черепа.
Краниопластика
Поступила на краниопластику 09.12.2022. При осмотре: состояние средней тяжести ввиду выраженного «синдрома трепанированных». В неврологическом статусе без очаговой симптоматики. На КТ головного мозга – дефект черепа после ДК, кистозно-атрофические изменения в зоне операции (рис. 3).
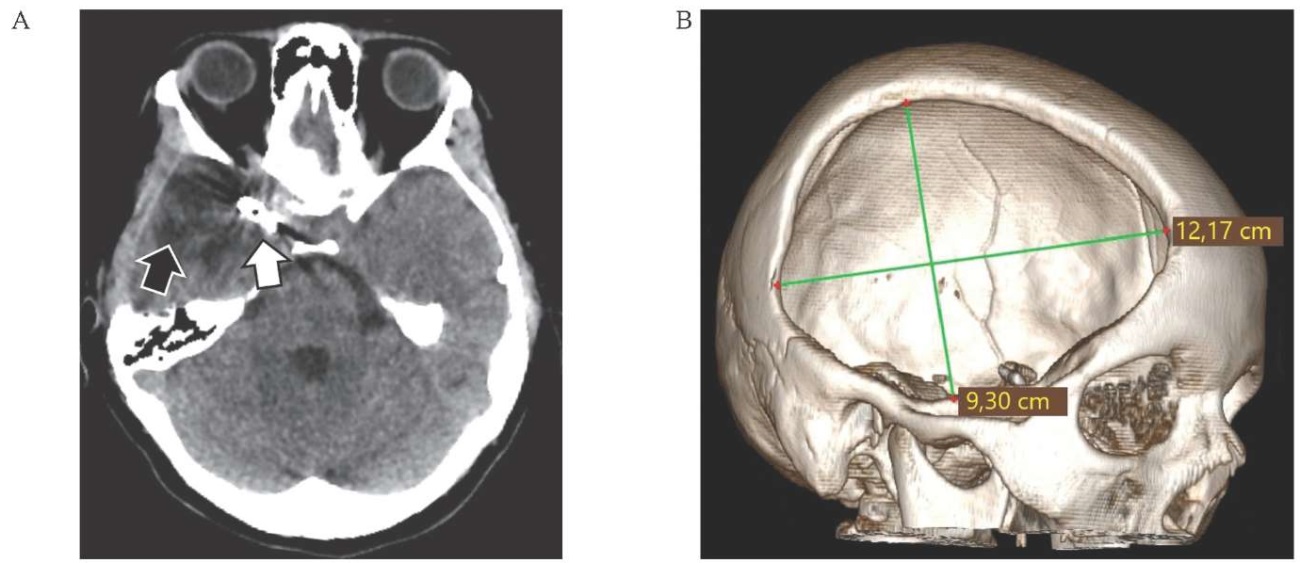
РИС. 3. Компьютерная томография головного мозга пациентки 34 лет перед выполнением краниопластики (09.12.2022).
A. Аксиальная проекция: кистозно-атрофические изменения в зоне кровоизлияния (черная стрелка), клипс (белая стрелка).
В. 3D-реконструкция компьютерной томогорафии головного мозга: размер дефекта черепа 12,17×9,30 см.
FIG. 3. Computed tomography scan of the brain in 34-year-old female patient before cranioplasty (09 Dec 2022).
A. Axial projection: cystic atrophic changes in haemorrhage area (black arrow), clips (white arrow).
В. 3D reconstruction of a computed tomography scan of the brain: the size of the skull defect is 12.17×9.30 cm.
В день поступления пациентке выполнена краниопластика гигантского дефекта черепа (12×9 см) сетчатым биосовместимым титановым имплантом (Osteonic Co., Ltd, Южная Корея), смоделированным интраоперационно.
На послеоперационной КТ головного мозга от 10.12.2022 отмечается нормализация пространственных краниоцеребральных взаимоотношений правого полушария головного мозга (рис. 4A, В). При контрольной церебральной ангиографии от 12.12.2022: магистральные артерии правого каротидного бассейна проходимы, признаков артериоспазма нет, аневризма не контрастируется (рис. 4С, D).
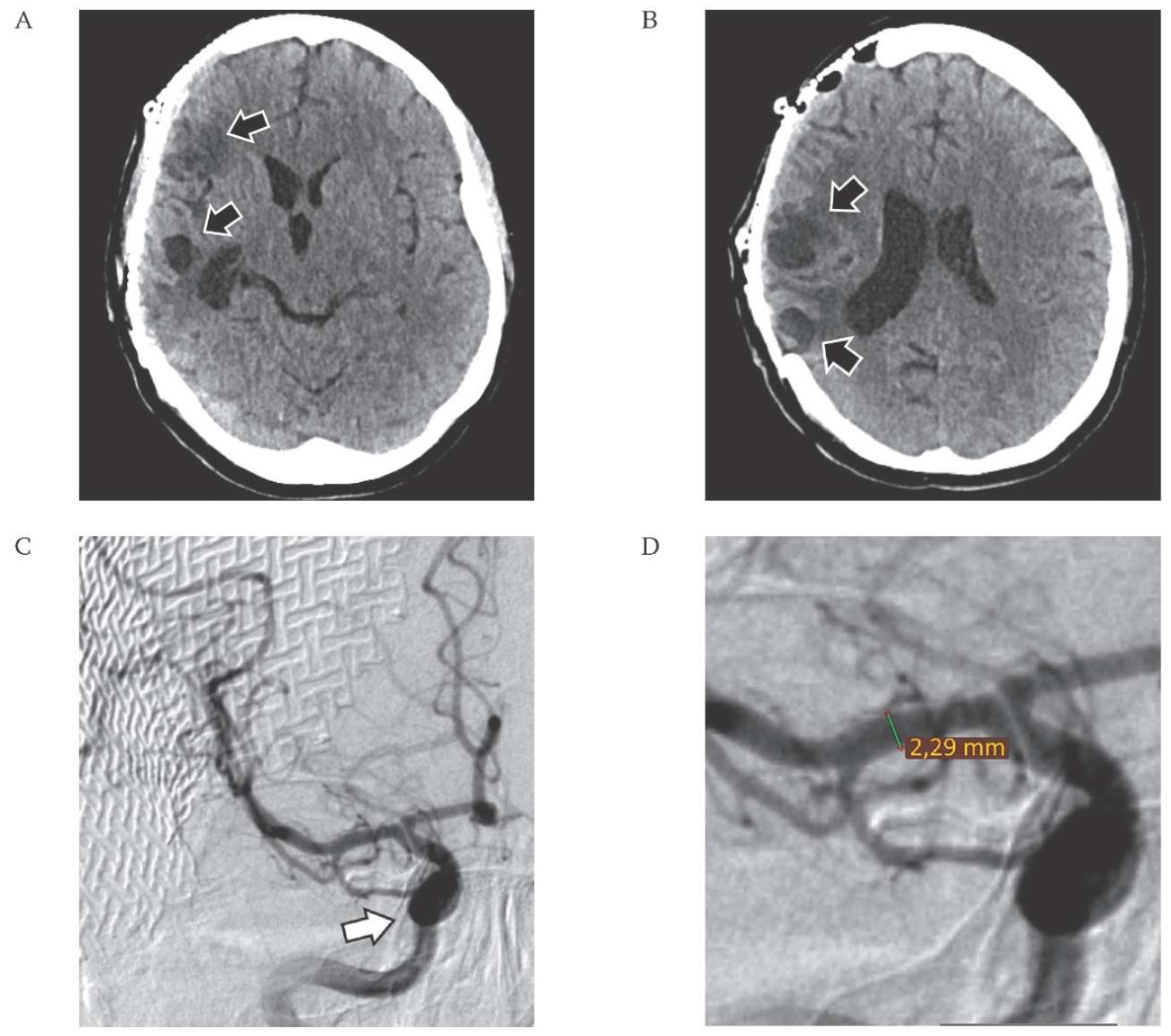
РИС. 4. Компьютерная томография головного мозга (10.12.2022) и церебральная ангиография (12.12.2022) пациентки 34 лет после краниопластики.
А, B: Компьютерная томография (аксиальная проекция). Определяются порэнцефалические кисты правой височной и теменной долей (стрелки).
C, D: Церебральная ангиография (боковая проекция).
C. Клипированная аневризма не контрастируется (стрелка). Признаков артериоспазма нет.
D. Диаметр средней мозговой артерии в М1 сегменте – 2,29 мм.
FIG. 4. Computed tomography of the brain (10 Dec 2022) and cerebral angiography (12 Dec 2022) of a 34-year-old female patient after cranioplasty.
A, B: Computed tomography (axial projection). Porencephalic cysts of the right temporal and parietal lobes are determined (arrows).
C, D: Cerebral angiography (lateral projection).
C. The clipped aneurysm is not contrasted (arrow). There are no signs of arteriospasm.
D. The diameter of the middle cerebral artery in the M1 segment is 2.29 mm.
После операции клиника «синдрома трепанированных» быстро регрессировала, выписана на 12-й день от поступления.
При контрольном осмотре 12.01.2023: сознание ясное, ориентирована, когнитивные функции не нарушены, мышечная сила достаточная во всех конечностях, патологических рефлексов нет, функциональные исходы по расширенной шкале исходов Глазго 7 баллов. Повторные судорожные припадки не наблюдались. Продолжает прием леветирацетама в прежней дозе.
ОБСУЖДЕНИЕ
В 1994 году C. Fischer и соавт. впервые продемонстрировали возможность кардинального улучшения клинического состояния пациентов при рефрактерных к консервативной терапии САК из аневризм путем выполнения ДК [11]. Однако последующие исследования не показали достаточной эффективности ДК при разрывах церебральных аневризм, для того чтобы рекомендовать эту операцию в широкую практику [12–15]. Лишь спустя десятилетия была признана польза ДК у строго отобранных пациентов с разрывами церебральных аневризм, хотя за рубежом четких критериев отбора до настоящего времени не предложено.
Основной причиной таргетного действия ДК при САК являются сложный, мультистадийный патогенез аневризматических кровоизлияний и максимальная эффективность ДК при превентивном выполнении у компенсированных пациентов – до развития инфарктов больших полушарий с масс-эффектом и инфарктов ствола.
Так, R. Jabbarli и соавт. [5] на примере 245 случаев САК продемонстрировали улучшения функциональных исходов при выполнении ранней декомпрессии по сравнению с отсроченной. В систематическом обзоре 2020 года M. Darkwah и соавт. [6] показано, что в большинстве случаев ранней декомпрессии подвергаются изначально тяжелые пациенты, а у пациентов средней тяжести ДК выполняется, как правило, после клинической декомпенсации, когда операция почти бессмысленна.
Недавно стартовало проспективное исследование PICASSO, направленное на сравнительный анализ исходов первичной ДК при САК с медикаментозным лечением внутричерепной гипертензии и отсроченной операции, применяемой как ultima ratio, которое, возможно, расширит научные представления по этой проблеме [16].
На этом фоне работы, выполненные в России, оказались более полезными для практики [7][8]. Они позволили разработать официальные рекомендации по выполнению ДК у пациентов с разрывами церебральных аневризм, согласно которым наружная декомпрессия рекомендуется при наличии одного из факторов: (1) Hunt-Hess – V, (2) дислокация срединных структур – более 5 мм, (3) внутримозговая гематома – более 30 мл, (4) признаки острой ишемии у пациентов с массивным САК (Fisher 3) и регламент лечения нетравматических внутричерепных кровоизлияний у беременных1,2.
В соответствии с этими документами хирургически тактика у беременных с разрывами церебральных аневризм не должна отличаться от тактики лечения других пациентов, а абсолютным показанием к экстренному прерыванию беременности со стороны центральной нервной системы является наличие симптомов преэклампсии и эклампсии2. Указанные рекомендации совпадают с единодушным мнением зарубежных исследователей, которые при сроке гестации менее 24 недель считают необходимым оперативное выключение разорвавшейся аневризмы и пролонгирование беременности [9][10].
Ретроспективно анализируя выбранный объем оперативного вмешательства на аневризме (лечение проводилось до утверждения новых клинических рекомендаций по геморрагическому инсульту)1, можно сказать, что выбранная нами хирургическая тактика (наружная декомпрессия и клипирование аневризмы) соответствовала новым стандартам.
Послеоперационное консервативное лечение пациентки помимо профилактики тромбоэмболических осложнений было направлено на поддержание нормального волемического статуса и системного артериального давления, что de facto соответствует лечебным мероприятиям, проводимым в акушерском стационаре для коррекции фетоплацентарной недостаточности. Для ограничения лучевой нагрузки в качестве метода послеоперационного контроля мы применяли МРТ головного мозга.
Необходимо упомянуть о том, что в соответствии с приказом Минздравсоцразвития России № 736 от 3 декабря 2007 г. «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» с изменениями и дополнениями от 27 декабря 2011 г.3 у представленной пациентки было прямое показание для прерывания беременности – аневризма мозговой артерии (Класс IX. Пункт 6). Вместе с этим, опираясь на статью 56 пункт 1 и статью 20 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» (Федеральный закон от 21.11.2011 № 323-ФЗ)4, учли волеизъявление пациентки пролонгировать беременность, и был осуществлен мультидисциплинарный подход к лечению, доказавший свою эффективность.
ЗАКЛЮЧЕНИЕ
Лечение беременных с разрывами церебральных аневризм – чрезвычайно ответственная задача, представляющая серьезные сложности в медицинском, морально-этическом и правовом отношении. Тщательная, динамическая, взвешенная оценка тяжести течения заболевания и беременности, индивидуальных рисков планируемого оперативного вмешательства и потенциальных осложнений, возможность выполнения оптимального объема диагностических и лечебных процедур и мероприятий интенсивной терапии мультидисциплинарной командой позволяют сохранить здоровье матери и ребенку.
ВКЛАД АВТОРОВ
Ткачев В.В. руководил написанием статьи. Першин М.Е. и Ткачев В.В. внесли основной вклад в разработку концепции статьи, подготовили текст. Литвиненко Д.В. и Конарева Т.И. принимали участие в обследовании пациента и подготовке материалов клинического наблюдения. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Vyacheslav V. Tkachev supervised the writing of the article. Mikhail E. Pershin and Vyacheslav V. Tkachev made the main contribution to the development of the concept of the article, prepared the text. Dmitry V. Litvinenko and Tatyana I. Konareva took part in the examination of the patient and the preparation of clinical observation materials. All authors approved the fi nal version of the publication.
Соблюдение этических норм. Заявление о согласии. Пациентка дала согласие на публикацию представленной статьи «Превентивная декомпрессивная краниоэктомия при разрыве церебральной аневризмы в первом триместре беременности: успешный исход для матери и плода» в журнале «Сеченовский вестник».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Благодарность. Авторы выражают благодарность Галине Р. Обивалиной – студентке 5-го курса лечебного факультета федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации за помощь в подготовке и оформлении иллюстраций.
Compliance with ethical standards. Consent statement. Patient has consented to the submission of this clinical case “Preventive decompressive craniectomy for ruptured cerebral aneurysm in the first trimester of pregnancy: Successful outcome for mother and fetus” in the “Sechenov Medical Journal”.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Acknowledgements. The authors are grateful to Galina R. Obivalina, a 5th year student of the Faculty of Medicine of the Federal State Budgetary Educational Institution of Higher Education “Kuban State Medical University” of the Ministry of Health of the Russian Federation, for her help in preparing and designing the illustrations.
1. Министерство здравоохранения РФ. Клинические рекомендации. Геморрагический инсульт (утв. Министерством здравоохранения РФ, 2022 г.) https://cr.minzdrav.gov.ru/recomend/523_2 (дата обращения: 05.07.2024).
2. Ассоциация нейрохирургов. России Клинические рекомендации. Хирургическое лечение нетравматических внутричерепных кровоизлияний у беременных. Обсуждены и утверждены на Пленуме Правления Ассоциации нейрохирургов России г. Красноярск, 14.10.2015 https://ruans.org/Text/Guidelines/sah_pregnant.pdf (дата обращения: 05.07.2024).
3. Министерство здравоохранения РФ. Приказ Минздравсоцразвития России № 736 от 3 декабря 2007 г. https://minzdrav.gov.ru/documents/7780-prikaz-minzdravsotsrazvitiya-rossii-736-ot-3-dekabrya-2007-g (дата обращения: 05.07.2024).
4. Министерство здравоохранения РФ. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» https://minzdrav.gov.ru/documents/7025 (дата обращения: 05.07.2024).
Список литературы
1. Steiner T., Juvela S., Unterberg A., et al. European stroke organization. European stroke organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis. 2013; 35(2): 93–112. https://doi.org/10.1159/000346087. Epub 2013 Feb 7. PMID: 23406828
2. Крылов В.В., Дашьян В.Г., Шатохин Т.А. и др. Выбор сроков открытого хирургического лечения больных с разрывом церебральных аневризм, осложненных массивным базальным субарахноидальным кровоизлиянием (Fisher 3). Нейрохирургия. 2015; 3: 11–17. / Krylov V.V., Dash’Yan V.G., Shatokhin T.A., et al. The timing of open surgical treatment for patients with massive basal subarachnoid hemorrhage (Fisher 3) because of cerebral aneu rysms rupture. The Russian Journal of Neurosurgery. 2015; 3: 11–17 (In Russian). EDN: VTQXEL
3. Yao Z., Hu X., Ma L., et al. Timing of surgery for aneurysmal subarachnoid hemorrhage: A systematic review and meta-analysis. Int J Surg. 2017 Dec; 48: 266–274. https://doi.org/10.1016/j.ijsu.2017.11.033. Epub 2017 Nov 28. PMID: 29180068
4. Lu J., Wang L., Li R., et al. Timing of operation for poor-grade aneurysmal subarachnoid hemorrhage: relationship with delayed cerebral ischemia and poor prognosis. CNS NeurosciTher. 2023 Apr; 29(4): 1120–1128. https://doi.org/10.1111/cns.14088. Epub 2023 Jan 10. PMID: 36627811
5. Jabbarli R., Oppong M.D., Dammann P., et al. Time is brain! Analysis of 245 cases with decompressive craniectomy due to subarachnoid hemorrhage. World Neurosurg. 2017 Feb; 98: 689– 694.e2. https://doi.org/10.1016/j.wneu.2016.12.012. Epub 2016 Dec 18. PMID: 27993743
6. Darkwah Oppong M., Golubovic J., Hauck E.F., et al. Decompressive craniectomy in aneurysmal subarachnoid hemorrhage: Who and when? – A systematic review and meta-analysis. Clin Neurol Neurosurg. 2020 Dec; 199: 106252. https://doi.org/10.1016/j.clineuro.2020.106252. Epub 2020 Sep 28. PMID: 33011517
7. Дашьян В.Г., Левченко О.В., Айрапетян А.А. и др. Декомпрессивная краниотомия в хирургии разорвавшихся аневризм головного мозга. Российский нейрохирургический журнал имени профессора А. Л. Поленова. 2015; 4: 18–25. EDN: YFSCBF / Dash’yan V.G., Levchenko O.V., Airapetyan A.A., et al. Decompressive craniotomy at surgical treatment of rupted intracranial aneurysms. Russian Journal of Neurosurgery. 2015; 4: 18–25 (In Russian).
8. Пилипенко Ю.В., Коновалов Ан.Н., Элиава Ш.Ш. и др. Определение оправданности и эффективности декомпрессивной трепанации черепа у больных с субарахноидальным кровоизлиянием после микрохирургического выключения аневризм. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018; 82(1): 59–71. https://doi.org/10.17116/neiro201882159-71. PMID: 29543217 / Pilipenko Yu.V., Konovalov An.N., Eliava S.S., et al. Reasonability and efficacy of decompressive craniectomy in patients with subarachnoid hemorrhage after microsurgical aneurysm exclusion. Burdenko’s Journal of Neurosurgery. 2018; 82(1): 59–71 (In Russian, In English). https://doi.org/10.17116/neiro201882159-71. PMID: 29543217
9. Beighley A., Glynn R., Scullen T., et al. Aneurysmal subarachnoid hemorrhage during pregnancy: a comprehensive and systematic review of the literature. Neurosurg Rev. 2021 Oct; 44(5): 2511– 2522. https://doi.org/10.1007/s10143-020-01457-2. Epub 2021 Jan 7. PMID: 33409763
10. Selo-Ojeme D.O., Marshman L.A., Ikomi A., et al. Aneurysmal subarachnoid haemorrhage in pregnancy. Eur J ObstetGynecolReprod Biol. 2004 Oct 15; 116(2), 131–143. https://doi.org/10.1016/j.ejogrb.2004.04.016. PMID: 15358453
11. Fisher C.M., Ojemann R.G. Bilateral decompressive craniectomy for worsening coma in acute subarachnoid hemorrhage. Observations in support of the procedure. Surg Neurol. 1994 Jan; 41(1): 65–74. https://doi.org/10.1016/0090-3019(94)90210-0. PMID: 8310390
12. Holsgrove D.T., Kitchen W.J., Dulhanty L., et al. Intracranial hypertension in subarachnoid hamorrhage: outcome after decompressive craniectomy. Acta Neurochir Suppl. 2014; 119: 53–55. https://doi.org/10.1007/978-3-319-02411-0_9. PMID: 24728633
13. Hwang U.S., Shin H.S., Lee S.H., et al. Decompressive surgery in patients with poor-grade aneurysmal subarachnoid hemorrhage: clipping with simultaneous decompression versus coil embolization followed by decompression. J Cerebrovasc Endovasc Neurosurg. 2014 Sep; 16: 254–261. https://doi.org/10.7461/jcen.2014.16.3.254. Epub 2014 Sep 30. PMID: 25340028.
14. Jussen D., Marticorena S., Sandow N., et al. Ultra-early decompressive hemicraniectomy in aneurysmal intracerebral hemorrhage: a retrospective observational study. Minerva Anestesiol. 2015 Apr; 81(4): 398–404. Epub 2014 Sep 29. PMID: 25263023
15. Otani N., Nawashiro H., Wada K., et al. Surgical results after primary decompressive craniectomy in poor-grade aneurysmal subarachnoid hemorrhage. Acta Neurochir Suppl. 2013; 118: 269–272. https://doi.org/10.1007/978-3-7091-1434-6_51. PMID: 23564146
16. Güresir E., Lampmann T., Brandecker S., et al. Primary decompressive craniectomy in aneurysmal subarachnoid hemorrhage (PICASSO) trial: study protocol for a randomized controlled trial. Trials. 2022 Dec 20; 23(1): 1027. https://doi.org/10.1186/s13063022-06969-4. PMID: 36539817.
Об авторах
М. Е. ПершинРоссия
Першин Михаил Евгеньевич, врач-нейрохирург нейрохирургического отделения № 2,
ул.1 Мая, д. 167, г. Краснодар, 350086.
Д. В. Литвиненко
Россия
Литвиненко Дмитрий Викторович, канд. мед. наук, врач-нейрохирург нейрохирургического отделения № 2,
ул.1 Мая, д. 167, г. Краснодар, 350086.
Т. И. Конарева
Россия
Конарева Татьяна Ивановна, заведующая отделением анестезиологии и реанимации № 3,
ул.1 Мая, д. 167, г. Краснодар, 350086.
В. В. Ткачев
Россия
Ткачев Вячеслав Валерьевич, д-р мед. наук, заведующий нейрохирургическим отделением № 2,
ул.1 Мая, д. 167, г. Краснодар, 350086.
Дополнительные файлы

|
1. Чек-лист CARE | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(102KB)
|
Метаданные ▾ | |
Рецензия
JATS XML







































