Перейти к:
Особенности манифестации и течения болезни Крона у трех родных братьев
https://doi.org/10.47093/2218-7332.2020.11.3.70-77
Аннотация
Наследственная предрасположенность — наиболее значимый фактор риска болезни Крона (БК) у сиблингов.
Описание случаев. В многодетной семье из 6 детей одного поколения у 3 братьев выявлена БК: у одного — в возрасте 15 лет и у двух — в возрасте 17 лет. У старшего брата БК манифестировала острой кишечной непроходимостью, прикрытой перфорацией подвздошной кишки, разлитым перитонитом; у среднего — симптоматикой, сходной с аппендикулярным инфильтратом. Обоим братьям выполнена резекция терминального отдела подвздошной, слепой и части восходящего отдела ободочной кишок с наложением илеоасцендоанастомоза. У младшего брата диагностирована нестриктурирующая, непенетрирующая форма БК с постепенным началом и отсутствием осложнений. Среди сиблингов, не страдающих БК, у двух установлены ревматоидный артрит и витилиго.
Обсуждение. Сходными признаками семейной формы БК оказались молодой возраст дебюта и сочетанное поражение подвздошной и толстой кишки; отличительными — наличие осложнений и хирургические вмешательства только у двух братьев. Особенностью наблюдения служит развитие заболевания только у мальчиков и сочетание в одном поколении семьи трех различных аутоиммунных заболеваний.
Ключевые слова
Отягощенный семейный анамнез — важный фактор риска воспалительных заболеваний кишечника (ВЗК), который отмечается у 8–12% пациентов, причем при болезни Крона (БК) чаще, чем при язвенном колите.
При наличии в семье пациента с ВЗК риск развития заболевания у родственников первой степени родства увеличивается в 4–8 раз [1, 2]. Это может быть обусловлено, с одной стороны, генетической предрасположенностью, с другой — общими внешними факторами риска [1][3].
Более 100 генов связывают с предрасположенностью к БК, которая реализуется через изменения врожденного и адаптивного иммунитета, механизмов распознавания микроорганизмов, проницаемости эпителиального барьера [3][4].
M.P.C. Santos и соавт. [1], анализируя исследования за последние 30 лет, делают заключение о том, что среди родственников максимальный риск ВЗК описан у сиблингов по сравнению с детьми и родителями, особенно если пробанд страдает БК (относительный риск 23–35).
Нами представлено уникальное описание многодетной семьи, в которой у трех из шести детей развилась БК. Проанализированы общие черты и индивидуальные особенности течения заболевания.
ОПИСАНИЕ СЛУЧАЕВ
Старший брат, 36 лет
В 2000 году в возрасте 17 лет впервые появилась острая, схваткообразная боль в правой половине живота, не связанная с приемом пищи, диарея до 15 раз в сутки и гематохезия. Состояние быстро ухудшалось: боль в животе стала нестерпимой и приобрела разлитой характер. Проведена экстренная лапаротомия, выявлена острая тонкокишечная непроходимость, прикрытая перфорация подвздошной кишки, утолщение стенки восходящего отдела толстой кишки, разлитой серозно-геморрагический перитонит. Проведена правосторонняя гемиколэктомия с формированием илеотрансверзоанастомоза «конец в конец». На основании интраоперационных данных и гистологического исследования операционного материала установлен диагноз: БК, илеоколит, пенетрирующая, стриктурирующая форма (A2L3B3+В2) [5]. В течение следующих 16 лет самочувствие оставалось удовлетворительным, терапию не получал.
В 2016 году вновь появилась схваткообразная боль в области правого фланка живота, которая сопровождалась подъемом температуры тела до 37,5 °С, отсутствием стула и отхождения газов в течение 5 дней, вздутием живота. По данным компьютерной томографии (КТ) органов брюшной полости (ОБП) обнаружены расширенные и заполненные жидкостью петли тонкой кишки, содержащие горизонтальные уровни жидкости, изменения терминального отдела тонкой кишки — циркулярно утолщенные (до 8–10 мм) стенки терминального отдела тонкой кишки, отек окружающей клетчатки. Тонкокишечная непроходимость была купирована консервативными методами: ципрофлоксацин 400 мг/сут и метронидазол 1500 мг/сут внутривенно капельно. Для поддерживающего лечения назначен азатиоприн в дозе 100 мг/сут (1,2 мг/кг веса).
С января по март 2017 г. при сохранном аппетите, без ограничений в питании, похудел на 20 кг (потерял 25% от исходной массы тела, индекс массы тела (ИМТ) составил 20,5 кг/м2), с апреля по июнь 2017 г. отмечено несколько рецидивов тонкокишечной непроходимости, аналогичных описанному выше, разрешившихся при проведении консервативной терапии. По результатам КТ ОБП, выполненной в апреле 2017 г., выявлена картина БК: стриктура илеотрансверзоанастомоза и подвздошной кишки протяженностью до 11 см с сужением просвета кишки до 0,3 см в диаметре, супрастенотическим расширением до 5 см и нарушением кишечной проходимости. Для индукции ремиссии назначен преднизолон 60 мг/сут с постепенным снижением дозы и его полной отменой, антибактериальные препараты, спазмолитики; продолжено лечение азатиоприном, доза которого увеличена до 150 мг/сут (2,5 мг/кг).
В ноябре 2017 года планово проведена резекция подвздошной кишки с зоной илеотрансверзоанастомоза, выполнена илеостомия по Бруку. В послеоперационном периоде начата биологическая терапия адалимумабом в дозе 160 мг подкожно однократно с переходом на 80 мг через 2 недели и 40 мг каждые последующие 2 недели с положительным эффектом: боль в животе не беспокоила, прибавил в весе (ИМТ 26,6 кг/м2). В декабре 2018 года по данным илеоколоноскопии и КТ ОБП констатирована ремиссия БК.
В апреле 2019 года проведена ликвидация одноствольной илеостомы с формированием реконструктивно-восстановительного илеотрансверзоанастомоза. В 2020 году продолжается поддерживающая биологическая терапия адалимумабом в дозе 40 мг подкожно каждые 2 недели; жалоб не предъявляет.
Средний брат, 29 лет
В 2005 году в возрасте 15 лет впервые возникла боль в правой подвздошной области, появился частый жидкий стул со слизью, за месяц потерял в весе 6 кг (ИМТ 15,2 кг/м2). Госпитализирован в хирургическое отделение с подозрением на аппендикулярный инфильтрат. По данным ультразвукового исследования (УЗИ) ОБП выявлено утолщение стенки подвздошной кишки с сужением ее просвета. При ирригоскопии был обнаружен дефект наполнения слепой кишки. Проведена лапаротомия: обнаружены утолщенные плотные стенки терминального отдела подвздошной, слепой и части восходящего отдела ободочной кишок; выполнена резекция этих отделов и наложен илеоасцендоанастомоз «конец в конец». При гистологическом исследовании операционного материала выявлены признаки БК. Противорецидивная терапия не назначалась.
В течение следующих 14 лет эпизодически отмечал боль в правой половине живота, неустойчивый стул, самочувствие в целом оставалось удовлетворительным, за медицинской помощью не обращался.
С июня 2019 года усилилась боль в животе, появилась диарея до 3 раз в сутки, иногда с примесью слизи. По поводу этих жалоб в октябре 2019 года поступил в Клинику пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Университетской клинической больницы № 2 Сеченовского Университета (далее — Клиника). При объективном исследовании: состояние удовлетворительное. ИМТ 25,2 кг/м2. Брюшная стенка деформирована за счет послеоперационного рубца, при пальпации по методу Образцова — Стражеско отмечена болезненность в области илеоасцендоанастомоза. По остальным органам и системам — без видимых патологических изменений. Общий анализ крови, мочи — без значимых изменений. Проведена илеоколоноскопия: в илеоасцендоанастомозе и на протяжении 20 см подвздошной кишки выявлены множественные эрозии с налетом фибрина на фоне отечной и гиперемированной слизистой. При гистологическом исследовании биоптатов из эрозий слизистой оболочки подвздошной кишки выявлен хронический очаговый активный эрозивный илеит (рис. 1а, б).
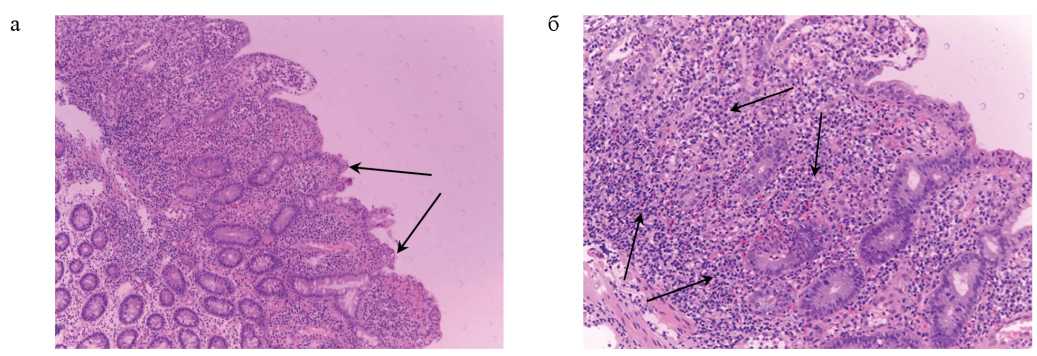
РИС. 1. Хронический очаговый активный эрозивный илеит. Окраска гематоксилином и эозином, а — ×80, б — ×160. Отмечается сглаживание ворсин, повреждение покровного эпителия (а: стрелки) и эпителия крипт, диффузная воспалительная инфильтрация со значительной примесью сегментоядерных лейкоцитов (б: стрелки).
FIG. 1. Chronic focal active erosive ileitis. Hematoxylin and eosin stain, а — ×80, б — ×160. There is a smoothing of the villi, damage to the integumentary epithelium (a: arrows) and crypt epithelium, diffuse inflammatory infiltration with a significant number of segmented leukocytes (b: arrows).
Выполнена КТ-энтероколонография, обнаружены признаки БК: неравномерное утолщение стенки тощей кишки до 7 мм и деформация рельефа ее слизистой оболочки; два участка сужения просвета и расширение отдельных петель подвздошной кишки; регионарная лимфаденопатия и уплотнение клетчатки в правой подвздошной области.
Клинический диагноз: БК, илеоколит, стриктурирующая форма (A1L3B2). Для индукции ремиссии назначен будесонид 9 мг/сут в течение 3 месяцев и азатиоприн 150 мг/сут в качестве поддерживающей терапии, с положительным эффектом: боль в животе не беспокоила, стул нормализовался. В 2020 году продолжается терапия азатиоприном в дозе 150 мг/сут (2 мг/кг), жалоб не предъявляет.
Младший брат, 24 года
В 2013 году в возрасте 17 лет появилась периодически возникающая боль в правой половине живота, эпизоды диареи.
Впервые обратился за медицинской помощью в 2015 году, когда отметил гематохезию. Общий анализ крови, мочи — без существенных изменений. Уровень фекального кальпротектина составил 541 мкг/г (<50 мкг/г). Илеоколоноскопия и гистологическое исследование позволили подтвердить диагноз БК с поражением терминального отдела подвздошной, слепой и прямой кишки. Назначен месалазин в дозе 2 г/сут внутрь с положительным эффектом (боль в животе не беспокоила, прекратилась гематохезия, нормализовался стул).
С начала 2019 года появилась эпизодическая боль в животе, жидкий стул без патологических примесей до 3 раз в сутки, присоединилась общая слабость. В ноябре 2019 года госпитализирован в Клинику. При объективном исследовании: состояние удовлетворительное. ИМТ 29 кг/м2. При пальпации по методу Образцова — Стражеско отмечена болезненность слепой и восходящей ободочной кишки. По остальным органам и системам — без видимых патологических изменений.
Проведена илеоколоноскопия: в терминальном отделе подвздошной кишки визуализируются множественные (более 10 на осмотренном участке) сливающиеся эрозии диаметром 4–8 мм; в слепой и частично восходящем отделе ободочной кишки — отдельные точечные эрозии до 1 мм. Обнаружена зубчатая аденома печеночного изгиба ободочной кишки. При гистологическом исследовании биоптатов из эрозий слизистой оболочки подвздошной кишки выявлен хронический очаговый активный эрозивный илеит с фолликулярной гиперплазией лимфоидной ткани (рис. 2а, б).
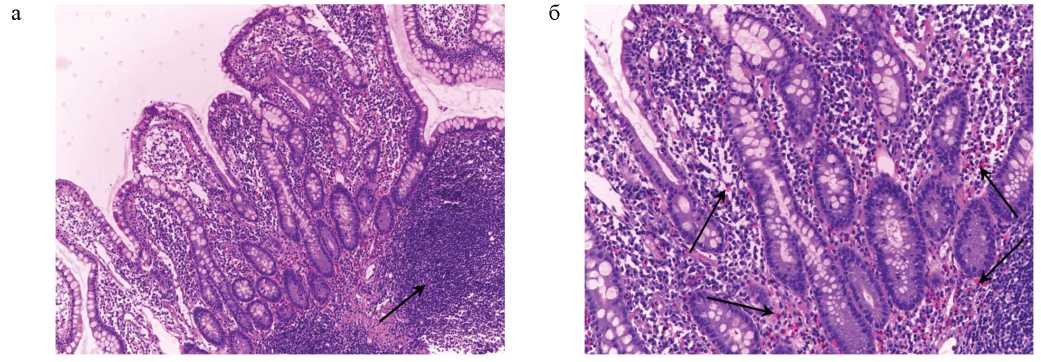
РИС. 2. Хронический очаговый активный эрозивный илеит с фолликулярной гиперплазией лимфоидной ткани. Окраска гематоксилином и эозином, а — ×80, б — ×160. Отмечается уплощение ворсин, гиперплазия и почкование крипт. Повышение плотности клеточного инфильтрата носит неравномерный характер. Обнаруживается крупный лимфоидный фолликул (а: стрелка). Местами отмечается повышение содержания эозинофилов (б: стрелки).
FIG. 2. Chronic focal active erosive ileitis with follicular hyperplasia of lymphoid tissue. Hematoxylin and eosin stain, а — ×80, б — ×160. Flattening of villi, hyperplasia and budding of crypts are noted. The increase in the density of the cellular infiltrate is uneven. A large lymphoid follicle is found (a: arrow). In some places, an increase in the content of eosinophils is noted (b: arrows).
Клинический диагноз: БК, илеоколит, нестриктурирующая, непенетрирующая форма (A2L3B1); низкая клиническая активность (индекс Беста 240 баллов). Зубчатая аденома печеночного изгиба ободочной кишки. Назначен будесонид 9 мг/сут на 3 месяца с последующим снижением дозы до полной отмены; азатиоприн 150 мг/сут (2 мг/кг) в качестве поддерживающей терапии. При уменьшении боли в животе и исчезновении диареи пациент самостоятельно отменил азатиоприн и начал принимать месалазин в дозе 4 г/сут. В декабре 2019 года в Клинике выполнена плановая эндоскопическая полипэктомия, отмечено уменьшение выраженности эрозивного илеита, заживление эрозий восходящего отдела ободочной кишки. На конец 2020 года жалоб не предъявляет, возобновлен прием азатиоприна.
Сравнительная характеристика манифестации и течения БК у трех братьев представлена в таблице.
Таблица. Сравнительная характеристика манифестации и течения болезни Крона у трех братьев
Table. Comparative characteristics of the manifestation and course of Crohn’s disease in three brothers

Семейный анамнез
Генеалогическое дерево описываемой семьи представлено на рисунке 3. Дед со стороны отца долгое время страдал диареей, в возрасте 45 лет ему был установлен диагноз парапроктита (?). Скончался в возрасте 50 лет от онкологического заболевания (?) (первичная локализация злокачественной опухоли не выявлена). Отца периодически беспокоил жидкий стул и абдоминальная боль. При колоноскопии выявлены единичные эрозии терминального отдела подвздошной кишки, диагноз ВЗК не установлен. В рассматриваемом поколении (поколение III) — четверо братьев и две сестры, из которых трое братьев страдают БК, у старшей сестры установлен диагноз ревматоидного артрита, у единственного брата, не страдающего БК, — витилиго.

РИС. 3. Генеалогическое дерево.
FIG. 3. Genealogical tree.
ОБСУЖДЕНИЕ
Семейная предрасположенность — общепризнанный фактор риска БК, вместе с тем, несмотря на активное изучение наследственных особенностей заболевания, тестирование в качестве методики, необходимой для правильного ведения пациентов, не упоминается в отечественных Клинических рекомендациях по диагностике и лечению БК у взрослых [6]. Позиция European Crohn’s and Colitis Organisation (ECCO, Европейское общество по болезни Крона и колиту) сформулирована четко: генетическое тестирование не рекомендуется для рутинного диагноза БК [7].
Большое число исследований посвящено оценке особенности манифестации и течения ВЗК у лиц с отягощенным семейным анамнезом и/или определенным генотипом. Казалось бы, ключевым итогом этих работ должна стать система оценки прогноза риска возникновения и характера течения БК у членов одной семьи, которая бы позволила, например, назначить наиболее подходящее медикаментозное лечение на основании клинической картины и генетического тестирования родственника. К сожалению, данные этих исследований, особенно в оценке прогноза, противоречивы [1]. При сравнении тяжести течения БК и необходимости назначения различных лекарственных препаратов у больных с семейной предрасположенностью и спорадическими случаями БК не было выявлено различий в частоте назначения кортикостероидов, иммуносупрессоров [2][8][9][10], биологических препаратов [10], в необходимости проведения хирургических вмешательств [8][9][10], госпитализации [2][10] и частоте рецидивов [9]. Единичные исследования показали, что пациенты с семейной формой БК получают антитела к фактору некроза опухоли альфа (ФНО-α) чаще, чем больные со спорадическими формами заболевания [1].
Семейная предрасположенность к ВЗК не означает облигатного развития этих заболеваний у всех родственников, что подтверждает отсутствие БК у трех из шести сиблингов. При этом наличие ВЗК более чем у двух близких родственников достоверно увеличивает риск по сравнению с одним или двумя больными родственниками [1]. Таким образом, наличие в семье пациента с БК должно нацеливать врача на целенаправленную диагностику этого заболевания при наличии клинической картины у родственника, что может существенно облегчить диагностический поиск. Сцепленность БК с полом не характерна, по эпидемиологическим данным заболевание одинаково часто поражает мужчин и женщин, и мы не можем объяснить, почему из шести сиблингов заболевание выявлено именно у трех братьев [1][3][6]. Важно отметить наличие у двух сиблингов, не страдающих БК, ревматоидного артрита и витилиго. Сочетание в одном поколении семьи трех различных аутоиммунных заболеваний представляет еще одну особенность настоящего наблюдения.
Представленное клиническое наблюдение демонстрирует особенности БК с семейной предрасположенностью, которые описаны в ряде исследований. Так, по мнению ряда авторов, для пациентов с БК, имеющих наследственную отягощенность, характерен более молодой возраст начала заболевания [11][12][13]. В представленных случаях БК манифестировала у трех братьев в подростковом возрасте. Локализация поражения может быть детерминирована определенными генами, а показатели конкордантности по локализации и течению заболевания в парах родственников с БК колеблются по разным данным от 16 до 86% [1]. Некоторые авторы считают, что для лиц с семейным анамнезом БК более характерны конкордантность локализации поражения и одновременное поражение тонкой и толстой кишки [13], хотя другие исследователи не поддерживают данное утверждение [1]. В описываемых случаях у сиблингов БК протекает в форме илеоколита с вовлечением в патологический процесс терминального отдела подвздошной, слепой и восходящей ободочной кишок.
ЗАКЛЮЧЕНИЕ
Таким образом, сходными признаками семейной формы БК в наших наблюдениях оказались молодой возраст начала заболевания и одинаковая локализация поражения (илеоколит). Отличием служит наличие осложнений, которые потребовали хирургического вмешательства у двух из трех братьев, у младшего брата заболевание протекает относительно благоприятно.
Наличие в семье пациента, страдающего БК, целесообразно рассматривать как довод в пользу проведения илеоколоноскопии при наличии клинической картины у родственника, что может сократить сроки установления правильного диагноза. Следует помнить о возможном сочетании различных аутоиммунных заболеваний в семьях пациентов, страдающих ВЗК.
ВКЛАД АВТОРОВ
А.В. Морковина внесла основной вклад в разработку концепции статьи, подготовила текст и согласна принять на себя от ветственность за все аспекты клинического наблюдения. Е.Ю. Юрьева, А.А. Шептулин осуществляли наблюдение и лечение пациентов и внесли существенный вклад в написание статьи. Т.Л. Лапина внесла существенный вклад в написание статьи. А.С. Тертычный проводил морфологическую диагностику и предоставил микрофотографии и их описание для статьи. П.В. Павлов проводил эндоскопические исследования пациентам. А.С. Тертычный и П.В. Павлов написали часть текста статьи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Anna V. Morkovina developed the concept of the article, wrote the text, and agreed to take responsibility for all aspects of the article. Elena Yu. Yuryeva and Arkady A. Sheptulin monitored and treated the patients, made a significant contribution to the writing of the article. Tatiana L. Lapina made a significant contribution to the writing of the article. Alexander S. Tertychnyy made histological investigations and provided histological images and their descriptions. Pavel V. Pavlov made endoscopic examinations. Alexander S. Tertychnyy and Pavel V. Pavlov wrote some parts of the manuscript. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Santos M.P.C., Gomes C., Torres J. Familial and Ethnic Risk in Inflammatory Bowel Disease. Ann Gastroenterol. 2018; 31(1): 14–23. https://doi.org/10.20524/aog.2017.0208 PMID: 29333063
2. Trier Moller F.T., Andersen V., Wohlfahrt J., Jess T. Familial risk of inflammatory bowel disease: a population-based cohort study 1977–2011. Am J Gastroenterol. 2015; 110(4): 564–71. https://doi.org/10.1038/ajg.2015.50 PMID: 25803400
3. Torres J., Mehandru S., Colombel J.F., Peyrin-Biroulet L. Crohn’s disease. Lancet. 2017; 389(10080): 1741–55. https://doi.org/10.1016/S0140-6736(16)31711-1 PMID: 27914655
4. Wang M.H., Picco M.F. Crohn’s Disease: Genetics Update. Gastroenterol Clin North Am. 2017; 46(3): 449–61. https://doi.org/10.1016/j.gtc.2017.05.002 PMID: 28838408
5. Silverberg M.S., Satsangi J., Ahmad T., et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol. 2005;19 Suppl A:5A–36A. https://doi.org/10.1155/2005/269076 PMID: 16151544
6. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И. и др. Клинические рекомендации по диагностике и лечению болезни Крона у взрослых (проект). Колопроктология. 2020; 19(2): 8–38. https://doi.org/10.33878/2073-7556-2020-19-2-8-38
7. Gomollón F., Dignass A., Annese V., et al. 3rd European Evidencebased Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis. 2017; 11(1): 3–25. https://doi.org/10.1093/eccojcc/jjw168 PMID: 27660341
8. Carbonnel F., Macaigne G., Beaugerie L., et al. Crohn’s disease severity in familial and sporadic cases. Gut. 1999; 44(1): 91–5. https://doi.org/10.1136/gut.44.1.91 PMID: 9862832
9. Henriksen M., Jahnsen J., Lygren I., et al. IBSEN Study Group Are there any differences in phenotype or disease course between familial and sporadic cases of inflammatory bowel disease? Results of a population-based follow-up study. Am J Gastroenterol. 2007; 102(9): 1955–63. PMID: 17573793
10. Ben-Horin S., Avidan B., Yanai H., et al. Familial clustering of Crohn’s disease in Israel: prevalence and association with disease severity. Inflamm Bowel Dis. 2009; 15(2): 171–5. https://doi.org/10.1002/ibd.20740 PMID: 18839423
11. Peeters M., Nevens H., Baert F., et al. Familial aggregation in Crohn’s disease: increased age-adjusted risk and concordance in clinical characteristics. Gastroenterology. 1996; 111(3): 597– 603. https://doi.org/10.1053/gast.1996.v111.pm8780562 PMID: 8780562
12. Annese V., Andreoli A., Astegiano M., et al. Italian Study Group for the Disease of Colon and Rectum Clinical features in familial cases of Crohn’s disease and ulcerative colitis in Italy: a GISC study. Am J Gastroenterol. 2001; 96(10): 2939–45. https://doi.org/10.1016/S0002-9270(01)03247-6 PMID: 11693330
13. Bengtson M.B., Solberg C., Aamodt G., et al. Clustering in Time of Familial IBD Separates Ulcerative Colitis from Crohn’s Disease. Inflamm Bowel Dis. 2009; 15(12): 1867–74. https://doi.org/10.1002/ibd.20978 PMID: 19434721
Об авторах
А. В. МорковинаРоссия
Морковина Анна Владимировна, клинический ординатор кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
+7 (961) 142-74-49
Е. Ю. Юрьева
Россия
Юрьева Елена Юрьевна, заведующая отделением гастроэнтерологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Университетской клинической больницы № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Т. Л. Лапина
Россия
Лапина Татьяна Львовна, канд. мед. наук, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
П. В. Павлов
Россия
Павлов Павел Владимирович, канд. мед. наук, заведующий отделением диагностической и лечебной эндоскопии Университетской клинической больницы № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
А. С. Тертычный
Россия
Тертычный Александр Семенович, д-р мед. наук, профессор кафедры патологической анатомии им. академика А.И. Струкова
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
А. А. Шептулин
Россия
Шептулин Аркадий Александрович, д-р мед. наук, профессор кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991







































