Перейти к:
Фактор роста эндотелия сосудов нивелирует усиление спонтанной трансдифференцировки классических и промежуточных моноцитов при ишемической кардиомиопатии
https://doi.org/10.47093/2218-7332.2025.16.1.20-33
Аннотация
Цель. Оценить влияние фактора роста эндотелия сосудов A (VEGF-A) на субпопуляционный состав моноцитов в культуре мононуклеаров крови у пациентов с ишемической болезнью сердца (ИБС) в зависимости от наличия ишемической кардиомиопатии (ИКМП).
Материалы и методы. Проведено одноцентровое экспериментальное исследование in vitro. В исследование включены 22 пациента с ИБС: 11 – с ИКМП, 11 – без ИКМП и 10 здоровых доноров. Мононуклеары крови выделяли из венозной крови иммуномагнитной сепарацией по антигенам CD14 и CD34, инкубировали без и с добавлением VEGF-A 50 нг/мл (контрольная и стимулированная пробы). Через 6 суток методом проточной цитофлуориметрии оценивали общее содержание моноцитов, долю классических CD14++CD16–, промежуточных CD14++CD16+, неклассических CD14+CD16++, переходных CD14+CD16– моноцитов.
Результаты. У пациентов с ИБС в обеих группах относительно здоровых доноров показано снижение содержания CD14++CD16+ в контрольной и стимулированной пробах. Только в группе ИБС с ИКМП относительно контрольной пробы после стимуляции VEGF-А установлено значимое увеличение всех CD14+: 10,63% (6,80; 17,64) vs. 15,28% (8,75; 27,99), р < 0,01, и их субпопуляций: CD14++CD16−: 6,08% (1,76; 8,84) vs. 8,57% (3,51; 16,8), р < 0,05, CD14++CD16+: 3,64% (2,03; 8,59) vs. 6,26% (3,87; 10,3), р < 0,05. В этой же группе отмечена тенденция к увеличению CD14+CD16++ после стимуляции: 0,19% (0,18; 1,11) vs. 0,61% (0,37; 1,58), р = 0,062. В группах ИБС без ИКМП и здоровых доноров не установлено различий содержания всех моноцитов и их субпопуляций после стимуляции VEGF-A. Содержание CD14+CD16– во всех группах пациентов в контрольной и стимулированной пробах не различалось.
Заключение. Для ИБС характерна недостаточность всех CD14+ клеток и промежуточных моноцитов ввиду их трансдифференцировки. VEGF-A влияет на субпопуляционный состав моноцитов при ИБС только при наличии ИКМП, увеличивая содержание всех CD14+ клеток, их промежуточных и классических форм без превышения показателей у здоровых доноров.
Ключевые слова
Сердечно-сосудистые заболевания являются одной из главных причин смертности в мире [1]. Несмотря на значительные достижения в области их консервативного и хирургического лечения, продолжается поиск новых терапевтических стратегий для пациентов с атеросклерозом. Так, индукция механизмов ангиогенеза стала привлекательной не только у пациентов с ишемией, но и у тех, кто перенес эндоваскулярное или открытое хирургическое вмешательство с целью профилактики рестеноза стента или трансплантата [2]. Фактор роста эндотелия сосудов A (vascular endothelial growth factor A – VEGF-A) стал одним из наиболее активно изучаемых сигнальных белков для стимуляции ангиогенеза у пациентов с атеросклерозом. На сегодняшний день используется не только рекомбинантный VEGF-A, но и препарат для пролонгированного синтеза in vivo – Неоваскулген® (Neovasculgen), который успешно применяется в терапии критической ишемии нижних конечностей [3].
VEGF-A представляет собой высококонсервативный секретируемый сигнальный белок, который связывается с рецепторами семейства VEGF-тирозинкиназы (receptors for vascular endothelial growth factor – VEGFR) 1-го и 2-го типов на поверхности эндотелиальных клеток. VEGFR2 стимулирует их пролиферацию, миграцию и выживаемость, в то время как VEGFR1 может действовать как рецептор-ловушка для VEGF-A [4]. Кроме того, VEGF-А может повышать проницаемость сосудов, приводя к инфильтрации сосудистой стенки моноцитами, или опосредовать развитие коллатералей путем привлечения и активации эндотелиальных клеток и моноцитов [4].
В настоящее время иммунофенотипически выделяют четыре субпопуляции моноцитов у человека – это классические, промежуточные, неклассические и переходные клетки. Большинство моноцитов в циркуляции представлены классическими CD14++CD16– моноцитами с ярко выраженными фагоцитирующими и провоспалительными свойствами. Эти свойства характерны и для CD14++CD16+ моноцитов (промежуточные клетки). Неклассические моноциты CD14+CD16++ имеют слабовыраженную способность к фагоцитозу, однако стимулируют процессы репарации, секретируя противовоспалительные цитокины и факторы роста [5]. Мало изучены переходные CD14+CD16– моноциты, вероятно, они являются предшественниками классических моноцитов или же дифференцируются из них [6]. При этом показано, что развитие ишемической болезни сердца (ИБС) и атеросклероза сопряжено с увеличением доли промежуточных моноцитов при уменьшении числа классических форм, и этот дисбаланс еще более усугубляется при остром коронарном синдроме и инфаркте миокарда [7][8], а при ишемической кардиомиопатии (ИКМП) – напротив, имеет место анергия дифференцировки моноцитов с дефицитом неклассических форм [9].
Несмотря на существующие данные о вовлеченности субпопуляций моноцитов в формирование ишемических расстройств при атеросклерозе, с одной стороны, и использование VEGF-A в лечении таковых – с другой стороны, до сих пор не изучено влияние VEGF-A на дифференцировку различных субпопуляций моноцитов, обладающих ангиопротективными или провоспалительными свойствами. Данный эффект может оказать значительное воздействие на течение заболевания при терапии VEGF-A.
Цель исследования: оценить влияние VEGF-A на субпопуляционный состав моноцитов в культуре мононуклеаров крови у пациентов с ИБС в зависимости от наличия ИКМП.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одноцентровое, экспериментальное исследование in vitro. Производился сплошной набор пациентов из числа госпитализированных в НИИ кардиологии – филиал Томского НИМЦ с 1 декабря 2022 по 31 мая 2023 г.
Необходимое число пациентов в подгруппах было определено на этапе планирования эксперимента по формуле ресурсов Мида для достижения числа степеней свободы компонента ошибки, равного 20. В процессе эксперимента объем выборки был увеличен согласно формуле Лера на основе пилотного анализа данных, полученных при исследовании числа больных, определенных формулой ресурсов Мида.
Набор пациентов
Потоковая диаграмма включения пациентов представлена на рисунке 1. Всего для участия в исследовании оценены 28 пациентов. Критерии невключения выявлены у 6 человек. В исследование включены 22 пациента с ИБС (19 мужчин и 3 женщины) в возрасте от 54 до 70 лет, в том числе 11 – с ИКМП и 11 – без ИКМП. В течение первых 4-х месяцев набрали 11 пациентов с ИБС без ИКМП и 8 пациентов с ИКМП. В течение последующих 2 месяцев в исследование включали только пациентов с ИКМП для увеличения объема выборки до расчетного значения (n = 11).
Критерии включения:
- возраст: от 18 до 70 лет;
- подписанное информированное согласие на участие в исследовании;
- инфаркт миокарда в анамнезе давностью более 6 месяцев;
- дополнительно для группы ИКМП – систолическая дисфункция левого желудочка (фракция выброса меньше 40%), сопровождающаяся одним или несколькими следующими признаками:
− инфаркт миокарда / реваскуляризация миокарда давностью не менее 6 месяцев;
− стеноз ствола левой коронарной артерии > 75 %;
− стеноз двух и более коронарных артерий > 75 % [10].
Критерии невключения:
- острые инфекционные заболевания менее чем за 3 недели до исследования (n= 2);
- аутоиммунные или аллергические заболевания в стадии обострения (n= 2);
- злокачественные опухоли (n= 1);
- вирусные гепатиты (n= 1);
- сифилис (n= 0);
- инфекция вируса иммунодефицита человека (n= 0);
- эритропоэз-стимулирующая (n= 1) или иммуносупрессивная (n = 1) терапия менее чем за 3 недели до исследования.
Группу сравнения составили 10 практически здоровых доноров (7 мужчин и 3 женщины), медиана возраста 57,5 (48,0; 65,5) года, не имеющих каких-либо заболеваний сердечно-сосудистой системы и жалоб соответствующего характера, подписавших информированное согласие на участие в исследовании (рис. 1).
Выделение мононуклеаров крови
Материалом исследования служила кровь из кубитальной вены в объеме 30 мл, взятая однократно утром натощак до физической нагрузки и проведения диагностических и лечебных процедур, стабилизированная гепарином (25 МЕ/мл).
Мононуклеары крови выделяли методом градиентного центрифугирования с помощью фиколла плотностью 1,077 г/см3 (ООО НПО «ПанЭко», Российская Федерация). После 2-кратной отмывки мононуклеаров 0,5% PBS (pH = 7,2) выполняли иммуномагнитную сепарацию с использованием антител CD14 MicroBeads и CD34 MicroBead Kit (“Miltenyi Biotec B.V. & Co. KG”, Германия), сепарационных колонок МS (“Miltenyi Biotec B.V. & Co. KG”, Германия) и магнита MiniMACS (“Miltenyi Biotec B.V. & Co. KG”, Германия) согласно инструкциям производителя. Доля CD14+ клеток (все моноциты) и CD34+ клеток (стволовые и прогениторные гемопоэтические клетки как потенциальные предшественники моноцитов, тоже присутствующие в крови) в культуре составляла 80–85 и 3–5% соответственно.
Жизнеспособность клеток определяли в тесте с 0,1% трипановым синим (ООО НПО «ПанЭко», Российская Федерация), при значении которой не менее 96% клетки вносили в 2 лунки 24-луночного планшета по 106 клеток в каждую. Инкубировали 6 суток в условиях 5% СО2 в полной питательной среде (питательная среда RPMI-1640 (ООО НПО «ПанЭко», Российская Федерация), эмбриональная телячья сыворотка, L-глутамин, пенициллин-стрептомицин) с добавлением в одну из лунок 50 нг/мл рекомбинантного VEGF-A человека (“Cloud-Clone Corp.”, США). Через 3 суток инкубации производили частичную замену среды и повторное внесение стимулятора в той же дозе. Пробу с рекомбинантным VEGF-A считали стимулированной, без VEGF-A – контрольной. Через 6 суток клетки снимали с поверхности планшетов с помощью инкубации их с 500 мкл 0,05% раствора трипсин-ЭДТА (ООО НПО «ПанЭко», Российская Федерация) на лунку в течение 5 мин при 37 °С. После отмывки клеток 500 мкл 0,5% PBS осадок ресуспендировали и клетки использовали для проточной цитофлуориметрии (рис. 2).
Определение субпопуляций моноцитов
Проточную цитофлуориметрию для определения субпопуляций моноцитов (CD14++CD16–, CD14++CD16+, CD14+CD16++, CD14+CD16–) в смешанной культуре мононуклеаров крови выполняли с использованием моноклональных антител CD14-FITC, CD16-PE согласно инструкциям производителя (“BD Biosciens”, США), погибшие клетки исключали из анализа с помощью окрашивания DAPI (“Wuhan Servicebio Technology Co., Ltd”, Китай).
Измерения интенсивности флуоресценции проводили на проточном цитометре “CytoFLEX” (“Beckman Coulter International S.A.”, США) с программным приложением “CytExpert 2.3” (“Beckman Coulter International S.A.”, США). Границы позитивности свечения меток устанавливали с помощью FMO (Fluorescence minus one control, флуоресценция минус один флуорохром), поскольку в работе использовалось также третье антитело (не представленное в настоящей публикации), однако детерминанты CD14 и CD16 оценены вне зависимости от экспрессии его лиганда. Оценивали долю позитивных по каждому маркеру клеток как долю от общего количества случаев, исключая область мелких объектов (FSC менее 100×104).
Статистический анализ
При описании результатов вычисляли медиану и интерквартильный размах (25-й и 75-й перцентили). Нормальность распределения проверяли с помощью критерия Колмогорова – Смирнова. Учитывая отклонение выборочных данных от нормального распределения, для сравнительного анализа применяли критерии Манна – Уитни (для независимых выборок) и Вилкоксона (для зависимых выборок) с введением поправки Бенджамини – Хохберга на множественное сравнение. Оценка статистической значимости различий относительных показателей проведена с помощью критерия хи-квадрат Пирсона. Рассчитаны коэффициенты корреляции Спирмена. Для оценки силы связи использовалась шкала Чеддока: при значениях коэффициента корреляции 0–0,3 связь оценена как очень слабая, 0,3–0,5 – слабая, 0,5–0,7 – средняя, 0,7–0,9 – сильная, 0,9–1 – очень сильная. Результаты статистического анализа считали значимыми при уровне р < 0,05. Статистический анализ выполнен с помощью программы “Statistica 10.0” (StatSoft Inc., США).
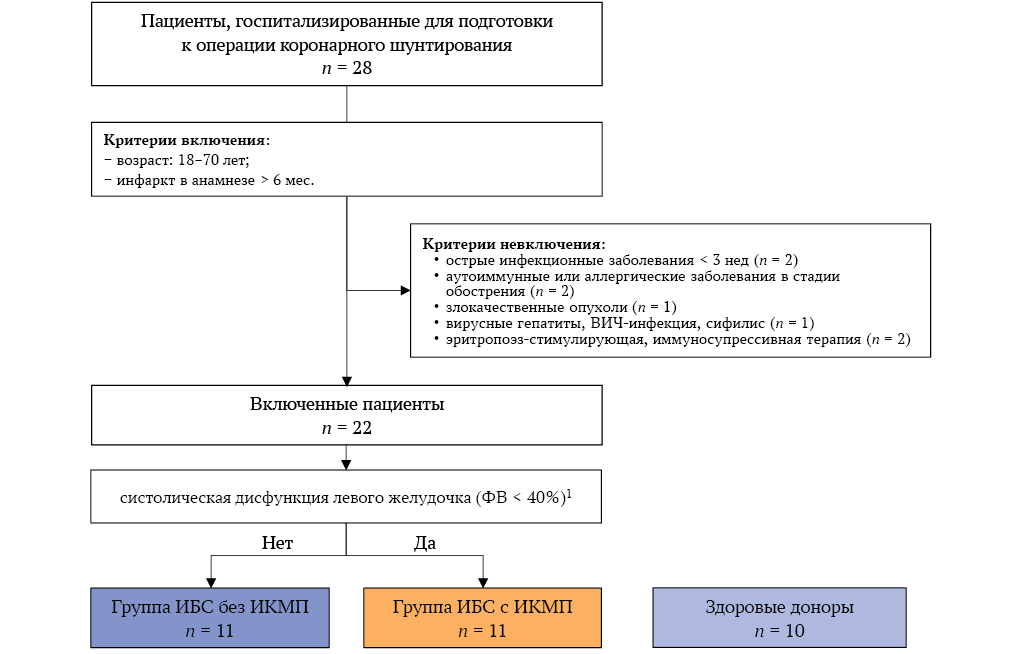
РИС. 1. Потоковая диаграмма включения пациентов в исследование.
Примечание: ВИЧ – вирус иммунодефицита человека; ИБС – ишемическая болезнь сердца; ИКМП – ишемическая кардиомиопатия; ФВ – фракция выброса.
1. Плюс ≥ 1 признак: реваскуляризация миокарда давностью > 6 мес.; стеноз ствола левой коронарной артерии >75%; стеноз двух и более коронарных артерий > 75%.
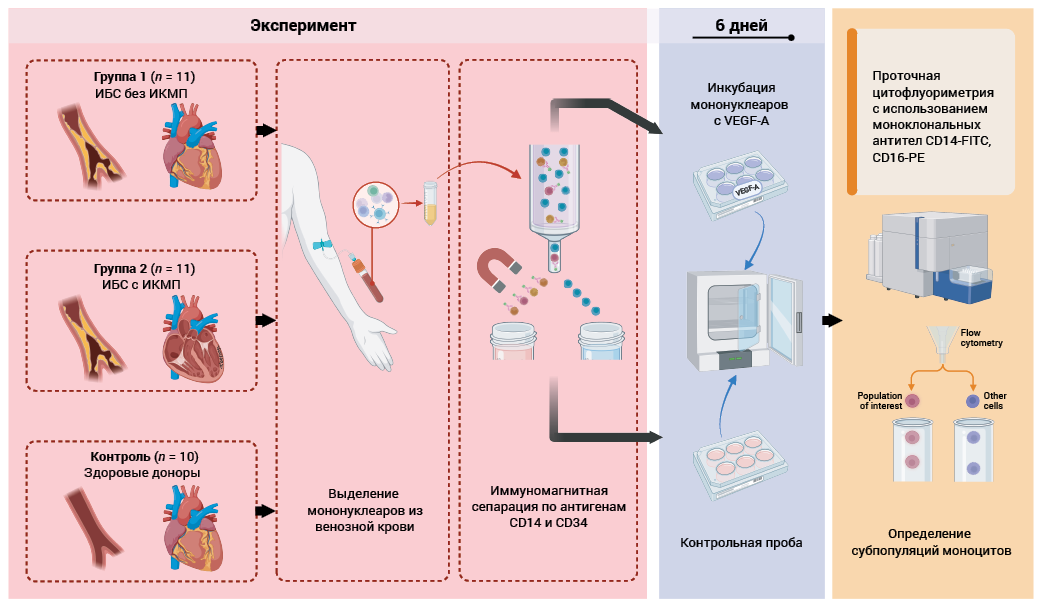
РИС. 2. Схема эксперимента.
Примечание: ИБС – ишемическая болезнь сердца; ИКМП – ишемическая кардиомиопатия; VEGF-A – vascular endothelial growth factor A, фактор роста эндотелия сосудов A.
Таблица 1. Исходные характеристики пациентов с ишемической болезнью сердца в исследованных группах
|
Признак |
Ишемическая болезнь сердца |
Значение р |
|
|
без ИКМП (n = 11) |
с ИКМП (n = 11) |
||
|
Мужчины, n (%) |
10 (91) |
11 (100) |
n.s. |
|
Женщины, n (%) |
1 (9) |
- |
n.s. |
|
Возраст, лет |
63,5 (58,0; 67,5) |
60,5 (56,5; 64,0) |
n.s. |
|
Стабильная стенокардия: |
|||
|
Класс II, n (%) |
2 (18) |
3 (27) |
n.s. |
|
Класс III, n (%) |
8 (73) |
7 (64) |
n.s. |
|
Класс IV, n (%) |
1 (9) |
1 (9) |
n.s. |
|
Фракция выброса левого желудочка, % |
59,25 (50,00; 67,50) |
30,50 (22,75; 36,50) |
<0,001 |
|
Сердечная недостаточность по NYHA |
|||
|
Класс I, n (%) |
2 (18) |
1 (9) |
n.s. |
|
Класс II, n (%) |
4 (36) |
7 (64)? |
n.s. |
|
Класс III, n (%) |
5 (46) |
3 (27) |
n.s. |
|
Препараты: |
|||
|
Пролонгированные нитраты, n (%) |
7 (64) |
6 (55) |
n.s. |
|
β1-адреноблокаторы, n (%) |
10 (91) |
9 (82) |
n.s. |
|
Блокаторы кальциевых каналов, n (%) |
7 (64) |
0 |
0,001 |
|
Ингибиторы АПФ, n (%) |
3 (27) |
5 (46) |
n.s. |
|
Антитромбоцитарные средства, n (%) |
8 (73) |
9 (82) |
n.s. |
|
Статины, n (%) |
9 (82) |
10 (91) |
n.s. |
Примечание: АПФ – ангиотензин-превращающий фермент; ИКМП – ишемическая кардиомиопатия; n.s. – not significant, не значимо; NYHA – New York heart association, Нью-Йоркская кардиологическая ассоциация.
Таблица 2. Содержание субпопуляций моноцитов в культуре мононуклеаров в контрольной пробе и стимулированной VEGF-А во всех исследованных группах
|
Содержание моноцитов |
Ишемическая болезнь сердца |
Здоровые доноры (n = 10) |
|||||||
|
без ИКМП (n = 11) |
с ИКМП (n = 11) |
||||||||
|
Контроль |
VEGF-A |
Значение р |
Контроль |
VEGF-A |
Значение р |
Контроль |
VEGF-A |
Значение р |
|
|
Все моноциты CD14+/++, % |
17,79 (7,15; 35,63) |
21,50 (7,15; 38,8) |
n.s. |
10,63 (6,80; 17,64)b |
15,28 (8,75; 27,99)а |
<0,01 |
40,42 (21,70; 47,62) |
41,25 (20,55; 46,69) |
n.s. |
|
Классические моноциты CD14++CD16−, % |
5,45 (2,13; 15,27) |
8,45 (3,23; 9,09) |
n.s. |
6,08 (1,76; 8,84) |
8,57 (3,51; 16,8) |
<0,05 |
10,72 (6,73; 2,04) |
10,66 (6,37; 12,31) |
n.s. |
|
Промежуточные моноциты CD14++CD16+, % |
9,12 (5,23; 23,06)a |
11,10 (4,60; 23,9)a |
n.s. |
3,64 (2,03; 8,59)b |
6,26 (3,87; 10,3)а |
<0,05 |
30,42 (13,36; 35,77) |
34,81 (13,73; 40,85) |
n.s. |
|
Неклассические моноциты CD14+CD16++, % |
0,86 (0,47; 1,28) |
1,06 (0,22; 1,81) |
n.s. |
0,19 (0,18; 1,11) |
0,61 (0,37; 1,58) |
0,062 |
0,92 (0,56; 1,27) |
0,89 (0,33; 1,45) |
n.s. |
|
Переходные моноциты CD14+CD16−, % |
2,90 (1,49; 4,47) |
2,23 (1,58; 4,59) |
n.s. |
2,48 (1,53; 4,80) |
2,40 (1,70; 3,51) |
n.s. |
2,53 (2,11; 4,78) |
2,49 (1,92; 6,204) |
n.s. |
Примечание: ИКМП – ишемическая кардиомиопатия; VEGF-A – vascular endothelial growth factor A, фактор роста эндотелия сосудов A; n.s. – not significant, не значимо;
a – p < 0,05 по сравнению с аналогичной пробой у здоровых доноров; b – p < 0,01 по сравнению с аналогичной пробой у здоровых доноров.
РЕЗУЛЬТАТЫ
Исходные характеристики пациентов
Пациенты с ИБС не различались по возрасту, полу и проводимой терапии в изученных группах (с и без ИКМП) (табл. 1). Пациентам с ИКМП не назначали блокаторы кальциевых каналов в связи с их отрицательным инотропным эффектом. Большинство пациентов в обеих группах имели стенокардию напряжения II–III функционального класса и недостаточность кровообращения II–III функционального класса по системе Нью-Йоркской кардиологической ассоциации (New York heart association, NYHA).
Влияние VEGF-A на состав субпопуляций моноцитов
Внесение VEGF-А в культуру мононуклеаров у здоровых доноров не приводило к изменениям как общей численности моноцитов, так и их субпопуляций. Обращает на себя внимание величина общей численности моноцитов в культуре, которая вне зависимости от наличия индуктора составила около 40% (табл. 2).
В пробах пациентов без ИКМП продемонстрировано 3-кратное уменьшение содержания промежуточных моноцитов CD14++CD16+ относительно группы здоровых доноров при сопоставимой с ней численности остальных иммунофенотипов моноцитов и их общего числа. Внесение VEGF-А в культуру мононуклеаров у этих пациентов так же, как у здоровых доноров, не влияло на общее количество моноцитов и их субпопуляций (табл. 2).
У пациентов с ИКМП, как и у пациентов без ИКМП, отмечалась недостаточность числа промежуточных моноцитов CD14++CD16+ в культуре мононуклеаров вне зависимости от наличия стимулятора. В пробах пациентов с ИКМП в отсутствие стимулятора регистрировался глубокий дефицит общего количества моноцитов (4-кратный) и промежуточных клеток CD14++CD16+ (10-кратный) относительно группы здоровых доноров. Эти два параметра под действием VEGF-А статистически значимо увеличивались по сравнению с контрольной пробой, хотя и не достигали значений здоровых доноров. В отличие от пациентов без ИКМП, содержание классических моноцитов CD14++CD16− у пациентов с ИКМП после инкубации с VEGF-А статистически значимо увеличивалось относительно пробы без стимулятора, становясь сопоставимым со значением в группе здоровых доноров (табл. 2).
Для численности неклассических CD14+CD16++ и переходных моноцитов CD14+CD16− в культуре клеток статистически значимых отличий между контрольной пробой и после стимуляции VEGF-А в изученных группах отмечено не было. Между тем только у пациентов с ИКМП регистрировалась отчетливая тенденция (р = 0,062) к увеличению доли неклассических моноцитов CD14+CD16++ в культуре клеток под влиянием VEGF-А относительно пробы без стимулятора (табл. 2).
Корреляция субпопуляций моноцитов с их общим количеством
(1) среди всех пациентов с ишемической болезнью сердца
Корреляционный анализ, проведенный среди всех пациентов с ИБС (как страдающих, так и не страдающих ИКМП), выявил сильную положительную связь общего количества моноцитов с долей промежуточных CD14++CD16+ и классических форм CD14++CD16− в контрольной пробе (рис. 3А); сила связи под действием VEGF-А не изменялась (рис. 3В). Между тем аналогичная по направлению и средняя по силе связь с количеством переходных моноцитов CD14+CD16− отмечалась в контрольной пробе и усиливалась в присутствии VEGF-А до очень сильной, а с численностью неклассических моноцитов CD14+CD16++ – умеренная по силе связь, характерная для нативной культуры мононуклеаров, под действием VEGF-А, напротив, становилась слабой (рис. 3С, 3D).
(2) В зависимости от наличия ишемической кардиомиопатии и стимуляции VEGF-А
Корреляционный анализ содержания субпопуляций моноцитов с их суммарным количеством выявил различный по силе характер взаимосвязей в зависимости как от наличия ИКМП, так и от стимуляции VEGF-А в культуре мононуклеаров (рис. 4).
Общим признаком для пациентов обеих групп и здоровых доноров была сильная положительная корреляция между суммарной численностью и долей промежуточных моноцитов в контрольной пробе (у всех категорий лиц) и под действием VEGF-А (в контроле и у пациентов без ИКМП). Особенностью пациентов с ИКМП являлась положительная сильная корреляция общего количества моноцитов с тремя их субпопуляциями (классическими, промежуточными, переходными) в отсутствие стимулятора, при добавлении которого корреляция с промежуточными формами исчезала. У пациентов без ИКМП, напротив, к положительной сильной корреляции общего количества моноцитов с классическими и промежуточными клетками в пробе без стимулятора добавлялась положительная сильная корреляции с переходными моноцитами при стимуляции VEGF-А (рис. 4).
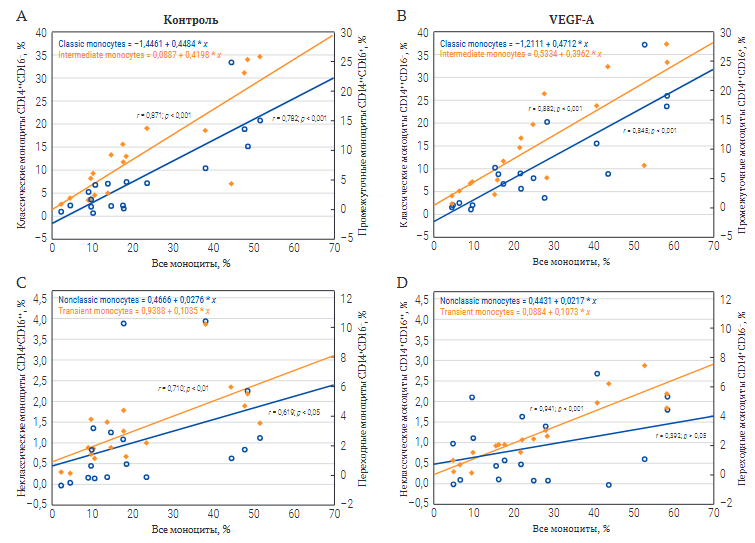
РИС. 3. Корреляция общего количества моноцитов в культуре с их отдельными субпопуляциями в контрольной пробе и стимулированной VEGF-А среди всех пациентов с ишемической болезнью сердца.
Примечание: VEGF-A – vascular endothelial growth factor A, фактор роста эндотелия сосудов A.
- Содержание классических CD14++CD16−и промежуточных CD14++CD16+ моноцитов в контрольной пробе.
- Содержание классических CD14++CD16−и промежуточных CD14++CD16+ моноцитов после стимуляции VEGF-А.
- Содержание неклассических CD14+CD16++ и переходных CD14+CD16−моноцитов в контрольной пробе.
- Содержание неклассических CD14+CD16++ и переходных CD14+CD16- моноцитов после стимуляции VEGF-А.
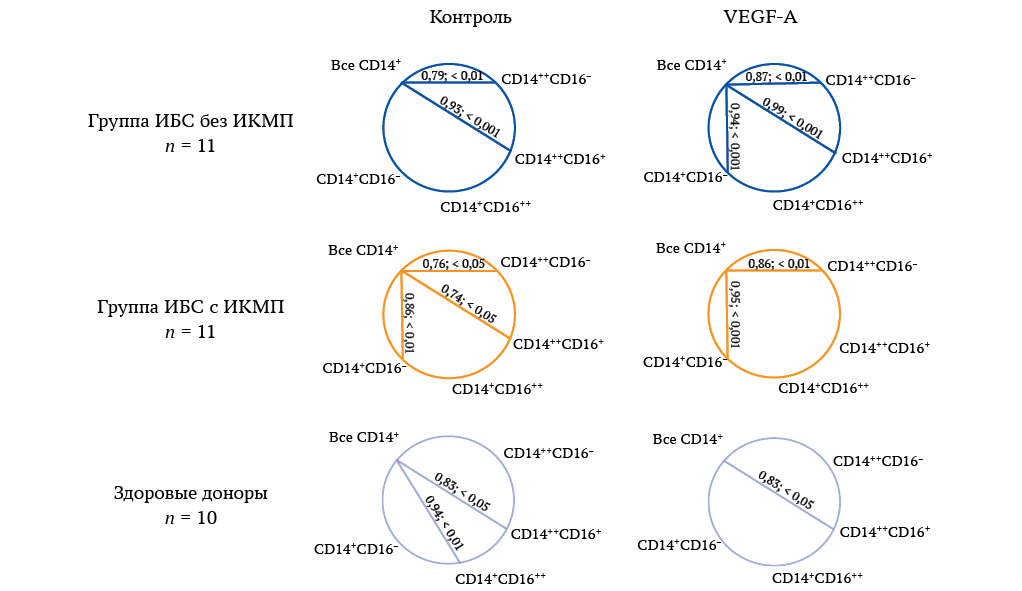
РИС. 4. Корреляция общего количества моноцитов в культуре с их отдельными субпопуляциями в контрольной пробе и стимулированной VEGF-А во всех исследованных группах.
Примечание: VEGF-A – vascular endothelial growth factor A, фактор роста эндотелия сосудов A; ИБС — ишемическая болезнь сердца; ИКМП — ишемическая кардиомиопатия; CD14++CD16– – классические моноциты; CD14++CD16+ – промежуточные моноциты; CD14+CD16++ –неклассические моноциты; CD14+CD16– – переходные моноциты.
ОБСУЖДЕНИЕ
Проведенное исследование выявило общую тенденцию для всех трех групп обследованных лиц: пациентов с ИБС без ИКМП, пациентов с ИКМП и здоровых доноров – низкое содержание CD14+ клеток после культивирования (относительно чистоты их выделения после сепарации перед началом культивирования) в пробах как содержащих, так и не содержащих VEGF-А. Учитывая, что, согласно методике, чистота выделения моноцитов составляла 80–85%, то после 6 суток культивирования у здоровых доноров таких клеток оставалось около 40%, а у пациентов с ИКМП – всего лишь 10–15%, хотя жизнеспособность клеток сохранялась не менее 96% (клетки живые, но не моноциты). Это объясняется высокой пластичностью моноцитов, которые могут дифференцироваться из одной субпопуляции моноцитов в другую, а также в макрофаги [11] и даже в фиброциты и фибробласты, не имеющие молекулы CD14 на своей поверхности [12]. Кроме того, немногочисленная фракция моноцитов, представляющая собой эндотелиальные прогениторные клетки CD14+CD34+VEGFR2+ (в крови 1–6%), может непосредственно дифференцироваться в эндотелиоциты, находясь в условиях эндотелиального (проангиогенного) микроокружения [13][14].
Примечательно, что у здоровых доноров моноциты при культивировании тоже подвергаются спонтанной трансдифференцировке (CD14+ остается всего 40%). У пациентов с ИБС без ИКМП этот процесс имеет тенденцию к большей выраженности (CD14+ около 18%), а у пациентов с ИКМП статистически значимо усилен (CD14+ только 10%). Последнее in vivo может быть патогенетическим фактором развития ИКМП, при которой обнаруживается диффузное фиброзирование жизнеспособного миокарда [15], вероятно, ввиду избыточной реактивности моноцитов в процессах их трансдифференцировки в фибробласты и фиброциты.
Исследование субпопуляционного состава моноцитов в нативной культуре мононуклеаров выявило отличия в содержании отдельных форм моноцитов у двух групп пациентов с ИБС. Так, в отсутствие ИКМП тенденция к снижению общей численности CD14+ клеток сопровождалась значимым уменьшением доли промежуточных моноцитов CD14++CD16+, а при ИКМП статистически значимое снижение числа CD14+ клеток сочеталось с глубоким дефицитом промежуточных моноцитов CD14++CD16+ и отчетливой тенденцией к недостаточности неклассических форм CD14+CD16++. Промежуточные и неклассические клетки являются активированными формами моноцитов, и их доля увеличивается при многих заболеваниях [16]. Вероятно, поэтому их численность в наибольшей степени уменьшалась при культивировании у пациентов обеих групп, определяя модуляцию общего количества моноцитов, что подтверждается положительной корреляцией этого показателя с долей промежуточных моноцитов CD14++CD16+ в обеих группах пациентов, а с долей неклассических CD14+CD16++ – только у здоровых доноров. Промежуточные клетки также показывают самую высокую продукцию активных форм кислорода в нестимулированном состоянии [16], а увеличение их количества повышает вероятность развития сердечно-сосудистых заболеваний [7–9][17].
Внесение VEGF-А в культуру мононуклеаров у пациентов с ИКМП позволило увеличить как общее содержание моноцитов, так и численность промежуточных CD14++CD16+ и классических форм CD14++CD16− относительно контрольной пробы. У пациентов с ИБС без ИКМП и здоровых доноров каких-либо изменений изучаемых показателей под действием VEGF-А не отмечалось. Так как основной причиной снижения количества моноцитов CD14+ при культивировании, по-видимому, является их трансдифференцировка в CD14– клетки (фиброциты, фибробласты, эндотелиоциты), можно предположить, что у пациентов с ИКМП добавление VEGF-А в культуру тормозит этот процесс и позволяет сохранить большее количество моноцитов промежуточного и классического иммунофенотипа.
Наиболее пластичными являются классические моноциты CD14++CD16− [11], которые после экстравазации участвуют в реализации врожденного иммунитета [11][18]. Соответственно, именно они должны демонстрировать наибольшее снижение количества в культуре, дифференцируясь в CD14– клетки. Однако нами было показано, что у пациентов с ИБС отмечается наибольший дефицит промежуточных моноцитов, в то время как дефицит классических выражен слабо. Это дает основания полагать, что именно промежуточные моноциты наиболее активно подвергаются трансдифференцировке при культивировании. При этом отсутствие различий в численности классических моноцитов CD14++CD16− в культуре пациентов с ИБС относительно здоровых доноров не противоречит данным об их высокой пластичности, поскольку в крови они являются преобладающей популяцией [9], а в культуре, напротив, преобладают промежуточные моноциты CD14++CD16+. Это позволяет предположить дифференцировку классических моноцитов при культивировании сначала в промежуточные формы, что было продемонстрировано in vivo [19], а далее их трансдифференцировку в немоноцитарные клетки. При этом убывание числа промежуточных форм несколько выше, чем классических, очевидно потому, что через 6 суток культивирования основная часть этих клеток уже перешла в промежуточные моноциты. Под действием VEGF-А дифференцировка и трансдиффференцировка моноцитов у пациентов замедляется. Этот неожиданный для моноцитов эффект VEGF-А, который обычно рассматривают в аспекте адаптации к гипоксии и ангиогенезу, но не моноцитопоэзу и воспалению, объясняется экспрессией на моноцитах провоспалительного VEGFR1 и проангиогенного VEGFR2 (5–10% моноцитов) [20]. Примечательно, что корректирующий эффект VEGF-А отмечался только у пациентов с ИКМП и отсутствовал у пациентов с ИБС без ИКМП и здоровых доноров. Возможно, это связано с гиперэкспрессией рецептора или усилением внутриклеточной трансдукции его сигнала за счет потенцирования через систему «цитохром P450 4A/F – 20-гидроксиэйкозатетраеновая кислота» при гипоксии [21], которая при ИКМП становится хронической из-за распространенной ишемии миокарда [14].
Показано, что устранение VEGF приводит к фрагментации митохондрий, подавлению клеточного метаболизма и гибели аутофагических клеток [21]. Эти эффекты были опосредованы фактором транскрипции FOXO (forkhead box protein), который индуцирует аутофагию, способствуя выживанию гемопоэтических стволовых клеток во время метаболического стресса. Воздействие VEGF на эндотелиальные культуры дезактивирует FOXO1 и тормозит клеточную гибель [22]. Если для классических и промежуточных моноцитов качество взаимосвязей принципиально не изменялось в присутствии и в отсутствие VEGF-А, то доля неклассических и переходных клеток в отсутствие этого фактора была взаимосвязана с общим количеством моноцитов, но в присутствии VEGF-А связь с переходными моноцитами усиливалась, а с неклассическими – исчезала. Кроме этого, отчетливая тенденция к 3-кратному увеличению
(р = 0,062) доли неклассических моноцитов в культуре у пациентов с ИКМП в присутствии VEGF-А подтверждает его способность тормозить трансдифференцировку и убывание числа неклассических моноцитов, что имеет благоприятное значение, поскольку эти клетки обладают протективными свойствами относительно эндотелия, устраняя с его поверхности иммунные комплексы и погибшие клетки; дефицит именно этих клеток отмечается в крови пациентов с ИКМП [9].
Согласно отличиям в корреляционной картине у трех групп обследованных лиц в присутствии и в отсутствие VEGF-А, при ИБС имеют место качественные нарушения реактивности моноцитов, в наибольшей степени выраженные при ИКМП, в виде дискоординации спонтанной трансдифференцировки классических, неклассических и переходных форм в ответ как на условия in vitro, так и на внесение VEGF-А. Способность промежуточных моноцитов к спонтанной трансдифференцировке усилена при ИБС вне зависимости от наличия ИКМП, но только при ИКМП она сопровождается уменьшением общего количества моноцитов в культуре и замедляется в присутствии VEGF-А.
Ограничения исследования и направления для дальнейших исследований
Результаты справедливы для пациентов Западно-Сибирского региона, имеющих инфаркт миокарда в анамнезе давностью не менее 6 месяцев и с многососудистым поражением коронарного русла. Данные о том, что VEGF-А нормализует субпопуляционный состав моноцитов, позволяют использовать VEGF-А для терапии ИБС с целью индукции ангиогенеза без риска усугубить течение атеросклероза. Сведения о наличии патологически усиленной трансдифференцировки моноцитов при ИБС можно использовать для поиска новых подходов к терапии этой патологии, способной нормализовать данный переход.
ЗАКЛЮЧЕНИЕ
Развитие ИБС вне зависимости от наличия ИКМП характеризуется снижением численности промежуточных моноцитов in vitro вследствие их спонтанной трансдифференцировки, что наиболее выражено при ИКМП и является патогенетическим фактором ее развития. Стимуляция мононуклеаров крови у пациентов с ИБС цитокином VEGF-A in vitro изменяет субпопуляционный состав моноцитов только при наличии ИКМП, тормозя их усиленную трансдифференцировку и предохраняя от чрезмерной убыли числа клеток классического, промежуточного и, в некоторой степени, неклассического иммунофенотипов, обусловливая протективный эффект VEGF-А. Одновременно с этим введение VEGF-А не приводит к избыточному накоплению клеток с провоспалительными свойствами (промежуточных и классических форм). При ИБС без ИКМП влияния на субпопуляционный состав моноцитов VEGF-А не оказывает, что создает потенциальную возможность его использования для лечения ИБС без риска усугубить атерогенез.
Список литературы
1. Kim S.J., Mesquita F.C.P., Hochman-Mendez C. New Biomarkers for Cardiovascular Disease. Tex Heart Inst J. 2023 Oct 16; 50(5): e238178. https://doi.org/10.14503/thij-23-8178. PMID: 37846107
2. Kastora S.L., Eley J., Gannon M., et al. What Went Wrong with VEGF-A in Peripheral Arterial Disease? A Systematic Review and Biological Insights on Future Therapeutics. J Vasc Res. 2022; 59(6): 381–393. https://doi.org/10.1159/000527079. Epub 2022 Nov 15. PMID: 36380643
3. Михайличенко В.Ю., Цатурян А.Б., Хизриев С.М. и др. Опыт применения терапевтического ангиогенеза препаратом «Неоваскулген» у пациентов с нешунтабельным поражением артерий нижних конечностей. Таврический медикобиологический вестник. 2022; 25(2): 55–60. EDN: FFLYZT
4. Wiszniak S., Schwarz Q. Exploring the Intracrine Functions of VEGF-A. Biomolecules. 2021 Jan 19; 11(1): 128. https://doi.org/10.3390/biom11010128. PMID: 33478167
5. Zhang H., Wang S.L., Sun T., et al. Role of circulating CD14++CD16+ monocytes and VEGF-B186 in formation of collateral circulation in patients with hyperacute AMI. Heliyon. 2023 Jun 29; 9(7): e17692. https://doi.org/10.1016/j.heliyon.2023.e17692. PMID: 37456037
6. Винс М.В., Чумакова С.П., Уразова О.И. и др. Субпопуляционный состав моноцитов крови и костного мозга у больных с хронической сердечной недостаточностью. Бюллетень сибирской медицины 2018; 17(4): 16–22. https://doi.org/10.20538/1682-0363-2018-4-16-22. EDN: VQWTMH /
7. Ruder A.V., Wetzels S.M.W., Temmerman L., et al. Monocyte heterogeneity in cardiovascular disease. Cardiovasc Res. 2023 Sep 5; 119(11): 2033–2045. https://doi.org/10.1093/cvr/cvad069. PMID: 37161473
8. Williams H., Mack C.D., Li S.C.H., et al. Nature versus Number: Monocytes in Cardiovascular Disease. Int J Mol Sci. 2021 Aug 24; 22(17): 9119. https://doi.org/10.3390/ijms22179119. PMID: 34502027
9. Чумакова С.П., Шипулин В.М., Уразова О.И., и др. Ишемическая кардиомиопатия: моноциты крови и медиаторы их дифференциации. Вестник Российской академии медицинских наук. 2019; 74(6): 396–404. https://doi.org/10.15690/vramn1185 EDN: MOGXIH
10. Felker G.M., Shaw L.K., O’Connor C.M. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002 Jan 16; 39(2): 210–218. https://doi.org/10.1016/s0735-1097(01)01738-7. PMID: 11788209
11. Orozco S.L., Canny S.P., Hamerman J.A. Signals governing monocyte differentiation during inflammation. Curr Opin Immunol. 2021 Dec; 73: 16–24. https://doi.org/10.1016/j.coi.2021.07.007. Epub 2021 Aug 16. PMID: 34411882
12. Pilling D., Fan T., Huang D., et al. Identification of markers that distinguish monocyte-derived fibrocytes from monocytes, macrophages, and fibroblasts. PLoS One. 2009 Oct 16; 4(10): e7475. https://doi.org/10.1371/journal.pone.0007475. PMID: 19834619
13. Денисенко О.А., Чумакова С.П., Уразова О.И. Эндотелиальные прогениторные клетки: происхождение и роль в ангиогенезе при сердечно-сосудистой патологии. Сибирский журнал клинической и экспериментальной медицины. 2021; 36(2): 23–29. https://doi.org/10.29001/2073-8552-2021-36-2-23-29. EDN: UJDHLQ
14. Chumakova S.P., Urazova O.I., Shipulin V.M., et al. Role of Angiopoietic Coronary Endothelial Dysfunction in the Pathogenesis of Ischemic Cardiomyopathy. Biomedicines. 2023 Jul 10; 11(7): 1950. https://doi.org/10.3390/biomedicines11071950. PMID: 37509589
15. Стельмашенко А.И., Беляева С.А., Карпов Р.М. и др.. Оценка состояния экстрацеллюлярного матрикса миокарда у пациентов с ишемической кардиомиопатией Морфологический альманах имени В.Г. Ковешникова. 2021; 19(4): 65–71. EDN: CPVJHJ
16. Williams H., Mack C., Baraz R., et al. Monocyte differentiation and heterogeneity: inter-subset and interindividual differences. Int J Mol Sci. 2023 May 15; 24(10): 8757. https://doi.org/10.3390/ijms24108757. PMID: 37240103
17. Rogacev K.S., Cremers B., Zawada A.M., et al. CD14++CD16+ monocytes independently predict cardiovascular events: a cohort study of 951 patients referred for elective coronary angiography. J Am Coll Cardiol. 2012 Oct 16; 60(16): 1512–1520. https://doi.org/10.1016/j.jacc.2012.07.019. Epub 2012 Sep 19. PMID: 22999728
18. Peet C., Ivetic A., Bromage D.I., et al. Cardiac monocytes and macrophages after myocardial infarction. Cardiovasc Res. 2020 May 1; 116(6): 1101–1112. https://doi.org/10.1093/cvr/cvz336. PMID: 31841135
19. Patel A.A., Zhang Y., Fullerton J.N., et al. The fate and lifespan of human monocyte subsets in steady state and systemic inflammation. J Exp Med. 2017 Jul 3; 214(7): 1913–1923. https://doi.org/10.1084/jem.20170355. Epub 2017 Jun 12. PMID: 28606987
20. Shantsila E., Wrigley B., Tapp L., et al. Immunophenotypic characterization of human monocyte subsets: possible implications for cardiovascular disease pathophysiology. J Thromb Haemost. 2011 May; 9(5): 1056–1066. https://doi.org/10.1111/j.1538-7836.2011.04244.x. PMID: 21342432
21. Chen L., Ackerman R., Saleh M., et al. 20-HETE regulates the angiogenic functions of human endothelial progenitor cells and contributes to angiogenesis in vivo. J Pharmacol Exp Ther. 2014 Mar; 348(3): 442–451. https://doi.org/10.1124/jpet.113.210120. Epub 2014 Jan 8. PMID: 24403517
22. Domigan C.K., Warren C.M., Antanesian V., et al. Autocrine VEGF maintains endothelial survival through regulation of metabolism and autophagy. J Cell Sci. 2015 Jun 15; 128(12): 2236–2248. https://doi.org/10.1242/jcs.163774. Epub 2015 May 8. PMID: 25956888
Об авторах
М. В. ГладковскаяРоссия
Гладковская Маргарита Вадимовна - очный аспирант и ассистент кафедры патофизиологии.
Московский тракт, д. 2., Томск, 634050
С. П. Чумакова
Россия
Чумакова Светлана Петровна, д-р мед. наук, доцент, профессор кафедры патофизиологии Сибирский ГМУ; профессор научно-образовательного центра «Стоматология» ФГАОУ ВО «Балтийский федеральный университет имени Иммануила Канта».
Московский тракт, д. 2, Томск, 634050; ул. Александра Невского, д. 14, Калининград, 236041
О. И. Уразова
Россия
Уразова Ольга Ивановна - д-р мед. наук, профессор, член-корр. РАН, заведующая кафедрой патофизиологии Сибирский ГМУ; ведущий научный сотрудник Научно-инжинирингового центра «Интеллектуальные системы доверенного взаимодействия» ФГАОУ ВО «Томский ГУ систем управления и радиоэлектроники».
Московский тракт, д. 2, Томск, 634050, пр. Ленина, д. 40, Томск, 634050
В. С. Полетика
Россия
Полетика Вадим Сергеевич - канд. мед. наук, доцент кафедры патофизиологии.
Московский тракт, д. 2, Томск, 634050
В. М. Шипулин
Россия
Шипулин Владимир Митрофанович - д-р мед. наук, профессор, заслуженный деятель науки РФ, главный научный сотрудник НИИ кардиологии.
Наб. р. Ушайки, д. 10, г. Томск, 634050
С. Л. Андреев
Россия
Андреев Сергей Леонидович, канд. мед. наук, врач – сердечно-сосудистый хирург, старший научный сотрудник отделения сердечно-сосудистой хирургии НИИ кардиологии.
Наб. р. Ушайки, д. 10, г. Томск, 634050
Дополнительные файлы

|
1. 1137-TREND чек-лист | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(377KB)
|
Метаданные ▾ | |
|
|
2. Graphic abstract | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(196KB)
|
Метаданные ▾ | |
Рецензия
Журнал "Сеченовский вестник". Лист редактора можно посмотреть здесь /
Sechenov Medical Journal. Editor's checklist you can find here
Название / Title | Фактор роста эндотелия сосудов нивелирует усиление спонтанной трансдифференцировки классических и промежуточных моноцитов при ишемической кардиомиопатии / Vascular endothelial growth factor attenuates enhanced spontaneous transdifferentiation of classical and intermediate monocytes in patients with ischemic cardiomyopathy |
Раздел / Section
| ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ / PATHOLOGICAL PHYSIOLOGY |
Тип / Article | Оригинальная статья / Original article |
Номер / Number | 1137 |
Страна/территория / Country/Territory of origin | Россия / Russia |
Язык / Language | Русский / Russian |
Источник / Manuscript source | Инициативная рукопись / Unsolicited manuscript |
Дата поступления / Received | 23.12.2024 |
Тип рецензирования / Type ofpeer-review | Двойное слепое / Double blind |
Язык рецензирования / Peer-review language | Русский / Russian
|
РЕЦЕНЗЕНТ А / REVIEWER A
Инициалы / Initials | 1137_А |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 15.03.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Данная рукопись посвящена актуальной проблеме – социально-значимой патологии – ишемической болезни сердца (ИБС), результаты лечения и профилактики которой до настоящего времени не удовлетворяют клиницистов.
Необратимая форма ИБС имеет высокий риск инвалидизации и неблагоприятных исходов. Выбранные авторами биомаркеры имеют высокую чувствительность к тканевой гипоксии, таким образом даже легкая ишемия может индуцировать их максимальный синтез в раннем периоде. Фенотипическая пластичность моноцитов и макрофагов способствует их привлекательности в качестве терапевтических мишеней.
Представленный материал показывает влияние ключевого фактора неоангиогенеза VEGF-A на изменение субпопуляционного состава моноцитов крови in vitro, что является новым. Результаты исследования in vitro являются первым шагом, позволяющим обозначить возможную новую терапевтическую стратегию. Выводы опираются на полученные результаты и не противоречат данным литературы. Список литературы содержит большинство источников последнего пятилетия.
Статья производит очень приятное впечатление, грамотно разработан дизайн эксперимента, подобраны группы, применяемые методы выделения моноцитов, типирования, культивирования, оценки результатов современны и
адекватны.
На мой взгляд, возможно было бы произвести расчет и обоснование минимально достаточной выборки, что 10–11 человек в каждой из групп достаточно для подтверждения статистической гипотезы.
РЕЦЕНЗЕНТ B / REVIEWER B
Инициалы / Initials | 1137_В |
Научная степень / Scientific degree | Доктор медицинских наук / Dr. of Sci. (Medicine) |
Страна/территория / Country/Territory | Россия / Russia |
Дата рецензирования / Date of peer-review | 28.02.2025 |
Число раундов рецензирования / Number of peer-review rounds | 1 |
Финальное решение / Final decision | принять к публикации / accept |
ПЕРВЫЙ РАУНД РЕЦЕНЗИРОВАНИЯ / FIRST ROUND OF PEER-REVIEW
Так как группа сердечно-сосудистых заболеваний занимает первое место по смертности среди прочих нозологий, тема исследования несомненно очень актуальна. Результаты исследования имеют практическую значимость для повышения эффективности лечения ишемической болезни сердца, в том числе, у пациентов со сниженной фракцией выброса.
Заключение обосновано корректно подобранными современными методами статистической обработки.
Приведенные авторами литературные источники соответствуют цели исследования. В списке из 22 источников приведены 13 источников за последние 5 лет (2020–2023 г. г).
Статья изложена грамотным русским языком, стиль изложения достаточно мягкий, автор не выдвигает безапелляционно свои выводы, а предпочитает рассуждающую манеру изложения, подтверждая сделанное по результатам статьи заключение обоснованными ссылками.







































