Перейти к:
Роль мезенхимных стромальных клеток и их секреторных продуктов в регенерации почек
https://doi.org/10.47093/2218-7332.2020.11.3.57-69
Аннотация
Заболевания почек представляют собой актуальную медицинскую проблему. Повреждение почек сопровождается окислительным стрессом и гибелью клеток, разрушением капилляров, воспалением и развитием фиброза. Мезенхимные стромальные клетки (МСК) оказывают комплексное влияние на восстановительный процесс путем продукции широкого спектра регуляторных молекул, в том числе в составе внеклеточных везикул, в связи с чем рассматриваются как перспективный ресурс для клеточной терапии заболеваний почек. Их ренопротективный эффект был показан на различных экспериментальных моделях, однако результаты клинических испытаний неоднозначны. Клиническое применение МСК затрудняется их низкой выживаемостью в микроокружении поврежденной почки, потенциальной иммуногенностью, туморогенностью и фиброгенностью. Перспективным направлением использования регенеративного потенциала МСК представляется бесклеточная терапия с применением их секреторных продуктов — кондиционированных сред или внеклеточных везикул. Однако внедрение МСК и их секреторных продуктов в медицинскую практику требует дальнейших исследований механизмов их прорегенеративного действия, совершенствования протоколов культивирования и проведения большего числа клинических испытаний.
Ключевые слова
Мезенхимные стромальные клетки (МСК) на протяжении трех последних десятилетий находятся в фокусе фундаментальных и прикладных биомедицинских исследований. Они присутствуют в большинстве тканей и органов, локализуясь по ходу кровеносных сосудов, обладают широким спектром потенций к дифференцировке и способны к паракринной секреции биологически активных веществ, оказывающих трофическое и регенеративное действие, что позволяет рассматривать их в качестве универсальных регуляторов тканевого гомеостаза и одного из наиболее перспективных ресурсов для регенеративной медицины.
Число клинических испытаний с использованием МСК за последние 25 лет составило уже более 950 [1]. В том числе имеются обнадеживающие результаты введения МСК пациентам с различными заболеваниями почек [2][3][4], представляющими собой актуальную медицинскую проблему ввиду широкой распространенности и трудностей лечения.
Для успешного применения МСК в терапии этих заболеваний необходимо знание механизмов влияния данных клеток на процессы, происходящие в поврежденных почках. Рассмотрение этих механизмов, а также перспектив применения МСК и продуктов их функциональной активности в клеточной терапии заболеваний почек является целью настоящего обзора.
Механизмы повреждения и регенерации почек
В настоящее время распространенность заболеваний почек во всем мире достигает 8–16%, причем около 2 миллионов пациентов находятся на заместительной почечной терапии, на диализе либо имеют трансплантат почки [5]. Острое повреждение почек может быть вызвано ишемией (вследствие низкого артериального давления, синдрома длительного сдавления, хирургических операций с пережатием почечных сосудов), воздействием нефротоксических веществ (в частности, антибиотиков и противоопухолевых препаратов) или обструкцией мочевыводящих путей, тогда как в основе хронического повреждения часто лежит сахарный диабет или артериальная гипертензия. Хроническая почечная недостаточность может быть следствием острых заболеваний почек, а также склеротического поражения почечных клубочков, аутоиммунных и инфекционных заболеваний [4][6]. В связи с пандемией коронавирусной инфекции COVID-19 особую актуальность приобретает проблема развивающегося у части пациентов и ассоциированного с высокой летальностью поражения почек вследствие как прямого нефротоксического действия вируса SARS-CoV-2, так и вызываемой им системной воспалительной реакции [7].
В эксперименте повреждение почек чаще всего моделируют временным пережатием сосудов с целью вызывать реперфузионное поражение [8, 9] или введением цитотоксического препарата цисплатина [10][11]. Известны и другие экспериментальные модели поражения почек. В частности, острое повреждение почек вызывают внутримышечным введением глицерина, которое, индуцируя рабдомиолиз и гемолиз, тем самым подвергает почки воздействию токсичных концентраций миоглобина и гемоглобина [12]. Для моделирования хронических заболеваний почек используют инъекции антибиотиков, обладающих нефротоксическим действием [13], одностороннюю перевязку мочеточника [14, 15] либо субтотальную нефрэктомию [16].
Повреждение почек сопровождается генерацией активных форм кислорода как клетками почечной паренхимы, так и инфильтрирующими иммунными клетками, что приводит к окислительному стрессу и гибели клеток путем некроза и апоптоза. В частности, показано, что ишемически-реперфузионное повреждение почек вызывает деградацию антиапоптотического белка Bcl 2 (B-cell lymphoma 2, белок В-клеточной лимфомы 2) и, как следствие, повышение частоты апоптоза; кроме того, наблюдается массовый некроз, а в сохранившихся клетках в течение нескольких дней после реперфузии остается нарушенным функционирование митохондрий.
«Сигналы опасности», высвобождаемые из клеток при некрозе (ядерные белки, дезоксирибонуклеиновая кислота, аденозинтрифосфорная кислота (АТФ), белки теплового шока, мочевая кислота), активируют иммунную систему, что приводит к усилению воспаления и усугубляет повреждение почечной паренхимы [17]. Кроме того, повреждение почек сказывается на состоянии их микроциркуляторного русла: перициты мигрируют из стенки капилляра в интерстиций, что приводит к гибели эндотелия и снижению плотности капиллярной сети [18]. Дисфункция эндотелия, лейкоцитарная инфильтрация и некроз могут приводить к изменению проницаемости сосудов, образованию микротромбов и развитию локальной ишемии, что, в свою очередь, вызывает дальнейшее повреждение ткани [17]. В случае хронического заболевания почек следствием длительно протекающего воспалительного процесса является фиброз, связанный с активацией фибробластов и индукцией эпителио-мезенхимного перехода в эпителиальных клетках [19], а также с дифференцировкой перицитов в миофибробласты [18].
Частичное восстановление поврежденных почечных структур — канальцев и в меньшей степени почечных телец — возможно благодаря наличию в почке клеток с характеристиками стволовых или родоначальных. В частности, клетки наружного слоя капсулы Боумена, расположенные в области сосудистого полюса — так называемые париетальные эпителиальные клетки, — способны дифференцироваться в подоциты, а их субпопуляция с фенотипом CD133+CD24+PDX– — также и в эпителий канальцев. Возможно, в поврежденной почке идет и обратный процесс дифференцировки подоцитов в париетальные эпителиальные клетки с их миграцией в наружный листок капсулы [20]. Другой потенциальный источник регенерации почечных телец — ренин-продуцирующие гладкомышечные клетки приносящих артериол, которые могут мигрировать в клубочек и дифференцироваться в подоциты, мезангиальные клетки, перициты и эритропоэтин-продуцирующие клетки [21]. Однако в целом регенеративный потенциал почечных телец невысок. Значительно большей способностью к регенерации обладает эпителий почечных канальцев. В проксимальных и дистальных извитых канальцах содержатся стволовые клетки с фенотипом CD133+CD24+CD106–, которые при повреждении канальца дифференцируются и замещают погибшие клетки этого же отдела нефрона, не мигрируя в другие его сегменты. Другой возможный механизм восстановления поврежденных канальцев — дедифференцировка зрелых эпителиальных клеток с их последующей пролиферацией и повторной дифференцировкой [20].
Повреждение почки сопровождается ее инфильтрацией макрофагами, которые обеспечивают утилизацию клеточного детрита и оказывают паракринное регуляторное влияние на окружающие клетки [17]. В регенерации участвуют также интерстициальные фибробласты. В ответ на повреждение эпителия они активируются и вступают в клеточный цикл. При подавлении этого процесса состояние почки ухудшается [22]. Показано, что после гибели эпителиальных клеток канальцев интерстициальные клетки мигрируют в область дефекта и, по-видимому, контролируют процесс дедифференцировки эпителиоцитов [23].
Мезенхимные стромальные клетки в нормальной и поврежденной почке
В почках, как и во многих других тканях и органах, содержатся стромальные клетки с характерным для МСК иммунофенотипом, способные к дифференцировке в различные мезенхимные производные. Подобные клетки были выделены различными авторами из почки как мыши [24][25][26][27], так и человека [28]. Они способны к самоподдержанию и клональному росту [27] и экспрессируют типичные маркеры МСК, такие как CD29, CD44, CD73, CD90, CD105, CD106, CD146, NG2 [24][25][26][27][28], а также нестин, характерный для многих тканеспецифических стволовых клеток [27][28]. Большинство авторов сообщают о способности этих клеток к дифференцировке в трех классических для МСК направлениях: остеогенном, адипогенном и хондрогенном [24][27][28]. Кроме того, по крайней мере некоторые из этих популяций МСК способны давать начало различным клеткам, присутствующим в почках: фибробластам, продуцирующим эритропоэтин [25], юкстагломерулярным клеткам [26], подоцитам [27][28], клеткам мезангия [28], а также эндотелиальным клеткам [25][28] и гладким миоцитам [25][26].
МСК локализуются в интерстиции почки в непосредственной близости от канальцев и, по некоторым данным, наиболее многочисленны в области сосочка [24][27]. Они встречаются также в клубочках [27][28] и в капсуле почки [29]. Присутствующие в почке МСК располагаются по ходу кровеносных сосудов и, повидимому, являются перицитами либо их малодифференцированной субпопуляцией [18]. В пользу этой гипотезы свидетельствует экспрессия почечными МСК маркеров периваскулярных клеток, в частности NG2 [27] и CD146 [28]. Вероятно, их функция в нормальной почке состоит прежде всего в стабилизации капилляров и поддержании тканевого гомеостаза [18]. В патологических условиях резидентные МСК могут принимать участие в регенерации, оказывая регуляторное влияние на эпителиальные клетки канальцев, подоциты и эндотелий, на что указывают результаты их трансплантации животным с поврежденными почками [8][13][25][27]. В эксперименте с флуоресцентно меченными клетками почечной капсулы была непосредственно показана их миграция в интерстиций в ответ на ишемическое повреждение почки. При этом удаление капсулы приводило к замедлению восстановления функций почки после ишемии [29].
По-видимому, в регенерацию почки вносят вклад не только резидентные МСК, но и мигрирующие из других тканевых источников. После системного введения МСК, выделенных из костного мозга, экспериментальным животным с поврежденными почками донорские клетки обнаруживаются в почечной паренхиме, что сопровождается улучшением функционального состояния органа [30][31]. Хемоаттрактантом для МСК служит фактор стромального происхождения-1 (SDF-1, Stromal cellderived factor-1), выделяемый клетками поврежденной почки и взаимодействующий с рецептором CXCR4 (C-X-C chemokine receptor type 4 или CD184) на поверхности МСК. Показано, что экспрессия этого рецептора усиливается под влиянием трансформирующего фактора роста-β (TGF-β, transforming growth factor-β), образующегося в почке при ишемии [32]. Еще одним механизмом, опосредующим направленную миграцию МСК в почку, служит взаимодействие CD44 с гиалуроновой кислотой. При введении экспериментальным животным МСК от мышей, лишенных CD44, а также при блокировании CD44 с помощью нейтрализующих антител или растворимой гиалуроновой кислоты, приживления донорских МСК в поврежденных почках не происходит [30].
Регенеративные эффекты мезенхимных стромальных клеток
Роль МСК в регенерации почек связана главным образом с их паракринным регуляторным влиянием на окружающие клетки, тогда как возможность их непосредственного участия в замещении погибших эпителиоцитов остается дискуссионной. Сведения о способности МСК давать начало почечному эпителию неоднозначны: одни авторы сообщают, что эти клетки могут быть индуцированы к нефрогенной дифференцировке in vitro [33], а после введения животным с поврежденными почками они включаются в канальцы и начинают экспрессировать эпителиальные маркеры [24], однако другие исследователи не обнаруживают включения МСК в канальцы, несмотря на оказываемый ими терапевтический эффект [34]. В связи с тем, что острое повреждение почек сопровождается массовой гибелью клеток, один из важнейших механизмов регенеративного действия МСК связан с их способностью предотвращать апоптоз, которая была показана на моделях как токсического поражения почек [35], так и ишемии-реперфузии [9, 27, 34], а также диабетической нефропатии [36]. Цитопротективное действие МСК проявляется также в снижении окислительного стресса, о чем свидетельствует повышение уровня глутатиона и активности супероксиддисмутазы, а также снижение содержания малондиальдегида и других маркеров оксидативного повреждения в ткани почки [9][10]. Показано, что МСК восстанавливают энергетику и усиливают антиоксидантную защиту клеток почечных канальцев, устраняя вызванную повреждением митохондриальную дисфункцию. Они не только способствуют сохранению структурной целостности и функциональности митохондрий в клетках почки и стимулируют их восстановление, но и, соединяясь с этими клетками цитоплазматическими выростами, передают им собственные митохондрии. Результатом улучшения функции митохондрий становится усиление синтеза АТФ, уменьшение окислительного стресса и предотвращение апоптотической гибели клеток [37].
Другой механизм, с помощью которого МСК ускоряют восстановление структуры и функции почек, связан со стимуляцией пролиферации эпителия канальцев [10, 34]. Впрочем, остается не вполне ясным, воздействуют ли МСК на зрелые эпителиоциты, вызывая их дедифференцировку и пролиферацию, или же мишенью их митогенного эффекта являются стволовые либо родоначальные клетки почечного эпителия [20].
МСК, введенные животным с повреждением почек, препятствуют снижению плотности капиллярной сети и улучшают почечную перфузию, предотвращая атрофию канальцев вследствие недостаточного кровоснабжения [38]. Главным образом это связано с продукцией ими факторов, стимулирующих ангиогенез, прежде всего фактора роста сосудистого эндотелия (VEGF, vascular endothelial growth factor) [9], но нельзя исключить и непосредственную дифференцировку МСК в эндотелий и гладкомышечные клетки сосудов [34].
Иммуномодулирующие свойства МСК проявляются в том, что под их влиянием уменьшается инфильтрация поврежденной почки нейтрофилами и макрофагами [13][19][38], но повышается содержание в ней T-регуляторных клеток [35]; кроме того, фенотип макрофагов изменяется c провоспалительного M1 на противовоспалительный М2 [13]. При этом в ткани почки снижается уровень провоспалительных цитокинов (таких как интерлейкин-1β (IL, interleukin), IL-6, фактор некроза опухолей-α (TNF-α, tumor necrosis factor-α), интерферон-γ), а содержание факторов, подавляющих воспаление (IL-4, IL-10, эпидермальный фактор роста (EGF, epidermal growth factor), основной фактор роста фибробластов (bFGF, basic fibroblast growth factor)), напротив, повышается [9][35].
На различных моделях повреждения почек была неоднократно показана способность МСК предотвращать развитие фиброза. Сообщалось, что введение этих клеток уменьшает отложение внеклеточного матрикса в интерстиции и клубочках [13][14][15][19], а также экспрессию α-гладкомышечного актина (α-SMA, α-smooth muscle actin), являющегося маркером миофибробластов [15]. В экспериментах на культурах мезангиальных клеток было показано, что их дифференцировка в миофибробласты в присутствии МСК подавляется [39]. Механизмы антифибротического действия МСК могут быть связаны с уменьшением воспаления, ведущего к активации пролиферации фибробластов, и с подавлением сигнальных путей, опосредующих эпителио-мезенхимный переход в клетках канальцев, прежде всего TGF-β/Smad3. В частности, сообщалось, что в почках животных с диабетической нефропатией под влиянием трансплантированных МСК снижается экспрессия TGF-β и сохраняется экспрессия белков плотных контактов, свидетельствующая о поддержании эпителиального фенотипа клеток канальцев [19].
Однако влияние МСК на фиброгенез в почках не столь однозначно. Эти клетки способны давать начало миофибробластам, и высказываются опасения, что провоспалительное и профибротическое микроокружение поврежденной почки может индуцировать их дифференцировку в этом направлении [5]. Имеются данные об участии трансплантированных МСК костного мозга в развитии фиброза у крыс после ишемического повреждения почек [40], а также о быстром прогрессировании хронического заболевания почек с развитием гломерулосклероза и интерстициального фиброза у пациента после трансплантации аутологичных МСК из жировой ткани [41]. Все это заставляет с осторожностью относиться к перспективам применения МСК в лечении заболеваний почек.
Основные результаты исследований влияния МСК на состояние поврежденных почек экспериментальных животных суммированы в таблице 1.
Таблица 1. Ренопротективные эффекты мезенхимных стромальных клеток в экспериментальных исследованиях
Table 1. Renoprotective effects of mesenchymal stromal cells in experimental studies
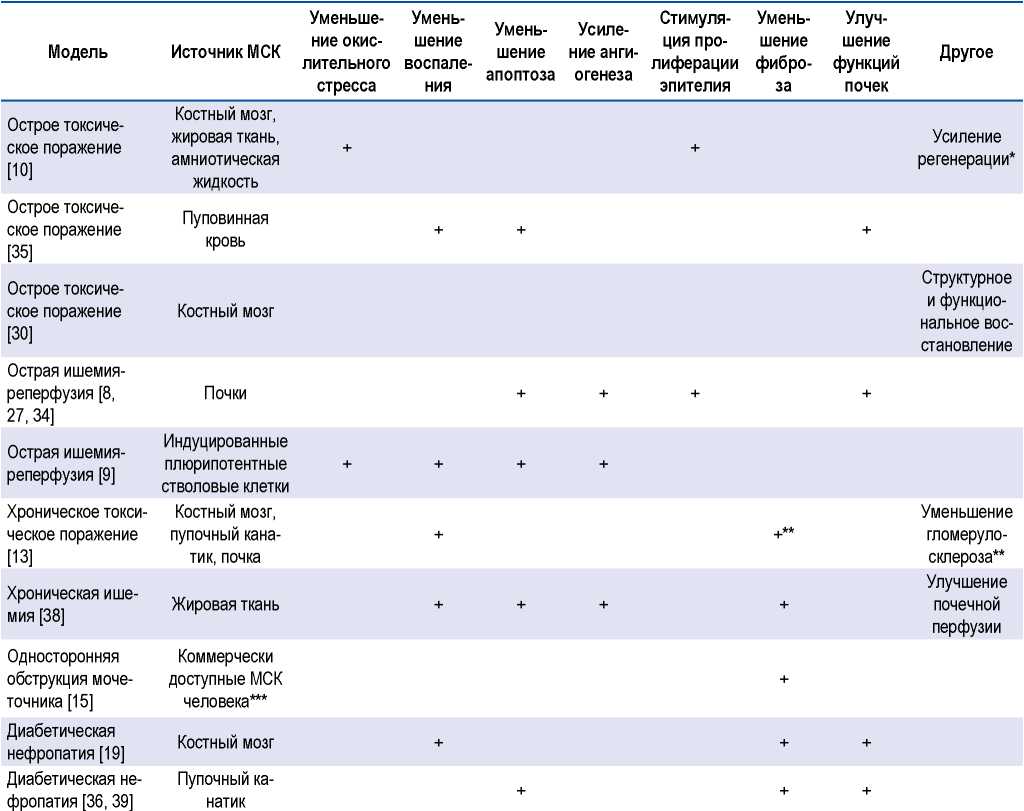
Примечание. * Наиболее эффективны МСК амниотической жидкости, наименее — МСК жировой ткани.
** Наиболее эффективны МСК пупочного канатика.
*** Тканевой источник МСК не указан.
Note. * Amniotic fluid MSCs are the most effective, and adipose tissue MSCs are the least effective.
** Umbilical cord MSCs are the most effective.
*** The tissue source of MSCs is not specified.
Секреторные продукты мезенхимных стромальных клеток как ресурс для регенерации почек
Возможное фиброгенное действие МСК — не единственное препятствие на пути к их широкому применению в лечении заболеваний почек. Несмотря на очевидные преимущества МСК, такие как доступность тканевых источников, легкость выделения и культивирования, высокая способность к размножению in vitro и отсутствие этических ограничений на их использование [5], клиническое применение этих клеток сопряжено с рядом проблем. Прежде всего это низкая выживаемость трансплантированных клеток в неблагоприятных условиях очага поражения, в значительной мере ограничивающая их терапевтический потенциал [42]. Вероятно, именно с этой причиной связана неоднозначность результатов клинических испытаний клеточной терапии заболеваний почек с использованием МСК (табл. 2). Наряду с данными об улучшении функций почек после введения этих клеток больным с хроническими заболеваниями почек [4], атеросклерозом почечных сосудов [3] и диабетической нефропатией [2] имеются и сообщения об отсутствии существенного эффекта МСК у пациентов с острым повреждением почек [43], волчаночным нефритом [44] и аутосомно-доминантной поликистозной болезнью почек [45].
Таблица 2. Основные результаты введения мезенхимных стромальных клеток пациентам с заболеваниями почек
Table 2. The main results of administration of mesenchymal stromal cells in patients with kidney diseases

Предпринимаются попытки повысить жизнеспособность МСК путем их прекондиционирования (факторами роста, цитокинами, гипоксией) или генетической модификации [5][42], однако нельзя сбрасывать со счетов и такие проблемы, как риск отторжения аллогенных клеток иммунной системой реципиента, а также потенциальную туморогенность МСК, которая может усугубляться под влиянием уремических токсинов [11].
С учетом всего вышесказанного наиболее перспективным направлением использования регенеративного потенциала МСК представляется бесклеточная терапия с применением их секреторных продуктов. Она возможна благодаря тому, что прорегенеративные эффекты МСК в значительной степени связаны с выделением ими разнообразных биологически активных веществ, влияющих на локальное клеточное окружение. Это, в частности, регулирующие деятельность иммунной системы IL-6, IL-8, моноцитарный хемотаксический белок-1 (MCP-1, monocyte chemotactic protein-1) и TGF-β; тканевые ингибиторы металлопротеиназ, участвующие в ремоделировании внеклеточного матрикса; VEGF, фактор роста гепатоцитов (HGF, hepatocyte growth factor), инсулиноподобный фактор роста-1 (IGF-1, insulin-like growth factor-1) [6]. Ренопротективным действием обладают также продуцируемые МСК: тромбоцитарный фактор роста (PDGF, platelet-derived growth factor), EGF, костный морфогенетический белок-7 (BMP-7, bone morphogenetic protein-7) [20]. Помимо растворимых факторов, секрет МСК включает различные популяции внеклеточных везикул, которые в настоящее время рассматриваются как одно из важнейших средств межклеточной коммуникации. Прежде всего это микровезикулы, отпочковывающиеся от плазмалеммы, и экзосомы, образующиеся из эндосом. Везикулы обоих типов содержат белки, в том числе цитокины и факторы роста, и нуклеиновые кислоты, такие как мРНК и микро-РНК. Связываясь с рецепторами на поверхности клеток-мишеней или доставляя свое содержимое непосредственно в их цитоплазму путем слияния с плазматической мембраной, продуцируемые МСК внеклеточные везикулы оказывают регуляторное действие на различные ткани и органы, в том числе стимулируют их регенерацию после повреждения [46].
С точки зрения удобства и безопасности клинического использования кондиционированные МСК среды, содержащие совокупность выделенных ими растворимых факторов и внеклеточных везикул, имеют ряд преимуществ перед культурами клеток: их получение не требует длительного наращивания клеточной массы, способного привести к старению культур и снижению их терапевтической эффективности, облегчаются стандартизация и хранение полученных препаратов, устраняется проблема гибели клеток под влиянием патологического микроокружения, снимается риск злокачественной трансформации вводимых МСК или их нежелательной дифференцировки в организме реципиента (в частности, в миофибробласты). На различных экспериментальных моделях повреждения почек было показано, что введение животным среды, кондиционированной МСК, оказывает эффект, сопоставимый с таковым при трансплантации клеток, от которых эта среда была получена [13][19]. Так, кондиционированная МСК среда подавляла гибель клеток, воспаление и фиброгенез при токсическом повреждении почек [13], ишемии-реперфузии [27] и диабетической нефропатии [19] и замедляла прогрессирование хронической болезни почек, в частности, уменьшая повреждение эндотелия клубочков [16].
Следующий шаг на пути перехода от клеточной терапии к бесклеточной — использование внеклеточных везикул, полученных от МСК. Как и в случае кондиционированных сред, введение экспериментальным животным с повреждениями почек очищенной фракции внеклеточных везикул воспроизводит эффект самих МСК [8], а в некоторых отношениях даже превосходит его [14]. При этом, сохраняя все преимущества кондиционированных МСК сред, внеклеточные везикулы эффективнее их защищают почки от острого повреждения, вероятно, за счет более высокой концентрации действующих веществ [47].
Полученные от МСК внеклеточные везикулы улучшают состояние поврежденных почек, предотвращая окислительный стресс [48] и апоптотическую гибель клеток [8][19][48], стимулируя пролиферацию эпителиоцитов канальцев [12], увеличивая плотность капиллярной сети [48], подавляя воспаление [19] и развитие фиброза [14][48]. Эти эффекты были показаны на экспериментальных моделях токсического повреждения почек [12], ишемии-реперфузии [8], реноваскулярной болезни [48], диабетической нефропатии [19], односторонней обструкции мочеточника [14]. Имеются и данные клинических испытаний, согласно которым введение внеклеточных везикул от МСК из пупочного канатика пациентам с хроническими заболеваниями почек приводило к повышению скорости клубочковой фильтрации, а также снижению уровня мочевины в крови и креатинина в сыворотке; при этом в плазме крови повышалось содержание противовоспалительного цитокина IL-10 и обладающего иммуносупрессивным действием TGF-β, тогда как уровень провоспалительного цитокина TNF-α снижался [49].
Ренопротективное действие обнаружено как у экзосом [12][19], так и у микровезикул [14], полученных от МСК, но по крайней мере в некоторых случаях экзосомы обладают более выраженным влиянием на поврежденные почки, чем микровезикулы. Так, при введении мышам с острым токсическим повреждением почек экзосом от МСК из костного мозга было отмечено усиление пролиферации клеток канальцев, тогда как микровезикулы от тех же клеток подобного эффекта не оказывали [12].
Влияние продуцируемых МСК внеклеточных везикул на регенерацию почек опосредовано главным образом содержащимися в них молекулами РНК. Показано, что обработка везикул рибонуклеазой отменяет их терапевтический эффект [8]. В везикулах, выделяемых МСК, обнаружен широкий спектр микро-РНК, влияющих на патофизиологические процессы в почках (miR-21, -199, -30, -29, -145, -210, -22, -125b, -130a, -23a, -15a/15b/16, семейство let-7), а также различные мРНК, которые могут быть непосредственно доставлены в цитоплазму клеток-мишеней с последующей трансляцией в функционально активные белки. Очевидно, определенный вклад в ренопротективное действие этих везикул вносят и присутствующие в них цитокины и факторы роста, в частности HGF, VEGF, IL-10 и другие регуляторные белки, контролирующие ангиогенез, ремоделирование внеклеточного матрикса, воспалительные реакции и апоптоз [50]. Молекулярные механизмы прорегенеративных эффектов различных компонентов секретома МСК в отношении поврежденных почек в настоящее время продолжают уточняться.
Данные о ренопротективном действии секреторных продуктов МСК, полученные на различных экспериментальных моделях и в клинических испытаниях, приведены в таблице 3.
Таблица 3. Ренопротективные эффекты секреторных продуктов мезенхимных стромальных клеток
Table 3. The renoprotective effects of secretory products of mesenchymal stromal cells

ЗАКЛЮЧЕНИЕ
Результаты многочисленных исследований, посвященных оценке ренопротективных эффектов МСК на различных экспериментальных моделях острого или хронического повреждения почки, свидетельствуют о комплексном влиянии этих клеток на восстановительный процесс, включающем предотвращение гибели и стимуляцию пролиферации резидентных клеток, иммуномодуляцию, улучшение васкуляризации и регуляцию отложения внеклеточного матрикса. Таким образом, МСК создают в почке прорегенеративное микроокружение, препятствующее деструктивным изменениям под действием повреждающих факторов и способствующее полноценному восстановлению структуры и функций органа. По данным ряда сравнительных исследований, наибольшей терапевтической эффективностью в отношении заболеваний почек характеризуются МСК из пуповины и амниотической жидкости, однако ренопротективный эффект показан также и для клеток из других клинически значимых источников, прежде всего костного мозга и жировой ткани.
Свое благотворное влияние на состояние поврежденных почек МСК осуществляют главным образом путем паракринной секреции разнообразных биологически активных веществ, как в виде растворимых молекул, так и в составе внеклеточных везикул. Все это позволяет надеяться на успешное применение МСК и в еще большей степени продуктов их секреторной активности, прежде всего внеклеточных везикул, в лечении заболеваний почек различной этиологии. В частности, не исключено, что данный подход окажется полезным и при лечении последствий поражения почек при коронавирусной инфекции, ставшей в настоящее время одной из актуальнейших медицинских проблем. Однако внедрение МСК и их секреторных продуктов в клиническую практику требует дальнейших исследований, направленных на выяснение клеточных и молекулярных механизмов их прорегенеративного действия. Кроме того, необходимо совершенствование протоколов культивирования клеток с целью максимального сохранения, а возможно, и усиления их терапевтического потенциала, а также проведение большего числа клинических испытаний для подтверждения безопасности и эффективности клеточной или бесклеточной терапии с использованием МСК.
ВКЛАД АВТОРОВ
О.В. Паюшина и Д.А. Цомартова участвовали в написании текста рукописи. Е.В. Черешнева, М.Ю. Иванова, Т.А. Ломановская выполняли поиск и анализ литературы по теме обзора. С.Л. Кузнецов разработал общую концепцию статьи и осуществлял руководство ее написанием. Все авторы участвовали в обсуждении и редактировании работы. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Olga V. Payushina and Dibakhan A. Tsomartova participated in writing the text of the manuscript. Elizaveta V. Chereshneva, Marina Yu. Ivanova, and Tatyana A. Lomanovskaya searched and analyzed the literature on the topic of the review. Sergey L. Kuznetsov developed the general concept of the article and supervised its writing. All authors participated in the discussion and editing of the work. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Pittenger MF, Discher DE, Péault BM et al. Mesenchymal stem cell perspective: cell biology to clinical progress. NPJ Regen Med. 2019; 4: 22. DOI: 10.1038/s41536-019-0083-6
2. Packham DK, Fraser IR, Kerr PG, Segal KR. Allogeneic mesenchymal precursor cells (MPC) in diabetic nephropathy: a randomized, placebo-controlled, dose escalation study. EBioMedicine. 2016; 12: 263–9. DOI:10.1016/j.ebiom.2016.09.011
3. Saad A, Dietz AB, Herrmann SMS et al. Autologous mesenchymal stem cells increase cortical perfusion in renovascular disease. J Am Soc Nephrol. 2017; 28(9): 2777–85. DOI: 10.1681/ASN.2017020151
4. Villanueva S, González F, Lorca E et al. Adipose tissue-derived mesenchymal stromal cells for treating chronic kidney disease: A pilot study assessing safety and clinical feasibility. Kidney Res Clin Pract. 2019; 38(2): 176–85. DOI: 10.23876/j.krcp.18.0139
5. Fan M, Zhang J, Xin H et al. Current perspectives on role of MSC in renal pathophysiology. Front Physiol. 2018; 9: 1323. DOI: 10.3389/fphys.2018.01323.
6. Peired AJ, Sisti A, Romagnani P. Mesenchymal stem cell-based therapy for kidney disease: a review of clinical evidence. Stem Cells Int. 2016; 2016: 4798639. DOI:10.1155/2016/4798639
7. Martinez-Rojas MA, Vega-Vega O, Bobadilla NA. Is the kidney a target of SARS-CoV-2? Am J Physiol Renal Physiol. 2020; 318(6): F1454–62. DOI: 10.1152/ajprenal.00160.2020
8. Ranghino A, Bruno S, Bussolati B et al. The effects of glomerular and tubular renal progenitors and derived extracellular vesicles on recovery from acute kidney injury. Stem Cell Res Ther. 2017; 8(1): 24. DOI: 10.1186/s13287-017-0478-5
9. Ko SF, Chen YT, Wallace CG et al. Inducible pluripotent stem cell-derived mesenchymal stem cell therapy effectively protected kidney from acute ischemia-reperfusion injury. Am J Transl Res. 2018; 10(10): 3053–67
10. Ashour RH, Saad MA, Sobh MA et al. Comparative study of allogenic and xenogeneic mesenchymal stem cells on cisplatin-induced acute kidney injury in Sprague-Dawley rats. Stem Cell Res Ther. 2016; 7(1): 126. DOI: 10.1186/s13287-016-0386-0
11. Večerić-Haler Ž, Cerar A, Perše M. (Mesenchymal) stem cell-based therapy in cisplatin-induced acute kidney injury animal model: risk of immunogenicity and tumorigenicity. Stem Cells Int. 2017; 2017: 7304643. DOI: 10.1155/2017/7304643
12. Bruno S, Tapparo M, Collino F et al. Renal regenerative potential of different extracellular vesicle populations derived from bone marrow mesenchymal stromal cells. Tissue Eng Part A. 2017; 23(21–22): 1262–73. DOI: 10.1089/ten.tea.2017.0069
13. Rota C, Morigi M, Cerullo D et al. Therapeutic potential of stromal cells of non-renal or renal origin in experimental chronic kidney disease. Stem Cell Res Ther. 2018; 9(1): 220. DOI: 10.1186/s13287-018-0960-8
14. He J, Wang J, Lu X et al. Micro-vesicles derived from bone marrow stem cells protect the kidney both in vivo and in vitro by microRNA-dependent repairing. Nephrology (Carlton). 2015; 20(9): 591–600. DOI: 10.1111/nep.12490
15. Matsui F, Babitz SK, Rhee A et al. Mesenchymal stem cells protect against obstruction-induced renal fibrosis by decreasing STAT3 activation and STAT3-dependent MMP-9 production. Am J Physiol Renal Physiol. 2017; 312(1): F25–32. DOI:10.1152/ajprenal.00311.2016
16. van Koppen A, Joles JA, van Balkom BW et al. Human embryonic mesenchymal stem cell-derived conditioned medium rescues kidney function in rats with established chronic kidney disease. PLoS One. 2012; 7(6): e38746. DOI: 10.1371/journal.pone.0038746
17. Золотухин П.В., Беланова А.А., Лебедева Ю.А. и др. Клеточная физиология повреждения и восстановления почек. Нефрология. 2015; 19(5): 17–22
18. Kramann R, Humphreys BD. Kidney pericytes: roles in regeneration and fibrosis. Semin Nephrol. 2014; 34(4): 374–83. DOI:10.1016/j.semnephrol.2014.06.004
19. Nagaishi K, Mizue Y, Chikenji T et al. Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes. Sci Rep. 2016; 6: 34842. DOI:10.1038/srep34842
20. Кирпатовский В.И., Соколов М.А., Рабинович Э.З., Сивков А.В. Клеточные и гуморальные механизмы регенерации почки. Экспериментальная и клиническая урология. 2017; (2): 102–11
21. Shankland SJ, Pippin JW, Duffield JS. Progenitor cells and podocyte regeneration. Semin Nephrol. 2014; 34(4): 418–28. DOI: 10.1016/j.semnephrol.2014.06.008
22. Zhou D, Fu H, Liu S et al. Early activation of fibroblasts is required for kidney repair and regeneration after injury. FASEB J. 2019; 33(11): 12576–87. DOI:10.1096/fj.201900651RR
23. Schiessl IM, Grill A, Fremter K et al. Renal interstitial platelet-derived growth factor receptor-β cells support proximal tubular regeneration. J Am Soc Nephrol. 2018; 29(5): 1383–96. DOI:10.1681/ASN.2017101069
24. Dekel B, Zangi L, Shezen E et al. Isolation and characterization of nontubular Sca-1+Lin- multipotent stem/progenitor cells from adult mouse kidney. J Am Soc Nephrol. 2006; 17(12): 3300–14. DOI:10.1681/ASN.2005020195
25. Plotkin MD, Goligorsky MS. Mesenchymal cells from adult kidney support angiogenesis and differentiate into multiple interstitial cell types including erythropoietin-producing fibroblasts. Am J Physiol Renal Physiol. 2006; 291(4): F902–12. DOI:10.1152/ajprenal.00396.2005
26. Wang H, Gomez JA, Klein S et al. Adult renal mesenchymal stem cell-like cells contribute to juxtaglomerular cell recruitment. J Am Soc. Nephrol. 2013; 24(8): 1263–73. DOI: 10.1681/ASN.2012060596
27. Jiang MH, Li G, Liu J et al. Nestin(+) kidney resident mesenchymal stem cells for the treatment of acute kidney ischemia injury. Biomaterials. 2015; 50: 56–66. DOI: 10.1016/j.biomaterials.2015.01.029
28. Bruno S, Bussolati B, Grange C et al. Isolation and characterization of resident mesenchymal stem cells in human glomeruli. Stem Cells Dev. 2009; 18(6): 867–80. DOI:10.1089/scd.2008.0320
29. Park H-C, Yasuda K, Kuo M-C et al. Renal capsule as a stem cell niche. Am J Physiol Renal Physiol. 2010; 298(5): F1254–62. DOI: 10.1152/ajprenal.00406.2009
30. Herrera MB, Bussolati B, Bruno S et al. Exogenous mesenchymal stem cells localize to the kidney by means of CD44 following acute tubular injury. Kidney Int. 2007; 72(4): 430–41. DOI:10.1038/sj.ki.5002334
31. Yu X, Lu C, Liu H et al. Hypoxic preconditioning with cobalt of bone marrow mesenchymal stem cells improves cell migration and enhances therapy for treatment of ischemic acute kidney injury. PLoS One. 2013; 8(5): e62703. DOI: 10.1371/journal.pone.0062703
32. Si XY, Li JJ, Yao T, Wu XY. Transforming growth factor-β1 in the microenvironment of ischemia reperfusion-injured kidney enhances the chemotaxis of mesenchymal stem cells to stromal cell-derived factor-1 through upregulation of surface chemokine (C-X-C motif) receptor 4. Mol Med Rep. 2014; 9(5): 1794–8. DOI:10.3892/mmr.2014.1989
33. Machiguchi T, Nakamura T. Nephron generation in kidney cortices through injection of pretreated mesenchymal stem cell-differentiated tubular epithelial cells. Biochem Biophys Res Commun. 2019; 518(1): 141–7. DOI:10.1016/j.bbrc.2019.08.022
34. Chen J, Park HC, Addabbo F et al. Kidney-derived mesenchymal stem cells contribute to vasculogenesis, angiogenesis and endothelial repair. Kidney Int. 2008; 74(7): 879–89. DOI:10.1038/ki.2008.304
35. Park JH, Jang HR, Kim DH et al. Early, but not late, treatment with human umbilical cord blood-derived mesenchymal stem cells attenuates cisplatin nephrotoxicity through immunomodulation. Am J Physiol Renal Physiol. 2017; 313(4): F984–96. DOI:10.1152/ajprenal.00097.2016
36. Chen L, Xiang E, Li C et al. Umbilical cord-derived mesenchymal stem cells ameliorate nephrocyte injury and proteinuria in a diabetic nephropathy rat model. J Diabetes Res. 2020; 2020: 8035853. DOI: 10.1155/2020/8035853
37. Zhao L, Hu C, Zhang P et al. Mesenchymal stem cell therapy targeting mitochondrial dysfunction in acute kidney injury. J Transl Med. 2019; 17(1): 142. DOI:10.1186/s12967-019-1893-4
38. Zou X, Jiang K, Puranik AS et al. Targeting murine mesenchymal stem cells to kidney injury molecule-1 improves their therapeutic efficacy in chronic ischemic kidney injury. Stem Cells Transl Med. 2018; 7(5): 394–403. DOI: 10.1002/sctm.17-0186
39. Li H, Rong P, Ma X et al. Mouse umbilical cord mesenchymal stem cell paracrine alleviates renal fibrosis in diabetic nephropathy by reducing myofibroblast transdifferentiation and cell proliferation and upregulating MMPs in mesangial cells. J Diabetes Res. 2020; 2020: 3847171. DOI: 10.1155/2020/3847171
40. Broekema M, Harmsen MC, van Luyn MJ et al. Bone marrow-derived myofibroblasts contribute to the renal interstitial myofibroblast population and produce procollagen I after ischemia/reperfusion in rats. J Am Soc Nephrol. 2007; 18(1): 165–75. DOI:10.1681/ASN.2005070730
41. Kim JS, Lee JH, Kwon O et al. Rapid deterioration of preexisting renal insufficiency after autologous mesenchymal stem cell therapy. Kidney Res Clin Pract. 2017; 36(2): 200–4. DOI: 10.23876/j.krcp.2017.36.2.200
42. Zhao L, Hu C, Zhang P et al. Preconditioning strategies for improving the survival rate and paracrine ability of mesenchymal stem cells in acute kidney injury. J Cell Mol Med. 2019; 23(2): 720–30. DOI:10.1111/jcmm.14035
43. Swaminathan M, Stafford-Smith M, Chertow GM et al. Allogeneic mesenchymal stem cells for treatment of AKI after cardiac surgery. J Am Soc Nephrol. 2018; 29(1): 260–7. DOI: 10.1681/ASN.2016101150
44. Deng D, Zhang P, Guo Y, Lim TO. A randomised double-blind, placebo-controlled trial of allogeneic umbilical cord-derived mesenchymal stem cell for lupus nephritis. Ann Rheum Dis. 2017; 76(8): 1436–9. DOI:10.1136/annrheumdis-2017-211073
45. Makhlough A, Shekarchian S, Moghadasali R et al. Safety and tolerability of autologous bone marrow mesenchymal stromal cells in ADPKD patients. Stem Cell Res Ther. 2017; 8(1): 116. DOI: 10.1186/s13287-017-0557-7
46. Zhang B, Tian X, Hao J et al. Mesenchymal stem cell-derived extracellular vesicles in tissue regeneration. Cell Transplant. 2020; 29: 963689720908500. DOI:10.1177/0963689720908500
47. Zhang G, Wang D, Miao S et al. Extracellular vesicles derived from mesenchymal stromal cells may possess increased therapeutic potential for acute kidney injury compared with conditioned medium in rodent models: A meta-analysis. Exp Ther Med. 2016; 11(4): 1519–25. DOI: 10.3892/etm.2016.3076
48. Eirin A, Zhu XY, Jonnada S et al. Mesenchymal stem cell-derived extracellular vesicles improve the renal microvasculature in metabolic renovascular disease in swine. Cell Transplant. 2018; 27(7): 1080–95. DOI:10.1177/0963689718780942
49. Nassar W, El-Ansary M, Sabry D et al. Umbilical cord mesenchymal stem cells derived extracellular vesicles can safely ameliorate the progression of chronic kidney diseases. Biomater Res. 2016; 20: 21. DOI: 10.1186/s40824-016-0068-0
50. Tsuji K, Kitamura S, Wada J. Immunomodulatory and regenerative effects of mesenchymal stem cell-derived extracellular vesicles in renal diseases. Int J Mol Sci. 2020; 21(3): 756. DOI:10.3390/ijms21030756
Об авторах
О. В. ПаюшинаРоссия
Паюшина Ольга Викторовна, д-p биол. наук, старший преподаватель кафедры гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
+7 (926) 505-84-27
Д. А. Цомартова
Россия
Цомартова Дибахан Асланбековна, канд. мед. наук, доцент кафедры гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Е. В. Черешнева
Россия
Черешнева Елизавета Васильевна, канд. мед. наук, доцент кафедры гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
М. Ю. Иванова
Россия
Иванова Марина Юрьевна, канд. мед. наук, доцент кафедры гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Т. А. Ломановская
Россия
Ломановская Татьяна Александровна, старший преподаватель кафедры гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
С. Л. Кузнецов
Россия
Кузнецов Сергей Львович, д-р мед. наук, чл.-корр. РАН, профессор, заведующий кафедрой гистологии, цитологии и эмбриологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991