Перейти к:
Посттрансплантационный сахарный диабет как мультидисциплинарная проблема: обзор литературы
https://doi.org/10.47093/2218-7332.2021.12.1.60-73
Аннотация
Ежегодно растёт как количество проводимых трансплантаций, так посттрансплантационная выживаемость. Реципиенты солидных органов пожизненно получают иммуносупрессивную терапию (ИСТ), осложнениями которой являются нарушения углеводного и липидного обменов. Наиболее диабетогенными считаются препараты из группы ингибиторов кальциневрина и глюкокортикостероиды. Посттрансплантационный сахарный диабет (ПТСД) – это повышение гликемии, соответствующее критериям СД, впервые выявленное после трансплантации. ПТСД может ухудшать как краткосрочные, так и отдалённые исходы трансплантации, что обуславливает необходимость его своевременной диагностики, терапии и профилактики. У большинства пациентов в раннем посттрансплантационном периоде выявляются транзиторные нарушения углеводного обмена, поэтому скрининг ПТСД проводится не ранее, чем через месяц после трансплантации. Предпочтительным методом диагностики считается пероральный глюкозотолерантный тест (ПГТТ), в то время как диагностическая ценность гликированного гемоглобина ограничена. К возможным превентивным мероприятиям в группе высокого риска относят модификацию образа жизни и назначение сахароснижающих препаратов. Коррекция стрессовой гипергликемии после трансплантации проводится по общим рекомендациям по ведению послеоперационных пациентов. При выборе сахароснижающих препаратов при ПТСД необходимо учитывать, какой орган был трансплантирован, особенности пациента и вероятность межлекарственных взаимодействий с ИСТ. Для снижения риска сердечно-сосудистых событий необходим контроль артериального давления и показателей липидного обмена. В лечении и профилактике ПТСД остаётся множество открытых вопросов, решение которых требует междисциплинарного подхода.
Ключевые слова
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ | HIGHLIGHTS |
Пациенты после трансплантации солидных органов имеют высокий риск нарушений углеводного обмена, одним из основных факторов риска которых считается пожизненная иммуносупрессивная терапия. | Solid organ recipients receive lifelong immunosuppressive therapy that makes them vulnerable to posttransplant diabetes mellitus (PTSD). |
В качестве профилактики посттрансплантационного сахарного диабета (ПТСД) можно рассматривать выбор иммуносупрессивных препаратов без диабетогенного эффекта, модификацию образа жизни и назначение сахароснижающих препаратов. | Focus on immunosuppressive drugs without diabetogenic effect, lifestyle modification and antidiabetic drugs prescription are possible prevention tools for PTSD. |
Для проведения скрининга ПТСД необходимо проведение перорального глюкозотолерантного теста не ранее чем через месяц после трансплантации. | PTSD screening is carried out at least one month after transplantation oral glucose tolerance test. |
Выбор сахароснижающей терапии при ПТСД должен осуществляться с учетом особенностей пациента и трансплантата, а также возможности межлекарственных взаимодействий с иммуносупрессивными препаратами. | Antidiabetic therapy for PTSD should be chosen taking into account patient and the transplant characteristics, as well as the possibility of drug-drug interactions with immunosuppressive drugs. |
Успешное ведение пациентов после трансплантации подразумевает работу мультидисциплинарной командой. | Interdisciplinary approach is essential for successful management of patients after solid organ transplantation. |
С момента первой трансплантации трупной почки в 1930-х годах трансплантология сделала огромный шаг вперед. По данным Всемирной организации здравоохранения, ежегодно проводится более 130 тыс. трансплантаций солидных органов, из них, по данным на 2020 г., более 1900 – в Российской Федерации [1]. Количество трансплантаций продолжает неуклонно увеличиваться, в среднем на 7% в год.
Важно, что увеличивается не только количество операций, но и посттрансплантационная выживаемость. Годовая выживаемость у реципиентов почки составляет более 97%, а 5-летняя – более 86% [2]. По данным Американской коллегии хирургов, 5-летняя выживаемость после пересадки печени составляет 73%, а 20-летняя – более 50%. Медиана выживаемости после трансплантации сердца составляет 10 лет, а для пациентов, переживших первый год после операции, – 13 лет [3].
Рост числа успешных трансплантаций и повышение выживаемости ставит перед практическим здравоохранением новую задачу: профилактику отдаленных осложнений и обеспечение достойного качества жизни реципиентов. Пациенты после трансплантации вынуждены получать пожизненную иммуносупрессивную терапию, одним из осложнений которой являются метаболические нарушения, ухудшающие отдаленные исходы трансплантации и сердечно-сосудистый прогноз. В первую очередь к ним относятся посттрансплантационный сахарный диабет (ПТСД) и дислипидемия [4].
ОПРЕДЕЛЕНИЕ И ДИАГНОСТИКА
Первое сообщение о возникновении ПТСД датировано 1964 г., в нем описан случай сахарного диабета (СД), возникший после трансплантации почки. Впоследствии стало ясно, что речь идет не о единичном случае, а об общей тенденции. Понятие ПТСД включает все случаи СД, впервые выявленные после трансплантации, как те, что дебютировали после трансплантации, так и те, что не были своевременно диагностированы до трансплантации, за исключением стрессовой гипергликемии, которая может развиваться в первый месяц после оперативного вмешательства, в период подбора иммуносупрессивной терапии. Следует отметить, что у диагноза нет «срока давности»: в случае выявления СД у пациента после трансплантации не важно, сколько лет прошло после ее проведения – заболевание следует расценивать как ПТСД. В отношении ПТСД действуют диагностические критерии, одобренные Американской диабетологической ассоциацией и Всемирной организацией здравоохранения для диагностики СД в общей популяции. Установление диагноза правомерно при выявлении любых двух значений в диабетическом диапазоне (табл. 1). Термин «предиабет» используется для характеристики нарушений углеводного обмена, не достигающих диабетических значений; выделяют нарушение гликемии натощак (НГН) и нарушение толерантности к глюкозе (НТГ) [5][6][7].
Таблица 1. Диагностические критерии сахарного диабета и нарушений углеводного обмена (Американская диабетическая ассоциация [6])
Table 1. Diagnostic criteria for diabetes and impaired glucose metabolism (American Diabetes Association [6])
Тип нарушений углеводного обмена | Глюкоза плазмы натощак, ммоль/л | Глюкоза плазмы через 2 ч | Гликированный гемоглобин, HbA1c | Другие критерии |
Норма | <5,6 | <7,8 | <5,7% | |
Нарушение гликемии натощак | 5,6–6,9 | <7,8 | ||
Нарушение толерантности | <7,0 | 7,8–11,1 | ||
Посттрансплантационный сахарный диабет | ≥7,0 | ≥11,1 | ≥6,5% | Симптомы СД + гликемия |
В раннем послеоперационном периоде необходим динамический контроль гликемии, поскольку на фоне повышения контринсулярных гормонов и назначения больших доз глюкокортикостероидов (ГКС) у 60–90% реципиентов солидных органов развивается стрессовая гипергликемия, что может потребовать назначения инсулинотерапии [8][9]. Однако более чем в половине случаев повышение носит транзиторный характер, поэтому для исключения гипердиагностики скрининг ПТСД рекомендовано проводить уже после подбора постоянных доз иммуносупрессивной терапии через 30–45 дней после трансплантации [6].
Стратегия скрининга ПТСД подразумевает выявление пациентов из группы высокого риска и проведение у них соответствующих тестов. Однако в настоящее время не существует шкал стратификации риска углеводных нарушений после трансплантации, а значит, необходимо рассматривать возможность тотального скрининга ПТСД. По заключению международного консенсуса по ПТСД, прошедшего в Вене в 2013 г., основным методом диагностики ПТСД признан пероральный глюкозотолерантный тест (ПГТТ) с раствором 75 г безводной глюкозы. В то же время диагностическая ценность исследования гликированного гемоглобина (HbA1c), применяемого в общей популяции для выявления СД, несколько ограничена: часто встречающаяся в первый год после трансплантации анемия может приводить к ложноотрицательным результатам. В то же время HbA1c ≥ 6,5% весьма вероятно свидетельствует в пользу ПТСД. Уровень HbA1c в диапазоне 6,2–6,4% указывает на высокий риск ПТСД [5]. Предполагается, что определение глюкозы плазмы натощак и/или HbA1c может ограничить выборку пациентов, нуждающихся в проведении ПГТТ [10].
ЭПИДЕМИОЛОГИЯ
Распространенность ПТСД варьирует между разными трансплантационными центрами, что объясняется различиями в характеристиках пациентов и протоколах иммуносупрессивной терапии. Кроме того, частота ПТСД зависит от того, какой именно орган был трансплантирован. По данным зарубежных работ, в среднем распространенность ПТСД составляет 10–20% у реципиентов почек и 20–40% у реципиентов других солидных органов [11]. Аналогичные результаты были получены в отечественных исследованиях: ПТСД развивался у 6,8–22% реципиентов почки [12][13][14]. В последние годы распространенность ПТСД среди реципиентов почки снижается, а в популяции пациентов после трансплантации сердца – растет [10].
ФАКТОРЫ РИСКА И ПРОФИЛАКТИКА
Перед проведением трансплантации у потенциального реципиента необходимо оценить наличие факторов риска ПТСД и измерить глюкозу плазмы натощак. Поскольку при наличии предиабетических нарушений до трансплантации риск ПТСД в 2,5 раза выше, ряд исследователей предлагают проводить ПГТТ даже у пациентов с нормальной тощаковой гликемией [15].
Среди факторов риска можно выделить традиционные, свойственные СД 2 типа, и специфические, характерные для ПТСД. Все они опосредуют свое влияние через два ключевых патогенетических механизма: инсулинорезистентность и нарушение секреции инсулина β-клетками поджелудочной железы. К традиционным факторам риска относятся возраст старше 45 лет, этническая принадлежность (риск выше в азиатской, афро- и латиноамериканской популяциях), СД 2 типа у родственников первой линии, носительство полиморфных вариантов однонуклеотидных полиморфизмов ряда генов (TCF7L2, KCNJ11, Kir6.2, KCNQ1, а также генов, кодирующих интерлейкины), ожирение, НГН/НТГ в анамнезе. Специфическими факторами риска являются протокол иммуносупрессивной терапии, гипергликемия в раннем посттрансплантационном периоде, цитомегаловирусная инфекция и инфекция, вызываемая вирусом гепатита С (Hepatitis C Virus, HCV), отторжение трансплантата, характеристики трансплантата (риск выше при пересадке трупных органов), особенности врожденного иммунитета (уровень лектина, связывающего маннозу) [16].
Закономерно встает вопрос о проведении профилактических мероприятий у пациентов, имеющих факторы риска. Соблюдение принципов рационального питания, регулярные физические упражнения и снижение массы тела уменьшают вероятность и замедляют развитие СД 2 типа у пациентов из группы высокого риска [17]. Учитывая общность факторов риска, резонно предположить, что модификация образа жизни позволит снизить риск ПТСД, однако исследований по оценке эффективности этих мероприятий не проводилось. Следует оговориться, что мероприятия по снижению массы тела не следует проводить сразу после трансплантации: для обеспечения нормальных репаративных процессов пациентам необходимо эукалорийное сбалансированное питание, а физические нагрузки могут быть ограничены болевым синдромом и потерей белка на фоне катаболических процессов.
Согласно российским клиническим рекомендациям для профилактики СД 2 типа у пациентов с предиабетом одобрен препарат метформин [18]. Вероятно, он мог бы быть эффективен для профилактики ПТСД, особенно у пациентов с ожирением, что требует проведения исследований. Однако превентивная тактика подразумевает назначение препарата в раннем послеоперационном периоде, когда его применение может быть ограничено снижением скорости клубочковой фильтрации < 45 мл/мин/1,73 м2, кровопотерей, гипоксическими состояниями и инфекционными осложнениями. Метформин нужно отменять за 48 ч до проведения оперативного вмешательства и исследований с контрастным усилением, необходимость которых после трансплантации зачастую возникает непредсказуемо. В связи с этим активно изучается возможность применения других классов сахароснижающих препаратов. Так, ингибиторы дипептидилпептидазы-4 (иДПП-4) не применяются у пациентов с предиабетом в общей популяции, но ввиду отсутствия у них вышеупомянутых недостатков их можно рассматривать в качестве потенциальной альтернативы метформину [5]. Отдельного внимания заслуживает препарат линаглиптин, который метаболизируется, минуя почки, а значит, может применяться без коррекции дозы даже при терминальной стадии почечной недостаточности. В настоящее время проводятся исследования по оценке эффективности инсулинотерапии для профилактики ПТСД у реципиентов с НГН/НТГ [19].
РОЛЬ ИММУНОСУПРЕССИВНОЙ ТЕРАПИИ В ПАТОГЕНЕЗЕ ПОСТТРАНСПЛАНТАЦИОННОГО САХАРНОГО ДИАБЕТА
Выделяют индукционную и поддерживающую иммуносупрессивную терапию, а также терапию, назначаемую при развитии криза отторжения. К препаратам, использующимся для индукционной терапии, относят ГКС, моноклональные (алемтузумаб, базиликсимаб) и поликлональные (антитимоцитарный глобулин) антитела к Т-лимфоцитам. В зависимости от риска отторжения применяются различные протоколы поддерживающей терапии, подразумевающие назначение нескольких препаратов с различными механизмами действия, среди которых ингибиторы кальциневрина – циклоспорин А и такролимус, антиметаболиты – азатиоприн, микофенолата мофетил и микофенолат натрия, ингибиторы пролиферативного сигнала mTOR – сиролимус и эверолимус, селективный блокатор костимуляции Т-лимфоцитов белатацепт, а также ГКС. В зависимости от клинической ситуации (возраст пациента, орган-трансплантат и др.) эти препараты комбинируются в двух- или трехкомпонентные схемы поддерживающей терапии (рис. 1) [20].

РИС. 1. Схемы двух- и трехкомпонентной поддерживающей иммуносупрессивной терапии.
FIG. 1. Double and triple scheme of maintenance immunosuppressive therapy.
В последующем терапия корректируется, в том числе для снижения риска побочных действий ингибиторов кальциневрина и неблагоприятных метаболических эффектов длительного применения ГКС [21].
Среди иммуносупрессивных препаратов выделяют те, которые обладают диабетогенным эффектом: ингибиторы кальциневрина, ингибиторы mTOR, ГКС (рис. 2), и те, которые считаются нейтральными в отношении влияния на углеводный обмен: микофенолата мофетил и азатиоприн [5].
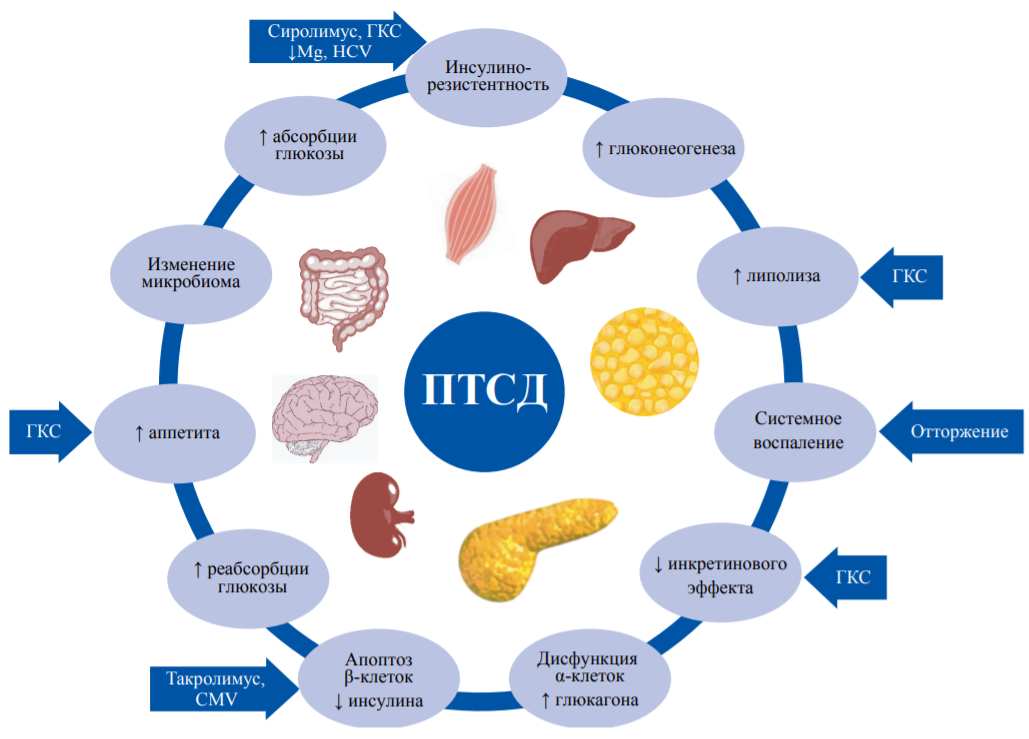
РИС. 2. Патогенез посттрансплантационного сахарного диабета и влияние иммуносупрессивной терапии.
FIG. 2. Post-transplant diabetes mellitus pathogenesis and effect of immunosuppressive drugs.
Примечание: ↑ – эффект увеличения/стимуляции; ↓ – эффект уменьшения/ингибирования, CMV – цитомегаловирусная инфекция, ГКС – глюкокортикостероиды, HCV – вирус гепатита С.
Note: ↑ – increase / stimulation effect; ↓ – reduction / inhibition effect, CMV – cytomegalovirus, ГКС – glucocorticosteroids, HCV – Hepatitis C Virus.
ГКС усугубляют инсулинорезистентность, стимулируют глюконеогенез, повышают аппетит, способствуют увеличению массы тела. Эти эффекты являются дозозависимыми: наибольшее влияние наблюдается при индукционной терапии в раннем посттрансплантационном периоде. В то же время было показано, что минимальные поддерживающие дозы преднизолона, применяемые в течение 5 лет после трансплантации, не оказывают значимого влияния на риск развития ПТСД [9].
Оба препарата из класса ингибиторов кальциневрина повышают риск ПТСД: циклоспорин – на 8%, такролимус – на 18% [22]. Для них описано несколько диабетогенных механизмов действия: нарушение секреции инсулина, усиление апоптоза β-клеток, снижение экспрессии гена инсулина, подавление активности глюкокиназы, повышение инсулинорезистентности, гипомагниемия. Кратковременное применение такролимуса у крыс приводило к умеренной гиперинсулинемии, в то время как при более длительном применении уровень инсулина снижался [5]. У здоровых добровольцев с нормальной массой тела при введении ингибиторов кальциневрина наблюдалось повышение чувствительности к инсулину, из чего можно предположить, что этот класс препаратов способствует развитию ПТСД только у пациентов, имеющих другие факторы риска [21][22].
Ранее сообщалось, что оба представителя класса ингибиторов mTOR обладают отрицательными метаболическими эффектами. В опытах на животных и в клинических наблюдениях был показан дозозависимый эффект ингибиторов mTOR в отношении гипергликемии и дислипидемии. Результаты ряда исследований позволяют предположить двухфазное влияние ингибиторов mTOR: вначале чувствительность к инсулину увеличивается, а при длительном применении развивается инсулинорезистентность. Предполагалось, что сиролимус, аналогично ингибиторам кальциневрина, потенцирует гипергликемию только у пациентов, имеющих прочие факторы риска [23]. Второй препарат из этого класса, эверолимус, не влияет на инсулинорезистентность, но может угнетать секрецию инсулина [24]. По мере накопления опыта применения ингибиторов mTOR изменился подход к режимам дозирования этих препаратов, и по результатам более поздних рандомизированных исследований в группах, получающих сиролимус или эверолимус после трансплантации почки, не наблюдалось увеличения частоты ПТСД. В связи с чем возникло предположение о возможности снижения риска развития нарушений углеводного обмена при переводе пациентов с ингибиторов кальциневрина на ингибиторы mTOR, которое в настоящее время не нашло клинического подтверждения [12, 25].
Иммуносупрессивная терапия является потенциально модифицируемым фактором риска развития ПТСД, однако при выборе протокола на другой чаше весов остается риск отторжения трансплантата. Согласно рекомендациям Инициативы по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGO), возможны следующие модификации режима: снижение дозы или отмена такролимуса, циклоспорина А или ГКС; замена такролимуса на циклоспорин А, микофенолата мофетил или азатиоприн [26]. Обсуждается возможность индивидуального подбора препаратов в зависимости от риска развития ПТСД, однако в настоящее время однозначных данных о предпочтительности конкретной схемы у пациентов с факторами риска нет [27].
ВЛИЯНИЕ ПОСТТРАНСПЛАНТАЦИОННОГО САХАРНОГО ДИАБЕТА НА ИСХОДЫ ТРАНСПЛАНТАЦИИ
ПТСД может ухудшать исходы трансплантации; характер и степень его влияния зависят от того, какой орган был трансплантирован, от характеристик реципиента (возраст, наличие сердечно-сосудистых заболеваний) и режима иммуносупрессивной терапии [5]. Наиболее изученным представляется влияние на исход после трансплантации почки: однолетняя выживаемость у реципиентов с ПТСД значимо ниже, чем у реципиентов без ПТСД (83% по сравнению с 98%) [13][28]. Смертность при ПТСД выше в 2 раза и примерно соответствует показателям у реципиентов с СД, выявленным до трансплантации. По другим данным, ПТСД влияет на выживаемость только у пациентов моложе 55 лет.
Снижение выживаемости в долгосрочной перспективе обусловлено в большей степени сердечно-сосудистыми событиями: у пациентов с ПТСД они случаются в 3 раза чаще, даже при условии контроля над другими факторами риска [29][30]. По результатам большинства исследований ПТСД снижает жизнеспособность трансплантата и ассоциирован с большей частотой его отторжения (70% против 45% у пациентов без ПТСД). Остается неясным, является ПТСД причиной отторжения, или же нарушения углеводного обмена встречаются чаще среди пациентов, получающих бóльшие дозы ГКС по поводу отторжения.
Следует также отметить, что ПТСД увеличивает риск развития сепсиса и сепсис-ассоциированной смертности. В частности, у реципиентов печени ПТСД ассоциирован с повышенным риском сепсиса, хронической почечной недостаточности и снижением общей выживаемости. Как наличие предшествующего СД, так и развитие ПТСД у HCV-положительных реципиентов печени было ассоциировано с более частым рецидивом гепатита, обусловленного HCV. У HCV-положительных реципиентов ПТСД является предиктором тяжелого фиброза печени в течение 5 лет после трансплантации. Также у реципиентов с ПТСД выше смертность, ассоциированная с гепатитом HCV. В свою очередь, удовлетворительный гликемический контроль уменьшал выраженность фибротических процессов [31].
По некоторым данным, ПТСД у реципиентов сердца ассоциирован с риском артериальной гипертензии, почечной недостаточности, инфекционных осложнений, но не влияет на выживаемость. Данные о влиянии ПТСД на выживаемость реципиентов легких остаются неоднозначными [5][10].
ВЕДЕНИЕ ПАЦИЕНТА НА ЭТАПЕ СТАЦИОНАРНОГО ЛЕЧЕНИЯ
Операционный стресс и индукционная терапия ГКС провоцируют стрессовую гипергликемию, которая увеличивает риск нозокомиальных и раневых инфекций, а также сердечно-сосудистых событий. На данный момент нет единых рекомендаций относительно целевых значений гликемии и терапевтической тактики в раннем посттрансплантационном периоде, однако к этой группе пациентов применимы общие рекомендации по ведению стрессовой гипергликемии (табл. 2). Целевые значения глюкозы плазмы в периоперационном периоде и у пациентов в отделении реанимации и интенсивной терапии 7,8–10 ммоль/л, после перевода в палату – глюкоза плазмы натощак < 7,8 ммоль/л, через 2 часа после еды < 10 ммоль/л [19]. Достижение и поддержание целевых значений гликемии улучшает клинические исходы, в то время как более низкие значения гликемии не только не снижают смертность и количество осложнений, а, напротив, ассоциированы с повышением риска отторжения. Оптимальный способ коррекции стрессовой гипергликемии – непрерывная внутривенная инфузия инсулина [32][33]. Применение пероральных сахароснижающих препаратов у пациентов в раннем послеоперационном периоде ограничено их недостаточной сахароснижающей эффективностью и риском побочных эффектов [6].
Таблица 2. Терапевтическая тактика у реципиентов солидных органов при стрессовой гипергликемии (адаптировано из V. Shivaswamy et al., 2016 [5])
Table 2. Therapeutic approach for stress hyperglycemia after solid organ transplantation (adapted from V. Shivaswamy et al., 2016 [5])
Клиническая ситуация | Причины изменений | Терапевтическая тактика |
Сразу после трансплантации | большие дозы ИСТ; операционный стресс | НВИИ; постоянная коррекция дозы инсулина; контроль гликемии ежечасно |
1-я неделя после трансплантации | уменьшение дозы ИСТ; изменение нутритивного статуса; восстановление фильтрационной функции (у реципиентов почки) | коррекция доз инсулина в зависимости от функции почек и изменений питания; постепенный перевод на подкожные инъекции; контроль гликемии не реже 4 раз в сутки |
Болюсная терапия ГКС, например при остром отторжении | резкое увеличение потребности в инсулине; значимая вариабельность в фильтрационной функции (у реципиентов почки) | подкожное введение НПХ-инсулина на время болюсной терапии; в случае недостижения целевых значений гликемии на подкожных инъекциях – временный перевод на НВВИ |
Полное парентеральное питание | резкое увеличение потребности в инсулине | НВВИ и/или добавление инсулина в инфузионную после достижения стабильных целевых значений |
Note: ОРИТ – intensive care unit; ИСТ – immunosuppressive therapy; НВИИ – continuous intravenous insulin infusion; ГКС – glucocorticosteroids; НПХ-инсулин – NPH, Neutral Protamine Hagedorn.
ВЕДЕНИЕ ПАЦИЕНТОВ С ПТСД В ДОЛГОСРОЧНОЙ ПЕРСПЕКТИВЕ
После стабилизации состояния пациента встает вопрос о дальнейшей тактике ведения. Целевые значения гликемии при ПТСД определяются так же, как и при других видах СД: учитывается возраст, ожидаемая продолжительность жизни пациента, спектр сопутствующей патологии и риск гипогликемических состояний. По рекомендациям Американской диабетической ассоциации целевой уровень HbA1c для большинства пациентов с ПТСД должен быть < 7,0%. Согласно рекомендациям KDIGO целевой уровень HbA1c для реципиентов почки – 7–7,5%, учитывая более высокий риск гипогликемии. Из-за распространенности недостоверных результатов на фоне анемии в течение первого года после трансплантации уровень HbA1c не может быть единственным показателем адекватной оценки компенсации углеводного обмена; пациентам необходимо проводить динамический самоконтроль гликемии: целевые значения глюкозы плазмы натощак < 7,0 ммоль/л, через 2 часа после еды < 9,0, ммоль/л.
В РФ доступны девять классов сахароснижающих препаратов [18]. Часть пациентов успешно достигает целевых значений гликемии на терапии пероральными сахароснижающими препаратами, другие – на их комбинации с инсулином. При невозможности применения пероральной сахароснижающей терапии проводится базис-болюсная инсулинотерапия. Выбор препарата зависит от множества факторов: сахароснижающей эффективности, сердечно-сосудистой безопасности, возможности применения препарата при снижении функции почек, риска гипогликемии и других. Поскольку основу иммуносупрессивной терапии составляют препараты с узким терапевтическим окном, при назначении дополнительных лекарственных средств крайне важно учитывать их метаболизм через систему цитохромов. Назначение препаратов, которые метаболизируются CYP 3A4, нежелательно, так как это может потребовать коррекции дозы иммуносупрессивных средств [33]. Вероятно, терапевтическая тактика при ПТСД должна различаться в зависимости от трансплантированного органа [5].
Метформин – препарат первой линии терапии СД 2 типа, подавляющий глюконеогенез и повышающий утилизацию глюкозы мышцами за счет снижения инсулинорезистентности. Несмотря на эффективность и безопасность в общей популяции, наличие плейотропных эффектов, его применение при ПТСД имеет ряд относительных ограничений, описанных выше [5]. Тем не менее применение метформина у реципиентов почки не снижает выживаемость пациентов и трансплантата [34], однако данных о безопасности применения у реципиентов других органов нет. Применение метформина в первый год после трансплантации почки у реципиентов с претрансплантационным СД было ассоциировано со значительно более низким уровнем общей, онкологической и инфекционной смертности, а также с незначительным снижением частоты сердечно-сосудистой смертности, острого отторжения и дисфункции нефротрансплантата [35]. В опытах на животных метформин подавлял апоптоз β-клеток поджелудочной железы, индуцированный иммуносупрессивной терапией [36]. Цитохром CYP 3A4 не участвует в метаболизме метформина [33].
Механизм действия тиазолидиндионов основан на повышении чувствительности к инсулину. По результатам небольших исследований, тиазолидиндионы безопасны при применении у реципиентов почки и не требуют коррекции доз иммуносупрессивной терапии [36]. В то же время у тиазолидиндионов есть побочные действия, которые могут быть крайне нежелательны у реципиентов солидных органов: усиление реабсорбции натрия может приводить к отечному синдрому и сердечной недостаточности (особенно у реципиентов сердца).
Препараты сульфонилмочевины стимулируют глюкозонезависимую секрецию инсулина. Долгие годы препараты сульфонилмочевины применялись для лечения ПТСД, несмотря на то что исследований по оценке их безопасности и эффективности в этой группе пациентов практически не проводилось. Этот класс препаратов обеспечивает эффективный контроль гликемии, но их применение при ПТСД ограничено по ряду причин: риск развития гипогликемии, особенно при почечной недостаточности и при денервированном сердце, и увеличение массы тела [16]. Гликвидон метаболизируется с участием CYP 3A4, в связи с чем не рекомендован для применения вместе с иммуносупрессивными препаратами, концентрация глибенкамида повышается при применении вместе с циклоспорином А, остальные представители класса вступают в межлекарственные взаимодействия с триметопримом, метронидазолом и флуканазолом, часто применяемым после трансплантации [34].
Глиниды (натеглинид и репаглинид), которые также относятся к препаратам, стимулирующим секрецию инсулина, ввиду более короткой продолжительности действия и меньшего риска гипогликемии могут быть препаратами выбора у пациентов с ПТСД и сниженной функцией почек. Несмотря на то что оба представителя класса частично метаболизируются с участием CYP 3A4, в небольшом ретроспективном исследовании репаглинид показал умеренную сахароснижающую эффективность у реципиентов почки без необходимости коррекции доз иммуносупрессивной терапии [37].
Препараты из группы иДПП-4 подавляют действие фермента, метаболизирующего глюкагоноподобный пептид 1-го типа, и тем самым опосредованно стимулируют глюкозозависимую секрецию инсулина. Благодаря низкому риску гипогликемии, нейтральному влиянию на вес и возможности применения при снижении функции почек иДПП-4 являются перспективным классом для лечения ПТСД. В крупномасштабных исследованиях EXAMINE, TECOS, CARMELINA представители класса – ситаглиптин, алоглиптин, линаглиптин – подтвердили сердечно-сосудистую безопасность у пациентов с СД 2-го типа. По результатам клинических исследований вилдаглиптин и ситаглиптин могут быть рекомендованы в качестве безопасной терапии для реципиентов почки с ПТСД [38][39][40][41]; а вилдаглиптин – еще и для пациентов после трансплантации сердца [42].
Агонисты рецепторов глюкагоноподобного пептида 1-го типа напрямую стимулируют глюкозозависимую секрецию инсулина ß-клетками и подавляют избыточную выработку глюкагона, играющую важную роль в патогенезе ПТСД [37][43][44]. Терапия агонистами рецепторов сопровождается снижением веса и ассоциирована с низким риском гипогликемии. Однако из-за таких побочных эффектов, как тошнота и рвота, а также увеличение времени опорожнения желудка, возникают опасения относительно влияния этого класса препаратов на фармакокинетику иммуносупрессантов. В настоящее время есть лишь единичные клинические наблюдения: применение лираглутида в течение 3 недель у реципиентов почки не влияло на уровень такролимуса в крови [45].
Механизм действия ингибиторов натрий-глюкозного котранспортера 2-го типа основан на подавлении реабсорбции глюкозы в почках, что приводит к глюкозурии и инсулиннезависимому снижению гликемии. При применении для терапии СД 2 ингибиторы натрий-глюкозного котранспортера 2-го типа способствуют снижению веса, а некоторые представители класса снижают сердечно-сосудистую смертность и прогрессирование почечной недостаточности [46][47]. Данные о безопасности и эффективности препаратов у реципиентов солидных органов остаются недостаточными. В серии случаев (7 пациентов) эмпаглифлозин был безопасен при добавлении к сахароснижающей терапии у реципиентов почки со стабильно функционирующим трансплантатом [47]. По заключению авторов другой серии случаев, эффективность и безопасность применения канаглифлозина у пациентов с ПТСД сопоставима с таковыми у пациентов СД 2 типа [48], а через год после начала терапии эмпаглифлозином у реципиентов сердца с ПТСД наблюдалось значимое снижение массы тела и уменьшение дозы фуросемида по сравнению с контрольной группой [49].
МЕЖДИСЦИПЛИНАРНЫЙ ПОДХОД К ВЕДЕНИЮ ПАЦИЕНТОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ
Пересадка солидного органа подразумевает пожизненное наблюдение в трансплантационном центре мультидисциплинарной командой, включающей помимо хирургов-трансплантологов также врачей – нефрологов, эндокринологов, кардиологов, реабилитологов и психотерапевтов. Такой подход позволяет коллегиально решать возникающие клинические трудности и обеспечивает более индивидуализированный подход. Естественно, пациенты после трансплантации обращаются за медицинской помощью и в лечебные учреждения по месту жительства, что обуславливает необходимость повышения осведомленности врачей различных специальностей об особенностях ведения таких пациентов и возможных осложнениях трансплантации, включая ПТСД. Оптимальная система ведения пациентов заключается в возможности взаимодействия трансплантационного центра с амбулаторными медицинскими учреждениями и органами социальной поддержки, включая обмен данными и, по возможности, телемедицинские консультации [4].
Особенно важен командный подход у пациентов с ПТСД, для которых помимо достижения целевых значений гликемии важно контролировать другие факторы риска сердечно-сосудистых событий (артериальное давление, показатели липидного спектра) и функцию почек вне зависимости от того, какой орган был трансплантирован.
ЗАКЛЮЧЕНИЕ
Повышение качества и увеличение продолжительности жизни посттрансплантационных пациентов, безусловно, подразумевает междисциплинарный подход, а пациенты с ПТСД нуждаются в особо пристальном внимании. Более глубокое понимание патогенеза ПТСД, а также своевременная профилактика, диагностика и коррекция нарушений углеводного обмена после трансплантации могут улучшить отдаленный прогноз реципиентов солидных органов. В настоящее время остается множество открытых вопросов: стратификация риска ПТСД (создание шкалы для решения вопроса о назначении превентивной медикаментозной терапии), возможность применения иДПП-4 для профилактики в группе высокого риска. Кроме того, необходимо проведение более масштабных исследований по оценке эффективности и безопасности сахароснижающих препаратов для терапии ПТСД.
Список литературы
1. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2019 году. XII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2020; 22(2): 8–34. https://doi.org/10.15825/1995-1191-2020-2-8-34
2. Wang J.H., Skeans M.A., Israni A.K. Current status of kidney transplant outcomes: dying to survive. Adv Chronic Kidney Dis. 2016; 23(5): 281–286. https://doi.org/10.1053/j.ackd.2016.07.001 PMID: 27742381
3. Stehlik J., Edwards L. B., Kucheryavaya A. Y., et al. The Registry of the International Society for Heart and Lung Transplantation: 29th official adult heart transplant report-2012. J Heart Lung Transplant. 2012 Oct; 31(10): 1052–1064. https://doi.org/10.1016/j.healun.2012.08.002 PMID: 22975095
4. Готье С.В., Шевченко А.О., Попцов В.Н. Пациент с трансплантированным сердцем. Руководство для врачей по ведению пациентов, перенесших трансплантацию сердца. М. – Тверь: ООО «Издательство «Триада», 2014. 144 с.
5. Shivaswamy V., Boerner B., Larsen J. Post-transplant diabetes mellitus: causes, treatment, and impact on outcomes. Endocr Rev. 2016 Feb; 37(1): 37–61. https://doi.org/10.1210/er.2015-1084 PMID: 26650437
6. Sharif A., Hecking M., de Vries A.P., et al. Proceedings from an international consensus meeting on posttransplantation diabetes mellitus: recommendations and future directions. Am J Transplant. 2014; 14(9): 1992–2000. https://doi.org/10.1111/ajt.12850 PMID: 25307034
7. World Health Organization. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia. Report of a WHO/IDF Consultation. Geneva, Switzerland: WHO; 2006. 50 p.
8. Park S.C., Yoon Y.D., Jung H.Y., et al. Effect of transient posttransplantation hyperglycemia on the development of diabetes mellitus and transplantation outcomes in kidney transplant recipients. Transplant Proc. 2015 Apr; 47(3): 666–671. https://doi.org/10.1016/j.transproceed.2014.11.05.3 PMID: 25891707
9. Boerner B., Shivaswamy V., Goldner W., Larsen J. Management of the hospitalized transplant patient. Curr Diab Rep. 2015 Apr; 15(4): 19. https://doi.org/10.1007/s11892-015-0585-6 PMID: 25721247
10. Valderhaug T.G., Jenssen T., Hartmann A., et al. Fasting plasma glucose and glycosylated hemoglobin in the screening for diabetes mellitus after renal transplantation. Transplantation. 2009; 88(3): 429–434. https://doi.org/10.1097/TP.0b013e3181af1f53 PMID: 19667949
11. Jenssen T., Hartmann A. Post-transplant diabetes mellitus in patients with solid organ transplants. Nat Rev Endocrinol. 2019; 15(3): 172–188. https://doi.org/10.1038/s41574-018-0137-7 PMID: 30622369
12. Новикова М.С., Аллазова С.С., Котенко О.Н., Шилов Е.М. Посттрансплантационный сахарный диабет у пациентов с аллотрансплантацией почки. Клиническая нефрология. 2018; 4: 20–24. https://dx.doi.org/10.18565/nephrology.2018.4.20-24
13. Прокопенко Е.И., Ватазин А.В., Щербакова Е.О. Посттрансплантационный сахарный диабет у реципиентов ренального трансплантата: опыт одного центра. Нефрология. 2017; 21(6): 20–28. https://doi.org/10.24884/1561-6274-2017-21-6-20-28
14. Мовчан Е.А., Ким Ю.Ю., Рябцева Е.П., Галкина Е.В. Посттрансплантационный сахарный диабет. Journal of Siberian Medical Sciences. 2018; 4: 26–33. https://doi.org/10.31549/2542-1174-2018-4-26-33
15. Lane J.T., Dagogo-Jack S. Approach to the patient with new-onset diabetes after transplant (NODAT). J Clin Endocrinol Metab. 2011; 96(11): 3289–3297. https://doi.org/10.1210/jc.2011-0657 PMID: 22058376
16. Sharif A., Baboolal K. Risk factors for new-onset diabetes after kidney transplantation. Nat Rev Nephrol. 2010; 6(7): 415–423. https://doi.org/10.1038/nrneph.2010.66 PMID: 20498675
17. Diabetes Prevention Program Research Group. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: The Diabetes Prevention Program Outcomes Study. Lancet Diabetes Endocrinol. 2015; 3(11): 866–875. https://doi.org/10.1016/S2213-8587(15)00291-0 PMID: 26377054
18. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова 9-й выпуск. Сахарный диабет. 2019; 22 (1S1): 1–144. https://doi.org/10.14341/DM221S1
19. Hecking M., Haidinger M., Döller D., et al. Early basal insulin therapy decreases new-onset diabetes after renal transplantation. J Am Soc Nephrol. 2012; 23(4): 739–749. https://doi.org/10.1681/ASN.2011080835 PMID: 22343119
20. Allison T.L. Immunosuppressive Therapy in Transplantation. Nurs Clin North Am. 2016 Mar; 51(1): 107–120. https://doi.org/10.1016/j.cnur.2015.10.008 PMID: 26897428
21. Bloom R.D., Rao V., Weng F., et al. Association of hepatitis C with posttransplant diabetes in renal transplant patients on tacrolimus. J Am Soc Nephrol. 2002; 13(5): 1374–1380. https://doi.org/10.1097/01.asn.0000012382.97168.e0/ PMID: 11961026
22. Øzbay L.A., Møller N., Juhl C., et al. Calcineurin inhibitors acutely improve insulin sensitivity without affecting insulin secretion in healthy human volunteers. Br J Clin Pharmacol. 2012; 73(4): 536–545. https://doi.org/10.1111/j.13652125.2011.04118.x PMID: 21988494
23. Shivaswamy V., Bennett R.G., Clure C.C., et al. Tacrolimus and sirolimus have distinct effects on insulin signaling in male and female rats. Transl Res. 2014; 163(3): 221–231. https://doi.org/10.1016/j.trsl.2013.12.002 PMID: 24361102
24. Tanimura J., Nakagawa H., Tanaka T., et al. The clinical course and potential underlying mechanisms of everolimusinduced hyperglycemia. Endocr J. 2019 Jul 28; 66(7): 615–620. https://doi.org/10.1507/endocrj.EJ18-0542 PMID: 30982794
25. Sommerer C., Witzke O., Lehner F., et al. Onset and progression of diabetes in kidney transplant patients receiving everolimus or cyclosporine therapy: an analysis of two randomized, multicenter trials. BMC Nephrol. 2018 Sep; 19(1): 237. https://doi.org/10.1186/s12882-018-1031-1 PMID: 30231851
26. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO Clinical Practice Guideline for the Care of Kidney Transplant Recipients. Am J Transplant. 2009; 9(3): S1–155. https://doi.org/10.1111/j.1600-6143.2009.02834.x PMID: 19845597
27. Лазарева К.Е., Ржевская О.Н., Загородникова Н.В. Причины развития и методы коррекции посттрансплантационного сахарного диабета. Трансплантология. 2017; 9(4): 335–349. https://doi.org/10.23873/2074-0506-2017-9-4-335-349
28. Boudreaux J.P., McHugh L., Canafax D.M., et al. The impact of cyclosporine and combination immunosuppression on the incidence of posttransplant diabetes in renal allograft recipients. Transplantation. 1987; 44(3): 376–381. https://doi.org/10.1097/00007890-198709000-00010 PMID: 3307061
29. Hjelmesaeth J., Hartmann A., Leivestad T., et al. The impact of early-diagnosed new-onset post-transplantation diabetes mellitus on survival and major cardiac events. Kidney Int. 2006; 69(3): 588–595. https://doi.org/10.1038/sj.ki.5000116 PMID: 16395250
30. Hermayer K.L., Egidi M.F., Finch N.J., et al. A randomized controlled trial to evaluate the effect of glycemic control on renal transplantation outcomes. J Clin Endocrinol Metab. 2012; 97(12): 4399–4406. https://doi.org/10.1210/jc.2012-1979 PMID: 23074234
31. Morbitzer K.A., Taber D.J., Pilch N.A., et al. The impact of diabetes mellitus and glycemic control on clinical outcomes following liver transplant for hepatitis C. Clin Transplant. 2014; 28: 862–868. https://doi.org/10.1111/ctr.12391 PMID: 24893750
32. Garcia C., Wallia A., Gupta S., et al. Intensive glycemic control after heart transplantation is safe and effective for diabetic and non-diabetic patients. Clin Transplant. 2013; 27(3): 444–454. https://doi.org/10.1111/ctr.12118 PMID: 23574363
33. Vanhove T., Remijsen Q., Kuypers D., Gillard P. Drug-drug interactions between immunosuppressants and antidiabetic drugs in the treatment of post-transplant diabetes mellitus. Transplant Rev (Orlando). 2017; 31(2): 69–77. https://doi.org/10.1016/j.trre.2016.09.001 PMID: 27665059
34. Stephen J., Anderson-Haag T.L., Gustafson S., et al. Metformin use in kidney transplant recipients in the United States: an observational study. Am J Nephrol. 2014; 40(6): 546–553. https://doi.org/10.1159/000370034 PMID: 25613554
35. Vest L.S., Koraishy F.M., Zhang Z., et al. Metformin use in the first year after kidney transplant, correlates, and associated outcomes in diabetic transplant recipients: A retrospective analysis of integrated registry and pharmacy claims data. Clin Transplant. 2018; 32(8): e13302. https://doi.org/10.1111/ctr.13302 PMID: 29851159
36. Haidinger M., Werzowa J., Hecking M., et al. Efficacy and safety of vildagliptin in new-onset diabetes after kidney transplantation – a randomized, double-blind, placebo-controlled trial. Am J Transplant. 2014; 14(1): 115–123. https://doi.org/10.1111/ajt.12518 PMID: 24279801
37. Türk T., Pietruck F., Dolff S., et al. Repaglinide in the management of new-onset diabetes mellitus after renal transplantation. Am J Transplant. 2006; 6(4): 842–846. https://doi.org/10.1111/j.1600-6143.2006.01250.x PMID: 16539642
38. Haidinger M., Antlanger M., Kopecky C., et al. Posttransplantation diabetes mellitus: evaluation of treatment strategies. Clin Transplant. 2015; 29(5): 415–424. https://doi.org/10.1111/ctr.12541 PMID: 25777150
39. Boerner B.P., Miles C.D., Shivaswamy V. Efficacy and safety of sitagliptin for the treatment of new-onset diabetes after renal transplantation. Int J Endocrinol. 2014; 2014: 617638. https://doi.org/10.1155/2014/617638 PMID: 24817885
40. Lane J.T., Odegaard D.E., Haire C.E., et al. Sitagliptin therapy in kidney transplant recipients with new-onset diabetes after transplantation. Transplantation. 2011; 92(10): e56–57. https://doi.org/10.1097/TP.0b013e3182347ea4 PMID: 22067216
41. Strøm Halden T.A., Åsberg A., Vik K., et al. Short-term efficacy and safety of sitagliptin treatment in long-term stable renal recipients with new-onset diabetes after transplantation. Nephrol Dial Transplant. 2014; 29(4): 926–933. https://doi.org/10.1093/ndt/gft536 PMID: 24452849
42. Gueler I., Mueller S., Helmschrott M., et al. Effects of vildagliptin (Galvus®) therapy in patients with type 2 diabetes mellitus after heart transplantation. Drug Des Devel Ther. 2013; 7: 297–303. https://doi.org/10.2147/DDDT.S43092 PMID: 23630415
43. Halden T.A.S., Egeland E.J., Åsberg A., et al. GLP-1 restores altered insulin and glucagon secretion in posttransplantation diabetes. Diabetes Care. 2016; 39(4): 617–624. https://doi.org/10.2337/dc15-2383 PMID: 26908914
44. Pinelli N.R., Patel A., Salinitri F.D. Coadministration of liraglutide with tacrolimus in kidney transplant recipients: a case series. Diabetes Care. 2013; 36(10): e171–172. https://doi.org/10.2337/dc13-1066 PMID: 24065848
45. Vallon V., Gerasimova M., Rose M.A., et al. SGLT2 inhibitor empagliflozin reduces renal growth and albuminuria in proportion to hyperglycemia and prevents glomerular hyperfiltration in diabetic Akita mice. Am J Physiol Renal Physiol. 2014; 306(2): F194–204. https://doi.org/10.1152/ajprenal.00520.2013 PMID: 24226524
46. Zinman B., Wanner C., Lachin J.M., et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015; 373(22): 2117–2128. https://doi.org/10.1056/NEJMoa1504720 PMID: 26378978
47. Mahling M., Schork A., Nadalin S., et al. Sodium-glucose cotransporter 2 (SGLT2) inhibition in kidney transplant recipients with diabetes mellitus. Kidney Blood Press Res. 2019; 44(5): 984–992. https://doi.org/10.1159/000501854 PMID: 31437852
48. Rajasekeran H., Kim S.J., Cardella C.J., et al. Use of canagliflozin in kidney transplant recipients for the treatment of type 2 diabetes: a case series. Diabetes Care. 2017; 40(7): e75–76. https://doi.org/10.2337/dc17-0237 PMID: 28416475
49. Cehic M., Greenfield J., Hayward Ch., et al. Impact of empagliflozin for the treatment of diabetes mellitus after heart transplantation. Transplantation. 2018; 102(7): S88. https://doi.org/10.1097/01.tp.0000542675.44943.1c
Об авторах
А. В. БалашоваРоссия
Балашова Анастасия Владимировна, ассистент кафедры эндокринологии № 1
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
+7 (916) 102-67-60
В. Р. Мустафина
Россия
Мустафина Виолетта Рафаэлевна, ординатор
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
И. В. Глинкина
Россия
Глинкина Ирина Владимировна, канд. мед. наук, доцент кафедры эндокринологии № 1
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991






































