Перейти к:
VEGF-C — биомаркер повреждения почек при экспериментальной интраабдоминальной гипертензии
https://doi.org/10.47093/2218-7332.2020.11.3.47-56
Аннотация
Лимфангиогенез играет важную роль в развитии воспаления паренхимы почек при их повреждении. Васкулоэндотелиальный фактор роста тип С (vascular endothelial growth factor, VEGF-C) — цитокин, регулирующий лимфангиогенез, — является потенциальным ранним биомаркером острого повреждения почек.
Цель. Изучить содержание VEGF-C в почечном гомогенате и сыворотке крови новорожденных крыс с экспериментальной интраабдоминальной гипертензией (ИАГ) различной тяжести и длительности, установить взаимосвязь с морфологическими изменениями в паренхиме почек.
Материалы и методы. Эксперимент проведен на 50 новорожденных крысах линии Wistar, которые были разделены на 5 групп по 10 особей: группы 1 и 2 с легкой ИАГ длительностью 5 и 10 дней соответственно, группы 3 и 4 с тяжелой ИАГ длительностью 5 и 10 дней соответственно и 5-я контрольная группа. ИАГ достигалась введением стерильного вазелина в брюшную полость до заданного уровня интраабдоминального давления под контролем интравезикальной манометрии. Содержание VEGF-C измерялось методом ELISA. Морфологическое исследование биопсийного материала и его фотосъемка осуществлялись на микроскопе Leica DM2000. Сравнение групп проводилось с помощью критериев Манна — Уитни, Краскела — Уоллиса, Вилкоксона; проводился однофакторный дисперсионный анализ.
Результаты. Отмечено увеличение концентрации VEGF-C в почечном гомогенате во всех экспериментальных группах (pк < 0,001). Степень повышения VEGF-C зависела от тяжести ИАГ (p < 0,05), но не от длительности экспозиции ИАГ. Содержание VEGF-C в сыворотке крови было повышено только в 3-й группе (pк = 0,011). При морфологическом исследовании установлены изменения, которые характерны для гидропической дистрофии: изменение высоты канальцевого эпителия, нарастание отека интерстиция, расширение мочевых пространств гломерул. Степень морфологических изменений паренхимы почек зависела от тяжести и длительности ИАГ.
Заключение. Наблюдалась взаимосвязь между морфологическими изменениями паренхимы почек при ИАГ различной тяжести и длительности и изменением уровня VEGF-C в почечном гомогенате.
Ключевые слова
Васкулоэндотелиальный фактор роста тип С (vascular endothelial growth factor, VEGF-C) — представитель семейства сосудистых факторов роста, регулирующих ангиогенез в физиологических и патологических условиях. VEGF-C оказывает действие, связываясь со своими рецепторами VEGFR-2 (vascular endothelial growth factor receptor) и VEGFR-3 на поверхности эндотелиоцитов. При этом рецепторы VEGFR-3 экспрессируются преимущественно лимфатическими эндотелиоцитами, тогда как VEGFR-2 представлены на поверхности эндотелиоцитов как лимфатических, так и кровеносных сосудов [1]. Действие VEGF-C на лимфатические эндотелиоциты через VEGFR-3 имеет решающее значение для их выживаемости, пролиферации и миграции [2], что делает VEGF-C ключевым фактором, регулирующим лимфангиогенез. Связываясь с VEGFR-2, VEGF-C также оказывает влияние на кровеносные сосуды [3][4][5].
Лимфатические сосуды играют важную роль в развитии воспаления паренхимы почек. Отек тубулоинтерстициального пространства, возникающий в процессе воспалительного ответа, индуцирует ремоделирование межклеточного матрикса, которое впоследствии может приводить к фиброзу. Лимфангиогенез, стимулируемый при воспалении, улучшает дренаж межклеточной жидкости, обеспечивает условия для миграции и активации иммунных клеток, ускоряет удаление остатков погибших клеток и провоспалительных медиаторов [6]. В конечном счете эти процессы приводят к уменьшению интенсивности воспалительного ответа и, как следствие, к уменьшению неспецифического повреждения паренхимы [4].
Сигнальный путь VEGF-C/VEGFR-3 оказывает существенное влияние на процесс воспаления, сопровождающегося отеком [7]. На экспериментальной модели односторонней обструкции мочеточника было показано, что интенсивность лимфангиогенеза коррелирует с экспрессией VEGF-C и VEGF-D в почках и выраженностью фиброза. Также было показано, что источником VEGF-C в почках являются макрофаги и тубулоэпителиальные клетки. При этом экспрессия VEGF-C в М2-поляризованных макрофагах выше, чем в М1 [8]. Эти данные подтверждаются результатами исследования S. Hasegawa и соавт. [9], согласно которым VEGF-C снижает интенсивность макрофагальной инфильтрации, в особенности М1-поляризованных макрофагов. Они продемонстрировали, что VEGF-C в модели односторонней обструкции мочеточника снижал экспрессию коллагена 1-го типа и трансформирующего фактора роста бета-1 (transforming growth factor beta 1, TGF-β1). In vitro VEGF-C стимулировал пролиферацию лимфатических эндотелиоцитов и индуцировал в них экспрессию молекул адгезии ICAM-1 (inter-cellular adhesion molecule 1, молекула межклеточной адгезии 1), VCAM-1 (vascular cell adhesion molecule 1, васкулярная молекула клеточной адгезии 1) и E-селектинов. В исследовании X. Chang и соавт. [10] установлено регуляторное влияние VEGF-C на выживаемость тубулоэпителиальных клеток и процесс аутофагии. Таким образом, было показано, что в почках VEGF-C выполняет защитную и противовоспалительную функцию.
Исследований, в которых изучается лимфангиогенез при заболеваниях почек, крайне мало, в особенности в контексте острого повреждения почек. На данный момент наиболее полно эта тема освещена в исследовании A. Zarjou и соавт. [11]. На экспериментальной мышиной модели реперфузионного повреждения почек было показано, что уровень экспрессии VEGF-C в почках и его концентрация в сыворотке крови при остром повреждении почек повышается. Похожая картина наблюдается и на мышиной модели цисплатин индуцированного повреждения почек. При этом повышение концентрации VEGF-C также обнаруживается в моче. Важно отметить, что повышение уровня экспрессии и концентрации в сыворотке и в моче наблюдалось при моделировании как острого, так и хронического цисплатин-индуцированного повреждения почек. Таким образом, измерение VEGF-C в сыворотке и/или в моче может стать важным инструментом диагностики состояния паренхимы почек.
Острое повреждение почек — важное звено патогенеза синдрома интраабдоминальной гипертензии (СИАГ) — нарушения функции органа или системы органов, возникающего или усугубляющегося на фоне интраабдоминальной гипертензии (ИАГ) [12]. В связи с более низкими показателями артериального давления и более высокими показателями нормального интраабдоминального давления (ИАД), по сравнению со взрослыми, СИАГ у детей может развиваться при менее выраженном подъеме ИАД [13]. При этом новорожденные особенно чувствительны к ИАГ в связи с морфофункциональными особенностями организма [14][15]. Совершенствование диагностики и тактики ведения СИАГ позволило снизить смертность взрослых пациентов c СИАГ с 80 до 37% [16][17][18]. Однако среди пациентов детского возраста смертность от СИАГ остается на стабильном уровне в 40–60% [19][20]. Ключом к решению этой проблемы могут стать новые методы ранней диагностики повреждения почек, которые позволят своевременно выявлять показания для ренопротективной терапии.
Мы предположили, что колебания VEGF-C в почечном гомогенате и сыворотке крови новорожденных крыс с ИАГ разной тяжести и длительности могут отражать наличие повреждения почек и его интенсивность. Цель нашего исследования: изучить содержание VEGF-C в почечном гомогенате и сыворотке крови новорожденных крыс с экспериментальной ИАГ различной тяжести и длительности, установить взаимосвязь с морфологическими изменениями в паренхиме почек.
МАТЕРИАЛЫ И МЕТОДЫ
Этика
Проведение исследования одобрено локальным этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» 04.12.2019 (выписка из протокола заседания № 16-19). Все процедуры с участием экспериментальных животных проводились в соответствии с ГОСТ 33215-2014 от 1.07.2016, ГОСТ 33216-2014 от 1.07.2016 и Руководством по уходу и использованию лабораторных животных (Guide for the Care and Use of Laboratory Animals, 8th edition) [21].
Экспериментальные животные
Эксперимент проведен на 50 новорожденных крысах Wistar (возраст 10–12 дней), которые были разделены на 5 групп по 10 особей в каждой: группы 1 и 2 — с легкой ИАГ длительностью 5 и 10 дней соответственно, группы 3 и 4 — с тяжелой ИАГ длительностью 5 и 10 дней соответственно и 5-я группа — контрольная (рис. 1).

РИС. 1. Схема исследования.
FIG. 1. Scheme of the study.
Моделирование интраабдоминальной гипертензии
Моделирование ИАГ на крысах достигалось введением стерильного вазелина в брюшную полость до заданного уровня ИАД под контролем интравезикальной манометрии: 9 ± 2 мм рт. ст. в группах легкой ИАГ, 17 ± 2 мм рт. ст. в группах тяжелой ИАГ. В контрольной группе крысам проводилась пункция брюшной полости без последующего введения вазелина.
Выведение животных из эксперимента и забор биологического материала
Вывод животных из эксперимента осуществлялся под фторотановым наркозом путем декапитации по истечению периода экспозиции ИАГ. Забор крови происходил интракардиально, биоматериал аликвотировали в пластиковые пробирки типа эппендорф. Далее происходило изъятие почек: одну почку помещали в пластиковую пробирку и замораживали при t –70 °C, вторую помещали в контейнер с 10% раствором нейтрального формалина. Образцы крови центрифугировали 10 мин при 2000 g и отделяли сыворотку, которую замораживали при t –70 °C.
Измерение концентраций биомаркеров
Перед проведением исследования почки гомогенизировали в ступке на льду в 1,15% буфере KCl (pH 7,4). Почечный гомогенат центрифугировали 10 мин при 14 000 g при t 4 °C, после чего собирали супернатант в чистые пластиковые пробирки типа эппендорф. Содержание VEGF-C в сыворотке и почечном гомогенате измерялось методом твердофазного иммуноферментного анализа с использованием наборов Rat VEGF-C ELISA (Bender MedSystems, Австрия).
Морфологическое и морфометрическое исследование
Для проведения морфологического и морфометрического исследования были случайно отобраны по 5 крыс из каждой группы. Морфологические препараты готовили, используя стандартные гистологические методики, окрашивали гематоксилином и эозином. Последовательные серийные гистологические срезы толщиной 2–3 мкм получали на ротационном микротоме. Была проведена микроскопия всей площади поверхностей срезов в преходящем
свете на световом микроскопе Leica DM5000B (Leica Microsystems, Швейцария). Для морфометрического исследования случайным образом бесконтрольно (при помощи препаратоводителя на столике микроскопа) выбрано 20 полей зрения при увеличении микроскопа ×100 раз, в которых измерялись периметр и площадь почечных клубочков, извитых канальцев (проксимальных и дистальных), прямых канальцев, собирательных трубочек, тонкого сегмента петли Генле и высота уротелия. Захват гистологических изображений осуществляли при помощи камеры для микроскопа Leica DFC490 c программным обеспечением LAS V4.8 (Leica Microsystems, Швейцария). Анализ полученных изображений проводили, используя специализированное программное обеспечение для медицинской морфометрии Axio Vision 4.8.2 (Carl Zeiss, Германия). Для обеспечения достоверности данных при определении каждого параметра использовали серию дублирующих измерений.
Статистическая обработка данных
Нормальность распределения значений изучаемых морфометрических признаков в исследуемых группах оценивалась тестом Шапиро — Уилка. Данные представлены как медиана и интерквартильный размах (25-й и 75-й перцентили).
Для определения различий показателей биомаркеров в экспериментальных и контрольной группах использовался критерий Манна — Уитни; в группах с ИАГ разной тяжести — критерий Краскела — Уоллиса, в группах с ИАГ тяжелой или легкой степени разной продолжительности — критерий Вилкоксона. При проведении множественного сравнения применяли критерий Данна. Для сравнения медианы периметра и площади структур почки, а также высоты уротелия 4 групп между собой и с контрольной использовался однофакторный дисперсионный анализ (one-way ANOVA). Различия считали значимыми при р < 0,05.
Для статистической обработки данных использовалась компьютерная программа IBM SPSS v.23.0 (SPSS: An IBM Company, США).
РЕЗУЛЬТАТЫ
Содержание VEGF-C в почечном гомогенате
Во всех экспериментальных группах в почечном гомогенате содержание VEGF-C по сравнению с контролем (125 [52; 162] пг/мл) было статистически значимо повышено: в группе 1 — 256 [209; 343] пг/мл (p < 0,001), в группе 2 — 230 [196; 279] пг/мл (p < 0,001), в группе 3 — 271 [264; 365] пг/мл (p < 0,001) и в группе 4 — 243 [194; 320] пг/мл (p < 0,001) (рис. 2).
Наблюдалась связь между повышением уровня VEGF-C и тяжестью ИАГ: при сравнении групп 1 и 3 (p < 0,001), 2 и 4 (p < 0,001) были выявлены значимые различия. Взаимосвязи между изменением уровня VEGF-C и длительностью экспозиции ИАГ не обнаружено: при сравнении групп 1 и 2 (p = 0,26) и групп 2 и 4 (p = 0,173) значимых различий уровня VEGF-C не выявлено (рис. 2).
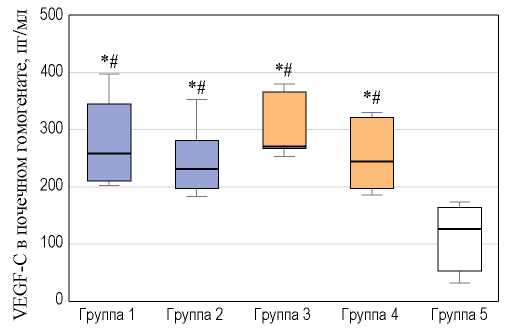
РИС. 2. Уровень VEGF-C в почечном гомогенате новорожденных крыс с экспериментальной интраабдоминальной гипертензией.
FIG. 2. VEGF-C renal homogenate level in newborn rats with experimental intraabdominal hypertension.
Примечание. * — p < 0,05 при сравнении с контролем; # — p < 0,05 при сравнении контрольной группы и групп с легкой ИАГ и тяжелой ИАГ.
Note. * — p < 0.05 when comparing with control; # — p < 0.05 when comparing control with mild and severe IAH.
Таким образом, ИАГ у новорожденных крыс вызывала подъем уровня VEGF-C в почечном гомогенате, при этом степень повышения VEGF-C зависела от тяжести ИАГ.
Содержание VEGF-C в сыворотке
Статистически значимое повышение VEGF-C в сыворотке по сравнению с контролем наблюдалось только в 3-й группе — у крыс с тяжелой ИАГ длительностью 5 дней: 84 [62; 223] пг/мл (p < 0,001). Значимых отличий содержания VEGF-C в группе 1 — 47 [45; 75] пг/мл (p = 0,082), группе 2 — 57 [46; 66] пг/мл (p = 0,272) и группе 4 — 66 [54; 76] пг/мл (p = 0,54) от контрольной группы — 62 [50; 71] пг/мл не выявлено (рис. 3).
Было выявлено статистически значимое различие уровня VEGF-C в группах 1 и 3 — с легкой и тяжелой ИАГ длительностью 5 дней (p = 0,011), а также в группах с тяжелой ИАГ длительностью 5 и 10 дней (p = 0,028). При сравнении групп 1 и 2 (p = 0,799) и групп 2 и 4 (p = 0,471) значимых отличий уровня VEGF-C не выявлено (рис. 3).
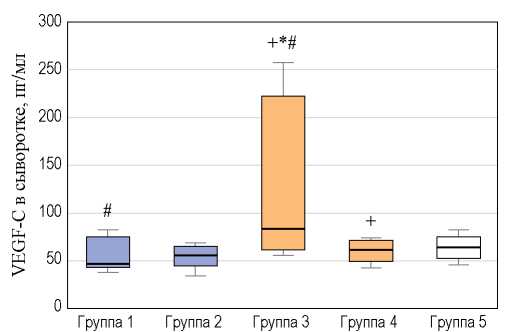
РИС. 3. Уровень VEGF-C в сыворотке новорожденных крыс с экспериментальной интраабдоминальной гипертензией.
FIG. 3. VEGF-C serum level in newborn rats with experimental intraabdominal hypertension.
Примечание. * — p < 0,05 при сравнении с контролем; # — p < 0,05 при сравнении контрольной группы и групп с легкой и тяжелой ИАГ; + — p < 0,05 при сравнении групп с продолжительностью ИАГ 5 и 10 дней.
Note. * — p < 0.05 when comparing with control; # — p < 0.05 when comparing control with mild and severe IAH; + — p < 0.05 when comparing groups of 5 and 10 days of IAH.
Таким образом, колебания уровня VEGF-C в сыворотке крови не были связаны с тяжестью или длительностью ИАГ у крыс.
Морфологический анализ паренхимы почек
В паренхиме почек крыс группы 1 были обнаружены минимально выраженные морфологические изменения: наличие расширения просветов собирательных трубочек в мозговом слое, слущивание эпителия в их просветы.
У крыс группы 2 были обнаружены незначительное расширение мочевого пространства гломерул; наличие в цитоплазме клеток эпителия проксимальных извитых канальцев, расположенных вблизи междольковых вен коркового слоя, начальных проявлений гидропической дистрофии.
В группе 3 изменения сходны со 2-й группой, также наблюдалось увеличение размеров клубочка и гидропия эпителия.
В группе 4 наблюдалось значительное расширение мочевого пространства гломерул; выраженные гидропические изменения по типу баллонной дегенерации эпителия единичных канальцев в этой же зоне; значительное расширение просветов собирательных трубочек мозгового слоя; разрыхление и отек интерстиция на границе коркового и мозгового слоев (рис. 4а и б).
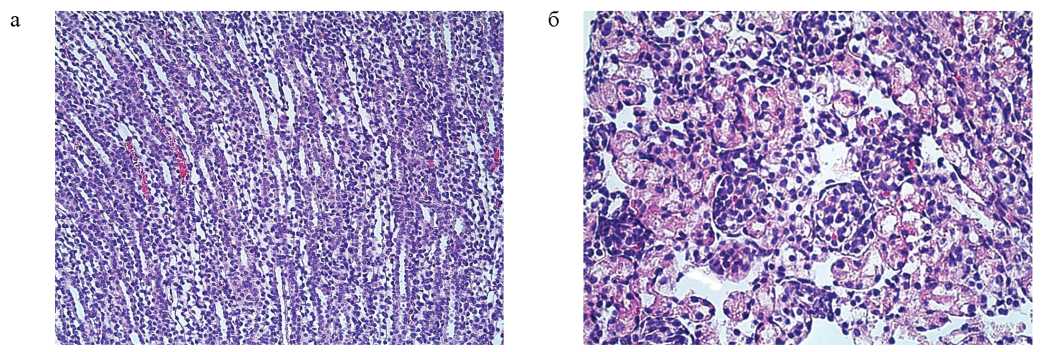
РИС. 4. Морфологические изменения в паренхиме почек в группе 4: а — расширенные просветы собирательных трубочек, фрагментов петли Генле в лучах мозгового слоя, гидропия выстилающего эпителия. Окраска гематоксилином и эозином, увеличение ×200; б — выраженный отек интерстиция, гидропия эпителия (вплоть до баллонной дегенерации) проксимальных и дистальных извитых канальцев коркового слоя. Окраска гематоксилином и эозином, увеличение ×400.
FIG. 4. Morphologic changes in the kidney parenchyma in group 4: а — dilated lumens of the collecting ducts and Henle’s loop segments in the medullary rays, hydropic change in epithelium. Hematoxylin and eosin staining, ×200 magnification; б — severe interstitial edema, hydropic change in epithelium (up to ballooning degeneration) of the proximal and distal convoluted tubules in the renal cortex. Staining with hematoxylin and eosin, magnification ×400.
Таким образом, с нарастанием тяжести и длительности ИАГ в паренхиме почек наблюдались все более выраженные морфологические изменения.
Морфометрический анализ паренхимы почек
В группах 1 и 3 по сравнению с контрольной группой наблюдалось уменьшение периметра и площади почечных телец (p < 0,01) и прямых почечных канальцев (p < 0,01). У крыс с ИАГ по сравнению с контрольной группой наблюдалось уменьшение периметра и площади проксимальных извитых канальцев в группе 3 (p < 0,05) и увеличение этих показателей в группах 2 и 4 (p < 0,01), аналогичные изменения наблюдались с показателями периметра и площади собирательных трубочек (группы 2 и 3, p < 0,01; группа 4, p < 0,05). Уменьшение периметра и площади дистальных извитых канальцев наблюдалось только в группе 2 (p < 0,05). У крыс с ИАГ по сравнению с контрольной группой наблюдалось уменьшение периметра и площади тонкого сегмента петли Генле в группе 3 (p < 0,05) и увеличение этих показателей в группе 2 (p < 0,01). При этом значимых изменений высоты уротелия у крыс с ИАГ обнаружено не было.
Таким образом, периметр и площадь собирательных трубочек, тонкого сегмента петли Генле, проксимальных, дистальных и прямых канальцев имели тенденцию к уменьшению в группах с ИАГ длительностью 5 дней с последующим повышением в группах с ИАГ длительностью 10 дней (табл.).
Таблица. Периметр и площадь структур паренхимы почек групп крыс с интраабдоминальной гипертензией и контрольной группы
Table. The perimeter and area of renal parenchyma structures in groups of rats with intraabdominal hypertension and control
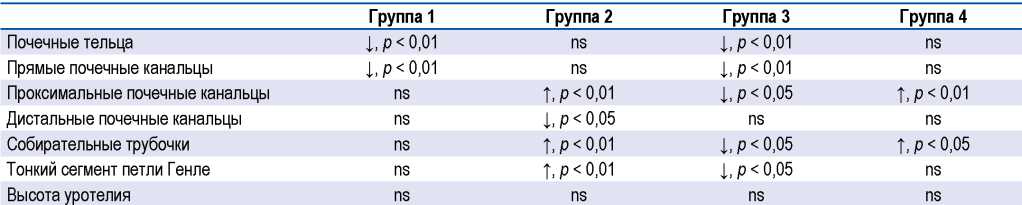
Примечание. ns — незначимо.
Note. ns — not significant.
ОБСУЖДЕНИЕ
VEGF-C является ключевым регулятором лимфангиогенеза и играет важную роль в процессе воспаления. Повышение его концентрации в сыворотке крови и моче при повреждении почек делает его потенциальным биомаркером этого состояния [9][22][23]. VEGF-C экспрессируют различные ткани [24], в том числе ткани кишечника, печени и почек, которые подвержены повреждению при ИАГ [25][26]. Это делает сывороточный уровень VEGF-C, в отличие от его концентрации в моче, неспецифичным к повреждению паренхимы именно почек.
В нашем исследовании в экспериментальной модели ИАГ у новорожденных крыс мы не наблюдали статистически значимой тенденции к повышению уровня VEGF-C в сыворотке (он был повышен только у крыс с тяжелой ИАГ длительностью 5 дней). Нам неизвестны другие работы, в которых исследовался сывороточный уровень VEGF-C у пациентов или экспериментальных животных с ИАГ. Однако в стандартных моделях повреждения почек (модель ишемия/реперфузия, цисплатин-индуцированное повреждение, односторонняя обструкция мочеточника и т.п.) наблюдается повышение сывороточного уровня VEGF-C [9][11]. Такое различие может объясняться менее выраженным повреждением паренхимы у крыс с ИАГ. Интенсивности повреждения могло быть недостаточно для существенного повышения уровня экспрессии VEGF C, которое бы повлияло на его содержание в сыворотке. Возможно также, что небольшой объем выборки не позволил детектировать невыраженные колебания уровня VEGF-C изза большого объема распределения цитокина в сыворотке.
Мы наблюдали повышение уровня VEGF-C в почечном гомогенате крыс с экспериментальной ИАГ. При этом концентрация VEGF-C зависела от тяжести ИАГ. Такая картина свидетельствует об активации процесса лимфангиогенеза в паренхиме почек, наличия воспаления и персистирующего повреждения тканей, интенсивность которых увеличивается с ростом ИАД. Это согласуется с современным представлением о патогенезе повреждения почек при ИАГ
[26]. A. Zarjou и соавт. [11] c помощью иммуногистохимического исследования показали, что VEGF-C в норме определяется в просвете почечных канальцев и в моче; при повреждении почек происходит стимуляция секреции VEGF-C и его концентрация в моче растет. Таким образом, одной из причин подъема уровня VEGF-C в почечном гомогенате крыс с ИАГ является увеличение его концентрации в моче.
Сбор достаточного количества мочи для проведения стандартного иммуноферментного анализа у новорожденных крыс крайне затруднителен. Изучение содержания VEGF-C в моче взрослых экспериментальных животных, а также пациентов с ИАГ может улучшить понимание патогенеза повреждения почек при ИАГ и показать, возможно ли использование VEGF-C в качестве мочевого биомаркера повреждения почек у людей.
Данные морфологического исследования свидетельствуют о наличии повреждения почек у новорожденных крыс с ИАГ, выраженность которого зависела от тяжести и длительности ИАГ. Мы наблюдали признаки гидропической дистрофии тканей, отека и венозного полнокровия паренхимы, расширение мочевых пространств гломерул и собирательных трубочек. В исследовании А. Köşüm и соавт. [27] тяжелая ИАГ (20–30 мм рт. ст.) у взрослых
крыс достигалась путем создания пневмоперитонеума. Эффект ИАГ оценивался спустя 3 часа. При морфологическом исследовании наблюдались венозное полнокровие гломерул, фокусы кровоизлияний в интерстиций, расширение лоханки и мочеточника. В исследовании X. Chang и соавт. [28] ИАГ у крыс с циррозом печени достигалась путем введения раствора альбумина и изотонического раствора натрия интраперитонеально. Эффект ИАГ оценивался спустя сутки. Так, при морфологическом исследовании у крыс с ИАД 5 и 10 cм H2O были обнаружены сужение просветов канальцев и воспалительная инфильтрация интерстиция. У крыс с ИАД 20 cм H2O были также выявлены признаки гидропической дистрофии эпителия, отека паренхимы и ее полнокровия, а также сформированные почечные цилиндры в просветах канальцев. В исследовании D. Morozov и соавт. [29] легкая и тяжелая ИАГ у новорожденных крыс достигалась путем введения бычьего коллагена интраперитонеально. Эффект ИАГ оценивался спустя 8 суток. При морфологическом исследовании наблюдались: в группе легкой ИАГ — минимальная дилатация мочевых пространств гломерул, вакуолизация эпителия проксимальных извитых канальцев, дилатация собирательных трубочек с невыраженной десквамацией эпителия в просветы; в группе тяжелой ИАГ — выраженная дилатация мочевых пространств гломерул, гидропическая дегенерация эпителия проксимальных извитых канальцев, кистозная трансформация проксимальных извитых канальцев и собирательных трубочек. Таким образом, наши данные не противоречат результатам других исследований, использующих иные модели ИАГ. Небольшие отличия морфологических изменений могут объясняться различием способа моделирования ИАГ и ее длительности.
В нашем исследовании мы также подтвердили наличие ряда признаков повреждения почек с помощью морфометрического анализа. Мы наблюдали тенденцию к увеличению периметра и площади собирательных трубочек, тонкого сегмента петли Генле, проксимальных, дистальных и прямых канальцев, связанную с увеличением длительности ИАГ. Данные морфометрического анализа в группах с ИАГ длительностью 10 дней коррелируют с результатами морфологического исследования.
Наше исследование имеет ряд ограничений. Малый размер выборки ограничивает трактовку результатов морфологического и морфометрического исследования и не позволяет уловить минимальные изменения концентраций маркера в почечном гомогенате и сыворотке крови. Используемая нами модель ИАГ является авторской и требует дальнейшего изучения. Изменения, наблюдаемые у крыс, могут не совпадать с изменениями в человеческом организме при действии тех же факторов.
Определение VEGF-C в моче может стать одним из способов оценки состояния паренхимы почек у пациентов с ИАГ. Однако для более полного понимания взаимосвязи повреждения почек при ИАГ с концентрацией VEGF-C в моче необходимы дальнейшие исследования с использованием других экспериментальных моделей ИАГ и исследования с участием пациентов с ИАГ и СИАГ.
ЗАКЛЮЧЕНИЕ
У новорожденных крыс с экспериментальной ИАГ наблюдалось повышение уровня VEGF-C в почечном гомогенате. Изменения концентрации VEGF-C были связаны с тяжестью ИАГ и коррелировали с морфологическими изменениями в паренхиме почек. Связи колебаний уровня VEGF-C в сыворотке с морфологическими изменениями в паренхиме почек не наблюдалось.
ВКЛАД АВТОРОВ
О.Л. Морозова и Л.Д. Мальцева разработали основную концепцию и дизайн исследования, а также проводили редактуру статьи. В.В. Яковлев совместно с А.В. Бадаевой проводили эксперимент, отбирали и анализировали биоматериал. В.В. Яковлев занимался интерпретацией полученных лабораторных данных, а также написал основную часть финальной версии статьи. Л.О. Севергина и Е.И. Иванова проводили морфологический и морфометрический анализ биоматериала и интерпретировали полученные данные. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Olga L. Morozova and Larisa D. Maltseva developed the basic concept and design of the study and edited the article. Vladislav V. Iakovlev and Anastasiia V. Badaeva conducted an experiment, collected and tested biomaterial. Vladislav V. Iakovlev interpreted obtained laboratory data, and also wrote the final version of the article. Lyubov O. Severgina and Elena I. Ivanova carried out morphological and morphometric analysis of biomaterial and interpreted obtained data. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (РФФИ) в рамках научного проекта № 20-315-90075.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The reported study was funded by Russian Foundation for Basic Research (RFBR), project number № 20-315-90075.
Список литературы
1. Rauniyar K., Jha S.K., Jeltsch M. Biology of Vascular Endothelial Growth Factor C in the Morphogenesis of Lymphatic Vessels. Front Bioeng Biotechnol. 2018; 6: 7. https://doi.org/10.3389/fbioe.2018.00007 PMID: 29484295
2. Veikkola T., Jussila L., Makinen T., et al. Signalling via vascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice. EMBO J. 2001; 20(6): 1223–31. https://doi.org/10.1093/emboj/20.6.1223 PMID: 11250889
3. Mäkinen T., Veikkola T., Mustjoki S., et al. Isolated lymphatic endothelial cells transduce growth, survival and migratory signals via the VEGF-C/D receptor VEGFR-3. EMBO J. 2001; 20(17): 4762–73. https://doi.org/10.1093/emboj/20.17.4762 PMID: 11532940
4. Huggenberger R., Ullmann S., Proulx S.T., et al. Stimulation of lymphangiogenesis via VEGFR-3 inhibits chronic skin inflammation. J Exp Med. 2010; 207(10): 2255–69. https://doi.org/10.1084/jem.20100559 PMID: 20837699
5. Hamada K., Oike Y., Takakura N., et al. VEGF-C signaling pathways through VEGFR-2 and VEGFR-3 in vasculoangiogenesis and hematopoiesis. Blood. 2000; 96(12): 3793–800. https://doi.org/10.1182/blood.V96.12.3793 PMID: 11090062
6. Kim H., Kataru R.P., Koh G.Y. Inflammation-associated lymphangiogenesis: a double-edged sword? J Clin Invest. 2014; 124(3): 936–42. https://doi.org/10.1172/JCI71607 PMID: 24590279
7. Onimaru M., Yonemitsu Y., Fujii T., et al. VEGF-C regulates lymphangiogenesis and capillary stability by regulation of PDGF-B. Am J Physiol Heart Circ Physiol. 2009; 297(5): H1685–96. https://doi.org/10.1152/ajpheart.00015.2009 PMID: 19734356
8. Lee A.S., Lee J.E., Jung Y.J., et al. Vascular endothelial growth factor-C and -D are involved in lymphangiogenesis in mouse unilateral ureteral obstruction. Kidney Int. 2013; 83(1): 50–62. https://doi.org/10.1016/j.kint.2017.07.006 PMID: 28938942
9. Hasegawa S., Nakano T., Torisu K., et al. Vascular endothelial growth factor-C ameliorates renal interstitial fibrosis through lymphangiogenesis in mouse unilateral ureteral obstruction. Lab Invest. 2017; 97(12): 1439–52. https://doi.org/10.1016/j.kint.2017.07.00610.1038/labinvest.2017.77 PMID: 29083411
10. Chang X., Yang Q., Zhang C., et al. Roles for VEGF-C/NRP-2 axis in regulating renal tubular epithelial cell survival and autophagy during serum deprivation. Cell Biochem Funct. 2019; 37(4): 290– 300. https://doi.org/10.1002/cbf.3402 PMID: 31211440
11. Zarjou A., Black L.M., Bolisetty S., et al. Dynamic signature of lymphangiogenesis during AKI and CKD. Lab Invest. 2019; 99(9): 1376–88. https://doi.org/10.1038/s41374-019-0259-0 PMID: 31019289
12. Kirkpatrick A.W., Roberts D.J., De Waele J., et al. Intraabdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013; 39(7): 1190–206. https://doi.org/10.1007/s00134-013-2906-z PMID: 23673399
13. Thabet F.C., Bougmiza I.M., Chehab M.S., et al. Incidence, Risk Factors, and Prognosis of Intra-Abdominal Hypertension in Critically Ill Children: A Prospective Epidemiological Study. J Intensive Care Med. 2016; 31(6): 403–8. https://doi.org/10.1177/0885066615583645 PMID: 25922384
14. Steinau G., Kaussen T., Bolten B., et al. Abdominal compartment syndrome in childhood: diagnostics, therapy and survival rate. Pediatr Surg Int. 2011; 27(4): 399–405. https://doi.org/10.1007/s00383-010-2808-x PMID: 21132501
15. Kaussen T., Steinau G., Srinivasan P., et al. Recognition and management of abdominal compartment syndrome among German pediatric intensivists: results of a national survey. Ann Intensive Care. 2012; 2 Suppl 1(Suppl 1): S8. https://doi.org/10.1186/2110-5820-2-S1-S8 PMID: 22873424
16. Vidal M.G., Ruiz Weisser J., Gonzalez F., et al. Incidence and clinical effects of intra-abdominal hypertension in critically ill patients. Crit Care Med. 2008; 36(6): 1823–31. https://doi.org10.1097/CCM.0b013e31817c7a4d PMID: 18520642
17. De Waele J., Desender L., De Laet I., et al. Abdominal decompression for abdominal compartment syndrome in critically ill patients: a retrospective study. Acta Clin Belg. 2010; 65(6): 399– 403. https://doi.org/10.1179/acb.2010.65.6.005 PMID: 21268953
18. Carr J.A. Abdominal compartment syndrome: a decade of progress. J Am Coll Surg. 2013; 216(1): 135–46. https://doi.org/10.1016/j.jamcollsurg.2012.09.004 PMID: 23062520
19. Ejike J.C., Humbert S., Bahjri K., Mathur M. Outcomes of children with abdominal compartment syndrome. Acta Clin Belg. 2007; 62 Suppl 1: 141–8. https://doi.org/10.1179/acb.2007.62. s1.018 PMID: 17469712
20. Pearson E.G., Rollins M.D., Vogler S.A., et al. Decompressive laparotomy for abdominal compartment syndrome in children: before it is too late. J Pediatr Surg. 2010; 45(6): 1324–9. https://doi.org/10.1016/j.jpedsurg.2010.02.107 PMID: 20620339
21. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th ed. Washington (DC): National Academies Press (US); 2011. https://doi.org/10.17226/12910 PMID: 21595115
22. Kinashi H., Falke L.L., Nguyen T.Q., et al. Connective tissue growth factor regulates fibrosis-associated renal lymphangiogenesis. Kidney Int. 2017; 92(4): 850–63. https://doi.org/10.1016/j.kint.2017.03.029 PMID: 28545716
23. Beaini S., Saliba Y., Hajal J., et al. VEGF-C attenuates renal damage in salt-sensitive hypertension. J Cell Physiol. 2019; 234(6): 9616–30. https://doi.org/10.1002/jcp.27648 PMID: 30378108
24. Joory K.D, Levick J.R., Mortimer P.S., Bates D.O. Vascular endothelial growth factor-C (VEGF-C) expression in normal human tissues. Lymphat Res Biol. 2006; 4(2): 73–82. https://doi.org/10.1089/lrb.2006.4.73 PMID: 16808669
25. Divarci E., Karapinar B., Yalaz M., et al. Incidence and prognosis of intraabdominal hypertension and abdominal compartment syndrome in children. J Pediatr Surg. 2016; 51(3): 503–7. https://doi.org/10.1016/j.jpedsurg.2014.03.014 PMID:25783342
26. Villa G., Samoni S., De Rosa S., Ronco C. The Pathophysiological Hypothesis of Kidney Damage during Intra-Abdominal Hypertension. Front Physiol. 2016 Feb 23; 7: 55. https://doi.org/10.3389/fphys.2016.00055 PMID: 26941652
27. Köşüm A., Borazan E., Maralcan G., Aytekin A. Biochemical and histopathological changes of intra-abdominal hypertension on the kidneys: Experimental study in rats. Ulus Cerrahi Derg. 2013; 29(2): 49–53. https://doi.org/5152/UCD.2013.39 PMID: 25931845
28. Chang Y., Qi X., Li Z., et al. Hepatorenal syndrome: insights into the mechanisms of intra-abdominal hypertension. Int J Clin Exp Pathol. 2013; 6(11): 2523–8. PMID: 24228115
29. Morozov D., Morozova O., Pervouchine D., et al. Hypoxic renal injury in newborns with abdominal compartment syndrome (clinical and experimental study). Pediatr Res. 2018; 83(2): 520–6. https://doi.org/10.1038/pr.2017.263 PMID: 29053704
Об авторах
В. В. ЯковлевРоссия
Яковлев Владислав Вячеславович, аспирант кафедры патофизиологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
+7 (926) 761-20-68
А. В. Бадаева
Россия
Бадаева Анастасия Викторовна, студентка
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Е. И. Иванова
Россия
Иванова Елена Ильинична, врач-патологоанатом
пер. Абрикосовский, д. 2, ГСП-1, г. Москва, 119991
Л. О. Севергина
Россия
Севергина Любовь Олеговна, д-р мед. наук, врачпатологоанатом, профессор кафедры патологической анатомии им. А.И. Струкова
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Л. Д. Мальцева
Россия
Мальцева Лариса Дмитриевна, канд. мед. наук, доцент кафедры патофизиологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
О. Л. Морозова
Россия
Морозова Ольга Леонидовна, д-р мед. наук, профессор кафедры патофизиологии
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991







































