Перейти к:
Сегментационная модель скрининга рака молочной железы на основе нейросетевого анализа рентгеновских изображений
https://doi.org/10.47093/2218-7332.2020.11.3.4-14
Аннотация
Повышение диагностической эффективности скрининга рака молочной железы (РМЖ) остается одной из наиболее актуальных проблем в онкологии и лучевой диагностике. Технологии искусственного интеллекта широко используются в клинической медицине для эффективного решения ряда технологических и диагностических задач.
Цель. Разработать и изучить диагностическую эффективность сегментационной нейросетевой модели детекции патологических изменений молочных желез на цифровых рентгеновских снимках.
Материалы и методы. Интеллектуальная система была разработана для описания маммографических исследований и включала в себя сегментационную нейронную сеть с архитектурой U-Net, классификационную нейронную архитектуру ResNet50 с выводом результата при помощи градиентного бустинга. Для обучения, определения диагностической точности и валидации разрабатываемой сегментационной диагностической модели использовали 15 486 рентгеновских исследований, размеченных в специально разработанной программной среде LabelCMAITech. Точность сегментации определяли по коэффициенту сходства, вероятность злокачественности находок вычисляли с помощью метрик бинарной классификации.
Результаты. Разработана система, представленная сегментационной моделью на основе нейросетевой архитектуры. Модель позволяет с высокой точностью 0,8176 и выше при пороговых значениях на выходных нейронах сети 0,1 и 0,15 локализовать рентгенологические находки, имеющие диагностическое значение для определения вероятности наличия признаков РМЖ в рентгеновском маммографическом исследовании: образования, локальную перестройку структуры, локальную асимметрию, кальцинаты. При сравнении результатов машинной сегментации и разметки изображений рентгенологом установлено, что модель не уступает врачу в точности определения образований, внеочаговых кальцинатов и внутрижелезистых лимфатических узлов.
Заключение. Результаты изучения эффективности работы системы позволяют рассматривать ее в качестве интеллектуального диагностического ассистента врача-рентгенолога при анализе скрининговых маммографических исследований.
Ключевые слова
На протяжении последних десятилетий рак молочной железы (РМЖ) сохраняет лидирующие позиции в структуре онкологической заболеваемости и смертности женского населения развитых стран мира, в том числе и России [1]. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно на планете диагностируется более 2,3 млн новых случаев заболевания [2]. Несмотря на значительные успехи современной фундаментальной онкологии и клинической медицины, революционные достижения в области иммунотерапии злокачественных новообразований, в 2018 году было зарегистрировано около 612 тыс. смертей от РМЖ во всем мире [3][4].
Классическая рентгенография молочных желез в прямой и косой проекциях представляет собой один из наиболее информативных и экономически эффективных методов ранней диагностики заболевания, позволяющий выявлять подозрительные изменения структуры органа на ранних — бессимптомных этапах развития и течения болезни [5]. При этом современные скрининговые стратегии РМЖ подразумевают применение данного метода лучевой диагностики на этапе оказания первичной медико-санитарной помощи женщинам, в том числе в рамках общенациональных профилактических программ [2]. В то же время подробный и точный анализ рентгенограмм, их корректная интерпретация требуют от врача-рентгенолога высокой профессиональной квалификации, широты общемедицинской и теоретической подготовки, плотного взаимодействия с клиницистами [6].
Прорывные достижения высоких технологий в медицине и лучевой диагностике сделали возможным применение методов машинного обучения для анализа и интерпретации диагностических изображений [5][6][7]. На основе использования методов искусственного интеллекта, в частности глубоких сверточных нейронных сетей, наиболее оптимальных для идентификации образов, уже был разработан ряд диагностических ассистентов, эффективность которых была подтверждена клинически [8][9][10]. В то же время разработка любых ассистирующих технологий требует участия высококвалифицированных специалистов на этапе как создания моделей, так и обучения. Например, создание эффективного и точного диагностического ассистента для интерпретации результатов рентгеновской маммографии сопряжено с необходимостью корректной, подробной и чрезвычайно точной сегментационной разметки диагностических изображений, нанесенной специалистом по лучевой диагностике.
Цель исследования: разработать и изучить диагностическую эффективность сегментационной нейросетевой модели детекции патологических изменений молочных желез на цифровых рентгеновских
снимках.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящее исследование проведено в соответствии с протоколом, прошедшим этическую экспертизу и утвержденным на заседании Ученого совета МНИОИ им. П.А. Герцена от 27.01.2020 (протокол № 2).
Для обучения, определения диагностической точности и валидации разрабатываемой сегментационной диагностической модели использовали 15 486 рентгеновских исследований, состоящих из изображений обеих молочных желез в двух проекциях (прямой и косой) с обезличенными персональными данными. Из архивов Национального центра онкологии репродуктивных органов МНИОИ им. П.А. Герцена получено 1786 исследований, из Центра амбулаторной онкологической помощи ГБУЗ г. Москвы ГКБ № 40 ДЗМ — 13 700.
Распределение исследований по группам в соответствии со шкалой BI-RADS [11] представлено на рисунке 1. Отнесение всего исследования к тому или иному классу осуществлялось по максимально установленному классу для одной или обеих (при совпадении классов) молочных желез.
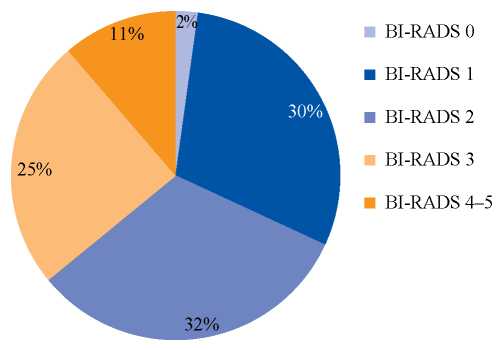
РИС. 1. Распределение результатов 15 486 маммографических исследований по классам в соответствии со шкалой BI-RADS.
FIG. 1. Distribution of the results of mammography studies (n = 15,486) by categories in accordance with the BI-RADS score.
Для целей обучения, валидации и тестирования весь массив исследований при помощи генератора случайных чисел был случайным образом разделен в соотношении 0,6:0,15:0,25 соответственно. Обучающая часть использовалась для обучения методу, валидационная — для проверки его качества во время обучения, а тестовая — для проверки качества обученной искусственной нейронной сети, при этом из 6194 тестовых и валидационных исследований 456 (7,4%) кейсов были с гистологически подтвержденной нормой или образованием доброкачественной или злокачественной природы. На валидационных и тестовых исследованиях модель обучение не проходила.
Средний возраст пациенток, чьи рентгенограммы составили обучающую совокупность изображений, равнялся 54,7 ± 3,4 года; лиц без признаков опухолевого процесса — 47,6 ± 2,7 года. Возраст пациенток с рентгенологическими признаками новообразования составил 68,2 ± 4,8 года, что соответствует среднему возрасту диагностики РМЖ в России и мире [1][2][3][4].
Все маммографические исследования были размечены опытными рентгенологами, соответствующими следующим требованиям: общий стаж работы в лучевой диагностике не менее 10 лет с опытом анализа рентгеновских маммограмм не менее 5 лет.
Разметка изображений осуществлялась в специально разработанной программной среде LabelCMAITech (ООО «КэреМенторЭйАй», Россия), позволяющей создавать личные кабинеты специалистов и передавать размеченные данные для обучения или валидации нейросетевой модели.
Каждое диагностическое исследование размечалось независимо двумя специалистами; в случае расхождения в заключении кейс автоматически передавался для анализа эксперту, научному сотруднику МНИОИ им. П.А. Герцена, для чего в разметчике была реализована функция экспертного кабинета. Мнение эксперта принималось за итоговое.
Сегментационная нейросетевая система была разработана для описания маммографических исследований и включала в себя:
1) определение плотности железы;
2) определение наличия асимметрии (тотальной и локальной);
3) сегментацию (локализацию) очаговой перестройки структуры органа;
4) сегментацию (локализацию) интрамаммарных лимфатических узлов;
5) определение образований и/или кальцинатов;
6) сегментацию (локализацию) образований и внеочаговых кальцинатов.
Сегментация очаговых образований молочной железы также включала определение вида образования по следующим признакам:
а) форма — правильная/неправильная;
б) контуры — четкие/нечеткие;
в) структура — однородная/неоднородная.
На основании аналитической оценки весов всех предыдущих пунктов происходило определение класса по BI-RADS.
Предложенный метод состоял из трех основных этапов, первые два изображены на рисунке 2. На первом этапе определялась плотность железы и оценивалась асимметрия; на втором — проводилась сегментация образований, кальцинатов и локальных изменений структуры железы с помощью полностью сверточной нейронной сети (convolutional neural network, CNN). На третьем этапе использовались результаты работы первых двух, и на их основании определялся класс по BI-RADS для данного исследования.
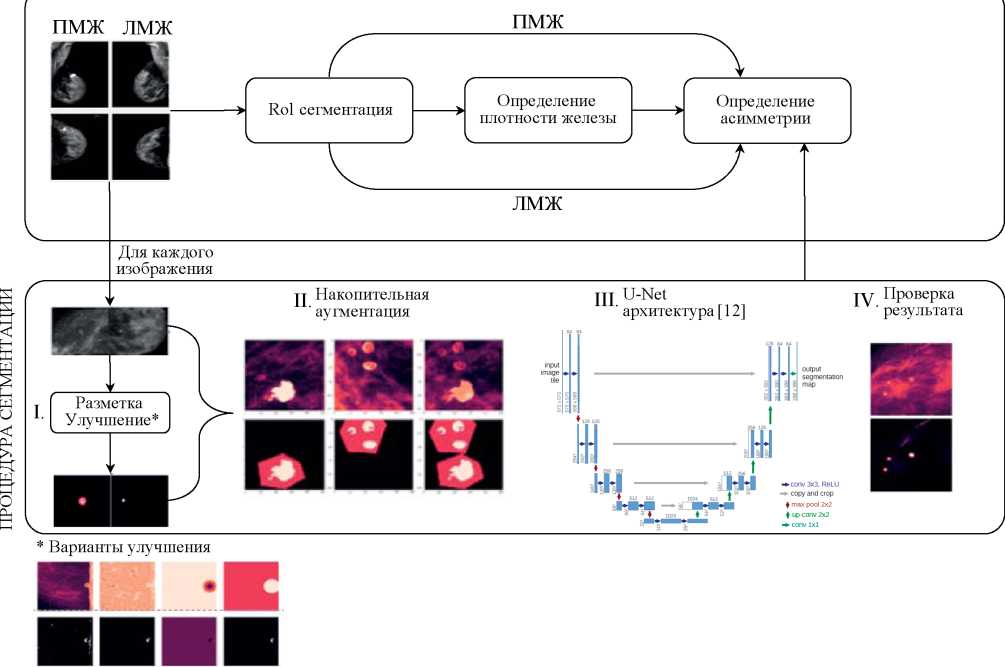
РИС. 2. Схема построения сегментационной модели с использованием архитектуры U-Net [12] (пояснение в тексте). ПМЖ — правая молочная железа, ЛМЖ — левая молочная железа.
FIG. 2. U-Net-based segmentation model workflow [12] (explanation in the text). ПМЖ — right breast, ЛМЖ — left breast
На первом этапе разработанного алгоритма происходило определение глобальных характеристик исследования: плотности железы и наличия ее асимметрии. Для этого с помощью сегментационной нейронной сети с архитектурой U-Net [12] определялись те части изображений, которые содержали ткани железы — регион интереса (region of interest, RoI). Для обучения сети использовалась бинарная функция кросс-энтропии, попиксельно вычисляемая с различными весами для каждого класса, как в уравнении (1):
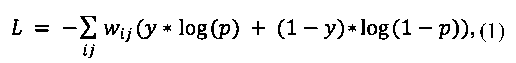
где p — прогнозируемая вероятность класса, y — истинный класс (0 или 1) и w — матрица весов.
Далее, используя полученные RoI исходных изображений, с помощью классификационной нейронной сети с архитектурой ResNet50 [13] определялась плотность железы на каждой проекции. Также, подавая на вход пары изображений (косые и прямые проекции попарно), определялось наличие асимметрии.
Второй этап метода отвечал за локализацию (сегментацию) и определение характеристик локальных изменений (пункты 3–6 из списка выше). В первую очередь для решения данной задачи потребовалось предварительно обработать сегментацию очагов, используемую как истинную для нашего обучающего набора данных. Часть разметок была выполнена таким образом, что один сегмент содержал несколько близко расположенных образований кальцинатов (сегмент первого типа), а другая часть — когда каждый сегмент содержал ровно одно образование/кальцинат и его границы совпадали с границами образования (сегмент второго типа).
Предобработка выполнялась над сегментами первого типа, которые с помощью метода бинарной классификации были разделены на сегменты, содержащие и очерчивающие ровно одно образование.
Для определения вида образований каждому виду был присвоен свой класс для сегментации. Таким образом, каждый класс отвечал за локализацию определенных образований, например с нечеткими контурами, а при сложении всех классов вместе получалась маска расположения всех образований, при их наличии.
Полученная таким образом разметка использовалась для обучения нейронной сети с архитектурой U-Net, сегментирующей образования, обучение которой проводилось аналогично тому, как описано выше.
Получив все результаты предыдущих двух этапов для исследования, определяли класс исследования по BI-RADS. Для этого использовался алгоритм градиентного бустинга [14], на вход которого подавались результаты первого этапа и максимальные значения каждой полученной маски со второго этапа. Во время обучения алгоритма на его выход подавались истинные значения класса BI-RADS для каждого исследования, полученные от рентгенологов и подтвержденные морфологически.
Статистический анализ
Диагностическая точность модели определялась на основании вычислений следующих показателей: точность, специфичность, чувствительность и площадь под ROC-кривой (area under receiver operating characteristic curve, AUC ROC) при применении бинарной классификации к ответу нейронной сети в виде вероятности наличия/отсутствия признаков злокачественного новообразования в анализируемом исследовании. Точность сегментации определялась по индексу сходства (Intersection over Union, IoU) между локализацией изменений моделью и истинной разметкой. Различия между полученными и истинными значениями определяли с использованием одномерного дисперсионного анализа и последующего применения t-критерия для независимых выборок. При проверке нулевых гипотез критическое значение уровня статистической значимости принималось равным 0,05 [15].
РЕЗУЛЬТАТЫ
При проведении оценки точности сегментации разработанной модели рассчитали коэффициенты соответствия локализации патологической находки на паре диагностических изображений (рентгенограмма правой или левой молочной железы в прямой и косой проекциях) (табл., рис. 3). Анализировались значения индекса IoU независимо для отсегментированных нейросетевой моделью образований (от 0,5 см в диаметре и выше), внеочаговых кальцинатов, внутрижелезистых лимфатических узлов и локальной перестройки структуры (табл.). Сравнивали значения, полученные для нейронной сети, с показателями точности врача-рентгенолога, не принимавшего участия в разметке изображения. За истинное значение (1,0) принимали заключение эксперта по каждому исследованию.
Таблица. Сравнительная точность локализации патологических находок, отсегментированных нейросетевой моделью и врачом-рентгенологом
Table. Comparative localizing of pathological findings segmented by the AI-based model and the radiologist
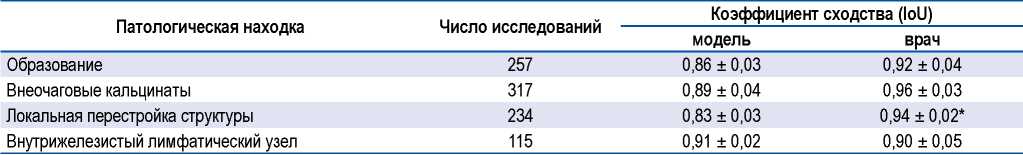
Примечание. * — различия при межгрупповом сравнении статистически значимы при р < 0,05 (одномерный дисперсионный анализ, t-критерий для независимых выборок).
Note. * — p < 0.05 for intergroup comparison (one-way dispersion analysis, independent t-test).

РИС. 3. Пример сегментации патологических находок в правой и левой молочных железах пациентки 43 лет. Интеллектуальная система определяет находку, наносит маску (а) и выдает описание находки (б).
FIG. 3. An example of AI-assisted segmentation of pathological findings in the right and left breast of a 43-year-old female patient. The system detects a finding, draws a mask (а) and issues a report with the finding description (б).
Примечание. Желтым и синим нейронной сетью нанесены маски, соответствующие образованию злокачественной природы и локальной перестройке структуры соответственно. Приоритетная маска (желтая) соответствует злокачественному новообразованию.
Note. AI-based system marks malignant neoplasm and architecture distortion with yellow and light blue respectively. Yellow priority mask covers the malignancy.
Как хорошо видно, для всех типов диагностических находок коэффициент сходства нейросетевой модели принимал значения выше 0,8, что отвечает общим требованиям к точности сегментации [16]. При этом необходимо обратить внимание на то, что точность нахождения локальной перестройки структуры железы, определенная для нейросетевого алгоритма, уступала точности практикующего рентгенолога.
Важным вопросом, связанным с оценкой аналитической точности систем компьютерного зрения в лучевой диагностике, является нейросетевая оценка вероятности признаков злокачественного новообразования в исследовании. Для решения этой задачи на тестовом наборе рентгеновских маммограмм с гистологически подтвержденной природой патологического образования провели расчет метрик точности разработанного алгоритма Следует отметить, что ответы модели с заключением по BI-RADS в диапазоне 1–2 принимались за отсутствие признаков злокачественности, тогда как для заключений BI-RADS 3–5 вычислялись вероятности наличия признаков неоплазии на рентгенограммах. В ходе исследования устанавливали различные значения порога на выходных нейронах модели. Оптимальные показатели точности удалось получить при пороговых значениях 0,10 и 0,15 (рис. 4).
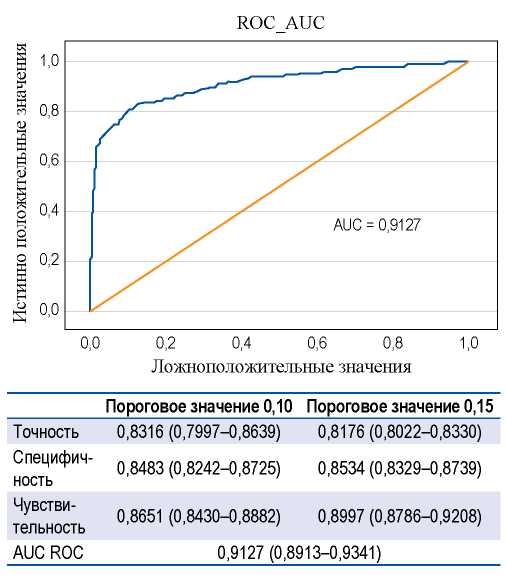
РИС. 4. Эффективность нейросетевой модели по определению вероятности признаков злокачественности находок в исследовании.
FIG. 4. The effectiveness of AI-based model in determining the likelihood of signs of malignancy in findings in the study.
Примечание. Объем тестового набора — 456 исследований, из них 286 — без патологических изменений, 77 — с морфологически подтвержденным РМЖ, 93 — с изменениями доброкачественной природы, подтвержденными морфологически.
Note. Test set includes 456 cases, of which 286 — without pathological changes, 77 — with morphologically confirmed breast cancer, 93 — with changes of a benign nature, confirmed morphologically.
В рамках настоящего исследования было также разработано и реализовано функциональное интеграционное решение, позволяющее проводить изучение клинической эффективности нейросетевой модели в рамках научно-практической коллаборации нескольких исследовательских и производственных центров. Схема решения представлена на рисунке 5. При реализации представленной интеграционной схемы исследователь (пользователь) оперирует с диагностическими изображениями, содержащимися в PACS (Picture Archiving and Communication System, система архивации и передачи изображений), при этом в нейронную сеть посредством облачного решения CMAI Cloud (ООО «КэреМенторЭйАй», Россия) отправляются для анализа изображения с обезличенными персональными данными. Как хорошо видно на схеме, на этапе сопоставления диагностической точности врача-рентгенолога и нейросетевой модели реализована экспертная функция исследовательской организации.
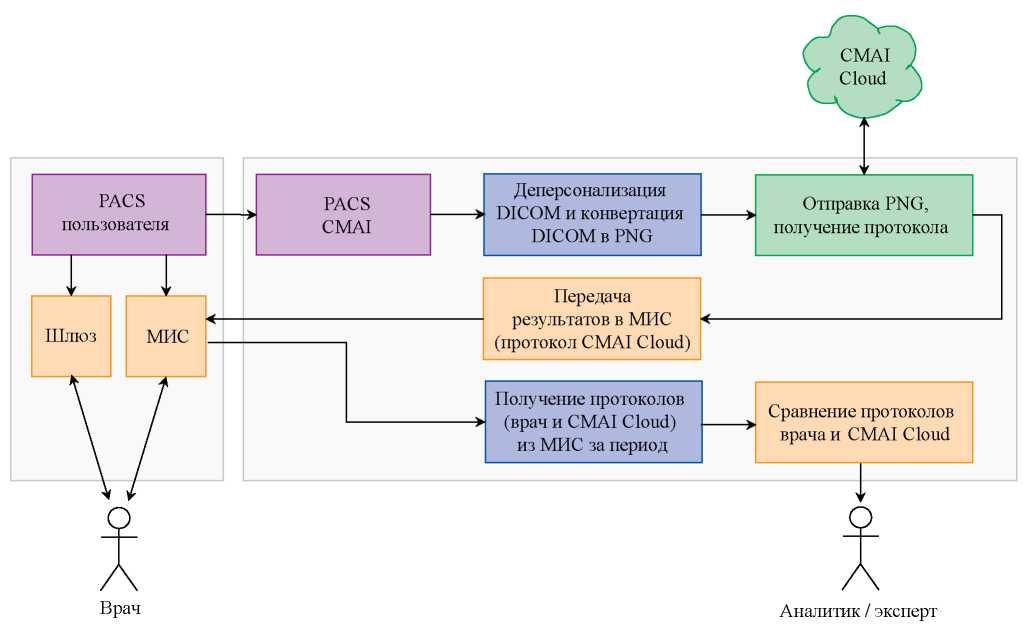
РИС. 5. Схема интеграции сегментационной модели в рамках реализации исследовательской коллаборации (пояснение в тексте).
FIG. 5. Scheme of segmentation model integration within the framework of the research collaboration (explanation in the text).
Примечание. МИС — медицинская информационная система, PACS — Picture Archiving and Communication System, CMAI — производитель нейронной сети.
Note. MИС — Medical Information System; PACS — Picture Archiving and Communication System; CMAI — Care Mentor AI, the system manufacturer.
ОБСУЖДЕНИЕ
Стремительное развитие цифровых технологий в лучевой диагностике охватывает самые разные процессы: получение лучевых изображений, их пре- и постпроцессинг. Вместе с тем наиболее сложной областью для цифровизации представляется анализ медицинских изображений и их интерпретация. Большое теоретическое и практическое значение имеет разработка систем для анализа результатов лучевого скрининга РМЖ. Оно определяется как распространенностью заболевания в популяции, так и невысокой эффективностью существующих программ раннего выявления заболевания.
Оставляя за скобками этические и правовые вопросы принятия диагностического решения без участия человека, следует сказать, что на сегодня достигнут большой прогресс в идентификации патологических находок на лучевых изображениях молочных желез и их последующей диагностической интерпретации с использованием технологий искусственного интеллекта. Так, в недавнем исследовании T. Schaffter и соавт. [17] было показано, что использование алгоритмов искусственного интеллекта для оценки скрининговых рентгеновских маммограмм уступает по точности опытным рентгенологам, но при этом применение нейросетевого ассистента в чтении снимков врачом-специалистом повышает общую точность интерпретации. Опубликованные в текущем году в Nature результаты международного исследования [18], проведенного научным коллективом под руководством S.M. McKinney в США и Великобритании, продемонстрировали преимущества модели, созданной при помощи искусственного интеллекта, над врачом-рентгенологом как в производительности, так и в общей точности анализа скрининговых маммографических кейсов.
Разработанная нами система представляет собой отечественную сегментационную модель на основе нейросетевой архитектуры. Она позволяет с высокой точностью локализовать рентгенологические находки, имеющие диагностическое значение для определения вероятности наличия признаков РМЖ в рентгеновском маммографическом исследовании. Результаты изучения эффективности работы системы позволяют рассматривать ее в качестве интеллектуального диагностического ассистента врачарентгенолога при анализе скрининговых маммографических исследований.
ЗАКЛЮЧЕНИЕ
Изученная нейросетевая модель производит сегментацию патологических находок на рентгенограммах молочных желез, имеющих диагностическое значение, и по своей точности не уступает врачу-рентгенологу. Разработанный метод по характеристикам точности, функциональности и эффективности может быть использован в виде диагностического ассистента врача-рентгенолога на этапе осуществления лучевого скрининга РМЖ.
ВКЛАД АВТОРОВ
Н.И. Рожкова руководила исследованием, анализировала результаты, участвовала в написании рукописи. П.Г. Ройтберг разрабатывал нейросетевую модель, анализировал результаты исследования, участвовал в написании рукописи. А.А. Варфоломеева и А.Н. Добренький разрабатывали нейросетевую модель, участвовали в получении первичных результатов и подготовке рукописи. М.Л. Мазо и Е.В. Сушков осуществляли подготовку диагностических исследований, разметку изображений, анализ результатов. Д.С. Блинов руководил исследованием, анализировал результаты, участвовал в подготовке графических материалов и написании рукописи. О.Н. Дерябина и А.И. Соколов осуществляли разметку изображений, статистический анализ результатов и подготовку рукописи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Nadezhda I. Rozhkova led the study, analyzed the study results, and wrote the manuscript. Pavel G. Roitberg developed artificial neural network-based model, analyzed the study results, and wrote the manuscript. Anna A. Varfolomeeva and Anton N. Dobrenkii developed artificial neural network-based model, managed the primary data, and wrote the manuscript. Mikhail L. Mazo and Evgenii V. Sushkov prepared datasets, labeled medical images, and analyzed the results. Dmitry S. Blinov led the study, analyzed the study results, prepared figures, and wrote the manuscript. Olga N. Deryabina and Alexey I. Sokolov labeled medical images, did statistical processing of primary data, and wrote the manuscript. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2019. CA A Cancer J Clin. 2019; 69: 7-34. https://doi.org/10.3322/caac.21551
2. Breast cancer. [web resource] URL https://www.who.int/cancer/prevention/diagnosis-screening/breast-cancer/en/ free (accessed September 16, 2020).
3. DeSantis C.E., Ma J., Gaudet M.M., Newman L.A., Miller K.D., Goding Sauer A., Jemal A., Siegel, R.L. Breast cancer statistics, 2019. CA A Cancer J Clin. 2019; 69: 438-451. https://doi.org/10.3322/caac.21583
4. Li Y., Chen H., Cao L., Ma J. A survey of computer-aided detection of breast cancer with mammography. J Health Med Inf. 2016; 4: 238. https://doi.org/10.4172/2157-7420.1000238
5. Welch H.G., Passow H.J. Quantifying the benefits and harms of screening mammography. JAMA Intern Med. 2014; 3: 448-454. https://doi.org/10.1001/jamainternmed.2013.13635
6. Curtis C., Frayne R., Fear E. Using X-Ray Mammograms to Assist in Microwave Breast Image Interpretation. Int. J. Biomed. Imag. 2012; 2012: 235380. https://doi.org/10.1155/2012/235380
7. Abdelhafiz D., Yang C., Ammar R. et al. Deep convolutional neural networks for mammography: advances, challenges and applications. BMC Bioinformatics. 2019; 20: 281 https://doi.org/10.1186/s12859-019-2823-4
8. American College of Radiology. The ACR breast imaging reporting and data system (BI-RADS) [web resource]. November 11, 2003. URL: http://www.Acr. org/departments/stand_accred/birads/contents.html. free (accessed February 27, 2020).
9. Ronneberger O., Fischer P., Brox T. U-Net: Convolutional Networks for Biomedical Image Segmentation. Arxiv. Lib. 2015; 15: 1-8. https://doi.org/10.1007/978-3-319-24574-4_28
10. He K., Zhang X., Ren S. Deep Residual Learning for Image Recognition. IEEE Comput. Vis. Pattern. Recognit. 2016; 10: 1-4. https://doi.org/10.1109/cvpr.2016.90
11. Natekin A., Knoll A. Gradient Boosting Machines, A Tutorial. Frontiers in Neurorobotics. 2013; 7: 21. https://doi.org/10.3389/fnbot.2013.00021
12. Wu J., Mahfouz M. R. Robust X-ray image segmentation by spectral clustering and active shape model. J Med. Imag. 2016; 3: 034005. https://doi.org/10.1117/1.jmi.3.3.034005
Об авторах
Н. И. РожковаРоссия
Рожкова Надежда Ивановна, д-р мед. наук, профессор, руководитель
ул. Погодинская, д. 6, г. Москва, 119121
П. Г. Ройтберг
Россия
Ройтберг Павел Григорьевич, канд. экон. наук, учредитель
2-й Тверской-Ямской пер., д. 10, г. Москва, 125047
А. А. Варфоломеева
Россия
Варфоломеева Анна Андреевна, специалист по машинному обучению
2-й Тверской-Ямской пер., д. 10, г. Москва, 125047
М. Л. Мазо
Россия
Мазо Михаил Львович, канд. мед. наук, старший научный сотрудник
ул. Погодинская, д. 6, г. Москва, 119121
А. Н. Добренький
Россия
Добренький Антон Николаевич, специалист по машинному обучению
2-й Тверской-Ямской пер., д. 10, г. Москва, 125047
Д. С. Блинов
Россия
Блинов Дмитрий Сергеевич, д-р мед. наук, руководитель отдела научных исследований и разработок
2-й Тверской-Ямской пер., д. 10, г. Москва, 125047
+7 (927) 197-14-22
Е. В. Сушков
Россия
Сушков Евгений Владимирович, заведующий отделением рентгенологии Центра амбулаторной онкологии
ул. Касаткина, д. 7, г. Москва, 129301
О. Н. Дерябина
Россия
Дерябина Ольга Николаевна, канд. мед. наук, доцент кафедры онкологии Медицинского института
ул. Большевистская, д. 68, г. Саранск, 430005
А. И. Соколов
Россия
Соколов Алексей Ильясович, ассистент кафедры хирургии Медицинского института
ул. Красная, д. 40, г. Пенза, 440026







































