Перейти к:
Прекондиционирование креатин фосфатом уменьшает ишемическо-реперфузионное повреждение изолированного сердца крысы
https://doi.org/10.47093/2218-7332.2022.13.1.24-33
Аннотация
Цель. Изучить влияние однократного введения креатин фосфата (КФ) непосредственно перед ишемией на кардиодинамические параметры и маркеры окислительного стресса в коронарном венозном оттоке ретроградно перфузированного изолированного сердца крысы.
Материалы и методы. 20 крыс линии Wistar albino были разделены на 2 группы: контрольную (К) и экспериментальную (Э), по 10 в каждой. Аорту изолированного сердца крысы канюлировали и ретроградно перфузировали раствором Кребса – Хензелейта по Лангердорфу. Обе группы подвергались ишемическо-реперфузионному повреждению, которое включало глобальную ишемию в течение 20 минут, а затем реперфузию в течение 30 минут. В группе Э проводилось прекондиционирование КФ в дозе 0,2 ммоль/л в течение 5 мин перед ишемией. Регистрировались кардиодинамические параметры и показатели окислительного стресса в точке стабилизации, на 1-й и 30-й минутах реперфузии.
Результаты. В группе Э по сравнению с группой К на 30-й минуте реперфузии отмечены статистически значимо более высокие значения кардиодинамических показателей: максимальной и минимальной скорости повышения давления в левом желудочке (в 1,7 и в 1,9 раза соответственно), систолического и диастолического давления в левом желудочке (в 1,5 и в 1,6 раза соответственно). Биомаркеры окислительного стресса (индекс перекисного окисления липидов, нитриты, супероксидный анион радикал и перекись водорода) также были статистически значимо ниже в группе Э как после 1-й минуты реперфузии (в 1,2, 1,4, 2,8 и 1,9 раза соответственно), так и после 30-й минуты (в 1,3, 2,1, 1,9 и 2,1 раза соответственно).
Заключение. Введение КФ в коронарный кровоток за 5 минут до индукции ишемии оказывает защитное действие на сократительную способность миокарда. В качестве механизма протективного действия КФ может рассматриваться уменьшение окислительного стресса и повреждения.
Ключевые слова
Ишемия миокарда подразумевает снижение снабжения сердца кислородом, что может вызвать ряд функциональных, биохимических и морфологических изменений. В результате ишемии наблюдаются снижение сократительной способности миокарда, развитие систолической и диастолической дисфункции, аритмий [1][2].
При ишемическо-реперфузионном повреждении значительный вклад в развитие сердечной дисфункции вносит повышение уровня окислительного стресса за счет резкого увеличения образования прооксидантов, которые вызывают свободнорадикальное повреждение. Последнее также может влиять на воспаление и, следовательно, еще больше усугублять повреждение миокарда [3][4].
Термин «ишемическое прекондиционирование» был впервые введен в 1986 году и относится к стратегии воздействия на сердце кратковременных эпизодов ишемии с целью повышения толерантности миокарда к прекращению кровоснабжения и доставки кислорода [5]. Считается, что в основе прекондиционирования лежат два кардиопротективных механизма: первый, который проявляется в течение первых 2–3 часов после эпизода ишемии, и второй, который начинается через 12–24 часа и длится около 4 дней, защищая миокард от инфаркта, сердечной недостаточности и желудочковых аритмий, вызванных ишемией и реперфузией, за счет улучшения сократительной способности миокарда, а также уменьшения накопления и адгезии нейтрофилов и предотвращения апоптоза миоцитов [6]. Однако, учитывая, что клиническое применение ишемического прекондиционирования ограничено, все большее внимание ученых сосредоточено на применении безопасных фармакологических веществ, которые будут вводиться до ишемии и которые бы, подобно ишемическому прекондиционированию, достигали кардиопротекции [7]. Имеющиеся литературные данные указывают на то, что большое количество веществ может имитировать процессы, вызванные ишемическим прекондиционированием, и в связи с этим может использоваться для фармакологического прекондиционирования [7][8].
Учитывая, что креатин фосфат (КФ) является первой молекулой, потребляемой при ишемии, гипоксии и токсической кардиомиопатии, и что в условиях гипоксии поглощение экзогенно вводимого КФ увеличивается [9], возникает вопрос, будет ли однократное введение этого вещества защищать миокард от повреждения. Именно поэтому целью данного исследования было изучение влияния однократного введения КФ непосредственно перед ишемией на кардиодинамические параметры и параметры окислительного стресса в коронарном венозном оттоке ретроградно перфузированного изолированного сердца крысы.
МАТЕРИАЛЫ И МЕТОДЫ
Данное экспериментальное исследование проводилось на животных в условиях ex vivo. При экспериментальной работе соблюдались положения «EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes 86/609 / EES» и принципы этики1. Исследование было одобрено Комитетом по защите благополучия лабораторных животных факультета медицинских наук Крагуевацкого университета, решение № 015722 от 15.07.2020.
Для исследования влияния КФ на ишемическореперфузионное повреждение сердца использовали 20 здоровых крыс Wistar albino coja мужского пола в возрасте 8 недель, массой тела 200–250 г. Крыс содержали в полипропиленовых клетках, заполненных слоем белой сосновой стружки, в постоянно контролируемой среде (температура (22 ± 1 °C), влажность (55 ± 10%), 12/12-часовой цикл свет/темнота) в Институте сердечно-сосудистой физиологии факультета медицинских наук, Крагуевацкий университет, Сербия. Все животные имели свободный доступ к пище и воде – ad libitum.
После анестезии кетамином (10 мг/кг) и ксилазином (5 мг/кг) животных выводили из эксперимента путем смещения шейных позвонков (Приложение 1 к животным / научным процедурам, Закон 1986 г., Великобритания). Исследование функции сердца ex vivo проводилось с использованием модели ретроградной перфузии изолированного сердца по Лангендорфу (Langendorff apparatus, Experimetria Ltd, 1062 Budapest, Hungary). Методика исследования подробно описана в наших предыдущих исследованиях [10].
После 20-минутного периода стабилизации 10 сердец, которые были отнесены к контрольной группе, подвергались ишемическо-реперфузионному повреждению, которое включало глобальную ишемию путем полного закрытия потока на аппарате Лангендорфа, так что как раствор Кребса – Хенселейта, так и кислород не достигали сердца в течение 20 минут, а затем в течение 30 минут проводилась реперфузия. Другие 10 сердец, которые были отнесены к экспериментальной группе, подвергались стабилизации в течение 20 мин, прекондиционированию КФ в дозе 0,2 ммоль/л в течение 5 минут с помощью инфузионного насоса через сердце, после чего вызывалось ишемическо-реперфузионное повреждение по способу, аналогичному для контрольной группы (рис.).
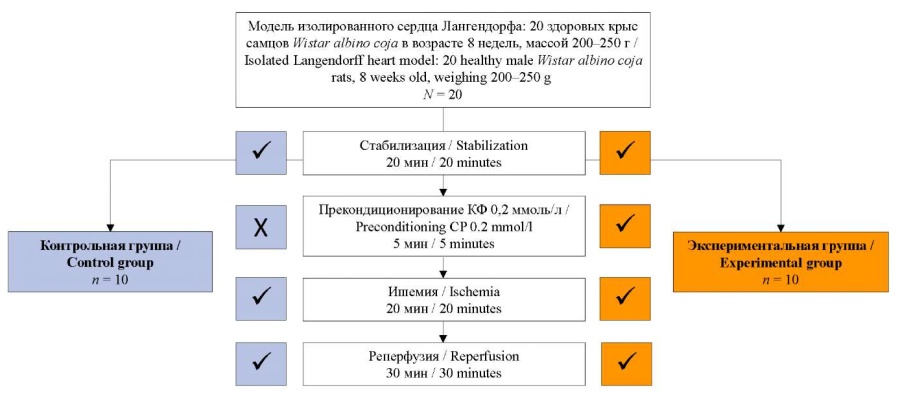
РИС. Схема исследования.
FIG. Scheme of the study.
Примечание: КФ – креатин фосфат.
Note: CP – creatine phosphate.
Существует очень мало исследований, изучавших влияние введения КФ непосредственно в сердце. В исследованиях по изучению системных эффектов КФ доза для крыс составляет обычно около 200 мг/кг. В одном из недавно опубликованных исследований внутривенно вводили КФ в дозе 20 ммоль [11]. В нашем исследовании выбрана в 100 раз меньшая доза, учитывая непосредственное введение КФ в коронарный кровоток.
Во время эксперимента наблюдались и регистрировались следующие кардиодинамические параметры: dp/dt max (максимальная скорость развития давления в левом желудочке, мм рт. ст./с), dp/dt min (минимальная скорость развития давления в левом желудочке, мм рт. ст./с), систолическое давление в левом желудочке (СДЛЖ, мм рт. ст.), диастолическое давление в левом желудочке (ДДЛЖ, мм рт. ст.) и частота сердечных сокращений (ЧСС, уд./мин). Кровоток через коронарные кровеносные сосуды выражался в мл/мин и измерялся флуориметрическим методом путем суммирования венозного оттока из коронарных кровеносных сосудов сердца.
Для изучения влияния КФ на выработку прооксидантов в сердце в образцах коронарного венозного оттока спектрофотометрическим методом на спектрофотометре Shimadzu UV-1800 (Specord S-600 Analytik Jena, Германия) определяли: концентрацию нитритов (NO2–), супероксидного анион-радикала (O2–) и перекиси водорода (H2O2), рассчитывали индекс перекисного окисления липидов (ИПОЛ). Основа для использования этих методик и сами методики описаны нами более подробно в предыдущей публикации [10].
Статистический анализ
Во время экспериментального протокола изученные параметры определялись во время стабилизации, а также на 1-й и 30-й минутах реперфузии. Все полученные результаты для групп представлены в виде долей, выраженных в процентах со стандартным отклонением, относительно данных последней минуты точки стабилизации соответствующей группы, которая принималась за 100%. Для сравнения значений между указанными точками использовали критерий Вилкоксона. При проверке нулевых гипотез принят уровень значимости р < 0,05.
РЕЗУЛЬТАТЫ
Кардиодинамические параметры и коронарный кровоток
Полученные результаты представлены в таблице 1.
Таблица 1. Кардиодинамические параметры в контрольной и экспериментальной группах во время реперфузии
Table 1. Cardiodynamic parameters in the control and experimental groups during the reperfusion
|
Показатель / |
1-я минута реперфузии / 1st minute of reperfusion |
30-я минута реперфузии / 30th minute of reperfusion |
||||
|
Контрольная группа / Control group |
Экспериментальная группа / Experimental group |
Уровень |
Контрольная группа / Control group |
Экспериментальная группа / Experimental group |
Уровень |
|
|
dp/dt max(%С) |
91,5 ± 9,0 |
121,9 ± 14,0 |
<0,01 |
55,4 ± 6,0 |
93,2 ± 9,0 |
<0,01 |
|
dp/dt min(%С) |
75,9 ± 8,0 |
64,7 ± 8,0 |
n.s. |
40,9 ± 5,0 |
76,5 ± 8,0 |
<0,01 |
|
СДЛЖ / DPLV (%С) |
86,6 ± 9,0 |
124,5 ± 13,0 |
<0,01 |
49,6 ± 5,0 |
74,8 ± 7,0 |
<0,05 |
|
ДДЛЖ / DPLV (%С) |
188,3 ± 20,0 |
120,8 ± 11,0 |
<0,01 |
49,4 ± 6,0 |
77,0 ± 8,0 |
<0,05 |
|
ЧСС / HR(%С) |
85,8 ± 7,0 |
86,8 ± 9,0 |
n.s. |
71,6 ± 7,0 |
65,1 ± 7,0 |
n.s. |
|
Коронарный кровоток / Coronary flow (%С) |
97,3 ± 10,0 |
99,8 ± 10,0 |
n.s. |
63,0 ± 7,0 |
63,0 ± 6,0 |
n.s. |
Примечание: данные представлены как процент от последней минуты точки стабилизации соответствующей группы (%С); dp/dt max – максимальная скорость повышения давления в левом желудочке; dp/dt min – минимальная скорость повышения давления в левом желудочке; ДДЛЖ – диастолическое давление в левом желудочке, мм рт. ст.; СДЛЖ – систолическое давление в левом желудочке; ЧСС – частота сердечных сокращений; n.s. – не значимо.
Note: the data is presented as a percentage of the last minute stabilization point of the corresponding group (%C); dp/dt max – the maximum rate of pressure increase in the left ventricle; dp/dt min – the minimum rate of pressure increase in the left ventricle; DPLV – diastolic pressure in the left ventricle, mmHg; SPLV – systolic pressure in the left ventricle; HR – heart rate; n.s.– not significant.
В контрольной группе, начиная с 1-й минуты реперфузии, уменьшались: dp/dt max, dp/dt min, СДЛЖ, к 30-й минуте эти параметры продолжали снижаться; ДДЛЖ увеличивалось в 1,9 раза во время 1-й минуты реперфузии и снижалось в 2 раза по сравнению с периодом стабилизации к 30-й минуте.
В экспериментальной группе с 1-й минуты реперфузии отмечено уменьшение dp/dt min, которая имела тенденцию к повышению к 30-й минуте. Другие кардиодинамические показатели – dp/dt max иСДЛЖ – повышались на 1-й минуте реперфузии и снижались к 30-й минуте. ДДЛЖ увеличивалось в 1,2 раза во время 1-й минуты реперфузии и снижалось в 1,3 раза к 30-й минуте по сравнению с периодом стабилизации.
Динамика коронарного кровотока и ЧСС была аналогичной в обеих группах: ЧСС начинала снижаться на 1-й минуте, и показатели достигали минимума к 30-й минуте; коронарный кровоток существенно неизменялся на 1-й минуте и снижался к 30-й минуте.
Значения обоих параметров, отражающих сократительную способность миокарда (dp/dt max и dp/dt min), через 30 минут от периода реперфузии были статистически значимо выше, чем значения, зарегистрированные в контрольной группе, в 1,7 и в 1,9 раза соответственно. Вместе с этим изменение значений СДЛЖ по сравнению со значениями, зарегистрированными в точке стабилизации, было статистически значимо выше и на 1-й, и на 30-й минутах реперфузии по сравнению с контрольной группой в 1,4 и в 1,5 раза соответственно. Одновременно на первой минуте реперфузии значения ДДЛЖ были статистически значимо ниже (в 1,6 раза) в экспериментальной, чем в контрольной группе. В контрольной группе наблюдалось выраженное снижение значений ДДЛЖ, так что в конце реперфузии оно было ниже в 1,6 раза, чем в экспериментальной группе.
Параметры окислительного стресса
Значения параметров окислительного стресса представлены в таблице 2.
Таблица 2. Параметры окислительного стресса в контрольной и экспериментальной группах во время реперфузии
Table 2. Oxidative stress parameters in the control and experimental groups
|
Показатель / |
1-я минута реперфузии / 1st minute of reperfusion |
30-я минута реперфузии / 30th minute of reperfusion |
||||
|
Контрольная группа / Control group |
Экспериментальная группа / Experimental group |
Уровень значимости р / |
Контрольная группа / Control group |
Экспериментальная группа / Experimental group |
Уровень значимости р / p value |
|
|
ИПОЛ / LPI(%С) |
112,3 ± 12,0 |
96,4 ± 10,0 |
<0,05 |
113,9 ± 12,0 |
90,7 ± 9,0 |
<0,01 |
|
NO2– (%С) |
127,7 ± 13,0 |
93,1 ± 9,0 |
<0,01 |
154,0 ± 16,0 |
75,1 ± 8,0 |
<0,01 |
|
O2– (%С) |
163,0 ± 15,0 |
57,8 ± 6,0 |
<0,01 |
215,2 ± 23,0 |
112,9 ± 12,0 |
<0,01 |
|
H2O2 (%С) |
162,1 ± 17,0 |
84,0 ± 9,0 |
<0,01 |
181,4 ± 19,0 |
87,2 ± 8,0 |
<0,01 |
Примечание: данные представлены как процент от последней минуты точки стабилизации соответствующей группы (%С); NO2– – нитриты; O2– – супероксидный анион-радикал; ИПОЛ – индекс перекисного окисления липидов; Н2O2 – перекись водорода.
Note: the data is presented as a percentage of the last minute stabilization point of the corresponding group (%C); NO2– – nitrites; O2– – superoxide anion-radical; POLI – lipid peroxidation index; Н2O2 – hydrogen peroxide.
В контрольной группе на 1-й минуте реперфузии происходило повышение концентрации параметров окислительного стресса, к 30-й минуте концентрация трех из них (NO2–, O2– и Н2O2) продолжала увеличиваться. В экспериментальной группе на 1-й минуте реперфузии отмечено снижение O2– и Н2O2 и отсутствие выраженных изменений NO2– и ИПОЛ. К 30-й минуте в этой группе продолжилось снижение NO2–, концентрация Н2O2 и ИПОЛ существенно не изменились, содержание O2– повысилось, но существенно не превышало значений в точке стабилизации.
Значения ИПОЛ, NO2–, O2– и Н2O2 были статистически значимо ниже в период реперфузии в экспериментальной группе по сравнению со значениями, зарегистрированными в контрольной группе как после 1-й минуты (в 1,2, 1,4, 2,8 и 1,9 раза соответственно), так и после 30-й минуты (в 1,3, 2,1, 1,9 и 2,1 раза соответственно).
ОБСУЖДЕНИЕ
Наши результаты выявили, что в контрольной группе кардиодинамические параметры – dp/dt max, dp/dt min, СДЛЖ и ЧСС – снижались во время реперфузии на 1-й и 30-й минутах по сравнению с периодом стабилизации, а ДДЛЖ значительно увеличивалось на 1-й минуте, а затем снижалось, что указывает на нарушение инотропной и лузитропной способности миокарда. Снижение СДЛЖ подтверждает, что ишемическо-реперфузионное повреждение нарушает систолическую функцию сердца. Уменьшение ЧСС и коронарного кровотока в последнюю минуту реперфузии подтверждает, что восстановление снабжения питательными веществами и кислородом ишемизированного миокарда парадоксально ухудшает функцию сердца. В литературе описано, что в период восстановления перфузии через ишемическую ткань происходит перегрузка Са2+, накопление внеклеточного K+, что синергетически ухудшает сократительную способность миокарда [12].
Введение КФ в дозе 0,2 ммоль/л непосредственно перед началом ишемии сопровождалось увеличением значений dp/dt max и снижением dp/dt min по сравнению с периодом стабилизации. Менее выраженные изменения параметров сердечной функции указывают на значительную роль КФ в процессе прекондиционирования сердца. Положительное влияние КФ на диастолическую функцию сердца чрезвычайно важно, потому что фаза релаксации определяет наполнение сердца и, в конечном итоге, его работу.
Кардиопротекторные эффекты КФ, продемонстрированные в нашем исследовании, согласуются с предыдущими исследованиями. В частности, ранее на модели кроликов и свиней наблюдалось влияние КФна сердца, подвергшиеся ишемии. Было отмечено, что введение указанного агента приводит к значительному уменьшению области некроза сердца и защите сарколеммы от необратимого повреждения [13]. Кроме того, когда КФ вводили за 5 минут до ишемии в дозе до 200 мг/кг, наблюдалось значительное снижение повреждения миокарда [14].
Другая группа авторов показала, что парентеральное введение КФ незадолго до ишемии миокарда вызывало лучший сократительный ответ миокарда и сохраняло уровень аденозинтрифосфата (АТФ) по сравнению с сердцами крыс, получавших физиологический раствор [9]. Кроме того, было показано, что прекондиционирование сердца КФ сохраняет запасы КФ и АТФ. Однако существенным недостатком данного исследования является то, что оно не отслеживало сократительную функцию сердца.
Кроме того, авторы исследования, которое отслеживало эффекты однократной дозы КФ (100 мг/кг, внутривенно), вводимой за 1 час до ишемии сердца, также подчеркивают кардиозащитный потенциал исследуемого соединения. В частности, ишемия сердца на животной модели была вызвана в течение 12-минутного периода перевязки левой передней нисходящей артерии, и из образцов миокарда были определены уровни следующих соединений: АТФ, аденозиндифосфат, фосфокреатин. Как и ожидалось, снижение АТФ наблюдалось в интактных сердцах, подвергшихся ишемии, тогда как в группе животных, получавших КФ, наблюдалось увеличение его концентрации в ткани сердца [15].
Считается, что ключевым патофизиологическим фактором, принимающим участие в прогрессировании ишемическо-реперфузионного повреждения, является увеличение уровня Ca2+ в результате его перехода из цитозоля в сакроплазматический ретикулум посредством SERCA2a (Ca2+-АТФаза саркоплазматического ретикулума). Снижение экспрессии и активности SERCA2a, которые были подтвержденыво время ишемическо-реперфузионного повреждения изолированного сердца крысы, дополнительно влияют на Са2+ перегрузку и могут объяснить нарушенную систолическую и диастолическую функцию сердца крысы в контрольной группе. Из-за открытия митохондриальных каналов может произойти гибель клеток. Было показано, что КФ может ингибировать открытие митохондриальных каналов и таким образом предотвращать перегрузку Са2+ в кардиомиоцитах, что может объяснить сохранение сократимости сердца в нашем исследовании. Потенциал КФ влиять на сократительную способность сердца наблюдался как на животных моделях, так и при наблюдении за пациентами с инфарктом миокарда. Способность КФ обеспечивать полное расслабление сердца важна для предотвращения возникновения реперфузионной контрактуры [16][17].
Механизмы, которые могут объяснить наблюдаемые защитные эффекты в нашем исследовании, включают участие КФ в энергетическом метаболизме клетки, влияние на стабилизацию мембраны имикроциркуляцию. КФ стабилизирует мембрану кардиомиоцитов, взаимодействуя с мембранными фосфолипидами, связывая противоположно заряженную группу с заряженной группой фосфолипидов. Благоприятное влияние КФ на микроциркуляцию объясняется тенденцией ингибировать агрегацию тромбоцитов путем быстрого удаления аденозиндифосфата [13][18]. Кроме того, экзогенное введение КФ может уменьшить накопление лизофосфатидилхолина и лизофосфатилэтаноламина в ишемической клетке сердца. Таким образом, значительно снижается и предотвращается возникновение потенциально смертельных аритмий [9].
В нашем исследовании в контрольной группе наблюдался значительный скачок концентрации H2O2, O2– и NО2– в период реперфузии по сравнению со значениями в периоде стабилизации. Прекондиционирование КФ предотвращало увеличение измеряемых прооксидантов, тем самым защищая сердце от окислительного ишемическо-реперфузионного повреждения. В литературе сообщается, чтопосле воздействия ишемии на сердце и последующей реперфузии в кардиомиоцитах образуются O2–, тогда как в сосудистом русле – O2– и H2O2 [19].
В нашем исследовании основное внимание было уделено мониторингу уровней прооксидантов из коронарного венозного оттока без учета антиоксидантных маркеров, которые изучались, в частности, в исследовании A. Shopit и соавт. [20], посвященном изучению влияния КФ на окислительный статус через определение уровней малонового диальдегида, глутатиона, супероксиддисмутазы in vitro и in vivo. Авторами отмечено, что введение КФ вызывает значительное снижение уровня малонового диальдегида и увеличение глутатиона и супероксиддисмутазы. Считается, что КФ увеличивает антиоксидантную способность миокарда и воздействует на сигнальные пути ядерного фактора транскрипции Nrf2 [20]. Следует иметь в виду, что обнаружение меньших количеств антиоксидантов также не обязательно означает,что произошло окислительное повреждение, но может указывать на то, что антиоксиданты удаляли прооксиданты и предотвращали повреждение тканей.
Роль эндогенного оксида азота (NO) в ишемическо-реперфузионном повреждении противоречива, и трудно объяснить, где граница между защитными и потенциально вредными эффектами. В частности, снижение биоиспользования NO может поставить под угрозу процесс расслабления артерий и изменить функцию эндотелия. Снижение концентрации NO2– в качестве косвенного маркера NO в нашем исследовании под влиянием КФ указывает на вклад этого соединения в улучшение эндотелиальной функции [21]. Результаты подтверждают, что активация эндотелиальной синтазы NO в ишемическо-реперфузионном повреждении приводит к увеличению синтеза и высвобождению NO в условиях пониженной концентрации прооксидантов. С другой стороны, когда присутствуют высокие концентрации активных форм кислорода, избыточное количество NO будет реагировать с O2– и образовывать токсичный радикал пероксинитрита (ONOO–), который усугубляет сердечную дисфункцию [22].
На настоящий момент в стратегии прекондиционирования окислительно-восстановительная передача сигналов еще недостаточно исследована и остается предметом изучения будущих исследований. Тем не менее было подтверждено, что временные низкие концентрации прооксидантов могут запускать механизмы защиты сердца и что передача сигналов активных форм кислорода во время прекондиционированияи во время фазы ранней реперфузии делает сердце устойчивым к реперфузионному повреждению [23]. До сих пор не было точно объяснено, может ли фармакологическое прекондиционирование помочь избежать массового производства активных форм кислорода и открытия митохондриальных каналов или просто смягчить эти процессы. Ранее описанное влияние КФ на митохондриальные каналы, вероятно, также отражается на окислительно-восстановительном статусе сердца, наблюдаемом в нашем исследовании.
Результаты исследований свидетельствуют о защитном эффекте введения КФ в коронарное русло непосредственно перед ишемией. Проведенное исследование имеет потенциальное практическое применение у пациентов, которым необходимо провести процедуру, вызывающую ишемию с последующей реперфузией миокарда. Что касается исследовательской модели, было бы интересно и, таким образом, ближе креальной ситуации, применить КФ на коронарных сосудах, а затем вызвать инфаркт или кардиоплегию in vivo. Принимая во внимание, что исследование проводилось на животной модели, возможны трансляционные исследования пациентов, перенесших операцию на сердце.
ВЫВОДЫ
Введение КФ в коронарный кровоток за 5 минут до индукции ишемии оказывает защитное действие на сократительную способность миокарда в модели изолированного сердца крысы; протективное действие в отношении сохранения показателей СДЛЖ и ДДЛЖ на значениях, более близких к исходным показателям, по сравнению с контрольной группой. Одним из механизмов защитного действия КФ может рассматриваться уменьшение окислительного стресса и окислительного повреждения.
ВКЛАД АВТОРОВ
Л.А. Гаджиева внесла значительный вклад в разработку концепции идеи, проведение исследования и обработку данных, подготовку рукописи. С.Б. Болевич внес основной вклад в разработку концепции идеи и методологии проведения эксперимента, а также написание текста статьи, окончательно утвердил публикуемую версию статьи и согласен принять на себя ответственность за все аспекты работы. В. Яковлевич внес основной вклад в разработку концепции идеи и методологии проведения эксперимента. И.А. Омаров проводил статистическую обработку результатов исследования и участвовал в разработке методологии проведения исследования и редактировании текста статьи. Х.А. Ордашев и М.К. Карташова участвовали в обработке данных и редактировании текста статьи. Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Luiza A. Gadjieva: study concept and design, acquisition of data, analysis and interpretation of data, drafting of the manuscript. Sergey B. Bolevich: study concept and design of the experiment, drafting of the manuscript, approved the final version of the publication and agreed to take responsibility for all aspects of the work. Vladimir Jakovlevich: study concept and design of the experiment. Israpil A. Omarov: statistical analysis, development of the research methodology and drafting of the manuscript. Hasan A. Ordashev and Maria K. Kartashova: analysis and interpretation of data, drafting of the manuscript. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. https://ec.europa.eu/environment/chemicals/lab_animals/legislation_en.htm (дата обращения: 08.06.2020).
Список литературы
1. Valikeserlis I., Athanasiou A.A., Stakos D. Cellular mechanisms and pathways in myocardial reperfusion injury. Coron Artery Dis. 2021 Sep 1; 32(6): 567–577. https://doi.org/10.1097/MCA.0000000000000997. PMID: 33471478
2. DePasquale E.C., Ardehali A. Primary graft dysfunction in heart transplantation. Curr Opin Organ Transplant. 2018; 23(3): 286–294. https://doi.org/10.1097/MOT.0000000000000523
3. Cai W.B., Zhao Y.J., Liu L., et al. Redox environment metabolomic evaluation (REME) of the heart after myocardial ischemia/ reperfusion injury. Free Radic Biol Med. 2021 Sep; 173: 7–18. https://doi.org/10.1016/j.freeradbiomed.2021.06.033. Epub 2021 Jul 9. PMID: 34252540
4. Lu C., Liu L., Chen S., et al. Azathioprine pretreatment ameliorates myocardial ischaemia reperfusion injury in diabetic rats by reducing oxidative stress, apoptosis, and inflammation. Clin Exp Pharmacol Physiol. 2021 Dec; 48(12): 1621–1632. https://doi.org/10.1111/1440-1681.13569. Epub 2021 Aug 22. PMID: 34370882
5. Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 1986 Nov; 74(5): 1124–1136. https://doi.org/10.1161/01.cir.74.5.1124. PMID: 3769170
6. Granfeldt A., Lefer D.J., Vinten-Johansen J. Protective ischaemia in patients: preconditioning and postconditioning. Cardiovasc Res. 2009 Jul 15; 83(2): 234–246. https://doi.org/10.1093/cvr/cvp129. Epub 2009 Apr 27. PMID: 19398470
7. Caricati-Neto A., Errante P.R., Menezes-Rodrigues F.S. Recent advances in pharmacological and non-pharmacological strategies of cardioprotection. Int J Mol Sci. 2019 Aug 16; 20(16): 4002. https://doi.org/10.3390/ijms20164002. PMID: 31426434
8. Roth S., Torregroza C., Feige K., et al. Pharmacological conditioning of the heart: an update on experimental developments and clinical implications. Int J Mol Sci. 2021 Mar 3; 22(5): 2519. https://doi.org/10.3390/ijms22052519. PMID: 33802308; PMCID: PMC7959135
9. Gaddi A.V., Galuppo P., Yang J. Creatine phosphate administration in cell energy impairment conditions: A summary of past and present research. Heart Lung Circ. 2017 Oct; 26(10): 1026–1035. https://doi.org/10.1016/j.hlc.2016.12.020. Epub 2017 Mar 14. PMID: 28392102
10. Говорушкина Н.С., Болевич С.Б., Яковлевич В. и др. Влияние соединения MK-801, глутамата и глицина через модуляцию N-метил-D-аспартатных рецепторов на изолированное сердце крысы. Сеченовский вестник. 2020; 11(1): 15–25. https://doi.org/10.47093/2218-7332.2020.11.1.15-25
11. Qaed E., Wang J., Almoiliqy M., et al. Phosphocreatine improves cardiac dysfunction by normalizing mitochondrial respiratory function through JAK2/STAT3 signaling pathway in vivo and in vitro. Oxid Med Cell Longev. 2019 Nov 30; 2019: 6521218. https://doi.org/10.1155/2019/6521218. PMID: 31885809
12. Kalogeris T., Baines C.P., Krenz M., Korthuis R.J. Cell biology of ischemia/reperfusion injury. Int Rev Cell Mol Biol. 2012; 298: 229–317. https://doi.org/10.1016/B978-0-12-394309-5.00006-7. PMID: 22878108
13. Sharov V.G., Afonskaya N.I., Ruda M.Y., et al. Protection of ischemic myocardium by exogenous phosphocreatine (neoton): pharmacokinetics of phosphocreatine, reduction of infarct size, stabilization of sarcolemma of ischemic cardiomyocytes, and antithrombotic action. Biochem Med Metab Biol. 1986 Feb; 35(1): 101–114. https://doi.org/10.1016/0885-4505(86)90064-2. PMID: 3778674
14. Zhang W., Zhang H., Xing Y. Protective effects of phosphocreatine administered post-treatment combined with ischemic postconditioning on rat hearts with myocardial ischemia/reperfusion injury. J Clin Med Res. 2015 Apr; 7(4): 242–247. https://doi.org/10.14740/jocmr2087w. Epub 2015 Feb 9. PMID: 25699120
15. Prabhakar G., Vona-Davis L., Murray D., et al. Phosphocreatine restores high-energy phosphates in ischemic myocardium: implication for off-pump cardiac revascularization. J Am Coll Surg. 2003 Nov; 197(5): 786–791. https://doi.org/10.1016/j.jamcollsurg.2003.05.001. PMID: 14585415
16. Kim J.S., Jin Y., Lemasters J.J. Reactive oxygen species, but not Ca2+ overloading, trigger pH- and mitochondrial permeability transition-dependent death of adult rat myocytes after ischemiareperfusion. Am J Physiol Heart Circ Physiol. 2006 May; 290(5): H2024–2034. https://doi.org/10.1152/ajpheart.00683.2005. Epub 2006 Jan 6. PMID: 16399872
17. Robinson L.A., Braimbridge M.V., Hearse D.J. Creatine phosphate: an additive myocardial protective and antiarrhythmic agent in cardioplegia. J Thorac Cardiovasc Surg. 1984 Feb; 87(2): 190–200. PMID: 6694410
18. Tokarska-Schlattner M., Epand R.F., Meiler F., et al. Phosphocreatine interacts with phospholipids, affects membrane properties and exerts membrane-protective effects. PLoS One. 2012; 7(8): e43178. https://doi.org/10.1371/journal.pone.0043178. Epub 2012 Aug 17. PMID: 22912820
19. Zucchi R., Poddighe R., Limbruno U., et al. Protection of isolated rat heart from oxidative stress by exogenous creatine phosphate. J Mol Cell Cardiol. 1989 Jan; 21(1): 67–73. https://doi.org/10.1016/0022-2828(89)91494-6. PMID: 2716067
20. Shopit A., Niu M., Wang H., et al. Protection of diabetes-induced kidney injury by phosphocreatine via the regulation of ERK/Nrf2/HO-1 signaling pathway. Life Sci. 2020 Feb 1; 242: 117248. https://doi.org/10.1016/j.lfs.2019.117248. Epub 2019 Dec 31. PMID: 31899224
21. Procházková D., Boušová I., Wilhelmová N. Antioxidant and prooxidant properties of flavonoids. Fitoterapia. 2011 Jun; 82(4): 513–523. https://doi.org/10.1016/j.fitote.2011.01.018. Epub 2011 Jan 28. PMID: 21277359
22. Bradic J., Jeremic N., Petkovic A., et al. Cardioprotective effects of Galium verum L. extract against myocardial ischemia-reperfusion injury. Arch Physiol Biochem. 2020 Dec; 126(5): 408–415. https://doi.org/10.1080/13813455.2018.1551904. Epub 2019 Jan 11. PMID: 30632812
23. Penna C., Mancardi D., Rastaldo R., Pagliaro P. Cardioprotection: a radical view Free radicals in pre and postconditioning. Biochim Biophys Acta. 2009 Jul; 1787(7): 781–793. https://doi.org/10.1016/j.bbabio.2009.02.008. Epub 2009 Feb 24. PMID: 19248760
Об авторах
Л. А. ГаджиеваРоссия
Гаджиева Луиза Абдурашидовна, соискатель ученой степени канд. мед. наук, врач-терапевт отдела экстренной медицинской помощи
ул. Пушкина, д. 29а–31, г. Махачкала, 367000
С. Б. Болевич
Россия
Болевич Сергей Бранкович, д-р мед. наук, профессор, заведующий кафедрой патологии человека
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
В. Яковлевич
Россия
Яковлевич Владимир, д-р мед. наук, профессор, декан факультета медицинских наук
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
ул. Светозара Марковича, д. 69, Крагуевац, 34000
И. А. Омаров
Россия
Омаров Исрапил Алисултанович, канд. мед. наук, врач – стоматолог-ортопед
Смоленская наб., д. 2, корп. 2, г. Москва, 121099
Х. А. Ордашев
Дания
Ордашев Хасан Алиевич, канд. мед. наук, доцент, заведующий кафедрой хирургической стоматологии и челюстно-лицевой хирургии с усовершенствованием врачей
пл. Ленина, д. 1, г. Махачкала, 367000
М. К. Карташова
Россия
Карташова Мария Константиновна, студентка 6-го курса лечебного факультета
ул. Трубецкая, д. 8, стр. 2, г. Москва,
Дополнительные файлы

|
1. ARRIVE чек-лист | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(108KB)
|
Метаданные ▾ | |







































