Перейти к:
Гемимегалэнцефалия, ассоциированная с фармакорезистентной эпилепсией и редкой молекулярно-генетической альтерацией в гене CPA6: клинический случай
https://doi.org/10.47093/2218-7332.2022.13.2.4-11
Аннотация
Гемимегалэнцефалия (ГМЭ) относится к крайне редким врожденным мальформациям кортикального развития, к группе mTOR-патий, и может быть результатом различных генетических нарушений. Одним из основных клинических проявлений является фармакорезистентная эпилепсия, требующая хирургического лечения.
Описание случая. Мальчик 4 лет поступил в нейрохирургическое отделение с приступами частых генерализованных тонико-клонических судорог и резистентностью к проводимой противоэпилептической терапии; также отмечалась задержка речевого развития. По данным магнитно-резонансной томографии выявлена правосторонняя ГМЭ. Выполнена стереотаксическая лазерная дисконнекция обширной кортикальной дисплазии в правой лобной доле головного мозга. По данным гистологического исследования выявлены морфологические признаки фокальной кортикальной дисплазии (ФКД) IIb. В течение 14 дней наблюдения в стационаре после операции судорог не отмечено. Полноэкзомное секвенирование ДНК показало наличие гетерозиготного состояния _000008.10^G 68419028del / 633del, pGlu212LysfsTers в гене CPA6.
Обсуждение. Особенностью случая является ГМЭ с морфологической картиной ФКД IIb типа, ассоциированная с не описанным ранее гетерозиготным состоянием в 6 экзоне гена CPA6. Указанная ассоциация позволяет расширить представления об изменении активации пути PI3K/AKT/mTOR как ключевого звена в патогенезе врожденной аномалии кортикального развития.
Ключевые слова
Список сокращений:
- mTOR – mammalian target of rapamycin, мишень рапамицина млекопитающих
- ГМЭ – гемимегалэнцефалия
- МРТ – магнитно-резонансная томография
- ФКД – фокальные кортикальные дисплазии
- ФРЭ – фармакорезистентная эпилепсия
- ЭЭГ – электроэнцефалография
Гемимегалэнцефалия (ГМЭ) относится к редким врожденным мальформациям кортикального развития и характеризуется унилатеральным увеличением размера полушария головного мозга с архитектурной и клеточной дисплазией, затрагивающей нейрональные и глиальные элементы [1][2].
Современный взгляд на причины развития ГМЭ, составляющей всего 1% от всех пороков кортикального развития и обнаруживаемой у 0,2% детей, страдающих эпилепсией, основывается на данных гистопатологии и молекулярно-генетических находках. Основными патогенетическими механизмами формирования ГМЭ считаются нарушения нейрональной миграции, дифференцировки и пролиферации в сочетании с альтерацией генов сигнального пути PI3K/AKT/mTOR. Так, экспертами Международной противоэпилептической лиги введен термин «мальформации кортикального развития, mTOR-патии» (mammalian target of rapamycin, мишень рапамицина млекопитающих), включающий в себя ГМЭ, фокальные кортикальные дисплазии (ФКД) и туберозный склероз [1][3][4].
Самым частым клиническим проявлением ГМЭ являются судорожные эпизоды, описана задержка нервно-психического развития, гемианопсия, односторонняя двигательная недостаточность [4]. Как и при многих других пороках формирования головного мозга, эпилепсия при ГМЭ характеризуется фармакорезистентностью (ФРЭ), что требует хирургического лечения эпилептогенных очагов, обычно в объеме гемисферотомии. Имеются данные о сохранении приступов, а также когнитивных нарушений после проведенного оперативного вмешательства, что обуславливает необходимость дальнейшего изучения генетических, патофизиологических и структурных изменений при данной патологии.
Характерные признаки ГМЭ устанавливаются по данным магнитно-резонансной томографии (МРТ): отмечается увеличение одной гемисферы головного мозга, деформация желудочков, изменение белого вещества с герниацией в сторону контралатеральной гемисферы, увеличение размера и стирание борозд в пораженном полушарии. По данным электроэнцефалографии (ЭЭГ), как правило, регистрируют серию иррегулярных паттернов, наиболее заметными из которых являются торможения и/или геми-гипсаритмия.
Мы представляем клинический случай ребенка четырех лет с ФРЭ, обусловленной ГМЭ, c первым в отечественной литературе обнаружением редкой молекулярно-генетической альтерации в гене CPA6, расположенной в локусе 8q13.2 длинного плеча восьмой хромосомы.
ОПИСАНИЕ СЛУЧАЯ
29.08.22 в нейрохирургическое отделение поступил мальчик 4 лет с приступами генерализованных тонико-клонических судорог длительностью до 1,5– 2 минут с последующей слабостью около 30 минут. Приступы возникали 1–2 раза в день в течение двух последовательных дней, после чего в течение трех дней отмечался период покоя. Также отмечались редкие орофарингеальные автоматизмы: 3–4 приступа в месяц.
Родился от первой беременности, срочных родов, протекавших без осложнений. В перинатальном и постнатальном периодах признаков неврологических расстройств не отмечалось. Семейный анамнез не отягощен.
С одного года отмечалась задержка нервно-психического развития, беспокойный сон, в возрасте двух лет впервые наблюдался приступ орофарингеальных автоматизмов, к которым присоединились тоникоклонические приступы с дальнейшей утратой сознания длительностью по 10–20 секунд и частотой 1–2 раза в неделю. Со слов матери было проведено ЭЭГ, МРТ, и неврологом установлен диагноз: структурная фокальная эпилепсия, G40.8. Принимал вальпроевую кислоту (600 мг/сут) без отчетливого клинического эффекта, через две недели к терапии был добавлен леветирацетам 500 мг/сут, на фоне которого, со слов матери, количество приступов увеличилось. Леветирацетам был заменен на перампанел 4 мг/сут, который продолжал принимать в комбинации с вальпроевой кислотой 600 мг/сут. Комбинированная терапия проводилась в течение двух лет, не имела положительного эффекта, выраженность, частота и продолжительность приступов постепенно прогрессировали.
На момент поступления: сознание ясное, ориентирован в пространстве. Неврологический статус: черепно-мозговые нервы, двигательная и чувствительная сфера без патологии, менингеальных симптомов нет; тазовые функции сохранны. Отмечается задержка речевого развития. По остальным органам и системам – без особенностей. Показатели клинического и биохимического анализов крови, общего анализа мочи находились в пределах референсных значений. Для проведения обследования и лечения у родителей пациента было получено информированное добровольное согласие.
По данным МРТ в лобной и островковой долях большого мозга справа визуализирована зона нарушения кортикального развития в виде сглаженности борозд, резкого утолщения извилин, отмечена «смазанность» кортико медуллярного перехода (рис. 1А, 1В). Сигнал в режимах Т2-ВИ и Flair повышен от коры и субкортикального белого вещества.
При выполнении видео-ЭЭГ-мониторинга произведена запись на протяжении периодов активного и пассивного бодрствования, а также в состоянии физиологического ночного сна в течение 7 суток. Биоэлектрическая активность головного мозга регистрировалась по 19 скальповым отведениям, установленным по системе «10–20%». Выявлено наличие интермиттирующего регионального замедления фоновой активности, локализованного в правой лобно височной области, включающее в свою структуру интериктальную эпилептиформную активность низкого индекса, представленную периодическими одиночными и сгруппированными разрядами комплексов «острая-медленная волна», «спайк-волна».
Кроме того, регистрировалось наличие редких полиморфных сгруппированных разрядов комплексов «спайк-волна», имеющих диффузный характер с левосторонним либо правосторонним преобладанием выраженности. Зафиксировано 5 иктальных эпизодов с генерализованными тонико-клоническими судорогами (рис. 2A). Инициальная зона приступа по данным ЭЭГ была локализована в одном случае – в правой лобной области, в четырех случаях – в правой лобно-височной области.
Консилиум в составе невролога, нейрохирурга, врача-рентгенолога установил диагноз: структурная фокальная эпилепсия, фармакорезистентное течение (G40.8). Правосторонняя гемимегалэнцефалия (Q04.5).
В связи с фармакорезистентным течением заболевания и наличием морфологического субстрата принято решение о проведении оперативного вмешательства.
31.08.22 пациенту была выполнена стереотаксическая лазерная дисконнекция обширной кортикальной дисплазии в правой лобной доле головного мозга с предварительным МРТ-ЭЭГ-картированием и под интраоперационным МРТ-контролем.
По результатам морфологического исследования из зоны эпилептического очага наблюдалось утолщение коры, были обнаружены нарушения цитоархитектоники неокортекса с нарушением гексаламинарной структуры в виде радиальной и тангенциальной дисламинации (рис. 3А). Выявлены многочисленные дисморфные нейроны: увеличенных размеров, с крупными ядрами, с гипертрофированными и утолщенными отростками, со «спеканием» и перимембранозной агрегацией субстанции Ниссля (рис. 3В), а также баллонные клетки с обильной стекловидной опалесцирующей цитоплазмой, без субстанции Ниссля (рис. 3С). Кальцинаты и микроскопические гетеротопии отсутствуют. По результатам иммуногистохимического исследования (антитела фирмы DAKO, Дания, система визуализации EnVision) в цитоплазме дисморфных нейронов выявлено повышенное накопление нейрофиламентов (рис. 3В), а в цитоплазме баллонных клеток яркое окрашивание с глиальным фибриллярным кислым белком (рис. 3С).
При контрольной МРТ головного мозга (рис. 1С, 1D) в зоне стереотаксической лазерной деструкции эпилептогенных очагов гематом нет. В лобной, островковой долях справа (преимущественно в измененной кортикальной пластинке и субкортикальном белом веществе), колене и передних отделах ствола мозолистого тела мелкие послеоперационные очаги ишемии с геморрагическими включениями.
По данным видео-ЭЭГ-мониторинга отмечалась некоторая положительная динамика в виде редукции диффузной разрядной активности. За время пребывания в стационаре после операции – в течение 14 дней – эпизодов судорог не было.
Выполнено полноэкзомное секвенирование дезоксирибонуклеиновой кислоты (ДНК), выделенной из биоматериала периферической крови, на наличие варианта _000008.10^G 68419028del / 633del, pGlu212LysfsTers в гене CPA6. По результатам сиквенса был обнаружен ранее не описанный вариант гетерозиготного состояния в 6-м экзоне гена CPA6.
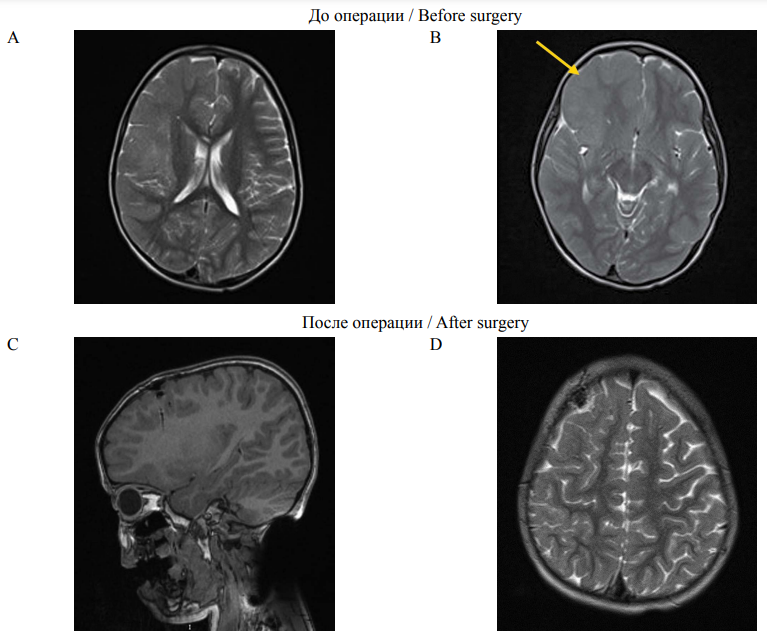
РИС. 1. Магнитно-резонансная томография головного мозга до и после операции. Т: 5,0 мм. L: 23,2 мм. Зона измененного сигнала указана желтой стрелкой.
FIG. 1. Magnetic Resonance Imaging of the brain before and after surgery. Т: 5.0 mm. L: 23.2 mm. Zone of the changed signal is indicated by the yellow arrow.
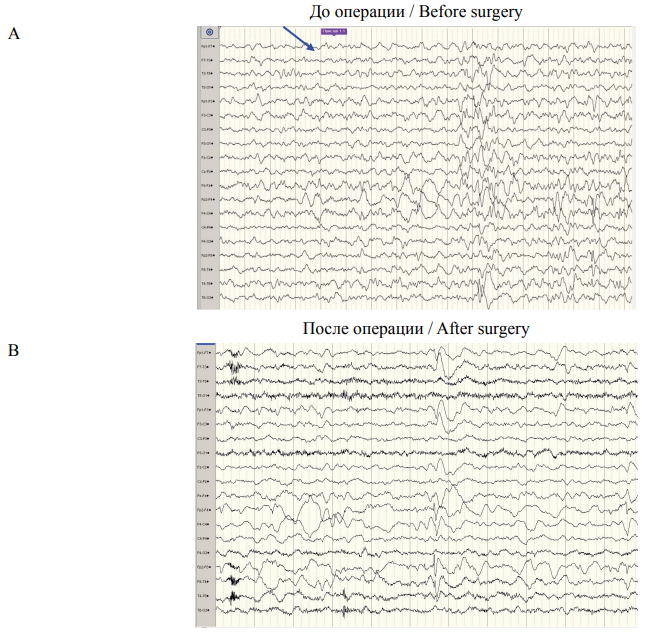
РИС. 2. Результаты видео-ЭЭГ-мониторинга. Инициальная зона приступа была локализована в правой лобной области. Зона изменений указана синей стрелкой. Объяснения в тексте.
FIG. 2. Video-EEG monitoring results. The initial zone of the attack was located in the right frontal lobe. Zone of the changes is indicated by the blue arrow. Explanations in the text.
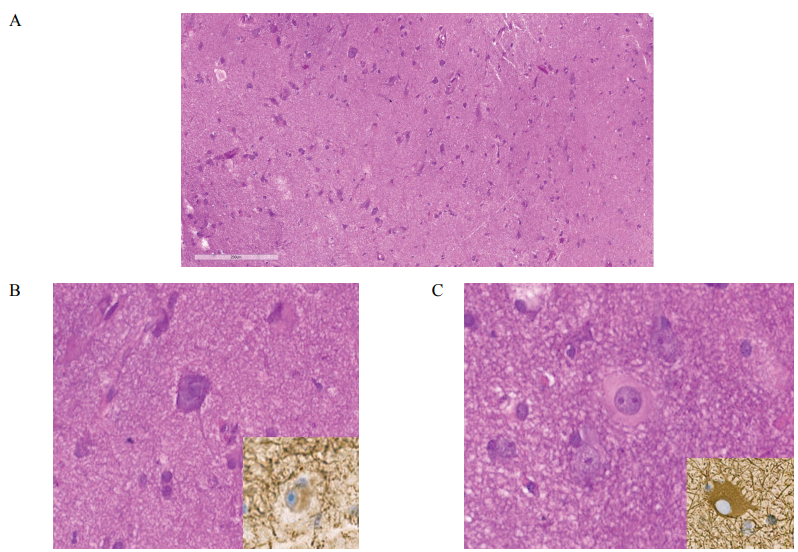
РИС. 3. Результаты гистологического исследования.
А. В области ГМЭ значительное расширение коры, сопровождающееся нарушением архитектоники. Окраска гематоксилином и эозином, ×200.
В. Дисморфный нейрон. Окраска гематоксилином и эозином, Накопление нейрофиламентов, иммуногистохимическое исследование, ×600.
С. Баллонная клетка. Окраска гематоксилином и эозином, глиальным фибриллярным кислым белком, иммуногистохимическое исследование, ×600.
FIG. 3. Histological examination results.
А. In the HME area, there is a significant expansion of the cortex, accompanied by a violation of the architectonics. Hematoxylin and Eosin Staining, ×200.
В. Dysmorphic neuron. Hematoxylin and Eosin Staining, Accumulation of neurofilaments, immunohistochemical stain, ×600.
С. Ballon cell. Hematoxylin and Eosin Staining, Glial fibrillary acidic protein (GFAP), immunohistochemical stain, ×600.
ОБСУЖДЕНИЕ
Обнаруженная у пациента молекулярно-генетическая альтерация в гене CPA6, расположенном в локусе 8q13.2 длинного плеча восьмой хромосомы (ОМIМ 609562), обычно приводит к развитию одного из восьми возможных типов семейной височной эпилепсии 5-го типа с аутосомно-доминантным типом наследования. Известно, что ген СРА6 ответствен за синтез энзима карбоксипепсидазы А6 (относится к подсемейству A/B металлокарбопептидаз M14), который расщепляет C-концевые гидрофобные аминокислоты из пептидов, связываясь с внеклеточным матриксом.
Мутации в гене CPA6 были описаны еще в 1996 году С. Берковик и обнаруживаются при аутосомно-рецессивных фебрильных судорогах, ювенильной миоклонической эпилепсии. Ряд авторов объединяют мегалэнцефалию, ФКД и ГМЭ в качестве анатомических подмножеств единого порока развития коры с переменной экспрессивностью и серии перекрывающихся фенотипов, связанных с активацией пути PI3K/AKT/mTOR. Есть данные, что патогенные варианты mTOR чаще всего связаны с ФКД, тогда как патогенные варианты PIK3CA чаще встречаются при ГМЭ [1].
У нашего пациента гетерозиготное состояние в 6-м экзоне гена CPA6 ассоциировано с развитием ГМЭ и морфологической картиной ФКД IIb типа, что ранее не было описано.
В последнее время подчеркивается, что мозаичные варианты RHEB (Ras гомолог) и повышенная активность mTOR выявляются в диспластических тканях, дисморфных нейронах и баллонных клетках. ФКД и ГМЭ представляют собой континуум заболеваний, при этом размер порока, степень дисплазии головного мозга прямо коррелирует с нагрузкой соматического варианта мутации. Интересно, что мутации PIK3CA обычно ассоциируются с незначительным увеличением нейронов, тогда как мутации AKT3 связаны с резко увеличенным размером нейронов. В некоторых публикациях отмечались повышенные уровни фосфорилированного рибосомного белка S6 как в нейронах, так и в астроцитах во всех случаях ГМЭ и ФКД II типа, независимо от наличия или отсутствия обнаруженных мутаций пути PI3K/AKT [2][3]. В связи с этим ряд авторов предлагают рассматривать ингибиторы мТОR, такие как эверолимус, в качестве потенциальных таргетных препаратов в лечении ГМЭ, так как эта группа препаратов уже рекомендована для лечения пациентов с ТС.
Необходимо отметить, что многочисленные селективные ингибиторы PI3K и AKT находятся на стадии клинических испытаний для лечения пациентов со злокачественными опухолями различных локализаций, поэтому можно предположить их потенциальную эффективность при лечении эпилепсий, связанных с активацией пути PI3K/AKT/mTOR в спектре континуума МКР, поскольку нейропатологические фенотипы комплекса туберозного склероза, синдромов мутации PTEN и ГМЭ имеют много общего, включая дисламинацию коры, цитомегалию и дисморфию нейронов.
На сегодня основным методом лечения ФРЭ при ГМЭ остается хирургическое вмешательство – функциональная гемисферотомия, которая купирует приступы у 65–85% пациентов в зависимости от патологического субстрата [5]. При этом когнитивные результаты обычно хуже, и в исследовании Global Pediatric Epilepsy Surgery Registry среди 45 детей после гемисферотомии около 43% имели среднее или слабое умственное развитие, 26% могли говорить соответственно возрасту, лишь 21% имел удовлетворительные навыки чтения. Более благоприятные когнитивные и лингвистические исходы наблюдались при резекции правого полушария и при более поздней манифестации эпилепсии [4].
В исследовании Ahsan N. V. Moosa при 6-летнем послеоперационном наблюдении 115 пациентов лишь у 56% пациентов не наблюдалось судорожных припадков, при этом у 17% наблюдались моторные нарушения (невозможность самостоятельно передвигаться), 30% имели нарушения речи, 58% пациентов старше 6 лет не обладали навыками чтения, лишь 5% пациентов посещали обычные школы, все остальные нуждались в особом уходе [6][7].
У нашего пациента в ближайшем послеоперационном периоде эпизодов судорог не отмечалось. Необходимо дальнейшее наблюдение с оценкой как неврологической картины, так и психического развития.
ЗАКЛЮЧЕНИЕ
ГМЭ – редкий врожденный порок развития головного мозга, ассоциированный с ФРЭ и задержкой психического развития. Хирургическое лечение в объеме гемисферотомии остается приоритетным для купирования эпилепсии. Обнаруженная ассоциация ГМЭ и ФРЭ с альтерацией в гене CPA6 позволяет расшить представления об изменении активации пути PI3K/AKT/mTOR как ключевого звена в патогенезе врожденной аномалии в представленном случае. Необходимо дальнейшее изучение генетических аномалий при данной патологии с целью разработки таргетной терапии.
ВКЛАД АВТОРОВ
Д.А. Мурзаева внесла основной вклад в разработку концепции статьи, подготовила текст и согласна принять на себя ответственность за все аспекты клинического наблюдения. Д.А. Ситовская внесла существенный вклад в разработку концепции статьи, в написание статьи, подготовила текст, иллюстративный материал. К.А. Султыгова, Д.Д. Сабанчиева, М.А. Киселева, О.П. Вербицкий принимали активное участие в проведении исследований пациента, подготовке материалов и описании клинического наблюдения. Ю.М. Забродская внесла значительные правки в статью, редактировала текст. Все авторы утвердили окончательную версию статьи.
AUTHORS CONTRIBUTIONS
Dzhamilia A. Murzaeva developed the main concept of the article, wrote the text, and agreed to take responsibility for all aspects of the article. Darya A. Sitovskaya developed the main concept of the article, made a significant contribution to the writing of the article. Kalimat A. Sultygova, Djennet D. Sabanchieva, Maria A. Kiseleva, Oleg P. Verbitskiy took active part in treatment of the patient, preparing materials and describing of the clinical case. Yulya M. Zabrodskaya reviewed and edited the text of the article. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проводилось в рамках госзадания № 121031000359–3 «Разработка новых подходов в диагностике медиобазальной фармакорезистентной эпилепсии на основе гистопротеомики эпилептических очагов».
Благодарности. Авторы статьи выражают благодарность лаборантам гистологической лаборатории Рахмаевой Елене Алимовне и Княжевой Татьяне Александровне за кропотливый труд в изготовлении качественных гистологических слайдов.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was carried out within the framework of State assignment No. 121031000359–3 “Development of new approaches in the diagnosis of mediobasal pharmacoresistant epilepsy based on the histoproteomics of epileptic foci”.
Acknowledgments. The authors of the article express their gratitude to the laboratory assistants of the histological laboratory Rakhmaeva Elena Alimovna and Knyazheva Tatyana Alexandrovna for the painstaking work in making high-quality histological slides.
Список литературы
1. Pirozzi F., Berkseth M., Shear R., et al. Profiling PI3K-AKTMTOR variants in focal brain malformations reveals new insights for diagnostic care. Brain. 2022 Apr 29; 145(3): 925–938. https://doi.org/10.1093/brain/awab376. PMID: 35355055.
2. Lee W.S., Baldassari S., Chipaux M., et al. Gradient of brain mosaic RHEB variants causes a continuum of cortical dysplasia. Ann Clin Transl Neurol. 2021 Feb; 8(2): 485–490. https://doi.org/10.1002/acn3.51286. Epub 2021 Jan 12. PMID: 33434304.
3. Jansen L.A., Mirzaa G.M., Ishak G.E., et al. PI3K/AKT pathway mutations cause a spectrum of brain malformations from megalencephaly to focal cortical dysplasia. Brain. 2015 Jun; 138(Pt 6): 1613–1628. https://doi.org/10.1093/brain/awv045. Epub 2015 Feb 25. PMID: 25722288.
4. Puka K., Jones M., Mathern G.W. Functional cognitive and language outcomes after cerebral hemispherectomy for hemimegalencephaly. Epilepsia. 2021 Dec; 62(12): 2932–2940. https://doi.org/10.1111/epi.17088. Epub 2021 Oct 4. PMID: 34608636.
5. Kurwale N.S., Patil S.B., Jagtap S.A., et al. Failed hemispherotomy: insights from our early experience in 40 patients. World Neurosurg. 2021 Feb; 146:e 685–e690. https://doi.org/10.1016/j.wneu.2020.10.170. Epub 2020 Nov 7. PMID: 33171323.
6. Moosa A.N., Jehi L., Marashly A., et al. Long-term functional outcomes and their predictors after hemispherectomy in 115 children. Epilepsia. 2013 Oct; 54(10): 1771–1779. https://doi.org/10.1111/epi.12342. Epub 2013 Aug 23. PMID: 23980759.
7. Jaiswal V., Hanif M., Sarfraz Z., et al. Hemimegalencephaly: A rare congenital malformation of cortical development. Clin Case Rep. 2021 Dec 18; 9(12): e05238. https://doi.org/10.1002/ccr3.5238. PMID: 34976397.
Об авторах
Д. А. МурзаеваРоссия
Мурзаева Джамиля Адильхановна, врач-патологоанатом, аспирант
ул. Маяковского, д. 12, г. Санкт-Петербург, 191014
Tel.: +7 (929) 262-30-82
Д. А. Ситовская
Россия
Ситовская Дарья Александровна, врач-патологоанатом, научный сотрудник научно-исследовательской лаборатории патоморфологии нервной системы РНХИ им. проф. А. Л. Поленова – филиала НМИЦ им. В. А. Алмазова
ул. Маяковского, д. 12, Санкт-Петербург, 191014
пр. Литейный, д. 56, Санкт-Петербург, 191014
К. А. Султыгова
Россия
Султыгова Калимат Арсановна, врач-невролог, врач-рентгенолог
ул. Ленинградская, д.70, п. Песочный, г. Санкт-Петербург, 197758
Д. Д. Сабанчиева
Россия
Сабанчиева Дженнет Данияловна, врач-психиатр
ул. Одесская, д. 54, г. Тюмень, 625023
М. А. Киселева
Россия
Киселева Мария Александровна, студентка
ул. Одесская, д. 54, г. Тюмень, 625023
О. П. Вербицкий
Россия
Вербицкий Олег Петрович, канд. мед. наук, врач-нейрохирург
пр. Литейный, д. 56, Санкт-Петербург, 191014
Ю. М. Забродская
Россия
Забродская Юлия Михайловна, д-р мед. наук, заведующая научно-исследовательской лабораторией патоморфологии нервной системы
ул. Маяковского, д. 12, Санкт-Петербург, 191014
Дополнительные файлы

|
1. Чек-лист CARE | |
| Тема | ||
| Тип | Прочее | |
Скачать
(661KB)
|
Метаданные ▾ | |







































