Перейти к:
Цитокиновый профиль зубодесневой жидкости у детей с нарушением системы иммунологического надзора
https://doi.org/10.47093/2218-7332.2022.13.3.34-44
Аннотация
Цель. Изучить цитокиновый профиль зубодесневой жидкости (ЗДЖ) у детей с ювенильным ревматоидным артритом (ЮРА).
Материалы и методы. Обследованы 20 детей с ЮРА и 10 пациентов без соматической патологии в возрасте от 6 до 16 лет. Состояние тканей пародонта оценивалось по пародонтальным индексам: десневой индекс GI (gingival index) и индекс кровоточивости десны GBI (gingival bleeding index). Забор ЗДЖ проводили с помощью специальных бумажных абсорбирующих эндодонтических штифтов. В ЗДЖ с помощью наборов реагентов ООО «Вектор-Бест» (Новосибирск, Россия) проводили иммуноферментный анализ определения концентрации IL-18, IL-10, IL-1β, IL-1RA, MCP-1, VEGF.
Результаты. Значение индекса GI в группе ЮРА составило 0,31 ± 0,10, в контрольной – 0,20 ± 0,05 (р < 0,05), индекса GBI – 19,90 ± 3,14 и 10,80 ± 2,60 соответственно (р < 0,05), что сопровождалось более выраженной степенью воспаления тканей пародонта в группе ЮРА. Содержание в ЗДЖ IL-18 в группе ЮРА составило 6,70 (4,97–7,92) пг/мл, в контрольной – 11,25 (8,70–13,10) пг/мл, IL-1β – 15,30 (13,79–17,18) и 5,36 (5,32–5,54) пг/мл соответственно. Содержание IL-10 в группе ЮРА составило 3,60 (2,89–4,45) пг/мл, что было сопоставимо со значениями контрольной группы. Концентрация IL-1RA была ниже в основной группе, чем в контрольной, – 3638,5 (2397,5–4133,5) и 4951,0 (4303,0–5455,0) пг/мл соответственно (p < 0,05). Общие уровни хемокинов в ЗДЖ были определены на уровне 15,65 (14,15–17,39) и 15,50 (12,80–21,20) пг/мл для MCP-1 для основной и контрольной групп соответственно и на уровне 49,60 (41,95–54,50) и 12,00 (11,00–13,00) пг/мл для VEGF.
Заключение. У детей с ЮРА в развитии гингивита играет роль дисбаланс про- и противовоспалительных цитокинов: повышенное содержание в ЗДЖ IL-1β – пускового фактора провоспалительных цепочек, снижение IL-1RA – противовоспалительного цитокина, повышение VEGF – маркера гипоксии.
Ключевые слова
Список сокращений:
- GBI – gingival bleeding index, индекс кровоточивости десны
- GI – gingival index score, десневой индекс
- IL-10 – interleukin-10, интерлейкин 10
- IL-1RA – interleukin-1 receptor antagonist, антагонист рецептора интерлейкина 1
- IL-1β – interleukin-1β, интерлейкин 1 бета
- IL-18 – interleukin-18, интерлейкин 18
- MCP-1 – monocyte chemoattractant protein-1, моноцитарный хемоаттрактантный протеин-1
- OHI-S – oral hygiene indices – simplified, упрощенный индекс гигиены полости рта
- VEGF – vascular endothelial growth factor, васкулоэндотелиальный фактор роста
- ГИБТ – генно-инженерная биологическая терапия
- ЗДЖ – зубодесневая жидкость / GCF – gingival crevicular fluid
- КПУ – кариес, пломба, удаленный зуб / DMF – decayed, missing, filled index
- НПВП – нестероидные противовоспалительные препараты
- РА – ревматоидный артрит
- ЮРА – ювенильный ревматоидный артрит
Современные исследования свойств и молекулярного состава зубодесневой жидкости (ЗДЖ) при воспалительных заболеваниях пародонта позволили сформулировать цитокиновую концепцию развития этого патологического процесса [1–3]. В рамках данной концепции установлено, что пародонто-патогенные бактерии индуцируют усиление продукции провоспалительных цитокинов активированными моноцитами и макрофагами, что приводит к дисбалансу между провоспалительными и противовоспалительными цитокинами. Исходом каскадных межклеточных взаимодействий, регулируемых цитокинами, является активация остеокластов и резорбция костной ткани [4]. Установлено, что активация иммунного ответа на Th1-тип реагирования и снижение функциональной активности B-лимфоцитов обуславливают увеличение концентрации провоспалительных цитокинов в ЗДЖ [5].
Цитокины представляют собой малые белковые молекулы, которые секретируются различными клетками системы иммунологического надзора [6]. Они осуществляют коммуникацию между клетками, стимулируют их деление, функциональную активность и апоптоз [7]. Цитокины играют ведущую в роль в координации работы врожденного и адаптивного иммунитета. Количество и тип цитокинов, секретируемых клетками, различаются в зависимости от типа патогена, что способствует адаптации иммунной системы к ответу и определяет, будет ли он врожденным или адаптивным.
Если имеет место сбалансированность между местной стимуляцией и умеренным иммунным ответом, то доминирует иммунологический надзор и соответствующий иммунный ответ [8]. При повышении уровня колонизации ключевыми пародонтогенными бактериями происходит чрезмерная активация иммунного ответа и разрушение тканей [9].
К основным цитокинам, участвующим в воспалительной реакции и воздействующим на костную ткань, относят IL-1β (interleukin-1β, интерлейкин 1 бета). Другим важным цитокином, участвующим в развитии иммунопатологического процесса, является IL-18 (interleukin-18, интерлейкин 18), который регулирует Т-хелперный тип иммунной реакции, усиливает синтез других провоспалительных цитокинов [10], в частности MCP-1 (мonocyte chemoattractant protein-1, моноцитарный хемоаттрактантный протеин-1), который регулирует процесс миграции и инфильтрации макрофагов и моноцитов [11].
К противовоспалительным цитокинам относятся: IL-1RA (interleukin-1 receptor antagonist, антагонист рецептора интерлейкина 1), блокирующий взаимодействие IL-1β с клеточным рецептором и препятствующий реализации его эффектов; IL-10 (interleukin-10, интерлейкин 10) – ингибитор провоспалительного цитокинового каскада, играющий ведущую роль в противовоспалительной реакции [12]. Ведущее значение в воспалительной иммунной реакции имеет VEGF (vascular endothelial growth factor, васкулоэндотелиальный фактор роста), который является многофункциональным ангиогенным цитокином [13][14].
Следовательно, изучение механизмов и каскадов реакций в тканях пародонта при воспалении считается перспективным с точки зрения разработки новых методов и подходов к лечению гингивитов и пародонтитов [15].
Разрушение тканей, сопровождающее многие хронические аутоиммунные воспалительные заболевания у детей, такие как ювенильный ревматоидный артрит (ЮРА), воспалительные заболевания кишечника, анкилозирующий спондилоартрит, псориаз и астма, также регулируется иммунным ответом хозяина. Общность каскада воспалительных реакций при соматических заболеваниях и при воспалительном процессе в тканях пародонта обусловлена появлением аутоантигенных свойств у клеток и нарушением баланса цитокиновой регуляции иммунологических процессов [16]. При этом воспалительный процесс в тканях пародонта становится хроническим как следствие нарушения баланса провоспалительных и противовоспалительных цитокинов.
В связи с этим одним из перспективных направлений разработки персонализированного плана лечения служит изучение патогенетических механизмов заболеваний тканей пародонта у детей с нарушением системы иммунологического надзора. Цель представленного исследования: изучить цитокиновый профиль ЗДЖ у детей с ЮРА.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено пилотное одномоментное одноцентровое исследование по определению содержания прои противовоспалительных цитокинов и хемокинов в ЗДЖ у детей с ЮРА. Исследование одобрено локальным комитетом по этике (протокол № 4 от 15.04.2010).
Клинический этап исследования выполнялся на базе Университетской детской клинической больницы ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет) с 1 марта по 30 апреля 2022 года. Нормативной базой для его выполнения был Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011, № 48, ст. 6724)1.
Производился сплошной набор пациентов. Всего обследовано 30 детей с ЮРА в возрасте от 6 до 15 лет, проходивших лечение в ревматологическом отделении. У всех пациентов диагноз «Ювенильный ревматоидный артрит» (код по международной классификации болезней 10-го пересмотра: M08.0) был установлен на основе клинико-лабораторных данных.
Критериями невключения в исследование были: наличие острого воспалительного заболевания (2 пациента), текущее ортодонтическое лечение (4 пациента); критерий исключения: решение родителей/ представителей ребенка прекратить участие в исследовании на любом из его этапов (4 пациента). Таким образом, в итоговый анализ включены 20 пациентов с ЮРА, из них на момент исследования низкая активность заболевания отмечена у 5 (25%), средняя активность – у 12 (60%), высокая – у 3 (15%) детей. Большая часть пациентов – 14 (70%) в качестве базисной терапии получала генно-инженерную биологическую терапию (ГИБТ), все пациенты получали нестероидные противовоспалительные препараты (НПВП).
В контрольную группу были включены 10 пациентов в возрасте от 9 до 16 лет, не имевших ЮРА и проходивших стоматологическое обследование на кафедре детской, профилактической стоматологии и ортодонтии Института стоматологии имени Е.В. Боровского ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет) в сроки набора группы исследования. Критериями невключения были: ортодонтическое лечение, местные или системные острые/ хронические заболевания.
Обязательным условием включения детей в группу исследования и контроля было наличие подписанного информированного согласия родителем или официальным представителем ребенка.
Стоматологическое обследование детей проводили по стандартной схеме, включающей данные анамнеза, объективного внешнего и внутриротового обследования. Индекс интенсивности кариеса определялся суммой постоянных зубов с кариозными полостями, пломбами и числом удаленных зубов (индекс КПУ). При значениях КПУ 0–1,1 уровень интенсивности кариеса определялся как очень низкий, 1,2–2,6 – низкий, 2,7–4,4 – средний, 4,5–6,5 – высокий и 6,6 и выше – очень высокий.
Упрощенный индекс оценки гигиены – OHI-S (Oral Hygien Indices – Simplified) по методу J.C Green, J.K. Vermillion определяли, окрашивая 6 индексных зубов. Уровень гигиены по индексу OHI-S оценивали по следующим критериям: 0–0,6 балла – хороший уровень гигиены, 0,7–1,8 – удовлетворительный, 1,9–2,5 – неудовлетворительный, более 2,6 – плохой.
Десневой индекс GI (gingival index) по Н. Silness и J. Loe, который позволяет определить локализацию и тяжесть течения гингивита, определяли с помощью зондирования десны в области индексных зубов пародонтальным зондом. Степень тяжести гингивита определяли по критериям: 0,1–1,0 балла – легкая, 1,1–2,0 – средняя, 2,1–3,0 – тяжелая степень. Выраженность кровоточивости десны оценивали по индексу кровоточивости десен GBI ( Gingival Bleeding Index) по J. Ainamo и I. Bay. Если кровотечение происходило в течение 10 секунд, регистрировался положительный результат и записывалось количество положительных участков, которое затем выражалось в процентах от количества обследованных участков.
Для забора ЗДЖ использовали общепринятый метод: изначально участок десны очищали от налета и высушивали с помощью стерильных ватных валиков. Получение жидкости из зубодесневой борозды проводили с помощью специальных бумажных абсорбирующих эндодонтических штифтов (Absorbent Paper Points, размер 25, President Dental, Германия), которые удобны для погружения в зубодесневую борозду. Материал данных штифтов представляет собой бумагу, обладающую высокой абсорбирующей способностью и не содержащую примеси. С помощью пинцета штифты погружали в зубодесневую борозду центрального правого резца в течение 1–2 минут для пропитывания ЗДЖ, далее штифт погружали в пробирку типа Eppendorff (Eppendorf Austria GmbH), содержащую 1 мл раствора хлорида натрия с 0,2% биоцида ProClin серии 300. Пробирки встряхивали с помощью центрифуги-вортекс СМ 70М-07 (ELMI, Латвия) в течение 10 минут. В результате получали образцы ЗДЖ с разведением 1:100. Их замораживали при -80 °С и хранили до проведения анализа.
В образцах ЗДЖ с помощью набора реагентов для иммуноферментного анализа ООО «ВекторБест» (Российская Федерация, Новосибирск) определяли концентрацию IL-18, IL-10, IL-1β, IL-1RA, MCP-1, VEGF.
Статистическая обработка данных
Данные представлены как абсолютное число пациентов и процент от общей численности группы. Для определения нормальности распределения непрерывных данных в группах использовали тест Шапиро – Уилка. Для признаков с нормальным распределением переменных данные представлены в виде среднего и стандартного отклонения, при сравнении групп использовался t-критерий Стьюдента. Признаки с ненормальным распределением представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили), при сравнении таких признаков между группами использовали непараметрический критерий Уилкоксона. В качестве порогового значения принят уровень значимости р < 0,05. Статистическая обработка данных производилась с помощью статистических пакетов: IBM SPSS Statistics 21.0 (IBM Corporation, США) и MedCalc v.16.8.4. (MedCalc Software Ltd, Бельгия).
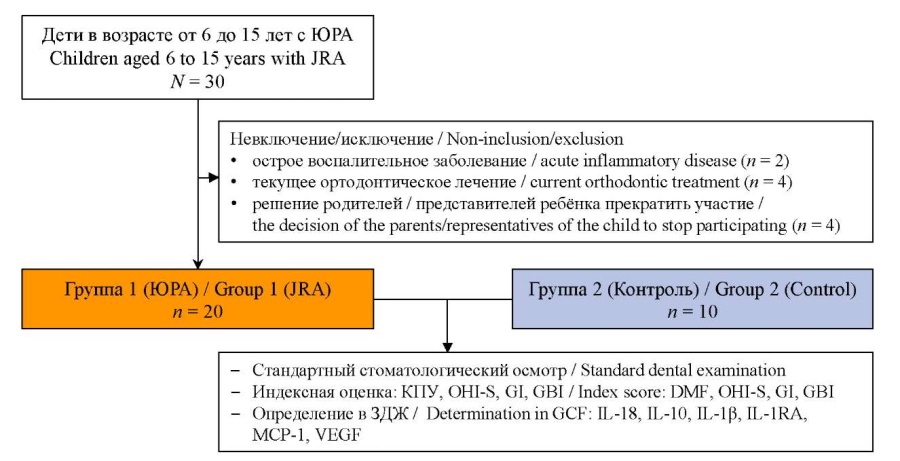
РИС. 1. Схема исследования.
FIG. 1. Scheme of the study.
Примечание: ЮРА – ювенильный ревматоидный артрит; КПУ – кариес, пломба, удаленный зуб; ЗДЖ – зубодесневая жидкость; GBI – gingival bleeding index, индекс кровоточивости десны; GI – gingival index score, десневой индекс; OHI-S – oral hygiene indices – simplified, упрощенный индекс гигиены полости рта.
Note: JRA – juvenile rheumatoid arthritis; DMF – decayed, missing, filled index; GCF – gingival crevicular fluid; GBI – gingival bleeding index; GI – gingival index score; OHI-S – oral hygiene indices – simplified.
РЕЗУЛЬТАТЫ
Характеристики групп по гигиеническому состоянию полости рта
Группа детей с ЮРА была сопоставима по возрасту и полу с контрольной группой.
Были выявлены существенные различия в стоматологическом статусе детей. Так, у детей с ЮРА индекс КПУ был выше, чем аналогичный показатель в контроле. Удовлетворительная или хорошая гигиена полости рта отмечена у 55% пациентов в группе ЮРА и 90% в контроле. Эти данные подтверждены индексной оценкой OHI-S: установлено повышение данного индекса в группе пациентов с ЮРА (табл. 1).
Состояние тканей пародонта, оцениваемое по пародонтальным индексам, выявило, что значение индексов GI и GBI в группе пациентов с ЮРА было статистически значимо выше, чем в группе контроля (табл. 1). Средняя и тяжелая степень гингивита отмечена у 90% детей с ЮРА, в группе контроля только у 20% детей выявлена средняя степень гингивита, у остальных – легкая.
Таблица 1. Исходные характеристики пациентов в группах 1 и 2
Table 1. Initial characteristics of the patients in group 1 and 2
|
Параметр / Parameter |
Группа 1 / |
Группа 2 / |
Значение р / |
|
Девочки / Girls |
8 (40) |
4 (40) |
n.s. |
|
Мальчики / Boys |
12 (60) |
6 (60) |
n.s. |
|
Возраст, годы / Age, years |
11,40 ±2,11 |
12,80 ± 2,40 |
n.s. |
|
КПУ, баллы / DMF, score |
5,55 ± 2,01 |
1,90 ± 0,60 |
<0,05 |
|
Уровень интенсивности кариеса / Dental caries severity |
|||
|
очень низкий / very low |
5 (50) |
<0,001 |
|
|
низкий / low |
4 (40) |
||
|
средний / average |
9 (45) |
1 (10) |
|
|
высокий / high |
7 (35) |
||
|
очень высокий / very high |
4 (20) |
||
|
OHI-S, баллы / score |
1,20 ± 0,66 |
0,55 ± 0,22 |
<0,05 |
|
GI, баллы / score |
0,31 ± 0,07 |
0,20 ± 0,06 |
<0,05 |
|
GBI, баллы / score |
19,9 ± 4,5 |
10,8 ± 3,7 |
<0,05 |
|
Степень гингивита / Grade of gingivitis |
|||
|
легкая / mild |
2 (10) |
8 (80) |
<0,001 |
|
средняя / average |
12 (60) |
2 (20) |
|
|
тяжелая / severe |
6 (30) |
||
|
Уровень гигиены полости рта /Oral hygiene level |
|||
|
хорошая / good |
7 (35) |
5 (50) |
n.s. |
|
удовлетворительная /satisfactory |
4 (20) |
4 (40) |
|
|
неудовлетворительная/ unsatisfactory |
8 (40) |
1 (10) |
|
|
плохая / bad |
1 (5) |
||
Примечание: данные представлены как абсолютное число пациентов и доля (%) от общей численности в группе либо как среднее значение и стандартное отклонение.
КПУ – кариес, пломба, удаленный зуб; OHI-S – упрощенный индекс гигиены полости рта; GI – десневой индекс; GBI – индекс кровоточивости десны; n.s. – не значимо.
Note: data are presented as an absolute number of patients and a share (%) of the total number in the group; or as an average and standard deviation.
DMF – decayed, missing, filled index; OHI-S – oral hygien indices – simplified; GI – gingival index score; GBI – gingival bleeding index; n.s. – not significant.
Концентрация цитокинов в зубодесневой жидкости
Анализ содержания провоспалительных цитокинов в ЗДЖ показал более низкое содержание IL-18 – 6,70 (4,97–7,92) пг/мл в группе ЮРА по сравнению с контролем – 11,25 (8,70–13,10) пг/мл (р < 0,05). Концентрация IL-1β была повышена – 15,30 (13,79–17,18) пг/мл в группе пациентов с ЮРА по сравнению с контрольной 5,36 (5,32–5,54) пг/мл (р < 0,05) (рис. 2А, В).
При анализе содержания противовоспалительных цитокинов были получены следующие данные: содержание IL-10 в группе ЮРА 3,60 (2,89–4,45) пг/мл, в контрольной группе – 1,90 (1,54–3,10) пг/мл (различия статистически не значимы). Концентрация другого противовоспалительного цитокина, IL-1RA, была ниже в группе пациентов с ЮРА, чем в контроле: 3638,5 (2397,5–4133,5) и 4951,0 (4303,0–5455,0) пг/мл соответственно (р < 0,05). (рис. 2C, D).
Содержание МСР-1 в ЗДЖ не имело значимых различий в группах: 15,65 (14,15–17,39) и 15,50 (12,80–21,20) пг/мл соответственно. Одновременно с этим концентрация VEGF в группе ЮРА была в несколько раз выше по сравнению с контролем: 49,60 (41,95–54,50) и 12,00 (11,00–13,00) пг/мл соответственно (р < 0,05) (рис. 2E, F).

РИС. 2. Уровень содержания провоспалительных, противовоспалительных цитокинов и хемокинов в зубодесневой жидкости.
FIG. 2. The level of proinflammatory, anti-inflammatory cytokines and chemokines in the gingival crevicular fluid.
ОБСУЖДЕНИЕ
В нашем исследовании отмечена тенденция к увеличению тяжести заболеваний пародонта у детей с ЮРА: у 18 (90%) пациентов выявлен гингивит средней или тяжелой степени, отмечено повышение индекса GI и GBI, что согласуется с данными ряда авторов [17][18].
В ЗДЖ пациентов с ЮРА установлен дисбаланс про- и противовоспалительных цитокинов. Так, уровень провоспалительного IL-18 был ниже, в то время как содержание IL-1β выше, чем в контроле. Следует отметить, что концентрация MCP-1 в исследуемой группе не отличалась от контрольной. Одновременно отмечено снижение содержания противовоспалительного IL-1RA в ЗДЖ пациентов с ЮРА, тогда как содержание IL-10 имело тенденцию к повышению по сравнению с контрольной группой. Концентрация VEGF в ЗДЖ была статистически значимо выше у пациентов с ЮРА.
Причины и механизмы прогрессирования гингивита при ЮРА до настоящего времени до конца не установлены. Содержание провоспалительных цитокинов и хемокинов, таких как IL-18 и MCP-1, в ЗДЖ значимо не отличалось от данных контрольной группы, что, возможно, связано с терапией основного заболевания – с применением НПВП и ГИБТ, непосредственно подавляющих продукцию ряда основных провоспалительных цитокинов. Некоторые авторы считают, что НПВП снижают активность иммунных клеток, поэтому при прекращении их фармакологического действия иммунные клетки повторно активируются [19]. M. Hatipoğlu и соавт. [20] установили, что у взрослых пациентов, принимающих анти-B-клеточную терапию, понижается уровень IL-1β в ЗДЖ, что позволяет предположить, что лечение ревматоидного артрита (РА) может изменять биохимические параметры ЗДЖ. Такие же выводы приводятся B. Cetinkaya и соавт. [21] при изучении концентрации в ЗДЖ таких цитокинов, как IL-1β, IL-4, IL-10и TNF-α (tumor necrosis factor-α, фактор некроза опухоли альфа): иммунологическая оценка не выявила статистически значимых различий в уровнях провоспалительных и противовоспалительных цитокинов между пациентами с РА и контролем. При этом в ряде других исследований было обнаружено, что концентрации IL-1β, IL-4, IL-10, матриксной металлопротеиназы-8, -13 и TNF-α в ЗДЖ были выше у пациентов с РА, чем в контроле. Так, B. Acar и соавт. [22] выявили повышенный уровень противоспалительного цитокина IL-10 на фоне ГПБТ пациентов с ЮРА.
Ряд исследователей считает важным определение IL-1β и IL-18 в ЗДЖ, так как их содержание прямо коррелирует с наличием ряда пародонтопатогенных бактерий, таких как F. nucleatum, C. rectus, P. microsи S. intermedius. Так, у детей с ЮРА L.A. Miranda и соавт. [23] были выявлены повышенные уровни IL-1β и IL-18 в сыворотке, что коррелировало с изменением микробиоты в ЗДЖ. Эти же авторы указывают, что начинающаяся потеря прикрепления, наблюдаемая у детей с ЮРА, может быть связана с измененной системной воспалительной реакцией [23]. При этом цитокины, продуцируемые клетками организма хозяина, играют важную роль в патогенезе как РА, так и заболеваний тканей пародонта. Так, в исследовании F.Y. Bozkurt [24] у пациентов с сочетанием этих заболеваний уровень IL-10 был значительно выше, чем в контроле. Наши данные согласуются с этим исследованием: отмечена тенденция к повышению IL-10 в группе детей с ЮРА.
При развитии хронического воспаления в тканях пародонта развивается гипоксия, которая активирует секрецию резидентными и воспалительными макрофагами различных цитокинов, регулирующих процесс ангиогенеза (например, VEGF) [13]. Таким образом, повышенный уровень VEGF в ЗДЖ у детей с ЮРА может быть маркером гипоксии в тканях пародонта.
Наше исследование имело ряд ограничений, связанных с небольшим объемом выборки и разной степенью активности заболевания у пациентов с ЮРА.
Выявление цитокиновых маркеров и предикторов воспаления, в том числе и аутовоспаления, в ЗДЖ у детей с нарушениями системы иммунологического надзора (например, при ЮРА) является перспективным направлением научных исследований, таким, как и исследование влияния цитокинов на культуральные макрофаги ротовой жидкости, изучение взаимосвязи микробиоты полости рта с изменениями уровня цитокинов ЗДЖ.
ЗАКЛЮЧЕНИЕ
Таким образом, в развитии гингивита у детей с ЮРА играет роль дисбаланс про- и противовоспалительных цитокинов. Установлено повышенное содержание в ЗДЖ IL-1β, который является триггером всех провоспалительных цепочек, снижение IL-1RA – противовоспалительного цитокина, повышение VEGF – маркера гипоксии. Изучение цитокинового профиля ЗДЖ уточняет механизмы развития иммуновоспалительной реакции в тканях пародонта, требует дальнейшего изучения и перспективно в выборе персонализированного подхода к терапии.
ВКЛАД АВТОРОВ
О.Л. Морозова и О.И. Адмакин разработали основную концепцию и дизайн исследования, а также проводили редактуру статьи. Ю.А. Козлитина и Н.Б. Захарова выполняли экспериментальную часть, отбирали и анализировали биоматериал, осуществляли лабораторные исследования. Н.С. Морозова интерпретировала полученные лабораторные данные, а также написала основную часть финальной версии статьи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Olga L. Morozova and Oleg I. Admakin developed the basic concept and design of the study, edited the article. Iuliia A. Kozlitina and Natalia B. Zakharova performed the experimental part, collected and analyzed the biomaterial, carried out laboratory studies. Natalia S. Morozova interpreted the obtained laboratory data and also wrote the main part of the final version of the article. All authors have approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки.
Conflict of interest. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
1. https://minzdrav.gov.ru/documents/7025 (дата обращения: 19.08.2022).
Список литературы
1. Захватов А. Н., Хайдар Д. А., Тарасова Т. В. и др. Динамика показателей цитокинового профиля при экспериментальном пародонтите. Вестник «Биомедицина и социология». 2022; 7(3): 43–47. http://dx.doi.org/10.26787/nydha-2618-8783-2022-7-3. EDN: RCTWGI.
2. Buduneli N., Kinane D.F. Host-derived diagnostic markers related to soft tissue destruction and bone degradation in periodontitis. J Clin Periodontol. 2011 Mar; 38 Suppl 11: 85–105. https://doi.org/10.1111/j.1600-051X.2010.01670.x. PMID: 21323706.
3. Liu J., Dan R., Zhou X., et al. Immune senescence and periodontitis: From mechanism to therapy. J Leukoc Biol. 2022 Nov; 112(5): 1025–1040. https://doi.org/10.1002/JLB.3MR0822-645RR. Epub 2022 Oct 11. PMID: 36218054.
4. Царев В.Н., Николаева Е.Н., Ипполитов Е.В., Царева Т.В. Экспрессия цитокинов пародонтального кармана и зубодесневой борозды у пациентов после внутрикостной дентальной имплантации и при развитии периимплантитов. Журнал микробиологии, эпидемиологии и иммунобиологии. 2012; 6: 110–114.
5. Островская Л.Ю., Захарова Н.Б., Могила А.П. и др. Изменение баланса цитокинов в десневой жидкости при заболеваниях пародонта и его значение для прогнозирования регенераторных нарушений в тканях пародонта. Саратовский научно-медицинский журнал. 2014; 10(3).
6. Базарный В.В., Полушина Л.Г., Семенцова Е.А. Являются ли саливарные цитокины семейства ИЛ-1 биомаркерами хронического пародонтита? Проблемы стоматологии. 2020; 16(3): 18–22. https://doi.org/10.18481/2077-7566-2020-16-3-18-22. EDN XGKUTY.
7. Супрун Е.Н. Динамика иммунного ответа. Аллергология и иммунология в педиатрии. 2014; 37(2): 35–40. EDN: WXBOCR.
8. Ганковская Л.В., Хелминская Н.М., Молчанова Е.А., Свитич О.А. Роль факторов врожденного иммунитета в патогенезе пародонтита. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016; 2: 100–107. EDN: ZRJCU.
9. Исамулаева А.З., Спицына А.В., Магомедов Ш.Ш. и др. Значимость цитокиновой регуляции в патогенезе заболеваний полости рта. Современные проблемы науки и образования. 2014; 6. EDN: TGQTNV.
10. Насонов Е.Л., Авдеева А.С. Интерлейкин 18 при иммуновоспалительных ревматических заболеваниях и COVID-19. Научно-практическая ревматология. 2022; 60(2): 195–204. https://doi.org/10.47360/1995-4484-2022-195-204. EDN EBRJCP.
11. Singh S., Anshita D., Ravichandiran V. MCP-1: Function, regulation, and involvement in disease. Int Immunopharmacol. 2021 Dec; 101 (Pt B): 107598. https://doi.org/10.1016/j.intimp.2021.107598. Epub 2021 May 20. PMID: 34233864; PMCID: PMC8135227.
12. Szabo Y.Z., Burns C.M., Lantrip C. Understanding associations between rumination and inflammation: A scoping review. Neurosci Biobehav Rev. 2022 Apr; 135: 104523. https://doi.org/10.1016/j.neubiorev.2022.104523. Epub 2022 Jan 5. PMID: 34998832; PMCID: PMC8957598.
13. Ерокина Н.Л., Лепилин А.В., Миронов А.Ю. и др. Роль цитокинов, хемокинов и факторов роста в заживлении лунок удаленных зубов. Пародонтология. 2021; 26(1): 58–63. https://doi.org/10.33925/1683-3759-2021-26-1-58-63. EDN: XWTMAN.
14. Яковлев В.В., Бадаева А.В., Иванова Е.И. и др. VEGF-C – биомаркер повреждения почек при экспериментальной интраабдоминальной гипертензии. Сеченовский вестник. 2020; 11(3): 47–56. https://doi.org/10.47093/2218-7332.2020.11.3.47-56. EDN: TYZVZK.
15. Журбенко В.А. Роль соматической патологии в развитии заболеваний тканей пародонта. Международный журнал прикладных и фундаментальных исследований. 2016; 1(1): 92. EDN: VJFXAV.
16. Bansal M., Rastogi S., Vineeth N.S. Influence of periodontal disease on systemic disease: inversion of a paradigm: a review. J Med Life. 2013 Jun 15; 6(2): 126–130. Epub 2013 Jun 25. PMID: 23904870.
17. Leksell E., Ernberg M., Magnusson B., Hedenberg-Magnusson B. Intraoral condition in children with juvenile idiopathic arthritis compared to controls. Int J Paediatr Dent. 2008 Nov; 18(6): 423–433. https://doi.org/10.1111/j.1365-263X.2008.00931.x. Epub 2008 Jul 4. PMID: 18637044.
18. Potempa J., Mydel P., Koziel J. The case for periodontitis in the pathogenesis of rheumatoid arthritis. Nat Rev Rheumatol. 2017 Oct; 13(10): 606–620. https://doi.org/10.1038/nrrheum.2017.132. Epub 2017 Aug 24. PMID: 28835673.
19. Порядин Г.В., Салмаси Ж.М., Кукес И.В. и др. Современные знания о воспалительных заболеваниях различной локализации и этиологии: новые возможности фармакотерапии. Фарматека. 2020; 27(14): 37–46. https://dx.doi.org/10.18565/pharmateca.2020.14.37-46. EDN: QTKQGQ.
20. Hatipoğlu M., Daltaban Ö., Uğur S., et al. B cell depletion in patients with rheumatoid arthritis is associated with reduced IL-1β in GCF. Clin Oral Investig. 2022 Jun; 26(6): 4307–4313. https://doi.org/10.1007/s00784-022-04378-0. Epub 2022 May 17. PMID: 35578115.
21. Cetinkaya B., Guzeldemir E., Ogus E., Bulut S. Proinflammatory and anti-inflammatory cytokines in gingival crevicular fluid and serum of patients with rheumatoid arthritis and patients with chronic periodontitis. J Periodontol. 2013 Jan; 84(1): 84–93. https://doi.org/10.1902/jop.2012.110467. Epub 2012 Mar 13. PMID: 22414257.
22. Acar B., Demir S., Özşin-Özler C., et al. Evaluation of periodontal status and cytokine response in children with familial Mediterranean fever or systemic juvenile idiopathic arthritis. Clin Oral Investig. 2022 Oct 5. https://doi.org/10.1007/s00784-022-04730-4. Epub ahead of print. PMID: 36197547.
23. Miranda L.A., Fischer R.G., Sztajnbok F.R., et al. Increased interleukin-18 in patients with juvenile idiopathic arthritis and early attachment loss. J Periodontol. 2005 Jan; 76(1): 75–82. https://doi.org/10.1902/jop.2005.76.1.75. PMID: 15830640.
24. Bozkurt F.Y., Yetkin Ay Z., Berker E., et al. Anti-inflammatory cytokines in gingival crevicular fluid in patients with periodontitis and rheumatoid arthritis: a preliminary report. Cytokine. 2006 Aug; 35(3-4): 180–185. https://doi.org/10.1016/j.cyto.2006.07.020. Epub 2006 Sep 18. PMID: 16982199.
Об авторах
Ю. А. КозлитинаРоссия
Козлитина Юлия Александровна - кандидат медицинских наук, доцент кафедры детской, профилактической стоматологии и ортодонтии Института стоматологии им. Е.В. Боровского.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Тел.: +7 (916) 962-91-95
О. И. Адмакин
Россия
Адмакин Олег Иванович - доктор медицинских наук, профессор, заведующий кафедрой детской, профилактической стоматологии и ортодонтии Института стоматологии им. Е.В. Боровского.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Н. С. Морозова
Россия
Морозова Наталия Сергеевна - кандидат медицинских наук, профессор кафедры детской, профилактической стоматологии и ортодонтии Института стоматологии им. Е.В. Боровского.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Н. Б. Захарова
Россия
Захарова Наталия Борисовна - доктор медицинских наук, профессор кафедры клинической лабораторной диагностики.
ул. Большая Садовая, д. 137, Саратов, 410000
О. Л. Морозова
Россия
Морозова Ольга Леонидовна - доктор медицинских наук, профессор кафедры патофизиологии.
ул. Трубецкая, д. 8, стр. 2, Москва, 119991
Дополнительные файлы

|
1. Чек-лист STROBE | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(34KB)
|
Метаданные ▾ | |







































