Перейти к:
Возрастное развитие соматостатинергических нейронов симпатических превертебральных узлов
https://doi.org/10.47093/2218-7332.2023.14.3.28-36
Аннотация
Цель. Определить содержание нейронов, экспрессирующих соматостатин (SST), и его колокализацию с тирозингидроксилазой (TH) и нейропептидом Y (NPY) в краниальном шейном ганглии (КШГ) и солнечном сплетении крысы.
Материалы и методы. Работа выполнена на 30 белых крысах-самцах линии Wistar шести возрастных групп (по 5 крыс в каждой): новорожденные, 10-, 20-, 30-, 60-суточные, 24-месячные. Срезы ганглиев инкубировали с первичными антителами к SST, NPY, TH и вторичными, конъюгированными с флуорохромами. Определяли долю иммунореактивных (IR) нейронов с видимым ядрышком и с флуоресценцией, превышающей фоновое свечение, по отношению к общему числу нейронов, а также среднюю площадь сечения с помощью программы Image J (NIH, США).
Результаты. SST-IR нейроны отсутствовали в КШГ. Иммунореактивный материал обнаруживался в области тел большинства нейронов солнечного сплетения в виде гранул для SST и NPY и располагался относительно гомогенно для TH. Доля SST-IR нейронов составляла 33% у новорожденных, увеличивалась в два раза в первый месяц жизни и далее оставалась постоянной (70–73%). Не установлено статистически значимых различий по долям SST-IR нейронов между краниальным брыжеечным ганглием (КБГ) и чревным ганглием (ЧГ) во всех возрастных группах. С момента рождения и до 60 суток жизни средняя площадь сечения SST-IR нейронов в ЧГ и КБГ увеличивалась в 3,4–3,9 раза и далее не менялась до 24 мес. С 20-х суток жизни средняя площадь сечения SST-IR нейронов в ЧГ была статистически значимо выше, чем в КБГ. Все SST-IR нейроны во всех возрастных группах содержали TH и 90–94% нейронов колокализовали NPY.
Заключение. Содержание SST-IR нейронов в различных симпатических узлах гетерохронно: они отсутствуют в КШГ, а их доля и площадь в солнечном сплетении в раннем постнатальном онтогенезе увеличивается. Это может быть связано с особенностями иннервируемых органов-мишеней
Ключевые слова
Список сокращений:
- CY3 – indocarbocyanine, индокарбоцианин
- FITC – fluorescein isothiocyanate, флуоресцеин-изотиоцианат
- IR – immunoreactive, иммунореактивные
- NPY – neuropeptide Y, нейропептид Y
- PBS – phosphate buffered saline, фоcфатно-cолевой буфеp
- SST – somatostatin, соматостатин
- SSTR – somatostatin receptor, рецепторк соматостатину
- TH – tyrosine hydroxylase, тирозингидроксилаза
- КБГ– краниальный брыжеечный ганглий
- КШГ – краниальный шейный ганглий
- ЧГ – чревный ганглий
Соматостатин (somatostatin, SST) представляет собой полипептид, относящийся к гормонам и нейропептидам. Существует в двух биологически активных формах: SST-14 и SST-28, которые различаются, соответственно, числом входящих в состав молекулы аминокислот [1]. Физиологические функции опосредованы 5 типами рецепторов к соматостатину: SSTR1–SSTR5 (somatostatin receptor), которые имеют похожую структуру и механизмы передачи сигналов, но отличаются своей клеточной и субклеточной локализацией и способом регуляции [1][2].
SST прежде всего рассматривается как сильный ингибирующий фактор в эндокринной системе и желудочно-кишечном тракте; влияет на деление клеток, сократимость гладких мышц внутренних органов, обмен питательными веществами. В качестве нейропептида SST оказывает прямое действие на центральную нервную систему и передачу нервных импульсов [1][3]; также играет роль трофического фактора в развитии нейронов в эмбриогенезе [4]. В недавних исследованиях обнаружено присутствие SST в автономной нервной системе млекопитающих – в части нейронов симпатических узлов [5]. В подавляющем большинстве этих нейронов содержится медиатор норадреналин и фермент его синтеза тирозингидроксилаза (tyrosine hydroxylase, TH), две трети нейронов содержат нейропептид Y (neuropeptide Y, NPY) [6][7].
Нейромедиаторный состав симпатических нейронов изменяется в онтогенезе, а также различен по локализации в ганглиях [8–10]. В частности, у крысы в эмбриогенезе на 16 сутки эмбрионального развития наблюдается транзиторная экспрессия SST в большинстве симпатических ганглионарных нейронов [10][11].
Во время эмбрионального развития морской свинки в солнечном сплетении SST-иммунореактивные (immunoreactive, IR) нейроны появляются позже, чем NPY-IR, причем большинство (75%) SST-IR нейронов на поздних эмбриональных стадиях продолжают экспрессировать NPY, что в неонатальном периоде наблюдается редко (<2%) [8][12].
После рождения у мыши в превертебральных узлах выявляется малое число SST-IR нейронов [13]. тогда как у морской свинки их количество в превертебральных узлах солнечного сплетения достигает 25%, а у свиней 12–15%, в отличие от паравертебральных узлов [14][15]. Так, в паравертебральном звездчатом ганглии крысы самая высокая доля нейронов, содержащих SST, наблюдается у новорожденных (7% от общего числа нейронов), позже количество SST-IR нейронов снижается до 4% и остается постоянным, начиная с 10 дней жизни [9].
В литературных источниках отсутствуют данные о постнатальных изменениях состава нейромедиаторов в других симпатических узлах, в частности паравертебральном краниальном шейном ганглии (КШГ), а также в солнечном сплетении: превертебральных чревных ганглиях (ЧГ) и краниальном брыжеечном ганглии (КБГ).
Целью исследования является определение содержания SST-IR нейронов в КШГ и солнечном сплетении крысы в постнатальном онтогенезе, а также колокализации соматостатина с другими нейротрансмиттерами, включая фермент синтеза катехоламинов TH и NPY.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на 30 белых крысах-самцах линии Wistar следующих шести возрастных групп (по 5 крыс в каждой): новорожденные, 10-, 20-, 30-, 60-суточные, 24-месячные.
Животных выводили из эксперимента путем инъекции летальной дозы уретана (3 г/кг, внутрибрюшинно). Далее проводилась транскардиальная перфузия раствором стандартного фоcфатно-cолевого буфеpа (phosphate buffered saline, PBS) 0,01 М, pH 7,4 (ООО «БиолоТ», РФ) объемом от 20 до 500 мл в зависимости от возраста, а затем таким же объемом фиксирующей смеси 4% pаcтвоpа паpафоpмальдегида (Sigma, США) в PBS. Далее извлекались: КШГ, ганглии солнечного сплетения (правый и левый ЧГ и КБГ) и помещались на 2 часа при комнатной температуре в ту же фиксирующую смесь, в которой проводили перфузию. Затем ганглии три раза промывались в PBS по 10 минут с интервалом в 5 минут и перемещались в 30% раствор сахарозы на PBS на 12 часов при температуре 4 °С. Серии срезов толщиной 12 мкм изготовляли на криостате.
На следующем этапе проводили прединкубацию срезов в течение 30 мин при комнатной температуре в PBS с добавлением 10% ослиной сыворотки (Jackson Immunoresearch, США), 1% тритона X-100, 0,1% бычьего сывороточного альбумина, 0,05% тимерозола. После этого срезы инкубировали с первичными антителами: козьими против SST, 1:200 (Santa Cruz, sc-7819), овечьими против TH, 1:1000 (Abcam, ab113), кроличьими против NPY, 1:500 (Abcam, ab30914), в течение 24 ч при комнатной температуре. После кратковременной промывки в PBS срезы инкубировали со вторичными антителами в течение 2 ч. Вторичные антитела были конъюгированы с флуорохромами – флуоресцеин изотиоцианатом (fluorescein isothiocyanate, FITC), дающим зеленую флуоресценцию, и индокарбоцианином (indocarbocyanine, CY3), дающим красную флуоресценцию (разведение 1:150, Jackson Immunoresearch, США).
Окраску клеток всей популяции нейронов проводили зеленым флуоресцентным красителем NeuroTrace™ Green Fluorescent Nissl Stains (Molecular Probes, США) – разведение 1:200. После этого срезы отмывали в PBS и заключали в среду для флуоресцентной микроскопии VectaShield (Vector Laboratories, США). Для исключения неспецифической реакции часть срезов инкубировали без первичных и/или вторичных антител.
Анализ препаратов проводился с использованием программно-аппаратного комплекса, включающего флуоресцентный микроскоп Olympus BX43 (Olympus, Япония) с набором фильтров (модуль зеркал UFBWA – синее возбуждение, фильтр возбуждения BP460-495, барьерный фильтр BA510550 – зеленая флуоресценция; модуль зеркал U-FGWА – зеленое возбуждение, фильтр возбуждения BP530-550, барьерный фильтр BA575-625 – красная флуоресценция), охлаждаемую ССD камеру Tucsen FL-20 (Xintu Photonics, Китай) и компьютер на базе процессора Intel Core i7 (Intel, США). Получение и последующая обработка изображений проводилась с использованием программы Mosaic, версия 2.1 (Xintu Photonics, Китай).
Полученные мультиканальной флуоресценцией с различными спектрами флуорохромов изображения препаратов комбинировали при помощи программы Paint Shop Pro 7.02 (Jasc Software, Inc., США), при этом накладывали снимки одного и того же поля зрения. Объединенный рисунок отображал зеленый и красный цвета и зоны их перекрытия в виде градиента желто-зеленого цвета.
Для выявления меченых нейронов использовали каждый третий из серийных срезов. Число меченых нейронов определяли на изображениях срезов площадью 0,14 мм², полученных под объективом 20х/0,50. Долю SST-IR нейронов определяли как их отношение к общему количеству нейронов, выявленных с помощью NeuroTrace™ Fluorescent NisslStains, которое принимали за 100%. Анализу подлежали нейроны, срез которых прошел через ядро с видимым ядрышком и с флуоресценцией, превышающей фоновое свечение. Число меченых нейронов, а также среднюю площадь сечения SST-IR нейронов определяли с помощью программы Image J (NIH, США). Для определения средней площади сечения при увеличении 200 вручную обводили границы IR клеток. Всего для анализа брали 200 нейронов в каждом ганглии каждой возрастной группы.
Статистическая обработка данных
Проверка на нормальность распределения случайных величин проводилась с использованием критерия Шапиро – Уилка. Значимость различий средних величин оценивалась при помощи однофакторного дисперсионного анализа (ANOVA). Для парных сравнений использовался t-критерий Стьюдента, для множественных межгрупповых сравнений использовалась поправка Бонферрони. Различия принимались как значимые при р < 0,05. Для статистического анализа данных использовалась программа Sigma Plot (Systat Software, США).
РЕЗУЛЬТАТЫ
Результаты показали, что иммуномечение к SST и NPY было представлено в виде гранул, заполняющих цитоплазму, в то время как иммунореактивность к TH была относительно гомогенной. В большинстве нейронов иммунореактивный материал обнаруживался в области тел, тем не менее у отдельных клеток он выявлялся и в области проксимальных дендритов.
Меченые нейроны были распределены по поверхности среза относительно равномерно. Мы не обнаружили количественных различий между левым и правым ЧГ, поэтому далее представлены усредненные данные по обоим узлам.
SST-IR нейроны не обнаруживались в КШГ, но выявлялись в солнечном сплетении. Начиная с периода новорожденности и до 24 мес. часть нейронов и в ЧГ, и в КБГ была SST-IR (рис. 1).
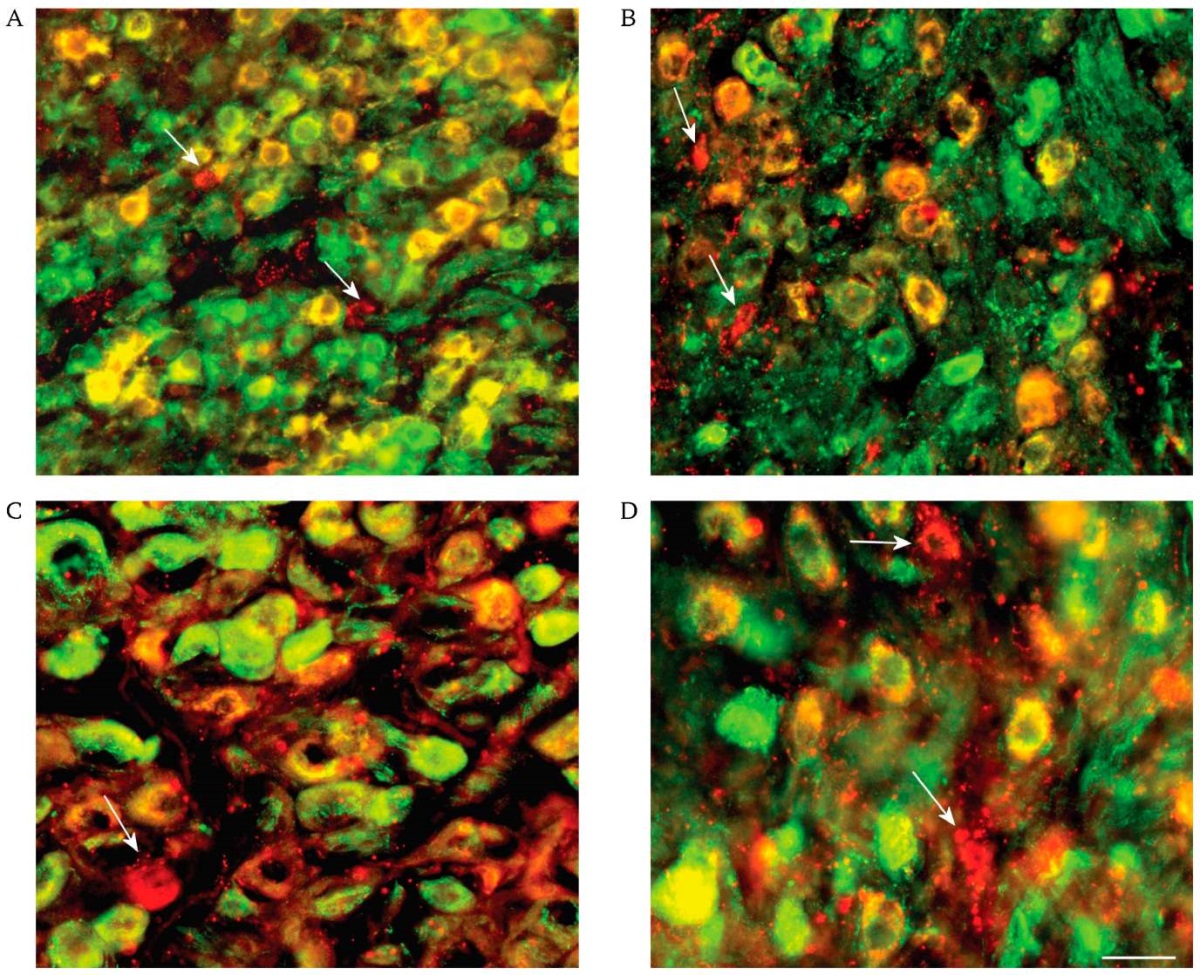
РИС. 1. Содержание в чревном ганглии у крыс разных возрастов нейронов,
экспрессирующих соматостатин (красные) и нейропептид Y (зеленые),
и их колокализация (желтый цвет).
Микрофото: об. 20, ок. 10. Масштаб: 30 мкм.
Иммунонегативные к нейропептиду Y
соматостатинергические нейроны указаны стрелкой.
Флуоресценция: флуоресцеин-изотиоцианат и индокарбоцианин.
Возраст крысы: A – новорожденная, B – 10-суточная,
C – 60-суточная, D – 24-месячная.
FIG. 1. Content of neurons expressing somatostatin (red)
and neuropeptide Y (green) and their colocalization (yellow)
in celiac ganglia of rats at different ages.
Microphotograph: ob. 20, oc. 10. Scale: 30 µm.
Somatostatinergic neurons immunonegative for neuropeptide Y
are indicated by arrows.
Fluorescence: fluorescein isothiocyanate and indocarbocyanine.
Age of the rat: A – newborn pup, B – 10-day-old,
C – 60-day-old, D – 24-month-old.
У новорожденных треть нейронов в ЧГ и КБГ была с IR. Доля SST-IR нейронов удваивалась в онтогенезе в обоих узлах в течение первых 30 суток жизни и сохранялась на уровне 70–73% до 24 мес. (табл. 1). Мы не наблюдали значимых различий по долям SST-IR между КБГ и ЧГ в каждой из возрастных групп.
Таблица 1. Доля соматостатинергических нейронов
в симпатических узлах крыс в постнатальном онтогенезе
Table 1. The content of somatostatinergic neurons
in postnatal sympathetic ganglia of rats
|
Возраст / Age |
Доля SST-IR нейронов, % / The content of SST-IR neurons, % |
Значение р / p value |
|
|
Чревный ганглий / Celiac ganglion |
Краниальный брыжеечный ганглий / Cranial mesenteric ganglion |
||
|
Новорожденный / Newborn pup |
34 ± 3,1a |
33 ± 3,3 a |
n.s. |
|
10 суток / 10-day-old |
42 ± 2,7 a |
45 ± 4,1a |
n.s. |
|
20 суток / 20-day-old |
55 ± 4,9 a |
53 ± 5,8 a |
n.s. |
|
30 суток / 30-day-old |
70 ± 6,2 |
72 ± 7,9 |
n.s. |
|
60 суток / 60-day-old |
73 ± 5,9 |
73 ± 6,2 |
n.s. |
|
24 месяца / 24-month-old |
71 ± 5,6 |
71 ± 7,1 |
n.s. |
Примечание: доля соматостатинергических нейронов
представлена в процентах от общего числа нейронов.
Данные по чревному ганглию представлены усредненными значениями
по правому и левому узлам.
a p < 0,05 по сравнению с 60-суточным.
SST-IR – somatostatin immunoreactive, соматостатин иммунореактивные;
n.s. – not significant (не значимо).
Note: the content of somatostatinergic neurons is given
as a percentage of the total number of neurons.
Data for celiac ganglia are presented as average values
for right and left nodes.
a p < 0,05 compared to 60-day-old.
SST-IR – somatostatin immunoreactive; n.s. – not significant.
Средняя площадь сечения SST-IR нейронов увеличивалась в ЧГ и КБГ с момента рождения до 60 суток жизни (табл. 2). С 20-х суток жизни у крыс средняя площадь сечения SST-IR нейронов в ЧГ была статистически значимо выше, чем в КБГ.
Таблица 2. Площадь поперечного сечения
соматостатинергических нейронов в симпатических узлах
крыс разных возрастов
Table 2. Cross-sectional area of somatostatinergic neurons
in the sympathetic ganglions of rats at different ages
|
Возраст / Age |
Площадь поперечного сечения SST-IR нейронов, мкм² / |
Значение р / p value |
|
|
Чревный ганглий / Celiac ganglion |
Краниальный брыжеечный ганглий / Cranial mesenteric ganglion |
||
|
Новорожденный / Newborn pup |
172 ± 7,2a |
167 ± 8,1a |
n.s. |
|
10 суток / 10-day-old |
272 ± 10,7a |
273 ± 12,6a |
n.s. |
|
20 суток / 20-day-old |
453 ± 11,2a |
382 ± 15,5a |
<0,05 |
|
30 суток / 30-day-old |
574 ± 22,2a |
485 ± 19,8a |
<0,05 |
|
60 суток / 60-day-old |
673 ± 33,3 |
576 ± 21,4 |
<0,05 |
|
24 месяца / 24-month-old |
735 ± 34,3 |
622 ± 38,5 |
<0,05 |
Примечание: представлена средняя площадь 200 нейронов.
Данные по чревному ганглию представлены усредненными значениями
по правому и левому узлам.
a p < 0,05 по сравнению с 60-суточным.
SST-IR – somatostatin immunoreactive, соматостатин иммунореактивные;
n.s. – not significant (не значимо).
Note: represents the average area of 200 neurons.
Celiac ganglion data are presented as average values for the right and left nodes.
a p < 0.05 compared to 60-day-old.
SST-IR – somatostatin immunoreactive; n.s. – not significant.
Во всех возрастных группах, с момента рождения и до 24 мес., все SST-IR нейроны ЧГ и КБГ колокализовали фермент синтеза катехоламинов TH. При этом, независимо от возраста, подавляющее большинство SST-IR нейронов (90–94%) содержали NPY (рис. 1, 2). Не было обнаружено значимых различий между долями SST-IR нейронов, колокализующих NPY, в различных возрастных группах (рис. 2).
РИС. 2. Процент соматостатинергических (SST) нейронов
в чревном ганглии в постнатальном онтогенезе,
колокализующих нейропептид Y (NPY).
FIG. 2. Percentage of somatostatinergic (SST) neurons
of the celiac ganglion colocalizing neuropeptide Y (NPY)
in postnatal ontogenesis.
ОБСУЖДЕНИЕ
Результаты настоящего исследования демонстрируют наличие SST-IR нейронов в превертебральных ЧГ и КБГ к моменту рождения, при этом в паравертебральном КШГ SST-IR нейроны не обнаружены. Доля SST-IR нейронов в превертебральных узлах у крысы превосходит аналогичный показатель у других млекопитающих, включая мышь, морскую свинку, свинью и человека: у мыши и человека обнаруживались лишь отдельные SST-IR нейроны, а у свиней и морской свинки количество SST-IR нейронов в превертебральных узлах доходит до 12–15 и 25% соответственно [5][6][13][14].
Наши более ранние данные свидетельствуют о том, что у крысы в узлах солнечного сплетения содержится больше SST-IR нейронов по сравнению с другими узлами, включая звездчатый узел [9]. Мы впервые обнаружили, что в онтогенезе крысы в первые 30 суток жизни доля SST-IR нейронов увеличивается в превертебральных симпатических узлах, в частности ЧГ и КБГ. В отличие от этого в паравертебральном звездчатом ганглии крыс наибольшее количество нейронов, содержащих SST, обнаруживалось у новорожденных животных и составляло 7% [9] В постнатальном онтогенезе в данном узле доля SST-IR нейронов уменьшается в первые 10 суток жизни до 4% [9]. Таким образом, в различных симпатических узлах доля SST-IR нейронов изменяется гетерохронно, что может быть связано с особенностями иннервируемых органов-мишеней. КШГ обеспечивает симпатическую иннервацию головы, звездчатый ганглий – органов грудной полости и шеи, а превертебральные узлы – органов брюшной полости [16][17]. Ранее нами было показано, что SST-IR нейроны, иннервирующие сердце, выявляются в звездчатом узле только у новорожденных крыс и не наблюдаются у более взрослых [18].
В данной работе мы установили, что доля SST-IR нейронов в превертебральных симпатических узлах крысы начиная с возраста 30 суток далее не изменяется до 2 лет. Согласно литературным данным, в гипоталамусе доля SST-IR нейронов у возрастных особей (2–2,5 года) этого вида животных также оставалась постоянной [19].
Продемонстрированная в данной работе более высокая средняя площадь сечения SST-IR нейронов в ЧГ по сравнению с КБГ у 20-суточных и более взрослых крыс подтверждает обнаруженные ранее данные о больших размерах NPY-IR нейронов в ЧГ относительно КБГ [8]. Нами установлено, что практически все SST-IR нейроны превертебральных узлов крыс в различные возрастные периоды также содержат TH и NPY. Нейромедиаторы SST и NPY подавляют перистальтику и секрецию в желудочно-кишечном тракте [7]. Предполагается, что NPY-IR нейроны солнечного сплетения, не содержащие SST, являются вазомоторными, а NPY/SST-IR – висцеромоторными [20]. Наибольшее число висцеромоторных волокон направляется к интрамуральным узлам межмышечного сплетения желудочно-кишечного тракта [7].
Экспрессия SST может изменяться при патологии – например, у свиньи при воспалении желудочно-кишечного тракта, включая язвенный колит и химически индуцированное воспаление нисходящей ободочной кишки, увеличивается количество данного пептида в ганглионарных нейронах [21]. Имеются данные о том, что SST подавляет воспалительные реакции в кишечнике путем двунаправленной коммуникации между нейронами и тучными клетками, также модулирует активность лимфоидной ткани, ассоциированной с кишечником [22]. SST стимулирует пролиферацию B-лимфобластов, при этом ингибирует активность Т-лимфоцитов, пролиферацию гранулоцитов, синтез провоспалительных цитокинов [23]. SST также участвует в соматостатинергической противовоспалительной петле (somatostatinergic anti-inflammatory loop) [24]: когда повреждающие агенты раздражают пептидергические нейроны, это вызывает высвобождение вещества P и/или кальцитонин-ген-родственного пептида (calcitonin gene-related peptide, CGRP). Последние индуцируют локальное нейрогенное воспаление, которое, в свою очередь, вызывает выброс SST из тех же нейронов. SST замыкает круг, останавливая высвобождение вышеуказанных нейропептидов, и ингибирует воспалительные процессы [24].
ЗАКЛЮЧЕНИЕ
В раннем постнатальном онтогенезе крысы в превертебральных узлах наблюдается увеличение доли нейронов, содержащих SST, что важно для становления симпатической иннервации желудочно-кишечного тракта. SST не только тормозит моторику и секрецию, но и оказывает обезболивающее и противовоспалительное действие в органах пищеварения. Дальнейшие эксперименты с изучением в различные возрастные периоды состава SST-рецепторов в органах-мишенях позволят уточнить особенности симпатической регуляции пищеварительной системы и разработать возможные пути фармакологической коррекции заболеваний желудочно-кишечного тракта.
ВКЛАД АВТОРОВ
А.И. Емануйлов и В.В. Порсева участвовали в сборе материала, проведении экспериментов и статистической обработке данных. А.В. Павлов и П.М. Маслюков разработали идею и дизайн исследования, а также участвовали в написании рукописи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Andrey I. Emanuilov and Valentina V. Porseva participated in the collection of material, experiments and statistical data processing. Alexei V. Pavlov and Petr M. Masliukov developed the idea and design of the study, and contributed to the writing of the manuscript. All authors approved the final version of the publication.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России (№ 58-16.05.2022).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена при поддержке Российского научного фонда (РНФ), грант 23-25-00141.
Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Yaroslavl State Medical University, No. 58 of 16.05.2022.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was supported by RSF, grant 23-25-00141.
Список литературы
1. Kumar U., Singh S. Role of somatostatin in the regulation of central and peripheral factors of satiety and obesity. Int J Mol Sci. 2020; 21(7): 2568. https://doi.org/10.3390/ijms21072568
2. Günther T., Tulipano G., Dournaud P., et al. International union of basic and clinical pharmacology. CV. Somatostatin receptors: structure, function, ligands, and new nomenclature. Pharmacol Rev. 2018; 70: 763–835. https://doi.org/10.1124/pr.117.015388
3. Ampofo E., Nalbach L., Menger M.D., Laschke M.W. Regulatory mechanisms of somatostatin expression. Int J Mol Sci. 2020; 21(11): 4170. https://doi.org/10.3390/ijms21114170
4. Singh S., Somvanshi R.K., Kumar U. Somatostatin-mediated regulation of retinoic acid-induced differentiation of SHSY5Y cells: neurotransmitters phenotype characterization. Biomedicines. 2022; 10(2): 337. https://doi.org/10.3390/biomedicines10020337
5. Ernsberger U., Deller T., Rohrer H. The diversity of neuronal phenotypes in rodent and human autonomic ganglia. Cell Tissue Res. 2020; 382(2): 201–231. https://doi.org/10.1007/s00441-020-03279-6
6. Palus K., Bulc M., Czajkowska M., et al. Neurochemical characteristics of calbindin-like immunoreactive coeliac-cranial mesenteric ganglion complex (CCMG) neurons supplying the pre-pyloric region of the porcine stomach. Tissue Cell. 2018; 50: 8–14. https://doi.org/10.1016/j.tice.2017.12.002
7. Furness J.B., Di Natale M., Hunne B., et al. The identification of neuronal control pathways supplying effector tissues in the stomach. Cell Tissue Res. 2020; 382(3): 433–445. https://doi.org/10.1007/s00441-020-03294-7
8. Masliukov P.M., Emanuilov A.I., Budnik A.F. Sympathetic innervation of the development, maturity, and aging of the gastrointestinal tract. Anat Rec (Hoboken). 2022; 306 (9): 2249–2263. https://doi.org/10.1002/ar.25015
9. Маслюков П.М., Емануйлов А.И., Ноздрачёв А.Д. Возрастные изменения нейротрансмиттерного состава нейронов симпатических узлов. Успехи геронтологии. 2016; 29(3): 442–453. PMID: 28525692
10. Ernsberger U., Deller T., Rohrer H. The sympathies of the body: functional organization and neuronal differentiation in the peripheral sympathetic nervous system. Cell Tissue Res. 2021. 386(3): 455–475. https://doi.org/10.1007/s00441-021-03548-y
11. Huang T., Hu J., Wang B., et al. Tlx3 controls cholinergic transmitter and Peptide phenotypes in a subset of prenatal sympathetic neurons. J Neurosci. 2013; 33(26): 10667–10675. https://doi.org/10.1523/JNEUROSCI.0192-13.2013. PMID: 23804090
12. Anderson R.L., Morris J.L., Gibbins I.L. Neurochemical differentiation of functionally distinct populations of autonomic neurons. J Comp Neurol. 2001. 429(3): 419–435. https://doi.org/10.1002/1096-9861(20010115)429:3<419::aidcne5>3.0.co;2-d. PMID: 11116229
13. Kaestner C.L., Smith E.H., Peirce S.G., Hoover D.B. Immunohistochemical analysis of the mouse celiac ganglion: An integrative relay station of the peripheral nervous system. J Comp Neurol. 2019; 527(16): 2742–2760. https://doi.org/10.1002/cne.24705
14. Szurszewski J.H., Linden D.R. Physiology of prevertebral sympathetic ganglia in: physiology of the gastrointestinal tract (Johnson L.R., ed). San Diego: Academic Press, 2012. P 583– 627. ISBN 9780123820266. https://doi.org/10.1016/B978-0-12-382026-6.00020-8
15. Furness J.B. Integrated neural and endocrine control of gastrointestinal function. Adv Exp Med Biol. 2016; 891: 159–173. https://doi.org/10.1007/978-3-319-27592-5_16
16. Martinez-Sanchez N., Sweeney O., Sidarta-Oliveira D., et al. The sympathetic nervous system in the 21st century: Neuroimmune interactions in metabolic homeostasis and obesity. Neuron. 2022; 110(21): 3597–3626. https://doi.org/10.1016/j.neuron.2022.10.017
17. Li Y.L. Stellate Ganglia and cardiac sympathetic overactivation in heart failure. Int J Mol Sci. 2022; 23(21): 13311. https://doi.org/10.3390/ijms232113311
18. Емануйлов А.И. Маслюков П.М., Ноздрачев А.Д. Симпатическая иннервация сердца в раннем постнатальном онтогенезе. Российский физиологический журнал им. И.М. Сеченова. 2019; 105(9): 1133–1141. https://doi.org/10.1134/S086981391909005X
19. Vishnyakova P.A., Moiseev K.Y., Porseva V.V., et al. Somatostatinexpressing neurons in the tuberal region of rat hypothalamus during aging. J Evol Biochem Phys 2021; 57: 1480–1489. https://doi.org/10.1134/S0022093021060247
20. Lomax A.E., Sharkey K.A., Furness J.B. The participation of the sympathetic innervation of the gastrointestinal tract in disease states. Neurogastroenterol Motil. 2010; 22(1): 7–18. https://doi.org/10.1111/j.1365-2982.2009.01381.x
21. Palus K., Bulc M., Całka J. Changes in somatostatin-like immunoreactivity in the sympathetic neurons projecting to the prepyloric area of the porcine stomach induced by selected pathological conditions. Biomed Res Int. 2017: 9037476. https://doi.org/10.1155/2017/9037476
22. Van Op den Bosch J., Adriaensen D., Van Nassauw L., Timmermans J.P. The role(s) of somatostatin, structurally related peptides and somatostatin receptors in the gastrointestinal tract: a review. Regul Pept. 2009; 156(1–3): 1–8. https://doi.org/10.1016/j.regpep.2009.04.003
23. Gonkowski S., Rytel L. Somatostatin as an active substance in the mammalian enteric nervous system. Int J Mol Sci. 2019; 20(18): 4461. https://doi.org/10.3390/ijms20184461. PMID: 31510021
24. Ameri P., Ferone D. Diffuse endocrine system, neuroendocrine tumors and immunity: what’s new? Neuroendocrinology. 2012; 95(4): 267–276. https://doi.org/10.1159/000334612
Об авторах
А. И. ЕмануйловРоссия
Емануйлов Андрей Игоревич - канд. мед. наук, доцент кафедры анатомии человека
ул. Революционная, д. 5, г. Ярославль, 150000
В. В. Порсева
Россия
Порсева Валентина Вячеславовна - д-р мед. наук, доцент кафедры патофизиологии
ул. Революционная, д. 5, г. Ярославль, 150000
А. В. Павлов
Россия
Павлов Алексей Владимирович - д-р мед. наук, профессор, заведующий кафедрой гистологии
ул. Революционная, д. 5, г. Ярославль, 150000
П. М. Маслюков
Россия
Маслюков Петр Михайлович - д-р мед. наук, профессор, заведующий кафедрой нормальной физиологии
ул. Революционная, д. 5, г. Ярославль, 150000
Тел.: +7 (910) 972-88-61
Дополнительные файлы

|
1. Чек-лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Прочее | |
Скачать
(115KB)
|
Метаданные ▾ | |
Рецензия
JATS XML







































