РУКОВОДСТВО ПО БИОМЕДИЦИНСКОЙ СТАТИСТИКЕ
Мета-анализ – одно из понятий научной методологии. Он является частым, но не обязательным компонентом систематического обзора эмпирических исследований. Для проведения мета-анализа объединяются результаты нескольких научных исследований и осуществляется проверка одной или нескольких взаимосвязанных научных гипотез при помощи количественных (статистических) методов. Для такого анализа можно использовать либо первичные данные оригинальных исследований, либо обобщенные опубликованные (вторичные) результаты исследований, посвященные одной проблеме. Мета-анализ используется для получения оценки величины неизвестного эффекта, а также для сравнения результатов различных исследований, выявляет в них закономерности или другие взаимосвязи, а также возможные источники разногласий. Мета-анализы занимают высшую ступень достоверности в концепции доказательной медицины, поэтому их результаты считаются самым надежным источником доказательств. Понимание всех этапов проведения мета-анализа позволит научным сотрудникам грамотно анализировать результаты таких исследований, а также формулировать задачи при самостоятельном проведении мета-анализов. В настоящей статье читатель познакомится с такими ключевыми понятиями мета-анализа, как взвешенные эффекты, гетерогенность, различные типы используемых статистических моделей, а также научится работать с некоторыми видами графиков, получаемых в мета-анализах.
ВНУТРЕННИЕ БОЛЕЗНИ
Цель. Провести анализ показателей пищевого поведения и гена рецептора лептина (Leptin receptor, LEPR) у пациентов с сахарным диабетом 2-го типа (СД2).
Материалы и методы. В исследование включены 83 пациента с СД2 (21 мужчина, 62 женщины), средний возраст 59,0 ± 9,9 года и 134 человека без клинических и лабораторных признаков сахарного диабета (105 женщин, 29 мужчин), средний возраст 55,0 ± 10,2 года. У всех участников исключена нервная булимия. Пищевое поведение оценивалось с использованием голландского опросника пищевого поведения (The Dutch Eating Behaviour Questionnaire), опросника импульсивности В. А. Лосенкова. Генотипирование по маркеру rs1137100 гена LEPR проведено методом полимеразной цепной реакции. Для сравнения значений переменных применялся U-критерий Манна – Уитни, хи-квадрат Пирсона; проведен ROC-анализ.
Результаты. В группе с СД2 отмечено более выраженное эмоциогенное пищевое поведение (4,9 (4,1; 5,2) vs 3,1 (2,8; 3,8), p < 0,0001), менее выраженное – ограничительное (2,8 (2,6; 3,6) vs 3,3 (2,6; 4,2), p < 0,0001) и экстернальное (3,3 (3,0; 3,8) vs 3,8 (3,3; 4,4), p < 0,0001), они также менее импульсивны (47 (38; 66) vs 61 (54,5; 70), p < 0,0001). Эти различия для эмоциогенного поведения подтверждены как при избытке массы тела, так и при всех степенях ожирения. Наилучшая прогностическая модель СД2 получена в зависимости от эмоциогенного пищевого поведения с точкой отсечения 4,1 балла: чувствительность 74,7 %, специфичность 79,1 %, AUROC = 0,777; 95 % доверительный интервал: 0,715–0,830, р < 0,0001. Распределение генотипов по полиморфному маркеру rs1137100 гена LEPR было одинаковым в обеих группах. Показатель ограничительного пищевого поведения был меньше у пациентов с GG генотипом по сравнению с AA и GA (1,77 ± 0,52 vs 2,94 ± 0,08, р < 0,01).
Заключение. Для пациентов с СД2 характерно эмоциогенное пищевое поведение. Ассоциация полиморфного локуса rs1137100 гена LEPR с ограничительным пищевым поведением при СД2 предполагает наличие генетических факторов формирования паттернов пищевого поведения.
Цель. Изучить в условиях реальной клинической практики персонифицированные внелегочные признаки у пациентов с бронхиальной астмой (БА) в зависимости от наличия или отсутствия ожирения и построить по ним модель контроля БА.
Материалы и методы. В одномоментное исследование, проведенное в 7 амбулаторных центрах, включены 237 взрослых пациентов с БА (средний возраст – 52,6 ± 1,3 года). По индексу массы тела (ИМТ) выделены группы: без ожирения (ИМТ < 30 кг/м2) – 128 пациентов, с ожирением (ИМТ ≥ 30 кг/м2) – 109 пациентов. Контроль БА оценивался по Asthma Control Questionnaire-5 (опросник контроля симптомов астмы), физическая активность (ФА) – по опроснику двигательной активности (ОДА23+), мотивация к ФА – по данным анкеты. Построена линейная регрессионная модель с включением пола, статуса курения, ИМТ, уровня двигательной активности для оценки уровня контроля БА. Рассчитан коэффициент эластичности Эj, β- и Δ-коэффициенты, их ранги.
Результаты. Распределение пациентов по степени контроля БА статистически значимо различалось в группах: контролируемая, частично контролируемая и неконтролируемая составили 25,8, 60,2, 14 % и 0, 33,9, 66,1 % соответственно в группах без и с ожирением (р < 0,001). Высокую или умеренную двигательную активность имели 88 % пациентов в группе без ожирения и 47 % с ожирением (р < 0,05). По уровню мотивации к ФА различий не выявлено: 41 % с ожирением и 42 % без ожирения относились к категории «раздумывающие или пытающиеся заниматься».
В регрессионной модели ранги распределились следующим образом (вычислена сумма рангов коэффициентов Эj, β и Δ): ранг 1 – ИМТ (0,8857, 0,4163, 0,5429), ранг 2 – уровень двигательной активности (0,6489, 0,3497, 0,4467), ранг 3 – статус курения (0,0339, 0,1333, 0,0047). Для пола коэффициент модели не был значимым.
Заключение. Ожирение и низкая физическая активность являются основными персонифицированными внелегочными признаками, влияющими на контроль БА, при этом значительная часть пациентов мотивирована для модификации уровня физической активности.
МОДЕЛИРОВАНИЕ В МЕДИЦИНЕ
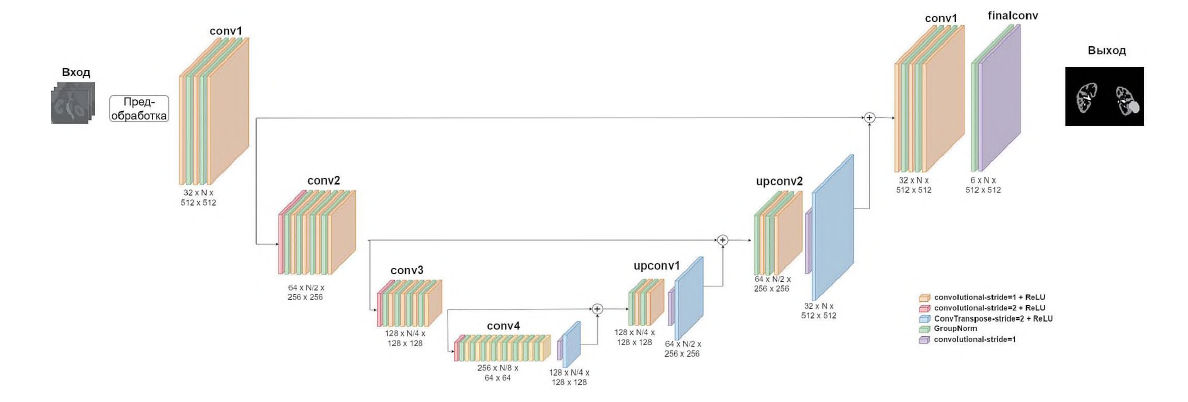
Цель. Разработать нейронную сеть для построения 3D-моделей образований почек и прилежащих структур.
Материалы и методы. Использованы DICOM данные 41 пациента с образованием почек. Данные включали все фазы мультиспиральной компьютерной томографии с контрастированием. Для обучения отобрано 32 наблюдения, для валидации – 9 наблюдений. На этапе разметки брались артериальная, венозная и экскреторная фазы, проводилась аффинная регистрация для совместного совпадения расположения почек и удаление шумов с помощью медианного фильтра и фильтра нелокальных средних. Затем были размечены маски артерий, вен, мочеточников, паренхимы почки и образований паренхимы. Моделью являлась архитектура SegResNet. Для оценки качества сегментации сравнивалась метрика Дайса с моделями AHNet, DynUNet и с тремя вариантами модели nnU-Net (lowres, fullres, cascade).
Результаты. На валидационной выборке значение метрики Дайса архитектуры SegResNet составило: для нормальной паренхимы почки – 0,89, образований почки – 0,58, артерий – 0,86, вен – 0,80, мочеточников – 0,80. Получены средние значения метрики Дайса для SegResNet, AHNet и DynUNet – 0,79; 0,67 и 0,75 соответственно. При сравнении с моделью nnU-Net метрика Дайса была больше для паренхимы почки у SegResNet – 0,89 по сравнению с тремя вариантами модели: lowres – 0,69, fullres – 0,70, cascade – 0,69. При этом для образований паренхимы почки метрика
Дайса была сопоставимой: для SegResNet – 0,58, для nnU-Net fullres – 0,59; lowres и cascade имели меньшие значения метрики Дайса – 0,37 и 0,45 соответственно.
Заключение. Полученная нейронная сеть SegResNet хорошо находит сосуды и паренхиму. Образования почек определяются труднее, возможно, из-за малых размеров и наличия ложных срабатываний сети. Планируется увеличение размера выборки до 300 наблюдений и использование операций постобработки для улучшения модели.
НЕЙРОХИРУРГИЯ
Лечение пациентов с одновременным наличием мальформации Киари I типа (МК I) и гидроцефалии может включать как одноэтапные, так и двухэтапные оперативные вмешательства. В статье описано выполненное впервые в Республике Таджикистан одномоментное двухэтапное хирургическое лечение.
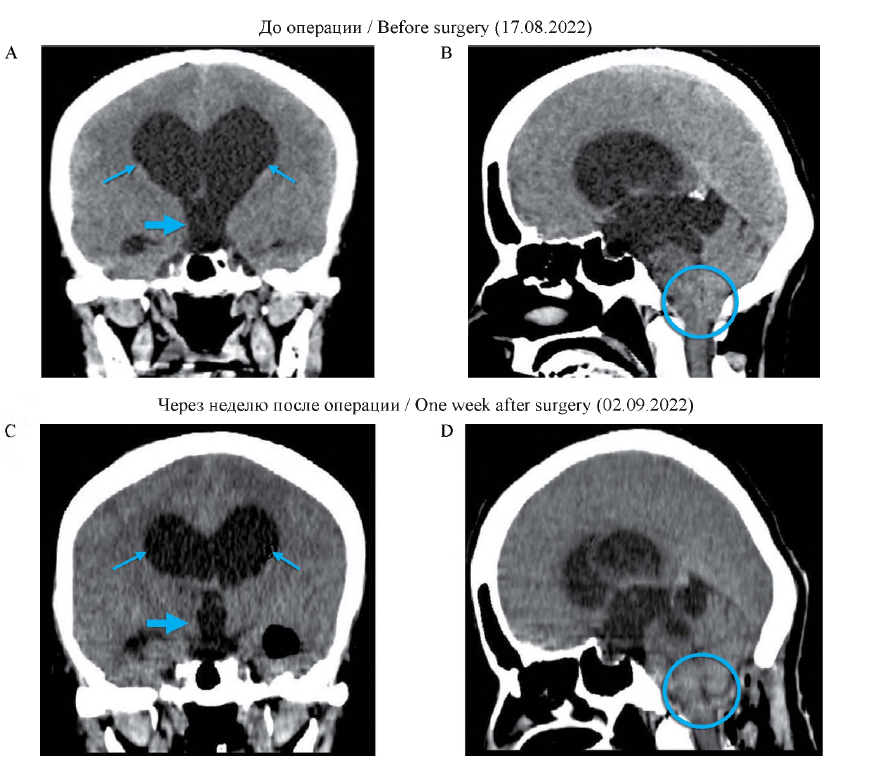
Описание случая. У пациентки 50 лет с трехлетним анамнезом жалоб на распирающую головную боль, головокружение, тошноту, рвоту появились нарушение координации движений и снижение остроты зрения. По данным компьютерной томографии (КТ) выявлены признаки МК I: опущение миндалин мозжечка на 5 мм ниже уровня большого
затылочного отверстия и окклюзионная тривентрикулярная гидроцефалия с симметричным увеличением боковых и третьего желудочков. Выполнена эндоскопическая тривентрикулоцистерностомия дна третьего желудочка (ЭВЦС III) в сочетании с декомпрессивной субокципитальной краниоэктомией, дополненной ламинэктомией СI. После операции наблюдался регресс симптомов. По данным контрольной КТ отмечалось умеренное уменьшение в размерах боковых и третьего желудочков, восстановление нормального анатомического строения задней черепной ямки.
Обсуждение. Хирургическое лечение пациентов с окклюзионной гидроцефалией заключается в создании внутреннего либо наружного обходного пути тока ликвора – имплантации ликворошунтирующих систем. В последние годы для хирургического лечения пациентов с окклюзионной гидроцефалией предпочтение отдается миниинвазивным
способам лечения – ЭВЦС III.
ISSN 2658-3348 (Online)