Перейти к:
Сосудистые маркеры когнитивной дисфункции у пациентов с неконтролируемой артериальной гипертензией
https://doi.org/10.47093/2218-7332.2020.11.3.26-36
Аннотация
Наличие артериальной гипертензии (АГ) способствует развитию когнитивной дисфункции, в генезе которой большая роль отводится сосудистым факторам.
Цель. Изучить состояние когнитивной функции и ассоциированные с ней сосудистые факторы у пациентов с неконтролируемой АГ.
Материалы и методы. В исследование включены 88 пациентов с неконтролируемой АГ — группа 1 (медиана возраста 60 лет, мужчины — 39%) и 46 — с контролируемой АГ — группа 2 (медиана возраста 59, мужчины — 41%). Когнитивная функция оценена с помощью Монреальской шкалы оценки когнитивных функций (MoCA). Изучены сосудистые факторы: толщина комплекса интима-медиа (КИМ), скорость пульсовой волны (СПВ), показатель микроциркуляции (ПМ) и концентрация асимметричного диметиларгинина (АДМА). Для статистического анализа применялись t-критерий Стьюдента, критерий Манна — Уитни. В группах проведен многофакторный линейный регрессионный анализ.
Результаты. В группе 1 отмечен более низкий показатель когнитивной функции по MoCA — 24 [22; 26] балла против 26 [25; 27] баллов в группе 2 (р = 0,002). Толщина КИМ была выше в группе 1, чем в группе 2 (1,1 [0,90; 1,20] мм vs 1,0 [0,80; 1,10] мм, р = 0,042), концентрация АДМА выше в группе 1 (0,73 ± 0,21 мкмоль/л vs 0,65 ± 0,1 мкмоль/л, р = 0,02), ПМ был выше в группе 2 (30,6 [27,1; 34,4] перф. ед. vs 22,8 [18,6; 26,1] перф. ед., р < 0,001). По СПВ различий между группами не установлено. В регрессионном анализе на число баллов по MoСA в группе 1 статистически значимо влияли возраст, толщина КИМ, АДМА и ПМ; в группе 2 — возраст и скорость клубочковой фильтрации.
Заключение. У пациентов с неконтролируемой АГ по сравнению с контролируемой АГ имеется более выраженная когнитивная дисфункция, которая ассоциирована с увеличением толщины КИМ, ухудшением микроциркуляции и повышением концентрации АДМА.
Ключевые слова
От осложнений сердечно-сосудистых заболеваний (ССЗ) — инфаркта миокарда, мозгового инсульта, терминальной почечной недостаточности, в России ежегодно умирает примерно 1,2 млн человек [1]. Известна прямая зависимость между частотой ССЗ и уровнем артериального давления (АД). Снижение АД на фоне лечения сопровождается пропорциональным уменьшением заболеваемости и смертности от ССЗ, независимо от его исходного уровня.
Показано, что наличие артериальной гипертензии (АГ) в среднем возрасте (45–64 года) способствует развитию когнитивной дисфункции в пожилом возрасте, в том числе как сосудистой деменции, так и болезни Альцгеймера [2][3], что нашло отражение в согласованной позиции Американской ассоциации сердца (American Heart Association, АНА) по когнитивной функции [4].
Метаанализ 12 исследований показал, что снижение АД уменьшает риск развития когнитивных нарушений и деменции на 9% [5]. В исследованиях SPRINT (Systolic Blood Pressure Intervention Trial), SPRINT MIND (Memory and Cognition in Decreased Hypertension) было продемонстрировано, что контроль АД предотвращает ухудшение когнитивной функции и, возможно, развитие деменции, а также замедляет прогрессирование поражения белого вещества головного мозга [6].
Развитие АГ в среднем возрасте сопровождается рассогласованием взаимодействия нейронов, астроцитов и микрососудистого русла головного мозга. Хроническое повышение АД вызывает цереброваскулярную дегенерацию, проявляющуюся сосудистым ремоделированием, гипертрофией, атеросклерозом, эндотелиальной дисфункцией и повышением проницаемости гематоэнцефалического барьера [7]. Эти данные легли в основу концепции, предложенной Qiu С. и Fratiglioni L. [8], о том, что деменция пожилых является хроническим заболеванием, дебютирующим в среднем возрасте АГ и сосудистой патологией. Таким образом, в генезе сосудистой деменции большая роль отводится нарушениям микроциркуляции и изменению жесткости сосудистой стенки [9]. Капилляры являются терминальными отделами большого круга кровообращения и их основная функция состоит в адекватном осуществлении обменных метаболических процессов в тканях, в том числе и головного мозга. Эндотелиальная дисфункция и нарушения микроциркуляции при АГ приводят к изменению и замедлению процессов метаболизма, что и вызывает в конечном итоге когнитивные нарушения [10].
Когнитивные нарушения способствуют не только ухудшению работоспособности и качества жизни пациентов, но и снижению их приверженности лечению, а соответственно его качества. В исследованиях HHP (Honolulu Heart Program) и HAAS (Honolulu Asia Aging Study, исследование старения «ГонолулуАзия») было показано, что лица в возрасте до 50 лет имели повышенный риск развития деменции только в группе пациентов, не получавших терапию [11]. Таким образом, определение факторов, связанных с нарушением когнитивной функции у пациентов с АГ в зависимости от эффективности ее лечения, представляется актуальным вопросом.
Цель работы: изучить состояние когнитивной функции и ассоциированные с ней сосудистые факторы у пациентов с неконтролируемой АГ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование одобрено локальным этическим Комитетом (протокол № 10-19 от 17.07.2019) и проводилось на базе кардиологического отделения Университетской клинической больницы № 4 ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет) с 1 июля по 30 сентября 2019 года. Исследование проводилось в соответствии с Хельсинкской декларацией о правах человека.
Все пациенты, поступившие с диагнозом АГ в указанное выше отделение (n = 170), были оценены по критериям включения и невключения.
Критериями включения пациентов в исследование были:
- возраст 18 лет и старше;
- наличие верифицированной эссенциальной АГ;
- длительность АГ более 1 года;
- информированное согласие на участие в исследовании.
Критерии невключения в исследование:
- хроническая сердечная недостаточность;
- фибрилляция предсердий;
- инфаркт миокарда в анамнезе;
- стеноз брахиоцефальных артерий (БЦА) по данным ультразвуковой доплерографии (УЗДГ) >50%;
- сахарный диабет;
- хроническая болезнь почек со снижением скорости клубочковой фильтрации (СКФ) (по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration, Сотрудничество по эпидемиологии хронической болезни почек) <45 мл/мин/1,73 м2;
- системные заболевания соединительной ткани;
- тяжелые сопутствующие инфекционные заболевания;
- неврологические заболевания.
В исследование включены 134 пациента с АГ. Пациенты были разделены на две группы: 88 человек с неконтролируемой АГ (НАГ, группа 1) и 46 — с контролируемой АГ (КАГ, группа 2).
К группе 1 были отнесены пациенты, у которых в течение 12 месяцев до включения в исследование не были достигнуты целевые цифры АД и/или развивались гипертонические кризы.
Группу 2 составили лица с сохранявшимися не менее 12 месяцев до включения в исследование целевыми уровнями АД согласно критериям Европейского общества кардиологов / Европейского общества по артериальной гипертензии (European Society of Cardiology / European society of hypertension, ESC/ESH, 2018 г.) [12] и отсутствием гипертонических кризов в течение этого же времени (рис. 1).

РИС. 1. Потоковая диаграмма включения пациентов в исследование
FIG. 1. Patient enrollment flowchart
У всех пациентов оценивались данные анамнеза: степень и продолжительность АГ, статус курения; объективные данные: рост, вес, рассчитывался индекс массы тела (ИМТ = вес, кг / рост, м2), наличие ожирения; биохимические параметры сыворотки крови: уровень общего холестерина (ОХ), липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ), глюкозы, креатинина.
Суточное мониторирование АД проводилось с помощью прибора BPLab (ООО «Петр Телегин», Россия) по стандартной методике.
Когнитивная функция оценивалась с помощью валидной, широко используемой Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment, MoCA), где максимальное количество баллов — 30. MoCA была разработана как средство быстрой оценки при умеренной когнитивной дисфункции, наличие которой устанавливалось при сумме баллов менее 26 [13].
В качестве сосудистых маркеров, ассоциированных с когнитивной дисфункцией, оценены:
- толщина комплекса интима-медиа (КИМ) в мм, наличие атеросклеротических бляшек в сонных артериях и процент стеноза сосудов с помощью УЗДГ БЦА на аппарате LOGIQF6 (GE Healthcare, США). За патологическое значение КИМ принята толщина ее более 0,9 мм;
- скорость пульсовой волны (СПВ) по данным объемной компьютерной осциллометрии плечевой артерии с помощью анализатора АПКО-8-РИЦ (ООО «Глобус», Россия); принятые референсные значения ≤1000 см/сек [12];
- параметры микроциркуляции методом лазерной доплерфлоуметрии (аппарат ЛАКК-02, НПП «Лазма», Россия). Исследование проводилось на ладонной поверхности дистальной фаланги 3-го пальца правой кисти с помощью одноканального лазерного анализатора. Определялся показатель микроциркуляции (ПМ), который отражает величину средней перфузии крови и выражается в перфузионных единицах (перф. ед.). Принятые референсные значения на дистальной фаланге ладонной поверхности третьего пальца: 25,3 ± 0,34 перф. ед. [14];
- эндотелиальная функция по концентрации асимметричного диметиларгинина (АДМА) методом иммуноферментного анализа на анализаторе XpressELISAKit (Германия). Принятые референсные значения АДМА в сыворотке крови: 0,459 ± 0,090 мкмоль/л [15].
Статистический анализ
При статистической обработке данных для переменных с нормальным распределением рассчитывали среднее арифметическое и стандартное отклонение, для переменных с ненормальным распределением — медиану и интерквартильный размах [25-й; 75-й процентили]. Для проверки гипотез на нормальность применялись критерии Колмогорова — Смирнова и Шапиро — Уилка.
При сравнении групп для проверки статистических гипотез применяли t-критерий Стьюдента (при нормальном распределении) и критерий Манна — Уитни — для переменных с ненормальным распределением. При сравнении показателей частот использовали критерий χ2 Пирсона. Для выявления и оценки связи между исследуемыми показателями использовался коэффициент корреляции Пирсона (r — при нормальном распределении признака) и ранговый коэффициент корреляции Спирмена (ρ — при ненормальном распределении признака). Различия считали значимыми при р < 0,05.
С целью оценки степени влияния на исследуемый результативный показатель (когнитивная функция — баллы по MoCA) каждого из введенных в модель факторов при фиксированных на среднем уровне других факторах в обеих группах был проведен многофакторный линейный регрессионный анализ с пошаговым включением предикторов (пол, возраст, статус курения, ИМТ, величина систолического и диастолического АД, степень и продолжительность АГ, показатели липидного профиля (ОХ, ТГ, ЛПНП), СКФ, толщина КИМ, наличие атеросклеротических бляшек, процент стеноза, СПВ, ПМ, уровень АДМА) и оценкой адекватности модели с помощью коэффициента корреляции (R) и R2 (коэффициент детерминации), а также анализа остатков. Данные обрабатывались с помощью программы Statistica 13.0 (TIBCO, США).
РЕЗУЛЬТАТЫ
Общая характеристика групп
Клиническая характеристика обследованных групп представлена в таблице 1. Исследованные группы статистически значимо различались по уровню среднесуточного систолического и диастолического АД.
Таблица 1. Клиническая характеристика пациентов обследованных групп
Table 1. Clinical characteristics of patients of the examined groups
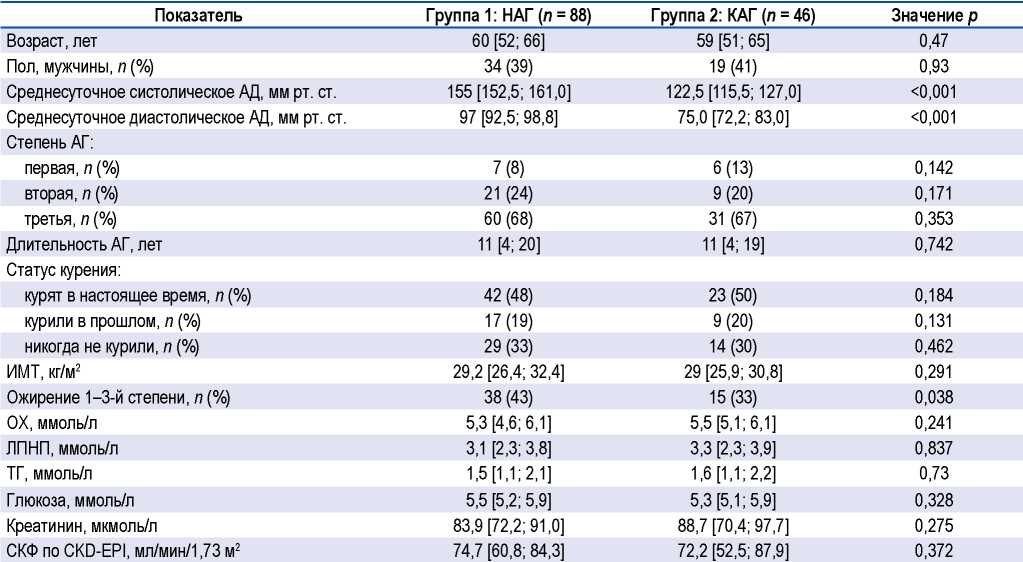
Различий по возрасту, соотношению мужчин и женщин между группами не выявлено.
В обеих группах наиболее часто отмечена АГ 3-й степени — у 67–68% пациентов, медиана длительности АГ не отличалась между группами и составила 11 лет. Половина пациентов были курящими на момент исследования, еще около 20% курили в прошлом.
В группе НАГ на 10% чаще встречалось ожирение, хотя статистически значимых различий по индексу массы тела между группами не установлено.
Уровень липопротеинов низкой плотности был повышен в обеих группах. По уровню общего холестерина, триглицеридов, глюкозы, креатинина и СКФ различий между группами не выявлено.
Когнитивная дисфункция
По данным MoCA в группе 1 выявлен более низкий показатель когнитивной функции: медиана числа баллов составила 24 [22; 26] против 26 [25; 27] в группе 2, различия статистически значимы, р = 0,002. Когнитивные нарушения (число баллов по MoCA <26) в группе 1 регистрировались более чем в два раза чаще, чем в группе 2 (73% против 33%, р = 0,029).
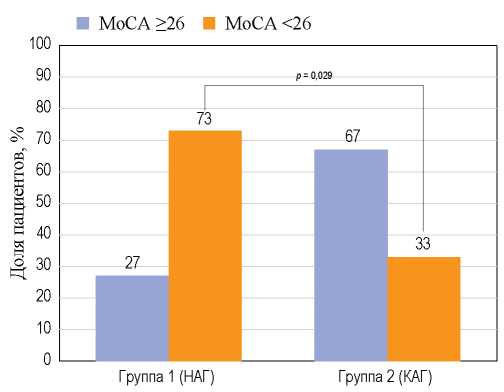
РИС. 2. Оценка когнитивной функции по данным MoCA в обследованных группах
FIG. 2. The state of cognitive function according to MoCA data in the examined groups
Сосудистые маркеры, ассоциированные с когнитивной дисфункцией
По данным УЗДГ БЦА поражение артерий, связанное с АГ, отмечено в обеих группах (табл. 2). Показатели толщины КИМ >0,9 мм и СПВ >1000 см/сек определены у большинства пациентов, при этом в группе 1 толщина КИМ была статистически значимо выше, чем в группе 2. Тяжесть стеноза БЦА и частота наличия в них бляшек не отличались между группами.
Таблица 2. Сосудистые маркеры в обследованных группах
Table 2. Vascular markers in the examined groups
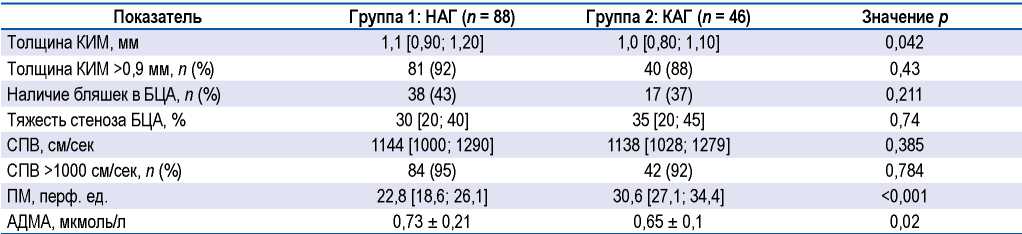
Определение содержания АДМА в сыворотке крови показало, что его концентрация была статистически значимо выше у пациентов в группе 1, чем в группе 2 (р = 0,02), причем в обеих исследуемых группах уровень АДМА оказался значимо выше референсных значений (р < 0,0001).
Исследование микроциркуляции методом лазерной доплерфлоуметрии выявило статистически значимое снижение ПМ в группе 1 по сравнению с референсными значениями (р = 0,01) и показателями группы 2 (р < 0,001). Следует отметить, что у пациентов в группе 2 ПМ был статистически значимо выше референсных значений (р = 0,01).
Проведен корреляционный анализ внутри групп между баллами по тесту MoCA и толщиной КИМ и ПМ.
Статистически значимые корреляции выявлены только в группе 1: отрицательная связь между баллами по тесту MoCA и толщиной КИМ (r = –0,495; p < 0,001) и положительная — между значениями теста MoCA и ПМ (r = 0,679; p < 0,001) (рис. 3).
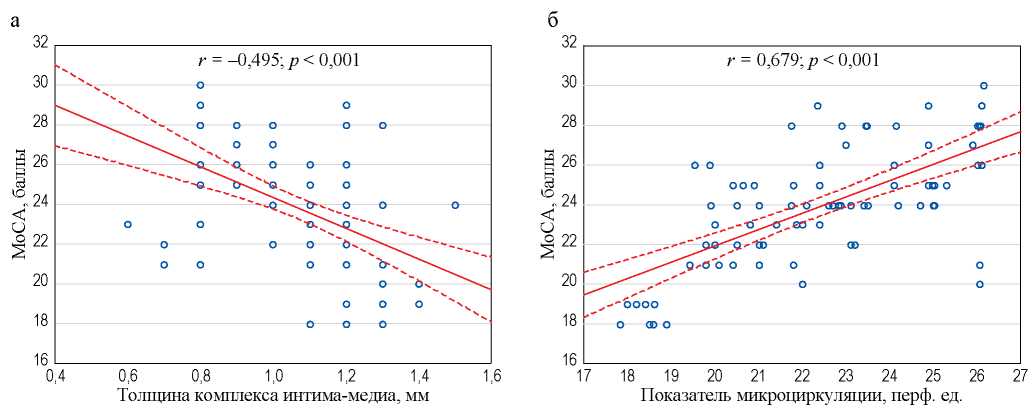
РИС. 3. Корреляция между уровнем когнитивной функции (MoCA) и толщиной комплекса интима-медиа (а) и показателем микроциркуляции (б) в группе с неконтролируемой артериальной гипертензией
FIG. 3. Correlations between the level of cognitive function (MoCA) and thickness of the intima-media complex (a) and microcirculation index (б) in patients with uncontrolled arterial hypertension
У пациентов в группе 2 корреляционные связи уровня когнитивной функции с толщиной КИМ и ПМ были слабыми и статистически незначимыми.
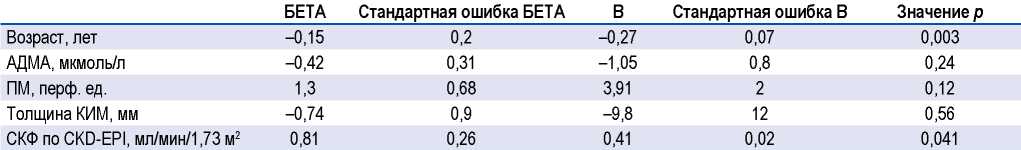
Среди всех изученных параметров в группе 1 (НАГ) статистически значимо на когнитивную функцию (число баллов по MoСA) в рамках полученной модели влияли возраст, толщина КИМ и уровень АДМА (все параметры с отрицательными коэффициентами), а также ПМ (с положительным коэффициентом) (табл. 3). Для полученного уравнения значение R составило 0,88, R2 = 0,77 (р < 0,001); остатки распределены нормально.
Таблица 3. Результаты многофакторного линейного регрессионного анализа в группе неконтролируемой артериальной гипертензии
Table 3. Results of multivariate linear regression analysis in the group of uncontrolled arterial hypertension

В группе 2 (КАГ) в рамках полученной модели установлена связь когнитивной функции с возрастом (отрицательный коэффициент) и СКФ (положительный коэффициент). Значение R для полученного уравнения составило 0,91, R2 = 0,82, (р < 0,001); остатки распределены нормально. Для концентрации АДМА, ПМ и толщины КИМ полученные коэффициенты не были статистически значимыми (табл. 4).
Таблица 4. Результаты многофакторного линейного регрессионного анализа в группе контролируемой артериальной гипертензии
Table 4. Results of multivariate linear regression analysis in the group of controlled arterial hypertension
ОБСУЖДЕНИЕ
В обследованных нами группах как неконтролируемой, так и контролируемой АГ выявлены признаки поражения артерий, связанных с АГ. Так, в обеих группах имелась одинаковая частота утолщения КИМ >0,9 мм, наличия бляшек в БЦА, увеличения СПВ >1000 см/сек, что, по-видимому, обусловлено сходными демографическими характеристиками обследованных групп (возраст, половой состав, частота курения, продолжительность АГ) и частотой и тяжестью метаболических нарушений, в том числе гиперлипидемии. При этом группы отличались по толщине КИМ, которая была статистически значимо выше в группе НАГ, что отражает более выраженные процессы ремоделирования сосудистой стенки в группе с неконтролируемым течением АГ.
В группе НАГ выявлен более низкий ПМ, который отражает величину перфузии крови в сосудах микроциркуляции, что свидетельствует об ограничении компенсаторных возможностей микроциркуляторного русла, в том числе об уменьшении количества функционирующих капилляров и снижении скорости кровотока. Таким образом, полученные результаты отражают более выраженные нарушения в микроциркуляторном русле при неконтролируемом течении АГ вследствие как функциональных (изменение тонуса), так и морфологических нарушений (рарефикация).
В обеих группах изучен сывороточный уровень АДМА — нового маркера, отражающего состояние функции эндотелиальной системы, который представляет собой эндогенный ингибитор синтазы оксида азота (NOS, NO-синтаза). Повышение концентрации АДМА отражает степень угнетения активности синтеза оксида азота и, соответственно, эндотелийзависимой вазодилатации. Средний уровень АДМА в обеих группах выходил за рамки референсных значений, что свидетельствует о наличии эндотелиальной дисфункции у пациентов с АГ. Обращает на себя внимание, что в группе НАГ уровень АДМА оказался статистически значимо выше, чем в группе КАГ, что позволяет предположить более выраженную степень дисфункции эндотелия при НАГ.
Изучение когнитивной функции является хорошо известным методом оценки состояния центральной нервной системы, однако как инструмент измерения ее поражения у пациентов с АГ оно было включено в Европейские рекомендации по диагностике и лечению АГ лишь в 2018 г. [16].
В нашей работе для оценки когнитивных нарушений использовался опросник MoCA, служащий для выявления умеренных форм когнитивной дисфункции [13]. В группе пациентов с НАГ выявлена более высокая частота и тяжесть нарушений по сравнению с группой КАГ. Известно, что НАГ является сильным и независимым фактором риска когнитивных расстройств, в том числе развития тяжелых деменций. Так, I. Skoog и соавт. [17] на основании результатов 15-летнего наблюдения за пациентами пришли к выводу, что исходно высокое АД (180/100 мм рт. ст. и выше) статистически значимо коррелирует с риском развития деменции.
В исследовании HAAS, в котором приняли участие более 3700 пациентов, была показана статистически значимая корреляция между уровнем систолического АД в среднем возрасте и риском развития когнитивных расстройств в дальнейшем. При этом повышение систолического АД на каждые 10 мм рт. ст. увеличивало риск развития когнитивных расстройств на 7–16% [11].
Негативное влияние АГ на когнитивные функции было продемонстрировано также в Роттердамском и Гетенбергском исследованиях и других работах [18].
Было выявлено значимое нарастание когнитивных нарушений с увеличением жесткости сосудистой стенки. К недостаткам этих исследований следует отнести то, что в них не производилась одномоментная оценка состояния сосудов мышечно-эластического типа и показателей микроциркуляции, а также влияния неконтролируемого и контролируемого течения АГ на прогрессирование когнитивных нарушений.
В нашем исследовании проведение корреляционного и множественного регрессионного анализа установило статистически значимую ассоциацию толщины КИМ и состояния когнитивной функции у пациентов с НАГ. Помимо этого, установлена ассоциация когнитивной функции с ПМ и эндотелиальной функцией, оцененной по уровню АДМА.
Хроническая дисфункция головного мозга обусловлена прогрессирующими морфологическими и функциональными нарушениями, среди которых ведущую роль играют нарушения сосудистого эндотелия. В последние годы в качестве кандидата — маркера дисфункции эндотелия рассматривается АДМА — эндогенный ингибитор NOS. В нашем исследовании повышенная концентрация АДМА, особенно в группе НАГ, является признаком снижения активности синтеза оксида азота, а соответственно и эндотелий-зависимой вазодилатации. Это, в свою очередь, может быть одним из механизмов как глобального ухудшения микроциркуляции, так и тканевой перфузии в сосудистом бассейне головного мозга. Следует принимать во внимание, что АДМА представляет собой неселективный ингибитор NOS, которая в организме представлена тремя изоформами фермента: эндотелиальной, индуцибельной и нейрональной [19].
Будучи синтезирован в головном мозге при участии нейрональной NOS, оксид азота может выступать в роли нейромедиатора. Имеются данные о существовании нитроксидергической системы мозга, которая представляет собой комплекс нейрональных и экстранейрональных (эндотелий, глия, макрофаги, лейкоциты, тромбоциты) структур, синтезирующих NO [20].
Клетки, синтезирующие NO, присутствуют во многих отделах мозга, однако наиболее богаты им обонятельная луковица, мозжечок и средний мозг. NO-опосредованные механизмы лежат в основе процессов узнавания, обучения и памяти, то есть когнитивной функции. Имеются данные о том, что ингибирование синтеза NO ведет к амнезии, нарушению двигательной активности, сексуального поведения, агрессивности, цикла сна–бодрствования.
ЗАКЛЮЧЕНИЕ
По нашим данным, у пациентов с НАГ по сравнению с КАГ имеется более выраженная когнитивная дисфункция, которая ассоциирована как с процессами ремоделирования сосудистого русла в виде увеличения толщины КИМ и с ухудшением микроциркуляции, так и с накоплением эндогенного ингибитора синтазы оксида азота — АДМА.
ВКЛАД АВТОРОВ
В.И. Подзолков разработал основную концепцию и дизайн исследования. А.Е. Брагина разработала дизайн исследования и написала основную часть финальной версии статьи. Т.А. Сафронова участвовала в разработке дизайна исследования, осуществляла анализ полученных результатов и написала часть финальной версии статьи. Д.У. Наткина и Н.А. Дружинина осуществляли набор пациентов, сбор клинических, лабораторных и анкетных данных, статистическую обработку и написали часть финальной версии статьи. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Valery I. Podzolkov developed the basic concept and design of the study. Anna E. Bragina designed the study and wrote the main part of the final article. Tatiana A. Safronova participated in the design of the study, analyzed the results obtained and wrote part of the final version of the article. Dinara U. Natkina, Natalia A. Druginina, recruited patients, collected clinical, laboratory and personal data, statistically processed and wrote part of the final version of the article. All authors approved the final version of the publication.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Благодарности: авторы выражают благодарность А.Г. Черепанову, преподавателю АНО ДО «ИТЭК Школа иностранных языков», за помощь в работе с литературой и переводе обзорных статей.
Conflict of interest. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Acknowledgments: the authors are grateful to Alexander G. Cherepanov, University teacher, ANO AE “ETEK School of Foreign Languages”, for work with literature and translation of reviews.
Список литературы
1. Оганов Р.Г., Масленникова Г.Я. Демографические тенденции в Российской Федерации: вклад болезней системы кровообращения. Кардиоваскулярная терапия и профилактика. 2012; 1; 5–10. https://doi.org/10.15829/1728-8800-2012-1-5-10
2. Emdin C.A., Rothwell P.M., Salimi-Khorshidi G., et al. Blood pressure and risk of vascular dementia: evidence from a primary care registry and a cohort study of transient ischemic attack and stroke. 2016; 47(6): 1429–35. https://doi.org/10.1161/STROKEAHA.116.012658 PMID: 27165956
3. Snyder H.M., Corriveau R.A., Craft S., et al. Vascular contributions to cognitive impairment and dementia including Alzheimer’s disease. 2015; 11: 710–17. PMID: 25510382
4. Iadecola C., Yaffe K., Biller J., et al. Impact of hypertension on cognitive function: a scientific statement from the American Heart Association. 2016; 68(6); е67–е94. https://doi.org/10.1161/HYP.0000000000000053 PMID: 27977393
5. Levi Marpillat N., Macquin-Mavier I., Tropeano A.I., et al. Antihypertensive classes, cognitive decline and incidence of dementia: a network meta-analysis. J Hypertens. 2013; 31(6): 1073– 82. https://doi.org/10.1097/HJH.0b013e3283603f53 PMID: 23552124
6. Kjeldsen S.E., Narkiewicz K., Burnier M., et al. Intensive blood pressure lowering prevents mild cognitive impairment and possible dementia and slows development of white matter lesions in brain: the SPRINT memory and cognition IN decreased hypertension (SPRINT MIND) study. 2018; 27(5): 247–48. https://doi.org/10.1080/08037051.2018.1507621 PMID: 30175661
7. Faraco G., Iadecola C. Hypertension: a harbinger of stroke and dementia. Hypertension. 2013; 62(5): 810–7. https://doi.org/10.1161/HYPERTENSIONAHA.113.01063 PMID: 23980072
8. Qiu C., Fratiglioni L. A Major role for cardiovascular burden in age-related cognitive decline. 2015; 12(5): 267–77. https://doi.org/10.1038/nrcardio.2014.223 PMID: 25583619
9. Киландер Л., Ниман Н., Боберг М. и др. Взаимосвязь артериальной гипертензии с когнитивными нарушениями: Результаты 20-летнего наблюдения 999 пациентов. Обзоры клинической кардиологии. 2005; 2; 37–49.
10. Орлова Н.В., Карселадзе Н.Д., Хачирова А.И. и др. Изучение влияния микроциркуляции и жесткости сосудов у больных артериальной гипертонией на когнитивные нарушения. Сибирский медицинский журнал. 2014; 4; 119–22.
11. Launer L.J., Hughes T., Yu B., et al. Lowering midlife levels of systolic blood pressure as a public health strategy to reduce late-life dementia: perspective from the Honolulu Heart Program/Honolulu Asia Aging Study. 2010; 55(6): 1352–9. https://doi.org/10.1161/HYPERTENSIONAHA.109.147389 PMID: 20404223
12. Williams B., Mancia G., Spiering W., et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). Eur Heart J 2018; 39(33): 3021–104. https://doi.org/10.1093/eurheartj/ehy339 PMID: 30165516
13. Carson N., Leach L., Murphy K.J. A re-examination of Montreal Cognitive Assessment (MoCA) cutoff scores. Int J Geriatr Psychiatry. 2018; 33(2): 379–88. https://doi.org/10.1002/gps.4756 PMID: 28731508
14. Козлов В.И., Азизов Г.А., Гурова О.А., Литвин Ф.Б. Лазерная допплеровская флоуметрия в оценке состояния и расстройств микроциркуляции крови. М., 2012. 32 с. URL: http://angiologia.ru/specialist/cathedra/recommendations/2012/001.pdf
15. Xuan С., Xu L-Q., Tian Q-W., et al. Dimethylarginine dimethylaminohydrolase 2 (DDAH 2) gene polymorphism, asymmetric dimethylarginine (ADMA) concentrations, and risk of coronary artery disease: A case-control study. Sci Rep. 2016; 6: 33934. https://doi.org/10.1038/srep33934 PMID: 27677852
16. Соловьева А.П., Горячев Д.В., Архипов В.В. Критерии оценки когнитивных нарушений в клинических исследованиях. Ведомости Научного центра экспертизы средств медицинского применения. 2018; 8(4): 218–30. https://doi.org/10.30895/1991-2919-2018-8-4-218-230
17. Skoog I., Lernfelt B., Landahl S., et al. 15-year longitudinal study of blood pressure and dementia. Lancet 1996; 347(9009): 1141–5. https://doi.org/10.1016/s0140-6736(96)90608-x PMID: 8609748
18. Ruitenberg A., Skoog I., Ott A., et al. Blood pressure and risk of dementia: results from the Rotterdam study and the Gothenburg H-70 Study. Dementia Geriatr Cogn Disorders. 2001; 12(1): 33–9. https://doi.org/10.1159/000051233 PMID: 11125239
19. Vallance P., Leone A., Calver A., et al. Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure. Lancet. 1992; 339(8793): 572–75. https://doi.org/10.1016/0140-6736(9 2)90865-z PMID: 1347093
20. Максимович Н.Е. Понятие о нитроксидергической системе мозга (роль нейрональных источников). Журнал Гродненского государственного медицинского университета. 2003; 4: 7–10.
Об авторах
В. И. ПодзолковРоссия
Подзолков Валерий Иванович, д-p мед. наук, профессор, зав. кафедрой факультетской терапии № 2; директор клиники факультетской терапии № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
А. Е. Брагина
Россия
Брагина Анна Евгеньевна, д-p мед. наук, профессор кафедры факультетской терапии № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Д. У. Наткина
Россия
Наткина Динара Умарбековна, врач-кардиолог, врач функциональной диагностики
Пресненский Вал, д. 14, стр. 3, г. Москва, 123557
+7 (926) 721-01-22
Н. А. Дружинина
Россия
Дружинина Наталья Александровна, канд. мед. наук, ассистент кафедры факультетской терапии № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991
Т. А. Сафронова
Россия
Сафронова Татьяна Аркадьевна, канд. мед. наук, доцент кафедры факультетской терапии № 2
ул. Трубецкая, д. 8, стр. 2, г. Москва, 119991







































