Перейти к:
Характеристика нейроглии в эпицентре и в удаленной от травмы области при контузионном повреждении спинного мозга у мини-свиньи
https://doi.org/10.47093/2218-7332.2023.14.3.19-27
Аннотация
Цель. Установить отсроченное (спустя 2 месяца) влияние травмы спинного мозга (ТСМ) в нижнегрудном отделе у мини-свиньи на морфологическое состояние макро- и микроглии в близлежащих и отдаленных каудальных участках.
Материалы и методы. Половозрелых самок вьетнамской вислобрюхой свиньи случайным образом разделяли на две группы: с ТСМ (n = 3) и интактную (n = 3). Дозированную контузионную ТСМ моделировали на уровне Th8–Th9 позвонков, через 2 месяца исследовали поперечные криостатные срезы каудального сегмента, прилегающего к эпицентру травмы, и поясничного утолщения (L4–S2). Экспрессию маркеров астроцитов (глиальный фибриллярный кислый белок, glial fibrillary acidic protein, GFAP) и микроглии (ионизированная кальций-связывающая адаптерная молекула 1, ionized calcium-binding adapter molecule 1, Iba1) оценивали как относительную иммунопозитивную площадь, занимаемую клетками. При подсчете количества олигодендроглиальных клеток (фактор транскрипции олигодендроцитов 2, oligodendrocyte transcription factor 2, Olig2) учитывали наличие ядер, выявляемых при помощи 4’,6-диамидино-2-фенилиндола (4',6-diamidino-2-phenylindole, DAPI).
Результаты. После ТСМ выявлено увеличение относительных площадей, занимаемых GFAP-позитивными астроцитами и Iba1-позитивными клетками микроглии, а также уменьшение Olig2-позитивных олигодендроцитов как в области повреждения, так и в поясничном утолщении. В обеих областях спустя 2 месяца после ТСМ доля астроцитов в передних рогах существенно не отличалась, а в задних рогах увеличивалась вдвое. Клетки микроглии занимали площадь в 2,5 раза больше в передних рогах обеих областей и в задних рогах поясничного утолщения, в задних рогах в области ТСМ присутствие микроглии увеличилось незначительно (в 1,2 раза). Количество олигодендроцитов уменьшилось в области эпицентра ТСМ в передних и задних рогах в 1,5–1,75 раза, в поясничном утолщении более значимо – в 2,5 раза в передних и в 5,5 раза в задних рогах.
Заключение. Результаты исследования обнаружили схожую картину распределения клеток макро- и микроглии как в области ТСМ, так и в удаленных участках. Полученные данные свидетельствуют о необходимости учитывать состояние удаленных от эпицентра ТСМ участков нервной ткани при стимулировании нейрорегенерации у таких пациентов.
Ключевые слова
Список сокращений:
- ТСМ – травма спинного мозга
- DAPI – 4',6-diamidino-2-phenylindole, 4’,6-диамидино-2-фенилиндол
- GFAP – glial fibrillary acidic protein, глиальный фибриллярный кислый белок
- Iba1 – ionized calcium-binding adapter molecule 1, ионизированная кальций-связывающая адаптерная молекула 1
- IL-10 – interleukin-10, интерлейкин 10
- Olig2 – oligodendrocyte transcription factor 2, фактор транскрипции олигодендроцитов 2
- PBS – phosphate buffered saline, фосфатно-солевой буфер
По данным Всемирной организации здравоохранения, во всем мире ежегодно регистрируют от 250 000 до 500 000 случаев травмы спинного мозга (ТСМ)1, которая приводит к различной степени выраженности нарушений двигательных, чувствительных и вегетативных функций организма [1].
Патологические процессы, возникающие после ТСМ, включают в себя массовую гибель клеток спинного мозга, разрывы нервных волокон, кровоизлияния, ишемические и воспалительные повреждения, на месте которых впоследствии образуются полости и кисты [2]. К сожалению, результаты терапии пациентов с тяжелой ТСМ нельзя назвать утешительными [3], что во многом связано с недостаточной изученностью клеточных механизмов, происходящих в спинном мозге при его повреждении.
Согласно современным представлениям, в ходе естественной регенерации после ТСМ вокруг эпицентра нейротравмы начинаются процессы частичного восстановления (ремоделирования) спинного мозга [2][4]. В центре травмы формируется очаг, состоящий из эндогенных пролиферирующих фибробластов, перицитов, эндотелиальных клеток и лейкоцитов. Одновременно с этим запускается процесс регенерации как нервных клеток, так и клеток нейроглии. Начиная с 1–2-го дня после ТСМ и примерно до 7–10 дня активно пролиферируют астроциты и мигрируют к границам формирующегося очага повреждения [5], образуя вокруг него плотную пограничную зону [6]. Непрерывные границы астроглиального рубца, состоящего из коллагена IV типа, эктрацеллюлярного матрикса и хондроитинсульфатных протеогликанов [7], препятствуют распространению воспаления из эпицентра ТСМ. На внешней границе рубца астроциты контактируют с реактивными прогениторными олигодендроглиальными клетками, экспрессирующими хондроитинсульфатный протеогликан 4, также известный как NG2 (neural/glial antigen 2, нейронный глиальный антиген 2), который, в свою очередь, блокирует прорастание аксонов через эпицентр травмы [8]. К глиальному рубцу прилегает реактивная нервная ткань, распространяющаяся от границы астроцитарного рубца во всех направлениях на значительное расстояние [4]. Она содержит все структурные элементы относительно сохранной и функционирующей нервной ткани и характеризуется наличием активированной глии, включая астроциты, микроглию и предшественники олигодендроглиоцитов, содержание которых постепенно снижается в дистальном от эпицентра направлении. Гипертрофированные реактивные астроциты активно взаимодействуют с функционирующими нейронами, вероятно, повышая их жизнеспособность [2] и способствуя локальному росту аксонов и синаптогенезу [9].
Особый интерес в реактивной нервной ткани представляют клетки микроглии. Среди них можно выделить провоспалительный (M1-подобный) и противовоспалительный прорегенеративный (M2-подобный) фенотипы, которые вносят свой вклад в процессы ответа на травму и последующего восстановления структуры спинного мозга [10]. После ТСМ активированные M1-подобные микроглиальные клетки, являясь антигенпредставляющими, экспрессируют главный комплекс гистосовместимости класса II (major histocompatibility complex class II, MHCII ) и участвуют в иммунных реакциях [11]. Исследования на моделях острой и подострой ТСМ показали, что для М1-подобных макрофагов характерна более высокая экспрессия хондроитинсульфатных протеогликанов, участвующих в формировании микроокружения [12], а для М2-подобных – высокий уровень экспрессии интерлейкина 10 (interleukin-10, IL-10), трансформирующего фактора роста бета (transforming growth factor beta, TGF-β) и аргиназы-1, которые оказывают положительное влияние на посттравматическую регенерацию спинного мозга [4], например путем индукции дифференцировки олигодендроглиоцитов через механизмы, опосредованные IL-10 [13].
Цель исследования – установить влияние ТСМ в нижнегрудном отделе на распределение клеток макро- и микроглии в каудальном сегменте, прилегающем к эпицентру повреждения, и в удаленной от него области (поясничном утолщении спинного мозга) у мини-свиньи.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на половозрелых 4-месячных самках вьетнамской вислобрюхой свиньи весом 20–25 кг. В течение двух недель до операции животных содержали одиночно в загоне с 12-часовым периодом чередования светлого и темного времени суток, со свободным доступом к воде и корму.
В день операции животных разделили случайным образом на две группы: интактные животные (n = 3) и мини-свиньи с контузионной ТСМ (n = 3). Премедикацию проводили с помощью внутримышечного введения 1,5 мл 2% раствора ксилазина (0,1 мл/кг), 1,5 мл раствора тилетамина и золазепама (0,1 мл/кг) и цефтриаксона (1 гр / 5 мл). После чего подопытному животному подключали ингаляционный наркоз (Minor Vet Optima, Zoomed, США) путем введения смеси 2,0–2,5% изофлурана (Laboratorios Karizoo, S.A., Испания) с кислородом. Контузионную ТСМ моделировали по протоколу, который использован нами ранее [14]. После ламинэктомии на уровне Th8–Th9 позвонков металлический цилиндр импактора фиксировали на расстоянии 1 мм от поверхности спинного мозга. Дозированную контузионную травму вызывали с помощью груза массой 50 г, падающего с высоты 50 см на участок спинного мозга, покрытого твердой мозговой оболочкой.
Забор спинного мозга у мини-свиней проводили через 2 месяца после моделирования нейротравмы. Животных выводили из эксперимента, вводя в глубокий наркоз с помощью золазепама 100 объемом 0,5 мл в/м и постепенно повышая концентрацию изофлурана до 5,0 об.% ингаляционно. Для иммунофлуоресцентного анализа выделяли каудальный отдел спинного мозга длиной 5 мм на расстоянии 5 мм от эпицентра травмы, а также поясничное утолщение (L4–S2).
У интактных животных забирали идентичные области спинного мозга. Полученные образцы постфиксировали в 4% растворе параформальдегида (Sigma, США) при 4 °С в течение 12 ч, с целью криопротекции инкубировали в 30% растворе сахарозы (Sigma, США). Свободно плавающие поперечные срезы спинного мозга толщиной 20 мкм нарезали на криостате Microm HM 560. Срезы промывали в фосфатно-солевом буфере (phosphate buffered saline, PBS) с 1% Triton X-100 в течение 5 минут 3 раза, неспецифические места связывания первичных антител блокировали в PBS с 1% тритоном X-100 и 5% сывороткой осла в течение 1 часа при комнатной температуре.
Астроциты выявляли с помощью первичных антител против глиального фибриллярного кислого белка (glial fibrillary acidic protein, GFAP), олигодендроглиальные клетки с помощью антител против фактора транскрипции олигодендроцитов 2 (oligodendrocyte transcription factor 2, Olig2), клетки микроглии с помощью антител против ионизированной кальций-связывающей адаптерной молекулы 1 (ionized calcium-binding adapter molecule 1, Iba1) (табл. 1). Первый этап реакции проводили при температуре 4 °С в течение 12 ч. После промывки в PBS срезы инкубировали 2 ч. при комнатной температуре с вторичными антителами, описанными в таблице 1.
Таблица 1. Первичные и вторичные антитела,
использованные для идентификации астроцитов, олигодендроцитов
и клеток микроглии в срезах спинного мозга мини-свиней
Table 1. Primary and secondary antibodies
used to label astrocytes, oligodendrocytes,
and microglia in mini-pig spinal cord sections
|
Маркеры / Markers |
Происхождение / Origin |
Разведение / Dilution |
Производитель / Manufacturer |
|
GFAP (моноклональные/ monoclonal)a |
Мышь / Mouse |
1:200 |
Santa Cruz (Cat#sc-33673) |
|
Iba1 (моноклональные / monoclonal)a |
Кролик / Rabbit |
1:150 |
Abcam (Cat # ab178847) |
|
Olig2 (моноклональные / monoclonal)a |
Кролик / Rabbit |
1:100 |
Abcam (Cat # ab220796) |
|
Anti-mouse IgG conjugated with Alexa 488b |
Осел / Donkey |
1:200 |
Invitrogen (Cat#A-21202) |
|
Anti-rabbit IgG conjugated with Alexa 647 b |
Осел / Donkey |
1:200 |
Invitrogen (Cat#A-31573) |
Примечание: a – первичные антитела; b – вторичные антитела.
Note: a – primary antibodies; b – secondary antibodies.
Для визуализации ядер клеток срезы дополнительно окрашивали раствором 4’,6-диамидино-2фенилиндола (4',6-diamidino-2-phenylindole, DAPI) 10 мкг/мл (Sigma, США). Цифровые изображения структур спинного мозга получали с помощью микроскопа Carl Zeiss AxioScope.A1 (Carl Zeiss, Германия) и анализировали в квадрате площадью 0,05 мм² в программе ImageJ (NIH, США). В качестве негативного контроля специфичности иммунофлуоресцентной реакции срезы спинного мозга окрашивали только вторичными антителами. Серое вещество исследовали: в передних рогах – VII, VIII, IX пластины; в задних рогах – I, II, III, IV пластины (по Рекседу). Экспрессию маркеров астроцитов (GFAP) и микроглии (Iba1) оценивали как относительную иммунопозитивную площадь, занимаемую клетками. При подсчете количества олигодендроглиальных клеток (Olig2иммунопозитивных) учитывали наличие ядер, выявляемых при помощи DAPI.
Статистический анализ
Описательные статистики представлены в виде медиан 1-го и 3-го квартилей. Для сравнения значений количественных переменных между группами применяли тест Краскела – Уоллиса. Для попарных межгрупповых сравнений использовали тест Данна, различия считали статистически значимыми при p < 0,05. Статистический анализ полученных данных проводили в среде для статистических вычислений R 4.1.2 (R Foundation for Statistical Computing, Vienna, Австрия).
РЕЗУЛЬТАТЫ
При иммунофлуоресцентном анализе площади астроцитов (GFAP-позитивных клеток) в передних рогах отдела спинного мозга, прилегающего к эпицентру травмы, у животных после ТСМ и у интактных существенной разницы не обнаружено (рис. 1А): 25,11 (21,35; 28,34)% vs. 22,59 (19,94; 25,66)%; р > 0,05. В задних рогах спинного мозга у мини-свиней после ТСМ GFAP-иммунопозитивная площадь была больше по сравнению с интактными животными: 12,53 (11,69; 13,73)% vs 6,23 (4,36; 8,73)%; p = 0,0173 (рис. 1).
При анализе количества астроцитов в поясничном утолщении в задних рогах обнаружено увеличение GFAP-позитивной площади у животных после ТСМ по сравнению с интактными животными: 19,87 (15,68; 23,70)% vs. 10,10 (9,17; 12,10)%; р = 0,002. В передних рогах эти значения у опытных и интактных животных значительно не различались и составили 23,54 (17,83; 29,59)% и 20,89 (16,18; 25,88)% соответственно; р > 0,05 (рис. 1).
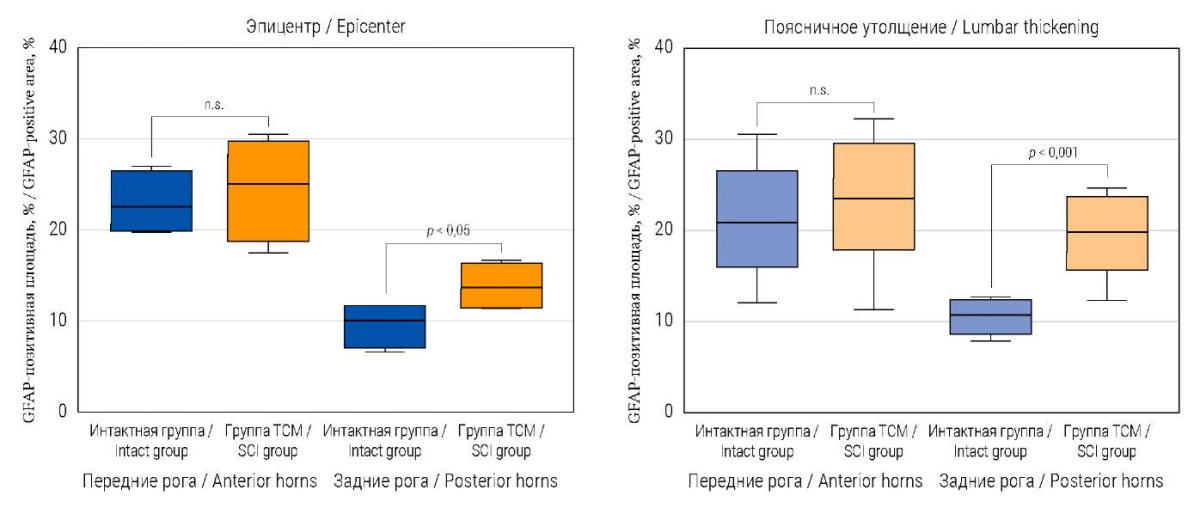
РИС. 1. Количественный анализ GFAP-позитивных площадей
в спинном мозге мини-свиней через 2 месяца после моделирования ТСМ.
FIG. 1. Quantitative analysis of GFAP-positive areas
in the spinal cord of mini-pigs 2 months after SCI modelling.
Примечание: n.s. – not significant, не значимо;
ТСМ – травма спинного мозга.
Note: n.s. – not significant; SCI – spinal cord injury.
Количество олигодендроцитов (Olig2-позитивных клеток) в передних и задних рогах в области эпицентра травмы в опытной группе было значительно снижено: 20,2 (20,0; 21,2) и 24,5 (22,25; 25) соответственно, по сравнению с интактной группой: 34,0 (34,0; 40,4) и 43 (40,75; 45,5) соответственно; p = 0,0002 и р < 0,0001 (рис. 2).
В поясничном утолщении количество Olig2-позитивных клеток у интактных мини-свиней составило 12 (11; 13) в передних и 16,5 (16; 20,75) в задних рогах. При этом у мини-свиней после ТСМ выявлено меньшее количество Olig2-позитивных клеток – 5 (4; 6) и 3 (2; 4,25) соответственно; р < 0,0001 и р = 0,0001 (рис. 2).
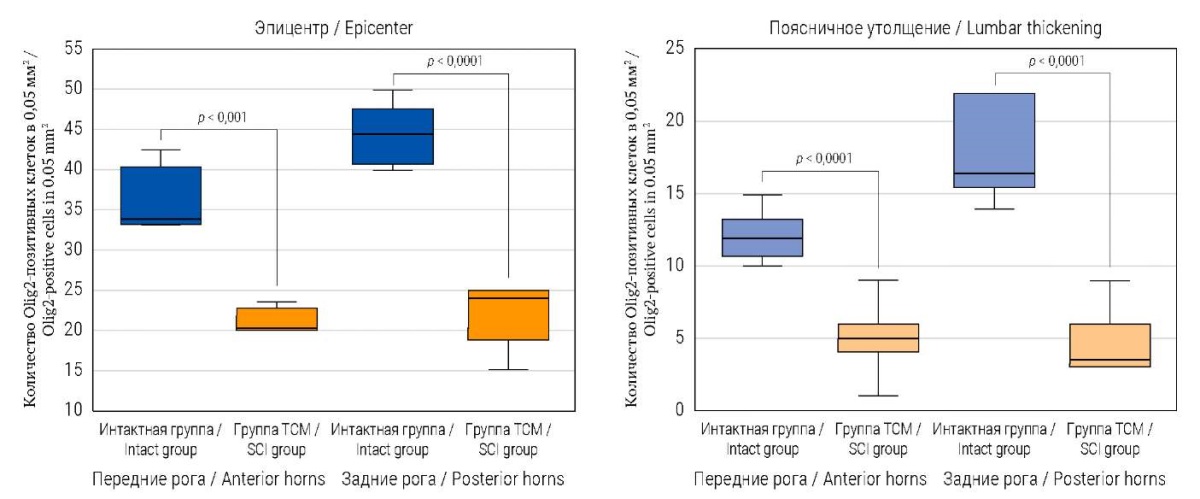
РИС. 2. Количественный анализ Olig2-позитивных клеток
в спинном мозге мини-свиней через 2 месяца после моделирования ТСМ.
FIG. 2. Quantitative analysis of Olig2-positive cells
in the spinal cord of mini-pigs 2 months after SCI modelling.
Примечание: ТСМ – травма спинного мозга.
Note: SCI – spinal cord injury.
Увеличение клеток микроглии (площадь Iba1-позитивных участков) выявлено в передних и задних рогах в области эпицентра травмы у животных с ТСМ: 24,31 (22,10; 27,19)% и 30,37 (29,29; 32,43)% соответственно, при сравнении с интактными мини-свиньями: 9,87 (8,87; 10,26)% и 26,10 (23,89; 28,09)% соответственно; р = 0,0053 и р = 0,0014 (рис. 3).
Iba1-позитивная площадь, занимаемая клетками микроглии, в поясничном утолщении была больше как в передних, так и задних рогах у мини-свиней с ТСМ: 25,41 (20,50; 26,25)%; р = 0,0001 и 22,19 (14,29; 23,53)% соответственно; р = 0,0001 при сравнении с интактными животными: 9,80 (7,35; 10,61)% и 8,12 (7,58; 8,79)% соответственно (рис. 3).
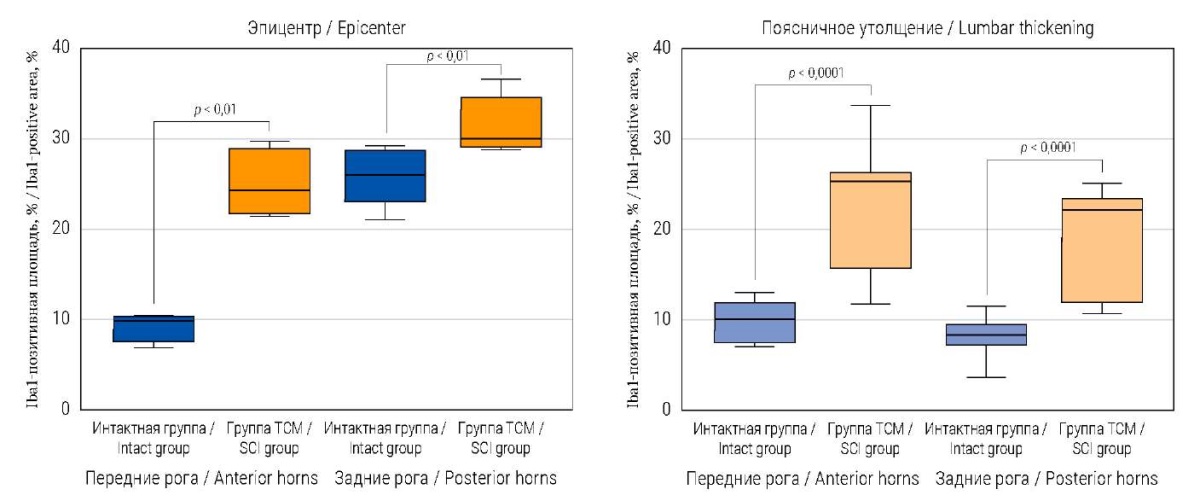
РИС. 3. Количественный анализ Iba1-позитивных клеток
в спинном мозге мини-свиней через 2 месяца после моделирования ТСМ.
FIG. 3. Quantitative analysis of Iba1-positive areas
in the spinal cord of mini-pigs 2 months after SCI modelling.
Примечание: ТСМ – травма спинного мозга.
Note: SCI – spinal cord injury.
ОБСУЖДЕНИЕ
Результаты нашего исследования показали, что через 2 месяца после ТСМ у мини-свиней как в каудальном отделе спинного мозга, прилегающем к эпицентру травмы, так и в удаленной области поясничного отдела происходит схожая посттравматическая реакция, проявляющаяся в увеличении площадей, занимаемых астроцитами (GFAP-позитивными клетками) и клетками микроглии (Iba1-позитивными клетками), участвующими в формировании глиального рубца, и одновременном уменьшении количества олигодендроцитов (Olig2-позитивных клеток), отвечающих за миелинизацию нервных волокон [2].
Полученные нами данные свидетельствуют о развитии хронического процесса, распространяющегося на удаленный от эпицентра ТСМ поясничный отдел спинного мозга. Анализ литературных источников также свидетельствует, что ТСМ вызывает нейровоспаление не только в эпицентре повреждения [2], но и в обширных зонах вокруг него в обоих (краниальном и каудальном) направлениях [11].
ТСМ оказывает длительное разрушительное воздействие на независимость и активность в повседневной жизни пациента, наносит физический и психологический ущерб [15]. Инвалидизация пациентов с ТСМ является значимой социально-экономической проблемой не только для пациента и членов его семьи, но и для государства. Ограниченная регенерация клеток в центральной нервной системе – ключевая проблема, которую необходимо решить при разработке новых методов лечения ТСМ. Экспериментальные подходы к посттравматическому морфофункциональному восстановлению спинного мозга первоначально разрабатываются на моделях ТСМ у животных, но они не могут быть напрямую экстраполированы на пациентов со спинномозговой травмой. Мини-свиньи по анатомическим особенностям нервной системы, физиологическим и биохимическим характеристикам приближены к человеку и считаются наиболее оптимальными животными для доклинических исследований [15].
Ремоделирование спинного мозга после ТСМ носит многогранный характер [11]. В эпицентре образуется очаг первичного повреждения с последующей активацией клеток макроглии и воспалительной инфильтрацией нейтрофилами, макрофагами, клетками резидентной микроглии [16]. Дегенерации поврежденных нервных волокон из очага ТСМ, а также проходящих через него, способствуют астроциты и микроглия, они же участвуют в реципрокной активации других нейронов [11]. В итоге происходит разрушение нервных волокон нисходящих и восходящих путей, прерывается связь между нейронами головного и спинного мозга. Воспалительный ответ подробно охарактеризован в зоне травмы [17], однако до сих пор недостаточно изучен в областях, удаленных от области повреждения [11]. При этом важность таких сведений для разработки новых методов терапии более чем очевидна.
На преодоление патогенетических и патоморфологических событий в подострой и хронической фазах ТСМ направлены такие современные стратегии лечения, как генная терапия (повышение выживаемости клеток спинного мозга, стимулирование роста аксонов, сдерживание развития нейровоспаления и предотвращение образования астроглиального рубца) и электростимуляция (содействие нейропластичности и интеграции эфферентных и афферентных сигналов, способствующих функциональному восстановлению спинного мозга). Согласно последним исследованиям, надлежит уделять внимание предотвращению патологических изменений спинного мозга не только в сегментах, прилежащих к эпицентру травмы, но и в отдаленных областях.
Ограничения исследования
Большинство работ, посвященных изучению патогенетических и патоморфологических процессов при ТСМ, сфокусировано главным образом на эпицентре первичного повреждения. В настоящем исследовании нами представлены данные о реакции клеток макро- и микроглии в каудальных сегментах спинного мозга после контузионной травмы в нижнегрудном отделе у мини-свиней. Однако патологический процесс распространяется и в краниальном направлении. В этой связи требуется проведение дополнительных исследований реорганизации клеток нейроглии выше эпицентра повреждения.
Направления для дальнейших исследований
Одним из аспектов последствий ТСМ является ремоделирование клеток нейроглии. Изучение патогенеза спинальной нейротравмы на мини-свиньях в нашей модели должно включать в себя исследование процессов: молекулярной перестройки внеклеточного матрикса, нейровоспаления, дегенерации и регенерации нервных проводников, реорганизации транстравматической нейронной сети и особенно вопросов нарушения и восстановления гемато-спинального барьера.
ЗАКЛЮЧЕНИЕ
Результаты нашего исследования продемонстрировали схожую картину распределения макро- и микроглии как в сохранной нервной ткани, каудально прилегающей к эпицентру ТСМ, так и в отдаленном участке поясничного утолщения. Ремоделирование нейроглии в удаленных от места повреждения спинного мозга областях является важным процессом, который следует учитывать при разработке способов нейрорегенерации у пациентов с ТСМ.
ВКЛАД АВТОРОВ
Р.Р. Гарифулин, А.А. Измайлов, В.А. Маркосян, И.С. Минязева провели исследование и собрали материал. Р.Р. Гарифулин, А.А. Измайлов проанализировали результаты. В.В. Валиуллин, Р.Р. Исламов написали и отредактировали текст рукописи. Р.Р. Исламов – руководитель работы, разработал идею исследования, сформулировал цели и задачи и осуществлял руководство работой. Все авторы утвердили окончательную версию публикации.
AUTHOR CONTRIBUTIONS
Ravil R. Garifulin, Andrey A. Izmailov, Vage A. Markosyan, Irina S. Minyazeva – сonducting a research and data collection. Ravil R. Garifulin, Andrey A. Izmailov – data curation and analysis. Victor V. Valiullin, Rustem R. Islamov – writing and editing the draft of the article. RustemмR. Islamov – work leader, conceptualization, supervision. All authors approved the final version of the publication.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России (№5-26.05.2020).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование выполнено при финансовой поддержке гранта РНФ № 16–15-00010.
Благодарности. Авторы выражают благодарность студентам ФГБОУ ВО «Казанский государственный медицинский университет», а именно Р.Х. Ахметову, А.Р. Сираевой, К.Р. Яппаровой за помощь в проведении исследования.
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Kazan State Medical University, No. 5 of 26.05.2020.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The research was supported by the grant from the Russian Science Foundation No. 16-15-00010.
Acknowledgements. The authors express their gratitude to the students of Kazan State Medical University, namely, Rustem H. Akhmetov, Alina R. Siraeva, and Kamila R. Yapparova, for assistance in conducting the study.
1. World Health Organization. Spinal cord injury. https://www.who.int/news-room/fact-sheets/detail/spinal-cord-injury (дата обращения: 13.12.2022).
Список литературы
1. Якушин О.А., Агаджанян В.В., Новокшонов А.В. Анализ летальных исходов у пациентов с позвоночно-спиномозговой травмой в остром периоде. Политравма. 2019; (3): 55–60. EDN: CWGZER
2. O’Shea T.M., Burda J.E., Sofroniew M.V. Cell biology of spinal cord injury and repair. J Clin Invest. 2017; 127(9): 3259–3270. https://doi.org/10.1172/JCI90608. Epub 2017 Jul 24. PMID: 28737515
3. Parthiban J., Zileli M., Sharif S.Y. Outcomes of spinal cord injury: WFNS Spine Committee Recommendations. Neurospine 2020; 17 (4): 809–819. https://doi.org/10.14245/ns.2040490.245. PMID: 33401858
4. Alizadeh A., Dyck S.M., Karimi-Abdolrezaee S. Traumatic spinal cord injury: an overview of pathophysiology, models and acute injury mechanisms. Front Neurol. 2019; 10: 282. https://doi.org/10.3389/fneur.2019.00282. PMID: 30967837
5. Ren Y., Ao Y., O’Shea T.M., et al. Ependymal cell contribution to scar formation after spinal cord injury is minimal, local and dependent on direct ependymal injury. Sci Rep. 2017; 7: 41122. https://doi.org/10.1038/srep41122. PMID: 28117356
6. Sofroniew M.V. Astrocyte barriers to neurotoxic inflammation. Nat Rev Neurosci. 2015; 16(5): 249–263. https://doi.org/10.1038/nrn3898. Erratum in: Nat Rev Neurosci. 2015 Jun; 16(6): 372. PMID: 2589150
7. Klapka N., Müller H.W. Collagen matrix in spinal cord injury. J. Neurotrauma 2006 Mar-Apr; 23(3–4): 422–435. https://doi.org/10.1089/neu.2006.23.422. PMID: 16629627
8. Krupa P., Siddiqui A.M., Grahn P.J., et al. The translesional spinal network and its reorganization after spinal cord injury. Neuroscientist. 2022; 28(2): 163–179. https://doi.org/10.1177/1073858420966276. Epub 2020 Oct 22. PMID: 33089762
9. Khakh B.S., Sofroniew M.V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat Neurosci. 2015; 18(7): 942– 952. https://doi.org/10.1038/nn.4043. PMID: 2610872
10. Orr M.B., Gensel J.C. Spinal cord injury scarring and inflammation: therapies targeting glial and inflammatory responses. Neurotherapeutics. 2018; 15(3): 541–553. https://doi.org/10.1007/s13311-018-0631-6. PMID: 29717413
11. Chelyshev Y. More attention on segments remote from the primary spinal cord lesion site. Front Biosci (Landmark Ed). 2022; 27(8): 235. https://doi.org/10.31083/j.fbl2708235. PMID: 36042182
12. Mikita J., Dubourdieu-Cassagno N., Deloire M.S., et al. Altered M1/M2 activation patterns of monocytes in severe relapsing experimental rat model of multiple sclerosis. Amelioration of clinical status by M2 activated monocyte administration. Mult Scler. 2011; 17(1): 2–15. https://doi.org/10.1177/1352458510379243. Epub 2010 Sep 2. PMID: 20813772
13. Dyck S., Kataria H., Alizadeh A., et al. Perturbing chondroitin sulfate proteoglycan signaling through LAR and PTPσ receptors promotes a beneficial inflammatory response following spinal cord injury. J Neuroinflammation. 2018; 15(1): 90. https://doi.org/10.1186/s12974-018-1128-2. PMID: 29558941
14. Islamov R.R., Bashirov F.V., Sokolov M.E., et al. Gene-modified leucoconcentrate for personalized ex vivogene therapy in a mini pig model of moderate spinal cord injury. Neural Regen Res. 2021; 16(2): 357–361. https://doi.org/10.4103/1673-5374.290902. PMID: 32859798
15. Schomberg D.T., Miranpuri G.S., Chopra A., et al. Translational relevance of swine models of spinal cord injury. J Neurotrauma. 2017; 34(3): 541–551. https://doi.org/10.1089/neu.2016.4567. Epub 2016 Aug 25. PMID: 27492951
16. Nakajima H., Honjoh K., Watanabe S., et al. Distribution and polarization of microglia and macrophages at injured sites and the lumbar enlargement after spinal cord injury. Neurosci Lett. 2020; 737: 135152. https://doi.org/10.1016/j.neulet.2020.135152. Epub 2020 Jun 9. PMID: 32531528
17. Islamov R., Bashirov F., Izmailov A., et al. New therapy for spinal cord injury: autologous genetically-enriched leucoconcentrate integrated with epidural electrical stimulation. Cells. 2022; 11(1): 144. https://doi.org/10.3390/cells11010144. PMID: 35011706
Об авторах
Р. Р. ГарифулинРоссия
Гарифулин Равиль Расимович - аспирант кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
А. А. Измайлов
Россия
Измайлов Андрей Александрович - канд. мед. наук, ассистент кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
Тел.: +7 (950) 322-39-76
В. А. Маркосян
Россия
Маркосян Ваге Аршалуйсович - ассистент кафедры оперативной хирургии и топографической анатомии
ул. Бутлерова, д. 49, г. Казань, 420012
И. С. Минязева
Россия
Минязева Ирина Салаватовна - студентка
ул. Бутлерова, д. 49, г. Казань, 420012
В. В. Валиуллин
Россия
Валиуллин Виктор Владимирович - д-р биол. наук, профессор кафедры гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
Р. Р. Исламов
Россия
Исламов Рустем Робертович - д-р мед. наук, профессор, заведующий кафедрой гистологии, цитологии и эмбриологии
ул. Бутлерова, д. 49, г. Казань, 420012
Дополнительные файлы

|
1. ARRIVE чек-лист | |
| Тема | ||
| Тип | Прочее | |
Скачать
(86KB)
|
Метаданные ▾ | |







































