Перейти к:
Влияние введения неселективного ингибитора NO-синтазы в период беременности на развитие коры головного мозга двадцатисуточных крысят
https://doi.org/10.47093/2218-7332.2023.14.3.37-44
Аннотация
Цель. Изучить морфологические особенности нейронов коры головного мозга двадцатисуточных крысят в условиях введения ингибитора синтазы оксида азота (Nitric oxide synthase, NOS) в период плацентации.
Материалы и методы. Беспородных белых крыс-самок (n = 12) рандомно разделили на 2 группы по 6 крыс в каждой. На 11-е сутки беременности в опытной группе вводили однократно внутримышечно N(омега)-нитро-L-аргинин метиловый эфир (N(omega)-nitro-L-arginine methyl ester, L‑NAME) в дозе 25 мг/кг, в контрольной – однократно внутримышечно 0,9% раствор NaCl. Рожденных крысят отбирали рандомно по одному от матери. На 20-е сутки после медицинской эвтаназии осуществляли забор головного мозга. В переднем отделе фронтальной коры изучали плотность и площадь нейронов, размер и форму перикарионов, выраженность их окраски толуидиновым синим.
Результаты. В опытной группе по сравнению с контрольной плотность и площадь нейронов у двадцатисуточных крысят были меньше на 10% (p > 0,05) и 22% (p > 0,05) соответственно, также изменялась форма перикарионов на вытянутую, фактор элонгации увеличивался на 0,3 ед. (p < 0,05) и происходило шестикратное увеличение доли гиперхромных нейронов (p < 0,05), появлялись гиперхромные сморщенные (p < 0,001) нейроны, отсутствовавшие у контрольных животных.
Заключение. Морфологические изменения нейронов коры головного мозга у крысят, рожденных от самок, получивших в период плацентации ингибитор NOS, могут быть следствием снижения образования оксида азота в самих нейронах и в эндотелии сосудов, питающих головной мозг.
Список сокращений
- L-NAME – N(omega)-nitro-L-arginine methyl ester, N(омега)-нитро-L-аргинин метиловый эфир
- NO – Nitric oxide, оксид азота
- NOS – Nitric oxide synthase, синтаза оксида азота
Оксид азота (nitric oxide, NO) является ключевой сигнальной молекулой, вовлеченной в функционирование различных органов и систем, в том числе в регуляцию нейротрансмиссии, вазодилатации и воспалительных реакций [1]. Синтаза оксида азота (Nitric oxide synthase, NOS), катализирующая образование NO, имеет три изоформы в зависимости от типа клеток и тканей, в состав которых она входит [2]. Нейрональная NOS (nNOS), ответственная за синтез NO нейронами, участвует в передаче сигналов нейронов, эндотелиальная NOS (eNOS) – в вазодилатации, а индуцибельная NOS (iNOS) – в иммунных ответах.
В центральной нервной системе локализованы все изоформы NOS. Синтезируемый NO участвует в регуляции кровообращения головного мозга, передачи сигнала в синапсах как ретроградный нейромедиатор и играет значимую роль во внутриклеточной передаче сигналов в нейронах – от регуляции их метаболического статуса до роста дендритных отростков. В период эмбриогенеза NO также участвует в формировании центральной и периферической нервной системы, в частности в дифференцировке нейронов, становлении синаптогенеза и церебрального кровотока [3][4].
Снижение образования NO служит главным механизмом запуска такого патологического процесса, как дисфункция эндотелия. Так, в период беременности это приводит к патологии маточно-плацентарного кровотока, нарушениям антенатального развития плода [5][6] и преэклампсии [7][8]. Тяжелый гестоз усугубляет состояние, связанное с нарушением функции плаценты, с ее васкуляризацией и часто осложняется преждевременными родами и различной патологией развития плода [9][10].
Нарушение метаболизма NO моделируется посредством введения неселективного ингибитора NO-синтазы – N(омега)-нитро-L-аргинин метилового эфира (N(omega)-nitro-L-arginine methyl ester, L-NAME) [11]. Применение L-NAME приводит к резкому уменьшению содержания нитрит-ионов за счет снижения экспрессии eNOS в эндотелии сосудов [2].
Применение L-NAME является широко используемой моделью экспериментальной преэклампсии [11], используется чаще всего на мышах и крысах [12]. В экспериментах при введении L-NAME беременным крысам наблюдалось развитие патологии, по своим клиническим проявлениям соответствующей гестозу: статистически значимо повышалось систолическое артериальное давление, снижалась микроциркуляция в плаценте, а также увеличивалась протеинурия [13][14]. Есть данные о неблагоприятном воздействии L-NAME на сердечно-сосудистую систему, снижении перфузии маточно-плацентарного ложа, уменьшении веса плаценты и веса потомства [15][16]. Однако влияние экспериментального ингибирования NOS в период плацентации на последующие структурные изменения нейронов в головном мозге плода изучено недостаточно.
Цель – изучить морфологические особенности нейронов коры головного мозга крысят на 20-е сутки постнатального развития в условиях введения неселективного ингибитора NO-синтазы (L-NAME) в период плацентации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 12 беспородных белых крысах-самках одного возраста (110 ± 10 дней) из одной популяции из вивария Гродненского государственного медицинского университета массой 300 ± 20 г и их потомстве. Животных содержали в стандартных поликарбонатных клетках объемом 16 300 см³. Кормление осуществляли с использованием сертифицированного сбалансированного гранулированного корма для грызунов и фильтрованной водопроводной воды ad libitum. Крысы находились в отдельных помещениях для содержания лабораторных животных в контролируемых условиях окружающей среды (20–26 °C при относительной влажности 30–70%) с 12-часовым циклом освещения и 10-кратной сменой объема воздуха в час.
Беспородных белых самцов массой 380 ± 20 г из расчета 1 самец на 3 самки подсаживали к последним после 18.00 для оплодотворения, а выявление беременности проводили на следующий день до 9.00 утра по наличию сперматозоидов во влагалищных мазках. После оплодотворения самок содержали по 1 особи в клетке в одинаковых условиях, после родов – вместе с родившимся потомством. Для всех самок наступившая беременность была первой.
Беременных крыс опытной и контрольной групп рандомно разделили на 2 группы по 6 самок в каждой. Крысам опытной группы вводили L-NAME в дозе 25 мг/кг на 11-е сутки беременности (период плацентации) однократно внутримышечно. Доза выбрана согласно данным литературы [11]. Контрольной группе вводили 0,9% раствор NaCl однократно внутримышечно в тот же срок беременности. Роды наступали на 24 ± 2 день беременности.
После родов крысята содержались в клетках со своими матерями при вышеописанных условиях. Формирование выборки животных производилось случайным образом с исключением крысят с явными анатомическими и/или поведенческими особенностями. Взятие головного мозга осуществляли на 20-е сутки постнатального развития – в период пубертатного возраста и завершения базового синаптогенеза. Выведение крысят из эксперимента осуществлялось при помощи эфирного наркоза с последующей быстрой декапитацией. Далее извлекали головной мозг, кусочки переднего отдела коры больших полушарий фиксировали в жидкости Карнуа. Готовили серийные парафиновые срезы, которые окрашивали 0,1% толуидиновым синим по методу Ниссля [17].
Изучение гистологических препаратов, микрофотографирование, морфометрию нейронов проводили с помощью микроскопа Axioscop 2 plus (Zeiss, Германия), цифровой видеокамеры Leica DFC320 (Leica Camera AG, Германия) и программы анализа изображения ImageWarp (Bitflow, США). Расположение фронтальной коры в гистологических препаратах мозга крысят определяли с помощью стереотаксического атласа [17]. У каждого животного контрольной группы оценивали не менее 30 нейронов, а экспериментальной – 150 нейронов пятого слоя коры головного мозга, что обеспечивало достаточный объем выборки для последующего анализа.
В данном исследовании были изучены размеры и форма нервных клеток (мкм²), а также выраженность их окраски толуидиновым синим [18]. С целью более точного подсчета нейронов разной степени хроматофилии цитоплазмы в фотографии гистологического препарата моделировалась сетка с ее последующим наложением на фото изучаемой области головного мозга в программе Microsoft Word (Microsoft Office, США). Сетка представляет собой таблицу, соответствующую размеру полученного изображения (123×165 мм), с десятью равными ячейками размером 24,7×33,0 мм. Во всех ячейках сетки, соответствующей площади участка гистологического препарата с учетом увеличения микроскопа, осуществлялся подсчет нейронов разной степени хроматофилии цитоплазмы (нормохромные, гипохромные, гиперхромные, гиперхромные сморщенные) с последующим определением их процентного содержания к общему количеству нейронов в сетке или абсолютного количества на 1 мм².
Для изучения размеров и формы перикарионов измеряли площадь, фактор элонгации (отношение максимального и минимального диаметров) и формфактор (отношение 4-х площадей к периметру в квадрате) в условных единицах. Для наглядного отображения формы нейронов коры головного мозга использовался шаблон геометрической фигуры овала в программе Microsoft Word (Microsoft Office, США) с указанием параметров «ширина» – Ш и «высота» – В. Параметры овала задавались в окне свойств фигуры «Размер» пропорционально геометрическим размерам нейронов.
Представленная работа является продолжением опубликованной нами ранее работы [19], в которой мы изучали эти же параметры у новорожденных крысят в аналогичных условиях.
Статистический анализ
В результате гистологических исследований получены количественные непрерывные данные, которые обрабатывали с помощью программы Statistica 13.0 (TIBCO, США). Так как в эксперименте использованы малые выборки, которые имели ненормальное распределение, анализ проводили методами непараметрической статистики. Данные представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили) [20]. Для сравнения групп применялся критерий Манна – Уитни, критерий хи-квадрат Пирсона. Различия между показателями считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
При изучении плотности расположения нейронов на 1 мм² фронтальной коры головного мозга у двадцатисуточных крысят была выявлена тенденция к уменьшению на 10% количества клеток у потомства, рожденного самками с пренатальным введением L-NAME, в сравнении с контрольной группой (p > 0,05).
Также в опытной группе выявлена тенденция к уменьшению площади нейронов на 22% (разница между группами не значима) и изменение формы перикарионов в сторону их большей вытянутости за счет статистически значимого увеличения фактора элонгации на 0,3 ед., в то время как форм-фактор не изменялся (табл.).
Таблица. Размеры и форма перикарионов пятого слоя
фронтальной коры головного мозга двадцатисуточных крысят
в условиях пренатального введения L-NAME
на 11-е сутки беременности
Table. Sizes and shape of perikaryons in the fifth layer brain frontal cortex
of 20-day-old rat pups under L-NAME prenatal injection
on the 11th day of pregnancy
|
Характеристика / |
Контрольная группа / |
Опытная группа / |
Значение р / |
|
Плотность на 1 мм2 / Density per 1 mm2 |
6122 (6048; 7189) |
5494 (4690; 7504) |
0,06 |
|
Площадь (мкм²) / area (µm²) |
111,5 (94,6; 118,9) |
87,2 (73,1; 112,2) |
0,20 |
|
Фактор элонгации, ед / Elongation factor, ed. |
1,19 (1,19; 1,23) |
1,51 (1,35; 1,69) |
0,04 |
|
Форм-фактор / Form factor |
0,87 (0,85; 0,88) |
0,77 (0,78; 0,84) |
0,80 |
|
Форма нейронов / Shape of neurons |
|
|
У двадцатисуточных крысят контрольной группы в пятом слое фронтальной коры головного мозга преобладали нормохромные нейроны (рис. 1).
Доли нейронов с различной выраженностью окраски статистически значимо различались в исследованных группах. В опытной группе животных, рожденных самками с пренатальным введением L-NAME, отмечалось уменьшение доли нормохромных нейронов до 80% (по сравнению с 95% в контрольной), шестикратное увеличение доли гиперхромных нейронов, появление гиперхромных сморщенных нейронов. По долям гипохромных нейронов группы не различались (рис. 2).
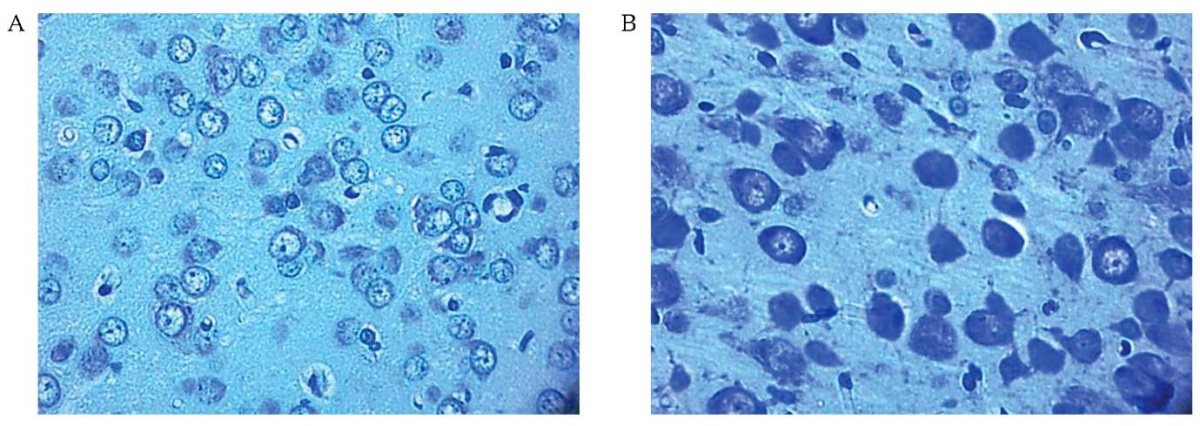
РИС. 1. Нейроны фронтальной коры головного мозга
20-суточных крысят в условиях пренатального введения L-NAME
на 11-е сутки беременности.
Цифровая микрофотография.
Окраска по методу Ниссля, ув. 400, об. 40, ок. 10.
A – контрольная группа.
В – экспериментальная группа: потомство, рожденное самками
с пренатальным введением L-NAME.
FIG. 1. Frontal cortex neurons of 20 day-old rats
under L-NAME prenatal injection on the 11th day of pregnancy.
Digital photomicrograph.
Nissl staining, magnification 400, ob. 40, oc. 10.
A – control group.
B – experimental group: offspring born to females
with prenatal administration of L-NAME.

РИС. 2. Соотношение нейронов с различной степенью хроматофилии
цитоплазмы пятого слоя фронтальной коры головного мозга
двадцатисуточных крысят в условиях пренатального введения L-NAME
на 11-е сутки беременности.
FIG. 2. The ratio of neurons with different degrees of cytoplasmic chromatophily
of the fifth layer of the frontal cortex in 20 day-old rats
under L-NAME prenatal injection on the 11th day of pregnancy.
ОБСУЖДЕНИЕ
Введение L-NAME – неселективного ингибитора NO-синтазы на 11-е сутки беременности (период плацентации) приводило у двадцатисуточных крысят опытной группы к уменьшению доли нормохромных нейронов, увеличению доли гиперхромных нейронов и появлению гиперхромных сморщенных нейронов, отсутствовавших у крысят контрольной группы. Также при введении L-NAME отмечалась тенденция к снижению плотности расположения нейронов в пятом слое коры головного мозга, форма изменялась из круглой на вытянутую. Данный эффект при введении L-NAME может быть обусловлен снижением образования NO как в нейронах, так и в эндотелии сосудов, что ведет к нарушению клеточного метаболизма, вазодилататорных компенсаторных механизмов с развитием ишемии и водно-электролитного дисбаланса, в порочном круге усугубляющих деформацию тел нейронов и их сморщивание [21][22].
В нашей предыдущей работе [19], выполненной на новорожденных крысятах, рожденных в аналогичных условиях, в группе после введения L-NAME фактор элонгации был равен 1,24 (1,21; 1,30) ед., форм-фактор 0,87 (0,81; 0,88), доля нормохромных нейронов составила 95%, гипохромных и гиперхромных – по 2,5%, гиперхромных сморщенных нейронов не было выявлено. Полученные данные в представленной работе могут свидетельствовать о развитии и прогрессировании постнатальных изменений в центральной нервной системе крысят, подвергнутых введению неселективного ингибитора NO-синтазы в период плацентации.
Предполагается, что интенсивная окраска цитоплазмы нейронов характеризует преобладание образования белка над его утилизацией. Некоторые исследователи расценивают гиперхромные нейроны как гиперфункциональные и считают, что синтезированный ими белок идет на их собственные потребности [23]. Хотя многие авторы изучали гиперхромные нейроны, тем не менее сведения о них весьма противоречивы и вынести по ним суждение о сущности и функциональном значении данного явления довольно трудно [23][24].
Существует мнение, согласно которому появление гиперхромных и гиперхромных сморщенных нейронов связано со снижением их функциональной активности и отражает происходящие в них процессы торможения. Подтверждением низкой функциональной активности гиперхромных сморщенных нейронов служат описываемые в литературе результаты электронно-микроскопического и ауторадиографического исследования, показывающие двукратное снижение скорости выведения вновь синтезированной рибонуклеиновой кислоты из ядра в цитоплазму клетки [22]. Описанные в литературе данные об электронной микроскопии гиперхромных несморщенных нейронов свидетельствуют о содержании большого количества канальцев гранулярной эндоплазматической сети в описанных клетках [24]. Также, в них повышено и количество свободных рибосом. В то же время гиперхромные нейроны имеют меньшее число митохондрий по сравнению с нормохромными. Ядра и цитоплазма гиперхромных сморщенных нейронов темные и покрыты многочисленными складками. Для данного типа нейронов характерны дезорганизация и деструктивные изменения органелл, наблюдается значительное расширение канальцев гранулярной эндоплазматической сети и комплекса Гольджи, свободные рибосомы образуют поля и скопления, отмечается набухание митохондрий и деградация их крист [23].
ЗАКЛЮЧЕНИЕ
Введение крысам в период плацентации неселективного ингибитора NO-синтазы L-NAME приводит к морфологическим нарушениям нейронов фронтальной коры головного мозга крысят, проявляющимся в пубертатном возрасте уменьшением размеров клеток, увеличением доли гиперхромных и появлением гиперхромных сморщенных нейронов наряду с уменьшением доли нормохромных нейронов, что, по всей видимости, является следствием снижения образования оксида азота как в самих нейронах, так и в эндотелии сосудов, питающих головной мозг.
ВКЛАД АВТОРОВ
Н.Е. Максимович внесла основной вклад в разработку концепции и дизайна исследования, руководила процессом написания статьи. Т.С. Русак, Е.И. Бонь провели эксперимент с животными, статистическую обработку данных и редактирование статьи. А.Д. Бернацкая, А.С. Кусмарцева внесли вклад в поиск литературных источников, а также подготовили иллюстрации. Все авторы одобрили окончательный вариант статьи и готовы взять на себя ответственность за все аспекты представленной публикации.
AUTHOR CONTRIBUTIONS
Nataliya Ye. Maksimovich made the main contribution to the development of the concept and design of the study, supervised the process of writing the article. Tatiana S. Rusak, Elizaveta I. Bon made an experiment with animals, carried out statistical data processing and editing the article. Anna D. Bernatskaya, Angelina S. Kusmartseva contributed to the literature review and prepared illustrations. All authors approved the final version of the article and are ready to take responsibility for all aspects of the submitted publication.
Соответствие принципам этики. Исследование проведено с соблюдением положений Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей. Все манипуляции с животными проведены в соответствии с разрешением Локального этического комитета УО «Гродненский государственный медицинский университет» (№ 6-03.11.2022).
Доступ к данным исследования. Данные, подтверждающие выводы этого исследования, можно получить у авторов по обоснованному запросу.
Данные и статистические методы, представленные в статье, прошли статистическое рецензирование редактором журнала – сертифицированным специалистом по биостатистике.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Ethics statements. The study complies with the standards of the EU Directive for the Protection of the Vertebrate Animals used for Experimental and other Scientific Purposes. Аll manipulations with animals were approved by the Local Bioethics Committee of the Grodno State Medical University, No. 6 of 03.11.2022.
Data availability. The data that support the findings of this study are available from the corresponding authors on reasonable request. Data and statistical methods used in the article were examined by a professional biostatistician on the Sechenov Medical Journal editorial staff.
Conflict of interests. The authors declare that there is no conflict of interests.
Financial support. The study was not sponsored (own resources).
Список литературы
1. Tricoire L., Vitalis T. Neuronal nitric oxide synthase expressing neurons: a journey from birth to neuronal circuits. Front Neural Circuits. 2012 Dec 5; 6: 82. https://doi.org/10.3389/fncir.2012.00082. PMID: 23227003; PMCID: PMC3514612
2. Dagdeviren M. Role of nitric oxide synthase in normal brain function and pathophysiology of neural diseases. Nitric oxide synthase – simple enzyme-complex roles. InTech; 2017. 248 p. https://dx.doi.org/10.5772/67267. ISBN 978-953-51-4837-1
3. Leon R.L., Mir I.N., Herrera C.L., et al. Neuroplacentology in congenital heart disease: placental connections to neurodevelopmental outcomes. Pediatr. Res. 2022. 91(4): 787–794. https://doi.org/10.1038/s41390-021-01521-7. Epub 2021 Apr 16. PMID: 33864014; PMCID: PMC9064799
4. Picón-Pagès P., Garcia-Buendia J., Muñoz F.J. Functions and dysfunctions of nitric oxide in brain. Biochimica et Biophysica Acta (BBA) – Molecular Basis of Disease. 2019; 1865(8): 1949–1967. https://doi.org/10.1016/j.bbadis.2018.11.007
5. Сидорова И.С, Никитина Н.А., Унанян А.Л., Агеев М.Б. Развитие головного мозга плода и влияние пренатальных повреждающих факторов на основные этапы нейрогенеза. Российский вестник акушера-гинеколога. 2022; 22(1): 35–44. https://doi.org/10.17116/rosakush20222201135
6. Kratimenos P., Penn A.A. Placental programming of neuropsychiatric disease. Pediatr. Res. 2019. 86(2): 157–164. https://doi.org/10.1038/s41390-019-0405-9. Epub 2019 Apr 19. PMID: 31003234
7. Dambrova M., Chlopicki S., Liepinsh E., et al. The methylester of gamma-butyrobetaine, but not gamma-butyrobetaine itself, induces muscarinic receptor-dependent vasodilatation. Naunyn Schmiedebergs Arch Pharmacol. 2004 May; 369(5): 533–539. https://doi.org/10.1007/s00210-004-0925-6. Epub 2004 Apr 2. PMID: 15060760
8. Szpera-Gozdziewicz A., Breborowicz G.H. Endothelial dysfunction in the pathogenesis of pre-eclampsia. Front. Biosci. 2014; 19(5): 734–746. https://doi.org/10.2741/4240
9. Moran M.C., Mulcahy C., Zombori G., et al. Placental volume, vasculature and calcification in pregnancies complicated by pre-eclampsia and intra-uterine growth restriction. Eur J Obstet Gynecol Reprod Biol. 2015 Dec; 195: 12–17. https://doi.org/10.1016/j.ejogrb.2015.07.023. Epub 2015 Aug 7. PMID: 26461962
10. Каптильный В.А., Рейштат Д.Ю. Преэклампсия: определение, новое в патогенезе, методические рекомендации, лечение и профилактика. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2020; 7(1): 19–30. https://doi.org/10.18821/2313-8726-2020-7-1-19-30
11. Гуреев В.В., Корокин М.В., Голубев И.В. и др. Коррекция функциональных нарушений при ADMA-подобной преэклампсии производными пептида, имитирующего α-спираль B эритропоэтина. Курский научно-практический вестник «Человек и его здоровье». 2020; (2): 42–49. https://doi.org/10.21626/vestnik/2020-2/06
12. Gatford K.L., Andraweera P.H., Roberts C.T., Care A.S. Animal models of preeclampsia: causes, consequences, and interventions. Hypertension. 2020 Jun; 75(6): 1363–1381. https://doi.org/10.1161/HYPERTENSIONAHA.119.14598. Epub 2020 Apr 6. PMID: 32248704
13. Климов В.А. Эндотелий фетоплацентарного комплекса при физиологическом и патологическом течении беременности. Акушерство и гинекология. 2008; 2: 7–9
14. de Souza C.O., Peraçoli M.T.S., Weel I.C., et al. Hepatoprotective and anti-inflammatory effects of silibinin on experimental preeclampsia induced by L-NAME in rats. Life Sciences. 2012; 91(5–6): 159–165. https://doi.org/10.1016/j.lfs.2012.06.036
15. Музыко Е.А., Перфилова В.Н., Кустова М.В. Отдаленные последствия у потомства, рожденного крысами с экспериментальной преэклампсией. Медицинский вестник Северного Кавказа. 2020; 15(3): 355–359. https://doi.org/10.14300/mnnc.2020.15084
16. Lotfullina N., Khazipov R. Ethanol and the developing brain: inhibition of neuronal activity and Neuroapoptosis. Neuroscientist. 2018 Apr; 24(2): 130–141. https://doi.org/10.1177/1073858417712667. Epub 2017 Jun 5. PMID: 28580823
17. Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 7th Edition, 2013. Hardback ISBN: 9780123919496. eBook ISBN: 9780124157521
18. Бонь Е.И., Максимович Н.Е., Зиматкин С.М. Морфологические изменения в теменной коре крыс после субтотальной ишемии головного мозга и на фоне введения L-NAME. Вестник ВГМУ. 2019; 18(1): 14–20. https://doi.org/10.22263/2312-4156.2019.1.14
19. Rusak T.S., Bon E.I., Maksimovich N.Ye, Martsun P.V. Effect of administration of a non-selective No Synthase inhibitor during pregnancy on cortical development in newborn rats. J Psych and Neuroche Res. 2023; 1(1): 01–03.
20. Буланов Н.М., Суворов А.Ю., Блюсс О.Б. и др. Основные принципы применения описательной статистики в медицинских исследованиях. Сеченовский вестник. 2021; 12(3): 4–16. https://doi.org/10.47093/2218-7332.2021.12.3.4-16
21. Максимович Н.Е. Понятие о нитроксидергической системе мозга (роль экстранейрональных источников). Журнал Гродненского государственного медицинского университета. 2015; 1(5): 3–5. https://journal-grsmu.by/index.php/ojs/article/view/1631
22. Baracskay P., Szepesi Z., Orbán G., et al. Generalization of seizures parallels the formation of “dark” neurons in the hippocampus and pontine reticular formation after focal-cortical application of 4-aminopyridine (4-AP) in the rat. Brain Res. 2008. 1228: 217–228. https://doi.org/10.1016/j.brainres.2008.06.044
23. Бонь Е.И., Максимович Н.Е., Зиматкин С.М. Морфологические особенности нейронов теменной коры и гиппокампа крыс после субтотальной церебральной ишемии на фоне введения омега-3 полиненасыщенных жирных кислот. Сибирский научный медицинский журнал. 2020; 40(3): 34–40. https://doi.org/10.15372/SSMJ20200305
24. Zimatkin S.M., Bon’ E.I. Dark Neurons of the brain. Neurosci Behav Physi. 2018; 48: 908–912. https://doi.org/10.1007/s11055-018-0648-7
Об авторах
Т. С. РусакБеларусь
Русак Татьяна Сергеевна - ассистент кафедры патологической физиологии им. Д.А. Маслакова
ул. Горького, д. 80, г. Гродно, 230009
Тел.: +375 29 284-68-74
Н. Е. Максимович
Беларусь
Максимович Наталия Евгеньевна - д-р мед. наук, профессор, заведующая кафедрой патологической физиологии им. Д.А. Маслакова
ул. Горького, д. 80, г. Гродно, 230009
Е. И. Бонь
Беларусь
Бонь Елизавета Игоревна - канд. биол. наук, доцент кафедры патологической физиологии им. Д.А. Маслакова
ул. Горького, д. 80, г. Гродно, 230009
А. Д. Бернацкая
Беларусь
Бернацкая Анна Дмитриевна - студентка
ул. Горького, д. 80, г. Гродно, 230009
А. С. Кусмарцева
Беларусь
Кусмарцева Ангелина Сергеевна - студентка
ул. Горького, д. 80, г. Гродно, 230009
Дополнительные файлы

|
1. Чек-лист ARRIVE 2.0 | |
| Тема | ||
| Тип | Прочее | |
Скачать
(105KB)
|
Метаданные ▾ | |









































