ВНУТРЕННИЕ БОЛЕЗНИ
Цель. Изучить распространенность признаков пневмонии, ассоциированной с коронавирусной инфекцией 2019 года (Coronavirus Disease 2019, COVID-19), у онкологических пациентов по данным компьютерной томографии (КТ) органов грудной клетки с помощью алгоритма искусственного интеллекта (ИИ).
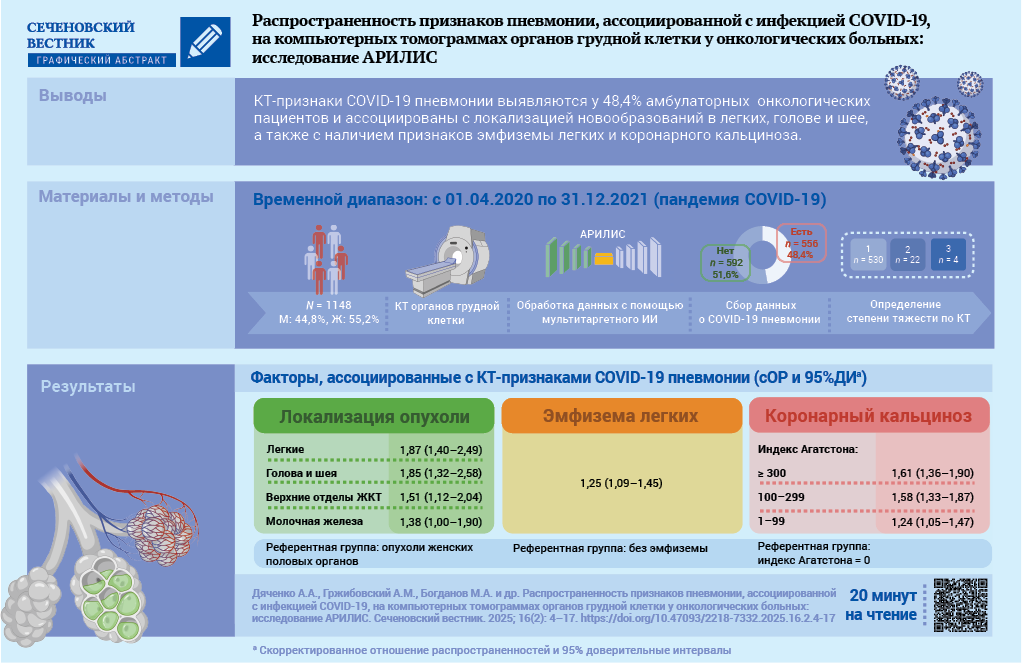
Материалы и методы. Проведено поперечное исследование в рамках проекта АРИЛИС. С помощью мультитаргетного ИИ проанализированы изображения КТ 1148 пациентов, проходивших обследование в Архангельском клиническом онкологическом диспансере за период с 01.04.2020 по 31.12.2021. Пациенты разделены на группы: без признаков пневмонии (n = 592, 51,6%) и с признаками пневмонии (n = 556, 48,4%). У 95,3% пациентов с пневмонией объем поражения составил менее 25% (КТ-1). С помощью многомерной регрессии Пуассона рассчитывали скорректированные отношения распространенностей (сОР, adjusted prevalence ratio) с 95% доверительными интервалами (ДИ).
Результаты. Для демографических признаков: пол, возраст, место жительства связи с наличием признаков пневмонии COVID-19 не установлено. Локализация опухоли ассоциирована с наличием признаков пневмонии COVID-19 (референтная группа – опухоли женских половых органов): рак легкого – сОР 1,87; 95% ДИ: 1,40–2,49; опухоли головы и шеи – сОР 1,85; 95%ДИ: 1,32–2,58; верхние отделы желудочно-кишечного тракта – сОР 1,51; 95% ДИ: 1,12–2,04; рак молочной железы – сОР 1,38; 95% ДИ: 1,00–1,90; р < 0,01. Наличие эмфиземы легких ассоциировано с признаками пневмонии COVID-19: сОР 1,25; 95% ДИ: 1,09–1,45, р = 0,002. С увеличением индекса Агатстона (Agatston score, AS) кальциноза коронарных артерий (референтная группа без кальциноза) увеличивалась ассоциация с наличием признаков пневмонии COVID-19 – для AS 1–99: сОР 1,24; 95% ДИ: 1,05–1,47; AS 100–299: сОР 1,58; 95% ДИ: 1,33–1,87; AS 300 и выше: сОР 1,61; 95% ДИ: 1,36–1,90; р < 0,001 для линейного тренда.
Заключение. Факторами, ассоциированными с выявлением пневмонии COVID-19, являются локализация новообразований в легком, органах головы и шеи, верхних отделах желудочно-кишечного тракта, молочной железе, а также наличие признаков эмфиземы и коронарного кальциноза по данным КТ.
ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ
Цель. Оценить влияние этамзилата на активацию сигнальных путей, регулирующих агрегацию тромбоцитов, при макрогематурии, возникающей после контактной уретеролитотрипсии (КЛТ).
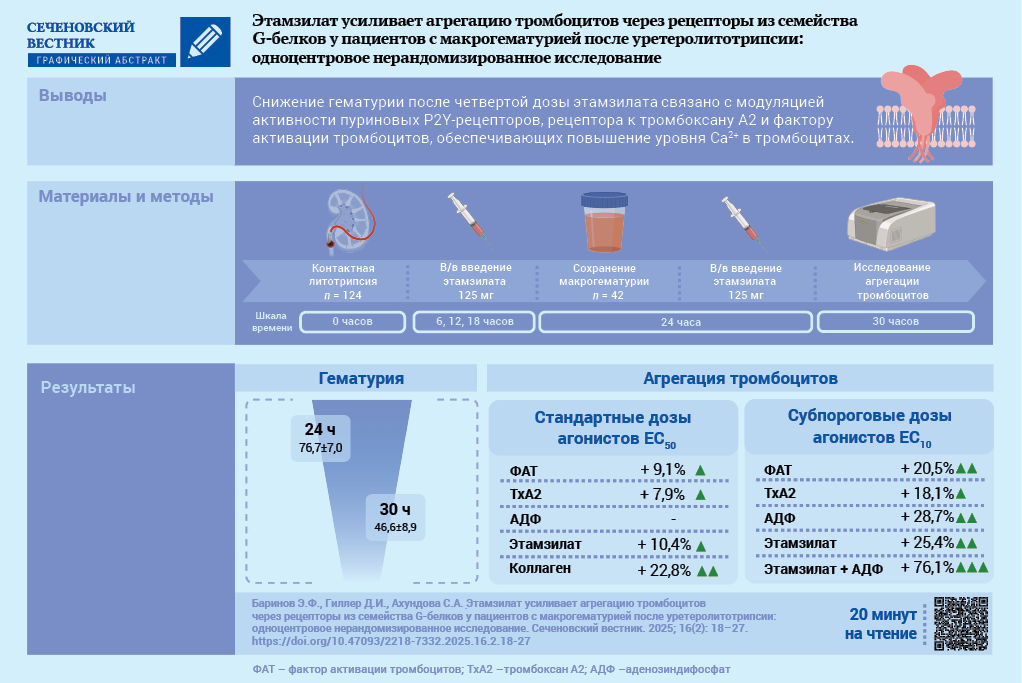
Материал и методы. Для участия в исследовании оценены 192 пациента, которым проводилась КЛТ с последующим введением этамзилата. Все пациенты принимали нестероидные противовоспалительные препараты. В анализ включены 42 пациента (20 мужчин, 22 женщины, средний возраст 54,2 ± 15,1 года), у которых после введения трех доз этамзилата (125 мг в/в первая доза через 6 часов после КЛТ, далее каждые 6 часов) сохранялась макрогематурия. До и после введения четвертой дозы этамзилата (125 мг в/в) оценена активность рецепторов тромбоцитов при введении стандартных (ЕС50) и субпороговых (ЕС10) концентраций агонистов: эпинефрин, аденозинтрифосфат, аденозиндифосфат (АДФ), аденозин, фактор активации тромбоцитов (ФАТ), растворимый коллаген IV типа и стабильный аналог тромбоксана А2.
Результаты. После введения четвертой дозы этамзилата макрогематурия статистически значимо снижалась по сравнению с показателем до введения: 46,6 ± 8,9 vs. 76,7 ± 7,0 эритроцитов в поле зрения (р < 0,001). После введения четвертой дозы этамзилата при использовании стандартных доз агонистов (ЕС50) повышалась активность ФАТ-рецептора на 9,1% (р = 0,007), ТР-рецептора (thromboxane prostanoid, тромбоксан простаноид) – на 7,9% (р = 0,006), GPVI-рецептора (Glycoprotein VI, гликопротеин VI) – на 22,8% (р < 0,001), агрегация тромбоцитов, индуцированной этамзилатом, – на 10,4% (р < 0,05). Максимальный эффект агрегации после введения четвертой дозы этамзилата при использовании субпороговых (ЕС10) концентраций агонистов обнаружен при инкубации тромбоцитов одновременно с этамзилатом и АДФ: амплитуда, Slope и AUC (area under curve, площадь под кривой) были выше на 16,9, 60,0 и 54,7% соответственно относительно таковых при изолированной стимуляции P2Y-рецепторов (р < 0,05) и на 26,2, 77,2 и 65,6% больше, чем при инкубации тромбоцитов только с этамзилатом (р < 0,05).
Заключение. Максимальный проагрегантный эффект этамзилата осуществлялся посредством Р2Y- рецепторов, также отмечена модуляция ТР-рецепторов и ФАТ-рецепторов, обеспечивающих повышение уровня внутриклеточного Са2+.
ХИРУРГИЯ
Цель. Оценить краткосрочные результаты неоперативного лечения (НОЛ) тупой травмы селезенки и прогностические факторы эффективности НОЛ в больнице третьего уровня.
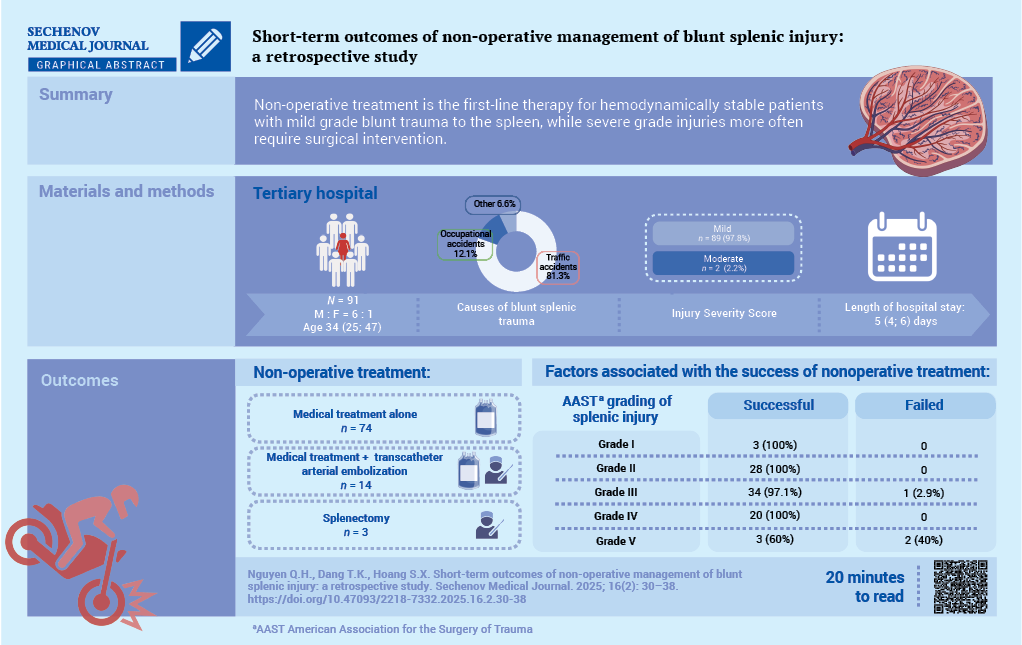
Материалы и методы. Исследуемая когорта включала 136 пациентов с разрывом селезенки в результате тупой травмы живота, проходивших лечение в Народной больнице 115, Хошимин, Вьетнам, в период с января 2021 по декабрь 2023 года. НОЛ было применено в 91 случае (66,9%). Для анализа собирались демографические данные пациентов, характеристики травмы, вид терапевтических вмешательств, характер осложнений и результаты лечения.
Результаты. Средний возраст среди 91 пациента, получавшего НОЛ, составил 34 (25; 47) года, соотношение мужчин и женщин – 6:1. Большинство разрывов селезенки (81,3%) произошло в результате дорожнотранспортных происшествий. Клинические симптомы включали: боль в животе (98,9%) и вздутие (27,5%). Результаты компьютерной томографии брюшной полости в соответствии с классификацией Американской ассоциации хирургии травм (American Association for the Surgery of Trauma, AAST) выявили преимущественно повреждения селезенки II и III степени (30,8 и 38,5% соответственно). Объем гемоперитонеума статистически значимо коррелировал с тяжестью травмы (p = 0,029). НОЛ было эффективно у 88 пациентов (96,7%), тогда как трем пациентам (3,3%) потребовалась спленэктомия. Медиана пребывания в больнице составила 5 (4; 6) дней. Медиана объема переливания крови – 937,5 ± 340,9 мл. Летальных исходов не наблюдалось.
Заключение. Наши результаты подтверждают, что НОЛ следует рассматривать как терапию первой линии для гемодинамически стабильных пациентов с тупой травмой селезенки, поскольку оно безопасно устраняет необходимость хирургического вмешательства и ассоциированных с ним осложнений.
ОНКОЛОГИЯ
Цель. Оценить диагностические возможности совмещенной позитронно-эмиссионной томографии (ПЭТ) с накоплением 18-фтордезоксиглюкозы и компьютерной томографии (КТ), дополненных 3D-визуализацией DICOM-файлов с помощью программы 3D Slicer, в выявлении опухолевой инвазии парагастральной клетчатки при местнораспространенном раке желудка.
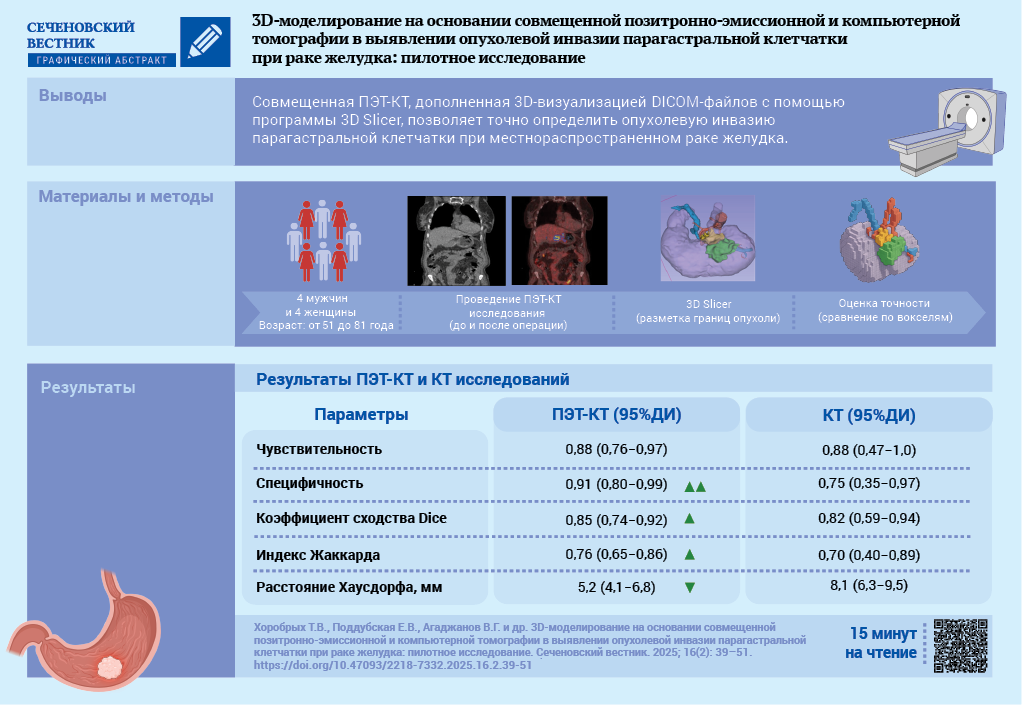
Материалы и методы. Проведено открытое проспективное исследование в рамках научно-исследовательского проекта «SmartGastro». В исследование включены 4 женщины и 4 мужчин в возрасте от 51 до 81 года с гистологически подтвержденным диагнозом «рак желудка». Всем пациентам выполняли совмещенную ПЭТ-КТ по протоколу «Whole body» на 60–80-й минуте после введения радиофармпрепарата (РФП). Обработка полученных результатов включала визуальный анализ КТ- и ПЭТ-изображений как по отдельности, так и совмещенных сканов, а также 3D-реконструкцию на основании денситометрического анализа DICOM-данных. Все пациенты были прооперированы. Удаленный макропрепарат поэтапно иссечен по периметру с последующим гистологическим исследованием краев резекции (парагастральной клетчатки). Во всех случаях подтверждена радикальность вмешательства R0. Первичную разметку границ опухоли по ПЭТ-КТ и КТ сравнивали по вокселям со вторичной разметкой, выполненной на основании визуального анализа удаленного макропрепарата.
Результаты. Компрометированная периопухолевая паракардиальная клетчатка по КТ в 5 из 8 наблюдений соответствовала зонам накопления РФП по ПЭТ. Участки повышенного накопления РФП в периопухолевой клетчатке и повышение денситометрической плотности этих же участков по данным КТ соответствовали истинной инвазии, подтвержденной при вторичной разметке, в 6 из 8 случаев. Чувствительность первичной разметки по совмещенной ПЭТ-КТ в сравнении по вокселям со вторичной разметкой составила 0,88 (95% доверительный интервал (ДИ) 0,76–0,97), специфичность – 0,91 (95% ДИ 0,80–0,99), расхождение границ опухоли, рассчитанное по расстоянию Хаусдорфа, составило 5,2 мм при средних размерах опухоли 38×30×39 мм.
Заключение. Совмещенная ПЭТ-КТ позволяет точно определить области компрометированного мезослоя жировой клетчатки. Создание 3D-моделей компрометированных опухолевым процессом парагастральных тканей в сочетании с визуализацией опухоли желудка и сосудов способствует комплексному предоперационному планированию онкологических операций.
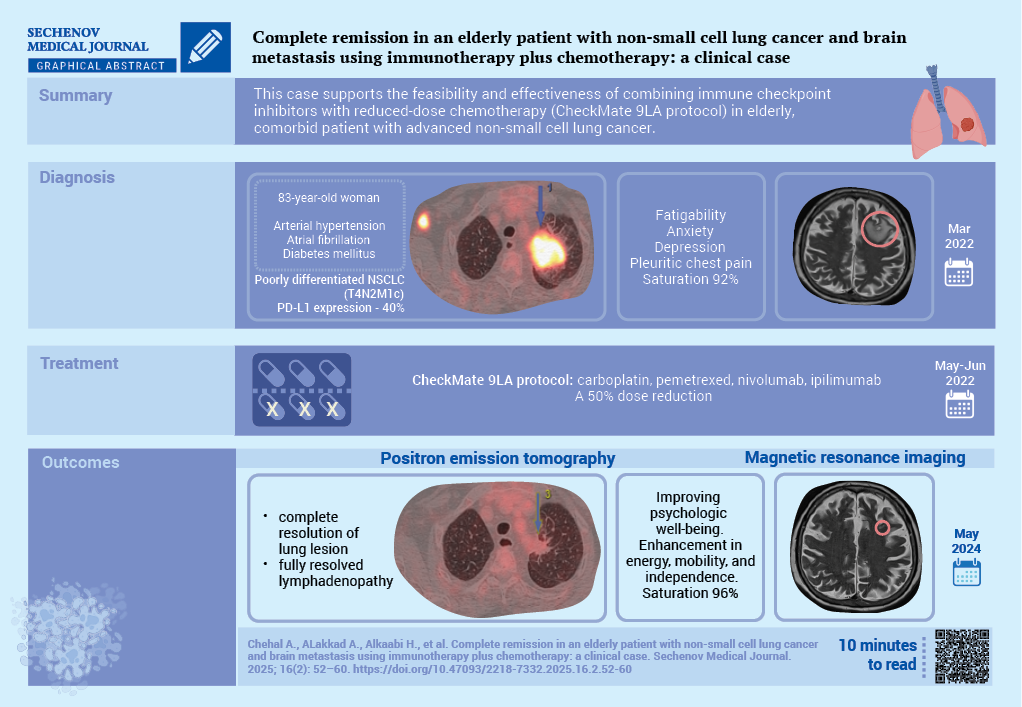
Рак легкого остается одной из ведущих причин онкологической смертности, большинство случаев приходится на немелкоклеточный рак легкого (НМРЛ). Среди его подтипов наиболее распространена аденокарцинома. Четвертая стадия НМРЛ характеризуется неблагоприятным прогнозом, особенно у пожилых пациентов с сопутствующими заболеваниями. Ингибиторы контрольных точек PD-L1 (Programmed death-ligand 1, лиганд 1 белка программируемой клеточной смерти) продемонстрировали обнадеживающую эффективность, в том числе в случаях с метастазами в головной мозг.
Описание случая. У 83-летней женщины с сахарным диабетом, артериальной гипертензией и фибрилляцией предсердий была диагностирована низкодифференцированная аденокарцинома легкого IVB стадии, подтвержденная чрескожной биопсией легкого. Уровень экспрессии PD-L1 составил 40%. Магнитно-резонансная томография (МРТ) выявила солитарный метастаз в головной мозг. Пациентке назначен дексаметазон и начата терапия по протоколу CheckMate 9LA с применением карбоплатина, пеметрекседа, ниволумаба и ипилимумаба в сниженной дозе. Через 2 года лечения по данным позитронно-эмиссионной томографии зарегистрировано значительное уменьшение очагов в легком, по данным МРТ – практически полная регрессия очага в головном мозге, а также клиническое улучшение.
Обсуждение. Данный случай подчеркивает возможность достижения длительной ремиссии и улучшения качества жизни при индивидуализированном подходе к лечению пожилых пациентов с распространенным НМРЛ и метастазом в головной мозг
ISSN 2658-3348 (Online)