АКУШЕРСТВО И ГИНЕКОЛОГИЯ
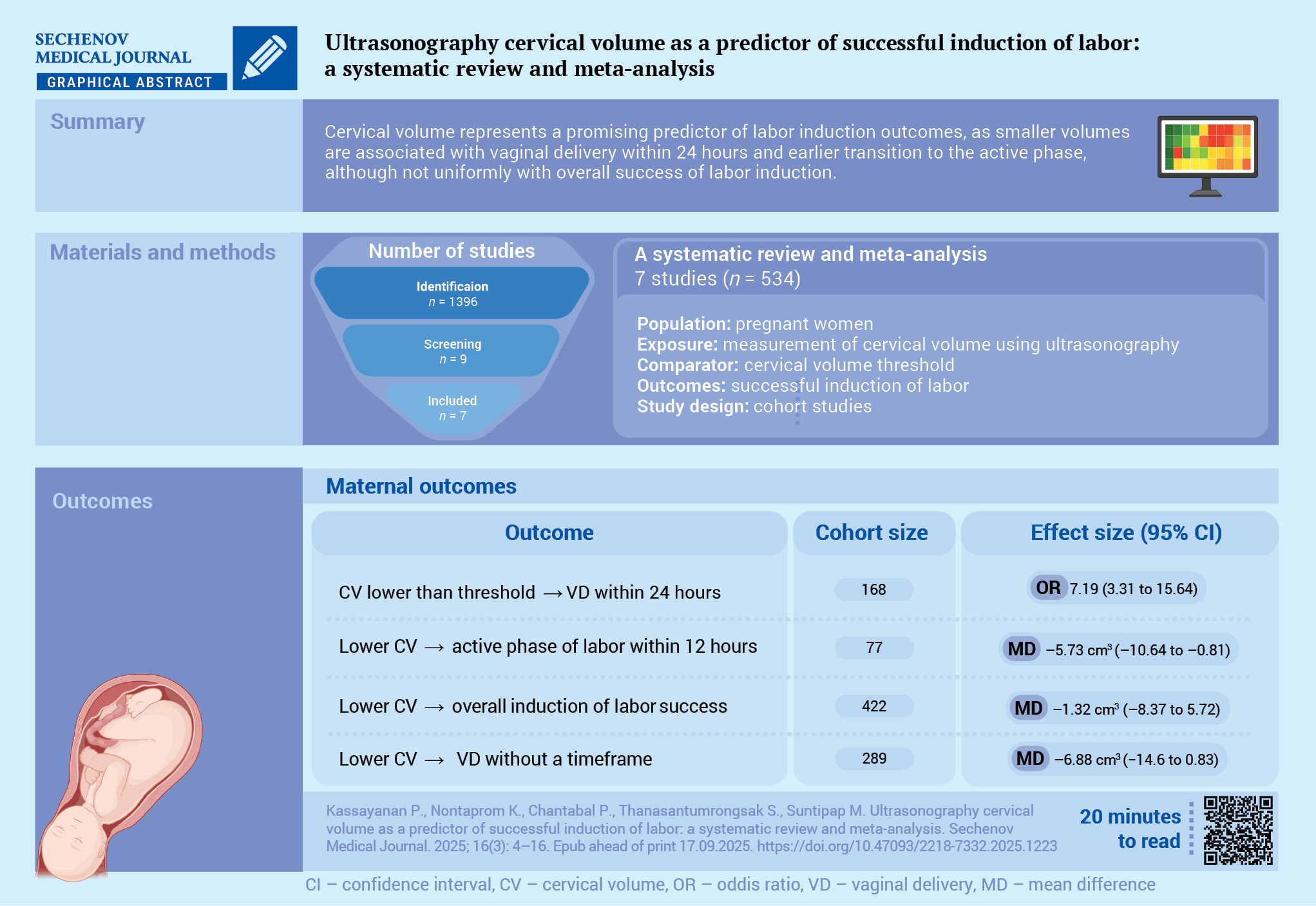
Цель. Сравнить объем шейки матки у пациенток с успешной и неуспешной индукцией родовой деятельности (ИРД).
Материалы и методы. Систематический обзор и метаанализ выполнен в соответствии с рекомендациями PRISMA. Поиск литературы проводился в базах PubMed, EMBASE, Scopus и Google Scholar для выявления когортных исследований, опубликованных в период с 1 января 2005 по 31 декабря 2024 года, в которых сравнивался объем шейки матки у беременных женщин, перенесших ИРД. Для метаанализа использовали модель со случайными эффектами.
Результаты. В анализ включены семь исследований с участием 534 беременных женщин. В четырех исследованиях выявлен низкий риск систематических ошибок, в двух – высокий; в одном исследовании оценка риска не выполнена из‑за отсутствия полного текста. При объединенном анализе двух исследований (n = 168) обнаружена положительная связь между меньшим объемом шейки матки и успешными естественными родами в течение 24 часов (отношение шансов 7,19; 95% доверительный интервал: 3,31–15,64; I² = 0%). При объединенном анализе пяти исследований (n = 422) не выявлено статистически значимой разницы между успешной и неуспешной ИРД (разница средних –1,32 см³; 95% доверительный интервал: –8,37–5,72; I² = 89,8%). Анализ подгрупп не выявил статистически значимой связи между объемом шейки матки и успешной ИРД при определении исхода как естественные роды без ограничения по времени или продолжительностью до 24 часов. Вместе с тем существенно меньший объем шейки матки отмечен у женщин, достигших активной фазы родов в срок до 12 часов. Тест Эггера подтвердил отсутствие публикационных смещений (коэффициент = 0,50; стандартная ошибка = 1,75; p = 0,78).
Заключение. Определение объема шейки матки в качестве параметра для прогнозирования успешной ИРД обладает значительным потенциалом; меньшие значения ассоциируются с лучшими исходами, хотя результаты анализа подгрупп остаются неоднозначными.
НЕЙРОХИРУРГИЯ
Цель. Спроектировать, разработать и валидировать 3D-модель головы для пункции овального отверстия, используя технологии искусственного интеллекта (ИИ) на основе компьютерного зрения.
Материалы и методы. В лаборатории прототипирования разработана трехмерная симуляционная модель с интеграцией ИИ. Ее эффективность для хирургического обучения оценивалась в двух группах: нейрохирурги с опытом работы пять и более лет (n = 10) и ординаторы (n = 28). Результаты обучения оценивались по времени вмешательства, количеству попыток пункции до первой попытки без осложнений, количеству осложнений, связанных с повреждением критических анатомических структур. Валидность оценивалась с помощью шкалы Лайкерта.
Результаты. До обучения группы различались по времени, затраченному на вмешательство, количеству попыток пункции и количеству осложнений, связанных с повреждением критических анатомических структур. После обучения время вмешательства сократилось на 50% в обеих группах, количество попыток пункции уменьшилось на 50,0% у врачей и на 60,3% у ординаторов. Общее число осложнений снизилось на 57,8% у врачей и на 59% у ординаторов. Анализ шкалы Лайкерта не выявил статистически значимых различий между группами по всем параметрам. Осуществимость и образовательная эффективность модели были оценены на 4 или 5 баллов 90% участников в обеих группах. Анатомическая реалистичность получила оценку 4 или 5 у 90% врачей и 100% ординаторов. Рентгенографический реализм получил оценку 4 или 5 от всех участников. Стоимость создания симулятора, не учитывая стоимость 3D-принтера, составила 22 685 рублей.
Заключение. Разработанная 3D-симуляционная модель с интеграцией искусственного интеллекта значительно улучшила результаты обучения как в группе врачей, так и в группе ординаторов. Использование стандартного оборудования для прототипирования представляет собой экономически эффективную, безрадиационную альтернативу для широкого внедрения в нейрохирургическое образование.
Известные хирургические доступы к дорсальной части среднего мозга включают: затылочный транстенториальный, супрацеребеллярный инфратенториальный, задний субтемпоральный и тонзиллоувеальный трансакведуктальный подходы.
Описание случая. 38-летний мужчина обратился с жалобами на легкую правостороннюю слабость и диплопию после эпизода головной боли и рвоты за две недели до поступления. В неврологическом статусе выявлено незначительное снижение мышечной силы с правой стороны, косоглазие вниз и наружу, легкий мидриаз и паралич аккомодации левого глаза, альтернирующий синдром. С помощью магнитно-резонансной томографии выявлен разрыв кавернозной мальформации размером 20×30×25 мм левой ножки среднего мозга, гематомы в каверноме. Путем супрацеребеллярного инфратенториального доступа в положении сидя с минимальным разрезом дорсальной части среднего мозга кавернома была полностью резецирована вместе с окружающей подострой гематомой. В раннем послеоперационном периоде наблюдался регресс неврологической симптоматики.
Обсуждение. Выбор медианной субокципитальной краниотомии и контралатерального супрацеребеллярного инфратенториального доступа является предпочтительным для полной резекции каверномы дорсальной поверхности среднего мозга во избежание послеоперационного неврологического дефицита.
Микрохирургическое лечение аневризм глазной артерии относят к хирургии высокого риска. Профилактика и остановка кровотечения из офтальмических аневризм стандартным наложением клипса проксимальнее аневризмы анатомически невозможно.
Описание случая. Пациент 46 лет поступил с жалобами на периодические головные боли в течение шести месяцев. Амбулаторно на магнитно‑резонансной томографии выявлена аневризма правой внутренней сонной артерии (ВСА). По данным компьютерно‑томографической и церебральной ангиографий верифицирована аневризма глазной артерии. Пациент из предложенных методов лечения выбрал открытую операцию. Проведено клипирование аневризмы устья глазной артерии птериональным доступом с экстрадуральным выделением петрозального сегмента ВСА с целью профилактики интраоперационного кровотечения. Течение послеоперационного периода гладкое, без неврологической симптоматики, швы сняты на 9‑е сутки. Пациент выписан под амбулаторное наблюдение с рекомендацией контроля радикальности клипирования через 6 месяцев.
Обсуждение. Временное клипирование ВСА в сонном канале при микрохирургических операциях по поводу аневризм глазной артерии позволяет контролировать кроветечение из основного операционного доступа – без выделения сосудисто‑нервного пучка шеи, что снижает травматичность операции и является предпочтительным с косметической точки зрения.
ВНУТРЕННИЕ БОЛЕЗНИ
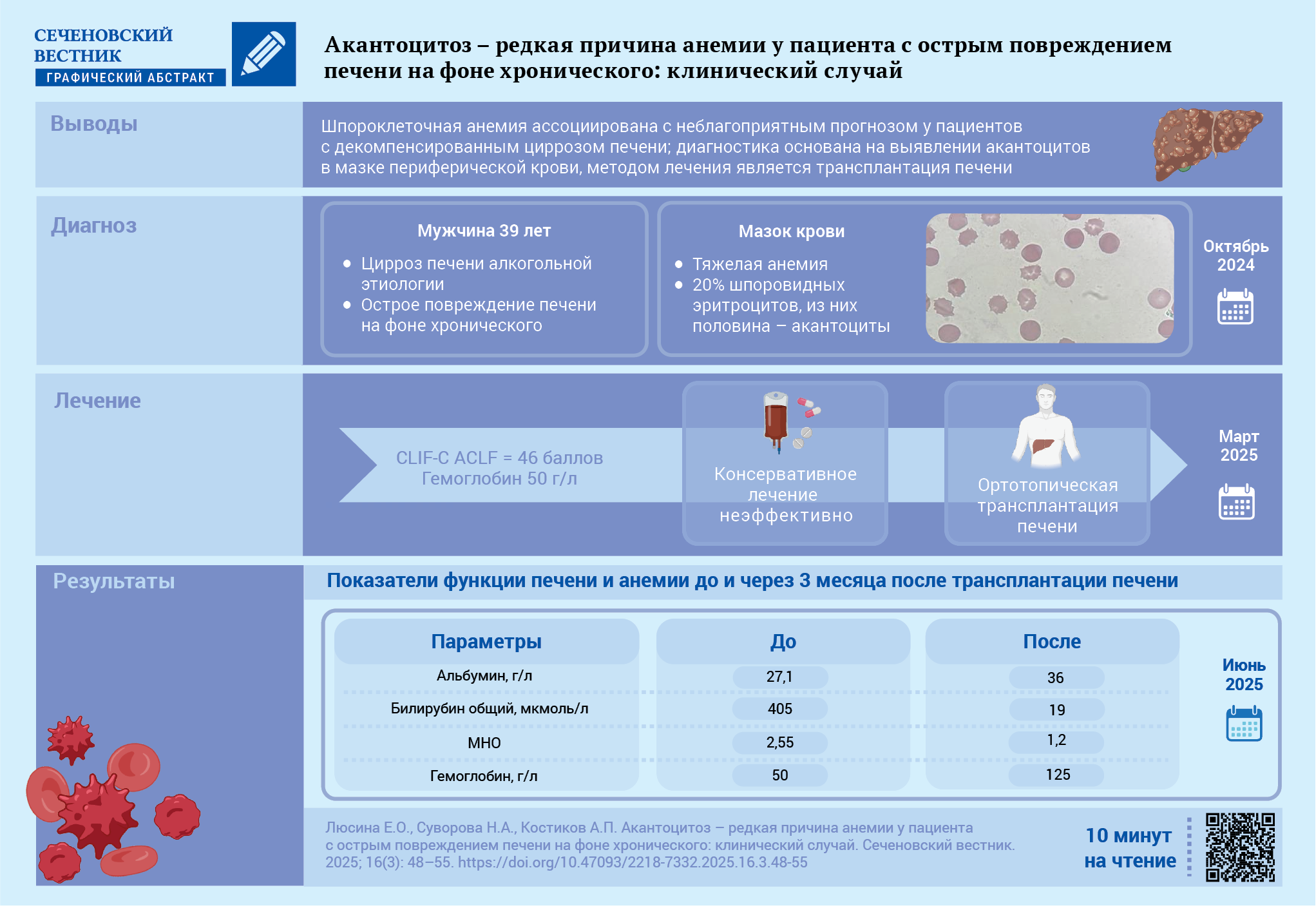
Одной из редких форм анемии у пациентов с циррозом печени (ЦП) является акантоцитоз (шпороклеточная анемия) – неиммунная гемолитическая анемия, обусловленная изменением липидного состава мембраны эритроцитов в результате тяжелой печеночной недостаточности.
Описание случая. У пациента 37 лет с декомпенсированным алкогольным ЦП (класс С по шкале Child – Pugh, индекс MELD‑Na (Model for End‑Stage Liver Disease – Na, модель для оценки терминальной стадии заболевания печени с учетом натрия) составил 34 балла) появилась выраженная слабость и одышка. Диагностировано острое повреждение печени на фоне хронического: показатель по шкале CLIF‑С ACLF (Chronic Liver Failure Consortium Acute-on-Chronic Liver Failure Score, шкала оценки острого повреждения печени на фоне хронического Консорциума по изучению хронической печеночной недостаточности) составила 46 баллов. Выявлена тяжелая макроцитарная анемия с ретикулоцитозом: гемоглобин – 50 г/л, эритроциты – 1,26×1012/л, ретикулоциты – 77,9 ‰. Исключена кровопотеря, дефицит железа, витамина В12 и фолатов, проба Кумбса отрицательная, исследование костного мозга исключило миелодисплазию. В мазке крови 20% эритроцитов имели форму шпоровидных клеток, из них около половины – акантоциты. Выполнена ортотопическая трансплантация печени. Контрольное обследование через три месяца показало нормализацию печеночных функциональных тестов и отсутствие анемии и акантоцитоза.
Обсуждение. Представленный случай демонстрирует необходимость изучения мазка крови для выявления акантоцитов как редкой, но прогностически неблагоприятной причины анемии у пациентов с ЦП. Единственным эффективным методом лечения является трансплантация печени.
ISSN 2658-3348 (Online)