The Sechenov Medical Journal is a scientific and practical peer-reviewed journal, the official publication of Sechenov University.
The Journal has been published since 2010 with a frequency of 4 issues per year and is intended for the health professionals.
Sechenov Medical Journal publishes original articles, reviews, and clinical cases, covering a wide range of issues in biomedical sciences, fundamental and clinical medicine and concerned with important clinical and basic research in the field of:
- cell biology,
- pathological physiology,
- internal diseases,
- obstetrics and gynaecology,
- oncology, surgery
- neurosurgery.
Publication time frames:
5 days - first decision (accept for review or reject the manuscript)
40 days - average duration of the review phase
99 days - from manuscript submission to publication (average)
20% - of all manuscripts submitted during the year were accepted for publication
The Title is included in the Russian Science Citation Index (RSCI) collection, based on the Russian Index of Science Citation(RISC) database and is in the Scopus database (since 2023) and in the "White List" of scientific journals
Sechenov Medical Journal was included in the K2 category of Higher Attestation Commission and equated to the K1 category considering indexing in Scopus.
Mass media state registration certificate PI № ФС77-78884 dated August 28, 2020, issued by the Federal Service for Supervision of Communications, Information Technology and Mass Media (Roskomnadzor).
Current issue
INTERNAL MEDICINE
PATHOLOGICAL PHYSIOLOGY
SURGERY
ONCOLOGY
Announcements
2025-07-31
The 2nd issue of the Sechenov Medical Journal for 2025 has been published
The second issue of the Sechenov Medical Journal for 2025 contains articles on the following sections:
INTERNAL DISEASES
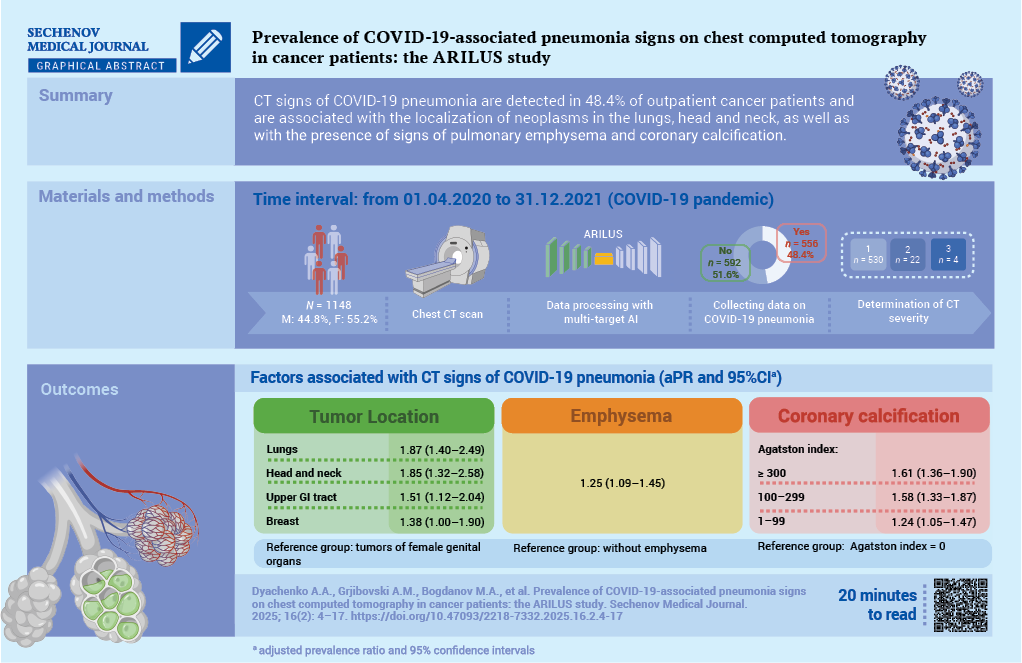
Prevalence of COVID-19-associated pneumonia signs on chest computed tomography in cancer patients: the ARILUS study
Andrey A. Dyachenko, Andrej M. Grjibovski, Maxim A. Bogdanov, Dmitriy V. Bogdanov, Ekaterina A. Nazarova, Anna A. Meldo, Valeria Yu. Chernina, Mikhail G. Belyaev, Victor A. Gombolevsky, Mikhail Yu. Valkov
PATHOLOGICAL PHYSIOLOGY
Etamsylate enhances platelet aggregation through G-protein-coupled receptors in patients with macrohematuria following ureteral lithotripsy: a single-center nonrandomized study
Edward F. Barinov, Dina I. Giller, Sabina A. Akhundova
Letter to the Editor Regarding “Bone turnover markers in oral and gingival crevicular fluid in children with end-stage chronic kidney disease”
Vitorino M. dos Santos, Kin M. Sugai
SURGERY
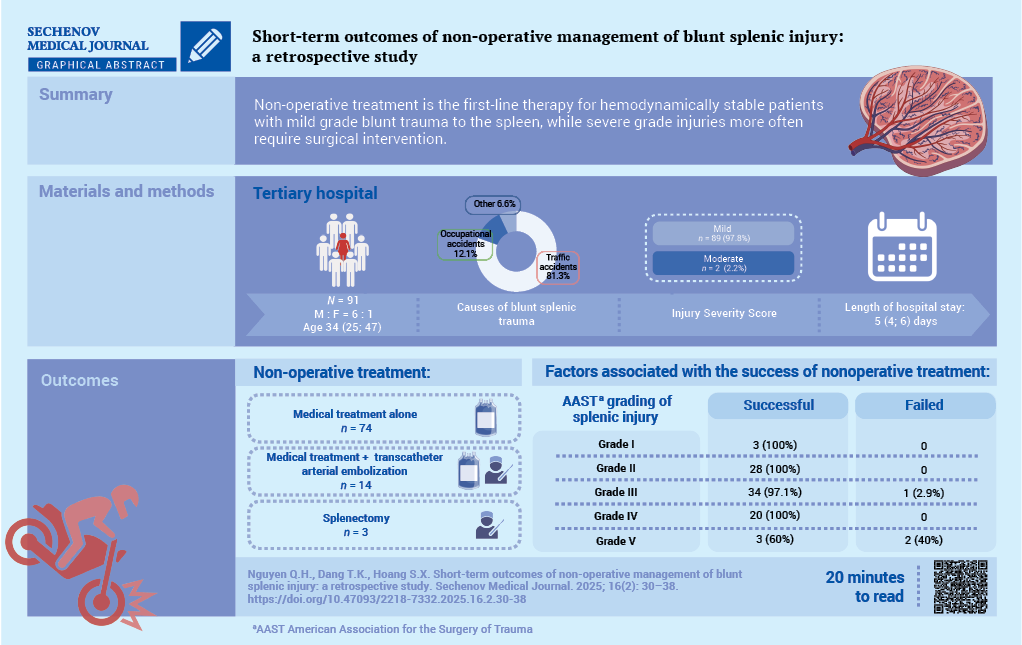
Short-term outcomes of non-operative management of blunt splenic injury: a retrospective study
Quang H. Nguyen, Toan K. Dang, Song X. Hoang
ONCOLOGY
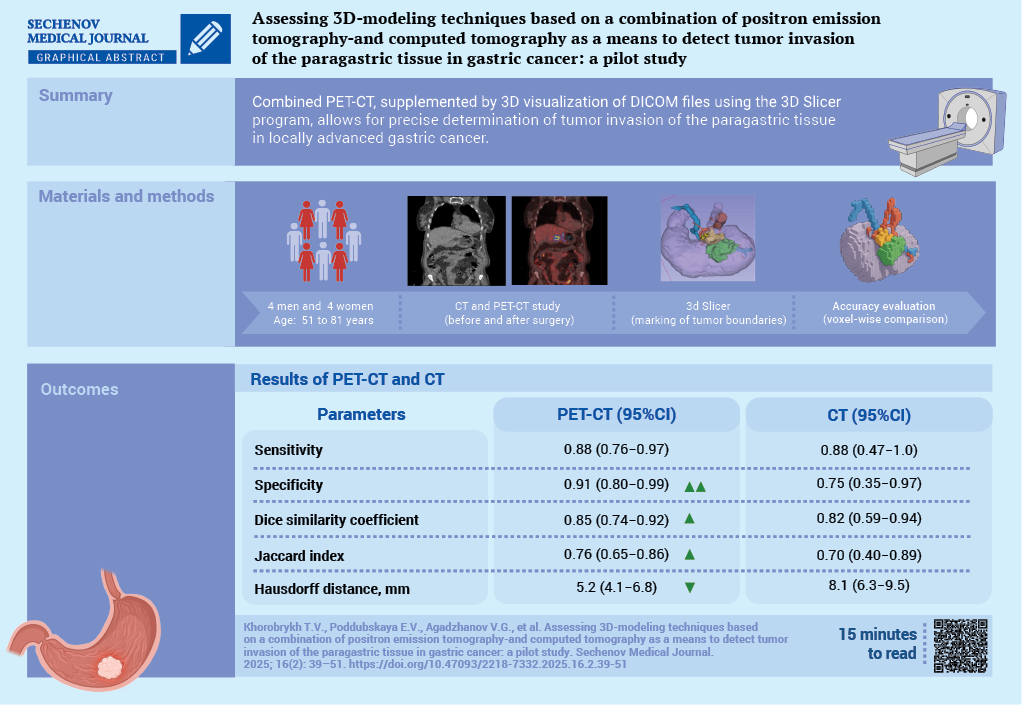
Assessing 3D-modeling techniques based on a combination of positron emission tomography-and computed tomography as a means to detect tumor invasion of the paragastric tissue in gastric cancer: a pilot study
Tatiana V. Khorobrykh, Elena V. Poddubskaya, Vadim G. Agadzhanov, Larisa M. Tulina, Ivan V. Ivashov, Anton V. Grachalov, Maria A. Tsai, Iaroslav A. Drach, Zumrud A. Omarova
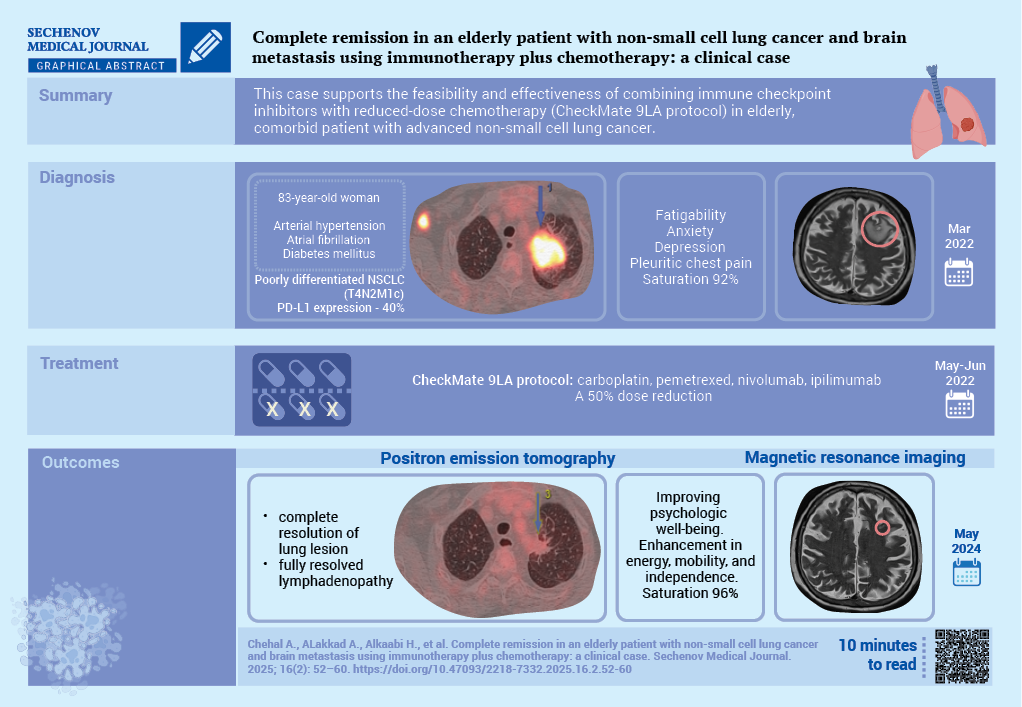
Complete remission in an elderly patient with non-small cell lung cancer and brain metastasis using immunotherapy plus chemotherapy: a clinical case
Aref Chehal, Ashraf ALakkad, Hamda Alkaabi, Aly A. Razek, Yazan Z. Alabed, Hazem M. Almasarei
| More Announcements... |